پدیده های تطبیقی در اختلالات گردش خون عمومی. اختلالات گردش خون مرکزی
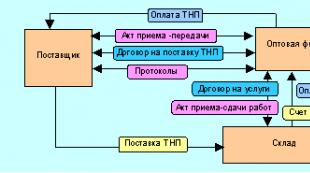
| نوع پارچه | خوش خیم | بدخیم |
| بافت مخاطی | پاپیلوم | سرطان |
| بافت غده ای | آدنوم | آدنوکارسینوم |
| بافت همبند فیبری | فیبروم | فیبروسارکوم |
| بافت چربی | لیپوم | لیپوسارکوم |
| ماهیچه | میوم | میوسارکوم |
| کشتی ها | همانژیوم | آنژیوسارکوم |
| بافت غضروف | کندروما | کندروسارکوم |
| استخوان | استئوما | استئوسارکوم |
دفاع از پایان نامه صورت خواهد گرفت «…. "2011 در ساعت __ در جلسه شورای پایان نامه (D.208.055.01) مرکز تحقیقات فدرال پیوند شناسی و اندام های مصنوعی.
آسیب شناسی کبد در راسوها در شرایط پرورش خز سلولی و اصلاح آن با جاذب طبیعی 16.00.02 آسیب شناسی، انکولوژی و مورفولوژی حیوانات
چکیده پایان نامهدفاع از پایان نامه در تاریخ 19 ژوئن 2009 ساعت 10 در جلسه شورای پایان نامه مشترک DM 212.117.15 در موردویان انجام خواهد شد. دانشگاه دولتیبه نام N.
جریانبه سه بخش تقسیم می شود: مرکزی, پیرامونیو میکروسیرکولاتوری.
گردش مرکزیشامل قلب و عروق بزرگ - آئورت، شریان های کاروتید، ورید اجوف، ورید پورتال.
گردش محیطیشامل شریان ها و وریدهای با کالیبر کوچکتر است.
گردش میکروسیرکولاتوری- این گردش خون در کوچکترین عروق است. این شامل شریان ها، پیش مویرگ ها می شود. مویرگ ها، پس مویرگ ها، ونول ها.
اختلالات گردش خون مرکزی
به طور معمول، قلب و عروق خونی به اندام ها و بافت ها می رسد مواد مغذیو اکسیژن اگر کار قلب و عروق خونی مختل شود، محصولات سمی متابولیک از اندام ها و بافت ها خارج نمی شوند. دو شکل نارسایی گردش خون وجود دارد:
1. جبران شده، که در طول فعالیت بدنی اتفاق می افتد.
2. جبران ناپذیر، در حالت استراحت فیزیکی، تنگی نفس، کبودی لب ها و ناخن ها، رنگ پریدگی، ادم، تپش قلب ظاهر می شود. علل: اختلال در عملکرد قلب، افت فشار خون (رگ های خونی)، یا همه به طور همزمان.
اختلالات گردش خون محیطی
فرم های زیر متمایز می شوند: پرخونی شریانی, پرخونی وریدی , ایسکمی, ترومبوز, آمبولی.
پرخونی شریانی.
علل: به دلیل افزایش جریان خون به سیستم میکروسیرکولاسیون با خروج طبیعی از طریق وریدها. با گسترش شریان ها و مویرگ ها، افزایش فشار موضعی و دمای بافت ها مشخص می شود. عوامل ایجاد کننده آن: بشقاب پرنده، التهاب، روان زا.
انواع پرخونی شریانی:
· فیزیولوژیکی: با عملکرد فعال اندام؛ از اثر استفاده کنید - پدهای حرارتی، گچ خردل و غیره.
· آسیب شناسی: در صورت نقض عصب، التهاب، بیماری های غدد درون ریز; در این صورت ممکن است پارگی رگ ها وجود داشته باشد.
علائم پرخونی شریانی: قرمزی (اکسی هموگلوبین زیاد)، افزایش تورگ بافت، افزایش ضربان عروق، گشاد شدن شریان ها، افزایش سرعت جریان خون، افزایش فشار خون، افزایش خروج لنف.
ارزش هیپرمی شریانی: اغلب دارای ارزش مثبت است - اندام ها را با O 2، مواد مغذی، ویتامین ها، لکوسیت ها، آنتی بادی ها تامین می کند. اما در شرایط آسیب شناسی می تواند باعث خونریزی، گسترش عفونت شود.
پرخونی وریدی
علل: افزایش خون رسانی به اندام به دلیل دشواری خروج خون از طریق سیاهرگ ها با جریان طبیعی از طریق شریان ها. با گسترش وریدها و مویرگ ها، کاهش فشار داخل عروقی، کاهش سرعت جریان خون، کاهش دمای بافت و گاهی ادم مشخص می شود. هنگامی که وریدها فشرده می شوند (توسط یک تومور، اسکار و غیره)، با کاهش طولانی مدت در فعالیت کلی (هیپوکینزی) رخ می دهد. اکثر دلایل رایج : نارسایی قلبی که در آن عملکرد مکش قلب مختل می شود، عملکرد مکش کاهش می یابد قفسه سینهبا بیماری های پلور، ریه ها، آسیب به عضلات تنفسی.
علائم پرخونی وریدی: سیانوز غشاهای مخاطی لب، ناخن، پوست، از آنجایی که O 2 به طور کامل توسط بافت ها استفاده می شود و سطح هموگلوبین که رنگ بنفش دارد افزایش می یابد. حجم اندام افزایش می یابد، ادم احتقانی ایجاد می شود. دمای اندام کاهش می یابد، پوست وریدهای گشاد، پر از خون و پیچیدگی را نشان می دهد که در آن فشار خونافزایش یافته و سرعت جریان خون کاهش می یابد. سپس ریز عروق مختل می شود، رگ ها و مویرگ ها منبسط می شوند و جریان خون متوقف می شود - استاز وریدی.
ارزش هیپرمی وریدی: هیپوکسی بافتی ایجاد می شود. تضعیف فرآیندهای اکسیداتیو منجر به تجمع محصولات متابولیک کمتر اکسید شده در بافت ها و اسیدوز می شود که در آن نفوذپذیری دیواره های عروقی افزایش می یابد. در بافت ها، فشار انکوتیک و اسمزی افزایش می یابد. همه اینها منجر به ایجاد ادم احتقانی می شود. با پرخونی وریدی، رکود خون در ریه ها ایجاد می شود و رخ می دهد هیپوکسی... نفوذپذیری دیواره رگ های خونی افزایش می یابد، عناصر خونی به سپتوم های بین آلوئولی و آلوئول ها خارج می شوند و وارد خلط می شوند. اسکلروز ریه ها ایجاد می شود. سفتی قهوه ای در ریه ها وجود دارد. با جبران خسارت قلب، استاز وریدی طولانی مدت در کبد ایجاد می شود. خون در ورید اجوف تحتانی و سپس در وریدهای کبد راکد می شود. دیاپدزی گلبول های قرمز اتفاق می افتد، سلول های کبدی می میرند. وضعیت کبد نامیده می شود جگر جوز هندی.
ایسکمی.
ایسکمی کاهش خون رسانی به اندام به دلیل کاهش جریان خون از طریق شریان ها است.
علل و نشانه ها.اثرات روان زا، باعث فعال شدن سیستم سمپاتیک-آدرنال با اثر تنگ کننده عروق، کاهش لومن شریان ها به دلیل ترومبوز، آمبولی، اسکلروز، التهاب دیواره های عروقی می شود. در ناحیه ایسکمیک، بافت رنگ پریده می شود. ضربان شریان ها ضعیف می شود، دما کاهش می یابد. در شریان ها فشار خون کاهش می یابد و سرعت جریان خون کاهش می یابد. در ناحیه ایسکمیک، بیمار احساس می کند پارستزی ها: بی حسی، گزگز، خزش، درد. این احساسات در اثر تحریک ایجاد می شوند. پایانه های عصبیتجمع محصولات متابولیک در ناحیه ایسکمیک در ایسکمی، کمبود O 2 باعث کمبود انرژی می شود. جبرانی در سلول ها باعث افزایش گلیکولیز بی هوازی و در نتیجه اسیدوز می شود. در نهایت، اتولیز رخ می دهد.
ارزش ایسکمیایسکمی منجر به کاهش عملکرد سلول ها و اندام ها می شود. ایسکمی مغز، قلب و کلیه ها به ویژه خطرناک است. اختلالات حساسیت و حرکت و اغلب اختلالات شدید تنفسی و گردش خون رخ می دهد. هر چه ایسکمی سریعتر ایجاد شود و بیشتر طول بکشد، اختلالات عملکرد ارگان ها شدیدتر می شود. ایجاد ایسکمی بر اساس مکانیسم های زیر است: انسدادی (انسداد رگ)، فشرده سازی (فشرده شدن رگ های خونی)، آنژیو اسپاستیک (اسپاسم رفلکس نوروژنیک عروق؛ به عنوان مثال، اسپاسم عروق کرونر)، هومورال با افزایش جریان خون مواد فعال و هورمون های منقبض کننده عروق - آدرنالین، وازوپرسین) ...
نامطلوب ترین پیامد ایسکمی نکروز ناحیه اندام است. نکروز مرتبط با نقض حادگردش نامیده می شود حمله قلبی... تشخیص انفارکتوس سفید، که در اندام هایی با گردش خون جانبی ضعیف (در طحال) رخ می دهد. انفارکتوس قرمز در اندام هایی با وثیقه توسعه یافته (ریه ها، روده ها) رخ می دهد. حملات قلبی سفید با تاج هموراژیک (قلب، کلیه ها) وجود دارد.
ترومبوز
ترومبوز فرآیند انعقاد خون داخل حیاتی در مجرای رگ یا در حفره قلب است که از جریان آن جلوگیری می کند.
علل تشکیل ترومبوزسه عامل اصلی تشکیل ترومبوز وجود دارد:
تغییر خواص دیواره عروقی;
· نقض وضعیت خون.
· اختلال در جریان خون در عروق.
انواع لخته خون.لخته های خون هستند سفیدمتشکل از فیبرین، پلاکت ها، لکوسیت ها و قرمزاز جمله گلبول های قرمز. انواع مختلط وجود دارد که دارای سر (ترومبوز سفید)، بدن (در واقع ترومبوز مختلط) و دم (ترومبوز قرمز) هستند. ترومبوس جداری وجود دارد که باعث کاهش لومن و انسداد می شود و مجرای رگ را می بندد.
مراحل ترومبوزصحنه پلاکت عروقی (سلولی)- اگر رگ آسیب دیده باشد، اسپاسم آن رخ می دهد، سلول های اندوتلیال آسیب دیده به هم می چسبند. تجمع) در محل آسیب به دیواره رگ بچسبد (چسبندگی) و همچنین بچسبد و فرو بریزد ( آگلوتیناسیون). صحنه انعقادیک فرآیند زنجیره ای با ماهیت آنزیمی است که در آن، در گروهی از واکنش ها، هر شکل فعال قبلی یک ماده، غیرفعال بعدی (ترومبوپلاستین - پروترومبین - ترومبین - فیبرینوژن - فیبرین - ترومبوز) را کاتالیز می کند.
پیامدهای ترومبوزهنگامی که لخته خون در یک سرخرگ تشکیل می شود، ایسکمی رخ می دهد و در ورید، پرخونی وریدی رخ می دهد. یک لخته خون می تواند شکسته شود و با جریان خون وارد اندام شود - ایجاد می شود حمله قلبی... یک لخته خون ممکن است جوانه بزند بافت همبند- سازماندهی لخته خون با ترمیم مجرای عروق - فاضلاب... سندرم DIC ممکن است ایجاد شود: افزایش گذرا در انعقاد خون و تشکیل لخته های خون در بسیاری از عروق کوچک. در همان زمان، فیبرینولیز روشن می شود و خونریزی و خونریزی رخ می دهد.
آمبولی
آمبولی - فرآیند انتقال ذرات توسط خون یا لنف، که در شرایط عادی یافت نمی شوند، انسداد رگ های خونی توسط آنها. این ذرات نامیده می شوند آمبولی.
تاشکند 2010
این پیشرفت آموزشی و روش شناختی با موضوع "مبانی رشته های پزشکی" برای دانشجویان سال دوم دانشکده داروسازی، گرایش داروسازی بالینی در نظر گرفته شده است.
گردآوری شده توسط: Bagdasarova E.S. - داوطلب علوم زیستی، دانشیار.
سعیدوف A.S. - دکترای علوم پزشکی، دانشیار.
Mirtursunova S.Z. - داوطلب علوم زیستی، دانشیار.
داوران:اوتیامیشف R.G. - دکترای علوم پزشکی، محقق برجسته، کمک هزینه پروژه ملی انستیتو تحقیقات هماتولوژی و PC وزارت بهداشت جمهوری ازبکستان
Aliev Kh.U. – دکترای علوم پزشکی، استاد گروه فارماکولوژی و داروسازی بالینی
کتابچه راهنمای آموزشی در CMC بررسی و توسط "___" _____ 2010، شماره پروتکل ___ تایید شد.
رئیس، پروفسور یولداشف Z.O.
دستورالعمل آموزشی - روشی در شورای علمی موسسه داروسازی تاشکند "___" _____ 2010، شماره پروتکل ___ در نظر گرفته شد.
دبیر علمی موسسه پروفسور اکراموف L.T.
سخنرانی شماره 7
موضوع: اختلال در گردش خون و لنف. پرخونی شریانی و وریدی. ایسکمی. استاز. ترومبوز آمبولی
1. نقض گردش خون و لنف.
2. پرخونی شریانی و وریدی
3. ایسکمی.
5. ترومبوز. آمبولی
نقض گردش خون و لنف
جریانحرکت مداوم خون از طریق سیستم بسته حفره های قلب و عروق خونی است. از یک طرف، به لطف گردش خون، اکسیژن، مواد مغذی، آب و املاح به بافتها میرسد که از محیط میآیند. از سوی دیگر، باعث حذف دی اکسید کربن از بافت ها، محصولات نهایی متابولیسم می شود. گردش خون همچنین یک پیوند ضروری در تبادل گاز و تبادل حرارت بین بدن و محیط است. علاوه بر این، حرکت مداوم خون، انتقال هورمون ها و سایر مواد فعال فیزیولوژیکی را تسهیل می کند، که عملکرد بدن را به عنوان یک سیستم یکپارچه تضمین می کند.
اندام های گردش خون شامل قلب، رگ های خونی است که دایره بزرگ و کوچکی از گردش خون را تشکیل می دهند. بطن راست قلب، شریان ریوی، وریدهای ریوی و دهلیز چپ، گردش خون ریوی را تشکیل می دهند. بطن چپ، آئورت، ورید اجوف تحتانی، دهلیز راست - گردش خون سیستمیک.
عملکرد طبیعی قلب حرکت خون را از طریق سیستم عروقی تضمین می کند که دارای پنج ناحیه است که در ویژگی های بیوفیزیکی آنها متفاوت است:
1) عروق بزرگ، که شامل آئورت و شریان های بزرگ است، با غلبه الیاف الاستیک در دیواره آنها مشخص می شود. آنها به دلیل خاصیت ارتجاعی خود، تبدیل جریان خون شدیداً ضربان دار را به یکنواخت تر و صاف تر تضمین می کنند.
2) عروق مقاومت - شریان های کوچک و شریان هایی که دیواره آنها حاوی است تعداد زیادی ازفیبرهای عضلانی، ایجاد یک تغییر فعال در لومن رگ های خونی. شرایط اخیر به اندازه کافی بر مقاومت محیطی کلی سیستم گردش خون تأثیر می گذارد.
3) رگ های تبادلی - مویرگ ها - باعث تبادل مواد بین خون و بافت ها می شوند و بنابراین از مهمترین عناصر گردش خون هستند.
4) عروق شنت - آناستوموزهای شریانی وریدی - تخلیه خون را از شریان ها به وریدها، دور زدن مویرگ ها، که از اهمیت فیزیولوژیکی زیادی برخوردار است، به عنوان مثال، در شرایط قرار گرفتن در معرض دمای پایین بدن انسان، فراهم می کند.
5) عروق خازنی - رگه ها - با بیشترین کشش و کشش نسبی مشخص می شوند. سیاهرگ ها 70 تا 80 درصد از کل خون بدن را تشکیل می دهند، ظرفیت کل سیستم گردش خون، میزان خون بازگشتی به قلب و حجم دقیقه خون را تعیین می کنند.
میزان جریان خون در بافتها و اندامها، متناسب با سطح عملکرد آنها، توسط مکانیسمهای تنظیمی گردش خون نیز تأمین میشود که به طور معمول به خود تنظیمی و تنظیم عصبی-هومورال تقسیم میشوند. مکانیسم خود تنظیمی در طراحی سیستم گردش خون و در ارتباط آن با سایر اندام ها و سیستم ها تعبیه شده است. تنظیم عصبی-هومورال گردش خون شامل زمینه های گیرنده سیستم گردش خون (به عنوان مثال، سینوس کاروتید قوس آئورت، شریان ریویمرکز قلبی عروقی بصل النخاع، هیپوتالاموس، قشر مغز قدیمی و جدید، نورون های سمپاتیک و پاراسمپاتیک پیش گانگلیونی و پس گانگلیونی واقع در بخش های مختلف. سیستم عصبی... در تنظیم عصبی-هومورال گردش خون اهمیت زیادی دارند غدد درون ریز: غدد فوق کلیوی، لوب خلفی غده هیپوفیز، دستگاه juxtaglomerular کلیه ها.
تغییر در عملکرد قلب، رگ های خونی، خواص رئولوژیکی خون، اختلال در مکانیسم تنظیم می تواند منجر به اختلال در گردش خون از طبیعت عمومی و محلی شود.
همه انواع اختلالات گردش خون، بسته به علل و مکانیسم ایجاد، می توانند به گروه های اصلی زیر تقسیم شوند:
1) اختلالات مرتبط با تغییرات در گردش خون:
هیپرمی شریانی و وریدی، کم خونی، ایسکمی؛
2) اختلالات مرتبط با آسیب به دیواره عروقی و تغییر در نفوذپذیری آن: خونریزی و خونریزی، خونریزی دیاپدی، پلاسموراژ.
3) اختلالات هموستاز و تنظیم وضعیت مایع خون: استاز، ترومبوز، انعقاد داخل عروقی منتشر، آمبولی.
5) نقض محتوای مایع بافت.
مکانیسمهای تنظیم گردش خون منطقهای از یک سو شامل اثر منقبضکننده عروق و عصب گشادکننده عروق، از سوی دیگر، تأثیر بر دیواره عروقی متابولیتهای غیر اختصاصی، یونهای معدنی، مواد فعال بیولوژیکی موضعی و هورمونهای وارد شده با خون. اعتقاد بر این است که با کاهش قطر عروق، ارزش تنظیم عصبی کاهش می یابد و برعکس، متابولیک افزایش می یابد.
در یک عضو یا بافت، در پاسخ به تغییرات عملکردی و ساختاری در آنها، ممکن است اختلالات گردش خون موضعی رخ دهد. رایج ترین اشکال نقض محلیگردش خون: هیپرمی شریانی و وریدی، ایسکمی، استاز، ترومبوز، آمبولی.
پرخونی شریانی
پرخونی شریانی- این افزایش خون رسانی به اندام در نتیجه جریان بیش از حد خون از طریق عروق شریانی است.
با تعدادی از تغییرات عملکردی مشخص می شود علائم بالینیقرمزی منتشر، اتساع شریانهای کوچک، شریانها، سیاهرگها و مویرگها، ضربان عروق و مویرگهای کوچک، افزایش تعداد عروق کارآمد، افزایش موضعی دما، افزایش حجم ناحیه پرخون، افزایش تورگ بافت، افزایش فشار در شریان ها، مویرگ ها و سیاهرگ ها، تسریع جریان خون، افزایش متابولیسم و افزایش عملکرد اندام ها.
علل پرخونی شریانی می تواند باشد: تأثیر عوامل مختلف محیطی از جمله بیولوژیکی، فیزیکی، شیمیایی. افزایش بار روی یک اندام یا محل بافت و همچنین اثرات روانزا. از آنجایی که برخی از این عوامل محرک های فیزیولوژیکی معمولی هستند (افزایش بار روی اندام، اثرات روان زا)، هیپرمی شریانی ناشی از عمل آنها باید فیزیولوژیکی در نظر گرفته شود. نوع اصلی هیپرمی شریانی فیزیولوژیکی پرخونی کاری یا عملکردی و همچنین پرخونی واکنشی است.
پرخونی کاری- این افزایش جریان خون در یک اندام است که همراه با افزایش عملکرد آن است (هیپرمی پانکراس در طول هضم، ماهیچه اسکلتی در طول انقباض آن، افزایش جریان خون کرونر با افزایش کار قلب، عجله خون به مغز در هنگام استرس روانی).
پرخونی واکنشینشان دهنده افزایش جریان خون پس از محدودیت کوتاه مدت است. معمولا در کلیه ها، مغز، پوست، روده ها، ماهیچه ها ایجاد می شود. حداکثر پاسخ چند ثانیه پس از از سرگیری پرفیوژن مشاهده می شود. مدت آن با طول مدت انسداد تعیین می شود. به دلیل پرخونی واکنشی، بنابراین، "بدهی" در جریان خون، که در طول انسداد ایجاد شده است، از بین می رود.
هیپرمی شریانی پاتولوژیکتحت تأثیر محرک های غیرمعمول (آسیب شناختی) (مواد شیمیایی، سموم، محصولات متابولیسم مختل، تشکیل شده در هنگام التهاب، سوختگی؛ تب، عوامل مکانیکی) ایجاد می شود. در برخی موارد، شرایط بروز هیپرمی شریانی پاتولوژیک افزایش حساسیت عروق به مواد محرک است که به عنوان مثال با آلرژی مشاهده می شود.
بثورات عفونی، قرمزی صورت با بسیاری بیماری های عفونی(سرخک، تیفوس، مخملک)، اختلالات وازوموتور همراه با لوپوس اریتماتوز سیستمیک، قرمزی پوست اندام با آسیب به شبکه عصبی خاص، قرمزی نیمی از صورت همراه با نورالژی همراه با تحریک عصب سه قلوو غیره نمونه های بالینی پرخونی شریانی پاتولوژیک هستند.
بسته به عاملی که باعث پرخونی شریانی پاتولوژیک می شود، می توان در مورد پرخونی التهابی، حرارتی، اریتم فرابنفش و غیره صحبت کرد.
بر اساس پاتوژنز، دو نوع پرخونی شریانی وجود دارد.- نوروژنیک (نوع نوروتونیک و فلج عصبی) و ناشی از عمل عوامل شیمیایی (متابولیک) موضعی است.
پرخونی شریانی نوروژنیک از نوع نوروتونیک می تواند به صورت انعکاسی در ارتباط با تحریک گیرنده های بیرونی و بین گیرنده و همچنین با تحریک اعصاب و مراکز گشادکننده عروق رخ دهد. عوامل ذهنی، مکانیکی، دما (گرما)، شیمیایی (سقز، روغن خردل و ...) و بیولوژیکی می توانند به عنوان محرک عمل کنند.
یک مثال معمولی پرخونی شریانی نوروژنیک قرمزی صورت و گردن در فرآیندهای پاتولوژیک در اندام های داخلی (تخمدان، قلب، کبد، ریه ها) است.
پرخونی شریانی ناشی از مکانیسم کولینرژیک (اثر استیل کولین) در سایر اندام ها و بافت ها (زبان، اندام تناسلی خارجی و غیره) نیز امکان پذیر است که رگ های آن توسط رشته های عصبی پاراسمپاتیک عصب دهی می شود.
در غیاب عصب پاراسمپاتیک، ایجاد پرخونی شریانی به دلیل سیستم سمپاتیک (کولینرژیک، هیستامینرژیک و β-آدرنرژیک) است که در حاشیه توسط فیبرها، واسطهها و گیرندههای مربوطه (گیرندههای H2 برای هیستامین، گیرندههای β-آدرنرژیک) نشان داده میشود. برای نوراپی نفرین، گیرنده های موسکارینی برای استیل کولین).
اعصاب کولینرژیک سمپاتیک شریان های کوچک و شریان های ماهیچه های اسکلتی، عضلات صورت، غشاهای مخاطی گونه ها و روده ها را گشاد می کنند. استیل کولین نیز واسطه آنهاست. فرض بر این است که در برخی موارد، پرخونی نتیجه تشکیل پروستاگلاندین ها در انتهای عصبی یا در بافت عصب شده - مواد فعال بیولوژیکی - مشتقات اسیدهای چرب غیراشباع چندگانه است.
پروستاگلاندین های E و A (PGE، PGA) اثر گشادکننده عروق بر روی شریان ها، متارتریول ها، پره مویرگ ها و ونول ها دارند. پروستاگلاندین I2 (PGI2 - پروستاسیکلین) از دیواره عضلانی رگ های خونی جدا شد که علاوه بر اثر آرامش بخش بر عروق با قطرهای مختلف، اثر ضد تجمع قوی بر پلاکت ها دارد.
پرخونی شریانی نوروژنیک از نوع فلج عصبی را می توان در کلینیک و در آزمایشات حیوانی هنگام برش الیاف و اعصاب سمپاتیک α-آدرنرژیک که دارای اثر منقبض کننده عروق هستند مشاهده کرد. در سال 1842، A.P. Walter برای اولین بار به انبساط عروق پنجه قورباغه هنگام بریدن رشته های سمپاتیک عصب سیاتیک اشاره کرد. بعداً K. Bernard (1851) قرمزی و افزایش دمای پوست سر خرگوش را در کنار گره گردنی تنه سمپاتیک مشاهده کرد. این به ویژه در گوش قابل توجه است.
اثرات مشابهی مشاهده می شود، همچنین در نقض یکپارچگی اعصاب مخلوط حاوی فیبرهای تنگ کننده عروق α-آدرنرژیک.
اعصاب منقبض کننده عروق سمپاتیک از نظر تونیکی فعال هستند و در شرایط عادی دائماً تکانه هایی با منشاء مرکزی (1-3 ضربه در هر ثانیه در حالت استراحت) حمل می کنند که مؤلفه عصبی (وازوموتور) تون عروق را تعیین می کند. واسطه آنها نوراپی نفرین است.
در انسان و حیوان، تکانه های تونیک ذاتی در اعصاب سمپاتیک است که به رگ های پوست اندام فوقانی، گوش ها، ماهیچه های اسکلتی، مجرای گوارش و غیره می رود. برش این اعصاب در هر یک از این اندام ها باعث افزایش جریان خون می شود. در عروق شریانی استفاده از سمپاتکتومی اطراف شریانی و گانگلیونی برای اندارتریت همراه با اسپاسم عروقی طولانی بر این اثر است.
پرخونی شریانی از نوع فلج عصبی را می توان از طریق شیمیایی نیز به دست آورد، که مانع انتقال تکانه های عصبی مرکزی در ناحیه گره های سمپاتیک (با استفاده از مسدود کننده های گانگلیون) یا در سطح انتهای عصب سمپاتیک (با استفاده از سمپاتولیتیک یا سمپاتیک می شود).
عوامل مسدود کننده آدرنرژیک). تحت این شرایط، کانال های Ca2 + آهسته وابسته به ولتاژ مسدود می شوند، ورود Ca2 + خارج سلولی به سلول های عضله صاف در امتداد یک گرادیان الکتروشیمیایی مختل می شود و همچنین انتشار Ca2 + از شبکه سارکوپلاسمی مختل می شود. بنابراین انقباض سلولهای ماهیچه صاف تحت تأثیر انتقالدهنده عصبی نوراپی نفرین غیرممکن است.
مکانیسم فلج عصبی پرخونی شریانی تا حدی زمینه ساز پرخونی التهابی، اریتم فرابنفش و غیره است.
ایده وجود پرخونی شریانی (فیزیولوژیکی و پاتولوژیک) ناشی از عوامل متابولیک (شیمیایی) موضعی بر اساس این واقعیت است که تعدادی از متابولیت ها باعث اتساع عروق می شوند و بدون توجه به عصب دهی مستقیماً بر روی عناصر عضلانی بدون علامت دیواره آنها تأثیر می گذارند. تاثیر می گذارد. این همچنین با این واقعیت تأیید می شود که عصب کشی کامل از ایجاد هیپرمی شریانی فعال، واکنشی یا التهابی جلوگیری نمی کند.
اتساع عروق ناشی از موارد زیر است: کاهش PO2 در خون و بافت های دیواره عروق، افزایش РCO2، بیش از حد متابولیت های غیر اختصاصی و یون های معدنی (اسید لاکتیک، اسیدهای آلی چرخه کربس، ATP، ADP، آدنوزین، یون های پتاسیم)، مواد فعال بیولوژیکی موضعی (برادی کینین، هیستامین، PGE، PGA، PGI2، استیل کولین غیرواسطه، اسید γ-آمینو بوتیریک) و هورمون هایی که از طریق خون به اندام ها منتقل می شوند (هورمون آتریانتریورتیک). سهم هر یک از عوامل فوق در ایجاد هیپرمی شریانی با منشاء مختلف یکسان نیست. در بروز پرخونی شریانی فعال و فعال و همچنین در هیپوکسی، آدنوزین که در نتیجه اثر اکتو-5 "-نوکلئوتیداز بر روی AMP تشکیل می شود، از اهمیت ویژه ای برخوردار است. قسمت خاصی وارد فضای خارج سلولی می شود. آدنوزین دآمیناز تخریب آدنوزین را تضمین می کند و در نتیجه تعادل آدنوزین را در داخل و خارج سلولی حفظ می کند.
امکان تشکیل یک عامل آرامش ویژه توسط سلول های اندوتلیوم دست نخورده مجاز است. این اکسید نیتریک (NO) در نظر گرفته می شود.
نقش مهمی در افزایش جریان خون در واکنشهای عروقی موضعی به تغییر pH محیط بافت اختصاص داده میشود - تغییر در واکنش محیط به سمت اسیدوز باعث افزایش اتساع عروق به دلیل افزایش حساسیت سلولهای عضله صاف به آدنوزین میشود. و همچنین کاهش درجه اشباع هموگلوبین با اکسیژن. در شرایط پاتولوژیک (سوختگی، ضربه، التهاب، اثر اشعه ماوراء بنفش، اشعه یونیزان و غیره) همراه با آدنوزین، سایر عوامل متابولیک نیز اهمیت قابل توجهی پیدا می کنند.
مکانیسم اثر گشادکننده عروق آنها هنوز به طور کامل شناخته نشده است. فرض بر این است که عمل هیپوتونیک محصولات مختلفمتابولیسم بر اساس کاهش واکنش لایه ماهیچه ای دیواره عروقی به اثر کششی فشار خون است. ممکن است بر اساس مسدود شدن ورود کلسیم به دلیل بسته شدن بخش خاصی از کانال های کلسیم در غشاء باشد که توسط گیرنده های a کنترل می شود.
نتیجه پرخونی شریانیممکن است متفاوت باشد در بیشتر موارد، پرخونی شریانی با افزایش متابولیسم و عملکرد اندام همراه است که یک پاسخ تطبیقی است. با این حال، عواقب نامطلوب نیز ممکن است. به عنوان مثال در آترواسکلروز، انبساط شدید رگ ممکن است با پارگی دیواره آن و خونریزی در بافت همراه باشد. چنین پدیده هایی به ویژه در مغز خطرناک هستند.
پرخونی وریدی
پرخونی وریدی در نتیجه افزایش خونرسانی به اندام یا محل بافت در نتیجه انسداد خروج خون از طریق سیاهرگها ایجاد می شود.
دلایل توسعه آن:انسداد وریدها توسط ترومبوز یا آمبولی، فشرده شدن توسط یک تومور، اسکار، رحم بزرگ شده. وریدهای دیواره نازک همچنین می توانند در مناطقی با افزایش شدید بافت و فشار هیدرواستاتیک (در کانون التهاب، در کلیه ها با هیدرونفروز) فشرده شوند.
در برخی موارد، لحظه مستعد پرخونی وریدی، ضعف ساختاری دستگاه الاستیک وریدها، رشد ناکافی و کاهش تن عناصر عضله صاف دیواره آنها است. اغلب این استعداد ماهیت خانوادگی دارد.
مشاغلی که نیاز به ماندن طولانی مدت روزانه (برای چندین ساعت) در وضعیت عمودی دارند، به پرخونی وریدی در نواحی دیستال کمک می کنند. اندام های تحتانیدر افرادی که به طور اساسی باعث پایین آمدن عناصر عضلانی الاستیک و صاف دیواره عروق وریدی شده اند.
سیاهرگها، مانند شریانها، اگرچه به میزان کمتری، مناطق بازتابزای غنی هستند، که احتمال ماهیت عصبی-رفلکسی پرخونی وریدی را نشان میدهد. اساس مورفولوژیکی عملکرد وازوموتور وریدها دستگاه عصبی عضلانی است که شامل عناصر عضله صاف و پایانه های عصب موثر است.
پرخونی وریدی نیز با تضعیف عملکرد بطن راست قلب، کاهش اثر مکش قفسه سینه (جنب اگزوداتیو، هموتوراکس)، انسداد جریان خون در گردش خون ریوی (پنومواسکلروز، آمفیزم ریوی، تضعیف سینه) ایجاد می شود. عملکرد بطن چپ).
از نظر بالینی، پرخونی وریدی با افزایش یک ناحیه اندام یا بافت، سیانوز، کاهش موضعی دما، ادم، افزایش فشار در وریدها و مویرگهای ناحیه راکد، کاهش سرعت جریان خون و دیاپدز گلبول قرمز ظاهر میشود. در مرحله نهایی پرخونی، حرکت آونگ مانند خون و استاز امکان پذیر است.
انبساط طولانی وریدها منجر به کشیده شدن دیواره آنها می شود که ممکن است با هیپرتروفی غشای عضلانی آن و پدیده فلبواسکلروز و واریس همراه باشد.
احتقان وریدی طولانی مدت با تغییرات قابل توجهی در عناصر عملکردی دیواره سیاهرگ، آتروفی و مرگ آنها همراه است. همراه با این، در محل پرخونی وریدی، تکثیر جایگزینی بافت همبند رخ می دهد. یک مثال کلاسیک سیروز کبد با نارسایی قلبی ناشی از احتقان وریدی است.
به خصوص عواقب جدی با استاز وریدی و لنفاوی همزمان ایجاد می شود.
عامل اصلی ایجاد تغییرات موضعی در پرخونی وریدی، گرسنگی اکسیژن (هیپوکسی) بافت است.
در عین حال، هیپوکسی در ابتدا به دلیل محدودیت ورودی است خون شریانی، پس از آن عمل بر روی سیستم های آنزیمی بافتی از اختلالات متابولیک، و در نتیجه نقض استفاده از اکسیژن. گرسنگی اکسیژن در پرخونی وریدی باعث نقض متابولیسم بافت، تغییرات آتروفیک و دیستروفیک و تکثیر بیش از حد بافت همبند می شود.
همراه با تغییرات موضعی در پرخونی وریدی، به ویژه اگر ناشی از آن باشد دلایل رایجو دارای یک ویژگی عمومی است، تعدادی از اختلالات همودینامیک عمومی با عواقب بسیار جدی نیز ممکن است. اغلب آنها زمانی رخ می دهند که جمع کننده های بزرگ وریدی مسدود می شوند - پورتال، ورید اجوف تحتانی. تجمع خون در این مخازن عروقی (تا 90 درصد کل خون) با کاهش شدید همراه است. فشار خون، سوء تغذیه اندام های حیاتی (قلب، مغز). مرگ در اثر نارسایی قلبی یا فلج تنفسی ممکن است.
ایسکمی
نقض گردش خون محیطی، که بر اساس محدودیت یا توقف کامل جریان خون شریانی است، ایسکمی (از یونانی ischeim - به تاخیر انداختن، توقف؛ هایما - خون) یا کم خونی موضعی نامیده می شود. ایسکمی با علائم زیر مشخص می شود: سفید شدن ناحیه ایسکمیک اندام، کاهش دما، اختلال در حساسیت به شکل پارستزی (احساس بی حسی، سوزن سوزن شدن، "خزش")، سندرم دردکاهش سرعت جریان خون و حجم یک اندام، کاهش فشار خون در ناحیه شریان واقع در زیر مانع، کاهش تنش اکسیژن در ناحیه ایسکمیک اندام یا بافت، کاهش تشکیل مایع بینابینی و کاهش تورگ بافت، اختلال در عملکرد یک اندام یا بافت، تغییرات دیستروفیک.
علت ایسکمی می تواند عوامل مختلفی باشد: فشرده شدن شریان، انسداد مجرای آن، تأثیر بر دستگاه عصبی عضلانی دیواره شریان. مطابق با این، انواع ایسکمی فشرده، انسدادی و آنژیو اسپاستیک متمایز می شود.
ایسکمی فشرده سازیاز فشردگی شریان اداکتور با بند، اسکار، تومور، جسم خارجی و غیره ناشی می شود.
ایسکمی انسدادینتیجه باریک شدن جزئی یا بسته شدن کامل مجرای شریان توسط ترومبوز یا آمبولی است. تغییرات مولد - نفوذی و التهابی در دیواره شریان ناشی از تصلب شرایین، اندارتریت محو کننده، پری آرتریت ندولار، همچنین منجر به محدودیت جریان خون موضعی توسط نوع ایسکمی انسدادی می شود.
ایسکمی آنژیو اسپاستیکبه دلیل تحریک دستگاه منقبض کننده عروق خونی و اسپاسم رفلکس آنها ناشی از تأثیر عاطفی (ترس، درد، عصبانیت)، عوامل فیزیکی (سرما، ضربه، تحریک مکانیکی)، عوامل شیمیایی، محرک های بیولوژیکی (سموم باکتریایی) و غیره رخ می دهد. آنژیواسپاسم با مدت زمان نسبی و شدت قابل توجهی مشخص می شود که می تواند علت کاهش شدید جریان خون تا توقف کامل باشد. اغلب، آنژیواسپاسم در شریانهایی با قطر نسبتاً بزرگ در داخل یک اندام بهعنوان رفلکسهای بدون شرط عروقی از گیرندههای درونی مربوطه ایجاد میشود. این رفلکس ها با اینرسی و استقلال قابل توجه مشخص می شوند. نمونه ای از این نوع واکنش های عروقی اسپاسم عروق کرونر قلب بر اثر تحریک گیرنده ها است. اعضای داخلی(روده ها، مجاری صفراویحالب، مثانه، ریه ها، رحم)، وازواسپاسم رفلکس اندام جفت شده (کلیه، اندام) با تحریک طرف مقابل. ایسکمی آنژیو اسپاستیک همچنین می تواند یک ویژگی رفلکس شرطی داشته باشد. در نهایت، تحریک مستقیم مرکز وازوموتور واقع در ناحیه زیر قشری توسط مواد سمی موجود در خون که آن را شستشو می دهد، تحریک مکانیکی تشکیلات زیر قشری که تون عروق را تنظیم می کنند (با فرآیند تومور در مغز، خونریزی های مغزی، با افزایش). فشار داخل جمجمه، وجود یک فرآیند پاتولوژیک، به ویژه التهابی در دیانسفالون نیز اغلب منجر به پدیده های آنژیواسپاستیک برجسته می شود.
بنابراین، توسعه آنژیواسپاسم در درجه اول به دلیل فعال شدن مکانیسم های نوروژنیک a-آدرنرژیک، H1-هیستامینرژیک، سروتونرژیک، دوپامینرژیک به دست می آید. منبع ماهیت غیرواسطه ای بیوژنیک آمین ها غدد فوق کلیوی (کاتکول آمین ها) و سلول های سیستم عصبی غدد درون ریز منتشر (APUD - سیستمی برای جذب پیش سازهای آمین و دکربوکسیلاسیون آنها) هستند که در اندام ها و بافت های مختلف پراکنده شده اند. توانایی تولید 5-هیدروکسی تریپتامین (سروتونین)، هیستامین و دوپامین. در بافت همبند شل، منبع هیستامین، علاوه بر این، بازوفیل های بافتی هستند، در خون - بازوفیل ها (هیستامین) و پلاکت ها (هیستامین، سروتونین). در ایجاد آنژیواسپاسم، پروستاگلاندین ها (PGF و ترومبوکسان A2) نقش خاصی دارند. دومی در پلاکت ها تشکیل می شود، انتشار آن به ویژه در طول چسبندگی و تجمع آنها بر روی دیواره عروقی آسیب دیده به شدت افزایش می یابد. در نهایت، پپتیدهای وازواکتیو، وازوپرسین و آنژیوتانسین II، اثر آنژیو اسپاستیک دارند.
مکانیسم مستقیم فعالسازی پروتئینهای انقباضی سلولهای عضلانی صاف برای چنین طیف گستردهای از منشا و طبیعت شیمیایی طیف مواد فعال بیولوژیکی به طور کامل ثابت نشده است. گیرنده های خاص سلول های ماهیچه صاف به عنوان یک واسطه عمل می کنند. با توجه به کاتکول آمین ها، اینها به ویژه گیرنده های α-آدرنرژیک هستند. هنگامی که آنها هیجان زده می شوند، ظاهراً اول از همه، خواص الکتریکی غشای سلول های عضله صاف به دلیل افزایش نفوذپذیری غشای سلولی برای یون های Na +، Ca2 +، K +، Cl- تغییر می کند. در طول پتانسیل عمل ناشی از نوراپی نفرین، نقش ویژه ای متعلق به یون های Ca2 + است که از طریق غشای سلولی از مایع بین سلولی وارد می شود و علاوه بر این، از شبکه سارکوپلاسمی آزاد می شود. نتیجه این امر فعال شدن پروتئین های انقباضی سلول های ماهیچه صاف و توسعه انقباض آنها است. با استفاده از مسدود کننده های آهسته کانال کلسیم (آنتاگونیست های Ca2 + - وراپامیل، نیفدیپین، بفیدیل)، می توان از کاهش (به طور متوسط 50٪) از کاهش نوراپی نفرین جلوگیری کرد. آنژیوتانسین II، یکی از قوی ترین مواد منقبض کننده عروق، به دلیل افزایش رسانایی یون های Na +، اثر مستقیم خود را بر روی سلول های ماهیچه صاف با دپلاریزه کردن آنها اعمال می کند. نقش مهمی در بروز ایسکمی آنژیواسپاستیک با تغییر حساسیت عناصر عضلانی دیواره عروقی نسبت به نوراپی نفرین و پپتیدهای وازواکتیو ایفا می کند. به عنوان مثال، یون های سدیم که در فیبرهای عضلانی رگ انباشته می شوند، حساسیت آن را به مواد فشار دهنده - کاتکولامین ها، وازوپرسین و آنژیوتانسین افزایش می دهند. اخیراً مشخص شده است که اندوتلیوم در عملکرد طبیعی مکانیسم انقباض - شل شدن عضلات صاف عروقی شرکت می کند. آسیب به اندوتلیوم، آن را از آزادسازی عامل آرامش محروم می کند و در نتیجه واکنش های اسپاستیک تشدید می شود. مورد دوم حتی می تواند روی استیل کولین و برادی کینین رخ دهد که معمولاً باعث اتساع عروق می شوند.
ماهیت تغییرات متابولیکی، عملکردی و ساختاری در ناحیه ایسکمیک بافت یا اندام با درجه تعیین می شود. گرسنگی اکسیژنشدت آن به سرعت توسعه و نوع ایسکمی، مدت زمان، محلی سازی، ماهیت آن بستگی دارد. گردش وثیقه، وضعیت عملکردی یک اندام یا بافت.
ایسکمی که در محل انسداد کامل یا فشرده شدن شریانها اتفاق میافتد، در حالی که سایر موارد برابر هستند، تغییرات شدیدتری نسبت به اسپاسم ایجاد میکند. ایسکمی به سرعت در حال توسعه، مانند طولانی مدت، دشوارتر از رشد آهسته یا کوتاه مدت است. از اهمیت ویژه ای در ایجاد ایسکمی انسداد ناگهانی عروق است، زیرا در این حالت اسپاسم رفلکس سیستم انشعاب این شریان می تواند بپیوندد.
ایسکمی اندام های حیاتی (مغز، قلب) عواقب شدیدتری نسبت به ایسکمی کلیه، طحال، ریه دارد و ایسکمی این دومی شدیدتر از ایسکمی بافت اسکلتی، ماهیچه ای، استخوانی یا غضروفی است. این اندام ها با سطح بالایی از متابولیسم انرژی مشخص می شوند، در عین حال رگ های جانبی آنها از نظر عملکردی مطلقاً یا نسبتاً قادر به جبران اختلالات گردش خون نیستند. در مقابل، عضلات اسکلتی و به ویژه بافت همبند، به لطف سطح پایینمتابولیسم انرژی در آنها در شرایط ایسکمیک پایدارتر هستند.
در نهایت، وضعیت عملکرد قبلی یک اندام یا بافت از اهمیت زیادی در ایجاد ایسکمی برخوردار است. انسداد جریان خون شریانی در شرایط افزایش فعالیت عملکردی اندام یا بافت خطرناک تر از حالت استراحت است. نقش اختلاف بین عملکرد اندام و خون رسانی آن در حضور تغییرات ارگانیک در شریان ها بسیار زیاد است. این به دلیل این واقعیت است که تغییرات ارگانیک در دیواره عروقی از یک سو توانایی آن را برای انبساط تحت افزایش بار محدود می کند و از سوی دیگر آن را به تأثیرات مختلف اسپاسمیک حساس تر می کند. علاوه بر این، امکان افزایش گردش خون جانبی در عروق اسکلروتیک نیز بسیار محدود است.
از نظر شماتیک، تغییرات در بافت ها در طول ایسکمی را می توان به چند مرحله متوالی تقسیم کرد.
1. کاهش کارایی چرخه کربس، افزایش شدت گلیکولیز و چرخه پنتوز، کاهش شدت متابولیسم انرژی به طور کلی. اختلال در تولید انرژی در محل ایسکمی از نظر بیماری زایی با اکسیژن رسانی ناکافی و سوبستراهای لازم برای اکسیداسیون، کاهش فعالیت و سنتز آنزیم ها، آزادسازی آنزیم ها از سلول های آسیب دیده به دلیل افزایش نفوذپذیری غشای سلولی، تفکیک فرآیندهای اکسیداسیون و فسفوریلاسیون همراه است. .
2. کاهش ذخایر فسفات های پرانرژی با افزایش کل محتوای Ca2 + در سلول، به ویژه پس از دوره های طولانی ایسکمی همراه است.
اولین علائم تغییرات فراساختاری چند دقیقه پس از شروع ایسکمی تشخیص داده می شود و با تغییر در ساختار داخلی میتوکندری مشخص می شود. تورم آنها، تجمع تدریجی قطرات چربی، ناپدید شدن متعاقب کریستاها و جایگزینی آنها با ماده دانه ای مشاهده می شود. از هم پاشیدگی بیشتر میتوکندری ها و همچنین شبکه آندوپلاسمی و هسته های سلولی، ممکن است منجر به تشکیل کانون نکروز - حمله قلبی شود. این، به عنوان یک قاعده، در اندام های پارانشیمی رخ می دهد، که با افزایش حساسیت به گرسنگی اکسیژن و آنژیو آرشیتکتونیکی متمایز می شوند، که اجازه نمی دهد به سرعت و به طور موثر اختلالات گردش خون را به دلیل ایجاد وثیقه از بین ببرد. ایسکمی طولانی مدت پوست، عضلات اسکلتی و بافت استخوانیچنین پیامدهای عملکردی و مورفولوژیکی وحشتناکی ایجاد نمی کند.
تلاش برای جلوگیری از ایجاد تغییرات نکروبیوتیک پس از ایسکمیک با استفاده از خونرسانی مجدد نتایج مثبتی به همراه نداشت، زیرا در شرایط خونرسانی مجدد، افزایش بیشتری در محتوای کلسیم بافت و تشدید آسیب به غشاها و میتوکندری وجود دارد. این اولین بار در طول ایسکمی میوکارد ایجاد شد. این خونرسانی مجدد تحت حفاظت آنتاگونیست های ورودی کلسیم انجام می شود.
3. مرحله افزایش بیوسنتز اجزای اصلی بیوشیمیایی بافت همبند - کلاژن، گلیکوزامینوگلیکان اسیدی و خنثی، که اساس سخت شدن بعدی ناحیه ایسکمیک بافت یا اندام است. پیش نیاز اجرای آن افزایش سنتز اسیدهای نوکلئیک است.
ایستایی
استاز (از گرم شدن، ایستایی - ایستادن) - کاهش سرعت و توقف جریان خون در مویرگ ها، شریان های کوچک و سیاهرگ ها. تمایز بین استاز واقعی (مویرگی) که در نتیجه تغییرات پاتولوژیک در مویرگ ها یا نقض خواص رئولوژیکی خون ایجاد می شود، ایسکمیک - به دلیل توقف کامل جریان خون از شریان های مربوطه به شبکه مویرگی و وریدی.
استاز وریدی و ایسکمیکنتیجه یک کاهش ساده و توقف جریان خون است. این شرایط به دلایلی مشابه هیپرمی وریدی و ایسکمی رخ می دهد. استاز وریدی می تواند نتیجه فشرده شدن وریدها، گرفتگی آنها با ترومبوز یا آمبولی باشد و استاز ایسکمیک نتیجه اسپاسم، فشرده شدن یا انسداد عروق است. از بین بردن علت استاز منجر به بازیابی جریان خون طبیعی می شود. برعکس، پیشرفت استاز ایسکمیک و وریدی به ایجاد واقعی کمک می کند.
در ایستایی واقعیستون خون در مویرگ ها و وریدهای کوچک بی حرکت می شود، خون همگن می شود، گلبول های قرمز متورم می شوند و قسمت قابل توجهی از رنگدانه خود را از دست می دهند. پلاسما همراه با هموگلوبین آزاد شده از دیواره عروقی خارج می شود. در بافت های کانون استاز مویرگی، نشانه هایی از سوء تغذیه شدید، نکروز وجود دارد.
علت استاز واقعی می تواند عوامل فیزیکی (سرما، گرما)، شیمیایی (سموم، محلول غلیظ کلرید سدیم و سایر نمک ها، سقز، خردل و روغن کروتون) و بیولوژیکی (سموم میکروارگانیسم ها) باشد.
مکانیسم ایجاد استاز واقعی با تجمع داخل مویرگ گلبول های قرمز، یعنی با چسبندگی آنها و تشکیل کنگلومراهایی که جریان خون را مختل می کنند، توضیح داده می شود. این باعث افزایش مقاومت محیطی می شود.
تجمع در نتیجه تغییر در خواص فیزیکی پلاسمولمای گلبول های قرمز تحت تأثیر مستقیم عواملی که به داخل رگ مویرگ نفوذ می کنند رخ می دهد. یک مطالعه میکروسکوپی الکترونی از پدیده تجمع گلبول های قرمز نشان داد که سطح آنها، صاف در شرایط عادی، با افزایش تجمع، ناهموار، "کرکی" می شود. در عین حال، خواص جذب گلبول های قرمز در رابطه با برخی رنگ ها تغییر می کند که نشان دهنده نقض وضعیت فیزیکوشیمیایی آنها است.
در پاتوژنز استاز واقعی، کند شدن جریان خون در عروق مویرگی به دلیل ضخیم شدن خون اهمیت زیادی دارد. نقش اصلی را افزایش نفوذپذیری دیواره عروق مویرگی واقع در منطقه استاز ایفا می کند. این توسط عوامل اتیولوژیکی که باعث استاز و متابولیت های تشکیل شده در بافت ها می شوند تسهیل می شود. اهمیت خاصی در مکانیسم استاز به مواد فعال بیولوژیکی (سروتونین، برادی کینین، هیستامین) و همچنین به تغییر اسیدوتیک واکنش بافتی محیط و حالت کلوئیدی آن داده می شود. در نتیجه، نفوذپذیری دیواره عروقی و اتساع عروق افزایش می یابد و منجر به ضخیم شدن خون، کند شدن جریان خون، تجمع گلبول های قرمز و در نتیجه استاز می شود.
انتشار آلبومین های پلاسما در بافت به ویژه مهم است که به کاهش بار منفی گلبول های قرمز کمک می کند که ممکن است با افتادن آنها از حالت تعلیق همراه باشد.
ترومبوز
ترومبوز- این فرآیند تشکیل در داخل بدن لخته های خون، متشکل از عناصر آن، در سطح داخلی دیواره عروق است. لخته های خون می توانند جداری (تا حدی مجرای رگ های خونی را کاهش دهند) و انسدادی باشند. نوع اول لخته شدن خون اغلب در قلب و تنه عروق بزرگ رخ می دهد، دوم - در شریان ها و وریدهای کوچک.
بسته به اینکه کدام اجزا در ساختار ترومبوس غالب هستند، ترومبوس های سفید، قرمز و مخلوط متمایز می شوند. در مورد اول، یک ترومبوز توسط پلاکت ها، لکوسیت ها و مقدار کمی از پروتئین های پلاسما تشکیل می شود. در مرحله دوم، گلبول های قرمز توسط رشته های فیبرین به هم متصل می شوند. لخته های خون مخلوط لایه های سفید و قرمز متناوب هستند.
از قرن گذشته، درک روشنی از عوامل اصلی تشکیل ترومبوز در قالب سه گانه Virchow شکل گرفته است.
1. آسیب به دیواره عروقی ناشی از عوامل فیزیکی (آسیب مکانیکی، جریان الکتریکی)، شیمیایی (NaCl، FeCl3، HgCl2، AgNO3) و بیولوژیکی (اندتوکسین های میکروارگانیسم) در نتیجه اختلال در تغذیه و متابولیسم آن. علاوه بر این، این اختلالات با آترواسکلروز، فشار خون بالا و فرآیندهای آلرژیک همراه است.
ترومب پاریتال عمدتاً در محل آسیب دیواره عروق تشکیل می شود. این از یک طرف با این واقعیت توضیح داده می شود که فاکتورهای انعقاد خون از پوشش داخلی آسیب دیده رگ آزاد می شوند و فرآیند تشکیل ترومبوز را فعال می کنند و از سوی دیگر با مهار موضعی فرآیند فیبرینولیز، کاهش در تشکیل PGI2 (پروستاسیکلین) و اندوپروکسیدهای آن در اندوتلیوم، که به طور معمول اثر ضد تجمعی بر پلاکتها دارد.
در شرایط آسیب به اندوتلیوم، توانایی آن در سنتز گلیسروفسفوکولین های حاوی آلکیل (فاکتور فعال سازی پلاکتی - PAF) افزایش می یابد. با تجمع و دگرانولاسیون پلاکت ها، آزادسازی آمین های وازواکتیو (هیستامین، سروتونین)، ATP، فعال شدن فسفولیپاز A2 و افزایش بیوسنتز ترومبوکسان A2 همراه است.
2. نقض فعالیت سیستم انعقادی و ضد انعقاد خون و دیواره عروقی. افزایش فعالیت سیستم انعقاد خون به دلیل افزایش غلظت پیش انعقادها (ترومبین، ترومبوپلاستین) در آن و همچنین کاهش فعالیت ضد انعقاد (کاهش محتوای ضد انعقاد خون یا افزایش فعالیت مهارکننده های آنها، از جمله فیبرینولیتیک، معمولاً منجر به انعقاد خون داخل عروقی (ICC) و ترومبوز می شود.
VSSV ناشی از ورود سریع و قابل توجه عوامل انعقاد خون به بستر عروقی است، به ویژه ترومبوپلاستین بافتی، که با جدا شدن زودرس جفت، آمبولی مایع آمنیوتیک، شوک تروماتیک، همولیز گلبول قرمز عظیم حاد مشاهده می شود. در یک آزمایش، BCCV را می توان با وارد کردن ترومبین فعال یا ترومبوپلاستین به گردش خون عمومی سگ یا خرگوش بازتولید کرد.
VSSK می تواند عمومی (سندرم انعقاد داخل عروقی منتشر - منتشر) و موضعی باشد. این یک فرآیند برگشت پذیر است، به ویژه با درمان به موقع ضد انعقاد.
انتقال VSSK به ترومبوز تحت تأثیر فاکتورهای انعقادی دیواره عروقی و پلاکت ها هنگام آسیب دیدن آنها اتفاق می افتد.
با توجه به افزایش مصرف فاکتورهای انعقاد خون و پلاکت ها در طول DIC، فعال شدن ثانویه سیستم ضد انعقاد و فیبرینولیز در فاز دوم DIC، سندرم ترومبوهموراژیک یا هیپرهیپو انعقاد ایجاد می شود.
3. کند شدن جریان خون و اختلال در آن (تلاطم در ناحیه آنوریسم). این عامل احتمالاً اهمیت کمتری دارد، اما به توضیح اینکه چرا لختههای خون در سیاهرگها پنج برابر بیشتر از شریانها، در سیاهرگهای اندام تحتانی - 3 برابر بیشتر از رگهای اندام فوقانی تشکیل میشوند، کمک میکند. همچنین فراوانی تشکیل ترومبوز در جبران گردش خون، ماندن در استراحت طولانی مدت در بستر.
فرآیند تشکیل ترومبوز را می توان به طور مشروط به دو مرحله تقسیم کرد: مرحله چسبندگی، تجمع و آگلوتیناسیون پلاکت ها (فاز سلولی) و فاز انعقاد (فاز انعقاد پلاسما). ماهیت فیزیکوشیمیایی فاز سلولی (هموستاز اولیه یا عروقی-پلاکتی) عبارت است از تغییر پتانسیل الکتریکی دیواره عروقی، بار پلاکت ها و سایر سلول های خونی، افزایش توانایی چسبندگی پلاکت ها و ایجاد ته نشین شدن آنها بر روی پلاکت ها. سطح آسیب دیده ("خارجی") پوشش داخلی رگ های خونی (چسبندگی) و "چسبیدن" به یکدیگر (جمع شدن).
بر اساس مفاهیم مدرن، مکانیسم اصلی چسبندگی و تجمع پلاکت ها کاهش بار منفی آنها به دلیل کاهش محتوای ATP و افزایش ADP در مناطق آسیب دیده رگ ها و بافت ها و همچنین پلاکت ها، مهار خواص ضد تجمعی دیواره عروقی هنگامی که به دلیل کاهش سنتز PGI2 (پروستاسیکلین) در برابر افزایش سنتز پلاکت های PGD2، PGN2، ترومبوکسان A2، PAF (فاکتور تجمع پلاکتی) آسیب می بیند. دومی، به ویژه ترومبوکسان A2، بر خلاف پروستاسیکلین، آغازگر قوی تجمع پلاکتی است. این عمل این مواد ظاهراً از طریق آزادسازی ADP توسط پلاکت ها که منجر به تجمع آنها می شود، محقق می شود. افزایش سنتز پروستاگلاندین ها به دلیل اثر فعال کننده محرک های مختلف در تجمع (ترومبین، کلاژن، سروتونین، آدرنالین، نورآدرنالین و غیره) بر روی فسفولیپاز A2 (آزادسازی اسید آراشیدونیک از فسفولیپیدهای غشای پلاکتی - سوبسترای سنتز اولیه پروستات است). ) دیگر سنتز آنها. فاکتورهای پلاسمایی انعقاد خون (فیبرینوژن، فاکتورهای VIII، XIII) نیز نقش خاصی در فرآیندهای چسبندگی و تجمع پلاکت ها دارند.
توجه به این نکته ضروری است که در مرحله تجمع برگشت ناپذیر، مقادیر اضافی ADP، سروتونین، آدرنالین، نوراپی نفرین و سایر مواد فعال بیولوژیکی، PAF از پلاکت ها در خون آزاد می شود. بنابراین این فرآیند شخصیت یک دور باطل را به خود می گیرد.
تغییرات غیرقابل برگشت در پلاکت ها در عرض 2 تا 3 دقیقه از لحظه آسیب به پوشش داخلی عروق رخ می دهد. در عین حال، گسترش سیتوپلاسم آنها، ظهور شبههای متعدد، از بین رفتن گرانولهای پلاکتی در لبههای پلاکتها، چسبندگی لکوسیتها و تشکیل الیاف فیبرین روی سطح آنها وجود دارد که به تثبیت پلاکت کمک میکند. پلاک اولیه پلاکت تجزیه بعدی به عمق توده گسترش می یابد، که با فعال شدن آنزیم های اتولیتیک، افزایش نفوذپذیری و انحلال غشاهای پلاسما تسهیل می شود. در نتیجه، شرایط برای افزایش نفوذ کلسیم از سرم خون به پلاکت ها، فعال شدن ATPase وابسته به Ca2 + در آنها، تغییر بیشتر نسبت ATP / ADP به سمت افزایش ADP و در نتیجه، بیشتر و بیشتر ایجاد می شود. افزایش تدریجی چسبندگی و تجمع
از لحظه تجزیه پلاکت ها و آزاد شدن فاکتورهای پلاکتی انعقاد خون در محیط، مرحله بعدی ترومبوز شروع می شود - فاز پلاسما (فاز انعقاد خون). ماهیت فیزیکوشیمیایی و بیوشیمیایی این فاز شامل چندین تغییر شکل متوالی از نوع پروآنزیم-آنزیم است. برخی از این تحولات ماهیت آنزیمی واقعی دارند.
در مرحله اول از مرحله انعقاد خون، ترومبوپلاستین بافت و خون با انتقال آنها به ترومبوپلاستین فعال خارجی و داخلی فعال می شود. ترومبوپلاستین خارجی از تعامل بافت و اجزای پلاسما سیستم انعقاد خون تشکیل می شود. خون یا ترومبوپلاستین داخلی (فاکتور پلاکتی 3) از پروترومبوپلاستین پلاکتی در اثر تعامل فاکتورهای انعقاد پلاسما تشکیل می شود. زمان تشکیل ترومبوپلاستین بافتی چند ثانیه است، در حالی که تشکیل ترومبوپلاستین خون چند دقیقه طول می کشد.
در مرحله دوم، ترومبین فعال تشکیل می شود. تحت تأثیر آنزیم پروتئولیتیک ترومبوپلاستین، پپتیدها از هر دو انتهای مولکول پروتئین پروترومبین جدا می شوند تا ترومبین، یک آنزیم پروتئولیتیک بسیار خاص، تشکیل شود.
در مرحله سوم، تحت تأثیر ترومبین، فیبرینوژن با تشکیل لخته به فیبرین تبدیل می شود. متعاقباً، پیوندهای هیدروژنی بین مولکولی در فیبرین-پلیمر تحت تأثیر عامل تثبیت کننده فیبرین پلاسمای خون حتی قوی تر می شوند.
فیبرین به شکل رشته های شل یا فشرده قسمت اعظم ترومبوز را تشکیل می دهد. سلول های خونی (پلاکت های تجمع یافته، تجمع لکوسیت ها و گلبول های قرمز) در سلول های شبکه تشکیل شده قرار دارند.
در مرحله نهایی انعقاد خون تحت اثر ترومباستنین (رتاکتوزیم) که از پلاکتهای سالم آزاد میشود، با استفاده از میکروسکوپ الکترونی، فیبرهای فیبرین و رشتههای موجود در پلاکتها کاهش مییابد (براساس نوع انقباض اکتومیوزین). فشرده سازی (پسرفت) و فشرده شدن لخته رخ می دهد. پسکشی فرآیندی ناپایدار است که وقتی پلاکتها در معرض عوامل شیمیایی (جیوه، کبالت، مس، فلوئور، فرمالدئید، اتر، کلروفرم) و فیزیکی (گرمای بیش از 57 درجه سانتیگراد، انجماد، قرار گرفتن در معرض امواج فراصوت) قرار میگیرند، مختل میشود. در این حالت سرکوب کامل انقباض مشاهده می شود. برای سیر طبیعی انقباض، وجود کلسیم، گلوکز، یونهای ATP، سیر فیزیولوژیکی گلیکولیز، نسبتهای معینی بین غلظت ترومبین و فیبرینوژن و همچنین فیبرینوژن و پلاکتها ضروری است.
در اصل، پویایی داده شده در فرآیند تشکیل ترومبوز، به ویژه، حضور اجباری فازهای سلولی و پلاسما، برای اکثر گونه های جانوری معمول است.
عواقب ترومبوز می تواند متفاوت باشد. با توجه به اهمیت آن به عنوان یک مکانیسم هموستاتیک در ترومای حاد همراه با خونریزی، ترومبوز باید از دیدگاه بیولوژیکی عمومی به عنوان یک پدیده تطبیقی در نظر گرفته شود.
در همان زمان، تشکیل ترومبوز در بیماری های مختلف(آترواسکلروز، اندارتریت محو کننده، دیابتو دیگران) ممکن است با عوارض شدید ناشی از اختلالات حاد گردش خون در ناحیه رگ ترومبوز شده (ایسکمی در ترومبوز شریانی، استاز خون در ترومبوز وریدی) همراه باشد.
ایجاد نکروز (انفارکتوس، قانقاریا) در حوضه یک رگ ترومبوز شده بدون وثیقه مرحله نهایی ترومبوز است. نقش ترومبوز عروق کرونر در ایجاد انفارکتوس میوکارد بسیار زیاد است.
نتیجه ترومبوزهمجوشی آسپتیک (آنزیمی، اتولیتیک)، سازماندهی (تجذب با جایگزینی با بافت همبند)، کانالیزاسیون مجدد، همجوشی سپتیک (چرکی) وجود دارد. مورد دوم به ویژه خطرناک است، زیرا به سپتیکوپمی و تشکیل آبسه های متعدد در اندام های مختلف کمک می کند.
آمبولی
آمبولی(از آمبالین یونانی - پرتاب به داخل) - انسداد رگ های خونی توسط اجسام (آمبولی) ناشی از جریان خون یا لنف.
محلی سازی بین آمبولی گردش خون بزرگ ریوی و سیستم ورید پورتال تمایز قائل می شود.
در تمام این موارد، حرکت آمبولی معمولاً مطابق با حرکت انتقالی طبیعی خون انجام می شود. نتیجه این است که منبع آمبولی گردش خون سیستمیک فرآیندهای پاتولوژیک در وریدهای ریوی، حفره های نیمه چپ قلب، شریان های گردش خون سیستمیک است. تغییرات پاتولوژیک کوچک در وریدهای گردش خون سیستمیک و نیمه راست قلب. تغییرات پاتولوژیک در حوضچه ورید پورتال منجر به بروز آمبولی ورید پورتال می شود. یک استثنا آمبولی رتروگراد است، زمانی که حرکت آمبولی نه از قوانین همودینامیک، بلکه از گرانش خود آمبولی پیروی می کند. چنین آمبولی در تنه های وریدی بزرگ با کاهش سرعت جریان خون و کاهش اثر مکش قفسه سینه ایجاد می شود. همچنین یک آمبولی متناقض وجود دارد که با بسته نشدن سپتوم دهلیزی یا بین بطنی مشاهده می شود، در نتیجه آمبولی از وریدهای گردش خون سیستمیک و نیمه راست قلب به سمت چپ عبور می کند و دایره کوچک را دور می زند. .
آمبولی با منشا اگزوژن... آمبولی هوا زمانی اتفاق میافتد که سیاهرگهای بزرگ (سینوسهای ژوگولار، ساب کلاوین، سختشما) آسیب میبینند که ضعیف فرو میروند و فشار آن نزدیک به صفر یا منفی است. این شرایط می تواند به عنوان علت آمبولی هوا در اجرای دستکاری های پزشکی - در حین تزریق محلول ها به این عروق باشد. در نتیجه هوا به داخل وریدهای آسیب دیده مکیده می شود، به ویژه در اوج دم، همراه با آمبولی بعدی عروق گردش خون ریوی. شرایط یکسانی در هنگام آسیب دیدن ریه یا فرآیندهای مخرب در آن و همچنین هنگام اعمال پنوموتوراکس ایجاد می شود. اما در چنین مواردی، آمبولی عروقی در گردش خون سیستمیک رخ می دهد. عواقب مشابهی در اثر جریان مقدار زیادی هوا از ریه ها به داخل خون هنگامی که شخص در معرض یک موج شوک انفجاری (هوا، آب) قرار می گیرد و همچنین در هنگام "فشرده سازی انفجاری" و صعود سریع به یک مکان بزرگ ایجاد می شود. ارتفاع گسترش شدید آلوئول های ریوی، پارگی دیواره های آنها و جریان هوا به شبکه مویرگی منجر به آمبولی اجتناب ناپذیر عروق گردش خون سیستمیک می شود.
با گانگرن بی هوازی (گاز)، آمبولی گاز نیز امکان پذیر است.
آمبولی با منشا درون زا.منبع ترومبوآمبولی ذره ای از یک ترومبوز جدا شده است. جدا شدن ترومبوز نشانه حقارت آن در نظر گرفته می شود (ترومبوز "بیمار"). در بیشتر موارد، لخته های خون "بیمار" در وریدهای گردش خون سیستمیک (وریدهای اندام تحتانی، لگن، کبد) تشکیل می شود که فراوانی بالای ترومبوآمبولی دایره کوچک را توضیح می دهد. تغییرات التهابی در دریچه های تنه ریوی و دریچه دهلیزی راست که اساس ترومبوآندوکاردیت هستند، اغلب با آمبولی ریه همراه است. تنها هنگامی که لخته های خون در سمت چپ قلب (با اندوکاردیت، آنوریسم) یا در شریان ها (با آترواسکلروز) تشکیل می شود، آمبولی عروق گردش خون سیستمیک رخ می دهد.
دلیل پایین بودن ترومبوز، جدا شدن ذرات آن و ترومبوآمبولی، همجوشی آسپتیک یا چرکی آن، نقض فاز انقباض تشکیل ترومبوس و همچنین انعقاد خون است.
آمبولی چربیزمانی اتفاق میافتد که قطرات چربی، اغلب با منشأ درونزا، وارد جریان خون میشوند.
علت ورود قطرات چربی به جریان خون آسیب (خرد شدن، ضربه مغزی شدید) مغز استخوان، بافت زیر جلدی یا لگنی و تجمعات چربی، کبد چرب است.
با افزایش سن، به دلیل جایگزینی مغز استخوان قرمز استخوان های لوله ای با رنگ زرد و افزایش محتوای چربی با نقطه ذوب پایین، خطر آمبولی چربی افزایش می یابد.
از آنجایی که منبع آمبولی عمدتاً در حوضه وریدهای گردش خون سیستمیک قرار دارد، آمبولی چربی در درجه اول در عروق گردش خون ریوی امکان پذیر است. فقط در آینده امکان نفوذ قطرات چربی از طریق مویرگ های ریوی (یا آناستوموز شریانی-وریدی دایره کوچک) وجود دارد. نیمه باقی ماندهقلب و شریان های گردش خون سیستمیک.
مقدار چربی عامل آمبولی چربی کشنده در حیوانات مختلف در محدوده 0.9 - 3 cm3 / kg متفاوت است.
آمبولی بافتیدر تروما مشاهده می شود، زمانی که ضایعات بافت های مختلف بدن، به ویژه بافت های غنی از آب (مغز استخوان، ماهیچه ها، مغز، کبد، تروفوبلاست) می توانند به سیستم گردش خون، به ویژه گردش خون ریوی منتقل شوند. جداسازی تودههای چربی شبیه گریل توسط آترومها در دیواره شریان آترواسکلروتیک و ورود آنها به جریان خون با آمبولی شریانهای گردش خون سیستمیک همراه است. آمبولی عروقی توسط سلول های تومور بدخیم از اهمیت ویژه ای برخوردار است، زیرا مکانیسم اصلی برای تشکیل متاستاز است.
آمبولی مایع آمنیوتیکهنگام ضربه اتفاق می افتد مایع آمنیوتیک در هنگام زایمان در عروق آسیب دیده رحم در ناحیه جفت جدا شده. ذرات متراکم در شریان ها و مویرگ های ریه ها باقی می مانند مایع آمنیوتیک(مکونیوم، ورنیکس کازئوزا)، که با تظاهرات بالینی آمبولی ریه همراه است. این نوع آمبولی با افزایش فعالیت سیستم فیبرینولیتیک خون، کاهش شدید محتوای فیبرینوژن در خون (هیپو و آفیبرینوژنمی)، اختلال در انعقاد خون (ثانویه) و طولانی مدت از آمبولی بافتی متمایز می شود. مدت خونریزی مداوم از رحم
آمبولی گازیپیوند پاتوژنتیک اصلی در حالت رفع فشار، به ویژه بیماری رفع فشار است. افت فشار اتمسفر از زیاد به نرمال (برای کیسون های در حال کار و غواصان) یا از نرمال به شدیداً پایین (با افزایش سریع به ارتفاع یا در حین کاهش فشار کابین هواپیمای ارتفاع بالا) منجر به کاهش حلالیت می شود. گازها (نیتروژن، دی اکسید کربن، اکسیژن) در بافت ها و خون و مسدود شدن حباب های این گازها (عمدتاً نیتروژن) مویرگ ها که عمدتاً در حوضه گردش خون سیستمیک قرار دارند.
تظاهرات بالینی آمبولیبا محلی سازی آن (گردش خون کوچک یا بزرگ)، ویژگی های آنژیو آرشیتکتتونیک، به ویژه، وضعیت گردش خون جانبی و تنظیم عصبی-هومورال آن، اندازه و ترکیب آمبولی، جرم کل آنها، سرعت ورود به جریان خون، و واکنش پذیری ارگانیسم
آمبولی گردش خون ریوی.مهمترین تغییر عملکردی در آمبولی عروقی در گردش خون ریوی، کاهش شدید فشار خون در گردش خون سیستمیک و افزایش فشار در گردش خون ریوی است. چندین فرضیه وجود دارد که مکانیسم اثر کاهش فشار خون را در آمبولی ریه توضیح می دهد. برخی از محققان کاهش شدید فشار خون را با کاهش حجم خون دقیقه ناشی از انسداد مکانیکی شریان ریوی و نارسایی بطن راست قلب مرتبط می دانند. با این حال، مطالعات بیشتر نشان داد که بسته شدن مکانیکی حتی بیشتر رگهای ریه هنوز باعث اختلالات گردش خون مانند آمبولی نمیشود.
ارزش مشخصی در کاهش فشار خون در طول آمبولی ریه به تضعیف عملکرد قلب به دلیل هیپوکسی میوکارد نسبت داده می شود که در نتیجه افزایش بار روی میوکارد است. نیمه راستقلب و افت شدید فشار خون.
اثر همودینامیک اجباری آمبولی عروقی در گردش خون ریوی افزایش فشار خون در شریان ریوی و افزایش شدید گرادیان فشار در ناحیه شریان ریوی - مویرگ ها است که به عنوان یک نتیجه اسپاسم رفلکس در نظر گرفته می شود. از عروق ریوی
همین اثر - تحریک گیرنده های عروق ریوی و اسپاسم بعدی - می تواند ناشی از افزایش فشار در شریان های ریه، تحریک مکانیکی عروق خونی توسط آمبولی، کاهش جریان خون در رگ زیر آمبولی باشد. انتشار موادی در محل انسداد (سروتونین، هیستامین) که خاصیت انقباض فیبرهای عروقی عضلانی نامشخص را دارند.
در ارتباط با اختلالات همودینامیک، فشار ورید مرکزی به شدت افزایش می یابد، سندرم حاد قلب ریوی(سندرم نارسایی حاد بطن راست قلب) که اغلب علت مرگ است.
نقض همودینامیک در گردش خون ریوی و بزرگ در آمبولی ریه در ترکیب با برونشیولاسپاسم عمومی منجر به تغییر در نسبت تهویه - پرفیوژن در ریه ها و در نتیجه تغییرات ثانویه در ترکیب گاز خون - افزایش ولتاژ CO2 می شود. کاهش ولتاژ O2 تنگی نفس به عنوان یک واکنش تطبیقی با هدف عادی سازی ترکیب گاز خون ایجاد می شود. اعتقاد بر این است که اختلال در تنفس خارجی در آمبولی ریوی یک واکنش رفلکس است که هم از میدان گیرنده گردش خون ریوی و هم در نتیجه تحریک مناطق بازتابی گردش خون سیستمیک با خون با محتوای اکسیژن کم ناشی می شود. به طور تجربی نشان داده شده است که با برش اعصاب واگمیزان اختلالات تنفسی مشاهده شده را می توان به میزان قابل توجهی کاهش داد.
آمبولی گردش خون سیستمیک... همانطور که قبلا ذکر شد، آمبولی رگ های گردش خون سیستمیک اغلب بر اساس فرآیندهای پاتولوژیک در نیمه چپ قلب است که با تشکیل لخته های خون در سطح داخلی آن (ترومبوآندوکاردیت، انفارکتوس میوکارد)، تشکیل ترومبوز در شریان ها همراه است. گردش خون سیستمیک با ترومبوآمبولی بعدی، گاز یا آمبولی چربی ... محل محلی سازی مکرر آمبولی عروق کرونر، مغز میانی، کاروتید داخلی، کلیه، طحال، شریان مزانتریک است. در صورت مساوی بودن همه چیزهای دیگر، محل آمبولی با زاویه تخلیه عروق جانبی، قطر آن و شدت گردش خون در اندام تعیین می شود. زاویه بزرگ خروج شاخه های جانبی در رابطه با بخش فوقانی رگ، قطر نسبتاً بزرگ آنها، پرخونی عوامل مستعد کننده برای یک یا دیگری محلی سازی آمبولی هستند.
در صورت آمبولی گازی همراه با بیماری رفع فشار یا "دکمپرسیون انفجاری"، یک لحظه مستعد برای محلی سازی آمبولی در عروق مغز و بافت زیر جلدی، حلالیت خوب نیتروژن در بافت های غنی از لیپوئید است.
شدت تصویر بالینی در هر مورد عمدتاً با رابطه دو عامل - وازواسپاسم رفلکس و درجه توسعه وثیقه تعیین می شود. اسپاسم رفلکس می تواند نه تنها در رگ های نزدیک، بلکه در رگ های دورتر نیز رخ دهد و روند روند پاتولوژیک را تشدید کند. در این مورد، تغییرات پاتوفیزیولوژیک موضعی اغلب با تغییرات معمولی همراه می شود که اغلب بیماران از این طریق می میرند.
از سوی دیگر، شرایط گردش خون جانبی در حوضه رگ مسدود شده توسط آمبولی و در بافت های مجاور عاملی است که از عواقب وحشتناک و اغلب غیرقابل برگشت آمبولی مانند مرگ محل بافت مربوطه جلوگیری می کند.
آمبولی ورید پورتال... آمبولی ورید پورتال، اگرچه بسیار کمتر از آمبولی گردش خون ریوی و سیستمیک است، اما در درجه اول با مجموعه علائم بالینی مشخص و اختلالات همودینامیک بسیار شدید توجه را به خود جلب می کند.
به دلیل ظرفیت زیاد بستر پورتال، انسداد توسط آمبولی تنه اصلی ورید پورتال یا شاخه های اصلی آن منجر به افزایش پر شدن خون در اندام های شکمی می شود. حفره (معده، روده، طحال) و ایجاد سندرم فشار خون پورتال (افزایش فشار خون در سیستم ورید پورتال از 8-10 به 40-60 سانتی متر H2O). در این مورد، در نتیجه، یک سه گانه بالینی مشخص (آسیت، گسترش وریدهای سطحی دیواره قدامی شکم، بزرگ شدن طحال) و تعدادی از تغییرات کلی ناشی از اختلال در گردش خون (کاهش جریان خون به قلب) ، سکته و حجم خون دقیقه، کاهش فشار خون)، تنفس (تنگی نفس، سپس کاهش شدید تنفس، آپنه) و عملکردهای سیستم عصبی (از دست دادن هوشیاری، فلج تنفسی). اینها تخلفات عمومیعمدتاً کاهش توده خون در گردش ناشی از تجمع آن (حدود 90٪) در بستر پورتال وجود دارد. چنین اختلالات همودینامیک اغلب علت مستقیم مرگ بیماران است.
در عین حال هیچ رابطه مستقیمی بین آسیت، گشاد شدن وریدهای سطحی دیواره قدامی شکم و اسپلنومگالی از یک سو و میزان فشار خون پورتال از سوی دیگر وجود ندارد. گاهی اوقات، با سطح بالای فشار پورتال، این علائم وجود ندارد و برعکس، در برخی موارد حتی با افزایش جزئی فشار در سیستم ورید پورتال ظاهر میشوند. این نشان می دهد که در توسعه این تظاهرات بالینیفشار خون پورتال، به ویژه آسیت، علاوه بر افزایش فشار، عوامل دیگری مانند اختلال در عملکرد متابولیک کبد، احتباس سدیم و متعاقب آن احتباس آب در بدن ناشی از تولید بیش از حد آلدوسترون توسط قشر آدرنال، وازوپرسین توسط قشر آدرنال، نقش مهمی ایفا می کنند. سلول های ترشحی عصبی هسته های فوق اپتیک و پارا بطنی هیپوتالاموس؛ کاهش فشار کلوئیدوسموتیک پلاسمای خون به دلیل هیپوپروتئینمی. افزایش نفوذپذیری دیواره مویرگهای بستر پورتال.
ادبیات:
1. M.S. عبداللهودژایوا "مبانی آسیب شناسی انسانی" - تاشکند: انتشارات خانه عسل. روشن شد آنها ابوبن سینو، 1997، کتاب درسی در 2 جلد;
2. N. N. Zaiko، Yu. V. Byts، A. V. Ataman و دیگران. فیزیولوژی پاتولوژیک"- مسکو:" پزشکی "، 1998؛
3. PF Litvitsky، "Pathophysiology" - مسکو: "GEOTAR-MED"، 2003، کتاب درسی در 2 جلد.
4. V. S. Paukov، P. F. Litvitsky، "آسیب شناسی" - مسکو: "پزشکی"، 2004;
5. A. Sh. Zaichik، L. P . چوریلوف "مبانی آسیب شناسی عمومی" - مسکو: "ELBI" 1999;
6. V. M. Pokrovsky، G. F. Korotko "فیزیولوژی انسان" - مسکو: "پزشکی"، 1999;
7. ویرایش شده توسط M. Woodley و F. Whelan "دایرکتوری درمانی دانشگاه واشنگتن" - مسکو: "Practice"، 1995;
متون سخنرانی در
برای دانش آموزان سال دوم
تاشکند 2010
وزارت بهداشت جمهوری ازبکستان
موسسه داروسازی تاشکند
"تایید میکنم"
معاون آموزشی، پروفسور. یولداشف Z.O.
"___" _______________ 2010
متون سخنرانی در
موضوع "مبانی رشته های پزشکی"
برای دانش آموزان سال دوم
دستورالعمل های داروسازی بالینی
اختلالات گردش خون
دانشیار D.G. Grigoriev
با توجه به شیوع و محلی شدن فرآیند، اختلالات گردش خون به موضعی و عمومی تقسیم می شوند.
اختلالات موضعی گردش خون و لنف به دلیل آسیب ساختاری و عملکردی به بستر عروقی در هر یک از بخش های آن - در یک اندام، بخشی از اندام یا بخشی از بدن ایجاد می شود.
اختلالات عمومی در سراسر بدن، کل سیستم گردش خون رخ می دهد و با اختلال در فعالیت قلب یا تغییر در حجم و خواص فیزیکوشیمیایی خون همراه است.
تقسیم اختلالات گردش خون به محلی و کلی مشروط است و باید از جنبه وحدت دیالکتیکی محلی و کلی فهمید.
اختلالات موضعی گردش خون
اختلالات گردش خون موضعی عبارتند از:
مجموعه شریانی؛
احتقان وریدی؛
استاز خون؛
خونریزی و خونریزی؛
ترومبوز؛
آمبولی؛
ایسکمی (کم خونی موضعی)؛
حمله قلبی.
بیایید فقط روی 2 نوع اختلالات گردش خون موضعی - ترومبوز و ایسکمی صحبت کنیم.
ترومبوز (از یونانی ترومبوز) - انعقاد خون داخل حیاتی در مجرای رگ یا حفره های قلب. لخته خون حاصل ترومبوز نامیده می شود.
لخته شدن خون پس از مرگ در عروق خونی مشاهده می شود (لخته شدن خون پس از مرگ). و توده های متراکم خونی که در همان زمان ریخته شده اند، لخته خون پس از مرگ نامیده می شوند.
علاوه بر این، لخته شدن خون در بافت ها در هنگام خونریزی از یک رگ آسیب دیده رخ می دهد و یک مکانیسم هموستاتیک طبیعی است که هدف آن متوقف کردن خونریزی زمانی است که یک رگ آسیب دیده است.
مکانیسم انعقاد خون
طبق مفهوم مدرن، روند هموستاز شامل 2 مرحله اصلی است - هموستاز عروقی-پلاکتی و انعقادی.
مرحله اولیه هموستاز پلاکتی عروقیهمراه با آسیب به دیواره عروقی (عمدتا اندوتلیوم)، چسبندگی (چسبندگی به دیواره عروق) و تجمع (به هم چسبیدن) پلاکت ها با تشکیل پلاک پلاکتی.
هموستاز انعقادیبه شکل یک واکنش آبشاری ("نظریه آبشار") - فعال شدن متوالی پروتئین های پیش ساز یا عوامل انعقادی در خون یا بافت ها رخ می دهد: مراحل اصلی این فرآیند تشکیل ترومبین است و سپس تحت تأثیر آن، تبدیل فیبرینوژن به فیبرین کل چرخه با جمع شدن (انقباض) لخته تکمیل می شود و آن را کامل، از نظر ماکروسکوپی خشک، فرو ریخته، با سطح موجدار می کند. بر خلاف in vivo، انعقاد پس از مرگ با جمع شدن لخته خاتمه نمییابد و بنابراین الاستیک، با سطحی براق و صاف است.
علاوه بر سیستم انعقادی، یک سیستم ضد انعقاد نیز وجود دارد که تنظیم سیستم هموستاز را تضمین می کند - حالت مایع خون در بستر عروقی در شرایط عادی. بر این اساس، ترومبوز تظاهر اختلال در تنظیم سیستم هموستاتیک است.
عوامل موثر بر تشکیل ترومبوز
آسیب به اندوتلیوم عروقی، که هم چسبندگی پلاکت ها و هم فعال شدن آبشار انعقاد خون را تحریک می کند، عامل اصلی تشکیل ترومبوز در بستر شریانی است. هنگامی که یک لخته خون در وریدها و در عروق میکروسکولار تشکیل می شود، آسیب اندوتلیال نقش کمتری ایفا می کند.
تغییرات در جریان خون، مانند کاهش جریان خون و جریان خون آشفته؛
تغییرات در خواص فیزیکوشیمیایی خون (ضخیم شدن خون، افزایش ویسکوزیته خون، افزایش سطح فیبرینوژن و تعداد پلاکت ها) از عوامل مهم تر در ترومبوز وریدی هستند.
مورفولوژی و انواع لخته های خون
مورفولوژی یک ترومبوز به عوامل زیادی از جمله کالیبر رگ بستگی دارد.
در رگ های رگ های بزرگ از نوع الاستیک و عضلانی-الاستیک، انواع لخته های خون زیر مشخص می شود:
لخته خون سفید؛
لخته خون قرمز؛
لخته خون مخلوط؛
ترومبوس سفید متشکل از پلاکتها، فیبرین و لکوسیتها با تعداد کمی گلبول قرمز است که به آرامی و اغلب در بستر شریانی، جایی که سرعت جریان خون بالا وجود دارد، تشکیل میشود.
لخته قرمز خون از پلاکت ها، فیبرین و تعداد زیادی گلبول قرمز تشکیل شده است که در شبکه فیبرین به دام افتاده اند. لختههای خون قرمز معمولاً در سیستم وریدی تشکیل میشوند، جایی که جریان آهسته خون باعث جذب گلبولهای قرمز میشود.
ترومبوز مخلوط اغلب رخ می دهد، دارای ساختار لایه ای است، حاوی عناصر خونی است که مشخصه ترومبوس سفید و قرمز است. لخته های خونی لایه ای بیشتر در سیاهرگ ها، در حفره آنوریسم های آئورت و قلب تشکیل می شوند. در یک ترومبوز مختلط، موارد زیر وجود دارد:
سر (ساختار لخته سفید خون دارد) وسیع ترین قسمت آن است.
بدن (در واقع ترومبون مخلوط)،
دم (دارای ساختار لخته خون قرمز).
سر به محلی از اندوتلیوم تخریب شده متصل است که ترومبوز را از لخته شدن خون پس از مرگ متمایز می کند.
در رابطه با لومن رگ، موارد زیر وجود دارد:
ترومبوز جداری (بیشتر لومن آزاد است)؛
یک ترومب انسداد یا مسدود کننده (لومن رگ تقریباً به طور کامل بسته است).
نتیجه ترومبوز
تشکیل لخته های خون پاسخی را از بدن برای از بین بردن لخته و بازگرداندن جریان خون به رگ خونی آسیب دیده آغاز می کند. مکانیسم های مختلفی برای این کار وجود دارد:
لیز ترومبوس (فیبرینولیز)، که منجر به تخریب کامل ترومبوز می شود، یک نتیجه مطلوب ایده آل است، اما بسیار نادر است.
سازماندهی و بازسازی مجدد: معمولاً در لخته های خونی بزرگ رخ می دهد. لیز آهسته و فاگوسیتوز یک ترومبوز با تکثیر بافت همبند و کلاژن سازی (سازماندهی) همراه است. در ترومبوز، ترک ها می توانند ایجاد شوند - کانال های عروقی که با اندوتلیوم پوشانده شده اند (کانالیزاسیون مجدد) که به دلیل آن جریان خون می تواند تا حدودی بازسازی شود. کانالیزاسیون مجدد آهسته است و طی چند هفته انجام می شود و اگرچه از ترومبوز حاد جلوگیری نمی کند، اما ممکن است در درازمدت پرفیوژن بافتی را کمی بهبود بخشد.
سنگ شدن ترومبوس یک نتیجه نسبتا مطلوب است که با رسوب نمک های کلسیم در ترومبوس مشخص می شود. در وریدها، این روند گاهی اوقات تلفظ می شود و سنگ های ورید (فلبولیت) می توانند تشکیل شوند.
فروپاشی سپتیک ترومبوز یک نتیجه نامطلوب است که زمانی رخ می دهد که ترومبوز از خون یا دیواره رگ عفونی شود.
در رگ های کوچک، از جمله MCB، اشکال خاصی از لخته های خون به نام میکروترومبی وجود دارد. آنها تقریباً منحصراً با انعقاد داخل عروقی منتشر ایجاد می شوند، بنابراین توصیه می شود آنها را در چارچوب این فرآیند در نظر بگیرید.
خون موضعی یا ایسکمی
کم خونی یا ایسکمی (از یونانی Ischo - مانع کردن، تاخیر) - کاهش یا توقف جریان خون شریانی به اندام، بافت یا بخشی از بدن.
بسته به علل و شرایط وقوع، انواع زیر از کم خونی متمایز می شود:
آنژیو اسپاستیک؛
انسداد
فشرده سازی؛
ایسکمی در نتیجه توزیع مجدد خون.
ایسکمی آنژیو اسپاستیک به دلیل اسپاسم شریان ها در اثر عمل محرک های مختلف رخ می دهد.
ایسکمی انسدادی در نتیجه انسداد مجرای شریان ها رخ می دهد و اغلب با ترومبوز یا آمبولی شریان ها و همچنین با تکثیر بافت همبند در لومن شریان همراه با التهاب دیواره آن (محو کننده) همراه است. اندارتریت) یا باریک شدن لومن شریان توسط پلاک آترواسکلروتیک. اغلب، ایسکمی انسدادی با آنژیو اسپاستیک ترکیب می شود.
ایسکمی فشاری در نتیجه فشردهسازی شریان هنگام اعمال تورنیکه، هنگام بستن شریانها در حین عمل با بستن، و همچنین هنگامی که آنها توسط یک افیوژن التهابی (اگزودا)، تومور، اسکار یا اندام بزرگ شده فشرده میشوند، مشاهده میشود.
ایسکمی در نتیجه توزیع مجدد خون. به عنوان مثال، ایسکمی مغزی پس از برداشتن سریع مایع آسیتی از حفره شکمیجایی که تودهای از خون میجوشد.
تغییرات مورفولوژیکی در اندام ها و بافت ها در همه انواع ایسکمی، به هر طریقی، با هیپوکسی یا آنکسی، یعنی با گرسنگی اکسیژن همراه است. بسته به علتی که باعث کم خونی شده است، ناگهانی بودن آن، مدت و درجه کاهش جریان خون شریانی، ایسکمی حاد و مزمن تشخیص داده می شود.
ایسکمی حاد قطع کامل و ناگهانی جریان خون شریانی به اندام یا بافت است. ایسکمی حاد باید به عنوان یک وضعیت پیش نکروز (پیش از انفارکتوس) در نظر گرفته شود. تشخیص آن در میوکارد پس از مرگ ناشی از بیماری ایسکمیک قلب از اهمیت ویژه ای برخوردار است.
ایسکمی مزمن - کاهش طولانی و تدریجی جریان خون شریانی منجر به ایجاد آتروفی سلول های پارانشیم و اسکلروز استرومایی در نتیجه افزایش فعالیت سنتز کلاژن فیبروبلاست ها می شود. به عنوان مثال، توسعه کاردیواسکلروز در بیماری ایسکمیک مزمن قلب.
بنابراین، نتیجه ایسکمی می تواند بازگشت به حالت عادی، آتروفی بافتی یا نکروز باشد.
پیامد و اهمیت ایسکمی متفاوت است و به شدت ایسکمی و مدت آن بستگی دارد. علاوه بر این، آنها به عوامل زیر بستگی دارند:
1. درجات توسعه وثیقه. در بافت هایی که شبکه جانبی عروق شریانی به خوبی توسعه یافته است، جریان خون در صورت مسدود شدن یک شریان به طور قابل توجهی کاهش نمی یابد، به عنوان مثال، هنگامی که شریان رادیال مسدود شده است، ایسکمی در دست مشاهده نمی شود، زیرا گردش خون جانبی در امتداد شریان اولنار وجود دارد. اختلال در گردش خون را جبران می کند. در بافت هایی که هیچ وثیعی ندارند، انسداد شاخه های انتهایی شریان های تامین کننده بافت منجر به قطع کامل جریان خون و انفارکتوس می شود، مثلاً با انسداد شریان مرکزی شبکیه یا وسط. شریان مغزی... اگر شدت گردش خون جانبی متوسط باشد، نتیجه انسداد شریان به عوامل دیگری بستگی دارد که در زیر توضیح داده شده است.
2. وضعیت شریان های جانبی. باریک شدن شریان های گردش خون باعث کاهش اثربخشی آن می شود. به عنوان مثال، هنگامی که شریان کاروتید داخلی در سنین جوانی مسدود می شود، جریان خون معمولاً با افزایش آن در رگ های جانبی دایره ویلیس جبران می شود. با این حال، در سنین بالا، با تنگ شدن آترواسکلروتیک این شریان های جانبی، ایسکمی مغزی اغلب زمانی رخ می دهد که یکی از شریان های کاروتید داخلی مسدود شود.
تغییرات ایسکمیک در بافت هایی که معمولاً گردش خون جانبی کافی در آنها وجود دارد (مثلاً در روده و اندام ها) اغلب در بیماران مسن به عنوان نتیجه مستقیم آترواسکلروز گسترده در سنین بالا ایجاد می شود.
3. اثربخشی عملکرد سیستم قلبی عروقی. برای توسعه جریان خون جانبی، کار موثر قلب و فشار خون بالا لازم است تا خون از طریق شریان های جانبی نسبتاً باریک جریان یابد.
4. میزان وقوع مانع. انسداد ناگهانی شریان باعث تغییرات ایسکمیک شدیدتر از انسداد تدریجی می شود زیرا زمان کمتری برای رشد عروق جانبی وجود دارد. به عنوان مثال، انسداد ناگهانی یک شریان کرونر در ابتدا طبیعی منجر به انفارکتوس میوکارد می شود. انسداد تدریجی بیشتر همان شریان باعث آسیب کمتر ایسکمیک به میوکارد می شود (تغییرات دژنراتیو و آتروفی کاردیومیوسیت ها، کاردیواسکلروز)، زیرا عروق جانبی زمان بیشتری برای رشد دارند.
5. حساسیت بافت به ایسکمی. بافت ها از نظر توانایی مقاومت در برابر ایسکمی متفاوت هستند. مغز بسیار حساس است و انفارکتوس در عرض چند دقیقه پس از انسداد شریان رخ می دهد. در مقابل، ماهیچههای اسکلتی، استخوانها و برخی بافتهای دیگر میتوانند چندین ساعت قبل از ایجاد اختلال در ایسکمی مقاومت کنند. این با ویژگی های متابولیسم تعیین می شود - غلبه گلیکولیز یا فسفوریلاسیون اکسیداتیو در بافت ها. جراحی فوری برای انسداد شانه یا شریان فمورالمی تواند از نکروز گسترده اندام جلوگیری کند.
6. سطح متابولیک بافت. خنک شدن (هیپوترمی) به دلیل کاهش کلی نیاز متابولیکی بافت ها، سرعت شروع آسیب ایسکمیک را کاهش می دهد. این پدیده در برخی از عمل های جراحی و هنگام انتقال اعضا برای پیوند استفاده می شود.
اختلالات عمومی گردش خون
اختلالات رایج گردش خون عبارتند از:
مجموعه شریانی عمومی؛
احتقان وریدی عمومی؛
کم خونی عمومی - حاد و مزمن؛
غلیظ شدن خون؛
رقیق شدگی خون؛
انعقاد داخل عروقی منتشر (انعقاد داخل عروقی منتشر).
فقط 2 نوع از اختلالات گردش خون عمومی را در نظر بگیرید - انعقاد داخل عروقی منتشر (DIC) و مجموعه وریدی عمومی.
سندرم یخ
سندرم DIC (سندرم انعقاد داخل عروقی منتشر، سندرم ترومبوهموراژیک، انعقاد مصرفی) یک فرآیند غیراختصاصی اکتسابی اختلال هموستاز است که در نتیجه فعال شدن بیش از حد پروترومبیناز و تشکیل ترومبین به دلیل ورود فعال کننده های انعقاد خون و انعقاد خون ایجاد می شود. وارد جریان خون
ویژگی های اصلی DIC عبارتند از:
تغییرات فاز در هموستاز به شکل هیپرانعقاد و به دنبال آن هیپوکواگولاسیون.
محاصره MCB با تجمع سلول های خونی و میکروترومبی.
سندرم هموراژیک
اتیولوژی انعقاد داخل عروقی منتشر.
سندرم DIC روند بسیاری از بیماری ها را پیچیده می کند فرآیندهای پاتولوژیک... بیشتر اوقات، با بیماری های زیر رخ می دهد:
عفونت ها، به ویژه عفونت های عمومی، از جمله سپسیس (30-50٪).
انواع شوک؛
همولیز و سیتولیز داخل عروقی حاد (با تزریق ناسازگار، کم خونی های همولیتیکو غیره.)؛
آسیب شناسی مامایی - جدا شدن زودرس جفت، آمبولی مایع آمنیوتیک، مرگ داخل رحمی جنین و غیره؛
تومورها، به ویژه لوسمی؛
سوختگی حرارتی و شیمیایی؛
بیماری های سیستم ایمنی و کمپلکس (روماتیسمی، گلومرولونفریت و غیره)
در دوران کودکی، سندرم DIC می تواند در ارتباط با بیماری ها و فرآیندهای پاتولوژیک زیر رخ دهد:
خفگی جنین و نوزاد؛
نارس بودن؛
Rhesus-komfikt;
عفونت ها، به ویژه آنهایی که در اثر فلور گرم منفی ایجاد می شوند.
عوامل درونزا و برونزا فعالسازی پلیسیستم هموستاز میتوانند بهعنوان علل فوری ایجاد DIC در این بیماریها و شرایط پاتولوژیک عمل کنند.
عوامل درون زا:
ترومبوپلاستین بافتی؛
محصولات پوسیدگی بافت ها و سلول های خونی؛
پروتئازهای لکوسیت؛
اندوتلیوم آسیب دیده
عوامل برون زا:
ریکتزیا؛
داروها و غیره
باکتری ها؛
پاتوژنز انعقاد داخل عروقی منتشر
توسعه سندرم DIC بر اساس مکانیسم های زیر است:
فعال سازی پلی سیستم هموستاز توسط عوامل درون زا و برون زا.
انعقاد خون داخل عروقی منتشر و تجمع سلول های خونی عمدتاً در MCB اندام ها و بافت های مختلف.
فعال سازی پلاسمین، کالیکرئین کینین و سیستم های مکمل.
انعقاد مصرفی - مصرف بخشی از فاکتورهای انعقادی و پلاکت ها و همچنین اجزای پلاسمین، کالیکرئین-کینین و سیستم های مکمل.
مسمومیت درون زا ثانویه با محصولات پروتئولیز و تخریب بافت.
ایجاد سندرم هموراژیک به دلیل اختلالات میکروسیرکولاسیون، مصرف فاکتورهای انعقاد خون، ترومبوسیتوپنی و ترومبوسیتوپاتی، تجمع محصولات پروتئولیز.
تغییرات دیستروفیک و نکروز در اندام ها و بافت های مختلف که عمدتاً در ارتباط با اختلالات همودینامیک و انسداد بستر عروقی توسط تجمعات سلول های خونی، میکروترومبی ها ایجاد می شود.
مکانیسم های نشان داده شده برای ایجاد سندرم DIC در یک رابطه علّی نزدیک است و جوهر مراحل سندرم را تشکیل می دهد که توسط آزمایشگاه و از نظر مورفولوژیکی بالینی تعیین می شود:
مرحله I - انعقاد بیش از حد و تجمع گلبول های خون.
مرحله دوم - انتقالی با افزایش مصرف انعقاد و ترومبوسیتوپنی.
مرحله III - کاهش انعقاد؛
مرحله IV - ترمیمی یا پیامدها و عوارض.
آناتومی پاتولوژیک سندرم یخ
تغییرات مورفولوژیکی در سندرم DIC شامل مجموعه ای کامل از علائم است که با تظاهرات بیماری زمینه ای در هم تنیده شده و توسط مکانیسم های تحریک کننده DIC، مدت زمان و اقدامات درمانی... در بین تمام علائم مورفولوژیکی، با توجه به درجه ارزش تشخیصی، مستقیم و مهر و موم متمایز می شوند.
بیشترین اهمیت را دارند نشانه های مستقیم- تشکیلات فیبرین با ساختار متنوع و شواهد مورفولوژیکی عینی فعال شدن و انعقاد خون هستند. در میان آنها موارد زیر متمایز می شوند:
الیاف مجزا و دستههای فیبرین، و همچنین الیاف فیبرین متقاطع سوزنی شکل ("prethrombi") که از فیبرین تثبیت نشده ساخته شدهاند.
پوشش با لایه ای از فیبرین دیواره رگ های خونی، که با آسیب قابل توجهی به دومی، عمدتا در مناطق لایه برداری اندوتلیوم رخ می دهد.
میکروترومبی ها که عمدتاً در ریز عروق موضعی هستند و بسته به مکانیسم های ایجاد DIC ظاهری متفاوت دارند:
میکروترومبی فیبرین ساخته شده از فیبرین تثبیت شده.
میکروترومب های هیالین که در طول توسعه سریع فرآیند ایجاد می شوند و از فیبرین ناپایدار و / یا گلبول های قرمز همولیز شده تشکیل شده اند.
میکروترومب های کروی بر اساس اختلالات گردش خون با تجمع گلبول های قرمز، همولیز بعدی و رسوب "سایه" پوشاننده گلبول های قرمز فیبرین ایجاد می شود.
پلاکت ها، لکوسیت ها، میکروترومب های ریتروسیتی که منعکس کننده مشارکت در تشکیل فیبرین سلول های خونی خاص هستند، عمدتاً از فیبرین ناپایدار ساخته شده اند.
میکروترومبی مخلوط از فیبرین تثبیت شده و ناپایدار.
همراه با میکروترومبی ها، تجمع گلبول های خون (گلبول های قرمز و پلاکت ها)، یک علامت مورفولوژیکی ثابت سندرم DIC، در ایجاد انسداد بستر عروقی اهمیت زیادی دارد.
علائم غیر مستقیمسندرم DIC نتیجه ایجاد محاصره بستر عروقی توسط تجمعات سلول های خونی، میکروترومبی ها و اختلالات همودینامیک - نکروز است. علائم غیر مستقیم نیز شامل سندرم هموراژیک است.
تصویر مورفولوژیکی مراحل انعقاد داخل عروقی منتشر.
مقایسه داده های بالینی و آزمایشگاهی و تغییرات مورفولوژیکی امکان تعیین تصویر مورفوژنیک توسعه انعقاد داخل عروقی منتشر را فراهم کرد.
مراحل I و II سندرم DIC با ظهور تغییرات زیر در پس زمینه ضایعات عروقی (تورم و پوسته پوسته شدن اندوتلیوم، اشباع پلاسما، تورم فیبرینوئید و نکروز فیبرینوئید) مشخص می شود:
تجمع پلاکت ها و گلبول های قرمز تا ایجاد پدیده لجن.
اختلالات همودینامیک همراه با اسپاسم شریانی و بای پس جریان خون؛
رشته ها و رشته های جداگانه فیبرین، "پرترومبوس"؛
میکروترومب های منفرد
انعقاد داخل عروقی منتشر مرحله III نیز عمدتاً با اختلالات میکروسیرکولاتوری به شکل تجمع و لجن گلبول های خون همراه با "اختلاط" پلاسما (طبقه بندی خون) در بخش وریدی-وریدی بستر عروقی، اسپاسم عروق شریانی و شانت کردن مشخص می شود. جریان خون. شدت تشکیل فیبرین در این مرحله به وضعیت دیواره های عروقی بستگی دارد. با این حال، در هر صورت، ساختارهای فیبرین داخل عروقی تعداد کمی هستند، اگرچه از نظر ترکیب متنوع هستند - "پیش ترومبی"، فیبرین، کروی، هیالین، مخلوط و سایر میکروترومب های "سنین" مختلف، پوشش فیبرین دیواره های عروقی، که منعکس کننده است. انواع مکانیسم های فعال سازی انعقاد خون و تداوم، موج روند.
علاوه بر این، در مرحله III، علائم سندرم هموراژیک ظاهر می شود، گاهی اوقات به صورت خونریزی های کانونی کوچک در غشاهای سروزی، غشاهای مخاطی، اندام های داخلی و کمتر در پوست ظاهر می شود.
بر اساس انسداد بستر عروقی توسط توده های گلبول های خونی، میکروترومبی ها، اختلالات همودینامیک در III و سپس در مرحله IV سندرم DIC، آسیب شناسی های مختلف اندام ایجاد می شود که اغلب موارد زیر است:
"ریه شوک"، نفروز نکروز تا تشکیل نکروز متقارن قشر کلیه، تغییرات دیستروفیک با نکروز کانونی کوچک منتشر میوکارد، کبد، پانکراس، غده هیپوفیز. آسیب شناسی اندام همچنین می تواند توسط سندرم هموراژیک ایجاد شود - خونریزی در غدد فوق کلیوی، خونریزی و فرسایش در دستگاه گوارش، مغز.
کامل بودن وریدهای عمومی
(هیپرمی یونیورسالیس ورید)
پرده وریدی عمومی یکی از شایع ترین انواع اختلالات گردش خون عمومی است و تظاهرات بالینی و مورفولوژیکی نارسایی قلبی یا ریوی است.
ماهیت پاتوفیزیولوژیک و پاتومورفولوژیک احتقان وریدی عمومی شامل توزیع مجدد حجم خون در گردش عمومی با تجمع آن در قسمت وریدی گردش خون سیستمیک (وریدهای توخالی و گاهی اوقات در رگ های ریه) و کاهش شریانی است. بخش
در مکانیسم ایجاد (یعنی در پاتوژنز) احتقان وریدی عمومی، سه عامل اصلی زیر نقش دارند:
1. نقض فعالیت قلبکه علل آن می تواند: نقص اکتسابی و مادرزادی قلبی باشد. بیماری های التهابی قلب - پریکاردیت، میوکاردیت، اندوکاردیت؛ کاردیواسکلروز با علل مختلف (آترواسکلروتیک، پس از انفارکتوس و غیره)؛ انفارکتوس میوکارد و غیره
2. بیماری های ریویهمراه با کاهش حجم گردش خون ریوی: آمفیزم ریوی. پنومونی مزمن غیر اختصاصی؛ پنوموسکلروز با علل مختلف؛ پنوموکونیوز (بیماری های ریوی گرد و غبار) و غیره
3. آسیب به قفسه سینه، جنب و دیافراگمهمراه با نقض عملکرد مکش قفسه سینه: پنوموتوراکس. تغییر شکل قفسه سینه و ستون فقرات.
احتقان وریدی عمومی می تواند در دوره بالینی حاد و مزمن باشد.
احتقان عمومی حاد وریدی تظاهر سندرم نارسایی حاد قلبی و هیپوکسی (خفگی) است. می تواند ناشی از انفارکتوس میوکارد باشد. میوکاردیت حاد؛ پلورزی اگزوداتیو حاد با تجمع بیش از حد پلورال افیوژن، فشرده سازی ریه ها. ایستادن زیاد دیافراگم (با پریتونیت)، محدود کردن تنفس. آمبولی ریه؛ پنوموتوراکس؛ انواع آسفیکسی
در نتیجه هیپوکسی، سد هیستوهماتوژن آسیب می بیند و نفوذپذیری مویرگی به شدت افزایش می یابد. در بافت ها استاز وریدی، اشباع پلاسما (پلاسموراژ)، ادم، استاز در مویرگ ها و خونریزی های دیاپدی متعدد مشاهده می شود. تغییرات دیستروفیک و نکروز در اندام های پارانشیمی ظاهر می شود. مشخص ترین تغییرات مورفولوژیکی در احتقان حاد وریدی در ریه ها و در کبد ایجاد می شود.
علت احتقان وریدی ریه ها نارسایی قلبی بطن چپ است. احتقان حاد وریدی باعث گشاد شدن مویرگ های آلوئولی می شود که با خارج شدن مایع به داخل آلوئول ها (ادم ریوی) همراه است. خونریزی داخل آلوئولار نیز ممکن است رخ دهد.
نارسایی قلب بطن راست باعث رکود در گردش خون سیستمیک می شود. در همان زمان، در کبد، گسترش وریدهای مرکزی کبد و رکود در سینوسوئیدها در قسمت مرکزی لوبول کبدی وجود دارد. این نواحی مرکزی قرمز راکد با بافت نرمال و کم رنگ تر در نواحی محیطی متناوب می شوند و الگوی عجیبی را ایجاد می کنند که یادآور جوز هندی است (به نام جوز هندی). در کبد، در ارتباط با ویژگی های معماری لوبول کبدی و گردش خون آن در توده حاد وریدی، خونریزی های مرکز لوبولار و نکروز ظاهر می شود.
توده وریدی عمومی مزمن در سندرم نارسایی قلبی مزمن (قلبی عروقی) یا ریوی ایجاد می شود. علل آن نقایص قلبی، بیماری ایسکمیک مزمن، میوکاردیت مزمن، کاردیومیوپاتی، آمفیزم ریوی، پنوموسکلروزیس با منشاء مختلف (اشکال سیروزی سل ریوی، ذات الریه مزمن، پنوموکونیوز)، انحنای ستون فقرات (قوز یا گیبوسیس در واریانت های مختلف) است. ، لوردوز)، آلودگی یا محو شدن حفره های پلور با چسبندگی با پلوریت چسبنده و غیره.
تظاهرات بالینی و مورفولوژیکی توده وریدی عمومی مزمن.
در طول معاینه خارجی بیمار، چه با توده وریدی عمومی حاد و چه مزمن، توجه به رنگ سیانوتیک پوست (سیانوز) جلب می شود، زیرا وریدهای پوست و بافت زیر جلدیبزرگ شده و پر از خون از طریق لایه شفاف اپیدرم، رنگ قرمز تیره خون وریدی رنگ مایل به آبی پیدا می کند. در انسان، بیشترین حجم خون در بافت زیر جلدی و سیاهرگ های اندام تحتانی رسوب می کند. پوست، به خصوص اندام تحتانی، سرد می شود، سیانوز یا سیانوز به وضوح روی صورت در ناحیه بینی، لاله گوش، لب ها و همچنین در دست ها و پاها قابل مشاهده است: در ناحیه ناخن. تخت، نوک انگشتان سیانوز قسمت های بیرون زده بدن آکروسیانوز نامیده می شود.
ادم بیان شده (ادم) درم و بافت زیر جلدی، به دلیل این که عروق لنفاوی نیز متسع و پر از لنف هستند. مایع ادماتیک ترانسودات (ترانسوداسیون - تراوش) نامیده می شود و حاوی مقدار کمی الکترولیت، کمتر از 2٪ پروتئین و سلول های خون و لنفاوی جدا شده است. در حفره های سروزی، تجمع بیش از حد مایع مشاهده می شود که به آن ادم حفره یا قطرات حفره ها می گویند. به افتادگی حفره شکم آسیت می گویند. افتادگی حفره های پلور - هیدروتوراکس، قطرات حفره پیراهن پریکارد - هیدروپریکارد. ادم بافت چربی زیر جلدی کل بدن در ترکیب با قطرات حفره ها را آنسارکا می نامند.
پرخونی شریانی اهمیت زیادی ندارد. پرخونی وریدی در افزایش پر شدن خون بافت بیان می شود، دشواری خروج خون مهم است، در حالی که جریان شریانی تغییر نمی کند یا اندکی کاهش می یابد.
پرخونی وریدی می تواند موضعی و عمومی باشد، اما پرخونی وریدی عمومی شایع تر است و اهمیت عملی دارد.
مشخصات میکروسکوپی: در بافت یک فرد زنده، کاهش جزئی دما (1-0.5 درجه سانتیگراد)، مقداری انبساط سیاهرگ ها و مویرگ ها وجود دارد و رنگ مایل به آبی (سیانوز) روی پوست ظاهر می شود.
با احتقان وریدی که به سرعت در حال توسعه است، ادم بافتی رخ می دهد، اما در همه بافت ها ایجاد نمی شود، بلکه در حفره ها و اندام هایی که فضایی برای قرار دادن مایع وجود دارد (در کلیه ها و کبد) ایجاد می شود. در عین حال، ادم ریوی، در جایی که فضای زیادی وجود دارد، از نظر ماکروسکوپی قابل توجه است.
ترانسودات (مایع ادماتوز) - با استاز وریدی، اغلب شفاف، رخ می دهد و بافت هایی که شسته می شود، بدون تغییر و رنگ طبیعی هستند.
اگزودا مایعی با منشاء پلاسمایی است که در هنگام التهاب ایجاد می شود. رنگ آن ابری، زرد مایل به خاکستری یا قرمز است. بافت های شسته شده با اگزودا رنگی کدر پیدا می کنند.
با افزایش آهسته پرخونی، بافت دچار سفت شدن قهوه ای می شود، زیرا در رکود مزمن، هنگامی که حجم خون در بستر وریدی افزایش می یابد، نفوذپذیری دیواره ها به مرور زمان افزایش می یابد که منجر به آزاد شدن مقدار کمی مایع می شود و کوچکترین عناصر شکل به بافت اطراف. در بافت های گلبول های قرمز، رنگدانه های مختلفی آزاد می شود: هموگلوبین و هموسیدرین.
القاء یک فشردگی است که در شرایط هیپوکسی مزمن رخ می دهد. هر بافتی از بدن که در شرایط گرسنگی اکسیژن قرار می گیرد، به طور فعال شروع به توسعه استرومای خود می کند، علاوه بر این، به دلیل بافت همبند. بزرگ شدن استروما یک واکنش تطبیقی است، زیرا مویرگ ها همراه با استروما به داخل بافت رشد می کنند که به جبران هیپوکسی کمک می کند، به عبارت دیگر، اسکلروز رخ می دهد.
تصویر میکروسکوپی: وریدهای گشاد شده و پر از خون. اگر احتقان وریدی حاد وجود داشته باشد، می توان مایع ادماتیک را تشخیص داد (حاوی پروتئین نیست، که با اگزودا که حاوی بیش از 1٪ پروتئین است متفاوت است). به دلیل وجود عناصر تشکیل شده در خون کدر است. در بافت ریه با سپتوم آلوئولی، که به طور معمول دارای "خصلت توری" است، در آسیب شناسی، شکاف بین آلوئول ها با بافت همبند پر می شود که تا حدودی رگ های خونی را فشار می دهد. همچنین یک رنگدانه قهوه ای - هموسیدرین وجود دارد که بخشی از آن در ماکروفاژها یافت می شود.
احتقان وریدی موضعی: معمولاً با انسداد یا بستن ورید اصلی همراه است. پرخونی وریدی عمومی 3 نوع اصلی دارد: رکود گردش خون ریوی، رکود گردش خون سیستمیک، رکود ورید باب. علل رکود در یک دایره کوچک: نارسایی بطن چپ، نقص میترال و آئورت، فشرده شدن مدیاستن وریدهای ریوی توسط تومور نادرترین علت است. در احتقان وریدی حاد دایره کوچک که از چند دقیقه تا چند ساعت ایجاد می شود، ادم ریوی ایجاد می شود. از نظر ماکروسکوپی: ریه ها فرو نمی ریزند، پس از فشار دادن با انگشت بر روی آنها، گودال های باز نشده باقی می مانند، هنگام برش، مقدار زیادی ترانسودات و خون سیاهرگی به بیرون جریان می یابد. تصویر میکروسکوپی: سپتوم آلوئولی ضخیم شده، رنگدانه قهوه ای تا حدی آزادانه در سپتوم قرار دارد، تا حدی در ماکروفاژها، وریدها با خون گشاد می شوند. علت مرگ: نارسایی قلبی و ریوی.
علل رکود در گردش خون سیستمیک: رکود وریدی در گردش خون ریوی، تغییرات اسکلروتیک منتشر در ریه ها، نارسایی بطن راست، فشرده سازی تومور تنه های سیاهرگ توخالی. با رکود به سرعت در حال توسعه، ادم ایجاد می شود (با پرخونی گردش خون سیستمیک - ادم پوست و بافت های نرم)، که آناسارکا نامیده می شود. در همان زمان، اندام ها افزایش می یابد، خطوط کلی بافت های نرم تغییر می کند، با فشار دادن روی آنها، حفره هایی باقی می مانند که صاف نمی شوند، یک الگوی وریدی قابل مشاهده است.
اشکال ادم: ادم شکم - آسیت، ادم حفره پلور- هیدروتوراکس، ادم حفره پریکارد - هیدروپریکارد و غیره. سیانوز با وریدهای واریسی همراه است و هر چه از قلب بافت دورتر باشد، بارزتر است.
"کبد جوز هندی" با بزرگ شدن کبد مشخص می شود: لبه پایینی از زیر قوس دنده ای با چندین انگشت گسترش می یابد، حساسیت در لمس مشاهده می شود. کبد بسیار بزرگتر از حد طبیعی است. برش یک الگوی جوز هندی مشخص را نشان می دهد. از نظر میکروسکوپی این واقعیت بیان می شود که در لوبول های کبدی تمام وریدهای اصلی گشاد شده و پر از خون هستند، تمام مویرگ هایی که در آنها جریان می یابد نیز پر از خون هستند و چربی در قسمت های محیطی لوبول ها به دلیل اختلالات متابولیک ظاهر می شود. علت مرگ نارسایی قلبی است.
رکود در سیستم ورید پورتال معمولاً به طور علّی با کبد مرتبط است: تغییرات اسکلروتیک منتشر رخ می دهد - سیروز، به ندرت سفتی راکد منجر به این واقعیت می شود که مویرگ ها در لوبول های کبدی توسط بافت همبند فشرده می شوند.
فشار خون پورتال شامل تعدادی تظاهرات بالینی است:
2) رگهای واریسیآناستوموز پورتوکاوال کبدی (وریدهای مری و معده، وریدهای راست روده، وریدهای دیواره قدامی شکم)؛
3) بزرگ شدن احتقانی طحال (سپلنومگالی) با سفتی بیشتر.
2. خونریزی
خونریزی عبارت است از آزاد شدن خون از حفره قلب و عروق خونی به محیط یا داخل حفره بدن. خونریزی نوعی خونریزی است که با تجمع خون در بافت ها مشخص می شود. خونریزی داخلی به داخل حفره امکان پذیر است (هموپریکاردیت، همارتروز، هماتورکس و غیره). بر اساس سن، خونریزی ها به قدیمی (در حضور هموسیدرین) و تازه تقسیم می شوند.
با توجه به نوع تغییرات بافتی، آنها متفاوت هستند:
1) خونریزی هایی مانند هماتوم - همیشه با تخریب بافت همراه است.
2) پتشی یا اکیموز - خونریزی های نقطه ای کوچک که روی پوست یا غشاهای مخاطی موضعی هستند.
3) انفیلتراسیون هموراژیک یا خیساندن. باعث تخریب بافت نمی شود؛
4) کبودی
مکانیسم های خونریزی: پارگی دیواره، جدا شدن دیواره و دیاپدزی گلبول قرمز. نتیجه: یک هماتوم در ماده مغز به کیست تبدیل می شود که حاوی محتویات سروزی است. V بافت های نرمهماتوم از بین می رود یا چرکی می شود.
3. ترومبوز
ترومبوز فرآیند انعقاد خون داخل حیاتی در مجرای رگ یا در حفره های قلب است. این دناتوره شدن غیرقابل برگشت پروتئین ها و سلول های خونی است.
1) تغییرات در دیواره عروقی با فرآیندهای التهابی، اسپاسم آنژیونورتیک، تصلب شرایین، با فشار خون(به جای انقباض و اتساع صحیح رگ وریدیباریک می شود و شکل خود را برای مدت طولانی به صورت اسپاسمیک حفظ می کند.
2) تغییر در سرعت و جهت جریان خون (با نارسایی قلبی). لخته های خونی که با ضعف شدید انقباضی و با افزایش نارسایی قلبی ظاهر می شوند، مارانث (راکد) نامیده می شوند. آنها می توانند در وریدهای محیطی رخ دهند.
3) تعدادی از دلایل مرتبط با تغییر در ترکیب شیمیایی خون: با افزایش پروتئین های درشت، فیبرینوژن، لیپیدها. چنین حالت هایی مشاهده می شود که تومورهای بدخیم، آترواسکلروز.
مکانیسم تشکیل ترومبوز شامل مراحل IV است:
I - مرحله آگلوتیناسیون پلاکتی؛
II - انعقاد فیبرینوژن، تشکیل فیبرین؛
III - آگلوتیناسیون گلبول های قرمز.
IV - رسوب - رسوب پروتئین های مختلف پلاسما به لخته.
از نظر ماکروسکوپی - تشخیص ترومبوز از لخته پس از مرگ ضروری است. ترومبوز ارتباط نزدیکی با دیوار دارد رگ خونی، و دسته، به عنوان یک قاعده، آزادانه دروغ می گوید. ترومبوس با سطحی کسل کننده و گاهی حتی زبر مشخص می شود، در حالی که لخته دارای سطحی صاف، براق و "آینه مانند" به نظر می رسد. ترومبوز قوام شکننده ای دارد و قوام لخته شبیه ژله است.
بسته به مکان و شرایطی که تحت آن تشکیل لخته خون رخ داده است، متفاوت است:
1) لخته های خون سفید (پلاکت ها، فیبرین ها، لکوسیت ها). این لخته های خون زمانی تشکیل می شوند که جریان خون سریع در شریان ها وجود داشته باشد.
2) لخته های خون قرمز (پلاکت ها، فیبرین ها، گلبول های قرمز) در شرایط جریان خون آهسته، اغلب در رگ ها رخ می دهد.
3) مختلط: محل اتصال سر نامیده می شود، بدن آزادانه در مجرای رگ قرار دارد. سر اغلب بر اساس اصل یک لخته خون سفید ساخته شده است، تناوب مناطق سفید و قرمز در بدن وجود دارد و دم معمولا قرمز است.
4) ترومب های هیالین - یک گزینه بسیار نادر (آنها از گلبول های قرمز تخریب شده، پلاکت ها، رسوب پروتئین تشکیل شده اند). این رسوب پروتئین است که شباهت به غضروف را ایجاد می کند. این لخته های خون در شریان ها و ونول ها تشکیل می شوند.
در رابطه با لومن رگ، ترومبوس ها متفاوت هستند:
1) انسداد (انسداد) یعنی مجرای رگ توسط جرم یک ترومبوس بسته می شود.
2) جداری
3) در حفره های قلب و در آنوریسم ها ترومب های کروی شکل وجود دارد.
1) متداول ترین سازماندهی است، یعنی جوانه زدن بافت همبند رخ می دهد.
2) تحجر - رسوب آهک؛
3) نرم شدن ثانویه (توافق) ترومبوز - به دو دلیل ایجاد می شود: آنزیمولیز میکروبی (زمانی که میکروب ها وارد ترومبوس می شوند) و آنزیمولیز موضعی که به دلیل آنزیم های خود که در صورت آسیب آزاد می شوند ایجاد می شود.
4. آمبولی
آمبولی انتقال ذرات توسط خون است که به طور معمول در آن مشاهده نمی شود.
سه جهت مرکزی حرکت آمبولی در گردش خون وجود دارد:
1) از قلب چپ به سیستم شریانی؛
2) از وریدهای گردش خون سیستمیک از طریق قلب راستبه تنه ریوی؛
3) از طریق ورید باب.
7 نوع آمبولی وجود دارد.
1. ترومبوآمبولی: علت جدا شدن ترومبوز نرم شدن آن است اما می تواند از محل چسبندگی نیز جدا شود.
2. آمبولی بافتی (سلولی) در تومورهای بدخیم مشاهده می شود، زمانی که سلول های سرطانی یا سارکوم در جریان خون رشد می کنند، سلول ها از تومور جدا می شوند و همراه با جریان خون به گردش در می آیند. هنگامی که در شاخه های دوردست اندام های داخلی گیر می کنند، باعث آمبولی تومور می شوند. این گره های تومور دور در ارتباط با تومور مادری متاستاز هستند و خود این فرآیند متاستاز نامیده می شود. در سرطان معده، متاستاز از طریق سیاهرگ باب به کبد رخ می دهد.
3. آمبولی میکروبی با التهاب چرکی ایجاد می شود. چرک با کمک آنزیم های خود بافت های اطراف از جمله رگ های خونی را ذوب می کند، میکروب ها می توانند از طریق رگ ذوب شده به داخل خون نفوذ کرده و در سراسر بدن گردش کنند. هرچه آبسه بزرگتر باشد، احتمال ورود میکروب ها به جریان خون بیشتر می شود. وضعیتی که در این مورد مشاهده می شود، سپسیس نامیده می شود.
4. آمبولی چربی در شکستگی های بزرگ استخوان های لوله ای با رقیق شدن ایجاد می شود. قطرات چربی (از مغز استخوان) وارد سیاهرگ ها می شود و مویرگ های ریه را از بین می برد.
5. آمبولی هوا زمانی رخ می دهد که وریدهای بزرگ زخمی شوند.
6. آمبولی گاز در بیماری رفع فشار رخ می دهد (به عنوان مثال، افزایش شدید غواصان وجود دارد) - ترکیب گاز خون تغییر می کند، حباب های نیتروژن به طور خود به خود در آن ظاهر می شوند (با فشار بالا- به عنوان یک قاعده، در طول غواصی - نیتروژن به میزان بیشتری در خون تبدیل می شود و در هنگام صعود، نیتروژن زمان خروج از خون را ندارد).
7. آمبولی اجسام خارجی- هنگامی که گلوله ها و قطعات بر خلاف جریان خون تحت تأثیر جاذبه (عقب نشین) یا از طریق جریان خون حرکت می کنند.
5. حمله قلبی
حمله قلبی یک نکروز ناشی از قطع خون رسانی به بافت است. رنگ حملات قلبی سفید، قرمز و سفید با لبه قرمز است. در شکل، که با نوع گردش خون مرتبط است، نامنظم و مخروطی (در کلیه ها، ریه ها) وجود دارد. قوام آن می تواند خشک یا مرطوب باشد.
مراحل توسعه حمله قلبی.
1. مرحله ایسکمیک تصویر ماکروسکوپی ندارد و معمولا چندین ساعت (تا 10-8 ساعت) طول می کشد. از نظر میکروسکوپی: ناپدید شدن گلیکوژن و آنزیم های مهم در سلول ها.
2. مرحله نکروز - انفارکتوس ماکرو و میکروسکوپی بیان مشخصه ای دارد. مدت زمان مرحله تا یک روز می باشد.
3. مرحله نتیجه - اغلب با سازمان خاتمه می یابد. در مغز، یک حفره تشکیل می شود - یک کیست، در قلب و سایر اندام ها سازماندهی و تشکیل یک اسکار است. این یک هفته یا بیشتر طول می کشد.
استاز توقف جریان خون در عروق میکروواسکولار است که منجر به همولیز و انعقاد خون می شود. دلیل آن اختلالات دیسیرکولاتوری است که می تواند با عملکرد عوامل فیزیکی و شیمیایی مرتبط باشد - در بیماری های عفونی، عفونی-آلرژیک و خود ایمنی، در بیماری های قلب و عروق خونی. استاز برگشت پذیر و غیر قابل برگشت است (که منجر به نکروز می شود).