راهنمای مطالعه: پاتوژنز نکروز. انواع مورفولوژیکی اصلی نکروز.
نکروز (از یونانی. نکروز- مرده) - نکروز، مرگ سلول ها و بافت ها در یک موجود زنده تحت تأثیر عوامل ایجاد کننده بیماری. این نوع مرگ سلولی از نظر ژنتیکی کنترل نمی شود.
عوامل ایجاد کننده نکروز:
ü فیزیکی ( زخم گلوله، تشعشع، برق، دمای پایین و بالا - سرمازدگی و سوختگی)؛
ü سمی (اسیدها، قلیاها، نمکهای فلزات سنگین، آنزیمها، داروها، الکل اتیلیک و غیره)؛
ü بیولوژیکی (باکتری ها، ویروس ها، تک یاخته ها و غیره)؛
ü آلرژیک (آندوآنتی ژن ها و اگزوآنتیژن ها، به عنوان مثال، نکروز فیبرینوئید در بیماری های عفونی-آلرژیک و خود ایمنی، پدیده آرتوس)؛
ü عروقی (حمله قلبی - نکروز عروقی)؛
ü تروفونورتیک (زخم بستر، زخم های غیر التیام بخش).
بسته به مکانیسم اثر عامل بیماری زا، موارد زیر وجود دارد:
- نکروز مستقیم به دلیل اثر مستقیم عامل (نکروز تروماتیک، سمی و بیولوژیکی).
- نکروز غیرمستقیم که به طور غیر مستقیم از طریق سیستم عروقی و عصبی غدد درون ریز (نکروز آلرژیک، عروقی و تروفونورتیک) رخ می دهد.
علائم مورفولوژیکی نکروز
قبل از نکروز یک دوره نکروبیوز وجود دارد که بستر مورفولوژیکی آن تغییرات دیستروفیک است.
کرنل تغییر می کند.
کروماتین سلول مرده به صورت توده های بزرگ متراکم می شود. حجم هسته کاهش می یابد، چروکیده، متراکم، به شدت بازوفیل می شود، یعنی به رنگ آبی تیره با هماتوکسیلین رنگ آمیزی می شود. این فرآیند نامیده می شود کاریوپیکنوزیس(چروک شدن). سپس هسته پیکنوز می تواند به ذرات بازوفیلیک متعددی پاره شود (کاریورکسیس)یا در نتیجه عمل لیزوزومی دئوکسی ریبونوکلئاز دچار لیز (انحلال) شوند. (کاریولیز).سپس حجم آن افزایش می یابد، با هماتوکسیلین ضعیف می شود، خطوط هسته به تدریج از بین می رود. با نکروز به سرعت در حال توسعه، هسته بدون مرحله pyknotic لیز می شود.
تغییرات سیتوپلاسمی
- سیتوپلاسم سلول در نتیجه انعقاد پروتئین های سیتوپلاسمی و تخریب (ناپدید شدن) ریبوزوم ها یکنواخت و اسیدوفیل می شود.
- تورم میتوکندری و تخریب (تخریب) غشای اندامک ها باعث واکوئل شدن سیتوپلاسم می شود.
- هضم یک سلول با آنزیم هایی که از لیزوزوم های خود آزاد می شود باعث لیز سلولی (اتولیز) می شود.
بنابراین، انعقاد پروتئین ها در سیتوپلاسم اتفاق می افتد و معمولاً به دنبال آن برخورد می شود.
تغییرات در ماده بین سلولیهم ماده بینابینی و هم ساختارهای فیبری را پوشش می دهد. اغلب، تغییرات مشخصه نکروز فیبرینوئید ایجاد می شود: الیاف کلاژن، الاستیک و رتیکولین به توده های صورتی متراکم، همگن، گاهی اوقات بازوفیل تبدیل می شوند که می توانند دچار تکه تکه شدن، تجزیه توده ای یا لیز شوند. در موارد کمتر، ممکن است ادم، لیز و مخاط ساختارهای فیبری وجود داشته باشد که مشخصه نکروز برخوردی است.
اشکال بالینی و مورفولوژیکی نکروز
بین نکروز انعقادی (خشک) و نکروز برخوردی (تر) تمایز قائل شوید.
الف- نکروز انعقادی (خشک).
نکروز انعقادی معمولاً در اندامهای غنی از پروتئین و مایعات فقیر رخ میدهد، مثلاً در کلیهها، میوکارد، غدد فوق کلیوی، طحال، معمولاً در نتیجه گردش خون ناکافی و بیاکسی، اثر عوامل فیزیکی، شیمیایی و سایر عوامل مخرب، به عنوان مثال، نکروز انعقادی سلول های کبدی در آسیب ویروسی یا تحت تأثیر عوامل سمی پیدایش باکتریایی و غیر باکتریایی. نکروز انعقادی خشک نیز نامیده می شود، زیرا با این واقعیت مشخص می شود که نواحی مرده حاصل خشک، متراکم، فرو ریخته، سفید یا زرد هستند.
نکروز انعقادی شامل:
حمله قلبی- نوعی نکروز عروقی (ایسکمیک) اندام های داخلی (به جز مغز). این شایع ترین نوع نکروز است.
حمله قلبی (از لات. انفارسیته- پر کردن، پر کردن) ناحیه مرده یک اندام یا بافت است که در نتیجه قطع ناگهانی جریان خون (ایسکمی) از گردش خون خارج شده است. حمله قلبی نوعی انعقاد عروقی (ایسکمیک) یا نکروز برخوردی... این شایع ترین نوع نکروز است.
هم سلول های پارانشیمی و هم بافت بینابینی دچار نکروز می شوند. اغلب، حمله قلبی با ترومبوز یا آمبولی، اسپاسم، فشرده سازی عروق شریانی رخ می دهد. به ندرت، نقض خروج وریدی می تواند علت حمله قلبی باشد.
دلایل ایجاد حمله قلبی:
- ایسکمی حادناشی از اسپاسم طولانی مدت، ترومبوز یا آمبولی، فشرده سازی شریان.
- تنش عملکردی یک اندام در شرایط کمبود خون. اهمیت زیادی برای وقوع حمله قلبی، نارسایی آناستوموزها و عوامل جانبی است که به میزان آسیب دیواره عروق و تنگ شدن مجرای آنها (آترواسکلروز، اندارتریت محو کننده)، به میزان اختلالات گردش خون بستگی دارد. (به عنوان مثال، استاز وریدی) و در سطح بسته شدن شریانی توسط ترومبوس یا آمبولی.
بنابراین، حملات قلبی معمولا با آن دسته از بیماری ها رخ می دهد که با تغییرات شدید در دیواره رگ ها و اختلالات گردش خون عمومی مشخص می شود. آی تی:
- بیماری های روماتیسمی؛
- نقص قلبی؛
- آترواسکلروز؛
- بیماری هایپرتونیک؛
- اندوکاردیت باکتریایی (عفونی).
مورفولوژی حملات قلبی
تصویر ماکروسکوپی از حملات قلبی. شکل، اندازه، رنگ و قوام حمله قلبی ممکن است متفاوت باشد.
شکل حمله قلبی.معمولا حملات قلبی گوه ای شکل هستند. در این حالت، قسمت نوک تیز گوه رو به دروازه اندام است و قسمت وسیعتر به سمت اطراف میرود، مثلاً زیر کپسول اندام، زیر صفاق (سکتههای طحال)، زیر پلور (سکتههای ریوی). )، و غیره. شکل مشخصهحملات قلبی در کلیه ها، طحال، ریه ها بر اساس ماهیت آنژیو آرشیتکتونیکی این اندام ها تعیین می شود - نوع اصلی (دوگانه متقارن) انشعاب شریان ها. کمتر دچار حملات قلبی می شوند شکل نامنظم... چنین انفارکتوس هایی در قلب، مغز، روده ها مشاهده می شود، زیرا در این اندام ها نه نوع اصلی، بلکه شل یا مختلط انشعاب شریانی غالب است.
بزرگی حملات قلبی.حمله قلبی می تواند بیشتر یا تمام یک اندام را بپوشاند (انفارکتوس جزئی یا کلی) یا فقط در زیر میکروسکوپ تشخیص داده شود (ریزانفارکتوس).
رنگ و قوام حملات قلبی.اگر حمله قلبی بر اساس نوع ایجاد شود نکروز انعقادیسپس بافت در ناحیه نکروز متراکم تر می شود، به رنگ خشک، سفید متمایل به زرد می شود (سکته قلبی، کلیه، طحال). اگر حمله قلبی به صورت نکروز برخوردی ایجاد شود، بافت مرده نرم و مایع می شود (سکته مغزی یا کانون نرم شدن خاکستری).
بسته به مکانیسم توسعه و ظاهر، آنها متمایز می شوند:
- حمله قلبی سفید (ایسکمیک)؛
- حمله قلبی قرمز (هموراژیک)؛
- حمله قلبی سفید با تاج هموراژیک.
انفارکتوس سفید (ایسکمیک) در نتیجه توقف کامل جریان رخ می دهد خون شریانیدر اندام ها، به عنوان مثال، در قلب، کلیه ها، طحال، مغز بالای دایره ویلیس. معمولاً در مناطقی با یک سیستم جریان خون (نوع اصلی انشعاب شریانی) رخ می دهد که در آن گردش خون جانبی ضعیف است. به دلیل خروج وریدی بدون مزاحمت از بافت ایسکمیک و به دلیل اسپاسم قسمت انتهایی شریان ها پس از قطع جریان خون، این حملات قلبی رنگ پریدگی دارند. انفارکتوس سفید (ایسکمیک) ناحیه ای است که به وضوح از بافت های اطراف محدود شده است، به رنگ سفید مایل به زرد، بدون ساختار.
یک انفارکتوس سفید با یک تاج هموراژیک با یک ناحیه سفید مایل به زرد نشان داده می شود، اما این ناحیه توسط یک منطقه خونریزی احاطه شده است. در نتیجه این واقعیت ایجاد می شود که وازواسپاسم در امتداد حاشیه انفارکتوس با گسترش پارتیک آنها و ایجاد خونریزی جایگزین می شود. چنین حمله قلبی می تواند در کلیه ها، میوکارد رخ دهد.
انفارکتوس قرمز (هموراژیک) با این واقعیت مشخص می شود که ناحیه نکروز از خون اشباع شده است، قرمز تیره و به خوبی مشخص شده است. حمله قلبی به دلیل آزاد شدن خون از عروق نکروزه عروق ریز در ناحیه انفارکتوس قرمز می شود. برای ایجاد یک حمله قلبی قرمز، ویژگی های آنژیوآرشیتکتونیک اندام مهم است - دو یا چند سیستم جریان خون، ایجاد وثیقه: در ریه ها - وجود آناستوموز بین شریان های برونش و ریوی، در روده - فراوانی آناستوموزها بین شاخه های شریان های مزانتریک، در مغز در ناحیه دایره ویلیسین آناستوموزها بین شاخه های شریان های کاروتید داخلی و بازیلار. انفارکتوس قرمز همچنین می تواند در بافت زمانی رخ دهد که یک ترومب انسدادی حل شود یا تکه تکه شود (پوسیدگی)، که جریان خون شریانی را در ناحیه انفارکتوس بازیابی می کند.
انفارکتوس هموراژیک در کلیه و قلب نادر است. یک پیش نیاز برای چنین خیساندن خونریزی، احتقان وریدی است.
انفارکتوس وریدی زمانی اتفاق می افتد که کل سیستم تخلیه وریدی بافت مسدود شده باشد (به عنوان مثال، ترومبوز سینوس ساژیتال فوقانی، ترومبوز ورید کلیوی، ترومبوز ورید مزانتریک فوقانی). در این حالت، ادم شدید، احتقان، خونریزی و افزایش تدریجی فشار هیدرواستاتیک در بافت ها رخ می دهد. با افزایش شدید فشار هیدرواستاتیک، جریان خون شریانی به بافت دشوار می شود که منجر به ایسکمی و حمله قلبی می شود. انفارکتوس وریدی همیشه خونریزی دهنده است.
از نظر میکروسکوپی، ناحیه مرده با از بین رفتن ساختار، خطوط سلولی و ناپدید شدن هسته ها مشخص می شود.
بهترین اهمیت بالینیحملات قلبی (میوکارد)، مغز، روده، ریه، کلیه، طحال.
در دلحمله قلبی معمولاً سفید با یک کرولا هموراژیک است، شکل نامنظمی دارد، بیشتر در بطن چپ و سپتوم بین بطنی رخ می دهد، بسیار به ندرت - در بطن راست و دهلیز. مرگ می تواند در زیر اندوکارد (انفارکتوس زیر قلب)، اپی کارد (انفارکتوس زیر قلب)، در ضخامت میوکارد (اینترامورال)، یا کل ضخامت میوکارد را پوشش دهد. سکته مغزی). در ناحیه انفارکتوس، روکش های ترومبوتیک اغلب روی اندوکارد و روکش های فیبرینی روی پریکارد تشکیل می شود که با ایجاد التهاب واکنشی در اطراف محل های نکروز همراه است. اغلب، انفارکتوس میوکارد در پس زمینه آترواسکلروز و فشار خونبا اضافه شدن اسپاسم یا ترومبوز شریان ها، که شکل حاد بیماری عروق کرونر قلب است.
در مغزبالای دایره ویلیس، یک حمله قلبی سفید رخ می دهد که به سرعت نرم می شود (مرکز نرم شدن خاکستری مغز). اگر حمله قلبی در پس زمینه اختلالات قابل توجه گردش خون، رکود وریدی ایجاد شود، کانون نکروز مغز با خون اشباع شده و قرمز می شود (تمرکز نرم شدن قرمز مغز). در ناحیه ساقه مغز، زیر دایره ویلیس، حمله قلبی قرمز نیز ایجاد می شود. حمله قلبی معمولاً در گره های زیر قشری موضعی می شود و مسیرهای مغز را از بین می برد که با فلج ظاهر می شود. انفارکتوس مغزی، مانند انفارکتوس میوکارد، اغلب در پس زمینه آترواسکلروز و فشار خون بالا رخ می دهد و یکی از تظاهرات بیماری های عروق مغزی است.
در ریه هادر اکثریت قریب به اتفاق موارد، انفارکتوس هموراژیک تشکیل می شود. علت آن اغلب ترومبوآمبولی است، کمتر - ترومبوز همراه با واسکولیت. محل انفارکتوس به خوبی مشخص شده است، شکل مخروطی دارد که قاعده آن به سمت پلور است. پوشش های فیبرین (جنب واکنشی) روی پلور در ناحیه انفارکتوس ظاهر می شود. در نوک مخروط رو به رو ریشه ریه، اغلب ترومبوس یا آمبولی در شاخه یافت می شود شریان ریوی... بافت مرده متراکم، دانهدار و به رنگ قرمز تیره است. انفارکتوس ریوی هموراژیک معمولاً در پس زمینه استاز وریدی رخ می دهد و توسعه آن تا حد زیادی با ویژگی های آنژیوآرشکتتونیک ریه ها ، وجود آناستوموز بین سیستم شریان های ریوی و برونش تعیین می شود. در شرایط پر احتقانی و بسته شدن مجرای شاخه شریان ریوی، خون از شریان برونش وارد ناحیه نکروز بافت ریه می شود که مویرگ ها را پاره می کند و به مجرای آلوئول ها می ریزد. التهاب بافت ریه (پنومونی حوالی انفارکتوس) اغلب حول یک حمله قلبی ایجاد می شود. انفارکتوس هموراژیک شدید ریه می تواند باعث زردی فوق کبدی شود. حملات قلبی سفید در ریه ها بسیار نادر است. این بیماری با اسکلروز و از بین رفتن لومن شریان های برونش رخ می دهد.
در کلیه هاانفارکتوس، به عنوان یک قاعده، سفید با یک تاج هموراژیک است، ناحیه مخروطی شکل نکروز یا ماده قشر یا کل ضخامت پارانشیم را می پوشاند. هنگامی که تنه شریانی اصلی بسته می شود، انفارکتوس کلی یا ساب کل ایجاد می شود. نکروز متقارن قشر کلیه که منجر به ایجاد نارسایی حاد کلیه می شود، نوعی حمله قلبی است. ایجاد انفارکتوس ایسکمیک کلیه معمولاً با ترومبوآمبولی همراه است، کمتر با ترومبوز شاخه های شریان کلیوی در روماتیسم، اندوکاردیت باکتریایی، فشار خون بالا، بیماری عروق کرونر قلب. به ندرت، با ترومبوز سیاهرگ کلیوی، انفارکتوس وریدی کلیه رخ می دهد.
در طحالانفارکتوس های سفید، اغلب با التهاب فیبرینی واکنشی کپسول و تشکیل چسبندگی های بعدی با دیافراگم، برگ جداری صفاق، و حلقه های روده وجود دارد. انفارکتوس ایسکمیک طحال با ترومبوز و آمبولی همراه است. با ترومبوز ورید طحال، گاهی اوقات، بسیار نادر، انفارکتوس وریدی تشکیل می شود.
در روده هاحملات قلبی خونریزی دهنده و همیشه تحت تجزیه سپتیک است که منجر به سوراخ شدن دیواره روده و ایجاد پریتونیت می شود. علت، اغلب، ولولوس، انواژیناسیون روده، فتق خفه شده، کمتر - آترواسکلروز با افزودن ترومبوز است.
نکروز کیسی (پنیردار).با سل، سیفلیس، جذام و همچنین با لنفوگرانولوماتوز ایجاد می شود. به آن اختصاصی نیز می گویند، زیرا اغلب با گرانولوم های عفونی خاص یافت می شود. که در اعضای داخلییک ناحیه محدود خشک و متلاشی از یک بافت زرد مایل به سفید آشکار می شود. در گرانولوم های سیفلیس، اغلب چنین مناطقی فرو ریخته نیستند، بلکه خمیری هستند و یادآور چسب عربی هستند. این یک نوع مختلط (یعنی خارج و داخل سلولی) نکروز است که در آن پارانشیم و استروما (هر دو سلول و فیبرها) به طور همزمان می میرند. از نظر میکروسکوپی، چنین محل بافتی بدون ساختار، همگن، رنگ آمیزی شده با هماتوکسیلین و ائوزین به رنگ صورتی به نظر می رسد، توده های کروماتین هسته ای (کاریورکسیس) به وضوح قابل مشاهده هستند.
نکروز مومی یا زنکری(نکروز عضلانی، اغلب دیواره قدامی شکم و ران، با عفونت های شدید - حصبه و تیفوس، وبا).
نکروز فیبرینوئید- نوع نکروز بافت همبند. در بیماری های آلرژیک و خودایمنی (به عنوان مثال، روماتیسم، روماتیسم مفصلیو لوپوس اریتماتوز سیستمیک). فیبرهای کلاژن و ماهیچه های صاف لایه میانی رگ های خونی آسیب دیده اند. نکروز فیبرینوئیدی شریان ها در فشار خون بدخیم مشاهده می شود. این نکروز با از دست دادن ساختار طبیعی الیاف کلاژن و تجمع مواد نکروزه همگن و صورتی روشن که از نظر میکروسکوپی شبیه فیبرین است مشخص می شود.
نکروز چربی
نکروز چربی آنزیمی:نکروز چربی اغلب در پانکراتیت حاد و آسیب به پانکراس رخ می دهد، زمانی که آنزیم های پانکراس از مجاری به بافت اطراف آزاد می شوند. در همان زمان، پلاکها و گرههای مات و سفید (مانند گچ) (استاتونکروز) در بافت چربی اطراف پانکراس ظاهر میشوند.
نکروز چربی غیر آنزیمی:نکروز چربی غیر آنزیمی در غده پستانی، بافت چربی زیر جلدی و در حفره شکمی... اکثر بیماران سابقه تروما دارند. نکروز چربی غیر آنزیمی باعث ایجاد یک پاسخ التهابی می شود که با حضور ماکروفاژهای متعدد با سیتوپلاسم کف آلود، نوتروفیل ها و لنفوسیت ها مشخص می شود. به دنبال آن فیبروز ایجاد می شود و تشخیص این فرآیند از تومور دشوار است.
قانقاریا(از یونانی. گانگرانا- آتش): این نکروز بافتی است که با محیط خارجی ارتباط برقرار می کند و تحت تأثیر آن تغییر می کند. بین خشک، مرطوب، گانگرن گازی و زخم بستر تمایز قائل شوید.
گانگرن خشک- این نکروز بافت ها در تماس با محیط خارجی است که بدون مشارکت میکروارگانیسم ها انجام می شود. قانقاریا خشک اغلب در اندام ها در نتیجه نکروز بافت انعقادی ایسکمیک رخ می دهد. بافت های نکروزه سیاه، خشک به نظر می رسند و به وضوح از بافت زنده مجاور جدا می شوند. در مرز با بافت های سالم، التهاب مرزی رخ می دهد. تغییر رنگ به دلیل تبدیل رنگدانه های هموگلوبینوژن در حضور سولفید هیدروژن به سولفید آهن است. به عنوان مثال می توان به قانقاریای خشک اشاره کرد:
- اندام های مبتلا به آترواسکلروز و ترومبوز شریان های آن (گانگرن آترواسکلروتیک)، از بین بردن اندارتریت؛
- با سرمازدگی یا سوختگی؛
- انگشتان مبتلا به بیماری رینود یا بیماری ارتعاش؛
- پوست مبتلا به تیفوس و سایر عفونت ها.
قانقاریا مرطوب:در نتیجه لایه بندی روی تغییرات بافت نکروز یک عفونت شدید باکتریایی ایجاد می شود. تحت تأثیر آنزیم های میکروارگانیسم ها، برخورد ثانویه رخ می دهد. قانقاریای مرطوب معمولاً در بافت های غنی از رطوبت ایجاد می شود. این می تواند در اندام ها رخ دهد، اما اغلب در اندام های داخلی، به عنوان مثال، در روده ها با انسداد شریان های مزانتریک (ترومبوز، آمبولی)، در ریه ها به عنوان یک عارضه ذات الریه (آنفولانزا، سرخک). ضعیف شده بیماری عفونی(اغلب سرخک) کودکان ممکن است دچار قانقاریای مرطوب بافت نرم گونه ها، پرینه شوند که به آن نوما (از نام یونانی - سرطان آب) می گویند.
زخم بستر (دکوبیتوس):به عنوان یک نوع قانقاریا، زخم بستر جدا می شود - نکروز بافتی (پوست، بافت نرم) تحت فشار طولانی مدت. زخم های فشاری اغلب در ناحیه ساکروم، فرآیندهای خاردار مهره ها، تروکانتر بزرگ ظاهر می شوند. استخوان ران(در بیماران بستری). در پیدایش آن، نکروز تروفونورتیک است، زیرا عروق و اعصاب فشرده می شوند، که باعث تشدید اختلالات تروفیسم بافتی در بیماران شدیداً بیمار می شود که از بیماری های قلبی عروقی، انکولوژیک، عفونی یا عصبی رنج می برند.
ب. نکروز برخوردی (مرطوب).
با ادغام بافت مرده مشخص می شود. در بافت هایی که از نظر پروتئین نسبتاً فقیر و غنی از مایع هستند، که در آن شرایط مطلوب برای فرآیندهای هیدرولیتیک وجود دارد، ایجاد می شود. لیز سلولی در نتیجه عمل آنزیم های خود (اتولیز) اتفاق می افتد. یک مثال معمولی از نکروز برخورد مرطوب تمرکز نرم شدن خاکستری است ( انفارکتوس ایسکمیک) مغز.
نتیجه نکروز
پیامدهای مطلوب نکروز:
- لیز
- سازمان، در محل نکروز در چنین مواردی، یک اسکار تشکیل می شود (اسکار در محل حمله قلبی).
- کپسوله سازی؛
- تحجر؛
- استخوان سازی
- تشکیل کیست
پیامدهای نامطلوب نکروز:
- ادغام چرکی (عفونی) کانون نکروز؛
- جداسازی تشکیل یک قطعه از بافت مرده است که تحت اتولیز و سازماندهی قرار نمی گیرد. سکته معمولاً در استخوان هایی با التهاب مغز استخوان - استئومیلیت - رخ می دهد. یک کپسول متوالی و یک حفره پر از چرک در اطراف چنین جداسازی تشکیل می شود.
- جهش - رد بافت نکروز.
آپوپتوز یا مرگ برنامه ریزی شده سلولی فرآیندی است که طی آن عوامل داخلی یا خارجی با فعال کردن یک برنامه ژنتیکی منجر به مرگ سلولی و حذف موثر آن از بافت می شود. از نظر مورفولوژیکی، آپوپتوز با مرگ سلولهای منفرد و بهطور تصادفی آشکار میشود، که همراه با تشکیل بدنهای گرد و احاطهشده با غشاء ("جسم آپوپتوز")، که بلافاصله توسط سلولهای اطراف فاگوسیت میشوند.
این یک فرآیند فرار است که در آن سلول های ناخواسته و معیوب از بدن خارج می شوند. نقش مهمی در مورفوژنز دارد و مکانیزمی برای کنترل دائمی اندازه اندام ها است. با کاهش آپوپتوز، تجمع سلول ها رخ می دهد، به عنوان مثال، رشد تومور. با افزایش آپوپتوز، کاهش تدریجی تعداد سلول ها در بافت مشاهده می شود، به عنوان مثال، آتروفی.
تظاهرات مورفولوژیکی آپوپتوز
سلول های آپوپتوز به صورت خوشه های گرد یا بیضی شکل سیتوپلاسم به شدت ائوزینوفیلیک با قطعات متراکم کروماتین هسته ای ظاهر می شوند. از آنجایی که فشرده سازی سلول و تشکیل اجسام آپوپتوز به سرعت اتفاق می افتد و همچنین به سرعت فاگوسیتوز، متلاشی یا به مجرای اندام پرتاب می شوند، بنابراین در آماده سازی های بافت شناسی در موارد شدت قابل توجه آن یافت می شود. علاوه بر این، آپوپتوز - بر خلاف نکروز - هرگز با یک واکنش التهابی همراه نیست، که همچنین شناسایی بافتی آن را پیچیده می کند.
ویژگی های مقایسه ای نکروز و آپوپتوز
|
القاء |
توسط محرک های فیزیولوژیکی یا پاتولوژیک فعال می شود |
بسته به عامل آسیب رسان متفاوت است |
|
شیوع |
قفس تک |
گروهی از سلول ها |
|
تغییرات بیوشیمیایی |
قطعه قطعه شدن DNA فرار توسط اندونوکلئازهای درون زا. |
اختلال یا خاتمه تبادل یونی. |
|
پوسیدگی DNA |
تراکم داخل هسته ای با تقسیم شدن به قطعات |
محلی سازی منتشر در یک سلول نکروزه |
|
یکپارچگی غشای سلولی |
ذخیره |
نقض شده است |
|
مرفولوژی |
انقباض و تکه تکه شدن سلول برای تشکیل اجسام آپوپتوز با کروماتین فشرده |
تورم و لیز سلول ها |
|
واکنش التهابی |
معمولا وجود دارد |
|
|
حذف سلول های مرده |
جذب (فاگوسیتوز) توسط سلول های همسایه |
فاگوسیتوز توسط نوتروفیل ها و ماکروفاژها |
برنج. 1. توالی تغییرات فراساختاری در طول آپوپتوز (راست) و نکروز (چپ)
1 - سلول طبیعی؛ 2 - شروع آپوپتوز; 3 - تکه تکه شدن یک سلول آپوپتوز. 4 - فاگوسیتوز اجسام آپوپتوز توسط سلولهای اطراف. 5 - مرگ ساختارهای داخل سلولی در هنگام نکروز. 6- تخریب غشای سلولی.
آپوپتوز در فرآیندهای فیزیولوژیکی و پاتولوژیک زیر نقش دارد:
ü تخریب برنامه ریزی شده سلول ها در طول جنین زایی (از جمله لانه گزینی، اندامزایی)؛
ü فرورفتگی اعضای وابسته به هورمون در بزرگسالان، به عنوان مثال، رد آندومتر در طول چرخه قاعدگیآترزی فولیکول ها در تخمدان ها در یائسگی و پسرفت غده پستانی پس از قطع شیردهی.
ü حذف برخی از سلول ها در طول تکثیر جمعیت سلولی.
ü مرگ سلولهای فردی در تومورها، عمدتاً در طول پسرفت آن، بلکه در یک تومور فعال در حال رشد.
ü مرگ سلولی سیستم ایمنیهر دو لنفوسیت های B و T، پس از تخلیه ذخایر سیتوکین، و همچنین مرگ سلول های T خودرأکتیو در طول توسعه در تیموس.
ü آتروفی پاتولوژیک اندام های پارانشیمی پس از انسداد مجاری دفعی که در پانکراس و لوزالمعده مشاهده می شود. غدد بزاقی، کلیه ها؛
ü مرگ سلولی ناشی از عملکرد سلول های T سیتوتوکسیک، به عنوان مثال، در طی رد پیوند و بیماری پیوند در مقابل میزبان.
ü آسیب به سلول ها در برخی بیماری های ویروسیبه عنوان مثال، برای هپاتیت ویروسیهنگامی که قطعاتی از سلول های آپوپتوز در کبد یافت می شوند، به عنوان بدن های کوچک کاونسیلمن.
تنظیم آپوپتوز
آپوپتوز مرگ سلولی تحت کنترل ژنتیکی است. در حال حاضر، تعداد زیادی ژن شناسایی شده اند که مواد لازم برای تنظیم آپوپتوز را رمزگذاری می کنند.
آپوپتوز را می توان تنظیم کرد:
- عوامل خارجی،
- مکانیسم های خودمختار
نکروز انعقادیبا فعالیت کم فرآیندهای هیدرولیتیک، محتوای بالای پروتئین و محتوای متوسط مایع در بافت ها ایجاد می شود. بافت نکروز دارای قوام متراکم و خشک است. به عنوان مثال، نکروز عضلانی مومی یا Tsenker در حصبه و تیفوس است. نکروز فیبرینوئید در بیماری های آلرژیک و خود ایمنی نوعی از نکروز انعقادی، نکروز کازئوزی (پنیردار) است که به دلیل تشابه قوام، رنگ و شکل ظاهری به پنیر دلمه ای نام خود را گرفته است. در بیماری هایی مانند سل، سیفلیس، جذام و لنفوگرانولوماتوز ایجاد می شود. تجزیه و تحلیل شیمیایی بافت های نکروزه در آنها آشکار می شود تعداد زیادی ازلیپیدها
دلایل ظاهر شدن
نکروز انعقادی اغلب در اثر شرایط غیر مرتبط با ترومای شدید، سموم یا پاسخ های ایمنی ناشی از بیماری مزمن ایجاد می شود. کمبود اکسیژن (هیپوکسی) باعث مرگ سلولی در ناحیه ای موضعی می شود که رگ های خونیقادر به تامین اکسیژن و سایر موارد مهم نیست مواد مغذی... لازم به ذکر است که در طول ایسکمی، اکثر بافت های بدن دچار نکروز انعقادی می شوند، ایسکمی در سیستم عصبی مرکزی ناشی از نکروز برخوردی است، زیرا ساختارهای متراکم بسیار کوچکی در بافت های عصبی وجود دارد.
پاتولوژی
ماکروسکوپی
تصویر ماکروسکوپی ناحیه مبتلا به نکروز انعقادی مانند یک بخش بافت رنگ پریده در تضاد با نواحی اطراف به نظر می رسد و همچنین با بافت عروقی و بافت خشک شده روی برش متمایز می شود. بعداً ممکن است بافت به دلیل پاسخ التهابی قرمز شود. اگر آسیب پایدار یا دائمی نباشد، بقای سلول های اطراف می تواند به بازسازی بافت آسیب دیده کمک کند.
نکروز(از یونانی. نکروز- مرده) - نکروز، مرگ سلول ها و بافت ها در یک موجود زنده. در همان زمان، فعالیت حیاتی آنها به طور کامل متوقف می شود. فرآیند نکروزمراحل مختلفی را طی می کند که به ما امکان می دهد در مورد آن صحبت کنیم مورفوژنز نکروز: 1) پارانکروز - شبیه به تغییرات نکروز، اما برگشت پذیر. 2) نکروبیوز - تغییرات دیستروفی برگشت ناپذیر که با غلبه واکنش های کاتابولیک بر واکنش های آنابولیک مشخص می شود. 3) مرگ سلولی که تعیین زمان شروع آن دشوار است. 4) اتولیز - تجزیه یک بستر مرده تحت عمل آنزیم های هیدرولیتیک سلول های مرده و ماکروفاژها. از نظر مورفولوژیکی، نکروز معادل اتولیز است. یک شکل خاص از نکروز است آپوپتوز(از یونانی aro - تقسیم و پتوز- حذف، سقوط). آپوپتوز بر اساس تقسیم سلولی به قطعات با تشکیل اجسام آپوپتوز (قطعات سلولی احاطه شده توسط یک غشاء و قابلیت فعالیت حیاتی) و فاگوسیتوز بعدی این اجسام توسط ماکروفاژها است.
فرآیندهای نکروز و نکروز (نکروز، آپوپتوز) به طور مداوم به عنوان تجلی فعالیت حیاتی طبیعی ارگانیسم رخ می دهد، زیرا اجرای هر عملکردی مستلزم صرف یک بستر مادی است که با بازسازی فیزیولوژیکی دوباره پر می شود. علاوه بر این، بیشتر سلول های بدن دائماً دچار پیری، مرگ طبیعی و به دنبال آن تخریب آنها توسط آپوپتوز و اتولیز فیزیولوژیکی می شوند.
بنابراین، فرآیندهای تخریب فیزیولوژیکی به طور مداوم در بدن در حال وقوع است، یعنی. نکروز، اتولیتیک و ترمیم کننده، یعنی. فرآیندهای ترمیمی و احیا کننده، که فعالیت حیاتی طبیعی آن را تضمین می کند.
نکروز بیشتر و زودتر در ساختارهای پارانشیمی فعال از نظر عملکردی (بخش های عملکردی میوکارد، قسمت های پروگزیمال و دیستال کلیه ها، نورون های مغز و غیره) رخ می دهد. بخشی از یک سلول، یک سلول، یک گروه از سلول ها، یک محل از بافت، اندام، یک عضو کامل، یا بخشی از بدن ممکن است دچار نکروز شود. بنابراین، در برخی موارد فقط با بررسی میکروسکوپی مشخص می شود، در برخی دیگر به وضوح با چشم غیر مسلح قابل تشخیص است.
علائم میکروسکوپی نکروزاینها شامل تغییرات مشخصه در سلول و ماده بین سلولی است. سلول تغییر می کند هم به هسته و هم به سیتوپلاسم مربوط می شود. هسته کوچک می شود، در حالی که
تراکم کروماتین وجود دارد - کاریوپیکنوزیس(شکل 44، الف)، به توده تجزیه می شود - کاریورکسیس(شکل 44، ب) و حل می شود - کاریولیزپیکنوز، رکسیس و لیز هسته مراحل متوالی فرآیند هستند و منعکس کننده پویایی فعال شدن هیدرولازها - ریبونوکلئاز و دئوکسی ریبونوکلئاز هستند که منجر به جدا شدن گروه های فسفات از نوکلئوتیدها و آزاد شدن اسیدهای نوکلئیک می شود که تحت depolymerization قرار می گیرند. V سیتوپلاسم دناتوره شدن و انعقاد پروتئین ها اتفاق می افتد، معمولاً با برخورد جایگزین می شود، فراساختارهای آن می میرند. تغییرات می تواند بخشی از سلول را پوشش دهد (نکروز انعقادی کانونی)،که رد می شود یا کل سلول (انعقاد سیتوپلاسم).انعقاد به پایان می رسد پلاسمورهکسیس- متلاشی شدن سیتوپلاسم به توده ها. در مرحله نهایی، تخریب ساختارهای غشایی سلول منجر به هیدراتاسیون آن می شود، ذوب هیدرولیتیک سیتوپلاسم رخ می دهد - پلاسمولیزذوب در برخی موارد کل سلول را در بر می گیرد (سیتولیز)در دیگران - فقط بخشی از آن (نکروز برخورد کانونی،یا دیستروفی بالون)(شکل 28، ب را ببینید). با نکروز کانونی، ترمیم کامل غشای خارجی سلول می تواند رخ دهد. تغییرات در سیتوپلاسم (انعقاد، پلاسمورکسیس، پلاسمولیز)، و همچنین تغییرات در هسته سلول، بیان مورفولوژیکی فرآیند آنزیمی است که مبتنی بر فعال شدن آنزیم های هیدرولیتیک لیزوزوم است.
برنج. 44.هسته با نکروز تغییر می کند:
الف - کاریوپیکنوز؛ اندازه هسته (R) کاهش می یابد، کاریوپلاسم با چگالی الکترون بالا، هسته تمایز ندارد. واکوئل های زیادی در سیتوپلاسم (B) وجود دارد، میتوکندری ها (M) همگن می شوند، کمپلکس گلژی (CG) از نظر اندازه کاهش می یابد. ES - شبکه آندوپلاسمی. الکترونوگرام. х17500 (طبق گفته V.G. Sharov)؛ ب - کاریورکسیس. نکروز فولیکول طحال همراه با تب عود کننده
تغییرات ماده بین سلولی با نکروز، آنها هم ماده بینابینی و هم ساختارهای فیبری را می پوشانند. ماده واسطهبه دلیل پلیمریزاسیون گلیکوزآمینوگلیکان های آن و آغشته شدن به پروتئین های پلاسمای خون، متورم و ذوب می شود. الیاف کلاژنهمچنین متورم می شود، با پروتئین های پلاسما (فیبرین) اشباع می شود، به توده های همگن متراکم تبدیل می شود، متلاشی یا لیز می شود. تغییرات الیاف الاستیکمشابه مواردی که در بالا توضیح داده شد: تورم، بازوفیلی، پوسیدگی، ذوب - الاستولیز الیاف مشبکاغلب در کانون های نکروز برای مدت طولانی باقی می مانند، اما پس از آن دچار تکه تکه شدن و از هم گسیختگی توده ای می شوند. تغییرات مشابه و رشته های عصبی.تجزیه ساختارهای فیبری با فعال شدن آنزیم های خاص - کلاژناز و الاستاز همراه است. بنابراین، در ماده بین سلولی با نکروز، تغییرات مشخصه از نکروز فیبرینوئید در موارد کمتر، آنها با ادم و بافت مخاطی برجسته ظاهر می شوند که مشخصه است نکروز برخوردی با نکروز بافت چربی فرآیندهای لیپولیتیک غالب است. تجزیه چربی های خنثی با تشکیل اسیدهای چرب و صابون ها اتفاق می افتد که منجر به التهاب واکنشی می شود. لیپوگرانولوما(سانتی متر. التهاب).
بنابراین، در پویایی تغییرات نکروز، به ویژه سلول ها، تغییری در فرآیندهای انعقاد و برخورد ایجاد می شود، اما غالباً یکی از آنها غالباً مشخص می شود که هم به علت ایجاد نکروز و هم به مکانیسم نکروز بستگی دارد. رشد آن و ویژگی های ساختاری اندام یا بافتی که در آن نکروز رخ می دهد.
با متلاشی شدن سلول ها و ماده بین سلولی در کانون نکروز، ریزه های بافتیدر اطراف کانون نکروز ایجاد می شود التهاب مرزبندی
با نکروز بافتی، بافت، رنگ و بوی آنها تغییر می کند. در برخی موارد، بافت مرده متراکم و خشک می شود (مومیایی کردن)در برخی دیگر شل است و ذوب می شود (میومالاسی، آنسفالومالاسیاز یونانی ملاکاس- نرم). بافت مرده اغلب کم رنگ و به رنگ سفید مایل به زرد است. به عنوان مثال، کانون های نکروز در کلیه ها، طحال، میوکارد زمانی که جریان خون متوقف می شود، کانون های نکروز تحت تأثیر مایکوباکتریوم توبرکلوزیس هستند. گاهی اوقات، برعکس، از خون اشباع شده است، رنگ قرمز تیره دارد. به عنوان مثال، کانون های نکروز گردش خون در ریه ها در برابر پس زمینه استاز وریدی ایجاد می شود. کانونهای نکروز پوست، رودهها، رحم اغلب رنگ قهوهای کثیف، خاکستری-سبز یا سیاه پیدا میکنند، زیرا رنگدانههای خونی که آنها را آغشته میکنند دستخوش تغییرات زیادی میشوند. در برخی موارد، کانون های نکروز با صفرا رنگ می شوند. هنگامی که بافت مرده پوسیده می شود، بوی بد مشخصی متصاعد می کند.
طبقه بندی.علت نکروز، مکانیسم توسعه، ویژگی های بالینی و مورفولوژیکی در نظر گرفته می شود.
بسته به علل نکروز با انواع زیر متمایز می شود: تروماتیک، سمی، تروفونورتیک، آلرژیک، عروقی.
نکروز تروماتیکنتیجه اثر مستقیم عوامل فیزیکی یا شیمیایی روی بافت است. چنین نکروزی زمانی رخ می دهد که در معرض تابش، دمای پایین (یخ زدگی) و دمای بالا (سوختگی)، در لبه های کانال زخم، با آسیب الکتریکی قرار گیرد. نکروز سمیدر نتیجه عمل روی بافت سموم با منشاء باکتریایی و غیر باکتریایی، ترکیبات شیمیایی با طبیعت مختلف (اسیدها، قلیاها، داروها، الکل اتیلیک و غیره) ایجاد می شود. به عنوان مثال، نکروز اپیتلیوم نفرون پروگزیمال در صورت مسمومیت با کلرید جیوه، نکروز کاردیومیوسیت ها هنگام قرار گرفتن در معرض اگزوتوکسین دیفتری. نکروز تروفونورتیکبا اختلالات تروفیسم عصبی بافت ها رخ می دهد. در نتیجه این اختلالات، اختلالات گردش خون، تغییرات دیستروفیک و نکروبیوتیک و در نتیجه نکروز ایجاد می شود. از جمله نکروز در بیماری ها و آسیب های مرکز و محیطی است سیستم عصبی(زخم های غیر التیام بخش در صورت آسیب اعصاب محیطی). نمونه ای از نکروز تروفونورتیک زخم های فشاری است.
نکروز آلرژیکبافت در یک ارگانیسم حساس رخ می دهد و، به عنوان یک قاعده، بیانگر واکنش های حساسیت مفرط از نوع فوری است. معمولا این نکروز فیبرینوئید،اغلب در بیماری های عفونی آلرژیک و خود ایمنی یافت می شود. یک مثال کلاسیک از نکروز آلرژیک پدیده آرتوس است. نکروز عروقیکه نامیده می شود حمله قلبیهنگامی رخ می دهد که جریان خون در شریان ها به دلیل ترومبوز، آمبولی، اسپاسم طولانی مدت مختل یا متوقف شود. (نکروز آنتی ژنیک).جریان خون ناکافی باعث ایسکمی، هیپوکسی و مرگ بافت به دلیل توقف فرآیندهای ردوکس می شود. (نکروز ایسکمیک).در ایجاد نکروز عروقی پراهمیتدارای کشش عملکردی اندام در شرایط نارسایی گردش خون جانبی با باریک شدن مجرای شریان های اصلی تغذیه کننده اندام است. به عنوان مثال، نکروز ایسکمیک میوکارد تحت شرایط بار عملکردی در آترواسکلروز تنگی عروق کرونر (کرونری) قلب است.
مکانیسم توسعهمکانیسم های نکروز پیچیده است و با ماهیت عوامل بیماری زا، ویژگی های ساختاری و عملکردی بافتی که در آن نکروز ایجاد می شود، واکنش ارگانیسم، عوامل ارثی تعیین می شود. بسته به مکانیسم عمل عامل بیماری زا، آنها متمایز می شوند نکروز مستقیم،به دلیل قرار گرفتن در معرض مستقیم (نکروز تروماتیک و سمی)، و نکروز غیر مستقیم،به طور غیر مستقیم از طریق سیستم های عروقی و عصبی غدد درون ریز (تروفونورتیک، آلرژیک، نکروز عروقی) ایجاد می شود.
در دوره قبل از تولد و در دوران کودکینکروز عمدتاً مستقیم مرتبط با اثر مستقیم یک عامل عفونی یا ماده سمی بر بافت ها (نکروز چندگانه فعال اندام های داخلی و غشاهای مخاطی در جنین ها، نوزادان و نوزادان نارس مبتلا به آبله مرغان عمومی، عمومی
واکسن آبله، سپسیس، توکسوپلاسموز) و یا به دلیل عوارض جانبی سمی خاص مواد مخدر(عوامل سیتواستاتیک، کلرپرومازین و غیره). نکروز غیر مستقیم، که اغلب در بزرگسالان رخ می دهد، در کودکان به عنوان یک استثنا با ناهنجاری های بستر عروقی یک ارگان خاص یا اختلالات متابولیسم الکترولیت مشاهده می شود.
اشکال بالینی و مورفولوژیکی نکروز با در نظر گرفتن ویژگیهای ساختاری و عملکردی اندامها و بافتهایی که در آن نکروز رخ میدهد، و همچنین دلایل وقوع آن و شرایط توسعه، جدا میشوند. در میان آنها، نکروز انعقادی، نکروز برخورد، قانقاریا، جداسازی، حمله قلبی متمایز می شود.
نکروز انعقادی (خشک).با این واقعیت مشخص می شود که مناطق مرده حاصل خشک، متراکم و به رنگ خاکستری مایل به زرد هستند. نکروز خشک بر اساس فرآیندهای دناتوره شدن پروتئین با تشکیل ترکیبات کم محلول است که ممکن است برای مدت طولانی تحت تجزیه هیدرولیتیک قرار نگیرند، در حالی که بافت ها کم آب می شوند. شرایط ایجاد نکروز خشک عمدتاً در بافت های غنی از پروتئین و فقیر در مایعات یافت می شود. یک مثال است مومی،یا زنکر(توصیف زنکر) نکروز عضلانیبا عفونت (تیفوئید و تیفوس)، تروما؛ نکروز پنیریبا سل، سیفلیس، جذام، لنفوگرانولوماتوز؛ نکروز فیبرینوئیدبا بیماری های آلرژیک و خود ایمنی.
نکروز برخوردی (تر).با ذوب شدن بافت مرده، تشکیل کیست مشخص می شود. در بافت هایی که از نظر پروتئین نسبتاً فقیر و غنی از مایع هستند، که در آن شرایط مطلوب برای فرآیندهای هیدرولیتیک وجود دارد، ایجاد می شود. نکروز مرطوب معمولی کانون نرم شدن خاکستری (انفارکتوس ایسکمیک) مغز است. وقتی توده های نکروز خشک ذوب می شوند، از برخورد ثانویه صحبت می کنند.
قانقاریا(از یونانی. گانگرانا- آتش) - نکروز بافت ها در تماس با محیط خارجی، در حالی که بافت ها خاکستری مایل به قهوه ای یا سیاه می شوند که با تبدیل رنگدانه های خون به سولفید آهن همراه است. قانقاریا خشک و مرطوب را تشخیص دهید.
در گانگرن خشکبافت مرده تحت تأثیر هوا خشک می شود، ضخیم می شود، کوچک می شود، مانند پارچه مومیایی می شود. بنابراین قانقاریای خشک نیز نامیده می شود مومیایی کردن(شکل 45). قانقاریا خشک در بافت ها رخ می دهد
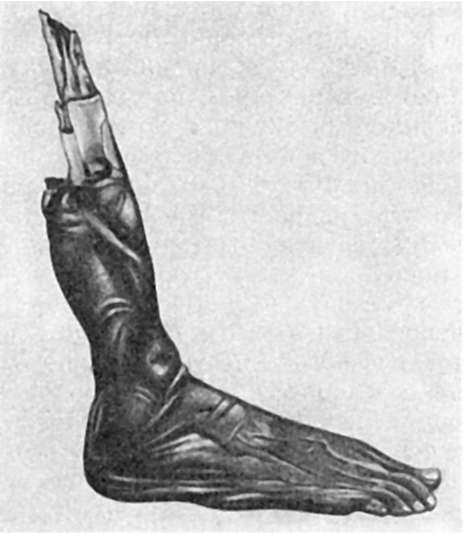 برنج. 45.گانگرن خشک اندام تحتانی
برنج. 45.گانگرن خشک اندام تحتانی
از نظر رطوبت ضعیف قانقاریا خشک اندام ها با تصلب شرایین و ترومبوز شریان آن (گانگرن آترواسکلروتیک)، با سرمازدگی یا سوختگی، انگشتان - با بیماری رینود یا بیماری لرزش، پوست - با عفونت (تیفوس)، همراه با اختلالات تروفیک عمیق و غیره است.
در قانقاریا مرطوببافت مرده در معرض میکروارگانیسم های پوسیدگی قرار می گیرد (You.perfringens، fusiformis، putrificans، histolyticus، proteusو دیگران)، متورم می شود، ادم می شود، بوی بدی متصاعد می کند. قانقاریای مرطوب بیشتر در بافت های غنی از رطوبت ایجاد می شود. بروز آن با اختلالات گردش خون (استاز وریدی) و گردش خون لنفاوی (لنفوستاز، ادم) تسهیل می شود. قانقاریای مرطوب در ریه ها رخ می دهد و باعث عارضه می شود فرآیندهای التهابی(پنومونی)، در روده با انسداد شریان های مزانتریک (ترومبوز، آمبولی). کودکانی که در اثر یک بیماری عفونی (معمولا سرخک) ضعیف شده اند ممکن است دچار قانقاریای مرطوب بافت نرم گونه ها، پرینه، شوند که به آن noma (از یونانی) می گویند. نام- سرطان آب).
گانگرن خشک و مرطوب را تشخیص دهید گانگرن بی هوازی،که یک بیماری عفونی مستقل است که توسط گروهی از میکروارگانیسمهای خاص (عمدتاً شما. پرفرینگنس).اغلب با شلیک گلوله و زخم های دیگر، همراه با تخریب گسترده ماهیچه ها و خرد شدن استخوان ها رخ می دهد.
چگونه یک نوع قانقاریا جدا می شود؟ زخم بستر - نکروز نواحی سطحی بدن (پوست، بافت های نرم) در معرض فشار. بنابراین، زخم بستر اغلب در ناحیه ساکروم، فرآیندهای خاردار مهره ها، تروکانتر بزرگتر استخوان ران ظاهر می شود. در پیدایش آن، نکروز تروفونورتیک است که معمولاً در بیماران شدیداً بیمار مبتلا به بیماری های قلبی عروقی، انکولوژیک، عفونی یا عصبی رخ می دهد.
جداسازی- ناحیه ای از بافت مرده که تحت اتولیز قرار نمی گیرد، جایگزین نمی شود بافت همبندو آزادانه در میان بافت های زنده قرار دارد. سکته معمولاً در استخوان هایی با التهاب مغز استخوان - استئومیلیت - رخ می دهد. یک کپسول متوالی و یک حفره پر از چرک در اطراف چنین جداسازی تشکیل می شود. اغلب، جداسازی از طریق فیستول از حفره خارج می شود، که تنها پس از آزاد شدن کامل بسته می شود. بافت های نرم نیز جدا می شوند (به عنوان مثال، مناطق نکروز ریه، زخم بستر). چنین جداکنندههایی به سرعت ذوب میشوند.
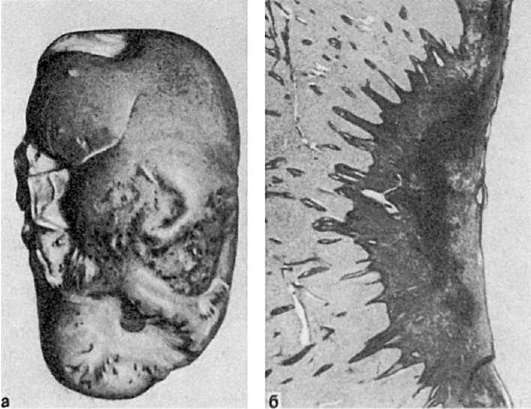
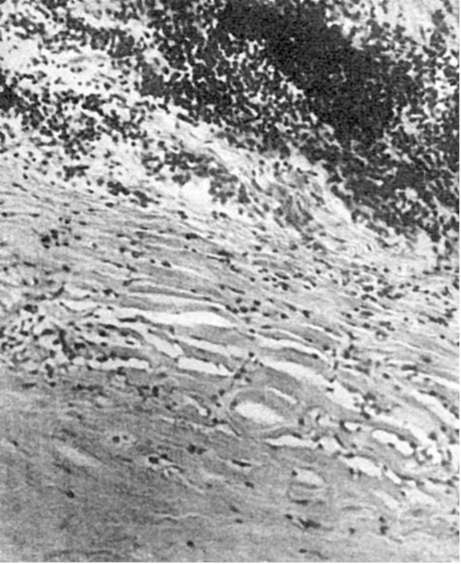
حمله قلبی(از لات انفارسیته- پر کردن، پر کردن) یک نکروز عروقی (ایسکمیک)، پیامد و بیان شدید ایسکمی است. حمله قلبی شایع ترین نوع نکروز است.
شکل، اندازه، رنگ و قوام حمله قلبی ممکن است متفاوت باشد. اغلب حملات قلبی هستند گوه شکل (شکل 46-49)، پایه گوه رو به کپسول است و نقطه به سمت دروازه اندام است. آنها در طحال، کلیه ها، ریه ها تشکیل می شوند که با ماهیت آنژیو مشخص می شود.
 برنج. 46.انفارکتوس طحال:
برنج. 46.انفارکتوس طحال:
الف - انفارکتوس ایسکمیک به شکل یک ناحیه مثلثی سبک با پایه رو به کپسول. ب - آنژیوگرافی همان طحال. عدم وجود عروق خونی در ناحیه انفارکتوس
معماری این اندام ها - نوع اصلی انشعاب شریان های آنها. کمتر دچار حملات قلبی می شوند اشتباه شکل (نگاه کنید به شکل 49). چنین انفارکتوس هایی در قلب، مغز، روده ها، یعنی. در اندام هایی که نه اصلی، بلکه شل یا مختلط انشعاب شریانی غالب است. حمله قلبی می تواند بیشتر یا تمام یک اندام را تحت تاثیر قرار دهد (انفارکتوس جزئی یا کلی)یا فقط در زیر میکروسکوپ یافت می شود (ریزانفارکتوس).اگر حمله قلبی بر اساس نوع ایجاد شود نکروز انعقادی،سپس بافت در ناحیه نکروز متراکم تر می شود، خشک می شود (سکته قلبی، کلیه، طحال). اگر حمله قلبی در اثر نوع نکروز برخوردی ایجاد شود، نرم و مایع می شود (انفارکتوس مغزی یا روده).
بسته به شکل ظاهری (عمدتا رنگ)، سه نوع انفارکتوس وجود دارد: سفید، سفید با تاج هموراژیک و قرمز.
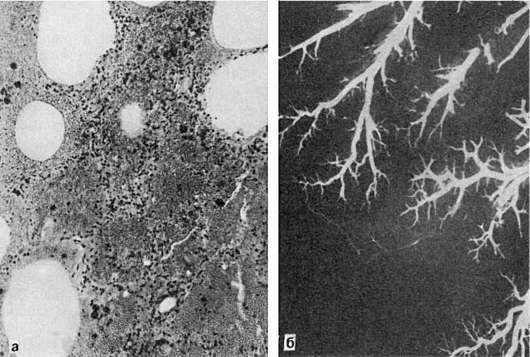
انفارکتوس سفید (ایسکمیک).یک ناحیه سفید مایل به زرد است که به خوبی از بافت اطراف جدا شده است (شکل 46). معمولاً در مناطقی با گردش وثیقه ناکافی رخ می دهد. به ویژه در طحال و کلیه شایع است.
انفارکتوس سفید با کرولای هموراژیکبا ناحیه ای به رنگ سفید مایل به زرد نشان داده می شود، اما این ناحیه توسط ناحیه ای از خونریزی احاطه شده است (شکل 47 و 49).
 برنج. 47.انفارکتوس کلیه:
برنج. 47.انفارکتوس کلیه:
الف - انفارکتوس کلیه سفید با کرولای هموراژیک (نمای مقطعی). ب - آنژیوگرافی از همان کلیه. عدم وجود عروق خونی در ناحیه انفارکتوس
 برنج. 48.انفارکتوس هموراژیک ریه:
برنج. 48.انفارکتوس هموراژیک ریه:
الف - آلوئول ها پر از خون هستند. ب - آنژیوگرافی ریه
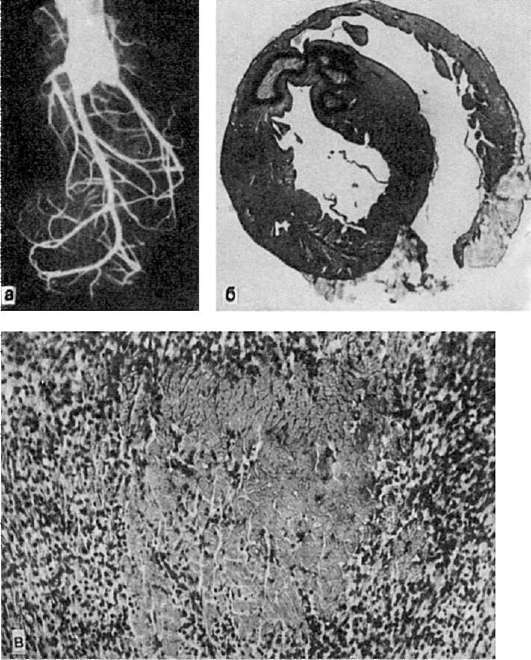 برنج. 49.انفارکتوس میوکارد:
برنج. 49.انفارکتوس میوکارد:
الف - آنژیوگرافی قلب خرگوش، که در آن انفارکتوس میوکارد بازتولید شده است (بسته شدن شاخه نزولی شریان کرونر چپ). عروق ناحیه ایسکمیک تزریق نمی شوند. ب - کانون های انفارکتوس ایسکمیک که توسط ناحیه ای از خونریزی احاطه شده است. ج - ناحیه نکروز میوکارد که توسط بافت گرانوله احاطه شده است
در نتیجه این واقعیت ایجاد می شود که وازواسپاسم در امتداد حاشیه انفارکتوس با گسترش پارتیک آنها و ایجاد خونریزی جایگزین می شود. چنین حمله قلبی در کلیه ها، میوکارد یافت می شود.
در حمله قلبی قرمز (هموراژیک).ناحیه نکروز از خون اشباع شده است، قرمز تیره و کاملاً مشخص است (شکل 48 را ببینید). احتقان وریدی شرایط مطلوبی برای چنین خیساندن خونریزی دهنده است. ویژگیهای آنژیوآرشیتکتتونیک اندام (آناستوموز بین شریانهای برونش و ریوی) نیز برای ایجاد حمله قلبی قرمز اهمیت دارد. انفارکتوس هموراژیک معمولا در ریه ها و به ندرت در روده ها، طحال و کلیه ها رخ می دهد.
بیشترین اهمیت بالینی انفارکتوس قلب (میوکارد)، مغز، ریه، کلیه، طحال و روده است.
V قلب حمله قلبی معمولاً سفید رنگ با تاج هموراژیک است، شکلی نامنظم دارد، اغلب در بطن چپ و سپتوم بین بطنی رخ می دهد (شکل 49)، بسیار به ندرت - در بطن راست و دهلیز. مرگ را می توان در زیر اندوکارد موضعی کرد (انفارکتوس سابندوکارد)،اپی کاردیوم (سکته قلبی)یا تمام ضخامت میوکارد را بپوشاند (سکته مغزی).در ناحیه انفارکتوس، روکش های ترومبوتیک اغلب روی اندوکارد و روکش های فیبرینی روی پریکارد تشکیل می شود که با ایجاد التهاب واکنشی در اطراف محل های نکروز همراه است. اغلب، انفارکتوس میوکارد در پس زمینه آترواسکلروز و فشار خون بالا رخ می دهد و به عنوان یک بیماری مستقل در نظر گرفته می شود (نگاه کنید به. ایسکمی قلبی).
V مغز اغلب یک حمله قلبی سفید رخ می دهد که به سرعت نرم می شود (تمرکز نرم شدن خاکستری مغز، شکل 50). اگر حمله قلبی در پس زمینه اختلالات قابل توجه گردش خون، رکود وریدی ایجاد شود، کانون نکروز مغز با خون اشباع شده و قرمز می شود (تمرکز نرم شدن قرمز مغز). حمله قلبی معمولاً در گره های زیر قشری موضعی می شود و مسیرهای مغز را از بین می برد که با فلج ظاهر می شود. انفارکتوس مغزی، مانند انفارکتوس میوکارد، اغلب در پس زمینه آترواسکلروز و فشار خون بالا رخ می دهد و یکی از تظاهرات بیماری های عروق مغزی است.
V ریه ها در اکثریت قریب به اتفاق موارد، انفارکتوس هموراژیک تشکیل می شود (شکل 48 را ببینید). به خوبی مشخص شده است، شکل مخروطی دارد که پایه آن به سمت پلور است. پوشش های فیبرین (جنب واکنشی) روی پلور در ناحیه انفارکتوس ظاهر می شود. در نوک مخروط، رو به ریشه ریه، ترومبوس یا آمبولی اغلب در شاخه شریان ریوی دیده می شود. بافت مرده متراکم، دانهدار و به رنگ قرمز تیره است.
انفارکتوس ریوی هموراژیک معمولاً در پس زمینه استاز وریدی رخ می دهد و توسعه آن تا حد زیادی با ویژگی های آنژیوآرشکتتونیک ریه ها ، وجود آناستوموز بین سیستم شریان های ریوی و برونش تعیین می شود. در شرایط احتقان و بسته شدن لومن شاخه شریان ریوی در ناحیه
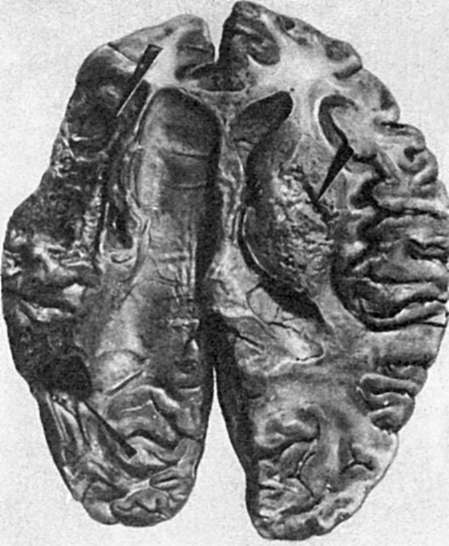 برنج. 50.تمرکز نرم کننده (راست) و کیست (چپ) در مغز (با فلش نشان داده شده است)
برنج. 50.تمرکز نرم کننده (راست) و کیست (چپ) در مغز (با فلش نشان داده شده است)
نکروز بافت ریه از شریان برونش خون می آید، که مویرگ ها را می شکند و به لومن آلوئول ها می ریزد. التهاب بافت ریه اغلب در اطراف حمله قلبی ایجاد می شود. (پنومونی حوالی انفارکتوس).انفارکتوس هموراژیک شدید ریه می تواند باعث زردی فوق کبدی شود. حملات قلبی سفید در ریه ها بسیار نادر است. این بیماری با اسکلروز و از بین رفتن لومن شریان های برونش رخ می دهد.
V کلیه ها انفارکتوس، به عنوان یک قاعده، سفید با یک تاج هموراژیک است، ناحیه مخروطی شکل نکروز یا ماده قشری یا کل ضخامت پارانشیم را می پوشاند (شکل 47 را ببینید). هنگامی که تنه شریانی اصلی بسته است، جمعیا انفارکتوس ساب کل کلیهنوعی سکته قلبی هستند نکروز متقارن قشر کلیه،منجر به نارسایی حاد کلیه می شود. ایجاد انفارکتوس ایسکمیک کلیه معمولاً با ترومبوآمبولی همراه است، کمتر با ترومبوز شاخه های شریان کلیوی، روماتیسم پیچیده، اندوکاردیت سپتیک طولانی مدت، فشار خون بالا، بیماری ایسکمیک قلبی. به ندرت، با ترومبوز سیاهرگ کلیوی، انفارکتوس وریدی کلیه رخ می دهد.
V طحال حملات قلبی سفید وجود دارد (نگاه کنید به شکل 46)، اغلب با التهاب فیبرینی واکنشی کپسول و تشکیل چسبندگی های بعدی با دیافراگم، برگ جداری صفاق، و حلقه های روده. انفارکتوس ایسکمیک طحال با ترومبوز و آمبولی همراه است. گاهی اوقات با ترومبوز ورید طحال انفارکتوس های وریدی
V روده ها حملات قلبی هموراژیک و اغلب تحت تجزیه گانگرونی قرار می گیرند که منجر به سوراخ شدن دیواره روده و ایجاد پریتونیت می شود.
به ندرت، حملات قلبی رخ می دهد در شبکیه چشم، کبد، ماهیچه ها، استخوان ها.
دلایل توسعه حمله قلبی - اسپاسم طولانی مدت، ترومبوزیا آمبولی شریان،و تنش عملکردی یک اندام در شرایط کمبود خون.اهمیت زیادی برای وقوع حمله قلبی دارد نارسایی آناستوموزهاو وثیقه،که به میزان آسیب دیواره سرخرگ ها و باریک شدن مجرای آنها (آترواسکلروز، اندارتریت محو کننده)، به میزان اختلالات گردش خون (به عنوان مثال، استاز وریدی) و به سطح بسته شدن شریان توسط ترومبوز یا ترومبوز بستگی دارد. آمبولی
بنابراین، حملات قلبی معمولاً با بیماری هایی رخ می دهد که با تغییرات شدید در شریان ها و اختلالات عمومی گردش خون (بیماری های روماتیسمی، نقایص قلبی، آترواسکلروز، فشار خون بالا، اندوکاردیت سپتیک طولانی مدت) مشخص می شود. نارسایی حاد گردش خون جانبی نیز به دلیل ایجاد یک حمله قلبی با بار عملکردی اندامی است، معمولاً قلب، که گردش خون آن مختل است. نارسایی آناستوموزها و وثیقه ها با ایجاد آن همراه است انفارکتوس وریدیبا ترومبوز
وریدها در شرایط توده احتقانی. برای وقوع حمله قلبی نیز از اهمیت بالایی برخوردار است وضعیت متابولیسم بافت، به عنوان مثال.زمینه متابولیک که در آن انفارکتوس ایسکمیک ایجاد می شود. متابولیسم اندام ها و بافت هایی که در آنها حمله قلبی رخ می دهد معمولاً به دلیل هیپوکسی ناشی از اختلالات گردش خون عمومی مختل می شود. فقط انسداد شریان های اصلی بزرگ می تواند بدون اختلالات گردش خون قبلی و اختلالات متابولیک در بافت منجر به نکروز شود.
نتیجه حمله قلبی.نتیجه به ویژگی های عامل ایجاد کننده و بیماری که حمله قلبی را پیچیده می کند، به وضعیت بدن و اندامی که در آن ایجاد می شود و به اندازه حمله قلبی بستگی دارد.
کانون های کوچک نکروز ایسکمیک ممکن است در معرض آن قرار گیرند اتولیزبه دنبال آن بازسازی کامل شایع ترین نتیجه مطلوب حمله قلبی که به عنوان نکروز خشک ایجاد می شود، آن است سازمانو تشکیل اسکار(شکل 51). سازماندهی حمله قلبی می تواند به آن پایان دهد سنگ شدگی یا هموسیدروز،وقتی صحبت از سازماندهی انفارکتوس هموراژیک می شود. یک کیست در محل انفارکتوس ایجاد می شود که بر اساس نوع نکروز برخوردی، به عنوان مثال، در مغز ایجاد می شود.
پیامد نامطلوب حمله قلبی است همجوشی چرکیکه معمولاً با آمبولی ترومبوباکتری در سپسیس همراه است.
معنی حمله قلبیبرای بدن، اهمیت حمله قلبی بسیار زیاد است، و در درجه اول به این دلیل که حمله قلبی نکروز ایسکمیک است. هر آنچه در مورد اهمیت نکروز گفته شد در مورد حمله قلبی نیز صدق می کند. با این حال، ذکر این نکته ضروری است که حمله قلبی یکی از شایع ترین و
 برنج. 51.سازماندهی حمله قلبی:
برنج. 51.سازماندهی حمله قلبی:
الف - اسکارهای جمع شده روی سطح کلیه پس از بهبودی حمله قلبی. ب - اسکار در محل حمله قلبی در طحال (ذره بین)
عوارض وحشتناک یک عدد بیماری قلب و عروقی... این در درجه اول آترواسکلروز و فشار خون بالا است. همچنین لازم به ذکر است که حملات قلبی در آترواسکلروز و فشار خون بالا اغلب در اندام های حیاتی - قلب و مغز ایجاد می شود و این امر درصد بالایی از موارد مرگ و ناتوانی ناگهانی را تعیین می کند. اهمیت پزشکی و اجتماعی انفارکتوس میوکارد و عواقب آن باعث شد تا آن را به عنوان تظاهرات یک بیماری مستقل تشخیص دهیم - بیماری عروق کرونر قلب
نتیجه نکروزبا یک نتیجه مطلوب، التهاب واکنشی در اطراف بافت مرده رخ می دهد که بافت مرده را محدود می کند. این التهاب نامیده می شود مرزبندی،و منطقه تحدید حدود - منطقه مرزیدر این ناحیه، رگ های خونی گشاد می شوند، توده ها، ادم ظاهر می شوند، تعداد زیادی لکوسیت ظاهر می شوند که آنزیم های هیدرولیتیک را آزاد می کنند و توده های نکروزه را ذوب می کنند (حل می کنند). به دنبال این، سلول های بافت همبند تکثیر می شوند که جایگزین یا رشد بیش از حد محل نکروز می شود. وقتی توده های مرده را با بافت همبند جایگزین می کنند، از آنها صحبت می کنند سازمان های.در محل نکروز در چنین مواردی، جای زخم(اسکار در محل حمله قلبی - به شکل 51 مراجعه کنید). رشد بیش از حد ناحیه نکروز منجر به آن می شود کپسولاسیون ها(شکل 52). نمک های کلسیم می توانند در توده های مرده با نکروز خشک و در کانون نکروز که سازمان دهی شده اند، رسوب کنند. در این صورت توسعه می یابد کلسیفیکاسیون (تحجر)کانون نکروز (نگاه کنید به دیستروفی های معدنی).در برخی موارد، تشکیل استخوان در محل نکروز مشاهده می شود - استخوان سازیبا تحلیل ریزه های بافتی و تشکیل یک کپسول، که معمولاً در نکروز مرطوب و اغلب در مغز یافت می شود، یک حفره در محل نکروز ظاهر می شود - یک کیست (نگاه کنید به شکل 50).
پیامد نامطلوب نکروز - ادغام چرکی کانون نکروز.این آمیختگی چرکی حملات قلبی با سپسیس است (اینگونه حملات قلبی را سپتیک می نامند). در نتیجه نکروز در مراحل اولیه رشد داخل رحمی، نقص عضو یا بخشی از بدن رخ می دهد.
معنی نکروز.این توسط ماهیت آن تعیین می شود - "مرگ محلی"، بنابراین نکروز اندام های حیاتی اغلب منجر به مرگ می شود. اینها انفارکتوس میوکارد، نکروز ایسکمیک مغز، نکروز قشر مغز هستند.
 برنج. 52.ناحیه نکروز (پایین) که توسط یک کپسول فیبری احاطه شده است (کپسولاسیون نکروز)
برنج. 52.ناحیه نکروز (پایین) که توسط یک کپسول فیبری احاطه شده است (کپسولاسیون نکروز)
مواد کلیوی، نکروز پیشرونده کبد، نکروز حاد پانکراس. اغلب، نکروز بافتی علت آن است عوارض شدیدبسیاری از بیماری ها (پارگی قلب در هنگام میومالاسی، فلج در هنگام سکته مغزی فشار خون بالا، عفونت با زخم های بزرگ بستر، و غیره)، و همچنین مسمومیت به دلیل اثرات محصولات پوسیدگی بافت بر روی بدن (به عنوان مثال، با قانقاریا اندام). ادغام چرکی کانون نکروز می تواند باعث التهاب چرکی غشاهای سروزی، خونریزی، سپسیس شود. با به اصطلاح نتیجه مطلوب نکروز، اگر در اندام های حیاتی (کیست در مغز، اسکار در میوکارد) رخ دهد، عواقب آن بسیار مهم است.
مرگ، نشانه های مرگ، تغییرات پس از مرگ
مرگبه عنوان یک مفهوم بیولوژیکی بیانی از توقف غیرقابل برگشت زندگی ارگانیسم است. با شروع مرگ، انسان تبدیل به جسد، جسد می شود (جسد).
بسته به علل، منجر به شروع مرگ، تمایز بین طبیعی (فیزیولوژیکی)، خشونت آمیز و مرگ ناشی از بیماری است.
مرگ طبیعیدر افراد مسن و دراز کبد در نتیجه زوال طبیعی (فیزیولوژیکی) بدن رخ می دهد. (مرگ فیزیولوژیکی).طول عمر یک فرد مشخص نشده است، با این حال، اگر ما براساس امید به زندگی جگرهای طولانی سیاره خود هدایت شویم، می تواند 150 سال یا بیشتر باشد.
علاقه به مشکل پیری و پیری که توسط شاخه خاصی از علم زیست پزشکی به آن می پردازد قابل درک است - پیری شناسی (از یونانی. جرون- پیر و آرم ها- تدریس)، و به بیماری های دوران پیری مورد مطالعه قرار گرفت طب سالمندی (از یونانی. جرون- پیر و iatreia- درمان) که بخشی از پیری شناسی است.
مرگ خشونت آمیزمشاهده شده در نتیجه چنین اقداماتی (عمدی یا غیرعمدی)، مانند قتل، خودکشی، مرگ بر اثر انواع جراحات (به عنوان مثال، ضربه های خیابانی، صنعتی یا خانگی)، تصادفات (مثلاً تصادف حمل و نقل). مرگ خشن به عنوان یک مقوله اجتماعی و حقوقی مورد مطالعه پزشکی قانونی و مراجع قضایی است.
مرگ بر اثر بیماریدر نتیجه ناسازگاری زندگی با تغییراتی در بدن ایجاد می شود که ناشی از فرآیندهای پاتولوژیک (دردناک) است. معمولاً مرگ ناشی از بیماری به کندی اتفاق می افتد و با انقراض تدریجی همراه است توابع حیاتی... اما گاهی اوقات مرگ به طور غیر منتظره اتفاق می افتد، گویی در سلامت کامل - ناگهانی،یا مرگ ناگهانی.با یک بیماری نهفته یا به اندازه کافی جبران شده مشاهده می شود، که در آن یک عارضه کشنده به طور ناگهانی ایجاد می شود (خونریزی شدید همراه با پارگی آنوریسم آئورت، ایسکمی حاد میوکارد با ترومبوز شریان کرونر قلب، خونریزی مغزی با فشار خون بالا و غیره).
بسته به توسعه برگشت پذیر یا تغییرات غیر قابل برگشت
عملکردهای حیاتی ارگانیسم بین مرگ بالینی و بیولوژیکی تمایز قائل می شوند.
مرگ بالینیبا توقف تنفس و گردش خون مشخص می شود، اما این تغییرات در فعالیت حیاتی بدن در عرض چند دقیقه (زمان تجربه قشر مغز) برگشت پذیر است. مرگ بالینی بر اساس نوعی حالت هیپوکسیک (عمدتاً سیستم عصبی مرکزی) به دلیل توقف گردش خون و عدم تنظیم مرکزی آن است.
قبل از شروع مرگ بالینی عذاب(از یونانی. آگون- مبارزه)، منعکس کننده فعالیت ناهماهنگ سیستم های هموستاتیک در دوره پایانی (آریتمی، فلج اسفنکتر، تشنج، ادم ریوی). بنابراین به عذابی که می تواند از چند دقیقه تا چند ساعت طول بکشد، اصطلاحاً گفته می شود ایالات پایانه،به مرگ بالینی ختم می شود در شرایط پایانی (آزار، شوک، از دست دادن خون و غیره) و مرگ بالینی، مجموعه احیا (از لات. دوبارهو انیمیشن- احیا) فعالیت ها. الگوهای اصلی انقراض و احیای عملکردهای حیاتی انسان توسط بخش خاصی از پزشکی به نام احیا بررسی می شود.
مرگ بیولوژیکی- تغییرات برگشت ناپذیر در فعالیت حیاتی ارگانیسم، آغاز فرآیندهای اتولیتیک. با این حال، مرگ سلول ها و بافت ها با شروع مرگ بیولوژیکی به طور همزمان اتفاق نمی افتد. اولین کسی که می میرد سیستم عصبی مرکزی است. در حال حاضر 5-6 دقیقه پس از توقف تنفس و گردش خون، تخریب عناصر فراساختاری سلول های پارانشیمی سر و نخاع... در سایر اندام ها و بافت ها (پوست، کلیه ها، قلب، ریه ها و غیره)، این روند برای چندین ساعت و حتی چند روز ادامه دارد، ساختار کلی بسیاری از اندام ها و بافت ها، که پس از مرگ در زیر میکروسکوپ نوری مشاهده می شود، برای مدت طولانی باقی می ماند. زمان، تنها با بررسی میکروسکوپی الکترونی، تخریب فراساختارهای سلولی را نشان می دهد. بنابراین، آسیب شناس، با مطالعه میکروسکوپی مواد گرفته شده از جسد، می تواند ماهیت تغییرات پاتولوژیک در اندام ها و بافت ها را قضاوت کند.
با توجه به اینکه پس از مرگ مرگ بسیاری از اعضا و بافت ها برای مدت نسبتا طولانی کشیده می شود، از مواد گرفته شده از جسد برای پیوند (پیوند) اعضا و بافت ها استفاده می شود. در حال حاضر، خون جسد برای انتقال، بافت های حفظ شده (قرنیه، پوست، استخوان، رگ های خونی) و اندام ها (کلیه) جسد برای پیوند به طور گسترده در عمل بالینی استفاده می شود.
مدت کوتاهی پس از مرگ بیولوژیکی، یک سری از نشانه های مرگ و تغییرات پس از مرگ: خنک کردن جسد؛ سخت گیری مرگ; خشک کردن جسد؛ توزیع مجدد خون؛ لکه های جسد؛ تجزیه جسد
سرد کردن جسد (الگور مورتیس)در ارتباط با توقف تولید گرما در بدن پس از مرگ و یکسان شدن دما ایجاد می شود
بدن مرده و محیط اگر قبل از مرگ بیمار درجه حرارت بسیار بالایی داشت یا تشنج در یک دوره آتونون طولانی مشاهده شد، سرد شدن جسد به کندی اتفاق می افتد. در برخی موارد (مرگ بر اثر کزاز، مسمومیت با استریکنین)، دمای جسد ممکن است در چند ساعت آینده پس از مرگ افزایش یابد.
سختگیریدر فشردگی عضلات ارادی و غیر ارادی بیان می شود. علت آن ناپدید شدن آدنوزین تری فسفریک اسید از ماهیچه ها پس از مرگ و تجمع اسید لاکتیک در آنها است. ریگور مورتیس معمولاً 2 تا 5 ساعت پس از مرگ ایجاد می شود و در پایان روز تمام ماهیچه ها را می پوشاند. ابتدا ماهیچه های جویدنی و تقلیدی صورت در معرض شدت مورتیس قرار می گیرند، سپس عضلات گردن، تنه و اندام ها. ماهیچه ها متراکم می شوند: برای خم شدن یک اندام در مفصل، باید تلاش قابل توجهی انجام دهید. Rigor mortis برای 2-3 روز باقی می ماند و سپس به همان ترتیبی که در آن رخ می دهد ناپدید می شود (رفع می شود). با تخریب خشونت آمیز rigor mortis، دوباره ظاهر نمی شود.
ریگور مورتیس در افرادی با ماهیچه های توسعه یافته و همچنین در مواردی که مرگ با تشنج رخ می دهد (به عنوان مثال، کزاز، مسمومیت با استریکنین) بسیار مشخص است و به سرعت ایجاد می شود. شدت مورتیس در افراد مسن و کودکان، در افراد خسته و فوت شده بر اثر سپسیس ضعیف بیان می شود. در جنین های نارس، ریگور مورتیس وجود ندارد. دمای پایین محیط شروع ریگور مورتیس را پیچیده می کند و عمر آن را طولانی می کند، دمای بالا وضوح ریگور مورتیس را تسریع می کند.
خشک کردن جسدبه دلیل تبخیر رطوبت از سطح بدن رخ می دهد. می توان آن را به مناطق خاصی محدود کرد، اما کل جسد نیز می تواند تحت خشک شدن قرار گیرد. (مومیایی کردن جسد).اول از همه، خشک شدن تأثیر می گذارد پوست, کره چشم، غشاهای مخاطی. مرتبط با خشک کردن کدر شدن قرنیهظاهر شدن روی صلبیه با یک شکاف پالپبرال از نقاط خشک قهوه ای به شکل مثلثی. پایه این لکه ها به قرنیه و نوک آن به گوشه چشم است. غشاهای مخاطی خشک، متراکم و قهوه ای رنگ می شوند. روی پوست، لکههای خشک، زرد مایل به قهوهای، پوستی مانند عمدتاً در مکانهای خیساندن یا آسیب به اپیدرم ظاهر میشوند. به اصطلاح لکه های پوستی ناشی از خشک شدن را می توان با ساییدگی ها و سوختگی های مادام العمر اشتباه گرفت.
توزیع مجدد خوندر جسد به صورت سرریز خون در وریدها بیان می شود، در حالی که شریان ها تقریباً خالی هستند. در سیاهرگ ها و حفره ها نیمه راستانعقاد خون پس از مرگ در قلب رخ می دهد. لختههای خون پس از مرگ، رنگ زرد یا قرمز، سطح صاف، قوام الاستیک (کشش) دارند و آزادانه در مجرای قلب یا محفظه قلب قرار دارند که آنها را از لختههای خون متمایز میکند. با شروع سریع مرگ، لخته های پس از مرگ کم هستند، با لخته شدن آهسته - بسیار.
هنگام مرگ در حالت خفگی (مثلاً خفگی نوزادان) خون در جسد لخته نمی شود. با گذشت زمان، همولیز جسد رخ می دهد.
لکه های جسددر ارتباط با توزیع مجدد خون در جسد ایجاد می شود و به موقعیت آن بستگی دارد. با توجه به اینکه خون به وریدهای قسمت های تحتانی بدن می ریزد و در آنجا تجمع می یابد، 3-6 ساعت پس از شروع مرگ، هیپوستازهای جسدآنها مانند لکه های بنفش تیره به نظر می رسند و با فشار دادن رنگ پریده می شوند. هیپوستازهای جسد در مناطقی از بدن که در معرض فشار هستند (ناحیه ساکروم، تیغه های شانه زمانی که جسد در پشت است) وجود ندارد. آنها به خوبی در هنگام مرگ ناشی از بیماری هایی که منجر به استاز وریدی عمومی می شود، و ضعیف - در کم خونی، خستگی بیان می شوند.
متعاقباً هنگامی که همولیز پس از مرگ گلبول های قرمز اتفاق می افتد، ناحیه هیپوستازهای جسد با پلاسمای خون آغشته می شود که از رگ ها پخش می شود و با هموگلوبین رنگ آمیزی می شود. لکه های جسد دیررس ایجاد می شوند، یا جذب جسداین لکه ها به رنگ صورتی مایل به قرمز هستند و با فشار از بین نمی روند.
تجزیه جسدمرتبط با فرآیندهای اتولیز و پوسیدگی جسد. اتولیز پس از مرگزودتر ایجاد می شود و در اندام های غده ای (کبد، لوزالمعده، معده) که سلول های آن غنی از آنزیم های هیدرولیتیک (پروتئولیتیک) هستند، شدیدتر بیان می شود. هضم خود پس از مرگ پانکراس خیلی زود اتفاق می افتد. در ارتباط با فعالیت شیره معده، پس از مرگ خود هضم معده (گاسترومالاسی) رخ می دهد. هنگامی که محتویات معده به مری پرتاب می شود، خود هضم دیواره آن (ازوفاگومالاسی) امکان پذیر است، و زمانی که محتویات معده به داخل مری آسپیره می شوند. راه های هوایی- نرم شدن "ترش" ریه ها (پنوممالاسی اسیدا).
اتولیز پس از مرگ به سرعت انجام می شود فرآیندهای پوسیدگیدر ارتباط با تکثیر باکتری های پوسیده در روده و کلونیزاسیون بعدی آنها در بافت های جسد.
پوترفاکشن اتولیز پس از مرگ را افزایش می دهد و منجر به ذوب شدن بافت هایی می شود که به رنگ سبز کثیف رنگ می شوند (از اثر سولفید هیدروژن بر روی محصولات تجزیه هموگلوبین، سولفید آهن تشکیل می شود) و بوی بدی متصاعد می کنند.
گازهای ایجاد شده در هنگام پوسیدگی جسد، روده ها را متورم می کند، به بافت ها و اندام ها نفوذ می کند که ظاهری کف آلود پیدا می کند و هنگام لمس کرپیتوس شنیده می شود. آمفیزم جسد).سرعت اتولیز جسد و پوسیدگی به دمای محیط بستگی دارد. در این راستا اجساد را در یخچال نگهداری می کنند. تجزیه و مومیایی کردن جسد را به حالت تعلیق در می آورد که با آن می توانید اجساد را برای مدت طولانی حفظ کنید. با این حال، مومیایی کردن ظاهر اندام ها را تغییر می دهد و ارزیابی ماهیت تغییرات آنها را در تحقیقات پزشکی پاتولوژیک یا پزشکی قانونی دشوار می کند.
مبحث 4. نکروز، آپوپتوز و آتروفی
4.1. نکروز
لازم است بدانید که مرگ سلولی تجلی دائمی فعالیت حیاتی ارگانیسم است و در حالت سالم با بازسازی فیزیولوژیکی سلول ها متعادل می شود. هم اجزای ساختاری سلول ها و هم سلول های کامل فرسوده می شوند، پیر می شوند، می میرند و نیاز به جایگزینی دارند. حفظ اندام ها و بافت های مختلف در حالت سالم بدون تجدید فیزیولوژیکی "طبیعی" و بنابراین بدون مرگ سلول های فردی غیرممکن است. این مرگ سلولی در سال 1972 نامگذاری شد. آپوپتوز». آپوپتوز - این مرگ سلولی برنامه ریزی شده است ... اما مرگ سلولی می تواند در یک موجود زنده در نتیجه اقدامات "خشونت آمیز" عوامل آسیب زا خارجی (بیماری زا) رخ دهد. این مرگ سلولی نامیده می شود "نکروز".سلول های مرده به طور کامل فعالیت نمی کنند. مرگ سلولی با تغییرات بیوشیمیایی و ساختاری برگشت ناپذیر همراه است.
بدین ترتیب، مرگ سلولیمی تواند به دو صورت اتفاق بیفتد: نکروز و آپوپتوز. نکروز(از یونانی. نکروز- مرده) - نکروز، مرگ سلول ها و بافت ها در یک موجود زنده تحت تأثیر عوامل ایجاد کننده بیماری. این نوع مرگ سلولی تحت کنترل ژنتیکی نیست
علل نکروز... عوامل ایجاد کننده نکروز:
-فیزیکی
( زخم گلوله، تشعشع، برق، دمای پایین و بالا - سرمازدگی و سوختگی)؛
-سمی
(اسیدها، قلیاها، نمک های فلزات سنگین، آنزیم ها، داروها، الکل اتیلیک و غیره)؛
-بیولوژیکی
(باکتری ها، ویروس ها، تک یاخته ها و غیره)؛
-حساسیتی
(آندوآنتیژن ها و اگزوآنتی ژن ها، به عنوان مثال، نکروز فیبرینوئید در بیماری های عفونی-آلرژیک و خود ایمنی، پدیده آرتوس)؛
-عروقی
(حمله قلبی - نکروز عروقی)؛
-تروفونورتیک
(زخم بستر، زخم های غیر التیام بخش).
بسته به مکانیسم اثر عامل بیماری زا تمایز بین:
-نکروز مستقیمبه دلیل اثر مستقیم عامل (نکروز تروماتیک، سمی و بیولوژیکی)،
-نکروز غیر مستقیمبه طور غیر مستقیم از طریق سیستم عروقی و عصبی غدد درون ریز (نکروز آلرژیک، عروقی و تروفونورتیک) ایجاد می شود.
علائم مورفولوژیکی نکروز
قبل از نکروز یک دوره نکروبیوز وجود دارد که بستر مورفولوژیکی آن تغییرات دیستروفیک است.
الف. تغییرات اولیه:در دوره اولیه نکروز، سلول از نظر مورفولوژیکی تغییر نمی کند. 1-3 ساعت طول می کشد تا تغییرات در میکروسکوپ الکترونی یا هیستوشیمی ظاهر شود و حداقل 6-8 ساعت قبل از ظاهر شدن تغییرات در میکروسکوپ نوری. حتی بعداً، تغییرات ماکروسکوپی ایجاد می شود. به عنوان مثال، اگر بیمار مبتلا به انفارکتوس میوکارد چند دقیقه پس از شروع حمله آنژین (دردی با جریان خون ناکافی به میوکارد) بمیرد، کالبد شکافی هیچ مدرک ساختاری دال بر نکروز را نشان نخواهد داد. اگر مرگ در روز دوم پس از حمله حاد رخ دهد، تغییرات آشکار خواهد بود.
ب- تغییرات هیستوشیمیایی:هجوم یون های کلسیم به سلول با آسیب غیر قابل برگشت و ظهور تظاهرات مورفولوژیکی نکروز همراه است. در یک سلول طبیعی، غلظت کلسیم درون سلولی تقریباً 001/0 غلظت آن در مایع خارج سلولی است. این گرادیان توسط غشای سلولی پشتیبانی می شود که به طور فعال یون های کلسیم را به خارج از سلول منتقل می کند. به طور تجربی ثابت شده است که وقتی سلول ها در نتیجه ایسکمی یا تحت تأثیر عوامل سمی مختلف آسیب می بینند، تجمع کلسیم در داخل سلول ها تنها زمانی مشاهده می شود که تغییرات غیرقابل برگشت باشد. کلسیم اندونوکلئازها (هیدرولیز، برش DNA)، فسفولیپازها (تخریب غشاها) و پروتئازها (تخریب، هضم اسکلت سلولی) را فعال می کند. افزایش فعالیت آنها با روش های هیستوشیمیایی تشخیص داده می شود. فعالیت آنزیم های ردوکس (به عنوان مثال سوکسینات دهیدروژناز) به شدت کاهش می یابد یا ناپدید می شود.
ب. تغییرات در هسته:تغییرات در هسته بهترین شواهد نکروز سلولی است. کروماتین سلول مرده به صورت توده های بزرگ متراکم می شود و هسته از نظر حجم کم می شود، منقبض می شود، متراکم می شود، به شدت بازوفیل می شود، یعنی به رنگ آبی تیره با هماتوکسیلین رنگ آمیزی می شود. این فرآیند نامیده می شود پیکنوز (چروک شدن).سپس هسته پیکنوز می تواند به ذرات بازوفیلیک متعددی پاره شود. کاریورکسیسیا در نتیجه عمل لیزوزومی دئوکسی ریبونوکلئاز لیز (انحلال) می شوند. (کاریولیز). سپس حجم آن افزایش می یابد، با هماتوکسیلین ضعیف می شود، خطوط هسته به تدریج از بین می رود. با نکروز به سرعت در حال توسعه، هسته بدون مرحله pyknotic لیز می شود.
د) تغییرات سیتوپلاسمی:تقریباً 6 ساعت پس از اینکه سلول دچار نکروز شد، سیتوپلاسم آن یکنواخت و به شدت اسیدوفیل می شود، یعنی با رنگ های اسیدی شدید، به عنوان مثال، هنگامی که با ائوزین رنگ می شود، رنگ آمیزی می شود. این اولین تغییری است که توسط میکروسکوپ نوری شناسایی می شود که در نتیجه انعقاد پروتئین های سیتوپلاسمی و تخریب (ناپدید شدن) ریبوزوم ها رخ می دهد. RNA ریبوزوم یک رنگ بازوفیلیک به سیتوپلاسم طبیعی می دهد. اندامک های سلولی تخصصی، مانند میوفیبریل ها در سلول های میوکارد، اولین کسانی هستند که ناپدید می شوند. تورم میتوکندری و تخریب (تخریب) غشاهای اندامک باعث واکوئل شدن سیتوپلاسم می شود. در نهایت، هضم یک سلول توسط آنزیم هایی که از لیزوزوم های خود آزاد می شوند، باعث لیز سلولی (اتولیز) می شود. بنابراین، در سیتوپلاسم رخ می دهد انعقاد پروتئین ها، معمولا با آنها جایگزین می شود برخورد
E. تغییرات در ماده بین سلولیهم ماده بینابینی و هم ساختارهای فیبری را پوشش می دهد. اغلب، تغییرات مشخصه نکروز فیبرینوئید ایجاد می شود: الیاف کلاژن، الاستیک و رتیکولین به توده های صورتی متراکم، همگن، گاهی اوقات بازوفیل تبدیل می شوند که می توانند دچار تکه تکه شدن، تجزیه توده ای یا لیز شوند. در موارد کمتر، ممکن است ادم، لیز و مخاط ساختارهای فیبری وجود داشته باشد که مشخصه نکروز برخوردی است.
اشکال بالینی و مورفولوژیکی نکروز
نکروز با تغییرات بالینی و مورفولوژیکی مختلف ظاهر می شود. تفاوت ها به ویژگی های ساختاری و عملکردی اندام ها و بافت ها، سرعت و نوع نکروز و همچنین دلایل وقوع آن و شرایط توسعه بستگی دارد. در میان اشکال بالینی و مورفولوژیکی نکروز مشخص می شود انعقاد (خشک)نکروز و برخورد (تر)نکروز
الف. نکروز انعقادی (خشک):با این نوع نکروز، سلول های مرده شکل خود را برای چند روز حفظ می کنند. سلول های فاقد هسته مانند توده ای از سیتوپلاسم منعقد، همگن و صورتی به نظر می رسند.
مکانیسم نکروز انعقادی به اندازه کافی روشن نیست. انعقاد پروتئین های سیتوپلاسمی آنها را در برابر عمل آنزیم های لیزوزومی مقاوم می کند و بنابراین مایع شدن آنها را کند می کند.
نکروز انعقادی معمولا در رخ می دهد اندام های غنی از پروتئین و فقیر در مایعات به عنوان مثال، در کلیه ها، میوکارد، غدد فوق کلیوی، طحال، معمولاً در نتیجه گردش خون ناکافی و بی اکسیژنی، اثر عوامل فیزیکی، شیمیایی و سایر عوامل آسیب رسان، به عنوان مثال، نکروز انعقادی سلول های کبدی (شکل 6.1) با یک عفونت ویروسی یا با اثر عوامل سمی منشأ باکتریایی و غیر باکتریایی. نکروز انعقادی همچنین به نام خشک زیرا با این واقعیت مشخص می شود که نواحی مرده حاصل خشک، متراکم، متلاشی، سفید یا زرد هستند.
نکروز انعقادی شامل:
-سکته - تنوع نکروز عروقی (ایسکمیک). اندام های داخلی (به جز مغز). این شایع ترین نوع نکروز است.
-کاسیوس (پنیردار)نکروز همچنین با سل، سیفلیس، جذام و همچنین با لنفوگرانولوماتوز ایجاد می شود. به آن اختصاصی نیز می گویند، زیرا اغلب با گرانولوم های عفونی خاص یافت می شود. در اندام های داخلی، ناحیه محدودی از بافت خشک، متلاشی و زرد مایل به زرد آشکار می شود. در گرانولوم های سیفلیس، اغلب چنین مناطقی فرو ریخته نیستند، بلکه خمیری هستند و یادآور چسب عربی هستند. این یک نوع مختلط (یعنی خارج و داخل سلولی) نکروز است که در آن پارانشیم و استروما (هر دو سلول و فیبرها) به طور همزمان می میرند. از نظر میکروسکوپی، چنین محل بافتی بدون ساختار، همگن، رنگ آمیزی با هماتوکسیلین و ائوزین به رنگ صورتی است، توده های کروماتین هسته ای (کاریورکسیس) به وضوح قابل مشاهده است.
نکروز مومی یا زنکر(نکروز عضلانی، اغلب دیواره قدامی شکم و ران، با عفونت های شدید - حصبه و تیفوس، وبا).
-نکروز فیبرینوئید- نوعی نکروز بافت همبند؛ اغلب در بیماری های آلرژیک و خودایمنی (به عنوان مثال، روماتیسم، آرتریت روماتوئید و لوپوس اریتماتوی سیستمیک) مشاهده می شود. فیبرهای کلاژن و ماهیچه های صاف غشای میانی رگ های خونی به شدت آسیب می بینند. نکروز فیبرینوئیدی شریان ها در فشار خون بدخیم مشاهده می شود. نکروز فیبرینوئید با از دست دادن ساختار طبیعی و تجمع مواد نکروزه همگن صورتی روشن که از نظر میکروسکوپی شبیه فیبرین است مشخص می شود. توجه داشته باشید که اصطلاح "فیبرینوئید" با اصطلاح "فیبرینوس" متفاوت است، زیرا دومی به تجمع فیبرین، به عنوان مثال، در هنگام لخته شدن خون یا التهاب اشاره دارد. نواحی نکروز فیبرینوئید حاوی مقادیر مختلفی از ایمونوگلوبولین ها و مکمل، آلبومین، کلاژن و محصولات تجزیه فیبرین هستند.
-نکروز چربی:
1. نکروز چربی آنزیمی: نکروز چربی اغلب در پانکراتیت حاد و آسیب پانکراس رخ می دهد، زمانی که آنزیم های پانکراس از مجاری به بافت اطراف آزاد می شوند. لیپاز لوزالمعده روی تری گلیسیریدها در سلول های چربی عمل می کند و آنها را به گلیسرول و اسیدهای چرب تجزیه می کند که با یون های کلسیم پلاسما تعامل می کنند و صابون های کلسیمی را تشکیل می دهند. در همان زمان، پلاکها و گرههای مات و سفید (مانند گچ) (استاتونکروز) در بافت چربی اطراف پانکراس ظاهر میشوند.
با پانکراتیت، لیپاز ممکن است وارد جریان خون شود، به دنبال آن انتشار گسترده ای ایجاد می شود، که علت نکروز چربی در بسیاری از قسمت های بدن است. بافت چربی زیر جلدی و مغز استخوان اغلب آسیب دیده است.
2. نکروز چربی غیر آنزیمی: نکروز چربی غیر آنزیمی در غده پستانی، بافت چربی زیر جلدی و در حفره شکمی مشاهده می شود. اکثر بیماران سابقه تروما دارند. نکروز چربی غیر آنزیمی به عنوان نکروز چربی تروماتیک نیز شناخته می شود، حتی اگر تروما به عنوان علت زمینه ای شناخته نشود. نکروز چربی غیر آنزیمی باعث ایجاد یک پاسخ التهابی می شود که با حضور ماکروفاژهای متعدد با سیتوپلاسم کف آلود، نوتروفیل ها و لنفوسیت ها مشخص می شود. به دنبال آن فیبروز ایجاد می شود و تشخیص این فرآیند از تومور دشوار است.
-گانگرن (از یونانی گانگرانا- آتش) : این یک نکروز بافتی است که با محیط خارجی ارتباط برقرار می کند و تحت تأثیر آن تغییر می کند. اصطلاح "گانگرن" به طور گسترده برای نشان دادن یک وضعیت بالینی و مورفولوژیکی استفاده می شود که در آن نکروز بافت اغلب توسط یک عفونت باکتریایی ثانویه با شدت متفاوت پیچیده می شود یا در تماس با محیط خارجی، دچار تغییرات ثانویه می شود. بین خشک، مرطوب، گانگرن گازی و زخم بستر تمایز قائل شوید.
1. گانگرن خشک - این نکروز بافت ها در تماس با محیط خارجی است که بدون مشارکت میکروارگانیسم ها انجام می شود. قانقاریا خشک اغلب در اندام ها در نتیجه نکروز بافت انعقادی ایسکمیک رخ می دهد. بافت های نکروزه سیاه، خشک به نظر می رسند و به وضوح از بافت زنده مجاور جدا می شوند. در مرز با بافت های سالم، التهاب مرزی رخ می دهد. تغییر رنگ به دلیل تبدیل رنگدانه های هموگلوبینوژن در حضور سولفید هیدروژن به سولفید آهن است. نمونه ها هستند گانگرن خشک:
اندام های با آترواسکلروز و ترومبوز شریان های او ( گانگرن آترواسکلروتیک
آندرتریت محو کننده؛
- در صورت سرمازدگی یا سوختگی؛
- انگشتان مبتلا به بیماری رینود یا بیماری ارتعاشی؛
- پوست مبتلا به تیفوس و سایر عفونت ها.
درمان شامل عمل جراحی برای برداشتنبافت مرده، خط مرزی به عنوان یک نقطه مرجع عمل می کند.
2. گانگرن مرطوب : در نتیجه لایه بندی روی تغییرات بافت نکروز یک عفونت شدید باکتریایی ایجاد می شود. تحت تأثیر آنزیم های میکروارگانیسم ها، برخورد ثانویه رخ می دهد. لیز یک سلول توسط آنزیم هایی که در خود سلول ایجاد نمی شوند، بلکه از خارج نفوذ می کنند، نامیده می شود. هترولیز... نوع میکروارگانیسم بستگی به محل گانگرن دارد. قانقاریای مرطوب معمولاً در بافت های غنی از رطوبت ایجاد می شود. این می تواند در اندام ها رخ دهد، اما اغلب در اندام های داخلی، به عنوان مثال، در روده ها با انسداد شریان های مزانتریک (ترومبوز، آمبولی)، در ریه ها به عنوان یک عارضه ذات الریه (آنفولانزا، سرخک). کودکانی که در اثر یک بیماری عفونی (معمولا سرخک) ضعیف شده اند ممکن است دچار قانقاریای مرطوب بافت نرم گونه ها، پرینه، شوند که به آن noma (از یونانی) می گویند. نام- سرطان آب). التهاب حادو رشد باکتری باعث می شود که ناحیه نکروزه ادماتیک و قرمز مایل به سیاه و با مایع سازی گسترده بافت مرده شود. با قانقاریا مرطوب، التهاب نکروزان گسترش می یابد که به وضوح محدود به بافت سالم مجاور نیست و بنابراین پاسخ به آن دشوار است. درمان جراحی... در نتیجه فعالیت حیاتی باکتری ها، بوی خاصی به وجود می آید. میزان مرگ و میر بسیار بالاست.
3. گانگرن گازی: به عنوان مثال، قانقاریا گازی زمانی رخ می دهد که زخم به فلور بی هوازی آلوده شود کلستریدیوم پرفرنجنسو سایر میکروارگانیسم های این گروه. مشخصه آن نکروز بافتی گسترده و تشکیل گاز در نتیجه فعالیت آنزیمی باکتری ها است. تظاهرات اصلی شبیه قانقاریا مرطوب است، اما با حضور اضافی گاز در بافت ها. کرپتاسیون (ترق زدن هنگام لمس) - مکرر علامت بالینیبا گانگرن گازی میزان مرگ و میر نیز بسیار بالاست.
4. زخم بستر (دکوبیتوس): به عنوان یک نوع گانگرن، زخم های دکوبیتوس متمایز می شوند - نکروز نواحی سطحی بدن (پوست، بافت های نرم)، که در معرض فشرده سازی بین تخت و استخوان هستند. بنابراین، زخم بستر اغلب در ناحیه ساکروم، فرآیندهای خاردار مهره ها، تروکانتر بزرگتر استخوان ران ظاهر می شود. در پیدایش آن، نکروز تروفونورتیک است، زیرا عروق و اعصاب فشرده می شوند، که باعث تشدید اختلالات تروفیسم بافتی در بیماران شدیداً بیمار می شود که از بیماری های قلبی عروقی، انکولوژیک، عفونی یا عصبی رنج می برند.
ب. نکروز برخوردی (تر):با ادغام بافت مرده مشخص می شود. در بافت هایی که از نظر پروتئین نسبتاً فقیر و غنی از مایع هستند رشد می کند، جایی که شرایط مطلوبی برای آن وجود دارد فرآیندهای هیدرولیتیک . لیز سلولیدر نتیجه عمل آنزیم های خود رخ می دهد ( اتولیز). یک مثال معمولی از نکروز برخورد مرطوب تمرکز نرم شدن خاکستری (انفارکتوس ایسکمیک) مغز است.
انفارکتوس مغزی اغلب نرم کننده نامیده می شود، زیرا اصلی است ماکروسکوپی نشانه کاهش خاصیت ارتجاعی بافت مغز در کانون ضایعه در هر زمان است. در روز اول، با یک ناحیه به طور نامشخص محدود از رنگ مایل به آبی، در لمس نرم نشان داده می شود. در پایان روز اول، تمرکز واضح تر می شود و رنگ پریده می شود. در روزهای بعد، ماده مغزی در این ناحیه شلتر میشود، رنگ آن مایل به زرد یا حتی با رنگ سبز میشود. در هفته های اول حجم مغز به دلیل ادم آن اندکی افزایش می یابد. پس از 1-1.5 ماه در محل انفارکتوس، یک حفره کاملاً مشخص تشکیل می شود که حاوی مایع کدر و ریزه است. تعیین زمان دقیق حمله قلبی بسیار دشوار است، نه تنها برای ظاهراو، بلکه در تصویر بافت شناسی.
بطور میکروسکوپیک بافت مغز همگن، بدون ساختار، ضعیف است رنگ صورتیهنگامی که با هماتوکسیلین و ائوزین رنگ آمیزی می شود. تحلیل بافت مرده توسط ماکروفاژها انجام می شود که شبیه توپ های دانه ای چربی هستند.
تظاهرات بالینینکروز
تظاهرات سیستمیک:با نکروز، تب معمولاً ظاهر می شود (به دلیل آزاد شدن مواد تب زا از سلول ها و بافت های نکروز) و لکوسیتوز نوتروفیل (به دلیل وجود یک واکنش التهابی حاد - التهاب مرزی). انتشار محتویات سلول های نکروزه: اجزای آزاد شده از محتوای سیتوپلاسمی سلول های نکروز (به عنوان مثال، آنزیم ها) وارد جریان خون می شوند، جایی که حضور آنها برای تعیین محل نکروز ارزش تشخیصی دارد. این آنزیم ها را می توان با روش های مختلف آزمایشگاهی شناسایی کرد (جدول 6.1). ویژگی ظاهر آنزیم ها به محلی سازی ترجیحی آنزیم در بافت های مختلف بدن بستگی دارد. به عنوان مثال، افزایش سطح ایزوآنزیم CF کراتین کیناز مشخصه نکروز میوکارد است، زیرا این آنزیم فقط در سلول های میوکارد یافت می شود. افزایش سطح آسپارتات آمینوترانسفراز (AST) کمتر اختصاصی است، زیرا این آنزیم نه تنها در میوکارد، بلکه در کبد و سایر بافت ها نیز یافت می شود. ظاهر ترانس آمینازها مشخصه نکروز سلولی کبد است.
تظاهرات محلی:زخم غشای مخاطی دستگاه گوارشممکن است با خونریزی یا خونریزی (به عنوان مثال، زخم معده خونریزی دهنده) عارضه داشته باشد. افزایش حجم بافت در نتیجه ادم می تواند منجر به افزایش جدی فشار در داخل شود فضای محدود(به عنوان مثال، در حفره جمجمه با نکروز ایسکمیک یا هموراژیک).
اختلال عملکرد:نکروز منجر به نارسایی عملکردی اندام می شود، به عنوان مثال، بروز نارسایی حاد قلبی در نتیجه نکروز (انفارکتوس) گسترده میوکارد (حاد) بیماری ایسکمیکقلبها). شدت تظاهرات بالینی به نوع، حجم بافت آسیب دیده نسبت به مقدار کل آن و حفظ عملکرد بافت زنده باقیمانده بستگی دارد. نکروز در یک کلیه باعث نارسایی کلیه نمی شود، حتی زمانی که کل کلیه از بین برود، زیرا کلیه دیگر می تواند از دست دادن را جبران کند. با این حال، نکروز ناحیه کوچکی از قشر حرکتی منجر به فلج شدن گروه عضلانی مربوطه می شود.
نتیجه نکروز نکروز یک فرآیند برگشت ناپذیر است.در نسبتا مطلوب خروج از اطراف بافت مرده رخ می دهد التهاب واکنشی که بافت مرده را مشخص می کند. این التهاب نامیده می شود مرزبندی , و منطقه تحدید حدود - منطقه مرزی در این ناحیه، رگ های خونی گشاد می شوند، توده ها، ادم، تعداد زیادی لکوسیت ظاهر می شوند که آنزیم های هیدرولیتیک را آزاد می کنند و توده های نکروزه را ذوب می کنند. توده های نکروزه توسط ماکروفاژها جذب می شوند. به دنبال این، سلول های بافت همبند تکثیر می شوند که جایگزین یا رشد بیش از حد محل نکروز می شود. وقتی توده های مرده را با بافت همبند جایگزین می کنند، از آنها صحبت می کنند سازمان . در محل نکروز در چنین مواردی، جای زخم (اسکار در محل سکته قلبی). رشد بیش از حد ناحیه نکروز با بافت همبند منجر به آن می شود کپسوله سازی و... نمک های کلسیم می توانند در توده های مرده با نکروز خشک و در کانون نکروز که سازمان دهی شده اند، رسوب کنند. در این صورت توسعه می یابد کلسیفیکاسیون (تحجر) کانون نکروز . در برخی موارد، تشکیل استخوان در محل نکروز مشاهده می شود - استخوان سازی . با تحلیل ریزه های بافتی و تشکیل کپسول، که معمولاً با نکروز مرطوب و اغلب در مغز رخ می دهد، یک حفره در محل نکروز ظاهر می شود - کیست
نتیجه نامطلوب نکروز - ادغام چرکی (سپتیک) کانون نکروز. جداسازی- این تشکیل ناحیه ای از بافت مرده است که تحت اتولیز قرار نمی گیرد، با بافت همبند جایگزین نمی شود و آزادانه در بین بافت های زنده قرار می گیرد. سکته معمولاً در استخوان هایی با التهاب مغز استخوان - استئومیلیت - رخ می دهد. یک کپسول متوالی و حفره در اطراف چنین جداسازی تشکیل می شود. پر از چرک اغلب، جداسازی از طریق فیستول از حفره خارج می شود، که تنها پس از آزاد شدن کامل بسته می شود. نوعی توقیف - جهش - پاره کردن انتهای انگشتان
معنی نکروز.این با ماهیت آن تعیین می شود - "مرگ محلی" و محرومیت از عملکرد چنین مناطقی، بنابراین، نکروز اندام های حیاتی، به ویژه مناطق بزرگ آنها، اغلب منجر به مرگ می شود. اینها انفارکتوس میوکارد، نکروز ایسکمیک مغز، نکروز قشر کلیه، نکروز پیشرونده کبد، پانکراتیت حاد، پیچیده با نکروز پانکراس هستند. اغلب، نکروز بافتی علت عوارض شدید بسیاری از بیماریها (پارگی قلب در هنگام میومالاسی، فلج در هنگام سکتههای هموراژیک و ایسکمیک، عفونت با زخمهای بزرگ بستر، مسمومیت ناشی از تأثیر محصولات پوسیدگی بافت بر روی بدن، به عنوان مثال، با قانقاریا اندام و غیره). تظاهرات بالینی نکروز می تواند بسیار متنوع باشد. فعالیت الکتریکی غیرطبیعی که در نواحی نکروز در مغز یا میوکارد رخ می دهد، می تواند منجر به تشنج یا آریتمی قلبی شود. نقض پریستالسیس در روده نکروزه می تواند باعث انسداد روده عملکردی (پویا) شود. خونریزی اغلب در بافت نکروز مشاهده می شود، به عنوان مثال، هموپتیزی همراه با نکروز ریه.
| قبلی |
نکروز
نکروز یک فرآیند برگشت ناپذیر است که با مرگ سلولها، بخشهایی از اندامها و بافتهای موجود زنده مشخص میشود. نکروز در شرایط پاتولوژیک در بیماری های مختلف مشاهده می شود و آگاهی از قوانین کلی این فرآیند، ریخت شناسی و علائم بالینیبه تشخیص و درمان بیماری هایی که با فرآیندهای نکروز رخ می دهند کمک می کند، بنابراین، نمایندگان تخصص های مختلف درگیر مطالعه نکروز هستند. هدف اصلی آن توانایی کنترل این فرآیندها، جستجوی وسایلی است که تخریب تدریجی سلول ها، بافت ها، اندام ها را تحت تأثیر آنزیم های خود ممکن می سازد. بنابراین، به طور طبیعی، مطالعه مورفو- و پاتوژنز نکروز، و همچنین مرگ سلولی برنامه ریزی شده ژنوتیپی تحت شرایط فیزیولوژیکی (آپوپتوز) با تأکید بر تغییرات اولیه و مراحل اولیه، از اهمیت ویژه ای برخوردار است. بنابراین، مطالعه نکروز و آپوپتوز در سطوح مختلف، چشماندازی را برای درک عمیقتر فرآیندهای مردن باز میکند. در عین حال، بسته به ویژگی های ساختاری و عملکردی اندام ها، بافت ها، سلول ها و همچنین ویژگی های فردی نکروز، دیدن علل وقوع، مکانیسم های تظاهرات، پیامدها و همچنین ویژگی های نکروز مهم است. درشت ارگانیسم
واژه شناسی
گانگرن (گانگرن - آتش) - نکروز بافت ها در تماس با محیط خارجی.
حمله قلبی (انفارسیره - چیزها) - نکروز بافتی اندام های داخلی (1)، نکروز بافتی که زمانی رخ می دهد که گردش خون مختل شود (2). نوع نکروزی که با نقض حادگردش خون (ترومبوز، آمبولی، اسپاسم عروقی طولانی مدت) در اندام هایی با عروق انتهایی عملکردی (به عنوان مثال نکروز عروقی). ناحیه قابل مشاهده ماکروسکوپی بافت مرده اندام های داخلی (3).
نکروز مارانتیک - زخم بستر در بیماران لاغر، افراد مسن، با علائم کاشکسی و ماراسموس.
میومالاسی (مالاکاس - نرم) - ذوب بافت مرده.
مومیایی کردن (mumificatio - خشک کردن) - خشک کردن، فشردگی بافت مرده.
نوما (نوم - "سرطان آب") - قانقاریا مرطوب بافت نرم گونه ها در کودکان.
نکروز (nekros - مرده) - نکروز، مرگ سلول ها و بافت ها در یک موجود زنده.
نکروز (nekros - مرده، bios - زندگی) - تغییرات قبل از نکروز، فرآیندهای دیستروفی برگشت پذیر. روند آهسته پژمرده شدن.
Sequestrum (sequestrum) - قطعه ای از بافت مرده است که تحت اتولیز قرار نمی گیرد، با بافت همبند جایگزین نمی شود و آزادانه در بین بافت زنده قرار می گیرد.
الاستولیز - تورم، تجزیه، ذوب الیاف الاستیک.
مرگ
مرگبه عنوان یک مفهوم بیولوژیکی بیانی از توقف غیرقابل برگشت زندگی یک موجود زنده است. با شروع مرگ، انسان تبدیل به جسد، جسد می شود (جسد).
با دیدگاه حقوقیدر اکثر کشورها بدن زمانی مرده در نظر گرفته می شود که فعالیت مغزی به طور کامل و غیر قابل برگشت متوقف شود .
اما در عین حال، تعداد زیادی از سلول ها و بافت ها در یک ارگانیسم مرده قانونی تا مدتی پس از مرگ زنده می مانند.
این اندام ها و بافت ها منبع اصلی اندام برای پیوند را تشکیل می دهند.
نکروزیس (مرگ محلی)
لازم است بدانید که مرگ سلولی تجلی دائمی فعالیت حیاتی ارگانیسم است و در حالت سالم با بازسازی فیزیولوژیکی سلول ها متعادل می شود. هم اجزای ساختاری سلول ها و هم سلول های کامل فرسوده می شوند، پیر می شوند، می میرند و نیاز به جایگزینی دارند. حفظ اندام ها و بافت های مختلف در حالت سالم بدون تجدید فیزیولوژیکی "طبیعی" و بنابراین بدون مرگ سلول های فردی غیرممکن است. این مرگ سلولی در سال 1972 نامگذاری شد. آپوپتوز». آپوپتوز - این مرگ سلولی برنامه ریزی شده است ... اما مرگ سلولی می تواند در یک موجود زنده در نتیجه اقدامات "خشونت آمیز" عوامل آسیب زا خارجی (بیماری زا) رخ دهد. این مرگ سلولی نامیده می شود "نکروز".سلول های مرده به طور کامل فعالیت نمی کنند. مرگ سلولی با تغییرات بیوشیمیایی و ساختاری برگشت ناپذیر همراه است.
آپوپتوز مرگ سلول ها بدون آسیب قبلی برگشت ناپذیر به سلول ها است، اما در نتیجه گنجاندن یک برنامه ژنتیکی که مرگ آنها را از پیش تعیین می کند، در سال 1964 مرگ برنامه ریزی شده سلولی نامیده شد. مرگ برنامه ریزی شده سلولی در مواردی رخ می دهد که در طول رشد، رشد کند. و بقای بافت ها و همچنین در طول ساخت و ساز در حال توسعه ساختارها در جریان مورفوژنز، خلاص شدن از شر برخی از سلول ها (از جمله سلول هایی که آسیب دیده اند و چرخه زندگی خود را کامل کرده اند) ضروری می شود. یک وضعیت متناقض ایجاد می شود: سلول زندگی خود را فدا می کند، به خاطر حفظ کل - بافت، اندام، ارگانیسم، به سمت خودکشی می رود. بنابراین، اهمیت بیولوژیکی مرگ برنامه ریزی شده سلولی، حفظ حیات است. مرگ برنامه ریزی شده سلولی بخشی جدایی ناپذیر از فرآیندهای بیولوژیکی مانند رشد جنینی، مورفوژنز و دگرگونی موجودات است. در موجودات چند سلولی، تعادل بین مرگ برنامه ریزی شده سلولی و میتوز، هموستاز بافتی را فراهم می کند.
اصطلاحات "مرگ برنامه ریزی شده سلولی" و "آپوپتوز" مترادف نیستند. اصطلاح "مرگ برنامه ریزی شده سلولی" در ادبیات هم به معنای محدود و هم به معنای گسترده کلمه استفاده می شود.
در مفهوم محدود، مرگ برنامه ریزی شده سلولی مخالف آپوپتوز است، زیرا اولین مورد به طور معمول در طول رشد ارگانیسم و با فراهم کردن هموستاز بافتی رخ می دهد. در همان زمان، آپوپتوز - خودکشی سلولی - تحت شرایط پاتولوژیک ایجاد می شود.
در مفهوم گسترده، مفهوم "مرگ برنامه ریزی شده سلولی" نه تنها به مرگ سلولی توسط آپوپتوز اشاره دارد، بلکه تعدادی دیگر از انواع مرگ سلولی را نیز شامل می شود: مرگ واکوئولی، یا اتوفاژیک، آتروفیک، و همچنین مرگ زمانی که سلول به تمایز نهایی می رسد. .
بدین ترتیب، مرگ سلولیمی تواند به دو صورت اتفاق بیفتد: نکروز و آپوپتوز... از آنجایی که صفات بیولوژیکی و همچنین اهمیت نکروز و آپوپتوز به طور قابل توجهی متفاوت است، این فرآیندها به طور جداگانه در نظر گرفته می شوند.
نکروز(از یونانی. نکروز- مرده) - نکروز، مرگ سلول ها و بافت ها در یک موجود زنده تحت تأثیر عوامل ایجاد کننده بیماری. این نوع مرگ سلولی تحت کنترل ژنتیکی نیست
علل نکروز... عوامل ایجاد کننده نکروز:
- فیزیکی ( زخم گلوله، تشعشع، برق، دمای پایین و بالا - سرمازدگی و سوختگی)؛
- سمی (اسیدها، قلیاها، نمک های فلزات سنگین، آنزیم ها، داروها، الکل اتیلیک و غیره)؛
- بیولوژیکی (باکتری ها، ویروس ها، تک یاخته ها و غیره)؛
- حساسیتی (آندوآنتیژن ها و اگزوآنتی ژن ها، به عنوان مثال، نکروز فیبرینوئید در بیماری های عفونی-آلرژیک و خود ایمنی، پدیده آرتوس)؛
- عروقی (حمله قلبی - نکروز عروقی)؛
- تروفونورتیک (زخم بستر، زخم های غیر التیام بخش).
بسته به مکانیسم اثر عامل بیماری زا تمایز بین:
- نکروز مستقیمبه دلیل اثر مستقیم عامل (نکروز تروماتیک، سمی و بیولوژیکی)،
- نکروز غیر مستقیمبه طور غیر مستقیم از طریق سیستم عروقی و عصبی غدد درون ریز (نکروز آلرژیک، عروقی و تروفونورتیک) ایجاد می شود.
انواع علل نکروز:
1. تروماتیک - از عمل عوامل فیزیکی و شیمیایی ناشی می شود.
2. سمی - هنگامی رخ می دهد که در معرض سموم از طبیعت باکتریایی و دیگر.
3. Trophoneurotic - همراه با اختلال در میکروسیرکولاسیون و عصب بافتی.
4. آلرژیک - با واکنش های ایمونوپاتولوژیک ایجاد می شود.
5. عروقی - همراه با اختلال در خون رسانی به اندام یا بافت.
مکانیسم های نکروز
مکانیسم های نکروز با مکانیسم های اتولیز متفاوت است، آنها متنوع هستند، تا حد زیادی به ماهیت عامل آسیب رسان و ویژگی های ساختاری و عملکردی سلول ها، بافت ها و اندام هایی که در آنها نکروز ایجاد می شود، بستگی دارد. نتیجه نهایی تمام مکانیسم های بیماری زایی نکروز، ظهور آشوب درون سلولی است. از بین انواع مسیرهای پاتوژنتیک نکروز، پنج مورد از مهمترین آنها را می توان تشخیص داد: 1) اتصال پروتئین های سلولی به یوبیکوئیتین، 2) کمبود ATP، 3) تولید گونه های اکسیژن فعال، 4) اختلال در هموستاز کلسیم، و 5 ) از دست دادن نفوذپذیری انتخابی توسط غشای سلولی.
• یوبیکوئیتین، یکی از پروتئین های حفاظت شده، پیوندهای کووالانسی را در پروتئازوم ها با باقی مانده های لیزین زنجیره های پلی پپتیدی سایر پروتئین ها تشکیل می دهد. سنتز یوبیکوئیتین، مانند پروتئین های خانواده شوک حرارتی، آسیب های مختلف را تشدید می کند. بنابراین، در سلول های سیستم عصبی مرکزی در بیماری آلزایمر و بیماری پارکینسون، و همچنین در سلول های کبدی با آسیب کبدی الکلی، پروتئوزوم ها یافت می شود - مجتمع هایی از پروتئین ها با یوبیکوئیتین. چنین کمپلکس هایی در سلول های کبدی از دیرباز به عنوان اجسام مالوری شناخته می شدند.
• کمبود ATP به طور مداوم در سلول های در حال مرگ یافت می شود. برای مدت طولانی، اعتقاد بر این بود که علت اصلی نکروز کاردیومیوسیت در طول ایسکمی، کاهش تشکیل ترکیبات پرانرژی تا حد معینی است. در سال های اخیر نشان داده شده است که مکانیسم های دیگری در آسیب ایسکمیک دخیل هستند. بنابراین، اگر میوکارد ایسکمیک در معرض خونرسانی مجدد قرار گیرد، تغییرات نکروز بسیار سریعتر و در مقیاس بزرگ رخ می دهد. تغییرات توصیف شده آسیب خونرسانی مجدد نامیده شد. استفاده از مهارکننده های کلسیم (مانند کلرپرومازین) و آنتی اکسیدان ها با وجود سطح پایین ATP، آسیب خونرسانی مجدد را کاهش می دهد، که نشان می دهد کمبود ATP به تنهایی برای ایجاد نکروز کافی نیست.
• تولید گونه های فعال اکسیژن (اکسیژن منفرد، آنیون رادیکال سوپراکسید، آنیون هیدروکسیل، پراکسید هیدروژن و غیره) به طور مداوم در سلول های زنده رخ می دهد. تعامل با لیپیدهای غشا، مولکولهای DNA، ایجاد استرس اکسیداتیو، گونههای فعال اکسیژن باعث افزایش نفوذپذیری غشا، مهار پمپهای کاتیونی، تقویت کمبود ATP و کلسیم اضافی داخل سلولی میشود که منجر به ایجاد آسیب سلولی و بافتی میشود. گونه های فعال اکسیژن بیشترین نقش را در پاتوژنز نکروز پنوموسیت در سندرم دیسترس نوزادان ایفا می کنند که در نتیجه اکسیژن درمانی، آسیب های خونرسانی مجدد در انفارکتوس میوکارد و نکروز سلول های کبدی در صورت مصرف بیش از حد پاراستامول ایجاد می شود.
• اختلالات هموستاز کلسیم با تجمع کلسیم داخل سلولی در سلول های در حال مرگ مشخص می شود. در سلولهای زنده، غلظت یونهای کلسیم در داخل سلول حدود هزار برابر کمتر از سلولهای خارج سلولی است. تغییرات اولیه در صورت آسیب با نقص عملکرد پمپ های کاتیونی به دلیل کمبود ATP همراه است. در این مورد، کلسیم در داخل سلول ها، عمدتاً در میتوکندری، تجمع می یابد. فعال شدن پروتئازها و فسفولیپازهای وابسته به Ca2 + رخ می دهد که منجر به آسیب غیرقابل برگشت به غشاها (میتوکندری، سیتوپلاسمی)، به نقض حتی بیشتر نفوذپذیری آنها و مرگ سلولی می شود.
از دست دادن توانایی نفوذ انتخابی به غشاهای سیتوپلاسمی یکی از موارد است ویژگی های مشخصهنکروز در معرض کمپلمان، عفونت های ویروسی و آسیب هیپوکسیک. در این حالت، آسیب به پروتئین های گذرنده، گیرنده ها و سیستم های آنزیمی که عبور برخی از مواد به داخل سلول را تنظیم می کنند، رخ می دهد. هنگامی که در معرض مکمل و پرفورین قرار می گیرند، پروتئین پلیمرازها در غشای سیتوپلاسمی گنجانده می شوند. ویروسهای لیتیک همچنین با لیپیدهای غشاء تعامل میکنند، پروتئینهای کپسید ویروسی را در آنها ترکیب میکنند، که منجر به تخریب غشاهای سیتوپلاسمی در لحظه خروج ویروس از سلول آلوده میشود. در سلول هایی که تحت ایسکمی قرار گرفته اند، محل پروتئین های گذرنده با تشکیل مهر و موم های پروتئین مشخصه "هیپوکسیک" مختل می شود.
مورفوژنز نکروزفرآیند نکروز از چندین مرحله مورفوژنتیک عبور می کند: پارانکروز، نکروز، مرگ سلولی، اتولیز.
پارانکروز - مشابه تغییرات نکروزه، اما برگشت پذیر.
نکروبیوز تغییرات دیستروفیک برگشت ناپذیر است که با غلبه واکنش های کاتابولیک بر واکنش های آنابولیک مشخص می شود.
مرگ یک سلول که زمان بندی آن دشوار است.
اتولیز - تجزیه یک بستر مرده تحت تأثیر آنزیم های هیدرولیتیک سلول های مرده و سلول های نفوذ التهابی.
برای تعیین مرگ سلولی، اغلب از معیارهای مورفولوژیکی استفاده می شود. چنین معیارهای قابل اعتمادی برای برگشت ناپذیری آسیب سلولی در EM، رسوب در میتوکندری رسوبات الکترونی متراکم حاوی پروتئین ها و نمک های کلسیم و تخریب غشای داخلی آنها است. در SM، تغییرات در ساختار سلول تنها در مرحله اتولیز قابل مشاهده است. بنابراین، صحبت در مورد علائم میکروسکوپی نکروز، ما در واقع در مورد تغییرات مورفولوژیکی در مرحله اتولیز صحبت می کنیم.
مورفولوژی نکروز
علائم ماکروسکوپی نکروز
در همه اشکال نکروز، تغییر در رنگ، قوام و در برخی موارد بوی بافت های نکروزه رایج است. بافت نکروزه می تواند قوام متراکم و خشک داشته باشد که با نکروز انعقادی مشاهده می شود. در این حالت، بافت ممکن است مومیایی شود. در موارد دیگر، بافت مرده شل است، حاوی مقدار زیادی مایع است و دچار میومالاسی (از یونانی malakas - نرم) می شود. به چنین نکروزی تضاد در قوام گفته می شود. رنگ تودههای نکروزه بستگی به وجود ناخالصیهای خون و رنگدانههای مختلف دارد و همچنین به دلیل ایجاد ناحیه التهاب مرزی است که رنگ قرمز مایل به قهوهای دارد در مرز بین بافت مرده و زنده. بافت مرده سفید یا مایل به زرد است که اغلب توسط یک تاج قرمز مایل به قهوه ای احاطه شده است. هنگامی که توده های نکروز با خون اشباع می شوند، می توانند رنگی از قرمز تا قهوه ای، زرد و سبز (بسته به غلبه رنگدانه های هموگلوبین خاص در آنها) به دست آورند. در برخی موارد، کانون های نکروز با صفرا رنگ می شوند. هنگامی که بافت مرده پوسیده می شود، بوی بد مشخصی متصاعد می کند. در رنگ، حمله قلبی می تواند سفید (طحال، مغز)، سفید با تاج هموراژیک (قلب، کلیه ها) و قرمز (هموراژیک) باشد. تاج هموراژیک به دلیل ناحیه التهاب مرزی ایجاد می شود که به طور طبیعی در مرز بافت های مرده و زنده ایجاد می شود. رنگ قرمز حمله قلبی به دلیل اشباع بافت های نکروزه با خون است، همانطور که در مورد انفارکتوس ریه در پس زمینه توده وریدی مزمن وجود دارد.
علائم مورفولوژیکی نکروز
قبل از نکروز یک دوره نکروبیوز وجود دارد که بستر مورفولوژیکی آن تغییرات دیستروفیک است.
الف. تغییرات اولیه:در دوره اولیه نکروز، سلول از نظر مورفولوژیکی تغییر نمی کند. 1-3 ساعت طول می کشد تا تغییرات در میکروسکوپ الکترونی یا هیستوشیمی ظاهر شود و حداقل 6-8 ساعت قبل از ظاهر شدن تغییرات در میکروسکوپ نوری. حتی بعداً، تغییرات ماکروسکوپی ایجاد می شود. به عنوان مثال، اگر بیمار مبتلا به انفارکتوس میوکارد چند دقیقه پس از شروع حمله آنژین (دردی با جریان خون ناکافی به میوکارد) بمیرد، کالبد شکافی هیچ مدرک ساختاری دال بر نکروز را نشان نخواهد داد. اگر مرگ در روز دوم پس از حمله حاد رخ دهد، تغییرات آشکار خواهد بود.
ب- تغییرات هیستوشیمیایی:هجوم یون های کلسیم به سلول با آسیب غیر قابل برگشت و ظهور تظاهرات مورفولوژیکی نکروز همراه است. در یک سلول طبیعی، غلظت کلسیم درون سلولی تقریباً 001/0 غلظت آن در مایع خارج سلولی است. این گرادیان توسط غشای سلولی پشتیبانی می شود که به طور فعال یون های کلسیم را به خارج از سلول منتقل می کند. به طور تجربی ثابت شده است که وقتی سلول ها در نتیجه ایسکمی یا تحت تأثیر عوامل سمی مختلف آسیب می بینند، تجمع کلسیم در داخل سلول ها تنها زمانی مشاهده می شود که تغییرات غیرقابل برگشت باشد. کلسیم اندونوکلئازها (هیدرولیز، برش DNA)، فسفولیپازها (تخریب غشاها) و پروتئازها (تخریب، هضم اسکلت سلولی) را فعال می کند. افزایش فعالیت آنها با روش های هیستوشیمیایی تشخیص داده می شود. فعالیت آنزیم های ردوکس (به عنوان مثال سوکسینات دهیدروژناز) به شدت کاهش می یابد یا ناپدید می شود.
ب. تغییرات در هسته:تغییرات در هسته بهترین شواهد نکروز سلولی است. کروماتین سلول مرده به صورت توده های بزرگ متراکم می شود و هسته از نظر حجم کم می شود، منقبض می شود، متراکم می شود، به شدت بازوفیل می شود، یعنی به رنگ آبی تیره با هماتوکسیلین رنگ آمیزی می شود. این فرآیند نامیده می شود کاریوپیکنوز (چروک شدن).سپس هسته پیکنوز می تواند به ذرات بازوفیلیک متعددی پاره شود. کاریورکسیسیا در نتیجه عمل لیزوزومی دئوکسی ریبونوکلئاز لیز (انحلال) می شوند. (کاریولیز). سپس حجم آن افزایش می یابد، با هماتوکسیلین ضعیف می شود، خطوط هسته به تدریج از بین می رود. با نکروز به سرعت در حال توسعه، هسته بدون مرحله pyknotic لیز می شود.
د) تغییرات سیتوپلاسمی:تقریباً 6 ساعت پس از اینکه سلول دچار نکروز شد، سیتوپلاسم آن یکنواخت و به شدت اسیدوفیل می شود، یعنی با رنگ های اسیدی شدید، به عنوان مثال، هنگامی که با ائوزین رنگ می شود، رنگ آمیزی می شود. این اولین تغییری است که توسط میکروسکوپ نوری شناسایی می شود که در نتیجه انعقاد پروتئین های سیتوپلاسمی و تخریب (ناپدید شدن) ریبوزوم ها رخ می دهد. RNA ریبوزوم یک رنگ بازوفیلیک به سیتوپلاسم طبیعی می دهد. اندامک های سلولی تخصصی، مانند میوفیبریل ها در سلول های میوکارد، اولین کسانی هستند که ناپدید می شوند. تورم میتوکندری و تخریب (تخریب) غشاهای اندامک باعث واکوئل شدن سیتوپلاسم می شود. در نهایت، هضم یک سلول توسط آنزیم هایی که از لیزوزوم های خود آزاد می شوند، باعث لیز سلولی (اتولیز) می شود. بنابراین، در سیتوپلاسم رخ می دهد انعقاد پروتئین ها، معمولا با آنها جایگزین می شود برخورد
E. تغییرات در ماده بین سلولیهم ماده بینابینی و هم ساختارهای فیبری را پوشش می دهد. اغلب، تغییرات مشخصه نکروز فیبرینوئید ایجاد می شود: الیاف کلاژن، الاستیک و رتیکولین به توده های صورتی متراکم، همگن، گاهی اوقات بازوفیل تبدیل می شوند که می توانند دچار تکه تکه شدن، تجزیه توده ای یا لیز شوند. در موارد کمتر، ممکن است ادم، لیز و مخاط ساختارهای فیبری وجود داشته باشد که مشخصه نکروز برخوردی است.
اشکال بالینی و مورفولوژیکی نکروز
نکروز با تغییرات بالینی و مورفولوژیکی مختلف ظاهر می شود. تفاوت ها به ویژگی های ساختاری و عملکردی اندام ها و بافت ها، سرعت و نوع نکروز و همچنین دلایل وقوع آن و شرایط توسعه بستگی دارد. در میان اشکال بالینی و مورفولوژیکی نکروز مشخص می شود انعقاد (خشک)نکروز و برخورد (تر)نکروز
الف. نکروز انعقادی (خشک):با این نوع نکروز، سلول های مرده شکل خود را برای چند روز حفظ می کنند. سلول های فاقد هسته مانند توده ای از سیتوپلاسم منعقد، همگن و صورتی به نظر می رسند.
مکانیسم نکروز انعقادی به اندازه کافی روشن نیست. انعقاد پروتئین های سیتوپلاسمی آنها را در برابر عمل آنزیم های لیزوزومی مقاوم می کند و بنابراین مایع شدن آنها را کند می کند.
نکروز انعقادی معمولا در رخ می دهد اندام های غنی از پروتئین و فقیر در مایعات به عنوان مثال، در کلیه ها، میوکارد، غدد فوق کلیوی، طحال، معمولا در نتیجه گردش خون ناکافی و بی اکسیژنی، اثر عوامل فیزیکی، شیمیایی و سایر عوامل آسیب رسان، به عنوان مثال، نکروز انعقادی سلول های کبدی با آسیب ویروسی یا با اثر عوامل سمی با منشا باکتریایی و غیر باکتریایی. نکروز انعقادی همچنین به نام خشک زیرا با این واقعیت مشخص می شود که نواحی مرده حاصل خشک، متراکم، متلاشی، سفید یا زرد هستند.
نکروز انعقادی شامل:
- حمله قلبی - تنوع نکروز عروقی (ایسکمیک). اندام های داخلی (به جز مغز - سکته). این شایع ترین نوع نکروز است.
- کیسی (پنیردار)نکروز همچنین با سل، سیفلیس، جذام و همچنین با لنفوگرانولوماتوز ایجاد می شود. به آن اختصاصی نیز می گویند، زیرا اغلب با گرانولوم های عفونی خاص یافت می شود. در اندام های داخلی، ناحیه محدودی از بافت خشک، متلاشی و زرد مایل به زرد آشکار می شود. در گرانولوم های سیفلیس، اغلب چنین مناطقی فرو ریخته نیستند، بلکه خمیری هستند و یادآور چسب عربی هستند. این یک نوع مختلط (یعنی خارج و داخل سلولی) نکروز است که در آن پارانشیم و استروما (هر دو سلول و فیبرها) به طور همزمان می میرند. از نظر میکروسکوپی، چنین محل بافتی بدون ساختار، همگن، رنگ آمیزی با هماتوکسیلین و ائوزین به رنگ صورتی است، توده های کروماتین هسته ای (کاریورکسیس) به وضوح قابل مشاهده است.
- نکروز مومی یا زنکر(نکروز عضلانی، اغلب دیواره قدامی شکم و ران، با عفونت های شدید - حصبه و تیفوس، وبا).
- نکروز فیبرینوئید- نوعی نکروز بافت همبند، که قبلاً به عنوان نتیجه تورم فیبرینوئید مورد مطالعه قرار گرفته است، اغلب در بیماری های آلرژیک و خود ایمنی (به عنوان مثال، روماتیسم، آرتریت روماتوئید و لوپوس اریتماتوز سیستمیک) مشاهده می شود. فیبرهای کلاژن و ماهیچه های صاف غشای میانی رگ های خونی به شدت آسیب می بینند. نکروز فیبرینوئیدی شریان ها در فشار خون بدخیم مشاهده می شود. نکروز فیبرینوئید با از دست دادن ساختار طبیعی و تجمع مواد نکروزه همگن صورتی روشن که از نظر میکروسکوپی شبیه فیبرین است مشخص می شود. توجه داشته باشید که اصطلاح "فیبرینوئید" با اصطلاح "فیبرینوس" متفاوت است، زیرا دومی به تجمع فیبرین، به عنوان مثال، در هنگام لخته شدن خون یا التهاب اشاره دارد. نواحی نکروز فیبرینوئید حاوی مقادیر مختلفی از ایمونوگلوبولین ها و مکمل، آلبومین، کلاژن و محصولات تجزیه فیبرین هستند.
- نکروز چربی:
1. نکروز چربی آنزیمی: نکروز چربی اغلب در پانکراتیت حاد و آسیب به پانکراس رخ می دهد، زمانی که آنزیم های پانکراس از مجاری به بافت اطراف آزاد می شوند. لیپاز لوزالمعده روی تری گلیسیریدها در سلول های چربی عمل می کند و آنها را به گلیسرول و اسیدهای چرب تجزیه می کند که با یون های کلسیم پلاسما تعامل می کنند و صابون های کلسیمی را تشکیل می دهند. در همان زمان، پلاکها و گرههای مات و سفید (مانند گچ) (استاتونکروز) در بافت چربی اطراف پانکراس ظاهر میشوند.
با پانکراتیت، لیپاز ممکن است وارد جریان خون شود، به دنبال آن انتشار گسترده ای ایجاد می شود، که علت نکروز چربی در بسیاری از قسمت های بدن است. بافت چربی زیر جلدی و مغز استخوان اغلب آسیب دیده است.
2. نکروز چربی غیر آنزیمی: نکروز چربی غیر آنزیمی در غده پستانی، بافت چربی زیر جلدی و در حفره شکمی مشاهده می شود. اکثر بیماران سابقه تروما دارند. نکروز چربی غیر آنزیمی به عنوان نکروز چربی تروماتیک نیز شناخته می شود، حتی اگر تروما به عنوان علت زمینه ای شناخته نشود. نکروز چربی غیر آنزیمی باعث ایجاد یک پاسخ التهابی می شود که با حضور ماکروفاژهای متعدد با سیتوپلاسم کف آلود، نوتروفیل ها و لنفوسیت ها مشخص می شود. به دنبال آن فیبروز ایجاد می شود و تشخیص این فرآیند از تومور دشوار است.
- قانقاریا (از یونانی گانگرانا- آتش) : این یک نکروز بافتی است که با محیط خارجی ارتباط برقرار می کند و تحت تأثیر آن تغییر می کند. اصطلاح "گانگرن" به طور گسترده برای نشان دادن یک وضعیت بالینی و مورفولوژیکی استفاده می شود که در آن نکروز بافت اغلب توسط یک عفونت باکتریایی ثانویه با شدت متفاوت پیچیده می شود یا در تماس با محیط خارجی، دچار تغییرات ثانویه می شود. بین خشک، مرطوب، گانگرن گازی و زخم بستر تمایز قائل شوید.
1. گانگرن خشک - این نکروز بافت ها در تماس با محیط خارجی است که بدون مشارکت میکروارگانیسم ها انجام می شود. قانقاریا خشک اغلب در اندام ها در نتیجه نکروز بافت انعقادی ایسکمیک رخ می دهد. بافت های نکروزه سیاه، خشک به نظر می رسند و به وضوح از بافت زنده مجاور جدا می شوند. در مرز با بافت های سالم، التهاب مرزی رخ می دهد. تغییر رنگ به دلیل تبدیل رنگدانه های هموگلوبینوژن در حضور سولفید هیدروژن به سولفید آهن است. نمونه ها هستند گانگرن خشک :
اندام های با آترواسکلروز و ترومبوز شریان های او ( گانگرن آترواسکلروتیک آندرتریت محو کننده؛
با سرمازدگی یا سوختگی؛
انگشتان مبتلا به بیماری رینود یا بیماری ارتعاشی؛
پوست مبتلا به تیفوس و سایر عفونت ها.
درمان شامل برداشتن بافت مرده با جراحی است که خط مرزی به عنوان نقطه مرجع عمل می کند.
2. گانگرن مرطوب : در نتیجه لایه بندی روی تغییرات بافت نکروز یک عفونت شدید باکتریایی ایجاد می شود. تحت تأثیر آنزیم های میکروارگانیسم ها، برخورد ثانویه رخ می دهد. لیز یک سلول توسط آنزیم هایی که در خود سلول ایجاد نمی شوند، بلکه از خارج نفوذ می کنند، نامیده می شود. هترولیز... نوع میکروارگانیسم بستگی به محل گانگرن دارد. قانقاریای مرطوب معمولاً در بافت های غنی از رطوبت ایجاد می شود. این می تواند در اندام ها رخ دهد، اما اغلب در اندام های داخلی، به عنوان مثال، در روده ها با انسداد شریان های مزانتریک (ترومبوز، آمبولی)، در ریه ها به عنوان یک عارضه ذات الریه (آنفولانزا، سرخک). کودکانی که در اثر یک بیماری عفونی (معمولا سرخک) ضعیف شده اند ممکن است دچار قانقاریای مرطوب بافت نرم گونه ها، پرینه، شوند که به آن noma (از یونانی) می گویند. نام- سرطان آب). التهاب حاد و رشد باکتری باعث می شود که ناحیه نکروزه ادموز و قرمز مایل به سیاه و با مایع شدن گسترده بافت مرده شود. در قانقاریای مرطوب، التهاب نکروزان گسترش می یابد که به وضوح محدود به بافت سالم مجاور نیست و بنابراین درمان جراحی آن دشوار است. در نتیجه فعالیت حیاتی باکتری ها، بوی خاصی به وجود می آید. میزان مرگ و میر بسیار بالاست.
3. گانگرن گازی : به عنوان مثال، قانقاریا گازی زمانی رخ می دهد که زخم به فلور بی هوازی آلوده شود کلستریدیوم پرفرنجنسو سایر میکروارگانیسم های این گروه. مشخصه آن نکروز بافتی گسترده و تشکیل گاز در نتیجه فعالیت آنزیمی باکتری ها است. تظاهرات اصلی شبیه قانقاریا مرطوب است، اما با حضور اضافی گاز در بافت ها. کرپتاسیون (ترق زدن هنگام لمس) یک علامت بالینی شایع در گانگرن گازی است. میزان مرگ و میر نیز بسیار بالاست.
4. زخم بستر (دکوبیتوس): به عنوان یک نوع گانگرن، زخم های دکوبیتوس متمایز می شوند - نکروز نواحی سطحی بدن (پوست، بافت های نرم)، که در معرض فشرده سازی بین تخت و استخوان هستند. بنابراین، زخم بستر اغلب در ناحیه ساکروم، فرآیندهای خاردار مهره ها، تروکانتر بزرگتر استخوان ران ظاهر می شود. در پیدایش آن، نکروز تروفونورتیک است، زیرا عروق و اعصاب فشرده می شوند، که باعث تشدید اختلالات تروفیسم بافتی در بیماران شدیداً بیمار می شود که از بیماری های قلبی عروقی، انکولوژیک، عفونی یا عصبی رنج می برند.
ب. نکروز برخوردی (تر):با ادغام بافت مرده مشخص می شود. در بافت هایی که از نظر پروتئین نسبتاً فقیر و غنی از مایع هستند رشد می کند، جایی که شرایط مطلوبی برای آن وجود دارد فرآیندهای هیدرولیتیک . لیز سلولیدر نتیجه عمل آنزیم های خود رخ می دهد ( اتولیز). یک مثال معمولی از نکروز برخورد مرطوب تمرکز نرم شدن خاکستری (انفارکتوس ایسکمیک) مغز است.
انفارکتوس مغزی اغلب نرم کننده نامیده می شود، زیرا اصلی است ماکروسکوپی نشانه کاهش خاصیت ارتجاعی بافت مغز در کانون ضایعه در هر زمان است. در روز اول، با یک ناحیه به طور نامشخص محدود از رنگ مایل به آبی، در لمس نرم نشان داده می شود. در پایان روز اول، تمرکز واضح تر می شود و رنگ پریده می شود. در روزهای بعد، ماده مغزی در این ناحیه شلتر میشود، رنگ آن مایل به زرد یا حتی با رنگ سبز میشود. در هفته های اول حجم مغز به دلیل ادم آن اندکی افزایش می یابد. بعد از 1-1.5 ماه. در محل انفارکتوس، یک حفره کاملاً مشخص تشکیل می شود که حاوی مایع کدر و ریزه است. تعیین زمان دقیق حمله قلبی نه تنها از نظر ظاهری، بلکه از نظر تصویر بافت شناسی نیز بسیار دشوار است.
بطور میکروسکوپیک بافت مغز وقتی با هماتوکسیلین و ائوزین رنگ آمیزی می شود، همگن، بدون ساختار، به رنگ صورتی است. تحلیل بافت مرده توسط ماکروفاژها انجام می شود که شبیه توپ های دانه ای چربی هستند.
تظاهرات بالینی نکروز
تظاهرات سیستمیک:با نکروز، تب معمولاً ظاهر می شود (به دلیل آزاد شدن مواد تب زا از سلول ها و بافت های نکروز) و لکوسیتوز نوتروفیل (به دلیل وجود یک واکنش التهابی حاد - التهاب مرزی). انتشار محتویات سلول های نکروزه: اجزای آزاد شده از محتوای سیتوپلاسمی سلول های نکروز (به عنوان مثال، آنزیم ها) وارد جریان خون می شوند، جایی که حضور آنها برای تعیین محل نکروز ارزش تشخیصی دارد. این آنزیم ها را می توان با روش های مختلف آزمایشگاهی تشخیص داد. ویژگی ظاهر آنزیم ها به محلی سازی ترجیحی آنزیم در بافت های مختلف بدن بستگی دارد. به عنوان مثال، افزایش سطح ایزوآنزیم CF کراتین کیناز مشخصه نکروز میوکارد است، زیرا این آنزیم فقط در سلول های میوکارد یافت می شود. افزایش سطح آسپارتات آمینوترانسفراز (AST) کمتر اختصاصی است، زیرا این آنزیم نه تنها در میوکارد، بلکه در کبد و سایر بافت ها نیز یافت می شود. ظاهر ترانس آمینازها مشخصه نکروز سلولی کبد است.
تظاهرات محلی:زخم غشای مخاطی دستگاه گوارش می تواند با خونریزی یا خونریزی (به عنوان مثال، زخم معده خونریزی دهنده) عارضه داشته باشد. افزایش حجم بافت در نتیجه ادم می تواند منجر به افزایش جدی فشار در یک فضای محدود شود (به عنوان مثال، در حفره جمجمه با نکروز ایسکمیک یا هموراژیک).
اختلال عملکرد:نکروز منجر به نارسایی عملکردی اندام می شود، به عنوان مثال، بروز نارسایی حاد قلبی در نتیجه نکروز (انفارکتوس) گسترده میوکارد (بیماری ایسکمیک حاد قلبی). شدت تظاهرات بالینی به نوع، حجم بافت آسیب دیده نسبت به مقدار کل آن و حفظ عملکرد بافت زنده باقیمانده بستگی دارد. نکروز در یک کلیه باعث نارسایی کلیه نمی شود، حتی زمانی که کل کلیه از بین برود، زیرا کلیه دیگر می تواند از دست دادن را جبران کند. با این حال، نکروز ناحیه کوچکی از قشر حرکتی منجر به فلج شدن گروه عضلانی مربوطه می شود.
نتیجه نکروز نکروز یک فرآیند برگشت ناپذیر است.در نسبتا مطلوب خروج از اطراف بافت مرده رخ می دهد التهاب واکنشی که بافت مرده را مشخص می کند. این التهاب نامیده می شود مرزبندی , و منطقه تحدید حدود - منطقه مرزی در این ناحیه، رگ های خونی گشاد می شوند، توده ها، ادم، تعداد زیادی لکوسیت ظاهر می شوند که آنزیم های هیدرولیتیک را آزاد می کنند و توده های نکروزه را ذوب می کنند. توده های نکروزه توسط ماکروفاژها جذب می شوند. به دنبال این، سلول های بافت همبند تکثیر می شوند که جایگزین یا رشد بیش از حد محل نکروز می شود. وقتی توده های مرده را با بافت همبند جایگزین می کنند، از آنها صحبت می کنند سازمان . در محل نکروز در چنین مواردی، جای زخم (اسکار در محل سکته قلبی). رشد بیش از حد ناحیه نکروز با بافت همبند منجر به آن می شود کپسوله سازی و... نمک های کلسیم می توانند در توده های مرده با نکروز خشک و در کانون نکروز که سازمان دهی شده اند، رسوب کنند. در این صورت توسعه می یابد کلسیفیکاسیون (تحجر) کانون نکروز . در برخی موارد، تشکیل استخوان در محل نکروز مشاهده می شود - استخوان سازی . با تحلیل ریزه های بافتی و تشکیل کپسول، که معمولا در نکروز مرطوب و اغلب در مغز یافت می شود، حفره ای در محل نکروز ظاهر می شود - کیست
نتیجه نامطلوب نکروز - ادغام چرکی (سپتیک) کانون نکروز. جداسازی - این تشکیل ناحیه ای از بافت مرده است که تحت اتولیز قرار نمی گیرد، با بافت همبند جایگزین نمی شود و آزادانه در بین بافت های زنده قرار می گیرد. سکته معمولاً در استخوان هایی با التهاب مغز استخوان - استئومیلیت - رخ می دهد. یک کپسول متوالی و یک حفره پر از چرک در اطراف چنین جداسازی تشکیل می شود. اغلب، جداسازی از طریق فیستول از حفره خارج می شود، که تنها پس از آزاد شدن کامل بسته می شود. نوعی توقیف - جهش - پاره کردن انتهای انگشتان
معنی نکروز.این با ماهیت آن تعیین می شود - "مرگ محلی" و محرومیت از عملکرد چنین مناطقی، بنابراین، نکروز اندام های حیاتی، به ویژه مناطق بزرگ آنها، اغلب منجر به مرگ می شود. اینها انفارکتوس میوکارد، نکروز ایسکمیک مغز، نکروز قشر کلیه، نکروز پیشرونده کبد، پانکراتیت حاد، پیچیده با نکروز پانکراس هستند. اغلب، نکروز بافتی علت عوارض شدید بسیاری از بیماریها (پارگی قلب در هنگام میومالاسی، فلج در هنگام سکتههای هموراژیک و ایسکمیک، عفونت با زخمهای بزرگ بستر، مسمومیت ناشی از تأثیر محصولات پوسیدگی بافت بر روی بدن، به عنوان مثال، با قانقاریا اندام و غیره). تظاهرات بالینی نکروز می تواند بسیار متنوع باشد. فعالیت الکتریکی غیرطبیعی که در نواحی نکروز در مغز یا میوکارد رخ می دهد، می تواند منجر به تشنج یا آریتمی قلبی شود. نقض پریستالسیس در روده نکروزه می تواند باعث انسداد روده عملکردی (پویا) شود. خونریزی در بافت نکروزه به ندرت مشاهده می شود، به عنوان مثال، هموپتیزی (هموپتیزی) همراه با نکروز ریه.
آپوپتوزیس
آپوپتوز،یا مرگ برنامه ریزی شده سلولی ، فرآیندی است که توسط آن عوامل داخلی یا خارجی فعال کردن برنامه ژنتیکی رهبری به مرگ سلولی و حذف موثر آن از بافت.آپوپتوز- این مکانیسم مرگ سلولی است که دارای تعدادی ویژگی بیوشیمیایی و مورفولوژیکی متمایز از نکروز است.
آپوپتوز- این هست نوع خاص بیوشیمیایی مرگ سلولی که با فعال سازی مشخص می شود اندونوکلئازهای درون زا غیر لیزوزومی که تقسیم شد DNA هسته ایبه قطعات کوچک آپوپتوز مورفولوژیکیخود را نشان می دهد مرگ سلولهای منفرد و بهطور تصادفی ، که با تشکیل گرد همراه است، توسط یک غشاء احاطه شده است ثور ("جسم آپوپتوز")، که بلافاصله توسط سلول های اطراف فاگوسیتوز می شوند.
این یک فرآیند فرار است که در آن سلول های ناخواسته و معیوب از بدن خارج می شوند. او نقش بزرگی دارد در مورفوژنز و مکانیزمی برای کنترل دائمی اندازه اندام ها است. با کاهش آپوپتوز، تجمع سلولی رخ می دهد، به عنوان مثال - رشد تومور... با افزایش آپوپتوز، کاهش تدریجی تعداد سلول ها در بافت مشاهده می شود، به عنوان مثال - آتروفی .
تظاهرات مورفولوژیکی آپوپتوز
آپوپتوز دارای ویژگی های مورفولوژیکی متمایز خود در سطوح نوری- نوری و فراساختاری است. هنگامی که با هماتوکسیلین ائوزین رنگ آمیزی می شود، آپوپتوز در آن مشخص می شود تک سلولی یا گروه های کوچکی از سلول ها . سلول های آپوپتوز به صورت خوشه های گرد یا بیضی شکل سیتوپلاسم به شدت ائوزینوفیلیک با قطعات متراکم کروماتین هسته ای ظاهر می شوند. به عنوان کوچک شدن و تشکیل سلول اجسام آپوپتوز به سرعت اتفاق می افتد و به همان سرعت فاگوسیتوز می شوند، متلاشی می شوند یا به مجرای اندام پرتاب می شوند. آماده سازی بافت شناسی، در موارد شدت قابل توجه آن یافت می شود... بعلاوه آپوپتوز - بر خلاف نکروز - هرگز با یک واکنش التهابی همراه نیست، که شناسایی بافت شناسی آن را نیز پیچیده می کند.
ویژگی های مقایسه ای نکروز و آپوپتوز
| امضا کردن | آپوپتوز | نکروز |
| القاء | توسط محرک های فیزیولوژیکی یا پاتولوژیک فعال می شود | بسته به عامل آسیب رسان متفاوت است |
| شیوع | قفس تک | گروهی از سلول ها |
| تغییرات بیوشیمیایی | قطعه قطعه شدن DNA فرار توسط اندونوکلئازهای درون زا. لیزوزوم ها دست نخورده هستند. |
اختلال یا خاتمه تبادل یونی. آنزیم ها از لیزوزوم ها آزاد می شوند. |
| پوسیدگی DNA | تراکم داخل هسته ای با تقسیم شدن به قطعات | محلی سازی منتشر در یک سلول نکروزه |
| یکپارچگی غشای سلولی | ذخیره | نقض شده است |
| مرفولوژی | انقباض و تکه تکه شدن سلول برای تشکیل اجسام آپوپتوز با کروماتین فشرده | تورم و لیز سلول ها. |
| واکنش التهابی | خیر | معمولا وجود دارد |
| حذف سلول های مرده | جذب (فاگوسیتوز) توسط سلول های همسایه | جذب (فاگوسیتوز) توسط نوتروفیل ها و ماکروفاژها. |
علائم مورفولوژیکی به وضوح مشخص می شود میکروسکوپ الکترونی... سلولی که تحت آپوپتوز قرار می گیرد با ( مورفوژنز آپوپتوز ):
کوچک شدن سلولاندازه سلول کاهش می یابد. سیتوپلاسم متراکم تر می شود. اندامک هایی که نسبتاً طبیعی به نظر می رسند فشرده تر هستند.
فرض بر این است که اختلال در شکل و حجم سلول در نتیجه فعال شدن ترانس گلوتامیناز در سلول های آپوپتوز رخ می دهد. این آنزیم باعث ایجاد پیوند متقابل پیشرونده در پروتئین های سیتوپلاسمی می شود که منجر به تشکیل نوعی غشاء در زیر غشای سلولی می شود که شبیه به سلول های اپیتلیال کراتینه می شود.
تراکم کروماتیناین مشخصه ترین تظاهرات آپوپتوز است. کروماتین در اطراف محیط، زیر غشای هسته، متراکم می شود، با تشکیل توده های متراکم به وضوح مشخص با اشکال و اندازه های مختلف. از طرف دیگر، هسته را می توان به دو یا چند قطعه تقسیم کرد.
سازوکار تراکم کروماتینبه خوبی مطالعه شده است این تغییرات با برش DNA هستهای در محلهایی که نوکلئوزومها را به هم متصل میکنند، مرتبط است، که منجر به ایجاد تعداد زیادی قطعه میشود که در آن تعداد جفتهای باز بر 180-200 تقسیم میشود. این قطعات تصویر مشخصی از راه پله در طول الکتروفورز ارائه می دهند. این تصویر با تصویر نکروز سلولی، که در آن طول قطعات DNA متفاوت است، متفاوت است. تکه تکه شدن DNA در نوکلئوزوم ها تحت اثر یک اندونوکلئاز حساس به کلسیم اتفاق می افتد. اندونوکلئاز به طور دائم در برخی از سلول ها (به عنوان مثال، تیموسیت ها) یافت می شود، جایی که با ظهور کلسیم آزاد در سیتوپلاسم فعال می شود و در سلول های دیگر قبل از شروع آپوپتوز سنتز می شود. با این حال، هنوز مشخص نشده است که چگونه تراکم کروماتین پس از برش DNA توسط اندونوکلئاز رخ می دهد.
تشکیل حفره ها و اجسام آپوپتوز در سیتوپلاسم.در سلول آپوپتوز، ابتدا با تشکیل حفرهها، فرورفتگیهای سطحی عمیق ایجاد میشوند، که منجر به تکه تکه شدن سلول با تشکیل اجسام آپوپتوز احاطهشده با غشاء متشکل از سیتوپلاسم و اندامکهای متراکم، با یا بدون قطعات هستهای میشود.
فاگوسیتوز سلول ها یا اجسام آپوپتوز اطراف سلول های سالم یا پارانشیمی یا ماکروفاژها ... اجسام آپوپتوز به سرعت در لیزوزوم ها از بین می روند و سلول های اطراف یا مهاجرت می کنند یا تقسیم می شوند تا فضای خالی پس از مرگ سلول را پر کنند.
فاگوسیتوزاجسام آپوپتوز توسط ماکروفاژها یا سلول های دیگر توسط گیرنده های روی این سلول ها فعال می شوند که سلول های آپوپتوز را جذب و مصرف می کنند. یکی از این گیرنده های ماکروفاژها گیرنده ویترونکتین است که یک β 3 -اینتگرین است و فاگوسیتوز نوتروفیل های آپوپتوز را فعال می کند.
آپوپتوزدر موارد زیر شرکت می کند فرآیندهای فیزیولوژیکی و پاتولوژیک:
تخریب سلولی برنامه ریزی شده در طول جنین زایی (از جمله کاشت، اندام زایی) و دگردیسی علیرغم این واقعیت که آپوپتوز در طول جنین زایی همیشه بازتابی از "مرگ برنامه ریزی شده سلولی" نیست، این تعریف آپوپتوز به طور گسترده توسط محققان مختلف استفاده می شود.
دررفتگی اعضای وابسته به هورمون در بزرگسالان , به عنوان مثال، رد آندومتر در طول چرخه قاعدگی، آترزی فولیکولی در تخمدان ها در طول یائسگی، و پسرفت پستان پس از قطع شیردهی.
حذف برخی از سلول ها در طول تکثیر سلولی
مرگ تک تک سلول ها در تومورها، عمدتا در طول رگرسیون آن، بلکه در یک تومور به طور فعال در حال رشد است.
مرگ سلولی سیستم ایمنی , هر دو لنفوسیت های B و T، پس از تخلیه ذخایر سیتوکین ها، و همچنین مرگ سلول های T خود راکتیو در طول توسعه در تیموس.
آتروفی پاتولوژیک اندام های وابسته به هورمون، به عنوان مثال، آتروفی پروستات پس از اخته شدن و کاهش لنفوسیت ها در تیموس با درمان گلوکوکورتیکوئید.
آتروفی پاتولوژیک اندام های پارانشیمی پس از انسداد مجاری دفعی , آنچه در پانکراس و غدد بزاقی، کلیه ها مشاهده می شود.
مرگ سلولی ناشی از سلول های T سیتوتوکسیک , برای مثال، رد پیوند و بیماری پیوند در مقابل میزبان.
آسیب سلولی در برخی بیماری های ویروسی , به عنوان مثال، در هپاتیت ویروسی، زمانی که قطعاتی از سلول های آپوپتوز در کبد به عنوان اجسام کوچک کاونسیلمن یافت می شود.
مرگ سلولی تحت تأثیر عوامل مخرب مختلف، که قادر به ایجاد نکروز هستند، اما در دوزهای کوچک عمل می کنند، به عنوان مثال، زمانی که درجه حرارت بالا، اشعه یونیزان، داروهای ضد سرطان.
تنظیم آپوپتوز
آپوپتوز مرگ سلولی تحت کنترل ژنتیکی است ... در حال حاضر، تعداد زیادی ژن شناسایی شده اند که مواد لازم برای تنظیم آپوپتوز را رمزگذاری می کنند. بسیاری از این ژن ها از کرم های گرد گرفته تا حشرات و پستانداران در طول تکامل زنده مانده اند. برخی از آنها در ژنوم ویروس ها نیز یافت می شوند. بنابراین، فرآیندهای اصلی بیوشیمیایی آپوپتوز در سیستمهای آزمایشی مختلف (عمدتاً مطالعات روی کرمهای گرد و مگسها انجام میشود) یکسان است، بنابراین نتایج تحقیق میتواند مستقیماً به سایر سیستمها (به عنوان مثال بدن انسان) منتقل شود.
آپوپتوزقابل تنظیم است:
- عوامل خارجی ,
- مکانیسم های خودمختار .
الف- تأثیر عوامل خارجی.
آپوپتوز را می توان با عمل بسیاری از عوامل خارجی تنظیم کرد آسیب DNA... در غیر قابل جبران آسیب DNA با آپوپتوز سلول هایی که به طور بالقوه برای بدن خطرناک هستند از بین می روند. در این فرآیند نقش مهمی ایفا می کند ژن سرکوب کننده تومور p53 ... آپوپتوز نیز توسط عفونت های ویروسی، اختلال در رشد سلولی، آسیب سلولی و از دست دادن تماس با مواد بافتی اطراف یا پایه. آپوپتوز دفاع بدن در برابر تداوم سلول های آسیب دیده است که می تواند برای یک ارگانیسم چند سلولی خطرناک باشد.
وقتی بافت با هر کدام تحریک می شود میتوژن سلول های آن به حالت افزایش فعالیت میتوز می روند که لزوماً با مقداری همراه است فعال شدن آپوپتوز ... سرنوشت سلول های دختر، چه زنده بمانند و چه تحت آپوپتوز قرار گیرند، به این بستگی دارد نسبت فعال کننده ها و بازدارنده های آپوپتوز :
مهار کننده هاعبارتند از فاکتورهای رشد، ماتریکس سلولی، استروئیدهای جنسی، برخی پروتئین های ویروسی.
فعال کننده ها عبارتند از فقدان فاکتورهای رشد، از دست دادن پیوند با ماتریکس، گلوکوکورتیکوئیدها، برخی ویروس ها، رادیکال های آزاد، پرتوهای یونیزان.
هنگامی که در معرض فعال کننده ها قرار می گیرند یا عدم وجود مهار کننده ها رخ می دهد فعال سازی پروتئازهای درون زاو اندونوکلئاز . این منجر به تخریب اسکلت سلولی، تکه تکه شدن DNA و اختلال در عملکرد میتوکندری می شود. سلول کوچک می شود، اما غشای آن دست نخورده باقی می ماند، اما آسیب آن منجر به فعال شدن فاگوسیتوز می شود. سلول های مرده به قطعات کوچک احاطه شده در غشاء متلاشی می شوند که به عنوان اجسام آپوپتوز شناخته می شوند. هیچ پاسخ التهابی به سلول های آپوپتوز رخ نمی دهد .
ب. مکانیسم خودمختار آپوپتوز.
در طول رشد جنین، سه دسته آپوپتوز مستقل وجود دارد: مورفوژنتیک، هیستوژنتیک و فیلوژنتیک.
آپوپتوز مورفوژنتیک در تخریب پایه های مختلف بافتی شرکت می کند. نمونه ها عبارتند از:
- تخریب سلول ها در فضاهای بین دیجیتالی.
مرگ سلولی منجر به تخریب اپیتلیوم اضافی در طول همجوشی می شود فرآیندهای پالاتینهنگام تشکیل کام سخت
- مرگ سلولی در قسمت پشتی لوله عصبی در حین بسته شدن، که برای رسیدن به وحدت اپیتلیوم، دو طرف لوله عصبی و مزودرم مرتبط ضروری است.
اختلال در آپوپتوز مورفوژنتیک در این سه محل منجر به ایجاد به ترتیب سینداکتیلی، شکاف کام و اسپینا بیفیدا.
آپوپتوز هیستوژنتیک در هنگام تمایز بافت ها و اندام ها مشاهده می شود، که برای مثال، با تمایز وابسته به هورمون اندام های تناسلی از ابتدایی های بافت مشاهده می شود. بنابراین، در مردان، هورمونی توسط سلول های سرتولی در بیضه جنین سنتز می شود که باعث پسرفت مجاری مولر (که از آن لوله های فالوپ، رحم و قسمت بالاواژن) با آپوپتوز.
آپوپتوز فیلوژنتیک در حذف ساختارهای ابتدایی جنین، به عنوان مثال، پرونفروس شرکت می کند.
تحت شرایط مختلف، می توان آن را مشاهده کرد تسریع و کاهش آپوپتوز... با اينكه آپوپتوزبا این حال، می تواند توسط عوامل مختلف خاص برای انواع خاصی از سلول ها فعال شود مسیر نهایی آپوپتوز توسط ژن های کاملاً مشخص تنظیم می شود و بدون توجه به علت فعال شدن آپوپتوز رایج است.
همه عواملی که آپوپتوز را تقویت یا تضعیف می کنند می توانند عمل کنند
- به طور مستقیم به مکانیسم مرگ سلولی ,
- به طور غیر مستقیم با تأثیر در تنظیم رونویسی .
در برخی موارد، تأثیر این عوامل بر آپوپتوز تعیین کننده است (به عنوان مثال، چه زمانی آپوپتوز تیموسیت وابسته به گلوکوکورتیکوئید ) و در دیگران اهمیت خاصی ندارد (مثلاً چه زمانی آپوپتوز وابسته به Fas و TNF ). تعداد زیادی از مواد در فرآیند تنظیم شرکت می کنند که بیشترین مطالعه شده آنها موادی هستند که از آنها تهیه شده است خانواده ها bcl-2
Bcl-2 ژناولین بار به عنوان ژنی توصیف شد که در سلول های لنفوم فولیکولی جابجا می شود و آپوپتوز را مهار می کند. با تحقیقات بیشتر مشخص شد که Bcl-2 چند ژنی استکه حتی در کرم های گرد نیز یافت می شود. همچنین ژن های همولوگ در برخی از ویروس ها یافت شده است. تمام مواد متعلق به این کلاس به دو دسته تقسیم می شوند فعال کننده ها و بازدارنده های آپوپتوز .
به مهار کننده هامربوط بودن: bcl-2، bcl-xL، Mcl-1، bcl-w، آدنوویروس E1B 19K، Epstein-Barr ویروسی BHRF1.
به فعال کننده هامربوط بودن بکس، bak، Nbk / Bik1، Bad، bcl-xS.
اعضای این خانواده با یکدیگر تعامل دارند. یکی از سطوح تنظیم آپوپتوز یک تعامل است پروتئین-پروتئین... پروتئین های خانواده bcl-2 هم همو و هم هترودیمر را تشکیل می دهند. برای مثال، مهارکنندههای bcl-2 میتوانند با فعالکنندههای bcl-2 دیمر تشکیل دهند. بدین ترتیب زنده ماندن سلول به نسبت فعال کننده ها و بازدارنده های آپوپتوز بستگی دارد... به عنوان مثال، bcl-2 با bax تعامل دارد، در حالی که با شیوع اولی، زنده ماندن سلول افزایش مییابد و با افزایش دومی کاهش مییابد. علاوه بر این، پروتئین های خانواده bcl-2 می توانند با پروتئین هایی که به این سیستم تعلق ندارند، تعامل داشته باشند. به عنوان مثال، bcl-2 می تواند به R- متصل شود. راسکه آپوپتوز را فعال می کند. پروتئین دیگری، Bag-1، توانایی bcl-2 را برای مهار آپوپتوز افزایش می دهد.
اکنون به طور کلی پذیرفته شده است که ژن هاشرکت کننده در تنظیم رشد و توسعه تومورها (انکوژن ها و ژن های سرکوب کننده تومور ) بازی نقش نظارتی v القاء آپوپتوز این شامل:
انکوژن bcl-2 , که مهار می کندآپوپتوز ناشی از هورمون ها و سیتوکین ها، که منجر به افزایش زنده ماندن سلول می شود.
پروتئین bax (همچنین از خانواده bcl-2 ) دایمرها را تشکیل می دهد bax-bax , که باعث افزایش عملکرد فعال کننده های آپوپتوز می شود. نسبت bcl-2 به bax حساسیت سلول ها به عوامل آپوپتوز را تعیین می کند و یک "سوئیچ مولکولی" است که تعیین می کند رشد بافت یا آتروفی رخ دهد.
انکوژن c-myc , محصول پروتئینی که می تواند آپوپتوز یا رشد سلولی را تحریک کند (مثلاً در حضور سایر سیگنال های بقا، bcl-2)
ژن p53 , که به طور معمول آپوپتوز را فعال می کند (نوع وحشی - نوع وحشی)، اما با جهش (نوع جهش یافته - معمولاً بر روی آن است که مطالعات ایمونوهیستوشیمی در سلول های تومور انجام می شود، در این مورد، میزان نوع وحشی نادیده گرفته می شود، بر این اساس، یک پیش بینی رفتار بافت تومور ساخته شده است، یعنی مقدار زیادی محصول پروتئینی ژن p53 - پیش آگهی نامطلوب است، زیرا ما در مورد مهار آپوپتوز صحبت می کنیم) یا عدم وجود (که در برخی از تومورها یافت می شود) بقای سلولی را افزایش می دهد. . مشخص شده است که p53 برای آپوپتوز زمانی که سلول ها توسط پرتوهای یونیزان آسیب می بینند ضروری است، اما در طول آپوپتوز ناشی از گلوکوکورتیکوئیدها و در طول پیری لازم نیست.
کاهش آپوپتوز
محصول ژن p53 یکپارچگی ژنوم را در طول میتوز نظارت می کند. در صورت نقض یکپارچگی ژنوم سلول به آپوپتوزبرعکس، پروتئین bcl-2آپوپتوز را مهار می کند... بدین ترتیب، کمبود p53 یا bcl-2 اضافی منجر به تجمع سلولی می شود : این ناهنجاری ها در تومورهای مختلف دیده می شود. مطالعه عوامل تنظیم کننده آپوپتوز در ساخت داروهایی که باعث افزایش مرگ سلول ها در نئوپلاسم های بدخیم می شوند، اهمیت زیادی دارد.
بیماری های خود ایمنی ممکن است منعکس کننده ناهنجاری هایی در القای آپوپتوز در سلول های لنفاوی باشد که می توانند با آنتی ژن های خود واکنش نشان دهند. به عنوان مثال، با لوپوس اریتماتوز سیستمیک، نقض وجود دارد گیرنده های Fasروی سطح سلولی لنفوسیت ها، که منجر به فعال شدن آپوپتوز می شود. مقداری ویروس ها با مهار آپوپتوز سلول های آلوده بقای خود را افزایش می دهند. به عنوان مثال، ویروس اپشتین بار می تواند تبادل را تحت تاثیر قرار دهد bcl-2 .
تسریع آپوپتوز
تسریع آپوپتوز در سندرم نقص ایمنی اکتسابی (ایدز)، بیماریهای نوروتروفیک و برخی بیماریهای خونی که در آنها کمبود هر عنصر جسمی وجود دارد، ثابت شده است. در بیماری ایدز، ویروس نقص ایمنی می تواند فعال شود CD4گیرنده روی لنفوسیت های T غیر عفونی ، بنابراین آپوپتوز را تسریع می کند که منجر به تخلیه سلول های این نوع می شود.
اهمیت آپوپتوز در رشد بدن و فرآیندهای پاتولوژیک
آپوپتوز نقش مهمی در رشد پستانداران و فرآیندهای پاتولوژیک مختلف دارد. عملکرد bcl-2برای حفظ زنده ماندن لنفوسیت ها، ملانوسیت ها، اپیتلیوم روده و سلول های کلیه در طول رشد جنینی مورد نیاز است. bcl-x برای مهار مرگ سلولی در جنین زایی، به ویژه در سیستم عصبی مورد نیاز است. Bax برای آپوپتوز تیموسیت ها و حفظ زنده ماندن اسپرم در طول رشد آنها مورد نیاز است. p53 یک ژن سرکوب کننده تومور است، بنابراین نقش خاصی در جنین زایی ندارد، اما برای سرکوب رشد تومور ضروری است. در موشهای فاقد هر دو ژن p53، تمایل بسیار بالایی برای ایجاد تومورهای بدخیم در نتیجه اختلال کامل یا جزئی آپوپتوز سلولهای پیش سرطانی مشاهده شد. سنتز پیشرفته پروتئین رمزگذاری شده توسط ژن bcl-2 منجر به سرکوب آپوپتوز و بر این اساس، توسعه تومورها می شود. این پدیده در سلول های لنفوم فولیکولی سلول B یافت می شود.
در بیماری های لنفوپرولیفراتیو و بیماری مشابه لوپوس اریتماتوز سیستمیک در موش، اختلال عملکرد لیگاند Fas یا گیرنده Fas وجود دارد. افزایش سنتز لیگاند Fas می تواند از رد پیوند جلوگیری کند.
آپوپتوز بخشی است فرآیند پاتولوژیکهنگامی که سلول ها با آدنوویروس ها، HIV و ویروس های آنفولانزا آلوده می شوند. مهار آپوپتوز در طول تداوم عفونت، در دوره نهفته مشاهده می شود و با افزایش تکثیر آدنوویروس ها، احتمالا ویروس های هرپس، ویروس اپشتین بار و HIV، فعال شدن آپوپتوز مشاهده می شود که به گسترش گسترده ویروس کمک می کند. ، ارتباط مستقیم بین آپوپتوز و بسیاری از شرایط پاتولوژیک آشکار است. مطالعات مربوط به اختلال عملکرد بسیاری از ژنهایی که آپوپتوز را تنظیم میکنند، ایجاد مسیرهای کاملاً جدیدی در درمان این بیماریها را ممکن میسازد. توسعه از داروهاکه می تواند آپوپتوز را تنظیم کند، فرصت های جدیدی را در درمان تومورهای بدخیم باز می کند، عفونت های ویروسیبیماری های خاص سیستم عصبی، نقص ایمنی و بیماری های خود ایمنی. به عنوان مثال، برای تومورهای بدخیمو بیماری های لنفوپرولیفراتیو برای افزایش آپوپتوز لازم است و در بیماری هایی که با آسیب سلولی مشخص می شود، باید آن را ضعیف کرد.









