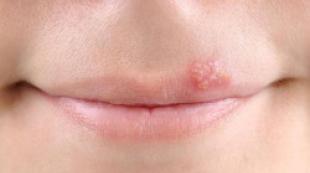
انواع انفارکتوس میوکارد. انفارکتوس میوکارد تحتانی چیست؟ پیشگیری از بیماری ایسکمیک قلبی
بازسازی بطن چپ پس از انفارکتوس حاد میوکارد.
بازسازی اولیه پس از انفارکتوس
فرآیند بازسازی اولیه LV پس از AMI شامل اختلال در توپوگرافی مناطق آسیب دیده و بدون آسیب است. در ناحیه آسیب دیده، گسترش ناحیه انفارکتوس با گسترش منطقه ای و نازک شدن ناحیه انفارکتوس در 24 ساعت اول از شروع بیماری رخ می دهد. گسترش انفارکتوس به طور قابل توجهی حجم و هندسه LV را تغییر می دهد، زمینه را برای تشکیل آنوریسم حاد و پارگی میوکارد فراهم می کند و یک بستر مهم برای گسترش حفره LV است. اتساع LV در دوره حاد انفارکتوس میوکارد را می توان به یک مکانیسم جبرانی نسبت داد که حجم سیستولیک را حفظ می کند و زمانی رخ می دهد که بیش از 20٪ میوکارد آسیب دیده باشد.
پیشگیری از بیماری ایسکمیک قلبی
سندرم آنتی فسفولیپید یا سندرم آنتی فسفولیپید با ترومبوز شریانی یا وریدی همراه است. این سندرم با اجسام آنتی فسفولیپیدی سرم که منجر به رویدادهای بالینی مانند شریانی یا ترومبوز وریدی... فراتر از انسداد سیستم شریانیانسداد ترومبوتیک عروق کرونر بسیار مهم است که منجر به حوادث تهدید کننده زندگی می شود.
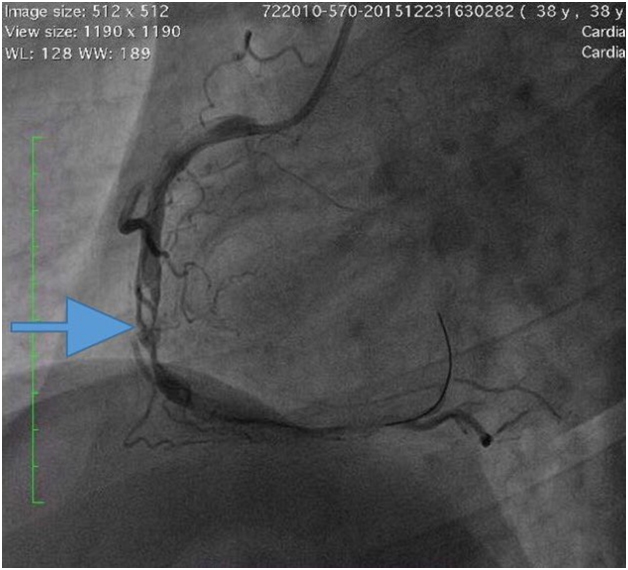
در اینجا یک مرد 38 ساله با سابقه سندرم آنتی فسفولیپید و ترومبوآمبولی ریویکه طی 4 ساعت در بیمارستان بستری شدند درد شدید v قفسه سینه... او قبلاً در مورد وارفارین درمانی مشاوره کرده بود، اما از وارفارین یا سایر داروها استفاده نکرد. او بیش از یک ماه درمان با وارفارین را ترک کرد. سطح حساس تروپونین T به طور قابل توجهی افزایش یافت. داده های فیزیکی عالی نبودند. پلاکت درمانی دوگانه آغاز شد. آنژیوگرافی تهاجمی عروق کرونر انسداد کامل شریان کرونر راست بعد از شاخه جانبی بطن راست را نشان داد.
نازک شدن جداری ناحیه آلوده LV نتیجه کاهش مقاومت میوکارد آسیب دیده در طول تنش سیستولیک با هر انقباض است و از طریق مکانیسم های مختلفی از جمله کشش میوسیت ها با کاهش قطر آنها و لغزش انجام می شود. میوسیت ها نسبت به یکدیگر
تنگی قابل توجهی در شریان نزولی قدامی چپ و شریان سیرکومفلکس مشاهده نشد. بیمار به بخش مراقبت های عروق کرونر منتقل شد. وارفارین با درمان ضد پلاکتی دوگانه شروع شد. 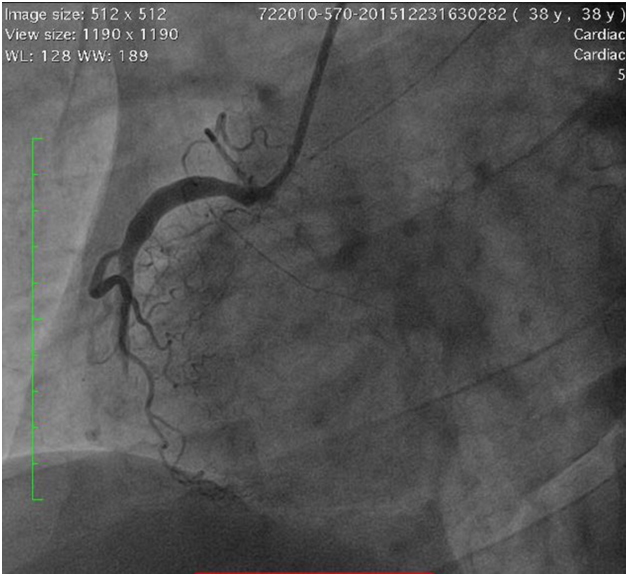
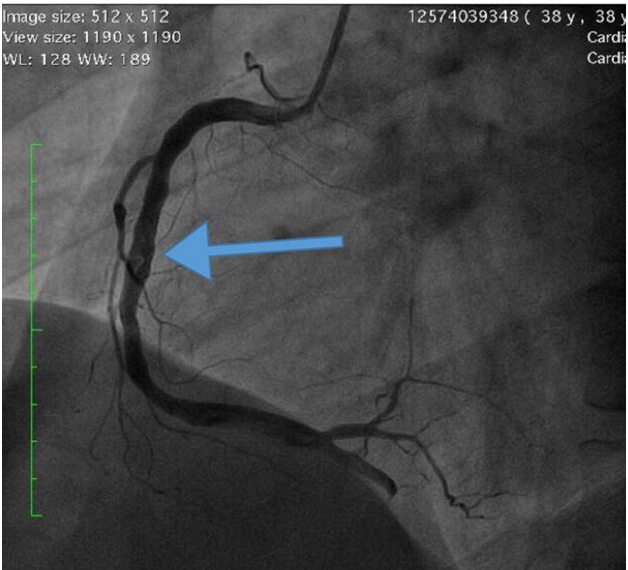
در بیماران جوان با خطر خونریزی کم باید درمان سه گانه به دارو اضافه شود. انفارکتوس حاد میوکارد تحتانی با تشکیل ترومبوز شدید در یک مرد جوان با سندرم آنتی فسفولیپید اولیه.
انبساط میوکارد عمدتاً با انفارکتوس های گسترده و ترانس مورال که ناحیه راس LV را درگیر می کند اتفاق می افتد. تعداد فزایندهای از محققین فرآیندهای بازسازی را که در میوکاردیوم تحت تأثیر دور از ناحیه نکروز اتفاق میافتد، توصیف میکنند. میوکارد دور از ناحیه انفارکتوس در معرض افزایش شدید استرس دیاستولیک میوکارد قرار می گیرد. همانطور که در بالا ذکر شد، با لغزش میوسیت ها نسبت به یکدیگر و هیپرتروفی آنها همراه است. هیپرتروفی میوکارد مشاهده شده ویژگی های فشار ترکیبی و اضافه بار حجمی را نشان می دهد.
شکل 1: الکتروکاردیوگرام 12 لید یک بیمار. درایوهای مختلف به نواحی خاصی از قلب نگاه می کنند. مجاورت به این معنا نیست که پشت سر هم از یکدیگر پیروی می کنند، بلکه به این معناست که به یک جنبه از قلب نگاه می کنند. بنابراین، هنگام طبقه بندی انفارکتوس میوکارد، دو یا چند نشانه ذکر شده است که معیارهای محل دقیق ایسکمی، آسیب یا انفارکتوس را برآورده می کند.
مهم است که به یاد داشته باشید که برخی از افراد دارای ناهنجاری هایی در آناتومی قلب خود هستند، بنابراین باید تشخیص داد که ممکن است برخی تغییرات وجود داشته باشد. با این حال، برای اکثریت جمعیت، نتایج خاصی وجود دارد که می توان برای هر منطقه گرفت. به طور کلی، نواحی تشریحی انفارکتوس تحتانی، قدامی، جانبی، سپتوم و خلفی هستند. همچنین درک این نکته مهم است که وقتی پزشک محل حمله قلبی را شناسایی میکند، دو موضوع جداگانه درگیر هستند.
استرس بالای میوکارد در قسمت دست نخورده میوکارد باعث ایجاد هیپرتروفی میوکارد و بازسازی محفظه در فاز مزمن پس از MI می شود. هیپرتروفی عضله قلب آسیب دیده یک پاسخ فیزیولوژیکی اولیه به آسیب میوکارد است که همراه با تغییرات در ناحیه آسیب دیده میوکارد است. اثرات مفید شروع فاز اولیه هیپرتروفی بطنی شامل عادی سازی عملکرد سیستولیک دیواره آسیب دیده و حفظ حجم سکته مغزی است. در عین حال، تأثیر طولانی مدت استرس بالای میوکارد به انتقال از هیپرتروفی عضله قلب به نارسایی آن کمک می کند.
انفارکتوس حاد میوکارد: انواع انفارکتوس میوکارد
- انتظار می رود شریان و شاخه های آن تامین کننده منطقه باشد.
- انگیزه هایی که در واقع به منطقه "نگاه می کنند".
انفارکتوس میوکارد قدامی
هنگامی که این اتفاق در شریان کرونر اصلی چپ رخ می دهد، اغلب به عنوان "خالق بیوه" نامیده می شود.انفارکتوس حاد میوکارد: انفارکتوس میوکارد جانبی قدامی
شریان کرونر چپ نیز سیرکومفلکس را تغذیه می کند. اغلب وجود دارد شوک قلبی... خون اکسیژن دار معمولاً از این محل به بطن چپ، سپتوم و شاخه های رباطی می رسد. بلوک های توزیع شده نیز رایج هستند. موضوع تمرکز: انفارکتوس حاد میوکارد.
تغییرات اولیه در حجم و هندسه LV پیامدهای پیش آگهی مهمی برای بیماران مبتلا به انفارکتوس میوکارد دارد. حتی افزایش نسبتاً کمی در حجم انتهای سیستولیک و انتهای دیاستولیک LV بعد از MI خطر مرگ را 4-5 برابر افزایش می دهد. کار انجام شده در موسسه قلب و عروق بالینی به نام Myasnikov و همچنین منابع دیگر نشان میدهند که حجم انتهای سیستولیک LV 1 ماه پس از AMI دقیقترین پیشبینیکننده بقا است که از مقدار کسر جهشی فراتر میرود.
انفارکتوس حاد میوکارد: انفارکتوس میوکارد جانبی
این می تواند با انفارکتوس میوکارد قدامی یا تحتانی اتفاق بیفتد. این منطقه تحویل نیز شامل یک دسته از آن و بلوک های شاخه های بسته است. معمولاً با انفارکتوس قدامی میوکارد دیده می شود.
انفارکتوس حاد میوکارد: انفارکتوس میوکارد در ماه سپتامبر
تشدید انفارکتوس میوکارد. شریان کرونری راست ناحیه مرتبط با انفارکتوس میوکارد تحتانی را از طریق شاخه نزولی خلفی تغذیه می کند.انفارکتوس حاد میوکارد: انفارکتوس میوکارد تحتانی
یکی دیگر از جنبه های قلب که ممکن است درگیر شود، بطن راست است. اگر فقط شاخه حاشیه سمت راست بسته شود، می توان محل انفارکتوس را در بطن راست جدا کرد. هنگامی که این اتفاق در نزدیکی این شاخه رخ می دهد، علائم هر دو بطن راست و قسمت پایینی قلب می تواند رخ دهد. کاهش برون ده قلبی را می توان در انفارکتوس بطن راست متوجه شد زیرا بطن راست مقدار خونی را که به خوبی کاهش می دهد پمپ نمی کند. سمت چپقلبها.
بازسازی دیررس پس از انفارکتوس با بازسازی دیررس پس از انفارکتوس، این فرآیند شامل باقی مانده میوکارد دست نخورده یا انقباضی می شود. در MI کانونی و غیر ترانسمورال کوچک، عملکرد و هندسه ممکن است در طول مرحله بهبودی به حالت عادی برگردد، در حالی که در MI گسترده و فرامورال، بازسازی پیشرونده با افزایش حجم بیشتر و اختلال بیشتر در هندسه LV صورت میگیرد. V تاریخ های اولیهپس از انفارکتوس میوکارد، تغییر شکل حفره LV به شکل فشرده سازی آن در منطقه انتقال از اسکار به میوکارد باقی مانده به دلیل استرس بیش از حد میوکارد در این ناحیه رخ می دهد. در مراحل بعدی فرآیند بازسازی، ناحیه انتقال از اسکار به میوکارد باقی مانده صاف می شود که با کروی شدن دیرهنگام LV آشکار می شود و منجر به اتساع دیررس آن می شود. علاوه بر این، افزایش دیررس در شاخص کروی سیستولیک از افزایش شاخص کروی دیاستولیک بیشتر است. بنابراین، بیضایی طبیعی دیاستول به سیستول با بازسازی دیررس پس از انفارکتوس کاهش می یابد. این منجر به کاهش نسبی حجم ضربه ای می شود که باید با افزایش انقباض میوسیت یا انبساط اضافی بطن جبران شود. اختلال پیشرونده تغییر پویا در پیکربندی همچنین میتواند بر پر شدن دیاستولیک تأثیر بگذارد، که بیشتر به کشش و شل شدن فعال میوسیتها وابسته میشود. اختلالات فوق الذکر در عملکرد سیستولیک و دیاستولیک مرتبط با تغییر در شکل و هندسه LV ممکن است در شروع علائم نارسایی احتقانی قلب نقش داشته باشد.
مشکل دیگر انفارکتوس بطن راست این است که حجم خون در بطن راست به دلیل کاهش عملکرد این محفظه تجمع می یابد. این پاسخ های پاتوفیزیولوژیک بیمار را به سوی سه گانه علائم «کلاسیک» سوق می دهد که با این روند بیماری مرتبط است. اینها عبارتند از: افت فشار خون، اتساع ورید ژوگولار و صداهای واضح ریه. این سه گانه همیشه در همه بیماران مبتلا به این مشکل وجود ندارد، اما در نظر گرفته شده است علامت مشخصهبرای انفارکتوس بطن راست برای این سیم ها، سمت چپ قفسه سینه به آن منتقل می شود سمت راستقفسه سینه
رفتن به صفحه: 1 2
کمی بیشتر بدانید
انفارکتوس حاد میوکارد
ریچارد سی پاسترناک، یوجین براونوالد، جوزف اس. آلپرت
سکته قلبی یکی از شایع ترین بیماری ها در کشورهای غربی است. در ایالات متحده، سالانه حدود 1.5 میلیون نفر با سکته قلبی ثبت می شوند. در انفارکتوس حاد میوکارد، حدود 35 درصد از بیماران می میرند و کمی بیش از نیمی از آنها قبل از مراجعه به بیمارستان می میرند. 15 تا 20 درصد دیگر از بیمارانی که تحت مرحله حاد انفارکتوس میوکارد قرار گرفته اند در سال اول جان خود را از دست می دهند. خطر افزایش مرگ و میر در بین افرادی که سکته قلبی داشته اند، حتی پس از 10 سال، 3.5 برابر بیشتر از افراد هم سن و سال، اما بدون سابقه انفارکتوس میوکارد است.
انفارکتوس میوکارد خلفی
انفارکتوس حاد میوکارد: انفارکتوس میوکارد خلفی
روش دیگر به نام back transillumination است. انفارکتوس حاد میوکارد: نور معکوس و آزمایش آینه ای. مطمئن شوید که در موسسه ای که متخصص سلامت تصمیم گرفته است در آن کار کند، از کدام یک استفاده می شود.این بیومارکرها به ارائه اطلاعات مهم در مورد تشخیص انفارکتوس حاد میوکارد کمک می کنند. معمولاً بلافاصله پس از ورود برای کمک پزشکی جمع آوری می شوند و بعد از 6 و 12 ساعت تکرار می شوند. میوگلوبین: به سرعت آزاد می شود و مدت کوتاهی پس از درد اولیه قفسه سینه در ادرار قابل تشخیص است. در عرض 48-72 ساعت به حالت عادی برگردید. ... مهم است که به بیمار کمک کنیم تا بفهمد "فشار" و "سفتی" "درد" هستند. همیشه از بیمار بپرسید که آیا این احساسات وجود دارد یا خیر زیرا می توانند به سرعت متوجه شوند که دردی وجود ندارد.
تصویر بالینی
اغلب بیماران مبتلا به انفارکتوس حاد میوکارد از درد شکایت دارند. در برخی بیماران آنقدر شدید است که آن را شدیدترین دردی که تا به حال تجربه کرده اند توصیف می کنند (فصل 4). درد شدید، منقبض و پارگی معمولاً در اعماق قفسه سینه ایجاد می شود و در طبیعت شبیه حملات معمول آنژین صدری است، اما شدیدتر و طولانی تر. به طور معمول، درد در ناحیه مرکزی قفسه سینه و / یا ناحیه اپی گاستر احساس می شود. در حدود 30 درصد از بیماران، به اندام های فوقانی، کمتر به شکم، پشت تابش می کند و فک پایین و گردن را می گیرد. درد می تواند حتی به پشت سر نیز سرایت کند، اما هرگز به زیر ناف نمی رسد. مواردی که درد در زیر فرآیند xiphoid موضعی است، یا زمانی که خود بیماران ارتباط درد با حمله قلبی را انکار می کنند، دلایل تشخیص اشتباه هستند.
علاوه بر این، برخی از جمعیت ها، به ویژه بیماران دیابتی و افراد مسن، ممکن است اصلاً درد نداشته باشند. برخی دیگر ممکن است درد غیر معمولی مانند حاد، دردهای کوبنده... هر کس به شیوه خود به درد، بحران و ترس واکنش نشان می دهد. همیشه مراقب یک بیمار غیرعادی باشید و سوالات مناسب را سریع و موثر بپرسید.
هنگامی که بیماران به دلیل ریتم برادی کاردی غش می کنند، به آن حمله استوکس-آدامز می گویند. بیمار ممکن است رنگ پریده به نظر برسد و احساس خنکی یا لختگی داشته باشد و تغییرات مهمی در علائمی مانند افت فشار خون، تاکی کاردی، برادی کاردی، افزایش تعداد تنفس و تب خفیف داشته باشد.
درد اغلب با ضعف، تعریق، حالت تهوع، استفراغ، سرگیجه، بیقراری همراه است. احساسات ناخوشایند معمولاً در هنگام استراحت و اغلب در صبح ظاهر می شوند. اگر درد در حین ورزش شروع شود، برخلاف حمله آنژین صدری، معمولاً پس از قطع شدن از بین نمی رود.
با این حال، درد همیشه وجود ندارد. در حدود 15 تا 20 درصد و ظاهراً حتی در درصد بیشتری از بیماران، انفارکتوس حاد میوکارد بدون درد است و چنین بیمارانی ممکن است اصلاً به دنبال کمک پزشکی نباشند. بیشتر اوقات انفارکتوس میوکارد بدون درد در بیماران ثبت می شود دیابت قندیو همچنین در افراد مسن. در بیماران مسن، انفارکتوس میوکارد با تنگی نفس ناگهانی ظاهر می شود که می تواند به ادم ریوی تبدیل شود. در موارد دیگر، انفارکتوس میوکارد، اعم از دردناک و بدون درد، با از دست دادن ناگهانی هوشیاری، احساس ضعف شدید، بروز آریتمی یا به سادگی افت شدید غیرقابل توضیح فشار خون مشخص می شود.
قوانین کمک های اولیه
هر دقیقه ای که بدون درمان مناسب می گذرد یک عضله قلب اضافی را می کشد. متخصصان مراقبت های بهداشتی باید نسبت به علائم، چه خاص و چه مبهم، هوشیار باشند. دیس ریتمی هایی را که با مداخلات مناسب رخ می دهد درمان کنید. با توجه به نیاز بیمار و خدمات ارائه شده توسط مرکز، از قلب و عروق استفاده کنید و در صورت نیاز بیمار را انتقال دهید. استفاده از نیتروگلیسیرین برای درد قفسه سینه یک روش استاندارد است. همیشه قبل از دادن نیتروگلیسیرین از طریق وریدی دسترسی داشته باشید.
معاینهی جسمی
در بسیاری از موارد، بیماران پاسخ غالب به درد قفسه سینه دارند. آنها بی قرار، آشفته هستند، سعی می کنند با حرکت در رختخواب، انقباض و کشش درد را تسکین دهند، سعی در ایجاد تنگی نفس یا حتی استفراغ دارند. بیماران در هنگام حمله آنژین صدری رفتار متفاوتی دارند. آنها تمایل دارند از ترس عود درد، وضعیت ثابتی بگیرند. رنگ پریدگی، تعریق و سردی اندام ها شایع هستند. درد رتروسترنال که بیش از 30 دقیقه طول می کشد و تعریق مشاهده شده نشان دهنده احتمال بالای انفارکتوس حاد میوکارد است. علیرغم اینکه بسیاری از بیماران نبض دارند و فشار خوندر محدوده طبیعی باقی می ماند، در حدود 25٪ از بیماران مبتلا به انفارکتوس میوکارد قدامی، تظاهرات واکنش بیش از حد سیستم عصبی سمپاتیک (تاکی کاردی و / یا فشار خون بالا) مشاهده می شود، و تقریبا در 50٪ از بیماران مبتلا به انفارکتوس میوکارد تحتانی، علائم افزایش تون. سیستم عصبی سمپاتیک (برادی کاردی و / یا افت فشار خون).
بیماران ممکن است به اثرات گشادکننده عروق این دارو با اثرات منفی مانند افت فشار خون واکنش نشان دهند. غیر معمول که فشار خونپس از نیتروگلیسیرین زیر زبانی یا آئروسل شده به طور قابل توجهی کاهش می یابد. اگر این اتفاق افتاد، برای خنثی کردن اثرات گشادکننده عروق، آماده باشید تا یک بولوس کوچک نرمال سالین تجویز کنید. دیگر اثرات جانبیعبارتند از سردردو تاکی کاردی رفلکس غیرعادی تر. این اثرات معمولاً به دلیل نیمه عمر کوتاه این دارو کوتاه مدت هستند.
ناحیه پیش کوردیال معمولاً بدون تغییر است. لمس ایمپالس آپیکال ممکن است دشوار باشد. تقریباً در 25٪ از بیماران مبتلا به انفارکتوس قدامی میوکارد، در روزهای اول بیماری، نبض سیستولیک تغییر یافته در ناحیه پری آپیکال تشخیص داده می شود که ممکن است به زودی ناپدید شود. سایر علائم فیزیکی اختلال عملکرد بطن چپ که می تواند در انفارکتوس حاد میوکارد رخ دهد، به ترتیب کاهش تعداد دفعات وقوع، به شرح زیر است: صداهای قلبی IV (S4) یا III (S3)، صداهای خفه شده قلب و به ندرت، تقسیم متناقض لحن دوم (فصل 177).
همچنین از بیماران در مورد استفاده از داروها برای اختلال نعوظ بپرسید، زیرا این ترکیب می تواند دوره های بسیار شدید افت فشار خون را ایجاد کند. تعدادی از این داروها نیز برای نتایج مفیدشان در زنان مورد استفاده قرار می گیرند یا در حال مطالعه هستند.
انفارکتوس حاد میوکارد: نتیجه گیری
شایع ترین علت این رویداد در جمعیت بزرگسال بیماری آترواسکلروتیک عروق کرونر است. نکات اصلی این فصل شامل موارد زیر است. نویسندگان هیچ تضاد منافع را برای محتوای منتشر شده افشا نمی کنند. بیماری های همراه او شامل فشار خون بالا و دیابت نوع 2 بود. نوار ریتم باینمینای همبند با فعال سازی دهلیزی رتروگراد را نشان می دهد.
سوفل سیستولیک گذرا در راس قلب که عمدتاً در نتیجه نارسایی ثانویه دریچه دهلیزی بطنی چپ ایجاد می شود. نارسایی میترال) به دلیل اختلال در عملکرد عضلات پاپیلاری، دارای ویژگی سیستولیک متوسط یا دیررس است. هنگام گوش دادن در بسیاری از بیماران مبتلا به انفارکتوس ترانس مورال میوکارد، هر از گاهی صدای اصطکاک پریکارد شنیده می شود. در بیماران مبتلا به انفارکتوس بطن راست، ضربان وریدهای ژوگولار متسع اغلب رخ می دهد، کاهش حجم نبض در شریان های کاروتید، با وجود طبیعی بودن، وجود دارد. برون ده قلبی... در هفته اول سکته حاد میوکارد، افزایش دمای بدن تا 38 درجه سانتیگراد امکان پذیر است، اما اگر دمای بدن از 38 درجه سانتیگراد بیشتر شود، باید به دنبال دلایل دیگری برای افزایش آن بود. مقدار فشار خون بسیار متفاوت است. در اکثر بیماران مبتلا به انفارکتوس ترانس مورال میوکارد، فشار خون سیستولیک 10-15 میلی متر جیوه کاهش می یابد. هنر از سطح اصلی
وضوح الگوی بروگادا نوع 1 بلافاصله پس از رفع ایسکمی مشاهده شد. هیچ سابقه خانوادگی شناخته شده ای از مرگ ناگهانی قلبی وجود نداشت و بنابراین احتمال بالینی پایین تاج و تخت برادر واقعی وجود داشت. تا به حال، دو سوم انفارکتوس میوکارد در الکتروکاردیوگرام تشخیص داده نشده است، اما اکنون "کاردیوژنومتری" را ارائه می دهد. روش جدیدپژوهش.
این تکنیک جدید نظرسنجی بلافاصله یک تهدید را نشان می دهد حمله قلبیو اقدامات مناسب را می توان در مراحل اولیه انجام داد. این منجر به این واقعیت می شود که بسیاری از بیماران، علیرغم تحقیقات قبلی، برای حمله قلبی که اغلب به مرگ ختم می شود، آمادگی ندارند. هنگامی که بیماران از درد شدید قفسه سینه، سفتی و تنگی نفس شکایت دارند، اینها اغلب نشانه های حمله قلبی هستند. با این حال، اگر نتایج تحقیقات در محدوده باقی بماند، معمولاً دلیلی برای شروع اقدامات یا تحقیقات بیشتر توسط پزشکان وجود ندارد.
تحقیقات آزمایشگاهی
پارامترهای آزمایشگاهی زیر برای تایید تشخیص انفارکتوس میوکارد استفاده می شود: 1) پارامترهای غیر اختصاصی نکروز بافتی و پاسخ التهابی. 2) داده های نوار قلب؛ 3) نتایج تغییرات در سطح آنزیم های سرمی.
تظاهر واکنش غیر اختصاصی بدن در پاسخ به آسیب میوکارد، لکوسیتوز سلولی چندشکلی است که در عرض چند ساعت پس از شروع درد آنژین رخ می دهد، به مدت 3-7 روز ادامه می یابد و اغلب به مقادیر 12-15 109 / L می رسد. ESR به سرعت تعداد لکوسیتها در خون افزایش نمییابد، در هفته اول به اوج خود میرسد و گاهی برای 1-2 هفته بالا میماند.
بنابراین، پزشکان برای مدتی به دنبال روش جایگزینتشخیص زودهنگام حمله قلبی مرگ و میر بالا به دلیل تشخیص اشتباه. اگر سکته قلبی توسط یک بیمار غلبه کرد، امروزه می توان آن را نسبتاً خوب درمان کرد. سالانه حدود هزار نفر برای اولین بار دچار حمله قلبی می شوند و هزاران نفر از آنها جان خود را از دست می دهند. میزان مرگ و میر با استانداردهای امروزی بسیار بالاست. به گفته بسیاری از متخصصان قلب، الکتروکاردیوگرام تقریباً 100 ساله به طور مشترک مسئول است.
تازگی علمی کار
اغلب نتایج اندازه گیری کاملاً غیر قابل توجه است، اگرچه حمله قلبی رخ داده است. اگر انفارکتوس حاد میوکارد وجود داشته باشد، هر دقیقه طول می کشد تا آسیب بعدی و خطر مرگ ناگهانی قلبی به حداقل برسد. این می تواند صدمات جبران ناپذیری به عضله قلب وارد کند و قربانی می تواند به طور ناگهانی بمیرد زیرا اقدامات نجات دهنده آغاز نشده است. آزمایش خون نشانگر زیستی را می توان در حدود 50 درصد موارد انفارکتوس میوکارد تشخیص داد. با این حال، این شواهد معمولا تنها چند ساعت پس از وقوع حمله قلبی موفق می شوند.
تظاهرات الکتروکاردیوگرافی انفارکتوس حاد میوکارد با جزئیات در Ch. 178. اگرچه همیشه رابطه واضحی بین تغییرات ECG و میزان آسیب میوکارد وجود ندارد، اما ظهور موج Q پاتولوژیک یا ناپدید شدن موج R معمولاً تشخیص انفارکتوس ترانس مورال میوکارد را با احتمال زیاد امکان پذیر می کند. وجود انفارکتوس میوکارد غیر ترانس مورال در مواردی گفته می شود که فقط تغییرات گذرا در قطعه ST و تغییرات مداوم در موج T در ECG تشخیص داده می شود. اما این تغییرات بسیار متغیر و غیراختصاصی هستند و بنابراین نمی توانند مبنایی برای تشخیص باشند. تشخیص انفارکتوس حاد میوکارد در این راستا، یک نامگذاری منطقی برای تشخیص انفارکتوس حاد میوکارد، بسته به وجود تغییرات در موج Q یا امواج ST-T، تنها باید دومی را به فرامورال و غیر ترانس مورال متمایز کند.
آنزیم های آب پنیر
عضله قلب نکروزه در حین انفارکتوس حاد میوکارد به داخل خون رها می شود تعداد زیادی از آنزیم ها سرعت آزادسازی آنزیم های مختلف مختلف یکسان نیست. تغییر در سطح آنزیم های خون در طول زمان ارزش تشخیصی زیادی دارد. پویایی غلظت آنزیم هایی که اغلب برای تشخیص انفارکتوس حاد میوکارد استفاده می شوند در شکل نشان داده شده است. 190-1. سطح دو آنزیم سرم گلوتاماتوکسالواستات ترانس آمیناز (SGOT) و کراتین فسفوکیناز (CPK) بسیار سریع افزایش و کاهش می یابد، در حالی که سطح لاکتات دهیدروژناز (LDH) آهسته تر افزایش می یابد و برای مدت طولانی تری بالا می ماند. عیب تعیین SHOT این است که این آنزیم در ماهیچه های اسکلتی، سلول های کبدی، گلبول های قرمز نیز یافت می شود و می تواند از این منابع خارج قلبی آزاد شود. بنابراین، در حال حاضر، تعریف SHOT برای تشخیص انفارکتوس حاد میوکارد، به دلیل غیر اختصاصی بودن این آنزیم و اینکه دینامیک غلظت آن جایگاهی میانی را بین پویایی غلظت آنزیم اشغال می کند، کمتر از قبل استفاده می شود. CPK و پویایی غلظت LDH که در ارتباط با آن اطلاعات در مورد سطح SHOT در بیشتر موارد بیش از حد می شود. تعیین محتوای MB ایزوآنزیم CPK نسبت به تعیین غلظت SHOT مزایایی دارد، زیرا این ایزوآنزیم عملاً در بافت خارج قلب تشخیص داده نمی شود و بنابراین اختصاصی تر از SHOT است. از آنجایی که افزایش غلظت CPK یا SOGT برای مدت کوتاهی تعیین می شود، در مواردی که نمونه خون بیش از 48 ساعت پس از ایجاد انفارکتوس میوکارد گرفته می شود، ممکن است مورد توجه قرار نگیرد. تعریف MB-CPK در مواردی که ظن آسیب به ماهیچه های اسکلتی یا بافت مغز وجود دارد، منطقی است، زیرا آنها حاوی مقادیر قابل توجهی از این آنزیم هستند، اما ایزوآنزیم آن را ندارند. ویژگی ایزوآنزیم MB برای تشخیص آسیب میوکارد به تکنیک مورد استفاده بستگی دارد. خاص ترین روش رادیوایمونواسی، با این حال، در عمل، با این وجود، الکتروفورز ژل بیشتر مورد استفاده قرار می گیرد، که ویژگی کمتری دارد و بنابراین اغلب نتایج مثبت کاذب می دهد. در انفارکتوس حاد میوکارد، سطح LDH در روز اول افزایش می یابد، بین روز سوم و چهارم به اوج خود می رسد و به طور متوسط پس از 14 روز به حالت عادی باز می گردد. هنگام انجام الکتروفورز در ژل نشاسته، پنج ایزوآنزیم LDH را می توان تشخیص داد. بافت های مختلف حاوی مقادیر متفاوتی از این ایزوآنزیم ها هستند. ایزوآنزیم که دارای بالاترین تحرک الکتروفورتیک است، عمدتاً در میوکارد یافت می شود و به عنوان LDH تعیین می شود. ایزوآنزیم هایی با کمترین تحرک الکتروفورتیک عمدتاً در ماهیچه های اسکلتی و سلول های کبدی یافت می شوند. در انفارکتوس حاد میوکارد، سطح LDH1 حتی قبل از افزایش سطح LDH کل افزایش می یابد، یعنی ممکن است افزایش در سطح LDH مشاهده شود) با سطح طبیعی LDH کل. بنابراین، تشخیص افزایش سطح LDH | یک تست تشخیصی حساس تر در انفارکتوس حاد میوکارد نسبت به سطح LDH کل است، حساسیت آن بیش از 95٪ است.
برنج. 190-1. دینامیک آنزیم های سرم پس از انفارکتوس میوکارد معمولی
CPK - کراتین فسفوکیناز؛ LDH - لاکتات دهیدروژناز؛ GOT - گلوتاماتکسالواستات ترانس آمیناز.
از اهمیت بالینی خاص این واقعیت است که افزایش 2-3 برابری در سطح CPK کل (اما نه MB-CPK) ممکن است نتیجه تزریق عضلانی باشد. ممکن است مواردی از تشخیص متناقض انفارکتوس حاد میوکارد در بیمارانی که تحت آن قرار گرفته اند وجود داشته باشد تزریق عضلانیدارویی برای درد قفسه سینه که با بیماری قلبی مرتبط نیست. بعلاوه، منابع بالقوه افزایش سطح CPK می تواند شامل موارد زیر باشد: 1) بیماری های عضلانی، از جمله دیستروفی عضلانی، میوپاتی، پلی میوزیت. 2) درمان تکانه الکتریکی (کاردیوورژن)؛ 3) کاتتریزاسیون قلبی. 4) کم کاری تیروئید 5) سکته مغزی؛ 6) مداخلات جراحی؛ 7) آسیب به عضلات اسکلتی در هنگام تروما، تشنج، بی حرکتی طولانی مدت. جراحی قلب و درمان تکانه الکتریکی اغلب می تواند منجر به افزایش سطح ایزوآنزیم CPK شود.
مشخص شده است که بین میزان آنزیم آزاد شده در خون و اندازه انفارکتوس میوکارد همبستگی وجود دارد. نشان داده شده است که اگر سینتیک آزادسازی آنزیم، تخریب، توزیع آن و غیره مشخص باشد، جرم میوکاردی که تحت نکروز قرار گرفته است را می توان از منحنی غلظت-زمان تعیین کرد. تجزیه و تحلیل منحنی غلظت-زمان برای MB-CPK امکان تعیین میزان انفارکتوس میوکارد بر حسب گرم ... در حالی که ناحیه زیر منحنی تغییرات غلظت MB - CPK در طول زمان نشان دهنده اندازه انفارکتوس میوکارد است، مقادیر مطلق غلظت این آنزیم و زمان تا رسیدن به حداکثر غلظت با سینتیک آنزیم مرتبط است. MB - شستشوی CPK از میوکارد. ظهور لومن در عروق کرونر مسدود شده که در مراحل اولیه انفارکتوس حاد میوکارد به صورت خود به خود یا تحت تأثیر مکانیکی یا داروهای دارویی رخ می دهد، باعث افزایش سریع غلظت آنزیم می شود. حداکثر غلظت 1-3 ساعت پس از خونرسانی مجدد حاصل می شود. در این مورد، کل سطح زیر منحنی غلظت-زمان ممکن است کمتر از بدون خونرسانی مجدد باشد، که نشان دهنده اندازه کوچکتر انفارکتوس میوکارد است.
افزایش مشخصه در غلظت آنزیم ها در بیش از 95٪ از بیماران مبتلا به انفارکتوس میوکارد بالینی ثابت شده مشاهده می شود. با آنژین صدری ناپایدار، محتوای CPK، LDH، SHOT معمولاً افزایش نمی یابد. در بسیاری از بیماران مشکوک به انفارکتوس میوکارد، سطح اولیه آنزیم ها در خون در محدوده طبیعی باقی می ماند؛ با انفارکتوس میوکارد، می تواند 3 برابر افزایش یابد، اما در عین حال از حد بالای هنجار تجاوز نمی کند. این وضعیت در بیماران مبتلا به انفارکتوس میوکارد خفیف مشاهده می شود. اگرچه چنین افزایشی در محتوای آنزیم را نمی توان به عنوان یک معیار تشخیصی دقیق برای انفارکتوس حاد میوکارد در نظر گرفت، اما به احتمال زیاد باعث ایجاد شک می شود. در چنین شرایطی تعیین ایزوآنزیم ها می تواند کمک عملی کند.
برای تشخیص انفارکتوس حاد میوکارد یا ارزیابی شدت آن، روش های رادیونوکلئیدی ممکن است مفید باشد (فصل 179). سینتی گرافی در مرحله حاد انفارکتوس حاد میوکارد (تصویر "نقطه داغ") با پیروفسفات قلع 99m'Tc انجام می شود. اسکن معمولاً از روز دوم تا پنجم پس از شروع سکته قلبی نتیجه مثبت می دهد، اغلب در بیماران مبتلا به انفارکتوس ترانس مورال میوکارد. علیرغم اینکه این روش امکان تعیین محل سکته قلبی و اندازه آن را فراهم می کند (ص 887)، از نظر تشخیص، دقت کمتری نسبت به تعیین محتوای CPK دارد. تصاویر میوکارد با استفاده از تالیم-201، که توسط میوکارد زنده گرفته و متمرکز می شود، نقص پرفیوژن ("نقطه سرد") را در اکثر بیماران در اولین ساعات پس از ایجاد انفارکتوس میوکارد transmural نشان می دهد. این یک منطقه محلی است. کاهش رادیواکتیویته می تواند در ساعات بعدی پر شود. با این وجود، افتراق انفارکتوس حاد از تغییرات سیکاتریسیال قدیمی با استفاده از این روش غیرممکن است. بنابراین، اسکن تالیوم روشی بسیار حساس برای تشخیص سکته قلبی است، اما برای انفارکتوس حاد میوکارد اختصاصی نیست. با استفاده از بطن رادیونوکلئید با گلبول های قرمز نشاندار شده با 99mTe، در بیماران مبتلا به انفارکتوس حاد میوکارد، اختلالات انقباضی و کاهش کسر جهشی بطن چپ قابل تشخیص است. بطن رادیونوکلئید در ارزیابی همودینامیک اختلال در انفارکتوس حاد میوکارد و در صورت لزوم برای ایجاد تشخیص انفارکتوس میوکارد بطن راست، زمانی که کسر جهشی بطن راست کاهش مییابد، بسیار ارزشمند است. با این حال، به طور کلی، ویژگی این روش کم است، زیرا بطن های رادیونوکلئید تغییر یافته نه تنها در انفارکتوس حاد میوکارد، بلکه در سایر شرایط پاتولوژیک قلب نیز ثبت می شود.
در ارزیابی وضعیت بیماران مبتلا به انفارکتوس حاد میوکارد، اکوکاردیوگرافی دو بعدی نیز ممکن است مفید باشد. در این حالت، نقض انقباض بهویژه در ناحیه سپتوم و دیواره خلفی به راحتی قابل تشخیص است. و اگر چه اکوکاردیوگرافی نمی تواند سکته حاد میوکارد را از اختلالات انقباضی به دلیل وجود اسکار یا شدید متمایز کند. ایسکمی حادمیوکارد، سادگی و بی خطر بودن این روش به ما این امکان را می دهد که آن را به عنوان مرحله مهمی در معاینه بیماران مبتلا به انفارکتوس حاد میوکارد در نظر بگیریم. علاوه بر این، اکوکاردیوگرافی می تواند برای تشخیص انفارکتوس میوکارد بطن راست، آنوریسم بطن چپ و ترومبوز بطن چپ بسیار آموزنده باشد.
مدیریت بیماران مبتلا به انفارکتوس حاد میوکارد
در انفارکتوس حاد میوکارد، دو نوع اصلی از عوارض قابل تشخیص است - اینها عوارض ناشی از بی ثباتی الکتریکی (آریتمی) و مکانیکی (شکست پمپاژ) هستند. اکثر دلیل مشترکمرگ "آریتمیک" در انفارکتوس حاد میوکارد فیبریلاسیون بطنی است. اکثر بیماران مبتلا به فیبریلاسیون بطنی در 24 ساعت اول پس از شروع علائم می میرند و بیش از نیمی از آنها در یک ساعت اول می میرند. اگر چه ضربان های زودرس بطنییا تاکی کاردی بطنی اغلب قبل از فیبریلاسیون بطنی است. دومی می تواند بدون آریتمی قبلی ایجاد شود. این مشاهدات منجر به استفاده از لیدوکائین برای پیشگیری از فیبریلاسیون خود به خودی بطنی در انفارکتوس حاد میوکارد شد. بنابراین، تمرکز تاکتیک های درمانی از اقدامات احیا به پیشگیری از موقعیت هایی که نیاز به چنین اقداماتی وجود دارد، تغییر یافته است. این امر منجر به کاهش بروز فیبریلاسیون بطنی اولیه در دو دهه گذشته شده است. کاهش مرگ و میر بیمارستانی در انفارکتوس حاد میوکارد از 30% به 10% تا حد زیادی نتیجه اقدامات سازمانی مانند تحویل سریع بیماران مبتلا به انفارکتوس حاد میوکارد به بیمارستانهای مجهز به دستگاههای مانیتورینگ ECG و پرسنل (نه لزوماً با بالاتر بود. آموزش پزشکی) قادر به تشخیص سریع آریتمی های بطنی تهدید کننده زندگی و تجویز سریع درمان مناسب است.
با کاهش بروز مرگ ناگهانی در بیمارستان به دلیل درمان پیشگیرانه کافی ضد آریتمی، سایر عوارض انفارکتوس حاد میوکارد، به ویژه، عملکرد ناکافی پمپاژ میوکارد شروع به ظهور کردند. و علیرغم پیشرفتهایی که در درمان بیماران مبتلا به نارسایی حاد قلبی صورت گرفته است، در حال حاضر نارسایی حاد قلبی عامل اصلی مرگ در انفارکتوس حاد میوکارد است. اندازه ناحیه نکروزه ناشی از ایسکمی با میزان نارسایی قلبی و میزان مرگ و میر در 10 روز اول و بیشتر همبستگی دارد. تاریخ های دیرهنگام... به کیلیپ نسخه اصلی پیشنهاد شد طبقه بندی بالینیبر اساس ارزیابی درجه نارسایی قلبی. بر اساس این طبقه بندی، بیماران به چهار دسته تقسیم می شوند. کلاس 1 شامل بیمارانی است که هیچ نشانه ای از احتقان ریوی یا وریدی ندارند. در کلاس 2 - افراد مبتلا به نارسایی قلبی متوسط، که در آن خس خس سینه در ریه ها شنیده می شود، در ریتم ضربان قلب (ZZ)، تنگی نفس، علائم نارسایی قلب راست، از جمله احتقان وریدی و کبدی وجود دارد. در کلاس 3 - بیماران مبتلا به نارسایی شدید قلبی، همراه با ادم ریوی؛ در کلاس 4 - بیماران در شوک با فشار سیستمیک زیر 90 میلی متر جیوه. هنر و علائم انقباض عروق محیطی، همراه با تعریق، سیانوز محیطی، گیجی، الیگوری. برخی از مطالعات خطر مرگ و میر بیمارستانی را برای هر یک از کلاس های کلیپ بالینی بالا محاسبه کرده اند، این خطر برای کلاس 1 0-5٪، برای 2 10-20٪، برای سوم 45٪، 35-45٪ و برای چهارم است. - 85-90٪.
ملاحظات کلی
بنابراین، اصول اصلی درمان بیماران مبتلا به انفارکتوس حاد میوکارد، پیشگیری از مرگ ناشی از اختلالات ریتم و محدودیت اندازه سکته قلبی است.
در صورت وجود پرسنل پزشکی واجد شرایط و تجهیزات مناسب، آریتمی ها را می توان در صورت بروز ترمیم کرد. از آنجایی که بیشترین مرگ و میر ناشی از آریتمی در ساعات اولیه سکته حاد میوکارد مشاهده می شود، بدیهی است که اثربخشی مراقبت های پزشکی در بلوک ها مراقبت شدیدبستگی به سرعت زایمان بیمار دارد. تأخیر اصلی نه به دلیل نقص در حمل و نقل بیمار به کلینیک، بلکه به این دلیل است که زمان زیادی بین شروع کار می گذرد. سندرم دردو تصمیم بیمار برای مراجعه به پزشک. بنابراین، لازم است دانش پزشکی را به طور گسترده تبلیغ کرد و اهمیت مراجعه سریع به پزشک در صورت درد قفسه سینه را توضیح داد.
در درمان بیماران مبتلا به انفارکتوس حاد میوکارد، تعدادی از قوانین عمومی، که لازم است به ویژه در مورد آن سکونت کنیم. اولین و مهمترین چیز این است که برای حفظ تعادل بهینه بین تامین اکسیژن به میوکارد و نیاز به آن به منظور به حداکثر رساندن حفظ حیات میوکارد در ناحیه اطراف کانون نکروز تلاش کنیم. برای انجام این کار، باید آرامش را برای بیمار فراهم کرد، مسکنها و آرامبخشهای متوسط تجویز کرد، فضایی آرام ایجاد کرد که به کاهش ضربان قلب کمک میکند، که مقدار اصلی تعیینکننده نیاز اکسیژن میوکارد است.
با برادی کاردی سینوسی شدید (ضربان قلب کمتر از 45 در 1 دقیقه)، اندام تحتانی بیمار باید بلند شود و آتروپین تجویز شود یا تحریک الکتریکی انجام شود. دومی در مواردی که برادی کاردی با کاهش فشار خون یا افزایش آریتمی بطنی همراه باشد، ارجح است. بدون برادی کاردی مشخص، آتروپین نباید برای بیماران تجویز شود، زیرا این می تواند منجر به افزایش قابل توجه ضربان قلب شود. بیماران مبتلا به انفارکتوس حاد میوکارد با تاکی کاردی و فشار خون بالا باید تجویز شوند. مسدود کننده های آدرنرژیک ابتدا 0.1 میلی گرم بر کیلوگرم پروپرانولول (آناپریلین) یا 15 میلی گرم متوپرولول به صورت داخل وریدی تزریق می شود و این دوز به سه قسمت مساوی تقسیم شده و به صورت متوالی تجویز می شود. چنین تجویزی از این داروها در صورتی بی خطر است که عوارضی مانند نارسایی قلبی، بلوک دهلیزی، آسم برونش را ایجاد نکند. تمام اشکال تاکی آریتمی نیاز به درمان فوری و خاص دارند. داروهایی که دارای اثر غیرتروپیک مثبت هستند، مانند گلیکوزیدهای قلبی، سمپاتومیمتیکهایی که بر روی عضله قلب تأثیر میگذارند، فقط برای نارسایی شدید قلبی و در هیچ موردی برای اهداف پیشگیرانه تجویز نمیشوند. در صورت وجود آمین های سمپاتومیمتیک مختلف، باید به خاطر داشت که معرفی ایزوپروترنول، که دارای اثر کرونوتروپیک و گشادکننده عروقی است، کمترین مطلوبیت را دارد. دوبوتامین که تأثیر کمتری بر ضربان قلب و مقاومت عروق محیطی دارد، در مواقعی که نیاز به افزایش انقباض قلبی باشد، ترجیح داده می شود. دوپامین در بیماران مبتلا به نارسایی بطن چپ و افت فشار خون سیستمیک (فشار سیستولیک کمتر از 90 میلی متر جیوه) اثر مفیدی دارد. دیورتیک ها برای نارسایی قلبی نشان داده می شوند، در این موارد آنها قبل از تجویز داروهای محرک قلب استفاده می شوند، مگر اینکه علائم هیپوولمی و افت فشار خون وجود داشته باشد.
همه بیماران نیاز به استنشاق هوای غنی شده با اکسیژن دارند (به زیر مراجعه کنید). باید توجه ویژه ای به حفظ اکسیژن خون کافی در بیماران مبتلا به هیپوکسمی شود که در مورد بیماری های مزمن ریوی، پنومونی و نارسایی بطن چپ قابل مشاهده است. با کم خونی شدید، که می تواند به گسترش کانون ایسکمیک کمک کند، توده گلبول قرمز باید با دقت تزریق شود، گاهی اوقات همراه با دیورتیک ها. بیماری های همراهبه ویژه موارد عفونی همراه با تاکی کاردی و افزایش نیاز به اکسیژن میوکارد نیز نیاز به توجه فوری دارند. لازم است اطمینان حاصل شود که نوسانات فشار خون سیستولیک از 25 تا 30 میلی متر جیوه تجاوز نمی کند. هنر از سطح معمول برای بیمار.
بخش مراقبت های ویژه عروق کرونر این واحدها برای کمک به بیماران مبتلا به انفارکتوس حاد میوکارد به منظور کاهش مرگ و میر در بین بیماران و افزایش دانش در مورد انفارکتوس حاد میوکارد طراحی شده اند. واحدهای مراقبت ویژه (ICU) مراکز مراقبت پرستاری هستند که توسط پرسنل پزشکی مجرب و مجرب که قادر به ارائه کمک فوریدر مواقع اضطراری چنین واحدی باید مجهز به سیستم هایی باشد که امکان نظارت مداوم بر ECG در هر بیمار و نظارت بر پارامترهای همودینامیک در بیماران را فراهم کند، دارای تعداد مورد نیاز دفیبریلاتور، دستگاه های تهویه مصنوعی ریه و همچنین دستگاه هایی برای معرفی الکترولیت ها برای قلب باشد. کاتترهای تحریکی و شناور با بادکنک در انتها. با این حال، مهمتر از همه، حضور یک تیم پرستاری با مهارت بالا است که قادر به تشخیص آریتمیها، تجویز داروهای ضد آریتمی کافی، و انجام احیای قلبی عروقی، از جمله درمان الکترو پالس، در صورت نیاز است. همچنین لازم است که همیشه امکان دریافت نظر پزشک وجود داشته باشد. البته لازم به ذکر است که در نتیجه اصلاح به موقع آریتمی ها حتی قبل از ورود پزشک، جان بسیاری از پرستاران نجات یافت.
وجود بخشهای مراقبتهای ویژه این امکان را فراهم میسازد که در اسرع وقت به بیماران مبتلا به انفارکتوس حاد میوکارد، زمانی که مراقبت های بهداشتیممکن است موثرترین باشد برای دستیابی به این هدف، باید اندیکاسیون های بستری در بیمارستان را گسترش داد و بیماران حتی مشکوک به انفارکتوس حاد میوکارد را در بخش مراقبت های ویژه قرار داد. بررسی تحقق این توصیه بسیار آسان است. برای انجام این کار، کافی است تعداد بیماران با تشخیص ثابت شده انفارکتوس حاد میوکارد را در بین همه افراد بستری در بخش مراقبت های ویژه مشخص کنیم. با گذشت زمان اما به دلایلی این قانون زیر پا گذاشته شد. در دسترس بودن مانیتورینگ ECG و حضور پرسنل بسیار ماهر در بلوکهای به اصطلاح مشاهده متوسط، بستری شدن بیماران به اصطلاح کم خطر (بدون اختلال همودینامیک و بدون اختلالات ریتم) را در آنها ممکن میسازد. به منظور صرفه جویی در هزینه و استفاده بهینه از تجهیزات موجود، بسیاری از موسسات دستورالعمل هایی را برای ارائه مراقبت از بیمار و انتخاب بیماران مشکوک به انفارکتوس حاد میوکارد تهیه کرده اند. در ایالات متحده، اکثر این بیماران در بیمارستان بستری می شوند، در کشورهای دیگر، به عنوان مثال در انگلستان، بیماران در معرض خطر پایین در خانه درمان می شوند. در بین بیماران بستری با انفارکتوس حاد میوکارد، تعداد مراجعه کنندگان به بخش های مراقبت ویژه هم بر اساس وضعیت آنها و هم بر اساس تعداد تخت های این واحدها تعیین می شود. در برخی از کلینیکها، تختها در بخشهای مراقبتهای ویژه عمدتاً برای بیماران مبتلا به دوره پیچیده بیماری اختصاص داده میشود، بهویژه برای کسانی که نیاز به نظارت همودینامیک دارند. میزان مرگ و میر در واحدهای مشاهده فشرده 5-20 درصد است. این تنوع تا حدی به دلیل تفاوت در اندیکاسیون های بستری در بیمارستان، سن بیماران، ویژگی های بالینی و سایر عوامل ثبت نشده است.
خونرسانی مجدد
دلیل اکثریت حملات قلبی بین دیواریمیوکارد یک ترومبوس است که آزادانه در مجرای رگ قرار دارد یا به پلاک آترواسکلروتیک متصل است. بنابراین، یک رویکرد منطقی برای کاهش اندازه انفارکتوس میوکارد، رسیدن به خونرسانی مجدد با کمک انحلال سریع ترومبوز با یک داروی ترومبولیتیک است. ثابت شده است که برای اینکه خونرسانی مجدد موثر باشد، یعنی حفظ میوکارد ایسکمیک، باید در مدت کوتاهی پس از ظهور انجام شود. علائم بالینییعنی ظرف 4 ساعت و ترجیحاً 2 ساعت.
برای درمان بیماران مبتلا به انفارکتوس حاد میوکارد، FDA تجویز استرپتوکیناز (SC) را از طریق یک کاتتر در شریان کرونر ممکن می داند. علیرغم اینکه با کمک SC می توان ترومبوز را لیز کرد که در 95 درصد موارد باعث حمله قلبی می شود، برخی از مسائل مربوط به مصرف این دارو حل نشده باقی می ماند. به طور خاص، مشخص نیست که آیا تجویز KS به کاهش مرگ و میر کمک می کند یا خیر. تزریق داخل وریدی SC نسبت به تزریق داخل کرونری موثرتر است، اما مزیت زیادی دارد، زیرا نیازی به کاتتریزاسیون عروق کرونر نیست. از نظر تئوری، فعال کننده پلاسمینوژن بافتی مزیتی نسبت به SC دارد؛ تقریباً 2/3 لخته خون تازه را لیز می کند. تزریق داخل وریدی، باید اثر لیتیک را در محل ترومبوز تازه نشان دهد و در نتیجه، اثر ترومبولیتیک سیستمیک کمتری داشته باشد. با این حال، حتی اگر داروی ترومبولیتیک ایدهآل را در نظر داشته باشیم، معلوم نیست که اگر به طور معمول تجویز شود، واقعاً به حفظ میوکارد ایسکمیک کمک میکند و نیاز به هدایت را کاهش میدهد یا خیر. عروق مجدد مکانیکیبا کمک آنژیوپلاستی عروق کرونر و بای پس عروق کرونر و کاهش قابل توجه مرگ و میر در بیماران مبتلا به انفارکتوس حاد میوکارد. تحقیقات برای پاسخ به این سوالات در حال انجام است. در زمانی که این سطور نوشته می شود. فعال کننده پلاسمینوژن بافتی هنوز برای استفاده گسترده بالینی در دسترس نیست و استفاده از آن هنوز توسط دفتر بیولوژیکی تایید نشده است. تاکتیک های درمانی بهینه برای انسداد شدید (بیش از 80 درصد لومن شریان کرونر) باید تجویز داخل وریدی استرپتوکیناز در مراحل اولیه انفارکتوس حاد میوکارد (کمتر از 4 ساعت پس از شروع سندرم درد) در نظر گرفته شود. ممکن است، تجویز داخل کرونری استرپتوکیناز به طور همزمان، و سپس آنژیوپلاستی کرونری ترانس لومینال از راه پوست (PTCA). با این حال، نیاز به داشتن یک تیم آنژیوگرافی واجد شرایط در حالت آماده به کار باعث می شود کاربرد ممکنچنین تاکتیک درمانی تنها در تعداد کمی از بیماران مبتلا به انفارکتوس حاد میوکارد است. با این حال، اگر مطالعات فعلی نشان دهد که تجویز داخل وریدی فعال کننده پلاسمینوژن بافتی و به دنبال آنژیوگرافی عروق کرونر (پس از 1 تا 2 روز) و انجام PTCA، در صورت لزوم، می تواند به طور قابل توجهی آسیب میوکارد را در اکثر بیماران کاهش دهد، یک رویکرد عملی برای درمان بیماران مبتلا به حاد انفارکتوس میوکارد سپس فعال کننده پلاسمینوژن بافتی بلافاصله پس از تشخیص انفارکتوس حاد میوکارد به صورت داخل وریدی تجویز می شود و این تجویز را می توان هم در واحد مشاهده فشرده و هم در ماشین آمبولانس، کلینیک و حتی در محل زندگی یا محل کار بیمار انجام داد. پس از آن بیمار در کلینیک بستری می شود و در مدت 2 روز تحت آنژیوگرافی عروق کرونر و در صورت لزوم PTCA قرار می گیرد. این رویکرد به پرسنل کمتر ماهر و تجهیزات کمتر پیچیده نیاز دارد.
گزارش شده است که PTCA اولیه اورژانسی در انفارکتوس حاد میوکارد، یعنی PTCA که بدون ترومبولیز قبلی انجام میشود، نیز میتواند در بازگرداندن خونرسانی مجدد کافی مؤثر باشد، اما این روش بسیار پرهزینه است، زیرا مستلزم در دسترس بودن مداوم پرسنل واجد شرایط و تجهیزات پیچیده است. ...
ناحیه ای از میوکارد که برای دومین بار به دلیل انسداد عروقی دچار نکروز می شود، نه با محلی سازی این انسداد بلکه با وضعیت جریان خون جانبی در بافت های ایسکمیک تعیین می شود. میوکارد، که به خوبی توسط وثیقه ها با خون تامین می شود، در طول ایسکمی می تواند چندین ساعت بیشتر از میوکارد با یک شبکه جانبی ضعیف باقی بماند. اکنون مشخص شده است که با گذشت زمان، اندازه انفارکتوس میوکارد تحت تأثیر داروهای تجویز شده می تواند تغییر کند. تعادل بین اکسیژن رسانی به میوکارد و نیاز به آن در نواحی ایسکمیک در نهایت سرنوشت این نواحی را در حین انفارکتوس حاد میوکارد تعیین می کند. اگرچه در حال حاضر هیچ رویکرد درمانی پذیرفته شده ای وجود ندارد که به کاهش اندازه انفارکتوس میوکارد در همه بیماران کمک کند، اما آگاهی از این واقعیت که اندازه آن می تواند تحت تأثیر تعدادی از داروها افزایش یابد که بر رابطه بین نیاز به اکسیژن میوکارد تأثیر منفی می گذارد. و ارائه آن منجر به برآورد بیش از حد تعدادی از رویکردهای درمانی برای درمان بیماران مبتلا به انفارکتوس حاد میوکارد شده است.
درمان بیمار مبتلا به حمله قلبی بدون عارضه
بی دردی. از آنجایی که انفارکتوس حاد میوکارد اغلب با سندرم درد شدید همراه است، تسکین درد یکی از موارد است. تکنیک های ضروریدرمان. برای این منظور، مرفین به طور سنتی استفاده می شود بسیار موثر است. با این حال، می تواند فشار خون را با کاهش انقباض شریانی و وریدی به واسطه سمپاتیک کاهش دهد. سیستم عصبی... رسوب خون در وریدها منجر به کاهش برون ده قلبی می شود. این را باید در نظر داشت، اما لزوماً منع مصرف مورفین را نشان نمی دهد. افت فشار خون ناشی از رسوب خون در وریدها معمولاً به سرعت با افزایش ارتفاع از بین می رود اندام های تحتانیاگرچه برخی از بیماران ممکن است نیاز به تجویز سالین داشته باشند. بیمار ممکن است احساس تعریق، حالت تهوع نیز داشته باشد، اما این پدیده ها معمولاً خود به خود از بین می روند.
علاوه بر این، اثر مفید تسکین درد معمولاً بر این موارد غالب است احساسات ناخوشایند... مهم است که این عوارض جانبی مورفین را از تظاهرات مشابه شوک متمایز کنیم تا بیهوده درمان منقبض کننده عروق تجویز نشود. مورفین اثر واگوتونیک دارد و می تواند باعث برادی کاردی یا بلوک قلبی با درجه بالا شود، به ویژه در بیماران مبتلا به انفارکتوس میوکارد خلفی تحتانی. این عوارض جانبی مرفین را می توان با تجویز داخل وریدی آتروپین با دوز 0.4 میلی گرم از بین برد. تجویز مورفین در دوزهای منقسم کوچک (2-4 میلی گرم) هر 5 دقیقه به صورت داخل وریدی به جای مقادیر زیاد زیر جلدی ترجیح داده می شود، زیرا در مورد دوم جذب آن می تواند منجر به عواقب غیر قابل پیش بینی شود. مپریدین هیدروکلراید یا هیدرومورفون هیدروکلراید را می توان با موفقیت به جای مرفین استفاده کرد.
قبل از شروع مرفین درمانی، به اکثر بیماران مبتلا به انفارکتوس حاد میوکارد می توان زیر زبان نیتروگلیسیرین داد. معمولاً 3 قرص 0.3 میلی گرمی که در فواصل 5 دقیقه ای تجویز می شود برای ابتلای بیمار به افت فشار خون کافی است. چنین درمانی با نیتروگلیسیرین، که قبلاً در انفارکتوس حاد میوکارد منع مصرف در نظر گرفته می شد، می تواند هم به کاهش نیاز اکسیژن میوکارد (به دلیل کاهش بار اولیه) و هم در افزایش اکسیژن رسانی به میوکارد (به دلیل گشاد شدن عروق کرونر) کمک کند. یا عروق جانبی در ناحیه انفارکتوس). با این حال، نیترات ها را نباید برای بیمارانی که فشار خون سیستولیک پایین (کمتر از 100 میلی متر جیوه) دارند، تجویز کرد. ما باید در مورد خاصیت احتمالی نیترات ها، که شامل کاهش ناگهانی فشار و برادی کاردی است، به یاد داشته باشیم. آی تی عوارض جانبینیتراتها که اغلب در بیماران مبتلا به انفارکتوس میوکارد پایین رخ میدهد، میتوانند با تجویز داخل وریدی آتروپین از بین بروند.
برای از بین بردن درد در انفارکتوس حاد میوکارد، می توان آن را به صورت داخل وریدی نیز تجویز کرد. مسدود کننده های آدرنرژیک این داروها به طور قابل اعتمادی درد را در برخی از بیماران تسکین می دهند، عمدتاً در نتیجه کاهش ایسکمی به دلیل کاهش نیاز به اکسیژن میوکارد. ثابت شده است که در صورت تزریق داخل وریدی. مسدود کننده های آدرنرژیک مرگ و میر بیمارستانی را کاهش می دهند، به ویژه در میان بیماران با درجه خطر بالا. P-blockerها را در دوزهای مشابه در حالت هیپردینامیک تجویز کنید (به بالا مراجعه کنید).
اکسیژن. استفاده معمول از اکسیژن در انفارکتوس حاد میوکارد با این واقعیت توجیه می شود که شاخ شریانی در بسیاری از بیماران کاهش می یابد و استنشاق اکسیژن، طبق داده های تجربی، اندازه آسیب ایسکمیک را کاهش می دهد. استنشاق اکسیژن شاخ شریانی را افزایش می دهد و در نتیجه گرادیان غلظت مورد نیاز برای انتشار اکسیژن به ناحیه میوکارد ایسکمیک از نواحی مجاور و پرفیوژن بهتر را افزایش می دهد. اگر چه از نظر تئوری اکسیژن درمانی می تواند عوارض نامطلوبی مانند افزایش مقاومت عروق محیطی و کاهش جزئی برون ده قلبی ایجاد کند، مشاهده عملی استفاده از آن را توجیه می کند. اکسیژن از طریق یک ماسک آزاد یا نوک بینی در طی یک تا دو روز اول انفارکتوس حاد میوکارد تزریق می شود.
فعالیت بدنی. عواملی که کار قلب را افزایش می دهند می توانند به افزایش اندازه انفارکتوس میوکارد کمک کنند. از شرایطی که به افزایش اندازه قلب، برون ده قلبی، انقباض میوکارد کمک می کند اجتناب کنید. نشان داده شد که برای بهبودی کامل، یعنی جایگزینی ناحیه انفارکتوس میوکارد با بافت اسکار، 6 تا 8 هفته طول می کشد. مطلوب ترین شرایط برای چنین بهبودی با کاهش فعالیت بدنی فراهم می شود.
اکثر بیماران مبتلا به انفارکتوس حاد میوکارد باید در بخش مراقبت های ویژه بستری شده و تحت نظر باشند. مشاهده بیمار و نظارت مداوم ECG باید 2 تا 4 روز طول بکشد. یک کاتتر در ورید محیطی قرار داده می شود و به طور محکم ثابت می شود تا از جابجایی جلوگیری شود. محلول گلوکز ایزوتونیک باید به طور مداوم از طریق کاتتر تزریق شود یا با هپارین شستشو شود. چنین کاتتری در صورت لزوم، تجویز داروهای ضد آریتمی یا داروهای دیگر را ممکن می سازد. در صورت عدم وجود نارسایی قلبی و سایر عوارض در طی 2 تا 3 روز اول، بیمار باید بیشتر روز را در رختخواب سپری کند و 1 تا 2 بار به مدت 30-15 دقیقه روی صندلی کنار تخت بنشیند. از رگ برای اجابت مزاج استفاده می شود. بیمار باید شسته شود. او می تواند به تنهایی غذا بخورد. استفاده از نشیمنگاه توالت کنار تخت در تمامی بیماران دارای ثبات همودینامیک با ریتم ثابت از روز اول مجاز است. تخت باید مجهز به زیرپایی باشد و بیمار برای جلوگیری از استاز وریدی و ترومبوآمبولی و همچنین حفظ تون عضلانی در پاها باید در طول روز 10 بار در ساعت با هر دو پا این تخته پا را محکم فشار دهد.
تا روز 3-4، بیماران مبتلا به انفارکتوس میوکارد بدون عارضه باید 2 بار در روز به مدت 30-60 دقیقه روی صندلی بنشینند. در طول این مدت، آنها فشار خون خود را اندازه گیری می کنند تا افت فشار خون وضعیتی احتمالی را بررسی کنند، که با راه رفتن فرد می تواند مشکل ساز شود. با انفارکتوس میوکارد بدون عارضه، بیمار اجازه دارد از جای خود بلند شود و به تدریج بین روز سوم و پنجم شروع به راه رفتن کند. اولاً اگر حمام در اتاق بیمار یا نزدیک است، اجازه رفتن به دستشویی را دارند. زمان پیاده روی به تدریج افزایش می یابد و در نهایت پیاده روی در طول راهرو مجاز است. در بسیاری از کلینیک ها برنامه های ویژه ای برای توانبخشی قلبی عروقی با افزایش تدریجی بار وجود دارد که از بیمارستان شروع می شود و پس از ترخیص بیمار ادامه می یابد. مدت بستری شدن در بیمارستان برای انفارکتوس میوکارد بدون عارضه 7-12 روز است، با این حال، برخی از پزشکان هنوز بستری شدن بیماران مبتلا به انفارکتوس کیو میوکارد را به مدت 3 هفته ضروری می دانند. بیماران با کلاس II بالینی یا بیشتر ممکن است به مدت 3 هفته یا بیشتر نیاز به بستری شدن در بیمارستان داشته باشند. مدت زمان درمان بستری بستگی به این دارد که نارسایی قلبی با چه سرعتی از بین می رود و چه نوع شرایط خانه ای پس از ترخیص در انتظار بیمار است. بسیاری از پزشکان انجام آزمایش در برخی از بیماران را ضروری می دانند فعالیت بدنی(محدود به رسیدن به ضربان قلب معین) قبل از ترک بیمارستان. با کمک چنین آزمایشی، می توان بیمارانی را از گروه پرخطر شناسایی کرد، یعنی کسانی که در حین یا بلافاصله پس از ورزش، دچار حمله آنژین صدری، تغییرات در بخش ST، افت فشار خون یا بالا هستند. اکستراسیستول بطنی درجه این بیماران نیاز دارند توجه ویژه... برای مقابله با اختلالات ریتم نیاز به تجویز داروهای ضد آریتمی دارند. مسدود کننده های آدرنرژیک، نیترات های طولانی اثر یا آنتاگونیست های کلسیم برای جلوگیری از ایسکمی میوکارد. اگر بیماران در حالت استراحت یا با ورزش بسیار کم دچار ایسکمی شوند، یا در صورت وجود افت فشار خون، آنژیوگرافی عروق کرونر (CAG) باید انجام شود. اگر در همان زمان مشخص شد که ناحیه بزرگی از میوکارد زنده با یک شریان با باریک شدن شدید خون تامین میشود، ممکن است نیاز به انجام مجدد عروق با استفاده از پیوند عروق کرونر (CABG) یا آنژیوپلاستی عروق کرونر باشد. تست ورزش همچنین به ایجاد یک برنامه ورزشی فردی کمک می کند که باید در بیمارانی که تحمل ورزش بهتری دارند و علائم نامطلوب ذکر شده در بالا را ندارند، شدیدتر باشد. انجام تست استرس ورزشی قبل از ترخیص از بیمارستان به بیمار کمک می کند تا از توانایی های جسمانی خود مطمئن شود. علاوه بر این، در مواردی که آریتمی رخ نمی دهد یا علائم ایسکمی میوکارد در طول تست ورزش ظاهر نمی شود، برای پزشک راحت تر است که بیمار را متقاعد کند که هیچ نشانه عینی از خطر فوری برای زندگی یا سلامتی وجود ندارد.
مرحله نهایی توانبخشی بیمار پس از انفارکتوس حاد میوکارد در خانه انجام می شود. از هفته سوم تا هشتم، بیمار باید میزان فعالیت بدنی خود را از طریق پیاده روی در اطراف خانه افزایش دهد، در هوای خوب، بیرون برود. بیمار همچنان باید حداقل 10-8 ساعت در شب بخوابد.علاوه بر این، برخی از بیماران از دوره های خواب اضافی در صبح و بعد از ظهر بهره مند می شوند.
از هفته هشتم پزشک باید فعالیت بدنی بیمار را بر اساس میزان تحمل او نسبت به فعالیت بدنی تنظیم کند. در این دوره است که افزایش فعالیت بدنی بیمار می تواند باعث خستگی عمومی شود. مشکل افت فشار خون وضعیتی ممکن است همچنان وجود داشته باشد. اکثر بیماران پس از 12 هفته و برخی از بیماران حتی زودتر می توانند به سر کار بازگردند. قبل از بازگشت بیمار به کار (بعد از 6-8 هفته)، آزمایشی اغلب با حداکثر فعالیت بدنی انجام می شود. اخیراً تمایل به فعال شدن زودتر بیماران، ترخیص زودتر از بیمارستان و بازیابی سریعتر فعالیت بدنی کامل در بیمارانی که انفارکتوس حاد میوکارد داشتهاند، دیده شده است.
رژیم غذایی. در طول 4-5 روز اول، ترجیح داده می شود که بیماران یک رژیم غذایی کم کالری تجویز کنند، غذا را در دوزهای کسری کوچک مصرف کنند، زیرا افزایش برون ده قلبی بعد از غذا مشاهده می شود. در نارسایی قلبی، مصرف سدیم باید محدود شود. از آنجایی که بیماران اغلب از یبوست رنج می برند، افزایش نسبت غذاهای گیاهی حاوی مقدار زیادی فیبر غذایی در رژیم غذایی کاملا منطقی است. علاوه بر این، غذاهای پر پتاسیم باید برای بیمارانی که دیورتیک دریافت می کنند توصیه شود. در هفته دوم می توان میزان غذای مصرفی را افزایش داد. در این زمان، بیمار باید اهمیت محدود کردن محتوای کالری رژیم غذایی، محتوای کلسترول، چربی های اشباع شده را توضیح دهد. این برای اینکه بیمار آگاهانه از یک رژیم غذایی منطقی پیروی کند، ضروری است. تمایل به تغذیه صحیح و ترک سیگار به ندرت بیشتر از این دوره اولیه توانبخشی پس از انفارکتوس حاد میوکارد است.
وضعیت غیرمعمول در رختخواب در 3-5 روز اول بیماری و اثر مسکن های مخدر که برای تسکین درد استفاده می شود اغلب منجر به یبوست می شود. اکثر بیماران در استفاده از قایق مشکل دارند و باعث زور زدن بیش از حد آنها می شود، بنابراین توصیه می شود از صندلی توالت کنار تخت استفاده کنند. یک رژیم غذایی غنی از غذاهای گیاهی که دارای فیبر و ملین های زیادی مانند دیوکتیل سدیم سولفوسوکسیناز 200 میلی گرم در روز هستند نیز به پیشگیری از یبوست کمک می کند. اگر با وجود اقدامات فوق، یبوست ادامه داشت، باید مسهل ها توصیه شود. در انفارکتوس حاد میوکارد، ماساژ ملایم انگشت امکان پذیر است. راست روده
آرام بخش درمانی اکثر بیماران مبتلا به انفارکتوس حاد میوکارد در طول بستری شدن در بیمارستان نیاز به تجویز داروهای آرام بخش دارند که به تحمل بهتر دوره کاهش اجباری فعالیت کمک می کند - دیازپام 5 میلی گرم یا اگزازپام 15-30 میلی گرم 4 بار در روز. برای اطمینان از خواب طبیعی، داروهای خواب آور نشان داده شده است. موثرترین تریازولام (تریازولام) (از گروه بنزودیازپین های کوتاه اثر) در دوز 0.25-0.5 میلی گرم. تمازپام (15-30 میلی گرم) یا فلورازپام (فلورازپام) در همان دوز می تواند برای ایجاد یک اثر خواب آور طولانی مدت استفاده شود. این مشکل باید در روزهای اول اقامت بیمار در BIT مورد توجه ویژه قرار گیرد، جایی که وضعیت بیداری شبانه روزی می تواند منجر به اختلال خواب در آینده شود. البته باید به خاطر داشت که آرامبخش درمانی به هیچ وجه جایگزین نیاز به ایجاد جو روانی مطلوب در اطراف بیمار نمی شود.
داروهای ضد انعقاد بحث برانگیزترین نظرات در مورد نیاز به استفاده روتین از داروهای ضد انعقاد در انفارکتوس حاد میوکارد (AMI) بیان شده است. با این حال، فقدان شواهد آماری مستدل و مستدل در مورد کاهش مرگ و میر با استفاده از داروهای ضد انعقاد در چند هفته اول AMI نشان می دهد که مزایای این داروها کم است، یا شاید به طور کلی وجود نداشته باشد. درمان ضد انعقاد برای کند کردن روند انسداد عروق کرونر در مرحله اولیه بیماری در حال حاضر توجیه روشنی ندارد، اما اکنون دوباره مورد توجه قرار گرفته است، یعنی مشخص شده است که ترومبوز نقش مهمی در پاتوژنز AMI ایفا می کند. با این حال، مشخص شده است که درمان ضد انعقاد مطمئناً بروز ترومبوآمبولی را در شریان ها و وریدها کاهش می دهد. از آنجایی که مشخص شده است که فراوانی ترومبوآمبولی وریدی در بیماران مبتلا به نارسایی قلبی، شوک و سابقه ترومبوآمبولی وریدی افزایش مییابد، به چنین بیمارانی توصیه میشود که از داروهای ضد انعقاد روتین و پیشگیرانه در BIT استفاده کنند. تجویز روتین داروهای ضد انعقاد برای پیشگیری از ترومبوآمبولی وریدی در بیماران کلاس I توصیه نمی شود. در بیماران کلاس III و IV خطر ترومبوآمبولی وجود دارد شریان ریویافزایش یافته است، بنابراین توصیه می شود که در طی 14-10 روز اول بستری در بیمارستان یا تا زمانی که از بیمارستان مرخص می شوند، ضد انعقاد سیستمیک انجام دهند. این به بهترین وجه با انفوزیون داخل وریدی مداوم هپارین با استفاده از پمپ به دست می آید. در این مورد، اندازه گیری زمان لخته شدن و زمان ترومبوپلاستین جزئی برای تنظیم میزان تجویز دارو، افزایش یا کاهش آن ضروری است. پس از انتقال بیمار از BIT، هپارین با داروهای ضد انعقاد خوراکی جایگزین می شود. استفاده از دوزهای کوچک هپارین به صورت تزریق زیر جلدی (5000 واحد بین المللی هر 8-12 ساعت) مجاز است. در مورد درمان بیماران کلاس II با داروهای ضد انعقاد اختلاف نظر وجود دارد. تجویز داروهای ضد انعقاد در مواردی که نارسایی احتقانی قلب بیش از 3 تا 4 روز وجود دارد یا در مواردی که شدید است، مناسب به نظر می رسد. انفارکتوس قدامیمیوکارد
احتمال آمبولی شریانی توسط یک ترومب واقع در بطن در ناحیه انفارکتوس میوکارد، اگرچه کوچک است، اما بسیار قطعی است. اکوکاردیوگرافی دو بعدی (ECHO-KG) امکان تشخیص زودهنگام لخته های خون در بطن چپ را در حدود 30 درصد از بیماران مبتلا به انفارکتوس دیواره قدامی بطن چپ فراهم می کند، اما در بیماران مبتلا به انفارکتوس میوکارد تحتانی یا خلفی به ندرت آموزنده است. عارضه اصلی آمبولی شریانی همی پارزی با درگیری عروق مغزی و فشار خون شریانیزمانی که رگ های کلیه درگیر این فرآیند هستند. فراوانی کم این عوارض با شدت آنها در تضاد است و ایجاد قوانین سختگیرانه برای استفاده از داروهای ضد انعقاد برای پیشگیری از آمبولی شریانی در انفارکتوس حاد میوکارد را غیرعملی می سازد. احتمال ترومبوآمبولی با شیوع انفارکتوس میوکارد، درجه واکنش های التهابی همزمان و استاز اندوکاردی به دلیل آکینزی افزایش می یابد. بنابراین، همانطور که در مورد ترومبوآمبولی وریدی، نشانه های استفاده از داروهای ضد انعقاد برای پیشگیری از آمبولی شریانی با افزایش اندازه انفارکتوس حاد میوکارد گسترش می یابد. در مواردی که وجود ترومبوز با استفاده از ECHO-KG یا سایر روشها به وضوح تشخیص داده میشود، ضد انعقاد سیستمیک نشان داده میشود (در صورت عدم وجود موارد منع مصرف)، زیرا فراوانی عوارض ترومبوآمبولی به میزان قابل توجهی کاهش مییابد. مدت زمان دقیق درمان ضد انعقاد مشخص نیست، اما به نظر می رسد 3 تا 6 ماه باشد.
مسدود کننده های آدرنرژیک تجویز داخل وریدی. مسدود کننده های آدرنرژیک (BABs) در بالا مورد بحث قرار گرفته اند. مطالعات کنترل شده با دارونما به خوبی انجام شده نیاز به تجویز خوراکی معمول BAB را برای حداقل 2 سال پس از انفارکتوس حاد میوکارد تایید کرده است. کاهش مرگ و میر کلی، فراوانی مرگ ناگهانی و در برخی موارد انفارکتوس میوکارد مکرر تحت تأثیر BAB. دریافت BAB معمولاً 5 تا 28 روز پس از شروع انفارکتوس حاد میوکارد شروع می شود. معمولاً پروپرانولول (آناپریلین) با دوز 60 تا 80 میلی گرم 3 بار در روز یا سایر BAB با اثر کندتر در دوزهای معادل تجویز می شود. موارد منع مصرف BAB عبارتند از نارسایی احتقانی قلب، برادی کاردی، بلوک قلبی، افت فشار خون، آسم و دیابت ملیتوس وابسته به انسولین حساس.
آریتمی ها (همچنین به فصل های 183 و 184 مراجعه کنید). پیشرفت در اصلاح آریتمی ها نشان دهنده مهم ترین دستاورد در درمان بیماران مبتلا به انفارکتوس میوکارد است.
انقباضات زودرس بطنی (اکستراسیستول بطنی). اکستراسیستول های پراکنده بطنی نادر در اکثر بیماران مبتلا به انفارکتوس حاد میوکارد رخ می دهد و نیازی به درمان خاصی ندارد. معمولاً اعتقاد بر این است که درمان ضد آریتمی برای اکستراسیستول بطنی باید در موارد زیر تجویز شود: 1) وجود بیش از 5 اکستراسیستول بطنی منفرد در 1 دقیقه. 2) ظهور اکستراسیستول های بطنی گروهی یا چند توپی. 3) وقوع اکستراسیستول بطنی در فاز دیاستول اولیه، یعنی روی موج T مجموعه قبلی (یعنی پدیده R در T) قرار گرفته است.
تجویز داخل وریدی لیدوکائین به درمان انتخابی برای ضربان زودرس بطنی و آریتمی های بطنی تبدیل شده است، زیرا دارو به سرعت شروع به عمل می کند و عوارض جانبی به همان سرعت ناپدید می شوند (در عرض 15-20 دقیقه پس از قطع مصرف). برای دستیابی سریع به غلظت درمانی در خون، لیدوکائین به صورت بولوس 1 میلی گرم بر کیلوگرم به صورت داخل وریدی تجویز می شود. این دوز اولیه می تواند فعالیت نابجا را از بین ببرد و سپس یک انفوزیون مداوم با سرعت 2-4 میلی گرم در دقیقه برای حفظ اثر تجویز می شود. اگر آریتمی ادامه یابد، 10 دقیقه پس از معرفی بولوس اول، دومی با دوز 0.5 میلی گرم بر کیلوگرم تجویز می شود. در بیماران مبتلا به نارسایی احتقانی قلب، بیماری کبد، شوک، دوز لیدوکائین به نصف کاهش می یابد. به عنوان یک قاعده، اکستراسیستول بطنی خود به خود پس از 72-96 ساعت ناپدید می شود، در صورتی که آریتمی بطنی قابل توجهی پس از آن ادامه یابد، درمان طولانی مدت ضد آریتمی تجویز می شود.
برای درمان بیماران مبتلا به آریتمی های بطنی مداوم، معمولا از نووکائین آمید، توکائینید (توکاینید)، کینیدین استفاده می شود. BAB و دیسوپیرامید همچنین آریتمی های بطنی را در بیماران مبتلا به انفارکتوس حاد میوکارد از بین می برد. دیسوپیرامید در بیماران مبتلا به نارسایی بطن چپ با احتیاط فراوان تجویز می شود، زیرا اثر اینوتروپیک منفی قابل توجهی دارد. اگر این وجوه (فصل 184) که به صورت تک درمانی یا ترکیبی استفاده می شوند، در دوزهای معمول بی اثر باشند، باید غلظت آنها در خون تعیین شود. هنگامی که دوزهای زیادی از این داروها تجویز می شود، نظارت بالینی و ECG منظم برای شناسایی علائم احتمالی مسمومیت مورد نیاز است.
تاکی کاردی بطنی و فیبریلاسیون بطنی. در طول 24 ساعت اول AMI، تاکی کاردی بطنی (VT) و فیبریلاسیون بطنی (VF) اغلب بدون اختلالات ریتم تهدید کننده پیش از آنها رخ می دهد. خطر ابتلا به چنین آریتمی های اولیه را می توان به طور قابل توجهی با لیدوکائین وریدی پیشگیرانه کاهش داد. تجویز پیشگیرانه داروهای ضد آریتمی مخصوصاً برای بیمارانی که نمی توانند در کلینیک قرار گیرند یا در کلینیکی هستند که حضور مداوم پزشک در BIT تضمین نمی شود نشان داده می شود. با تاکی کاردی بطنی طولانی مدت، ابتدا لیدوکائین تجویز می شود. اگر آریتمی پس از یک یا دو تزریق دارو با دوز 50-100 میلی گرم ادامه یابد، درمان با الکترو پالس (الکتروکاردیوورژن) انجام می شود (فصل 184). دفیبریلاسیون الکتریکی بلافاصله با فیبریلاسیون بطنی و همچنین در مواردی که تاکی کاردی بطنی باعث اختلالات همودینامیک می شود انجام می شود. اگر فیبریلاسیون بطنی چند ثانیه یا بیشتر طول بکشد، اولین شوک دفیبریلاتور ممکن است ناموفق باشد، در این موارد، قبل از انجام مکرر کاردیوورژن، توصیه می شود فشار قفسه سینه، تهویه مصنوعی ریه ها "دهان به دهان" انجام شود. و همچنین بی کربنات سدیم (40-90 meq ) را به صورت داخل وریدی تزریق کنید. بهبود اکسیژن رسانی و پرفیوژن بافت و اصلاح اسیدوز احتمال دفیبریلاسیون موفقیت آمیز را افزایش می دهد (همچنین به فصل 30 مراجعه کنید). در بیماران مقاوم به درمان، فیبریلاسیون بطنی یا تاکی کاردی بطنی ممکن است با تجویز برتیلیوم (اورنید) موثر باشد. برای فیبریلاسیون بطنی، برتیلیوم به صورت بولوس 5 میلی گرم بر کیلوگرم داده می شود، سپس دفیبریلاسیون تکرار می شود. اگر دومی ناموفق باشد، بولوس دیگری از برتیلیوم (10 میلی گرم بر کیلوگرم) برای تسهیل دفیبریلاسیون داده می شود. تاکی کاردی بطنی را می توان با انفوزیون آهسته 10 میلی گرم بر کیلوگرم برتیلیوم در مدت 10 دقیقه از بین برد. در صورت عود آریتمی پس از تجویز اولین دوز برتیلیوم، می توان آن را به طور مداوم با دوز 2 میلی گرم در دقیقه تزریق کرد. پس از تجویز داخل وریدی برتیلیوم، افت فشار خون شدید ارتواستاتیک ممکن است رخ دهد. بنابراین در حین و پس از مصرف دارو، بیماران باید در وضعیت خوابیده به پشت باشند، علاوه بر این، باید برای تزریق وریدی مایعات آماده شوند.
با فیبریلاسیون بطنی اولیه، پیش آگهی طولانی مدت مطلوب است. این بدان معنی است که فیبریلاسیون بطنی اولیه پیامد ایسکمی حاد است و با وجود عوامل مستعد کننده ای مانند نارسایی احتقانی قلب، بلوک شاخه ای، آنوریسم بطن چپ همراه نیست. طبق یک مطالعه، 87 درصد از بیماران مبتلا به فیبریلاسیون بطنی اولیه زنده مانده و از بیمارستان مرخص شدند. پیش آگهی در بیماران مبتلا به فیبریلاسیون بطنی ثانویه، که در نتیجه عملکرد پمپاژ ناکافی قلب ایجاد شده است، بسیار کمتر مطلوب است. تنها 29 درصد از آنها زنده می مانند.
در گروه بیمارانی که تاکی کاردی بطنی در اواخر دوره بستری در آنها ایجاد می شود، مرگ و میر در طول سال به 85٪ می رسد. چنین بیمارانی به یک مطالعه الکتروفیزیولوژیک نیاز دارند (فصل 184).
تسریع ریتم idioventricular. ریتم idio-ventricular تسریع شده ("تاکی کاردی بطنی آهسته") یک ریتم بطنی با فرکانس 60 تا 100 در دقیقه است. در 25 درصد از بیماران مبتلا به انفارکتوس میوکارد رخ می دهد. اغلب، در بیماران مبتلا به انفارکتوس میوکارد خلفی تحتانی و، به عنوان یک قاعده، در ترکیب با برادی کاردی سینوسی ثبت می شود. ضربان قلب در یک ریتم تند بطنی شبیه به ضربان سینوسی قبل یا بعد از آن است. تشخیص بالینی ریتم سریع بطنی دشوار است، فقط با کمک نظارت ECG تشخیص داده می شود. این به این دلیل است که فراوانی انقباضات بطنی با ریتم سینوسی کمی متفاوت است و اختلالات همودینامیک حداقل است. چون نوسانات ریتم سینوسی باعث کاهش ریتم دهلیزی به زیر سطح فرار تسریع شده می شود، ریتم تسریع شده درون بطنی ایجاد می شود و به طور خود به خود ناپدید می شود. به طور کلی، تسریع ریتم idio-ventricular یک اختلال ریتم خوش خیم است و شروع تاکی کاردی بطنی کلاسیک را نشان نمی دهد. با این حال، تعدادی از موارد ثبت شده است که یک ریتم سریع بطنی با اشکال خطرناک تر آریتمی های بطنی ترکیب شده یا به آریتمی های بطنی تهدید کننده زندگی تبدیل شده است. اکثر بیمارانی که ریتم درون بطنی تسریع شده دارند نیازی به درمان ندارند. یک نظارت دقیق ECG کافی است، زیرا ریتم تسریع شده درون بطنی به ندرت به اختلالات ریتم جدی تبدیل می شود. اگر مورد دوم همچنان اتفاق بیفتد، ریتم تسریع شده idio-ventricular را می توان به راحتی با آن حذف کرد. استفاده از داروهایی که دفعات دفع بطنی را کاهش میدهند، مانند توکائینید، و/یا داروهایی که ریتم سینوسی را افزایش میدهند (آتروپین).
آریتمی فوق بطنی. در این گروه از بیماران، آریتمی های فوق بطنی بیشتر از قبیل ریتم اتصالی و تاکی کاردی اتصالی، تاکی کاردی دهلیزی، فلوتر دهلیزی و فیبریلاسیون دهلیزی رخ می دهد. این اختلالات ریتم اغلب ثانویه به نارسایی بطن چپ است. دیگوکسین معمولا برای درمان بیماران استفاده می شود. اگر ریتم پاتولوژیک بیش از دو ساعت ادامه داشته باشد و ضربان بطنی بیش از 120 در هر دقیقه باشد، یا اگر تاکی کاردی با ظاهر نارسایی قلبی، شوک یا ایسکمی همراه باشد (که با درد مکرر یا تغییرات ECG مشهود است)، پالس الکتریکی انجام شود. درمان نشان داده شده است.
اختلالات ریتم گره دارای علت متفاوتی است، آنها وجود هیچ آسیب شناسی خاصی را نشان نمی دهند، بنابراین، نگرش پزشک نسبت به چنین بیمارانی باید فردی باشد. مصرف بیش از حد دیژیتال به عنوان علت آریتمی گرهی باید کنار گذاشته شود. در برخی از بیماران با اختلال قابل توجه عملکرد بطن چپ، از دست دادن مدت زمان طبیعی سیستول دهلیزی منجر به کاهش قابل توجه برون ده قلبی می شود. در چنین مواردی، تحریک سینوس دهلیزی یا کرونری اندیکاسیون دارد. اثر همودینامیکی تحریک این دو نوع یکسان است، اما مزیت تحریک سینوس کرونری این است که موقعیت کاتتر را پایدارتر می کند.
برادی کاردی سینوسی. نظرات در مورد اهمیت برادی کاردی به عنوان یک عامل مستعد کننده برای ایجاد فیبریلاسیون بطنی متناقض است. از یک طرف، مشخص شده است که میزان تاکی کاردی بطنی در بیماران مبتلا به برادی کاردی سینوسی طولانی مدت 2 برابر بیشتر از بیماران با ضربان قلب طبیعی است. از سوی دیگر، برادی کاردی سینوسی در بیماران بستری در بیمارستان به عنوان شاخصی از پیش آگهی مطلوب در نظر گرفته می شود. تجربه استفاده از واحدهای متحرک برای مراقبتهای ویژه قلب نشان میدهد که برادی کاردی سینوسی که در اولین ساعات انفارکتوس حاد میوکارد اتفاق میافتد، قطعاً با ظهور بعدی ریتمهای بطنی نابجا مرتبط است تا برادی کاردی سینوسی که در مراحل بعدی انفارکتوس حاد میوکارد اتفاق میافتد. درمان برادی کاردی سینوسی باید در مواردی انجام شود که (در مقابل پس زمینه آن) فعالیت نابجای مشخص بطن ها وجود دارد یا هنگامی که باعث اختلالات همودینامیک می شود. از بین بردن برادی کاردی سینوسی با کمی بالا بردن پاهای بیمار یا انتهای پای تخت امکان پذیر است. برای تسریع ریتم سینوسی، بهتر است از آتروپین به صورت داخل وریدی با دوز 0.4 - 0.6 میلی گرم استفاده شود. اگر پس از این مدت نبض کمتر از 60 ضربه در دقیقه باقی بماند، تجویز کسری اضافی آتروپین، هر کدام 0.2 میلی گرم، ممکن است تا زمانی که دوز کل دارو به 2 میلی گرم برسد. برادی کاردی مداوم (کمتر از 40 در 1 دقیقه) که با وجود تجویز آتروپین ادامه دارد، می تواند با تحریک الکتریکی از بین برود. از تجویز ایزوپروترنول باید اجتناب شود.
اختلالات هدایت اختلالات هدایت می تواند در سه سطح مختلف از سیستم هدایت قلبی رخ دهد: در ناحیه گره دهلیزی، بسته دهلیزی بطنی (His)، یا در قسمت های دورتر سیستم هدایت (فصل 183). هنگامی که انسداد در ناحیه گره دهلیزی رخ می دهد، به عنوان یک قاعده، ریتم جایگزینی (فرار؟) اتصال دهلیزی، با مجتمع های QRS با مدت طبیعی وجود دارد. اگر انسداد در دیستال در رابطه با گره دهلیزی رخ دهد، ریتم جایگزینی در ناحیه بطن ها رخ می دهد، در حالی که مجتمع های QRS پیکربندی خود را تغییر می دهند، مدت زمان آنها افزایش می یابد. ناهنجاریهای هدایتی میتوانند در هر سه بسته محیطی سیستم رسانا رخ دهند؛ تشخیص چنین ناهنجاریهایی برای شناسایی بیمارانی که در معرض خطر ایجاد انسداد عرضی کامل هستند، مهم است. در مواردی که مسدود شدن هر دو از سه پرتو رخ می دهد، آنها از وجود یک انسداد دو پرتو صحبت می کنند. چنین بیمارانی اغلب دچار بلوک دهلیزی بطنی کامل (بلوک عرضی کامل) می شوند. بنابراین، بیمارانی که ترکیبی از بلوک شاخه راست و همیبلوک قدامی یا خلفی چپ چپ دارند یا بیمارانی که بلوک شاخه چپ تازه شروع شده دارند، به ویژه در معرض خطر بالایی برای ایجاد بلوک کامل (عرضی) هستند.
میزان مرگ و میر در بیماران با بلوک دهلیزی کامل همراه با انفارکتوس قدامی میوکارد 80 تا 90 درصد و تقریباً 3 برابر بیشتر از میزان مرگ و میر در بیماران با بلوک دهلیزی کامل همراه با انفارکتوس میوکارد پایین (30 درصد) است. خطر مرگ در مراحل بعدی در میان بیمارانی که از مرحله حاد انفارکتوس میوکارد جان سالم به در برده اند نیز در مورد اول به طور قابل توجهی بالاتر است. تفاوت در مرگ و میر با این واقعیت توضیح داده می شود که بلوک قلبی در انفارکتوس میوکارد تحتانی معمولاً به دلیل ایسکمی گره دهلیزی بطنی ایجاد می شود. گره دهلیزی یک ساختار مجزا کوچک است و حتی ایسکمی یا نکروز با شدت خفیف می تواند باعث اختلال در عملکرد آن شود. با انفارکتوس میوکارد دیواره قدامی، ظاهر یک بلوک قلبی با اختلال عملکرد هر سه دسته از سیستم هدایت کننده همراه است و بنابراین، تنها نتیجه نکروز گسترده میوکارد است.
تحریک الکتریکی است درمان موثرافزایش ضربان قلب در بیماران مبتلا به برادی کاردی، که در نتیجه انسداد دهلیزی ایجاد شده است، اما هیچ اطمینانی وجود ندارد که چنین افزایشی در ضربان قلب همیشه مطلوب باشد. به عنوان مثال، در بیماران مبتلا به انفارکتوس میوکارد دیواره قدامی و انسداد کامل عرضی، پیش آگهی عمدتاً بر اساس اندازه انفارکتوس تعیین می شود و اصلاح نقص هدایت لزوماً تأثیر مفیدی در نتیجه بیماری ندارد. تحریک الکتریکی، با این حال، ممکن است در بیماران مبتلا به انفارکتوس میوکارد خلفی تحتانی که در آنها انسداد کامل عرضی با ایجاد نارسایی قلبی، افت فشار خون، برادی کاردی شدید، یا فعالیت بطن نابجا قابل توجه همراه است، مفید باشد. چنین بیمارانی با انفارکتوس میوکارد بطن راست اغلب به دلیل از دست دادن "سکته مغزی" دهلیزی به ضربان قلب بطنی پاسخ ضعیفی می دهند و ممکن است به ضربان دهی دهلیزی متوالی دو محوری و متوالی نیاز داشته باشند.
برخی از متخصصان قلب، قرار دادن پروفیلاکسی کاتتر را برای تحریک در بیماران مبتلا به اختلالات هدایتی ضروری می دانند که به عنوان پیش سازهای انسداد کامل (عرضی) شناخته می شوند. در این مورد اتفاق نظر وجود ندارد. تحریک مداوم برای بیمارانی که دارای بلوک دوفاسیکولار دائمی و بلوک گذرا درجه III در مرحله حاد انفارکتوس میوکارد هستند توصیه می شود. مطالعات گذشته نگر در گروه های کوچکی از چنین بیمارانی نشان می دهد که با انجام ضربان قلب مداوم، احتمال مرگ ناگهانی کاهش می یابد.
نارسایی قلبی. اختلالات گذرا بطن چپ با درجات مختلف در حدود 50 درصد از بیماران مبتلا به انفارکتوس میوکارد رخ می دهد. شایع ترین علائم بالینی نارسایی قلبی خس خس سینه در ریه ها و S3 در ریتم گالوپ S4 است. رادیوگرافی اغلب علائم احتقان ریوی را نشان می دهد. با این حال، ظهور علائم رادیولوژیکی احتقان ریوی با ظهور علائم بالینی مانند خس خس سینه در ریه ها و تنگی نفس همزمان نیست. علائم مشخصه همودینامیک نارسایی قلبی افزایش فشار پر شدن بطن چپ و فشار در تنه ریوی است. باید به خاطر داشت که این علائم ممکن است نتیجه بدتر شدن عملکرد دیاستولیک بطن چپ (نارسایی دیاستولیک) و / یا کاهش حجم ضربه ای همراه با اتساع ثانویه قلب (نارسایی سیستولیک) باشد (فصل 181). به استثنای چند مورد، درمان نارسایی قلبی همراه با انفارکتوس حاد میوکارد با درمان سایر بیماری های قلبی تفاوتی ندارد (فصل 182). تفاوت اصلی در استفاده از گلیکوزیدهای قلبی نهفته است. اثر مفید دومی در انفارکتوس حاد میوکارد قانع کننده نیست. این تعجب آور نیست، زیرا عملکرد نواحی میوکارد که توسط انفارکتوس گرفته نشده است می تواند طبیعی باشد، در عین حال، انتظار اینکه دیجیتالیس بتواند عملکرد سیستولیک و دیاستولیک مناطق میوکارد را که توسط انفارکتوس یا ایسکمی گرفته شده است را بهبود بخشد دشوار است. از سوی دیگر، دیورتیک ها تأثیر بسیار خوبی در درمان بیماران مبتلا به نارسایی قلبی با انفارکتوس میوکارد دارند، زیرا آنها احتقان ریوی را در حضور نارسایی سیستولیک و / یا دیاستولیک قلب کاهش می دهند. تجویز داخل وریدی فوروزماید به کاهش فشار پر شدن بطن چپ و کاهش ارتوپنه و تنگی نفس کمک می کند. با این حال، فوروزماید باید با احتیاط مصرف شود، زیرا می تواند باعث دیورز شدید و کاهش حجم پلاسما، برون ده قلبی، فشار شریانی سیستمیک و در نتیجه کاهش پرفیوژن کرونر شود. درمان های مختلفی با موفقیت برای کاهش پیش بارگذاری و علائم احتقان استفاده شده است. فرمهای مقدار مصرفنیترات ها ایزوسورباید دی نیترات خوراکی یا پماد نیتروگلیسیرین معمولی از این نظر که پیش بارگذاری را از طریق گشاد شدن رگها بدون کاهش حجم کل پلاسما کاهش می دهند، نسبت به دیورتیک ها برتری دارند.
علاوه بر این، نیترات ها می توانند عملکرد بطن چپ را از طریق تأثیرشان بر ایسکمی میوکارد بهبود بخشند، زیرا دومی باعث افزایش فشار پر شدن بطن چپ می شود. درمان بیماران مبتلا به ادم ریوی در Ch. 182. مطالعه وازودیلاتورها که باعث کاهش پس بار قلبی می شوند، نشان داده است که کاهش آن منجر به کاهش کار قلب می شود و در نتیجه می تواند عملکرد بطن چپ را به میزان قابل توجهی بهبود بخشد، فشار پر شدن بطن چپ را کاهش دهد، شدت بیماری را کاهش دهد. احتقان ریوی و در نتیجه باعث افزایش برون ده قلبی می شود.
مانیتورینگ همودینامیک اختلال عملکرد بطن چپ هنگامی که انقباض 20 تا 25 درصد میوکارد بطن چپ نقض شود از نظر همودینامیک قابل توجه می شود. حمله قلبی که 40 درصد از سطح بطن چپ یا بیشتر را درگیر می کند، معمولاً منجر به سندرم شوک قلبی می شود (به زیر مراجعه کنید). فشار گوه مویرگی ریوی و فشار دیاستولیک تنه ریوی به خوبی با فشار دیاستولیک بطن چپ مرتبط است، بنابراین اغلب به عنوان شاخص هایی که فشار پر شدن بطن چپ را منعکس می کنند استفاده می شود. قرار دادن کاتتر شناور بالون در تنه ریوی به پزشک این امکان را می دهد که به طور مداوم فشار پر شدن بطن چپ را کنترل کند. استفاده از این روش در بیماران مبتلا به علائم بالینیاختلالات یا بی ثباتی همودینامیک. کاتتر نصب شده در تنه ریوی همچنین به شما امکان می دهد میزان برون ده قلبی را تعیین کنید. اگر علاوه بر این، نظارت بر فشار داخل شریانی انجام شود، می توان مقاومت عروق محیطی را محاسبه کرد، که به کنترل تجویز داروهای منقبض کننده عروق و گشادکننده عروق کمک می کند. برخی از بیماران مبتلا به انفارکتوس حاد میوکارد افزایش قابل توجهی در فشار پر شدن بطن چپ (بیش از 22 میلی متر جیوه) و برون ده قلبی طبیعی (در حدود 2.6-3.6 لیتر در دقیقه در هر متر مربع) نشان می دهند، در حالی که برخی دیگر فشار پر شدن بطن چپ نسبتاً پایینی دارند.
منوی اصلی
پایان نامه برای درجه علمی
دکترای علوم پزشکی
سنت پترزبورگ
کار در گروه قلب و عروق انجام شد. خانم. کوشاکوفسکی در GOU DPO "آکادمی پزشکی سن پترزبورگ آموزش تحصیلات تکمیلی آژانس فدرال مراقبت های بهداشتی و توسعه اجتماعی"
مشاور علمی:
دکترای علوم پزشکی، پروفسور گریشکین یوری نیکولاویچ
مخالفان رسمی:
دکترای علوم پزشکی پروفسور زمتسوفسکی ادوارد ونیامینوویچ
دکترای علوم پزشکی پروفسور پانوف الکسی ولادیمیرویچ
دکترای علوم پزشکی، پروفسور چورینا سوتلانا کنستانتینوونا
سازمان پیشرو: GOU VPO "آکادمی پزشکی نظامی به نام سانتی متر. کیروف"
دفاع در "___" _____________________ 2008 در ساعت ... در جلسه شورای پایان نامه D.208.089.01 در آکادمی پزشکی سن پترزبورگ آموزش تحصیلات تکمیلی Roszdrav (191015، سنت پترزبورگ، خیابان Kirochnaya. 41).
پایان نامه را می توان در کتابخانه بنیادی GOU DPO "آکادمی پزشکی سن پترزبورگ آموزش تحصیلات تکمیلی Roszdrav" (195196، سن پترزبورگ، Zanevsky pr. 1/82) یافت.
دبیر علمی شورای پایان نامه
دکترای علوم پزشکی پروفسور ع.م. لیلا
شرح کلی کار
فوریت مشکل
در بیماران مبتلا به انفارکتوس حاد میوکارد (AMI)، مرگ بخشی از میوکارد بطن چپ (LV) در حال کار، اساساً تغییرات جبرانی در قلب را آغاز می کند و بر اندازه، هندسه و عملکرد آن تأثیر می گذارد. مجموعه این تغییرات با مفهوم بازسازی پس از انفارکتوس متحد شده است [Belov Yu.V. 2003; Cohn J.N. 2000، ساتون ام.جی. 2000]. در برخی بیماران، نتیجه بازسازی، تثبیت طولانی مدت اندازه و عملکرد LV است که با پیش آگهی نسبتاً مطلوب قلبی همراه است. در همان زمان، در سایر بیماران به مرحله ناسازگاری می رود، که با افزایش نامطلوب همودینامیک، بیش از حد و / یا پیشرونده در LV و کاهش انقباض آن همراه است. مطالعات متعددی که در سالهای اخیر انجام شده است، رابطه بین افزایش حجم انتهای دیاستولیک (شاخص)، حجم انتهای سیستولیک (شاخص) آن و کاهش کسر جهشی مرتبط با بازسازی نامطلوب پس از انفارکتوس را با افزایش خطر نشان دادهاند. مرگ قلبی، AMI مکرر، ایجاد نارسایی احتقانی قلب (HF)، و همچنین سکته آمبولیک [Belenkov Yu.N. 2000; Pfeffer M.A. 1993; Schaer G. 2002; Solomon S.D. 2005].
بنابراین، توانایی پیشبینی ماهیت نامطلوب بازسازی LV پس از انفارکتوس معادل توانایی شناسایی در دوره اولیهحمله قلبی در بیماران با خطر بالای عوارض قلبی عروقی و مرگ قلبی در دراز مدت. چنین پیشبینی، به نوبه خود، میتواند نقش مهمی در ارزیابی امکانپذیری انجام مجدد عروق درون عروقی / جراحی در حوضچه شریان مرتبط با انفارکتوس در بیمارانی که تحت ترومبولیز قرار گرفتهاند بازی کند [Lyapkova N.B. 2007]، و همچنین رویکرد متفاوت تر به انتصاب در دوره پس از انفارکتوس داروهاقادر به جلوگیری از بازسازی [Belenkov Yu. N. 2005; A. Skvortsov 2006; Kloner R.A. 2001]. در مطالعات اخیر، ارتباط برخی از شاخصهای دوره حاد انفارکتوس میوکارد، از جمله موفقیت خونرسانی مجدد انجام شده، تعدادی از شاخصها که اندازه انفارکتوس را منعکس میکنند و غیره، با احتمال بازسازی نامطلوب پس از انفارکتوس نشان دادهاند. با این حال، هیچ رویکرد پذیرفته شده ای برای شناسایی بیماران در معرض خطر وجود ندارد.
ایجاد نارسایی قلبی پس از حمله قلبی با بدتر شدن کیفیت زندگی و کاهش قابل توجه میزان بقای بیماران همراه است [Novikova N.A. 2002; بووی ام.ال. 2003; بورسی اف 2005]. در عین حال، علیرغم پیشرفت قابل توجهی که در سالهای اخیر در درمان AMI به دست آمده است، میزان مرگ و میر در بیماران مبتلا به HF در طول سال اول پس از AMI عملا کاهش نیافته است. از آنجایی که بازسازی LV عامل اصلی تعیین کننده ایجاد نارسایی قلبی پس از انفارکتوس میوکارد است، به نظر می رسد مطالعه امکان پیش بینی توسعه نارسایی قلبی بر اساس تجزیه و تحلیل شاخص هایی که بر ماهیت بازسازی پس از انفارکتوس تأثیر می گذارد، مهم است.
هدف از مطالعه
توسعه معیارهایی برای پیش آگهی یک دوره نامطلوب بازسازی بطن چپ پس از انفارکتوس بر اساس تجزیه و تحلیل شاخص های بالینی، آزمایشگاهی و ابزاری موجود دوره حاد انفارکتوس میوکارد.
اهداف پژوهش
- توسعه پیشبینیکنندههای موفقیت خونرسانی مجدد بر اساس تجزیه و تحلیل غلظت آنزیمهای قلبی در دوره حاد انفارکتوس میوکارد. برای شناسایی پارامترهای الکتروکاردیوگرافی دوره حاد انفارکتوس میوکارد، اجازه می دهد تا بهترین پیش بینی از نتیجه خونرسانی مجدد. برای مطالعه فراوانی تغییرات نامطلوب در مهمترین پارامترهای بازسازی پس از انفارکتوس - اندیس پایان دیاستولیک، اندیس انتهای سیستولیک بطن چپ و کسر جهشی. بررسی امکان پیشبینی ماهیت بازسازی بر اساس تحلیل شاخصهای بالینی دوره حاد. برای شناسایی شاخص های آنزیمی و الکتروکاردیوگرافی که امکان پیش بینی ماهیت نامطلوب بازسازی را فراهم می کند. مهمترین پیش بینی کننده های اکوکاردیوگرافی تغییرات نامطلوب در پارامترهای اصلی بازسازی، از جمله مطالعه قابلیت های پیش بینی پارامترهای مطالعه داپلر بافت را بیابید. بر اساس تجزیه و تحلیل پیشبینیکنندههای شناسایی شده پویایی نامطلوب شاخصهای پایان دیاستولیک، پایان سیستولیک و کسر جهشی، برای ایجاد الگوریتمی برای پیشبینی بازسازی نامطلوب بطن چپ به عنوان یک کل. شناسایی عواملی که باعث ایجاد زودرس (در طول سال اول) نارسایی قلبی پس از انفارکتوس حاد میوکارد می شود.
تازگی علمی کار
تازگی علمی کار شامل شناسایی شاخص های موجود در دوره حاد انفارکتوس میوکارد است که امکان پیش بینی ماهیت بازسازی پس از انفارکتوس را فراهم می کند.
نشانگرهای غیر تهاجمی (آنزیمی و الکتروکاردیوگرافی) موفقیت خونرسانی مجدد، عاملی که می تواند به طور قابل توجهی بر ماهیت بازسازی تأثیر بگذارد، شناسایی شده است.
در میان متغیرهای بالینی، آزمایشگاهی، الکتروکاردیوگرافی و اکوکاردیوگرافی دوره حاد انفارکتوس میوکارد، شاخص هایی شناسایی شده اند که بیشترین تأثیر را در بازسازی دارند و همچنین مقادیر کمی آنها یافت شده است که امکان پیش بینی یک نوع نامطلوب را فراهم می کند. بازسازی با احتمال زیاد
یک رویکرد جدید برای تجزیه و تحلیل شاخصهای مطالعه داپلر بافتی دوره حاد انفارکتوس میوکارد پیشنهاد شده است که امکان پیشبینی بازسازی نامطلوب پس از انفارکتوس را فراهم میکند.
الگوریتمی برای پیشبینی بازسازی نامطلوب به طور کلی، بر اساس دادههای بهدستآمده در پیشبینیکنندههای بازسازی پس از انفارکتوس، توسعه داده شده است.
مهمترین پیشبینیکنندههای توسعه مهمترین پیامد منفی بازسازی نامطلوب - نارسایی قلبی - در اوایل دوره پس از انفارکتوس آشکار شد.
داده های به دست آمده به ما اجازه می دهد تا انتخاب دارو را بهینه کنیم و درمان جراحیبیمار پس از انفارکتوس حاد میوکارد.
مقررات دفاعی
- مطالعه "نمایه" غلظت کراتین کیناز و بخش CF کراتین کیناز در دوره حاد انفارکتوس میوکارد امکان ارزیابی موفقیت درمان ترومبولیتیک "در سطح میوکارد" را فراهم می کند. ارزیابی تعدادی از پارامترهای الکتروکاردیوگرافی رپلاریزاسیون بطن چپ، که برای تجزیه و تحلیل در دوره حاد انفارکتوس میوکارد در دسترس است، به ما امکان می دهد در مورد نتیجه خونرسانی مجدد میوکارد پس از درمان ترومبولیتیک نتیجه گیری کنیم. بر اساس تجزیه و تحلیل تعدادی از پارامترهای بالینی، آزمایشگاهی و ابزاری موجود در دوره حاد انفارکتوس میوکارد می توان تغییرات نامطلوب در شاخص های انتهای دیاستولیک، انتهای سیستولیک و کسر جهشی بطن چپ را در دراز مدت پس از انفارکتوس حاد میوکارد پیش بینی کرد. تجزیه و تحلیل تعدادی از پارامترهای مطالعه داپلر بافت پیشنهاد شده توسط ما، که منعکس کننده ویژگی های کمی انقباض موضعی و آرامش بطن چپ، به دست آمده در دوره حاد انفارکتوس میوکارد است، به ما امکان می دهد ماهیت بازسازی بطن چپ پس از انفارکتوس را پیش بینی کنیم. تجزیه و تحلیل پیش بینی کننده های اصلی انواع مختلف بازسازی نامطلوب بطن چپ پس از انفارکتوس، پیش بینی ماهیت نامطلوب بازسازی را به طور کلی ممکن می سازد. مطالعه تعدادی از شاخص های دوره حاد امکان پیش بینی توسعه اولیه نارسایی قلبی پس از انفارکتوس میوکارد را فراهم می کند.
اهمیت عملی کار
- روشی برای تشخیص نتایج درمان ترومبولیتیک بر اساس تجزیه و تحلیل تغییر غلظت نشانگرهای قلبی در دسترس (کراتین کیناز و کسر MB آن) در اولین روز انفارکتوس حاد میوکارد پیشنهاد شده است. روشهایی برای تشخیص نتایج خونرسانی مجدد میوکارد بر اساس تجزیه و تحلیل پارامترهای الکتروکاردیوگرافی بهدستآمده در دو روز اول انفارکتوس حاد میوکارد (دینامیک ارتفاع حداکثر و کل قطعه ST، دینامیک دامنه کل موج T) ایجاد شده است. مهمترین پیشبینیکنندههای یک نوع نامطلوب از بازسازی بطن چپ پس از انفارکتوس، شامل افزایش قابلتوجه در شاخصهای انتهای دیاستولیک و انتهای سیستولیک، و همچنین کاهش کسر جهشی بطن چپ، شناسایی شدند. مقادیر کمی این پیشبینیکنندهها پیدا شد که بیماران را با پیش آگهی مطلوب و نامطلوب بازسازی جدا میکند. پارامترهای مطالعه داپلر بافت، مربوط به دوره حاد انفارکتوس میوکارد، شناسایی شد، که به پیش بینی ماهیت بازسازی بطن چپ پس از انفارکتوس، از جمله محاسبه تعدادی از پارامترهای اطلاعاتی جدید برای این منظور، اجازه می دهد. بر اساس تجزیه و تحلیل پارامترهای ابزاری و آزمایشگاهی موجود در دوره حاد انفارکتوس میوکارد، الگوریتمی برای پیشبینی بازسازی نامطلوب بعد از انفارکتوس بطن چپ ایجاد شد. امکان پیش بینی توسعه نارسایی قلبی در سال اول پس از انفارکتوس حاد میوکارد بر اساس تجزیه و تحلیل تعدادی از شاخص های دوره حاد نشان داده شده است. نشان داده شده است که کدام پارامترهای اکوکاردیوگرافی که 12 ماه پس از انفارکتوس حاد میوکارد ارزیابی شده است، بیشترین همبستگی را با حضور تظاهرات بالینینارسایی قلبی.
مشارکت شخصی نویسنده در تعریف ایده اصلی مطالعه، برنامه ریزی آن، توسعه روش های اجرای آن، جمع آوری، پردازش و تجزیه و تحلیل مطالب به دست آمده بیان شد. نویسنده به طور مستقیم بیماران را برای ورود به مطالعه انتخاب کرد و به مدت 12 ماه پیگیری کرد. معاینه بالینی، تجزیه و تحلیل کمی تمام الکتروکاردیوگرام ها و پارامترهای آنزیمی، تمام مطالعات اکوکاردیوگرافی شخصا انجام شد.
نتایج این مطالعه به کار بخشهای قلب و عروق و بخش اکوکاردیوگرافی مؤسسه بهداشتی دولتی سنت پترزبورگ "بیمارستان پوکروفسکایا"، بخش جراحی درون عروقی اشعه ایکس موسسه مراقبتهای بهداشتی دولتی سن پترزبورگ "بیمارستان چند رشتهای شهر" معرفی شد. شماره 2" مطالب پایان نامه در دوره های سخنرانی و سمینارهای گروه قلب و عروق گنجانده شده است. خانم. کوشاکوفسکی و گروه فیزیولوژی بالینی و تشخیص عملکردی GOU DPO "آکادمی پزشکی سن پترزبورگ آموزش تحصیلات تکمیلی Roszdrav".
تایید کار
نتایج اصلی پایان نامه در کنگره ملی قلب و عروق روسیه ارائه شد (تامسک، 2004؛ مسکو، 2005؛ مسکو، 2007). انجمن علمی و آموزشی همه روسی "کاردیولوژی 2007" (مسکو، 2007)؛ پنجمین کنگره متخصصان تشخیص سونوگرافیدر پزشکی (مسکو، 2007)؛ کنفرانس علمی-عملی "استفاده از فناوری های پیشرفته اولتراسوند در مطالعه بیماران مبتلا به بیماری های قلبی عروقی" (سن پترزبورگ، 2007); هفتمین کنفرانس بین المللی "بیماری عروق کرونر: از پیشگیری تا مداخله" (ونیز، ایتالیا، 2007); سمینار علمی مشترک بخش زیست پزشکی خانه دانشمندان. M. Gorky RAS، شعبه شمال غرب انجمن پزشکی هسته ای و باشگاه اکوکاردیوگرافی سن پترزبورگ " مشکلات معاصرقلبی بصری "(سن پترزبورگ، 2008).
مفاد اصلی پایان نامه در 28 اثر چاپی منتشر شده منعکس شده است که 10 مورد از آنها در مجلات کمیسیون عالی گواهی فدراسیون روسیه منتشر شده است.
ساختار و محدوده پایان نامه
پایان نامه شامل یک مقدمه، یک بررسی ادبیات، یک فصل "مواد و روش ها"، 9 فصل به تجزیه و تحلیل مطالب خود، یک نتیجه گیری و فهرست منابع است. متن پایان نامه در 281 صفحه تایپ شده با 42 شکل و 113 جدول ارائه شده است. فهرست منابع شامل 266 عنوان است. 37 منبع داخلی و 229 منبع خارجی.
مواد و روش تحقیق
این مطالعه شامل بیمارانی بود که تحت STEMI در الکتروکاردیوگرام (ECG) قرار گرفتند که قرار بود تحت ترومبولیز قرار بگیرند که معیارهای زیر را برآورده میکردند.
معیارهای ورود به مطالعه عبارت بودند از: 1) درد ایسکمیک قفسه سینه حداقل 20 دقیقه. و بیش از 12 ساعت قبل از شروع برنامه ریزی شده ترومبولیز ایجاد نمی شود. 2) بالا رفتن قطعه ST ECG با پذیرش حداقل 0.1 میلی ولت (1 میلی متر) در 2 یا بیشتر لید اندام، یا در حداقل 2 یا چند لید قفسه سینه مجاور.
معیارهای خروج عبارت بودند از: 1) وجود موارد منع ترومبولیز سیستمیک. 2) محاصره کاملشاخه سمت چپ او در نوار قلب. 3) شوک قلبی هنگام پذیرش؛ 4) نقص دریچه قابل توجه همودینامیک. 5) کیفیت تصویر نامطلوب با اکوکاردیوگرافی (اکوکاردیوگرافی).
آلتپلاز یا استرپتوکیناز به عنوان یک عامل ترومبولیتیک، بسته به در دسترس بودن دارو، طبق طرح های استاندارد، طبق دستورالعمل سازنده، استفاده شد. علاوه بر ترومبولیز، برای همه بیماران تجویز شد دارودرمانیطبق استانداردهای پذیرفته شده عمومی
معاینه بالینی شامل ارزیابی تاریخچه و پارامترهای بالینی در هنگام پذیرش و ارزیابی کلاس NYHA HF در 12 ماهگی بود.
ECG قبل از شروع ترومبولیز، 3 ساعت بعد و 48 ساعت بعد از آن (به ترتیب EKG-1، EKG-2، EKG-3) ثبت شد. در EKG-1 و EKG-2، تعداد لیدهای با ارتفاع ST محاسبه شد. تعداد لیدها با Q پاتولوژیک (n سوراخ Q)؛ ارتفاع ST در سرب، جایی که حداکثر است (حداکثر ارتفاع ST، STmax). مجموع مقادیر ارتفاع ST در تمام سرنخهایی که در آن واقع شده است (کل ارتفاع ST، STsum)؛ دامنه کل امواج T در لیدهایی با ارتفاع قطعه ST (به ترتیب sumT1 و sumT2) و تفاوت در این دامنه ها (sumT2 - sumT1). در EKG-3، دامنه کل امواج T (sumT3) محاسبه شد و تفاوت بین دامنه های "T" در EKG-3 و EKG-1 (sumT3 - sumT1) محاسبه شد.
تجزیه و تحلیل غلظت کراتین کیناز (CK) و کسر MB کراتین کیناز (MB) در خون وریدی قبل از ترومبولیز (CK1 و MB1) و سپس 4 بار دیگر در فواصل 6 ساعته (CK2 و MB2، CK3 و MB3). و غیره) انجام شد، آن ها. در 24 ساعت اول حمله قلبی سلسله مراتب متقابل مقادیر غلظت آنزیم در این 5 سنجش با اعداد از 1 تا 5 که در یک ردیف مرتب شده بودند کدگذاری شد، در حالی که موقعیت عدد در ردیف با شماره ترتیبی سنجش آنزیم مطابقت داشت، بنابراین "پروفایل" ساخته شد. از غلظت آنزیم. به عنوان مثال، برای CC، سری 1 5 4 3 2 سلسله مراتب زیر را از مقادیر CC منعکس می کند: غلظت CC1 - اول از پایین (کوچکترین)، CC2 - پنجم از پایین (بالاترین)، CC3 - چهارم از پایین، CC4 - 3 , CC5 - دوم. علاوه بر این، حداکثر غلظت KK (KKmax) و MV (MBmax) در نظر گرفته شد.
EchoCG بر روی دستگاه های Combison-320، Siemens Sonoline 60، Vivid-3 Expert انجام شد. EchoCG قبل از ترومبولیز، در هنگام ترخیص (8.8 ± 0.2 روز پس از بستری)، پس از 6 و 12 ماه انجام شد. پس از AMI (به ترتیب EchoKG-1، EchoKG-2، EchoKG-6 و EchoKG-12) طبق پروتکل استاندارد. یک مطالعه استاندارد تک متغیره لزوماً شامل اندازهگیری جدایی میترال-سپتوم (EPSS) بود. در حالت B، حجم انتهای دیاستولی LV (EDV)، حجم انتهای سیستولیک LV (ESV) با روش سیمپسون تعیین شد، شاخص پایان دیاستولیک (EDI) به صورت EDV / BSA محاسبه شد. و شاخص پایان سیستولیک (ESI) به صورت ESR/BSA، ml/m2، که در آن BSA سطح بدن است. کسر جهشی LV (EF) نیز با استفاده از فرمول محاسبه شد: EF (%) = [(EDV - ESR) / EDV] 100. انقباض ناحیه LV با توجه به مدل رایج تقسیم LV به 16 بخش، با یک نیمه کمی ارزیابی شد. روش مطابق با سیستم چهار نقطه ای پذیرفته شده عمومی (1 - طبیعی؛ 2 - هیپوکینزی؛ 3 - آکینزی؛ 4 - دیسکینزی). برای توصیف کمی میزان اختلال انقباض موضعی، شاخص انقباض محلی LV (LVI) به عنوان مجموع نقاط / 16 محاسبه شد.
در حالت داپلر، بررسی استاندارد جریان خون روی دریچه ها انجام شد.
با EchoCG-2، مطالعه ای از سرعت حرکت طولی 12 بخش پایه و میانه میوکارد LV در حالت داپلر بافت پالسی نیز انجام شد [Alekhin MN. 2002]. نمودارهای حاصل از سرعت میوکارد در قالب دیجیتال ذخیره شد و پس از آن اندازهگیریها روی تصاویر ذخیرهشده انجام شد. حداکثر سرعت سیستولیک (Sm) و دیاستولیک (Em) در تمام بخشها اندازهگیری شد. سپس مجموع این سرعتها برای بخشهای معمولی انقباض (Sm sokr و Em sokr) و بخشهای با انقباض مختل (Sm dys و Em dys) و همچنین شاخصهای این سرعتها محاسبه شد. نسبت آنها به تعداد کل قطعات با انقباض مختل (به ترتیب، ind-Sm sokr، ind-Sm dys، ind-Em sokr و ind-Em dys). علاوه بر این، تعداد قطعات با انقباض مختل، که در آنها یک پیک مثبت انقباض هم حجمی ثبت شده بود، ارزیابی شد و شاخص IVC (ind-IVC) به روشی مشابه محاسبه شد.
مشخصات عمومی بیماران معاینه شده
در مجموع 187 بیمار در این مطالعه وارد شدند. تجزیه و تحلیل توانایی نشانگرهای آنزیمی و الکتروکاردیوگرافی برای پیشبینی نتیجه خونرسانی مجدد میوکارد در بخشی از بیماران مورد بررسی که تحت EchoCG-1 و EchoCG-2 قرار گرفتند، انجام شد و دادههای آزمایشگاهی و ECG مربوطه در 107 و 106 بیمار بهدست آمد. به ترتیب. در ارتباط با حذف از مشاهده تعدادی از بیماران (که تحت عروق عروق کرونر قرار گرفته بودند، دچار انفارکتوس مکرر شده بودند، تماس خود را از دست دادند و فوت کردند)، تجزیه و تحلیل عوامل مؤثر بر پویایی 12 ماهه CDI در 102 بیمار انجام شد، تجزیه و تحلیل از پویایی CSI و EF - در 115 بیمار، پیش آگهی توسعه اولیه HF - در 123 بیمار. تجزیه و تحلیل ارزش پیش آگهی پارامترهای داپلر بافتی در 55 بیمار مورد بررسی - در بیمارانی که تحت TDI با EchoCG-2 قرار گرفتند و EchoCG-12 نهایی را انجام دادند، انجام شد.
سن بیماران وارد شده در مطالعه 1 ± 59 سال (35 تا 80 سال) بود. بیماران مرد غالب بودند (146 نفر، 78٪). توزیع بیماران بر اساس وجود عوامل خطر اصلی بالینی قلبی به شرح زیر بود: 94-1 بیمار (50%); 1 - 72 بیمار (39٪)؛ 0 - 21 (11%). 60 بیمار (32%) در زمان بستری سابقه آنژین ناشی از فعالیت بیش از 1 ماه داشتند. در 24 بیمار (13%)، این AMI تکرار شد. اکثر بیماران ثبت نام شده (153 بیمار، 82٪) در زمان پذیرش به عنوان Killip کلاس I طبقه بندی شدند. 34 (18%) - تا کلاس های II و III. بیماران با کلاس IV طبق کیلیپ، همانطور که در بالا ذکر شد، در مطالعه قرار نگرفتند. اکثر بیماران مبتلا به انفارکتوس Q (165، 88٪)، 118 بیمار (63٪) - انفارکتوس قدامی میوکارد تشخیص داده شدند. ترومبولیز سیستمیک عمدتا با آلتپلاز (166 بیمار، 89٪)، 21 بیمار با استرپتوکیناز انجام شد. زمان از شروع درد قفسه سینه تا شروع خونرسانی مجدد بین 20 تا 555 دقیقه (میانگین 6 ± 224 دقیقه) بود.
حداکثر غلظت CC در روز اول AMI 177 ± 3478 U / L (از 168 تا 15476 U / L)، MV - 27 ± 539 U / L (از 25 تا 1960 U / L) بود.
در بیماران مورد بررسی، هیچ افزایشی در اندازه دیاستولیک اولیه LV مشاهده نشد: مقادیر CDI برای مردان (0.8 ± 57.0 میلی لیتر بر متر مربع) و زنان (1.7 ± 55.8 میلی لیتر در متر مربع) از حد نرمال تجاوز نکرد. اندازه دیاستولیک LV، اندازه گیری شده در حالت M (0.6 ± 47.7 میلی متر)، نیز افزایش نیافته است. شاخص ILC، که نشان دهنده اندازه ناحیه اختلال عملکرد انقباضی LV مرتبط با ایجاد انفارکتوس میوکارد است، به طور قابل توجهی افزایش یافت (0.03 ± 1.75). کاهش اولیه در انقباض جهانی متوسط بود: میانگین EF 0.9 ± 49.4٪ (از 22.6 به 73.4٪) بود.
تحلیل آماری
تجزیه و تحلیل آماری عمدتاً با استفاده از نرم افزار Statistica 6.0 (StatSoft, Inc. 1984-2001) انجام شد. علاوه بر این، از نرم افزار SAS 8.2 (SAS Institutes Inc. Cary, NC) استفاده شد.
مقادیر متغیر پیوسته به صورت میانگین ± خطای استاندارد میانگین ارائه می شود. مقايسه ميانگين مقادير در دو گروه با استفاده از آزمون دانشجويي با تعداد گروههاي بيش از دو گروه به روش فاصله اطمينان 99 درصد (CI) با تصحيح بونفروني انجام شد. تفاوت در تعداد پیامدها بین دو گروه با استفاده از جداول 2x2 در بخش آمار ناپارامتریک ارزیابی شد. جستجوی "نقاط تقسیم" متغیرهای پیوسته با استفاده از روش "درخت رگرسیون" (C&RT) برنامه Statistica، در برخی موارد - تابع خارج از ROC ماژول رگرسیون لجستیک برنامه SAS انجام شد. نقاط تفکیک متغیرهای طبقه بندی با استفاده از تابع "جدول و بنر" برنامه Statistica پیدا شد. ارزیابی تأثیر مستقل تعدادی از متغیرها بر شاخص نهایی با استفاده از رگرسیون لجستیک انجام شد، درجه تأثیر عامل به صورت نسبت شانس (OR) بیان شد که نشاندهنده 95٪ CI است. قبل از تدوین مدل های رگرسیونی، در تعدادی از موارد، تحلیل همبستگی متغیرهای مورد مطالعه انجام شد. اهمیت تفاوت در همه جا به صورت p تعریف شد<0,05.
نسبت احتمال (LR) برای پیش بینی بازسازی نامطلوب به طور کلی با استفاده از فرمول های زیر محاسبه شد: LR + = Se / (1-Sp). LR- = (1-Se) / Sp، که در آن (LR +) نسبت احتمال در حضور پیش بینی کننده مورد مطالعه است. (LR-) - نسبت احتمال در غیاب پیش بینی مورد مطالعه؛ Se حساسیت پیش بینی کننده به بازسازی نامطلوب است. Sp ویژگی پیش بینی کننده است. برای ساده کردن محاسبات، لگاریتم اعشاری LR هر پیش بینی کننده، lg (LR +) و lg (LR-) محاسبه شد، سپس مقادیر آنها بسته به وجود یا عدم وجود یک یا آن پیش بینی کننده در یک بیمار خاص، جمع شد. بالا، و لگاریتم کل نسبت احتمال lg (LR). سپس نسبت احتمال کل با در نظر گرفتن تأثیر همه پیش بینی کننده ها (LR) محاسبه شد: LR = 10lg (LR). پس از آن، بر اساس نسبت شانس پیش آزمون ایجاد بازسازی نامطلوب (ORpre) برابر با 0.25، نسبت شانس پس آزمون (ORpost) محاسبه شد: ORpost = ORpre LR. در نهایت، احتمال پس آزمون بازسازی نامطلوب (Рpost) پیدا شد: Рpost = ОШpost / (ОШpost + 1) 100%.
ارزیابی غیر تهاجمی بازده خونرسانی مجدد در انفارکتوس حاد میوکارد
مرحله اول مطالعه، بررسی ارزش تشخیصی تعدادی از شاخص های الکتروکاردیوگرافی و آنزیمی دوره حاد انفارکتوس میوکارد در رابطه با اثربخشی خونرسانی مجدد عروق کرونر بود، عاملی که می تواند تأثیر بسزایی در بازسازی پس از انفارکتوس داشته باشد. پویایی شاخص های انقباض LV محلی در دوره حاد به عنوان یک روش مرجع برای ارزیابی اثربخشی خونرسانی مجدد "در سطح میوکارد" استفاده شد. با توجه به داده های موجود در ادبیات، نتیجه خونرسانی مجدد "به طور کلی" را منعکس می کند، هم در سطح شریان اپی کاردیال و هم در سطح میکروسیرکولاسیون، زیرا با وضعیت نهایی خونرسانی به شریان تعیین می شود. وابسته به میوکارد، و بنابراین، بهتر از آنژیوگرافی عروق کرونر با اهداف مطالعه ما مطابقت داشت.
بررسی اثربخشی خونرسانی مجدد در انفارکتوس حاد میوکارد با استفاده از آنزیم ها – نشانگرهای قلبی: کراتین کیناز تام و کسر CF کراتین کیناز
ماهیت پرفیوژن میوکارد وابسته در عرض 24 ساعت پس از ترومبولیز می تواند به طور پویا در نتیجه اپیزودهای مکرر کانالیزه کردن مجدد - انسداد مجدد تغییر کند. بنابراین، از دیدگاه ما، تجزیه و تحلیل "پروفایل آنزیم" به ما امکان می دهد تا نتیجه نهایی ترومبولیز را با دقت بیشتری نسبت به شاخص های رایج مورد استفاده ارزیابی کنیم - زمان تا رسیدن به اوج غلظت آنزیم یا سرعت افزایش غلظت در 60-90 دقیقه اول پس از ترومبولیز.
هنگام تجزیه و تحلیل انواع پروفایل های غلظت آنزیم های قلبی، تنوع زیاد آنها آشکار شد: تعداد پروفایل های مختلف CC 28 و پروفایل های MB - 29 بود. با این وجود، در اکثر بیماران (در 75٪ از بیماران مورد مطالعه). موارد برای CC و در 70٪ موارد برای MB)، یکی از 7 نمایه اغلب مشاهده شد.
تنها نمایهای که امکان پیشبینی نتیجه خونرسانی مجدد را در سطح معنیداری آماری فراهم کرد، نمایه QC 1 5 4 3 2 بود، یعنی. با حداکثر اولیه (در ساعت 6) و کاهش مداوم سطح آنزیم در تمام آنالیزهای بعدی. در میان بیماران با این مشخصات QC، خونرسانی مجدد در 25 مورد (95% فاصله اطمینان (CI 51.9 - 83.6) موفقیت آمیز بود، در 11 بیمار ناموفق بود (95% فاصله اطمینان (CI): 16.4 - 48.1)، ص.<0,05. Данный профиль регистрировался наиболее часто (у 34% пациентов) и наблюдался в 40% случаев успешной реперфузии (УР). Тем не менее, у оставшихся 2/3 пациентов предсказать результат реперфузии на основании индивидуальных профилей ферментов не удавалось. В связи с этим индивидуальные профили были объединены в совокупности, что значительно повысило их диагностическую ценность.
سنگدانه ها تمام پروفایل های این آنزیم را با اوج غلظت اولیه (6 ساعت؛ 12 ساعت؛ 6 یا 12 ساعت) ترکیب کردند. علاوه بر این، پروفایلهای CC موجود در دانهها با کاهش مداوم غلظت پس از اوج بدون افزایش مکرر مشخص شدند. هنگام جمعآوری مجموعههای نمایههای MB، تنها واقعیت دستیابی اولیه به حداکثر غلظت در نظر گرفته شد.
تجزیه و تحلیل نشان داد که تنها مجموعههای CK و MB دارای ارزش تشخیصی در رابطه با UR هستند، که احتمال پیک آنزیمی را در هر دو ساعت 6 و 12 تأیید میکنند (به ترتیب "-KK" و "-MB" تعیین شدند). . تشخیص قابل اعتماد نتیجه خونرسانی مجدد نیز هنگام ترکیب چنین مجموعه هایی از CC و MB ("-KK + -MB" و "-KK یا -MB") امکان پذیر بود. ارزش تشخیصی پیش بینی کننده های آنزیمی خونرسانی مجدد در جدول 1 نشان داده شده است.
همه پیشبینیکنندههای بهدستآمده ویژگی نه چندان بالایی را نشان دادند، یعنی. در صورت خونرسانی مجدد ناموفق می توان در بیماران ثبت کرد، با این حال، حساسیت آنها، به عنوان یک قاعده، بیشتر از پیش بینی کننده های آنزیمی رایج (80٪) است. لازم به ذکر است که CK با وجود ویژگی بیشتر دومی در رابطه با آسیب میوکارد، ارزش تشخیصی بالاتری را نشان داد و نه MB.
انفارکتوس میوکارد (بیماری ایسکمیک حاد قلب) یک نکروز کانونی عضله قلب است که با کمبود گردش خون ایجاد می شود. شکل و وسعت به کالیبر و محل رگ مسدود شده بستگی دارد. انفارکتوس میوکارد حلقوی - آسیب به راس قلب. این یک شکل نیم دایره ای دارد که از پشت به دیواره جلویی از طریق سطح جانبی یا پایینی هدایت می شود - حمله قلبی تمام دیواره های بطن چپ را می گیرد.
با ناتوانی عروق کرونر در تامین نیاز اکسیژن میوکارد، کانون ایسکمی و سپس نکروز رخ می دهد. عوامل اتیولوژیک حمله قلبی:
- آترواسکلروز با ضایعه غالب آئورت و عروق کرونر قلب.
- فشار خون بالا، فرم قلبی.
- ترومبوز و آمبولی عروق کرونر مرتبط با انعقاد بیش از حد خون.
- واسکولیت (آرتریت)، که منجر به تکثیر اپیتلیوم داخل عروقی و اسکلروز دیواره می شود.
- استرس شدید فیزیکی یا روانی-عاطفی.
- اضافه وزن، عادات بد، عدم تحرک بدنی، اشتباه در غذا.
انفارکتوس میوکارد راس حلقوی بطن چپ اغلب با ترومبوز شریان بین بطنی قدامی ایجاد می شود.
انفارکتوس حاد دایره ای یک بیماری قلبی با کانون بزرگ ترانس دیواری است که با انسداد شریان سیرکومفلکس همراه است. منجر به عوارض شدید، از جمله مرگ در اثر شوک قلبی یا. تظاهر بالینی:
- درد انقباض حاد در پشت جناغ؛
- احساس ترس وحشتناک؛
- هایپریدروز - افزایش تعریق؛
- ضعف شدید؛
- حالت کلاپتوئید؛
- کمبود هوا؛
- احساس تپش قلب و نبض.
انفارکتوس کانونی بزرگ همیشه در ECG قابل مشاهده است. تظاهرات اصلی ظهور یک موج Q غیر طبیعی است که به همین دلیل به آن انفارکتوس کیو می گویند. بسته به محل آسیب قلبی، تغییرات در لیدهای خاصی ثبت می شود.

انفارکتوس راس دایره ای یک آسیب شناسی نسبتاً رایج است، اغلب دوره چنین حمله قلبی شدید است، پارگی دیواره خارجی در راس امکان پذیر است.
انفارکتوس دایره ای میوکارد که دیواره تحتانی بطن چپ را درگیر می کند در لیدهای II، III، aVF، Dorsalis، V3-V4، V7-V9 آشکار می شود. در صورت آسیب از طریق دیواره جانبی، علاوه بر موارد ذکر شده، تغییراتی در موج Q در لیدهای I، V5-V6، aVL، Anterior، Inferior مشاهده می شود.
آسیب به عضله قلب در 4 مرحله رخ می دهد:
- حمله قلبی 24 ساعته (مرحله حاد) با بالاترین خطر ابتلا به عوارض شدید مشخص می شود. این بیماری با نکروز فیبرهای عضلانی با پاسخ سلولی ضعیف در امتداد محیط نشان داده می شود.
- مرحله حاد 1 هفته طول می کشد، کانون نکروز به وضوح تشکیل می شود، توسط لکوسیت های هسته ای سگمنتال نفوذ می کند، در اطراف آن یک "تاج هموراژیک" (منطقه خونریزی های نقطه ای) وجود دارد. وضعیت بیمار وخیم اما پایدار است.
- بافت گرانولاسیون در ناحیه نکروز - مرحله تحت حاد - رشد می کند. تا یک ماه طول می کشد، وضعیت بیمار به تدریج بهبود می یابد، کار قلب ترمیم می شود.
- مرحله اسکار 2 ماه طول می کشد. انفارکتوس میوکارد در مرحله اسکار با بافت همبند رشد می کند، یک اسکار تشکیل می شود.
اگر کانون جدیدی از نکروز میوکارد در دوره تا 2 ماه ظاهر شود، آنها از عود صحبت می کنند. انفارکتوس مکرر به میدان توسعه یافته انتهای مرحله اسکار گفته می شود.
درد طولانی مدت در انفارکتوس میوکارد کانونی کوچک را می توان با یک دوره مکرر، تشکیل کانون های جدید نکروز یا ایسکمی طولانی مدت ناحیه حوالی انفارکتوس توضیح داد.
با انفارکتوس دایره ای میوکارد، نکروز تا کل ضخامت دیواره بطن چپ گسترش می یابد و منجر به اختلالات شدید در فعالیت قلب می شود:
- نارسایی حاد قلبی با ادم ریوی؛
- آریتمی و انسداد با آسیب به سیستم هدایت قلبی؛
- شوک قلبی با ایجاد انعقاد داخل عروقی منتشر؛
- خونریزی های متعدد با کاهش انعقاد خون؛
- ترومبوز وریدی مهاجرتی در نتیجه افزایش متعاقب انعقاد.
- ترومبوز داخل قلب جداری؛
- پارگی دیوار با هموتامپوناد پیراهن قلبی که منجر به مرگ می شود.
دوره غیر معمول
انفارکتوس دایره ای میوکارد به دلیل محل آن اغلب به شکل غیر معمول شکمی رخ می دهد. این خود را به عنوان درد اپی گاستر، حالت تهوع، استفراغ، اسهال، شبیه سازی بیماری های حاد دستگاه گوارش نشان می دهد. تایید تشخیص زمانی اتفاق می افتد که یک موج Q پاتولوژیک در ECG تشخیص داده شود.
تظاهرات اسکار قلبی
کاردیواسکلروز پس از انفارکتوس با تمرکز بافت فیبری نشان داده می شود، توانایی انقباض ندارد و منجر به نارسایی پیشرونده قلب می شود. اسکارهای بعد از حمله قلبی در نوار قلب مشخص می شود.
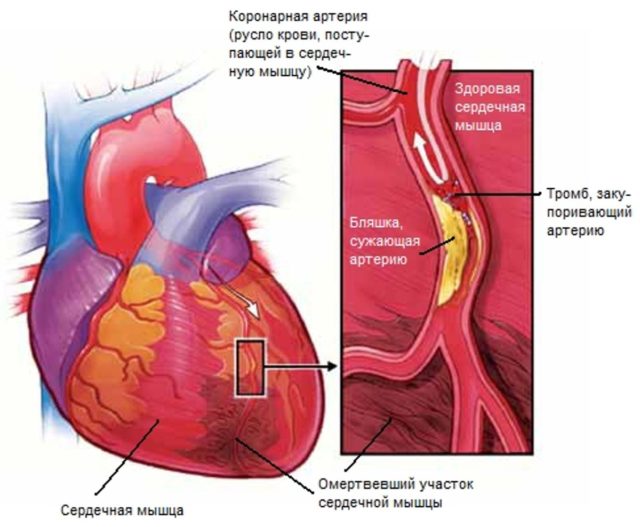
با ایجاد انفارکتوس میوکارد با کانونی بزرگ، ممکن است علائم نارسایی گردش خون وجود داشته باشد
اغلب، یک دیواره فیبری نازک آویزان می شود و یک آنوریسم قلبی تشکیل می شود. هنگامی که فیبرهای سیستم رسانا زخمی می شوند، اختلالات مداوم ریتم و انسداد قلب ایجاد می شود. نارسایی بطن چپ منجر به فشار خون بالا در گردش خون ریوی می شود که به آمفیزم و پنوموسکلروز ختم می شود. نارسایی ریوی می پیوندد.
کمک های اولیه
هنگامی که اولین علائم ایسکمی حاد قلب ظاهر می شود، باید بلافاصله با آمبولانس تماس بگیرید. قبل از آمدن دکتر چه باید کرد؟
- به بیمار "نیتروگلیسیرین" را زیر زبان بدهید، مجاز است هر 5 دقیقه یک قرص سه بار مصرف شود.
- 0.5 قرص "اسید استیل سالیسیلیک" را در آب حل کنید و در چند مرحله بنوشید.
- استراحت کامل را فراهم کنید.
- دکمه های لباس تنگ را باز کنید.
- هوای تازه فراهم کنید.
- هنگامی که فعالیت قلبی و ریوی متوقف شد، اقدامات فوری را شروع کنید.
پیشگیری از بیماری ایسکمیک قلبی
- با اضافه وزن مبارزه کنید.
- عادت های بد را کنار بگذارید.
- سطح گلوکز و کلسترول خون خود را کنترل کنید.
- برو برای ورزش.
- فشار خون خود را کنترل کنید.
در مورد تظاهرات بالینی احتمالی حمله قلبی، دوره غیر معمول آن به یاد داشته باشید. پزشک آمبولانس انفارکتوس میوکارد را در نوار قلب مشخص می کند. اما سیر بعدی بیماری و کامل شدن بازیابی عملکردهای قلب به دانش و مهارت شما بستگی دارد.