直接レニン阻害剤です。 高血圧症のための新世代の薬:薬のリスト。 高血圧とは何ですか
引用の場合:レオノバM.V. レニン-アンギオテンシン-アルドステロン系を遮断する新しい有望な薬剤//紀元前。 医療レビュー。 2013. No.17。 P. 886
開発におけるレニン-アンギオテンシン-アルドステロン系(RAAS)の役割 動脈性高血圧症(AH)およびその他の心血管疾患が現在優勢であると考えられています。 心血管系の連続体では、高血圧が危険因子の1つであり、心血管系への損傷の主な病態生理学的メカニズムはアンジオテンシンII(ATII)です。 ATIIはRAASの重要なコンポーネントです-血管収縮、ナトリウム保持、交感神経の活性化を実装するエフェクター 神経系、細胞増殖および肥大、酸化ストレスの発生および血管壁の炎症。
現在、RAASを遮断する2つのクラスの薬剤がすでに開発されており、臨床診療で広く使用されています。ACE阻害薬とATII受容体遮断薬です。 これらのクラスの薬理学的および臨床的効果は異なります。 ACEは、ATI、AT1-7、ブラジキニン、サブスタンスP、および他の多くのペプチドを代謝する亜鉛メタロプロテイナーゼのグループからのペプチダーゼです。 作用機序 ACE阻害剤主にATIIの形成の予防に関連しており、血管拡張、ナトリウム利尿を促進し、ATIIの炎症誘発性、増殖性およびその他の影響を排除します。 さらに、ACE阻害剤はブラジキニンの分解を防ぎ、そのレベルを高めます。 ブラジキニンは強力な血管拡張剤であり、ナトリウム利尿を増強し、そして最も重要なことに、それは心臓保護効果(肥大を防ぎ、心筋への虚血性損傷を減らし、冠状動脈血液供給を改善する)を持ち、血管保護効果を持ち、内皮機能を改善します。 同時に、高レベルのブラジキニンが開発の理由です 血管浮腫、これは、キニンレベルを大幅に増加させるACE阻害剤の重大な欠点の1つです。
ACE阻害薬は、組織内でのATIIの形成を常に完全にブロックできるとは限りません。 現在、ACEに関連しない他の酵素、主にエンドペプチダーゼであり、ACE阻害剤の作用が適用されないものも、組織内でのその形質転換に関与できることが確立されています。 その結果、ACE阻害薬はATIIの効果を完全に排除することはできず、それが不十分な効果の理由である可能性があります。
この問題の解決は、ATII受容体とAT1受容体を選択的に遮断する最初のクラスの薬剤の発見によって促進されました。 ATIIの悪影響は、AT1受容体を介して実現されます:血管収縮、アルドステロン、バソプレッシン、ノルエピネフリンの分泌、体液貯留、平滑筋細胞と心筋細胞の増殖、SASの活性化、および陰性のメカニズム フィードバック"-レニンの形成。 AT2受容体は、血管拡張、修復および再生プロセス、抗増殖作用、胚組織の分化および発達などの「有用な」機能を実行します。 ATII受容体遮断薬の臨床効果は、AT1受容体レベルでのATIIの「有害な」効果の排除によって媒介され、ATIIの副作用のより完全な遮断と、AT2受容体に対するATIIの効果の増加をもたらします。 、血管拡張作用と抗増殖作用を補完します。 ATII受容体遮断薬は、キニン系に干渉することなく、RAASに特定の効果をもたらします。 キニン系の活動への影響がないことは、一方では望ましくない影響(咳、血管浮腫)の重症度を軽減しますが、他方では、ATII受容体遮断薬から重要な抗虚血および血管保護効果を奪います。これはそれらをACE阻害剤と区別します。 このため、ATII受容体遮断薬の使用の適応症は、ほとんどの場合、ACE阻害薬の指定の適応症を繰り返し、代替薬になります。
高血圧治療の広範な実践にRAAS遮断薬が導入されたにもかかわらず、転帰と予後を改善するという問題が残っています。 これらには、人口の血圧管理を改善する可能性、抵抗性高血圧の治療の有効性、心血管疾患のリスクをさらに減らす可能性が含まれます。
RAASに影響を与える新しい方法の探求は活発に続けられています。 他の密接に相互作用するシステムが研究されており、ACEおよび中性エンドペプチダーゼ(NEP)阻害剤、エンドセリン変換酵素(EEC)およびNEP阻害剤、ACE / NEP / EPF阻害剤など、複数の作用機序を持つ薬剤が開発されています。
バソペプチダーゼ阻害剤
既知のACEに加えて、バソペプチダーゼには、ネプリライシン(中性エンドペプチダーゼ、NEP)とエンドセリン変換酵素の2つの亜鉛メタロプロテイナーゼが含まれます。これらは薬理学的効果の標的にもなります。
ネプリライシンは、血管内皮によって産生され、ブラジキニンと同様にナトリウム利尿ペプチドの分解に関与する酵素です。
ナトリウム利尿ペプチドシステムは、心房性ナトリウム利尿ペプチド(Aタイプ)、心房と心筋で合成される脳性ナトリウム利尿ペプチド(Bタイプ)、および生物学的機能によって合成される内皮Cペプチドの3つの異なるアイソフォームによって表されます。 RAASおよびエンドセリン-1の内因性阻害剤(表1)。 ナトリウム利尿ペプチドの心臓血管および腎臓への影響は、血管緊張および水電解質バランスへの影響による血圧の低下、ならびに標的臓器への抗増殖および抗線維化効果にあります。 最新のデータによると、ナトリウム利尿ペプチドシステムは、メタボリックシンドロームの発症に対する保護を提供する可能性のある脂質酸化、脂肪細胞の形成と分化、アディポネクチンの活性化、インスリン分泌、炭水化物耐性などの代謝調節に関与しています。
今日まで、心血管疾患の発症はナトリウム利尿ペプチドシステムの調節不全に関連していることが知られています。 したがって、高血圧症では、ナトリウム利尿ペプチドが不足し、塩分感受性とナトリウム利尿障害を引き起こします。 欠乏症を背景とした慢性心不全(CHF)では、ナトリウム利尿ペプチド系のホルモンの機能に異常があります。
したがって、ナトリウム利尿ペプチドシステムを強化して、追加の降圧および保護心腎効果を達成するために、NEP阻害剤を使用することが可能です。 ネプリライシンの阻害は、内因性ナトリウム利尿ペプチドのナトリウム利尿作用、利尿作用、および血管拡張作用の増強をもたらし、その結果、血圧の低下をもたらします。 ただし、NEPは、他の血管作動性ペプチド、特にATI、ATII、およびエンドセリン-1の分解に関与しています。 したがって、血管緊張に対するNEP阻害剤の効果のバランスは変動し、収縮剤と拡張の影響の有病率に依存します。 長期間使用すると、ネプリライシン阻害剤の降圧効果は、ATIIとエンドセリン-1の形成の代償的活性化のために弱く発現します。
この点で、ACE阻害剤とNEP阻害剤の効果の組み合わせは、補完的な作用機序の結果として血行動態および抗増殖効果を大幅に強化することができ、その結果、名前で統一された二重の作用機序を持つ薬剤が作成されましたバソペプチダーゼ阻害剤(表2、図1)。
バソペプチダーゼの既知の阻害剤は、NEP / ACEに対する選択性の程度が異なることを特徴としています:オマパトリラト-8.9:0.5; fazidoprilat-5.1:9.8; サンパトリレート-8.0:1.2。 その結果、バソペプチダーゼ阻害剤は、RAASの活性やナトリウム保持のレベルに関係なく、また器官保護(肥大、アルブミン尿、血管硬化の退行)において、降圧効果を達成するためのはるかに大きな機会を受け取りました。 臨床試験で最も研究されたのはオマパトリラトであり、ACE阻害薬と比較してより高い降圧効果を示し、CHFの患者では駆出率の増加と臨床転帰の改善をもたらしましたが(IMPRESS、OVERTURE研究)、ACE阻害薬に勝る利点はありませんでした。
ただし、オマパトリラトを使用した大規模な臨床試験では、ACE阻害薬と比較して血管性浮腫の発生率が高いことがわかりました。 ACE阻害薬を使用した場合の血管性浮腫の発生率は人口の0.1〜0.5%であることが知られており、そのうちの20%は生命を脅かすものであり、ブラジキニンとその代謝物の濃度の複数の増加に関連しています。 血管性浮腫の発生率を研究するために特別に設計された大規模な多施設共同研究OCTAVE(n = 25 302)の結果は、オマパトリラトによる治療中のこの副作用の発生率がエナラプリル群のそれを超えることを示しました-2.17%対0.68% (相対リスク3.4)。 これは、ブラジキニンの分解に関与するアミノペプチダーゼPの阻害に関連するACEとNEPの相乗的阻害中のキニンレベルへの影響の増加によって説明されました。
ACE / NEPをブロックする新しいデュアルバソペプチダーゼ阻害剤はilepatrilであり、NEPと比較してACEに対する親和性が高くなっています。 健康なボランティアのRAASおよびナトリウム利尿ペプチドの活性に対する効果に対するイレパトリルの薬力学的効果を研究したとき、薬物は用量依存的に(5および25mgの用量で)そして有意に(88%以上)ACEを抑制することが見出された塩分感受性に関係なく、血漿中で48時間以上..。 同時に、この薬は血漿レニン活性を48時間有意に増加させ、アルドステロンレベルを低下させました。 これらの結果は、10mgの用量でのACE阻害剤ラミプリルとは対照的に、RAASの顕著なより長期の抑制を示しました。これは、ACEに対するイルパトリルのより重要な組織効果およびACEに対するより高い親和性、および同等のものによって説明されました。 150mgのイルベサルタン+ 10mgのラミプリルの組み合わせと比較したRAAS遮断の程度。 RAASへの影響とは対照的に、ナトリウム利尿ペプチドへのイレパトリルの影響は、25 mgの投与後4〜8時間の期間におけるその排泄レベルの短期間の増加によって明らかになりました。これは、より低く弱いことを示しています。 NEPとの親和性があり、オマパトリラトと区別されます。 さらに、電解質の排泄レベルに関しては、ラミプリルやイルベサルタンと比較して、追加のナトリウム利尿作用はありません。この薬は、バソペプチダーゼの他の阻害剤と同様にありません。 最大の降圧効果は、薬を服用してから6〜12時間後に発生し、平均血圧の低下は5±5および10±4 mmHgです。 それぞれ低塩分感度と高塩分感度で。 その薬物動態学的特性によれば、イレパトリルは活性代謝物を有するプロドラッグであり、1〜1.5時間後に最大濃度に達して急速に形成され、ゆっくりと排出されます。 現在開催中 臨床研究フェーズIII。
RAASとNEPの二重抑制への代替経路は、ATIIとNEP受容体の遮断の組み合わせによって表されます(図2)。 ATII受容体遮断薬は、ACE阻害薬とは異なり、キニン代謝に影響を与えないため、血管性浮腫の合併症を発症するリスクが低い可能性があります。 現在第III相臨床試験が行われている、最初の薬剤-NEPを1:1の比率で阻害する効果を持つATII受容体遮断薬-LCZ696。 組み合わされた薬物分子は、バルサルタンとプロドラッグの形のNEP阻害剤(AHU377)を含んでいます。 高血圧症の患者を対象とした大規模な研究(n = 1328)で、200〜400 mgの用量のLCZ696は、160〜320 mgの用量のバルサルタンよりも血圧が5低下するという形で、降圧効果に利点があることを示しました。 / 3および6 / 3mmHg。..。 ..。 LCZ696の降圧効果は、脈拍血圧のより顕著な低下を伴いました:2.25および3.32mmHg。 それぞれ、200mgと400mgの用量で、これは現在、血管壁の硬直と心血管転帰への影響の正の予後因子と考えられています。 同時に、LCZ696による治療を背景とした神経液性バイオマーカーの研究では、バルサルタンと比較して、レニンとアルドステロンのレベルが同程度に増加し、ナトリウム利尿ペプチドのレベルが増加することが示されました。 高血圧症の患者は忍容性が高く、血管性浮腫の症例はありませんでした。 現在、PARAMOUMT研究は、CHFと無傷の駆出率を有する685人の患者で完了しています。 研究の結果は、LCZ696がバルサルタンと比較してNT-proBNPのレベルをより速くそしてより顕著に減少させ(主要評価項目はナトリウム尿酸ペプチドの活性の増加とCHFの予後不良のマーカーである)、またサイズを減少させることを示しましたそのリモデリングの退行を示す左心房の..。 CHFと駆出率が低下した患者を対象とした研究が進行中です(PARADIGM-HF研究)。
エンドセリン系阻害剤
エンドセリンシステムは、血管緊張と局所血流の調節に重要な役割を果たします。 3つの既知のアイソフォームの中で、エンドセリン-1が最も活性があります。 よく知られている血管収縮作用に加えて、エンドセリンは細胞外マトリックスの増殖と合成を刺激し、また腎血管の緊張に直接影響するため、水電解質の恒常性の調節に関与します。 エンドセリンの効果は、特定のA型およびB型受容体との相互作用によって実現され、その機能は相互に反対です。血管収縮はA型受容体を介して発生し、血管拡張はB型を介して発生します。 近年、B型受容体がエンドセリン-1のクリアランスに重要な役割を果たすことが確立されています。 これらの受容体が遮断されると、エンドセリン-1の受容体依存性クリアランスが破壊され、その濃度が上昇します。 さらに、B型受容体はエンドセリン-1の腎臓への影響の調節と水電解質の恒常性の維持に関与しており、これは重要です。
現在、エンドセリンの役割は、以下を含む多くの疾患の発症において証明されています。 AG、CHS、 肺高血圧症、慢性腎臓病; エンドセリンレベルとメタボリックシンドローム、内皮機能障害およびアテローム発生との密接な関係を示しています。 1990年代以降。 臨床使用に適したエンドセリン受容体拮抗薬の探索が進行中です。 A / B型受容体に対する選択性の程度が異なる既知の10種類の薬剤(「センタナ」)。 高血圧患者を対象とした臨床試験で、エンドセリン受容体の最初の非選択的拮抗薬であるボセンタンは、ACE阻害薬のエナラプリルに匹敵する降圧効果を示しました。 高血圧症におけるエンドセリン拮抗薬の使用の有効性に関するさらなる研究は、抵抗性高血圧症の治療および高い心血管リスクを伴うそれらの臨床的重要性を示した。 これらのデータは、DORADO(n = 379)とDORADO-AS(n = 849)の2つの大規模な臨床試験で得られたもので、抵抗性高血圧患者の3剤併用療法にダルセンタンが追加されました。 患者を対象としたDORADO研究では、抵抗性高血圧と 慢性疾患ダルセンタンの添加の結果としての腎臓およびタンパク尿は、血圧の有意な低下だけでなく、タンパク質排泄の低下も観察された。 その後、エンドセリン受容体拮抗薬の抗タンパク尿作用が、アボセンタンを使用した糖尿病性腎症患者を対象とした研究で確認されました。 しかし、DORADO-ASの研究では、比較薬やプラセボに比べて追加の血圧低下の利点は見られず、それがさらなる研究の終了の理由でした。 さらに、CHF患者を対象としたエンドセリン拮抗薬(ボセンタン、ダルセンタン、エンラセンタン)の4つの大規模な研究では、矛盾する結果が得られました。これは、エンドセリン-1の濃度の増加によって説明されました。 エンドセリン受容体拮抗薬のさらなる研究は、体液貯留に関連する副作用(末梢浮腫、体液量過剰)のために中断されました。 これらの効果の発現は、B型受容体に対するエンドセリン拮抗薬の効果と関連しており、他の経路を介してエンドセリンシステムに影響を与える薬物の探索を変えました。 エンドセリン受容体拮抗薬は現在、肺高血圧症の治療という1つの適応症しかありません。
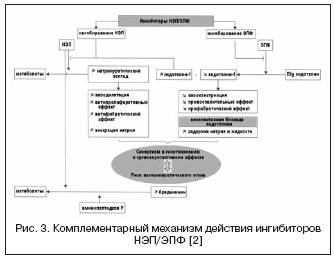
血管緊張の調節におけるエンドセリンシステムの高い重要性を考慮して、活性エンドセリン-1の形成に関与するバソペプチダーゼを介した別の作用機序であるEEFの探索が進行中です(図3)。 EEの遮断とNEPの阻害との組み合わせにより、エンドセリン-1の形成を効果的に抑制し、尿酸ナトリウムペプチドの効果を増強することが可能になります。 二重の作用機序の利点は、一方では、エンドセリンの活性化によって媒介される可能性のある血管収縮に関連するNEP阻害剤の不利な点を防ぐことであり、他方では、NEP阻害剤のナトリウム利尿活性は、補償することを可能にする。エンドセリン受容体の非選択的遮断に関連する体液貯留。 ダグルトリルはNEPとEEの二重阻害剤であり、第II相臨床試験が行われています。 研究は、心臓と血管のリモデリングの減少、肥大と線維症の退行による薬の顕著な心臓保護効果を示しました。
直接レニン阻害剤
フィードバックメカニズムによるACE阻害薬とATII受容体遮断薬は、レニンの活性を高めることが知られており、これがRAAS遮断薬の有効性を逃れる理由です。 レニンはRAASカスケードの最初の段階です。 それは腎臓の傍糸球体細胞によって生成されます。 レニンは、アンジオテンシノーゲンを介して、ATII形成、血管収縮、アルドステロン分泌を促進し、フィードバックメカニズムも調節します。 したがって、レニンの阻害はより多くを達成することを可能にします 完全封鎖 RAASシステム。 レニン阻害剤の探索は1970年代から続いています。 長い間、胃腸管での生物学的利用能が低い(2%未満)ため、経口形態のレニン阻害剤を入手することはできませんでした。 経口投与に適した最初の直接レニン阻害剤であるアリスキレンは、2007年に登録されました。アリスキレンは、バイオアベイラビリティが低く(2.6%)、半減期が長く(24〜40時間)、腎外排泄経路があります。 アリスキレンの薬力学は、ATIIレベルの80%の減少に関連しています。 高血圧患者を対象とした臨床試験では、150〜300 mg /日のアリスキレンにより、SBPが8.7〜13および14.1〜15.8 mmHg減少しました。 それぞれ、およびDBP-7.8-10.3および10.3-12.3 mmHg。 ..。 アリスキレンの降圧効果は、メタボリックシンドローム、肥満の患者を含む患者のさまざまなサブグループで観察されました。 重症度では、ACE阻害薬、ATII受容体遮断薬の効果に匹敵し、バルサルタン、ヒドロクロロチアジド、アムロジピンとの併用で相加効果が認められました。 多くの臨床研究は、この薬の器官保護効果を示しています:糖尿病性腎症の患者における抗タンパク尿効果(AVOID研究、n = 599)、高血圧患者の左心室肥大の退行(ALLAY研究、n = 465)。 したがって、AVOID研究では、100 mg /日の用量のロサルタンによる3か月の治療後、目標血圧レベルに達しました(<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
さらに、アリスキレンの一連の臨床研究が、患者の予後への影響を評価する他の心血管疾患の治療で実施されています:研究ALOFT(n = 320)、ASTRONAUT(n = 1639)、ATMOSPHERE(n = 7000)CHFの患者では、患者のALTITUDE研究 糖尿病心血管リスクが高い、梗塞後のリモデリング患者を対象としたASPIRE研究。
結論
心血管疾患の予防の問題を解決するために、複雑な複数の作用メカニズムを備えた新薬の作成が続けられており、血行力学的および神経液性調節のメカニズムのカスケードを通じてRAASのより完全な遮断が可能になっています。 そのような薬の潜在的な効果は、追加の降圧効果を提供するだけでなく、抵抗性高血圧を含む高リスク患者の血圧制御を達成することも可能にします。 薬複数の作用機序を持つことで、より顕著な有機保護効果の利点が示され、心血管系へのさらなる損傷を防ぎます。 RAASをブロックする新薬の利点の研究には、高血圧やその他の心血管疾患の患者の予後に対するそれらの効果のさらなる研究と評価が必要です。



文学
1.キャンベルD.J. バソペプチダーゼ阻害:二重の剣? //高血圧。 2003.Vol。 41. P.383-389。
2. Laurent S.、Schlaich M.、Esler M.高血圧症の新薬、手順、およびデバイス//ランセット。 2012.Vol。 380. P.591-600。
3. Corti R.、Burnett J.C.、Rouleau J.L. etal。 バソペプチダーゼ阻害剤:心血管疾患の新しい治療概念? // サーキュレーション。 2001.Vol。 104. P.1856-1862。
4. Mangiafico S.、Costello-Boerrigter L.C.、Andersen I.A. etal。 中性エンドペプチダーゼ阻害とナトリウム利尿ペプチドシステム:心血管治療における進化する戦略// Eur。 Heart J. 2012、doi:10.1093 / eurheartj / ehs262。
5. Rouleau J.L.、Pfeffer M.A.、Stewart D.J. etal。 心不全患者の運動耐容能と罹患率に関するバソペプチダーゼ阻害剤、オマパトリラト、およびリシノプリルの比較:IMPRESSランダム化試験//ランセット。 2000.Vol。 356. P.615-620。
6.パッカーM.、カリフR.M.、コンスタムM.A. etal。 慢性心不全患者におけるオマパトリラトとエナラプリルの比較:イベントの減少におけるオマパトリラトとエナラプリルのランダム化比較試験(OVERTURE)//循環。 2002.Vol。 106. P.920-926。
7. Warner K.K.、Visconti J.A.、Tschampel M.M. ACE阻害薬誘発性血管浮腫患者におけるアンジオテンシンII受容体遮断薬//アン。 Pharmacother。 2000.Vol。 34. P.526-528。
8. Kostis J.B.、Packer M.、Black H.R. etal。 高血圧患者におけるオマパトリラトとエナラプリル:オマパトリラト心血管治療vsエナラプリル(OCTAVE)試験//午前。 J.高血圧。 2004.Vol。 17.P.103-111。
9. Azizi M.、Bissery A.、Peyrard S. etal。 ヒトにおけるバソペプチダーゼ阻害剤AVE7688の薬物動態および薬力学// Clin。 Pharmacol。 そこに。 2006.Vol。 79. P.49-61。
10. Gu J.、Noe A.、Chandra P. etal。 新規の二重作用性アンギオテンシン受容体ネプリリシン阻害剤(ARNi)であるLCZ696の薬物動態および薬力学// J.Clin。 Pharmacol。 2010.Vol。 50. P.401-414。
11. Ruilope L. M.、Dukat A.、Buhm M. etal。 アンジオテンシンII受容体とネプリライシンの新規二重作用阻害剤であるLCZ696による血圧低下:無作為化、二重盲検、プラセボ対照、アクティブコンパレーター研究//ランセット。 2010.Vol。 375. P.1255-1266。
12. Solomon S. D.、Zile M.、Pieske B. etal。 駆出率が保存された心不全のアンジオテンシン受容体ネプリライシン阻害剤LCZ696:第2相二重盲検ランダム化比較試験//ランセット。 2012.Vol。 380(9851)。 P.1387-1395。
13.レビンE.R. エンドセリン//N.Engl。 J.Med。 1995.Vol。 333. P.356-363。
14. Dhaun N.、Goddard J.、Kohan D.E. etal。 臨床的高血圧症におけるエンドセリン-1の役割://高血圧症で20年。 2008.Vol。 52. P.452-459。
15. Burnier M.、Forni V.エンドセリン受容体拮抗薬:本態性高血圧症の管理における場所? //ネフロール。 ダイヤルします。 移植。 2011.0:1-4。 土井:10.1093 / ndt / gfr704。
16. Krum H.、Viskoper R. J.、Lacourciere Y. etal。 本態性高血圧症患者の血圧に対するエンドセリン受容体拮抗薬ボセンタンの効果。 ボセンタン高血圧調査員//N.Engl。 J.Med。 1998.Vol。 338. P.784-790。
17. Weber M. A.、Black H.、Bakris G. etal。 治療抵抗性高血圧患者の血圧を下げるための選択的エンドセリン受容体拮抗薬:無作為化二重盲検プラセボ対照試験//ランセット。 2009.Vol。 374.P.1423-1431。
18. Bakris G.L.、Lindholm L.H.、Black H.R. etal。 クリニックと携帯型血圧を使用した異なる結果:ダルセンタン耐性高血圧試験の報告//高血圧。 2010.Vol。 56. P.824-830。
19. Mann J. F.、Green D.、Jamerson K. etal。 顕性糖尿病性腎症のアボセンタン//J.Am。 Soc。 ネフロール。 2010.Vol。 21. P.527-535。
20. Kalk P.、Sharkovska Y.、Kashina E. etal。 エンドセリン変換酵素/中性エンドペプチダーゼ阻害剤SLV338は、血圧に依存しない方法で高血圧性心臓リモデリングを防ぎます//高血圧症。 2011.Vol。 57. P.755-763。
21. Nussberger J.、Wuerzner G.、Jensen C. etal。 理論的に活性なレニン阻害剤アリスキレン(SPP100)によるヒトのアンジオテンシンII抑制:エナラプリルとの比較//高血圧。 2002.Vol。 39(1)。 P.E1-8。
22. Alreja G.、Joseph J. Reninと心血管疾患:摩耗した道、それとも新しい方向性? //ワールドJ.カルディオール。 2011.Vol。 3(3)。 P.72-83。
23.インゲルフィンガーJ.R. 2型糖尿病におけるアリスキレンと二重療法//N.Engl。 J.Med。 2008.Vol。 358(23)。 P.2503-2505。
24. Pouleur A. C.、Uno H.、Prescott M. F.、Desai A.(ALLAY Investigatorsの場合)。 アルドステロンの抑制は、高血圧患者の左心室肥大の退行を仲介します// J。レニン-アンジオテンシン-アルドステロン系。 2011.Vol。 12.P.483-490。
25. Kelly D. J.、Zhang Y.、Moe G. etal。 新規レニン阻害剤であるアリスキレンは、ラットの進行性糖尿病性腎症のモデルにおいて腎保護作用があります//糖尿病。 2007.Vol。 50. P.2398-2404。
若い//アーチにおける甲状腺機能低下症の病因。 Dis。 子供。 -2000。 -Vol。 83.-P.207-210。
41. Kadenbach B.、Muller-HockerJ。ミトコンドリアDNAの突然変異と人間の死// Naturwissenschaften。 -1990。-いいえ。 5.-S.221-225。
42.マレーC.J. L.、ロペスA. D. 原因別の死亡率と障害の代替予測1990-2002:世界疾病負荷研究//ランセット。 -1997.-Vol。 349.-P.1498-1504。
43. Neill J.D.、Bonos D.J. 分子生物学と統合生理学の関係// Physiolのニュース。 科学 -2003.-Vol。 8.-P.233-235。
44. Reaven G.M. 人間の病気における抵抗の役割//糖尿病。 -1988。 -Vol。 37 .-- P.1595-1607。
45. Resnick H. E.、Jones K.、Ruotolo G. etal。 非糖尿病のアメリカ人インディアンにおけるインスリン抵抗性、メタボリックシンドローム、および偶発的な心血管疾患のリスク//ストロングハート研究。 糖尿病ケア。 -2003.-Vol。 26.-P.861-867。
46. SauvagetC。、Jagger C.、Arthur A.J. 活動的で認知障害のない平均余命:メルトンモーブレー75の結果-健康な頬//年齢の老化。 -2001年11月 -Vol。 30(6)。 -P.509-515。
47. Tutar E.、Kapadia S.、Ziada K. M. etal。 心臓病は若い年齢で始まります//午前。 心臓協会。 ミーティング。 -1999年11月 9.-Abstr。 #2760。-P.1234-1241。
48.ヨーロッパにおける小児糖尿病の発生率の変動と傾向。 EURODIABACE研究グループ//ランセット。 -2000。-Vol。 355(9207)。 -P.873-876。
49. Wallace T.M.、Levy J.C.、Matthews D.R. HOMEモデリングの使用と乱用//糖尿病ケア。 -2004.-Vol。 27.-いいえ。 6.-P.14871495。
2014年3月10日受領
ヴァシリエフアレクサンドルペトロヴィッチ博士 蜂蜜。 ロシア医学アカデミー「チュメニ心臓病学中心"。
住所:625026、Tyumen、st。 Melnikaite、111。Eメール: [メール保護] Streltsova Nina Nikolaevna、ロシア医学アカデミー「チュメニ心臓病学」のシベリア支部の連邦州予算機関「心臓病研究所」の支部の臨床心臓病学部の動脈性高血圧および冠状動脈不全の研究者中心"。 住所:625026、Tyumen、st。 Melnikaite、111。Eメール: [メール保護]
UDC 616-08-035 + 616-08-031.81
社会的に重要な疾患の治療のための直接レニン阻害剤アリスキレンの適用の可能性について
A.F. コルパコワ
FGBU「コンピューター技術の設計技術研究所」SBRAS、ノボシビルスク
Eメール: [メール保護]
社会的に重要な疾患の治療のための直接レニン阻害剤アリスキレンの使用の見通し
デジタル技術の設計技術研究所SBRAS、ノボシビルスク
このレビューでは、肥満、糖尿病、更年期障害、腎臓障害と組み合わせた動脈性高血圧症の患者の治療における直接レニン阻害剤アリスキレンの有効性と安全性に関する無作為化試験の結果を分析しています。 慢性腎臓病、メタボリックシンドローム。 アリスキレンは血圧降下作用だけでなく、心臓および腎保護作用もあり、その使用の適応を拡大することができることが確立されています。
キーワード:直接レニン阻害剤、治療の有効性と安全性、有機保護効果。
このレビューでは、肥満、糖尿病、閉経、腎不全、慢性腎臓病、メタボリックシンドロームに関連する動脈性高血圧症の患者の治療における直接レニン阻害剤アリスキレンの有効性と安全性に関するランダム化研究の結果を分析します。 著者らは、降圧作用とともに、アリスキレンはこの薬の使用の適応を拡大することができる心臓保護および腎保護効果を発揮すると結論付けています。 キーワード:直接レニン阻害剤、治療の有効性と安全性、有機保護効果。
序章
世界保健機関によると、社会的に重要な非感染性疾患は、全死亡の63%、または年間約3,600万人の死亡を占めており、世界のほとんどの国の社会経済的発展に甚大な被害をもたらしています。 世界の経済的に発展した国々では、動脈性高血圧症(AH)を含む心血管疾患(CVD)が、罹患率と死亡率の構造において主導的な位置を占めています。 ロシア連邦の成人人口の約40%は、 血圧(地獄)。 高血圧は、主にわが国の高い死亡率を決定する心筋梗塞および脳卒中の最も重要な危険因子であることが知られています。 CVD治療の有効性の進歩にもかかわらず、制御不能または抵抗性高血圧症の人々の数は増加しています。 患者の治療への順守が低いという問題もあります。
ここ数十年の研究により、高血圧、心不全、慢性腎臓病、全身性アテローム性動脈硬化症の形成と進行における交感神経副腎およびレニン-アンギオテンシン-アル-ドステロン(RAAS)系の役割が証明されています。 さらに、RAASは、組織の成長と発達、炎症とアポトーシスの調節、および多くの神経液性物質の合成と分泌の増強に関与しています。 RAASの重要な構成要素はレニン酵素であり、これがアンギオテンシノーゲンのアンギオテンシンI(AT1)への変換を引き起こします。 その後、AT1は、アンジオテンシン変換酵素(ACE)の助けを借りて、ヒトで最も活性の高いアンジオテンシンII(AT11)に変換されます。 したがって、全体としてのRAASの調子は、レニンの活性に依存し、したがって、標的組織(心筋、血管壁、腎組織)に対するその成分の関連する正および負の効果の重症度に依存します。 AT1およびAT11の受容体、およびアルドステロンの受容体との相互作用。 異なる酵素の関与によりRAAS活性化の後続の段階を実行できる場合、レニンの関与なしにアンジオテンシノーゲンからのAT1の形成は不可能です。 臨床研究の結果に基づいて、血漿レニン活性は、CVDの予後不良の最も信頼できるマーカーの1つであると主張することができます。 したがって、L。Sechietal。 (2008)247人の高血圧患者を調べたとき、レニンの血漿活性の増加は、内皮依存性および血漿止血リンクの活性化の素因となり、したがって、微小循環のレベルを含む血栓症の可能性を増加させることを示しました。自然に標的器官の損傷の重症度を悪化させます。 レニンの血漿活性、血清フィブリノーゲン濃度、D-ダイマーおよび1型プラスミノーゲン活性化因子阻害剤の血漿レベル、ならびに高血圧性心および腎臓の損傷の兆候の間には直接的な相関関係が見られました。 さらに、レニンの血漿活性が患者で持続的に増加する可能性がある多くの状況があります:
高血圧、メタボリックシンドローム、2型糖尿病、腹部肥満、慢性腎臓病。 血漿レニン活性の増加は、RAASのその後のレベルをブロックする薬剤、主にアンギテンシン変換酵素の阻害剤(ACE阻害剤)、およびナトリウム排泄の増加、特にチアジド系利尿薬によっても素因があります。
近年、RAASの活性に対する薬理学的制御は、ACEを阻害し、AT11およびアルドステロン受容体を遮断し、主にβ遮断薬を使用してレニン分泌を制限することにより、AT11産生を制限する方向で行われた。 RAASに影響を与える一次治療薬として推奨されている最新の降圧薬の作用機序の分析は、β遮断薬を除いて、それらすべてがレニン、プロレニン、およびACEのレベルの増加につながることを示しました。 したがって、利尿薬の使用は、血漿中のプロレニン、レニン、aPF、AT1、AT11、および組織中のAT11のレベルの増加を伴います。 ACE阻害薬の使用は、プロレニン、レニン、ACE、AT1の含有量のより顕著な増加に関連しています。 AT1受容体遮断薬(ARB)の使用は、すべてのRAASメディエーターの刺激を伴うことがわかりました:血漿中のプロレニン、レニン、APF、AT1、AT11、および組織中のAT11の有意な増加。
多くの研究は、ACE阻害薬、ARBまたはアルドステロンの助けを借りたRAAS活性の適切な減少は、「脱出」の現象が発生するため、実際に達成されるよりも仮定される可能性が高いことを示しています。 この現象を克服するために、ACE阻害薬+ ARB +β遮断薬、ACE阻害薬+スピロノラクトンの組み合わせが使用されます。 したがって、レニンはRAASの重要なリンクであるため、薬理学者にとって最も魅力的なターゲットであり続けています。
研究の目的:心血管疾患、慢性腎臓病、代謝症候群、糖尿病などの社会的に重要な疾患の単剤療法および直接レニン阻害剤(DIR)との併用療法の有効性と安全性に関する文献データを分析すること。
アリスキレン単剤療法の有効性と安全性
PIRの出現は、RAAS活動のより完全な制御を達成し、「脱出」現象を克服する方法と見なすことができます。 直接レニン阻害剤アリスキレン(Novartis、スイス)は、レニン分子の活性部位に結合することによって作用し、レニンのアンジオテンシノーゲンへの結合を防ぎ、それによってATPの前駆体であるAT1の形成をブロックします。 アリスキレンは臨床試験を受けており、ロシアを含む世界の多くの国で登録されており、単剤療法または他の降圧薬との併用による動脈性高血圧の治療に推奨されています。
対照臨床試験(RCT)の分析の結果、降圧薬としてのアリスキレンの有効性と安全性
単剤療法のためのパラタ。 したがって、8週間のプラセボ対照試験では、グレードI〜IIの高血圧症の672人の患者でAの有効性と安全性が評価され、SBPとDBPの用量依存的な減少が明らかになりました。 PIRの降圧効果は、離脱後2週間持続しました。 アリスキレンの忍容性は良好で、有害事象の発生率はプラセボと差がありませんでした。 PIR単剤療法またはプラセボを受けた8481人の患者を対象とした臨床試験のプール分析は、1日あたり150または300mgの用量でのPIRの単回投与がSBPの12.5および15.2mmHgの減少を引き起こしたことを示しました。 美術。 それぞれ、5.9 mmHgの減少と比較して。 美術。 プラセボを投与されている患者(p<0,0001). ДАД снижалось на 10,1 (на дозе 150 мг) и 11,8 мм рт. ст. (на дозе 300 мг) соответственно (в группе плацебо - на 6,2 мм рт. ст., р<0,0001). Различий в антигипер-тензивном эффекте пИр у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
軽度および中等度の高血圧症の患者におけるACE阻害薬と比較したPIRの降圧効果の研究により、以下が確立されました。PIRはラミプリルよりもSBPおよびDBPを有意に低下させます。 12週間の治療後、SBPとDBPは、アリスキレンの中止後よりもラミプリルの中止後の方が早くベースラインレベルに戻ります。 服用し忘れた後のアリスキレン、イルベサルタン、ラミプリルの降圧効果の比較は、この場合、達成された血圧の低下がラミプリル群よりもPIR群で有意に大きかったことを示しました。
PIRの治療可能性を他の降圧薬の治療可能性と比較する場合 薬 75、150、および300 mg /日の範囲用量でのPIRは、6.25、12.5、および25 mg /日の用量でのヒドロクロロチアジド(HCT)と同じくらい効果的であることが判明しました。 同時に、軽度および中等度の高血圧症の患者では、75mg /日の用量でPIRを使用して目標血圧レベルに到達する頻度は51.9%であり、1日量を300mgに増加させました。 -63.9%。 L. A.Sicaらによると。 (2006)、アリスキレンを1日150〜300 mg投与した軽度および中等度の高血圧患者のほぼ45%で適切な血圧制御を達成するために、追加の利尿薬を処方する必要がありました。 75〜300mg /日の用量範囲でのアリスキレンの降圧効果の重症度は、100mg /日のロサルタンと同等であることが見出された。
A.H.の調査によると Gradman etal。 (2005)、150mg /日の用量のアリスキレンは、同じ用量のイルベサルタンと同様の有効性と同等の安全性を持っていました。 軽度から中等度の高血圧症の1123人の患者を対象とした8週間のRCTにおいて、75、150、および300 mg /日の範囲用量でのPIR単剤療法は、80、160、および320 mg /日の用量でのバルサルタンによる単剤療法と同じくらい効果的であることが示されました。日。日 M.ウィアー他 (2006)8570人の患者が参加した8つのRCTのメタアナリシスで、軽度および中等度の高血圧症では、アリスキレン(75-600 mg /日)による単剤療法が、用量依存的な血圧の低下につながることを発見しました。患者の年齢と性別.... 一般的に、それを結論付ける必要があります
PIRは、オフィスおよび毎日の血圧、ならびに同等の用量の他の降圧薬を効果的に低下させます。 日常的に使用されているACE阻害薬やARBよりもわずかに効果的かもしれません。 後者の状況は、明らかに、PIRの濃度が50%減少する長い時間に関連しており、そのため、早朝の時間に血圧の適切な制御が達成されます。 この事実は、負の心血管および脳血管イベントの予防において深刻な臨床的重要性を持っている可能性があります。
アリスキレンは、第I相試験中の健康なボランティアと高血圧症の患者の両方で非常に安全であることがわかりました。 患者が研究を継続することを拒否することになった副作用の発生率は、プラセボ群の発生率と同等でした。 ほとんどの場合 副作用倦怠感が登録されました、 頭痛、低血圧、めまい、下痢。 副作用の発生率は薬の投与量に依存することに注意する必要があります。 PIRが内因性ブラジキニンとサブスタンスPの代謝に影響を与えないことが重要です。したがって、ACE阻害薬ほど頻繁に咳や血管浮腫の症状を引き起こさないことが重要です。 一般に、PIRの忍容性は、アンジオテンシン受容体拮抗薬およびプラセボの忍容性に匹敵します。 アリスキレンは、肝機能障害のある患者に十分に許容されるだけでなく、肝不全の重症度に依存しない薬物動態プロファイルも持っています。 後者の状況では、軽度から中等度の肝細胞機能不全を伴う高血圧症の患者に最適な薬剤としてPIRを検討することができます。 さらに、腎不全(35 ml / min / 1.73 m2以上の糸球体濾過率)、糖尿病、肥満、メタボリックシンドローム、心不全の患者におけるアリスキレンの使用の安全性に関するデータがあります。それ以上の年齢層で。 同時に、単剤療法でのPIRの使用を背景に、または臨床的に重大な腎動脈狭窄のある患者、非経口麻酔中、および長期投与を受けている患者でARBと併用すると、腎機能が低下する潜在的な危険性があります。 -シクロオキシゲナーゼ-2阻害剤の長期高用量....
アリスキレンを含む併用療法。 ほとんどの場合、高血圧患者は、目標血圧を達成するために、2つまたは3つの降圧薬との併用療法を必要とします。 臨床研究では、他の降圧薬と組み合わせると、PIRの降圧効果が高まることが示されています。 したがって、アリスキレンとバルサルタンの併用は、血圧低下の程度に相乗効果をもたらし、単剤療法の形でこれらの各成分の有効性を超えることがわかりました。 アリスキレン、バルサルタン、およびこれらの薬剤の組み合わせが血圧に及ぼす影響は、312の臨床センター(米国、スペイン)での大規模な研究で研究されました。
ニヤ、ドイツ)高血圧症の1797人の患者の参加。 治療の8週目の終わりまでに、アリスキレンとバルサルタンの組み合わせの作用下で、アリスキレンまたはバルサルタンのみを使用した場合よりも血圧が大幅に低下したことが認められました。 2009年に、多施設共同臨床試験の結果が発表されました。この試験では、1124人の高血圧患者を対象にPIRとHCT(初期降圧療法)の有効性が比較されました。 必要に応じて、アムロジピンがこれらの薬に追加されました。 単剤療法期間の終わり(12週目)までに、PIRはHCTよりも顕著な血圧低下をもたらすことが明らかになりました(-17.4 /-12.2対4.7 / -10.3 mm Hg、p<0,001). У пациентов с мягкой и умеренной АГ с ожирением и без ПИР+ГХТ обеспечивают достоверное снижение ДАД и САД. . Доказана и эффективность комбинированной терапии, включающей алискирен у пациентов с плохо контролируемой (резистентной) АГ .
W.B. ホワイトら。 (2010)13のRCTに従って、高血圧の治療におけるARBおよびチアジド系利尿薬と組み合わせたPIRの安全性と忍容性を分析しました。 2009年8月31日。この研究には、高血圧ステージ1および2の12942人の患者が含まれていました。 短期間の研究の結果、PIRとARB(バルサルタンまたはロサルタン)またはチアジド系利尿薬の併用は、これらの薬剤による単剤療法と同じように患者に許容されることが確立されました。 これらの発見は、長期的な研究でも確認されています。 同時に、アリスキレン-+バルサルタンまたはアリスキレン+ロサルタンの併用療法を受けた患者を対象とした短期試験では、副作用が32.2〜39.6%で検出され、単剤療法では30.0〜39.6%の患者で検出されました。 長期試験では、アリスキレン+ロサルタンの併用療法を受けた患者の55.5%、45%-アリスキレン+利尿薬で副作用が観察され、ロサルタン単独療法(53、%)および利尿薬による患者と有意差はありませんでした。 (48.9%)。 言い換えれば、アリスキレンとARBバルサルタンまたはロサルタンとの併用療法の安全性と忍容性は、これらの薬剤による単剤療法と同様でした。
Y. Liu etal。 (2014)、アリスキレン+アムロジピンとアリスキレン+ヒドロクロプチアジドの併用療法を受けた13614人の高血圧患者を含む19のRCTの分析の結果、併用療法は有意な結果をもたらしたと結論付けました(p<0,00001) большему снижению АД по сравнению с монотерапией. При этом не было установлено достоверных различий между комбинированной терапией и монотерапией в отношении побочных эффектов, кроме периферических отеков и гиперкалиемии при лечении только амлодипином. Подобный гипотензивный эффект комбинированной терапии получен у больных с ожирением и без него. Кроме того, выявлено, что лечение комбинацией алискирен+ амлодипин достоверно более эффективно, чем алиски-рен+гидрохлоптиазид, число побочных эффектов и отказов от лечения, обусловленных нежелательными реакциями, существенно не различалось .
アリスキレンの臓器保護作用。 実験では
動物実験では、アリスキレンが腎動脈の血管拡張を誘発し、微小利尿を増加させ、アルブミン尿の回復をもたらし、スーパーオキシドラジカルの形成を減少させ、抗炎症および抗アテローム性動脈硬化作用を有し、左心室肥大の減少に寄与する能力を示しています。 。 同時に、アリスキレンの腎保護および心臓保護の性質は、バルサルタンの性質と同等でした。
PIRの心臓保護および腎保護効果は、多くの臨床研究で高血圧および慢性腎臓病の患者の治療で確認されています。 S.C. トング。 etal。 (2012)非糖尿病性腎症の患者において、ロサルタンへのPIRの追加がタンパク尿を有意に減少させたことを発見しました。 著者らは、PIRの腎保護効果を、インターロイキン-6およびトランスフォーミング成長因子ベータ(TGF-β)の循環レベルの明らかな低下と関連付けています。
回避研究-ロシアの臨床センターも参加した糖尿病のタンパク尿の評価におけるアリスキレン(ASPIRE HIGHERプログラムの一部)は、非常に高いことを特徴とするさまざまな状況で標的臓器を保護するアリスキレンの能力を評価するために設計されました潜在的に致命的な合併症のリスク。 高血圧を伴う599人の糖尿病性腎症患者において、尿中アルブミン/クレアチニン比によって評価された、尿中アルブミン排泄に対するロサルタンとアリスキレンの最大用量の組み合わせの効果が研究された。 ロサルタン(100mg /日)へのアリスキレン(300mg /日)の追加は、尿中アルブミン/クレアチニン比の20%の有意な減少を伴い、この比の24.7%で50%以上の減少を含みました。忍耐。 同時に、ロサルタンとプラセボを併用した場合、尿中アルブミン/クレアチニン比の50%以上の低下は12.5%にとどまりました。 アリスキレンの腎保護効果は血圧に依存しませんでした。 大沢さんらの研究で。 (2013)高血圧を伴う慢性腎臓病の患者におけるARB療法へのアリスキレンの追加は、ベナゼプリルの追加と比較して、血圧のより有意な減少と心臓と腎臓の機能の改善につながることを示しました。
ALOFT研究(心不全治療のアリスキレン観察)の結果によると、不利な予後(血漿ナトリウム尿酸ペプチドの持続的な増加)の兆候を伴う慢性心不全(CHF)の標準治療レジメンへのアリスキレンの追加)および高血圧は、臨床状態の改善、僧帽弁逆流の大きさの僧帽弁開口部および伝達血流の面積に対する比率の減少を達成することを可能にしました。 アリスキレンのおかげで、非適応性神経液性活性化のマーカーの濃度(脳性ナトリウム利尿ペプチド(BNUP)とその前駆体の血漿レベル、尿中アルドステロン濃度、および血漿レニン活性)が減少しました。 同時に、150 mgのアリスキレンを追加した治療のバックグラウンドに対するBNPのレベルは、標準治療の5分の1に減少しました。
ランダム化研究でALLAY(The
アリスキレン左心室肥大評価)には、アリスキレンを300 mg、ロサルタン-100 mg /日、またはそれらの組み合わせで投与された465人の高血圧患者が参加しました。 PIRを受けている間、レニン活性と血漿アルドステロン濃度は減少しましたが、これらの指標はロサルタン治療で増加しました。 Alis-kirenはまた、左心室の心筋量指数の低下を引き起こしました。これは、高血圧と太りすぎの患者の肥大の退行を反映しています。 アリスキレンとロサルタンの併用により、左心室肥大がさらに減少しました。
I.M.の臨床試験 Fushtey etal。 (2013)高血圧性腎症とメタボリックシンドロームの患者におけるPIRの3ヶ月間の降圧療法を示しました。 コレステロールとトリグリセリドのレベルを大幅に低下させ、インスリン抵抗性の指標を示し、腎機能を改善し(微量アルブミン尿の減少と糸球体濾過の増加)、血管内皮の機能状態を改善しました。
ASPIRE HIGHERプログラム(AVOID、ALOFT、ALLAY、AGELESS)および他の多くの短期RCTの完了した研究の結果は、単剤療法と併用療法の両方で、アリスキレンの高い臨床効果と臓器保護効果を示しています。 しかし、ASPIREとAVANTGARDEの研究は相反する結果を生み出しました。 ASPIRE研究は、心筋梗塞患者の最適な治療レジメンにアリスキレンを追加しても、左心室リモデリングの発症を防ぐことはできませんが、腎機能障害、低血圧、高カリウム血症の形でより顕著な副作用を引き起こすことを示しました。
心血管および腎合併症のリスクが高い2型糖尿病患者において、アリスキレンと標準療法(ACE阻害薬またはARB)の組み合わせを使用したRAASの二重遮断にいくつかの期待が寄せられました。 8561人の患者がALTITUDE-心腎疾患エンドポイントを使用したアリスキレン試験I2型糖尿病(ASPIRE HIGHERプログラムの一部)に参加しました。 この研究の主な目標は、複合エンドポイント(心血管死と合併症:蘇生の成功、致命的でない心筋梗塞、致命的でない脳卒中、計画外の入院)への影響の観点から、標準治療にアリスクレンを追加することの有効性を評価することでした。 CHFによる;末期の慢性腎不全の発症、血清クレアチニンの倍増、腎障害に関連する原因による死亡)。 この研究は、標準治療にアリスキレンを追加することの有効性の欠如と、致命的でない脳卒中、腎機能障害、高カリウム血症、低血圧などの副作用のために早期に終了しました。 調査結果に基づいて、アリスキレンとACE阻害薬またはARBの併用療法は、ADおよび糖尿病または腎不全の患者には推奨されません。 その後、欧州医薬品庁と米国食品医薬品局の医薬品委員会は、降圧薬が
G. Mihai et al。による報告は、ALTITUDEの結果と矛盾しません。 (2013)、心血管疾患患者の3次元磁気共鳴画像法の結果を分析する際に、アリスキレンを1日300 mgの用量で36週間服用した場合、プラセボと比較して大動脈アテローム性動脈硬化症の進行の加速を確立しました。 このため、研究は予定より早く終了しました。
もう一つの失望は、宇宙飛行士の研究結果の報告でした。 ACE阻害薬、アルドステロン拮抗薬、アンジオテンシン受容体拮抗薬による心不全の従来の治療法にアリスキレンを追加すると、死亡率と繰り返し入院のリスクに追加の影響があると想定されていました。 しかし、得られた結果は、主要評価項目であるCVDによる再ゴシタリゼーションと死亡の数に関して、対照群とアリスキレンを追加した薬剤の組み合わせで治療された患者群との間に有意差がないことを示しました。 同時に、高カリウム血症、低血圧、腎不全などの副作用のリスクは、プラセボと比較して増加しました。
したがって、文献には、ACE阻害薬またはARBと組み合わせたアリスキレンによる治療の結果に関する矛盾するデータがあります。 おそらく、これらの矛盾は、ALTITUDE研究では、高用量のACE阻害薬またはARBと組み合わせた高用量(330 mg /日)のアリスキレンで治療が行われたという事実に関連しています。 W.P.による最近の研究 ウーら (2012)6ヶ月間の慢性腎臓病の103人の中国人患者におけるACE阻害薬またはARB療法に150mgのアリスキレンを加えることを発見しました。 2型糖尿病を併発しているグループと伴わないグループの両方で、血圧の制御とタンパク尿の減少に貢献しました。 同時に、糸球体濾過率とカリウム濃度に有意な変化はありませんでした。さらに、アリスキレンは血漿中のレニンの活性を低下させるだけでなく、カリウム代謝に重要な役割を果たすプロレニン受容体の発現にも影響を与えます。 。
カナダでは、さまざまな疾患(高カリウム血症、急性腎虚血、脳発作)で入院した66歳以上の患者903346人が、ACE阻害薬またはARBと組み合わせたアリスキレンによる治療を28か月間受けました。 多変量解析の結果、アリスキレンによる治療は、高カリウム血症、脳卒中、または急性腎不全による入院リスクの有意な増加とは関連がないことがわかりました。 慢性腎臓病、糖尿病、CHFの患者におけるACE阻害薬またはARBと組み合わせたPIRの28ヶ月間の治療。 また、副作用の増加を伴わなかった。 研究者R.M. カナダのTouyz(2013)。
結論
したがって、上記の分析に基づいて
研究の結果、直接レニン阻害剤アリスキレンは、高い降圧能力、好ましい治療プロファイル、高い安全性、良好な耐性を有し、顕著な器官保護効果を有すると結論付けることができます。 多施設無作為化試験により、さまざまな原因の高血圧症におけるアリスキレン+アムロジピン、アリスキレン+アムロジピン+ヒドロクロロチアジドとの併用療法の有効性と安全性が証明されています。 したがって、アリスキレンは、高血圧患者の大多数に対して、併用療法のための追加のクラスの降圧薬として適応されており、これは、動脈性高血圧の診断と治療に関するロシアのガイドライン(2010)に反映されています。 このグループには、さまざまな原因のAH、メタボリックシンドローム、肥満、慢性腎不全、慢性腎疾患、閉経期および閉経後の女性のAHを伴う、RAASの過剰な活性化が確立されている患者も含まれます。
それにもかかわらず、多くの未解決の問題、特にアリスキレンとACE阻害薬またはARBとの併用療法が残っており、追加の研究が必要です。
文学
1. Vasyuk Yu.A.、Sadulaeva I.A.、Yushchuk E.N. およびその他のレニン阻害剤-動脈性高血圧症の治療における新しい方向性// Ter。 記録。 -2010年。-第9号。-S。53-59。
2.WHOは世界的なNCDの状況について報告します。 非感染性疾患の世界的な負担、それらの危険因子および決定要因の分析。 -ジュネーブ:WHO、2011年.-- 176p。
3.動脈性高血圧症の診断と治療。 ロシアの推奨事項(第4改訂版)//全身性高血圧。 -2010.-No. 3.-S.5-26。
4. Mukhin N.A.、Fomin V.V. レニンは、動脈性高血圧症における直接的な薬理学的遮断の標的です// Ter。 記録。 -2009年。-第8号。-S。5-9。
5. Fushtei I.M.、S.L。 Podsevakhina、A.I。 Palamarchuk et al。高血圧性腎症患者の腎臓の機能状態、代謝状態の指標、および炎症の活動に対する降圧療法の効果//救急および回復医学の報告。 -2013.-T. 14、No。1.-S.63-67。
6. Chazova I.E.、Fomin V.V.、Paltseva E.M. 直接レニン阻害剤アリスキレン-動脈性高血圧症における腎臓保護の新しい可能性//臨床腎臓学。 -2009年。 -No.1-S.44-49。
7. Andersen K.、Weinberger M. H.、Egan B. etal。 高血圧症におけるアリスキレン、経口直接レニン阻害剤、およびラミプリルの有効性と安全性の比較:6か月のランダム化二重盲検試験//高血圧症。 -2008.-Vol。 26.-P.589-599。
8. Azizi M.、Webb R.、Nussberger J. etal。 アリスキレンによるレニン阻害:私たちは今どこにいて、どこに行くのか? // J。ハイパーテンス。 -2006.-Vol。 24 .-- P.243-256。
9. Brown M.、McInnes G.、Papst C. etal。 高血圧制御の初期治療戦略としてのアリスキレンとカルシウムチャネル遮断薬アムロジピンの併用(加速):無作為化並行群間試験//ランセット。 -2011.-Vol。 377.-P.312-320。
10. Choi D.E.、Jeong J.Y.、Lim B.J. etal。 アリスキレンは、片側尿管によって誘発される腎臓の炎症と線維症を改善します
マウスの閉塞//J.Urol。 -2011.-Vol。 186.-P.694-701。
11.2013動脈性高血圧の管理に関するESH / ESCガイドライン。 欧州高血圧学会(ESH)および欧州心臓病学会(ESC)の動脈性高血圧管理のためのタスクフォース//J.Hypertens。
2013.-Vol。 31.-P.1281-1357。
12. Danser A. H. J.、Deinum J. Renin、プロレニンおよび推定プロレニン受容体//高血圧。 -2005.-Vol。 46.-P.10691076。
13. Daugherty K.K. アリスキレン//午前 J.ヘルスシステム。 薬。 -2008.-Vol。 65、いいえ。 14.-P.1323-1332。
14.フィッシャーN.D.、ヤンダンサーA.H.、ヌスバーガーJ.他 健康なヒトにおけるアリスキレンによる直接レニン阻害に対する腎臓およびホルモンの反応//循環。 -2008.-Vol。 117.-いいえ。 25.-P。 3199-3205。
15. Gheorghiade M.、Bohm M.、Greene S.J. etal。 心不全で入院した患者の退院後の死亡率と心不全の再入院に対するアリスキレンの効果:ASTRONAUTランダム化試験// JAMA。 -2013.-Vol。 309.-P.1125-1135。
16.福富正明、星出聡、水野秀樹ほか 高齢高血圧患者の内皮機能に対するアリスキレン/アムロジピン併用療法と高用量アムロジピン単剤療法の異なる効果//午前。 J.高血圧。 -2014.-Vol。 27、いいえ。 1.-P.1420。
17. Gilbert C.J.、Gomes T.、Mamdani M.M. etal。 アンジオテンシン変換酵素阻害薬またはアンジオテンシン受容体遮断薬を投与されているオンタリオ州の患者では、アリスキレン使用中の有害事象の増加はありません//できます。 J.カルディオール。 -2013.-Vol。 29.-いいえ。 5.-P。 586-591。
18. Gradman A.H.、Schmieder R.E.、Lins R.L. etal。 新規の経口効果のあるレニン阻害剤であるアリスキレンは、高血圧患者のAT1受容体遮断薬と同様の降圧効果とプラセボのような忍容性を提供します//循環。 -2005.-Vol。 111.-P.1012-1018。
19.ジョーダンJ.、エンゲリS.、ボイS.W. 動脈性高血圧症の肥満患者におけるアリスキレンによる直接レニン阻害//高血圧症。 -2007.-Vol。 49、いいえ。 5.-P.1047-1055。
20.今西徹、辻岡秀樹、池島秀樹ほか レニン阻害剤アリスキレンは、一酸化窒素のバイオアベイラビリティの低下を改善し、アテローム性動脈硬化症の変化から保護します//高血圧。 -2008.-Vol。 52.-P.563-557。
21. Kario K.、Pickering T. G.、Umeda Y. etal。 高齢高血圧症における無症候性および臨床的脳血管疾患の予測因子としての血圧の朝の急上昇。 前向き研究//循環。 -2003.-Vol。 107.-P.1401-1406。
22. Kim S.、IwaoH。アンジオテンシンIIを介した心血管疾患および腎疾患の分子および細胞メカニズム// Pharmacol。 牧師 -2000。-巻。 52、いいえ。 5.-R.11-34。
23. Liu Y.、Yan R.、Song A. Aliskiren /アムロジピンvs. 高血圧症におけるアリスキレン/ヒドロクロロチアジド:2つの組み合わせとを比較した試験の間接メタアナリシス。 単剤療法//午前。 J.高血圧。 -2014.-Vol。 27、いいえ。 2.-P.268-278。
24.メンデC.W. 慢性腎臓病への直接レニン阻害の適用// Cardiovasc。 ドラッグサー。 -2010.-Vol。 14.-P。 130-149。
25. Mihai G.、Varghese J.、Kampfrath T. etal。 高解像度3DMRI(ALPINE)を使用した確立されたアテローム性動脈硬化症のプラーク進行に対するアリスキレンの効果:二重盲検プラセボ対照試験[電子リソース] //J.Am。 心臓協会。 -2013.-Vol。 2、いいえ。 3.3。
土井:10.1161 /JAHA.112.004879。
26. McMurray J.、Pitt B.、Latini R. etal。 症候性心不全患者における経口直接レニン阻害剤アリスキレンの効果// Circ。 ハートフェイル。 -2008.-Vol。 1.-P.17-24。
27.小川正明、鈴木淳、高山健一ほか 慢性腎臓病における梗塞後の心臓リモデリングの障害は、過剰なレニン放出によるものです//ラボ。 投資。 -2012.-Vol。 92、いいえ。 12.-P.17661776。
28. Oh B.-H.、Mitchell J.、Herron J.R. etal。 アリスキレン、経口レニン
阻害剤は、高血圧患者に用量依存的な有効性と持続的な24時間血圧制御を提供します//午前。 コル カルジオール。 -2007.-Vol。 49.-P.1157-1163。
29.大社和、田村、金岡、他 アンジオテンシン受容体拮抗薬へのアリスキレンの追加は、慢性腎臓病におけるベナゼプリルの追加よりも、自由行動下血圧プロファイルと心腎機能を改善します// Int。 モル。 科学 -2013。
巻 14.-P.15361-15375。
30. Oparil S.、Yarows S. A.、Patel S. etal。 高血圧患者におけるアリスキレンとバルサルタンの併用の有効性と安全性:無作為化二重盲検試験//ランセット。 -2007年。
巻 370.-P.221-229。
31. Parving H.-H.、Brenner B.M.、McMurray J.J.V. etal。 2型糖尿病に対するアリスキレンの試験における心腎エンドポイント//N.Engl。 J.Med。 -2012.-Vol。 367.-P.2204-2213。
32.プールJ.L.、シュミーダーR. E.、アジジM.他 経口的に有効なレニン阻害剤であるアリスキレンは、単独で、およびバルサルタンと組み合わせて降圧効果を提供します// Am。 J.高血圧。 -2007年。
巻 20.-P.11-20。
33. Pilz B.、Shagdarsuren E.、Wellner M. etal。 ヒトレニン阻害剤であるアリスキレンは、ダブルトランスジェニックラットの心臓および腎臓の損傷を改善します//高血圧。 -2005.-Vol。 46.-P.569576。
34. Shah S.、Coakley C.、Hough A. etal。 治療が困難な高血圧症の患者におけるトリプル抗レニンシステム薬物療法を導くための血漿レニン活性試験//アン。 Pharmacother。 -2013年。
巻 47、いいえ。 11.-P.1562-1568。
35. Schmieder R. E.、Philipp T.、Guerediaga J. etal。 経口直接レニン阻害剤アリスキレンの長期降圧効果と安全性。 ヒドロクロロチアジドを用いた12か月のランダム化二重盲検コンパレータ試験//循環。 -2009年。 -Vol。 119.-P.417-425。
36. Sechi L. A.、Novello M.、Colussi G. etal。 高血圧における血漿レニンと血栓形成促進状態との関係:臓器損傷との関連性// Am。 J.高血圧。 -2008.-Vol。 21、いいえ。 12.12。
37. Sen S.、Saberle S.、Ozyigit T. etal。 アリスキレン:過去および最近の臨床試験に焦点を当てた有効性および安全性データのレビュー// Ther。 アドバンス 慢性疾患 -2013.-Vol。 4、いいえ。 5.-P.232-241。
38. Sica D.、Gradman A.、Lederballe O. etal。 新規レニン阻害剤であるアリスキレンは忍容性が高く、高血圧の長期(52週間)治療中に単独またはHCTZと組み合わせて血圧低下効果を持続しました// Eur。 Heart J.-2006 .-- 27、abstractsuppl。 -P.121。
39. Scirica B. M.、Morrow D. A.、Bode C. etal。 左心室肥大(ALLAY)試験研究者のアリスキレン。 高血圧および左心室肥大の患者の左心室腫瘤に対する直接レニン阻害剤アリスキレン、アンジオテンシン受容体遮断薬ロサルタン、またはその両方の効果//循環。 -2009年。 -Vol。 119.-P.530-537。
40. Solomon S.、Sung H.、Shah A. etal。 収縮機能障害を伴う心筋梗塞後の左心室リモデリングに対する直接レニン阻害剤アリスキレンの効果// Eur。 ハートJ。
2011.-Vol。 32.-P.1227-1234。
41. Staessen J.A.、Li Y.、Thijs L.血圧低下と心血管予防:2003年から2004年の二次予防試験を含む最新情報// Hypertens。 解像度 -2005.-Vol。 28 .-- P.385-407。
42.スタントンA.心血管障害の管理におけるレニン阻害の治療的可能性//午前。 J.Cardiovasc。 薬物。 -2003.-Vol。 3.-P.389-394。
43. Stephan D.、Grima M.、Welsch M. etal。 高血圧患者における長期のラミプリル治療の中断:レニンアンジオテンシン系への影響// Fundam。 クリン。 Pharmacol。 -1996年。
巻 10、いいえ。 5.-P.474-483。
44.鈴木秀樹、岡田健一、阿部正明ほか アリスキレンは、高血圧性腎硬化症の患者の家庭血圧とアルブミン尿を低下させます// Clin。 Exp。 ネフロール。 -2013.-Vol。 17、いいえ3。-
45.スペンスJ.D. 抵抗性高血圧症の治療の生理学的調整//現在の心臓病学レビュー。 -2010.-Vol。 6.-P。 119-123。
46. TangS.C。、Lin M.、Tam S. etal。 免疫グロブリンA腎症におけるアリスキレンとロサルタンの併用:オープンラベルのパイロット研究//ネフロール。 ダイヤルします。 移植。 -2012.-Vol。 27、いいえ。 2.-P.613618。
47. Touyz R.M. アリスキレンとレニン-アンジオテンシン系の遮断薬との併用降圧治療-再保証、ただし注意が必要//できます。 J.カルディオール。 -2013年。
巻 29、いいえ。 5.-P.521-523。
48.ターンブルF.主要心血管イベントに対するさまざまな血圧低下レジメンの効果:無作為化試験の前向きに設計された概要の結果//ランセット。 -2003.-Vol。 362.-P.1527-1535。
49. Uresin Y.、Taylor A.、Kilo C. etal。 糖尿病と高血圧の患者における直接レニン阻害剤アリスキレンとラミプリルの単独または併用の有効性と安全性// J。レニンアンギオテンシンアルドステロンシステム。 -2007.-Vol。 8.-P.190-198。
50. Villamil A.、Chrysant S.、Calhoun D. etal。 アリスキレンによるレニン阻害は、ヒドロクロロチアジドと組み合わせて使用すると、相加的な降圧効果をもたらします// J.Hypertens。 -2007。 -Vol。 25.-P.217-226。
51. Vaidyanathan S.、Warren V.、Yeh C. etal。 肝機能障害のある患者における経口レニン阻害剤アリスキレンの薬物動態、安全性、および忍容性// Clin。 Pharmacol。 -2007.-Vol。 47、いいえ。 2.-P.192-200。
52. Vaidyanathan S.、Valencia J.、Kemp C. etal。 健康なボランティアにおける抗高血圧薬アムロジピン、バルサルタン、ヒドロクロロチアジド(HCTZ)およびラミプリルとの高血圧治療のための新規直接レニン阻害剤であるアリスキレンの薬物動態学的相互作用の欠如// Int。 J.Clin。 練習する。
2006.-Vol。 60.-P.1343-1356。
53.渡辺T.、バーカーT.A.、バークB.C. アンジオテンシンIIと内皮:多様な信号と影響//高血圧。 -2005。
巻 45.-P.163-169。
54.堰M.R. アンジオテンシンII受容体遮断薬による心血管リスク低減の機会//現在の高血圧レポート。 -2002.-Vol。 4.-P.333-335。
55. Weir M.、Bush C.、Zhang J. etal。 高血圧患者における経口レニン阻害剤アリスキレンの降圧効果と安全性:プール分析// Eur。 Heart J.-2006.-Vol。 27、抽象的なsuppl。 -P.299。
56. Whaley-Connell A.、Nistala R.、Habibi J. etal。 トランスジェニックRen2ラットの糸球体濾過バリア損傷に対する直接レニン阻害とAT1R遮断の効果の比較// Am。 J.Physiol。 腎臓の生理。 -2010.-Vol。 298.-P.655-661。
57. White W.B.、Bresalier R.、Kaplan A.P. etal。 アンジオテンシン受容体遮断薬およびチアジド系利尿薬と組み合わせた直接レニン阻害剤アリスキレンの安全性と忍容性:12,942人の患者の臨床経験のプール分析// J.Clin。 高血圧。 (グリニッジ)。 -2010.-Vol。 12、いいえ。 10.-P.765775。
58. Woo K.T.、Choong H.L.、Wong K.S. etal。 非糖尿病性慢性腎臓病におけるアリスキレンとロサルタンの遡及的研究// World Journal ofNefrology。 -2013.-Vol。 2、いいえ。 4.-P.129135。
59. Wu M.T.、Tung S.C.、Hsu K.T. etal。 アリスキレンのアドオン療法は、慢性腎臓病のタンパク尿を効果的に軽減します:オープンラベルの前向き試験[電子リソース] // Journal of the Renin-Angiotensin-AldosteronSystem。 -2012。-doi:10.1177 / 1470320312467560; PMID:23223162。
60.吉富恭子、川西健一、山口晃他 抵抗性高血圧症の患者における直接レニン阻害剤であるアリスキレンの有効性// Int。 ハートJ.-2013.-Vol。 54、いいえ。 2.-P.88-92。
2014年3月12日受領
コルパコワアラフェドロフナ、理学博士 蜂蜜。 科学、教授、主任研究員、生物研究所-
情報学FGBU「コンピュータ工学の設計と技術研究所」SBRAS。 住所:630090、ノボシビルスク、セント acad。 Rzhanova、6。Eメール: [メール保護]
UDC 616.24-008.331.1-085
肺動脈性肺高血圧症の治療におけるエンドセリン受容体拮抗薬(文献レビュー)
S.N. Ivanov1、T.G。 Volkova1、R.V。 Volkov2、Yu.A。 Khrustaleva1、V.G。 エフィメンコ1
1FGBUノボシビルスク循環器病理学研究所はロシア保健省の学者E.N.メシャルキンにちなんで名付けられました2州ノボシビルスク地域臨床病院Eメール: [メール保護]
肺動脈性肺高血圧症の治療におけるエンドセリン受容体拮抗薬(文献レビュー)
S.N. Ivanov1、T.G。 Volkova1、R.V。 Volkov2、Yu.A。 Khrustaleva1、V.G。 エフィメンコ1
ロシア連邦ノボシビルスク州立地域病院保健省の連邦州立機関「ノボシビルスク循環病理学研究所n.a.acac1。E.N。メシャルキン」
分析記事は、肺動脈性肺高血圧症(PAH)の治療におけるエンドセリン受容体拮抗薬の使用に関する文献のレビューを提供します。 実際に広く使用されている主な薬であるボセンタン(traklir)とアンブリセンタンについて説明します。 現在、このグループの両方の薬はロシアで登録されています。 この記事は、エンドセリン受容体拮抗薬の使用に関する主な臨床研究を示しています。
キーワード:肺動脈性肺高血圧症、ボセンタン(traklir)、アンブリセンタン。
この分析記事は、肺動脈性肺高血圧症の治療にエンドセリン受容体拮抗薬を使用するための文献のレビューを提供します。 著者らは、臨床診療で広く使用されている2つの主要な薬剤、ボセンタン(Tracleer)とアンブリセンタンの使用について説明しています。 これらの薬は両方ともロシア連邦に登録されています。 この記事は、エンドセリン受容体拮抗薬の主な臨床試験の結果を示しています。 キーワード:肺動脈性肺高血圧症、ボセンタン(Tracleer)、アンブリセンタン。
肺動脈性肺高血圧症(PAH)は、血管閉塞とさまざまな程度の血管収縮を特徴とする疾患であり、肺血管抵抗の増加と右心室性心不全(RVF)を引き起こします。 治療せずに放置すると、PAHは最終的にRVFと死につながります。 未治療の患者の生存率の中央値は2。8年です。 疫学データはさまざまですが、ヨーロッパでのこの病気の有病率は100万人あたり15例と推定されています。
PAHの発症の根底にある病態生理学的メカニズムには、血管作用物質と増殖因子の不均衡につながる肺血管機能障害が含まれ、血管リモデリングと肺血管収縮の発症につながります。 エンドセリン(ET)は、PAH発症の重要なメディエーターと見なされています。 PAHでは、ET-1のレベルが上昇し、病気の進行に寄与することがわかりました。 明らかになった有意な相関
エンドセリン1の血清レベルと、肺血管抵抗(PVR)、平均肺動脈圧(PMP)、および右心房圧のレベルによって測定される疾患の重症度との間。 PAHの詳細なエビデンスに基づく治療ガイドラインは以前に公開されています。
病気の治療には2つの薬理学的アプローチがあります:支持療法または対症療法のグループの薬の使用(血管収縮、呼吸困難および血栓塞栓性合併症の程度を減らすことを目的としています)および病態生理学的メカニズムに影響を与える薬の使用病気の発症。 ET-1受容体拮抗薬は、エンドセリンの血管収縮作用と増殖作用の両方を制限することができる薬剤であり、したがって、疾患の臨床経過を改善します。
Tracleer(ボセンタン)は最初で現在
レニン-アンギオテンシン-アルドステロン系(RAAS)の研究の歴史は、その活性の薬理学的調節へのアプローチを開発するという点で最も成功し、心血管および腎疾患の患者の寿命を延ばすことができました。 110年前に始まりました。 レニンが最初の成分として特定されたとき。 その後、実験的および臨床的研究において、レニンの生理学的役割と、さまざまな病的状態におけるRAAS活性の調節におけるその重要性を明らかにすることができ、これが非常に効果的な治療戦略である直接レニン阻害剤の開発の基礎となりました。
現在、レニンラシレス(アリスキレン)処方の最初の直接阻害剤は、他のRAASブロッカー(ACE阻害剤およびARB)が適応されていない場合、または有害事象の発生によりそれらの使用が困難な場合でも正当化されます。
他のRAASブロッカーと比較して、高血圧の標的臓器の保護における直接レニン阻害剤の追加機能を頼りにすることを可能にする別の状況は、負の法則に従って、他のレベルでRAASをブロックする薬剤を使用する場合です。フィードバック、プロレニンの濃度の増加、およびレニンの血漿活性の増加が発生します。 高血圧を軽減する能力の観点を含め、ACE阻害薬の有効性のしばしば注目される低下をキャンセルするのはこの状況です。 1990年代初頭、ACE阻害薬の多くの有機保護効果が今日ほど確実に確立されていなかったとき、それらの用量が増加すると、レニンの血漿活性とアンジオテンシンの血漿濃度が大幅に増加することが示されました。 IaEおよびARBに加えて、チアジドおよびループ利尿薬も血漿レニン活性の増加を引き起こす可能性があります。
アリスキレンは最初の直接レニン阻害剤となり、その有効性は第III相の対照臨床試験で確認され、単剤療法でも十分な作用期間と高血圧の低下が見られ、現在ではその任命は革新的なアプローチと見なすことができます。高血圧の治療。 ACE阻害薬とARBを用いたRAASの個々の成分の血漿濃度と活性に対するその影響を比較しました。 アリスキレンとエナラプリルはアンジオテンシンIIの血漿中濃度をほぼ同等に低下させることが判明しましたが、アリスキレンとは異なり、エナラプリルを服用すると血漿中のレニン活性が15倍以上増加しました。 アリスキレンがRAAS成分の活性のバランスの負の変化を防ぐ能力も、ARBと比較した場合に実証されました。
アリスキレンまたはプラセボによる単剤療法を受けている合計8,481人の患者を含む臨床研究のプール分析は、150mg /日の用量でのアリスキレンの単回投与を示しました。 または300mg /日。 SBPが12.5および15.2mmHg減少しました。 それぞれ、5.9 mmHgの減少と比較して、プラセボ(R<0,0001). Диастолическое АД снижалось на 10,1 и 11,8 мм рт.ст. соответственно (в группе, принимавшей плацебо – на 6,2 мм рт.ст.; Р < 0,0001). Различий в антигипертензивном эффекте алискирена у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
2009年に、アリスキレンとヒドロクロロチアジドの有効性が1124人の高血圧患者で比較された多施設共同臨床試験の結果が発表されました。 必要に応じて、アムロジピンがこれらの薬に追加されました。 単剤療法期間の終わりまでに、アリスキレンはヒドロクロロチアジドよりも血圧のより顕著な低下をもたらすことが明らかになりました(-17.4 / -12.2 mmHg対-14.7 / -10.3 mm Hg; R< 0,001)
この記事では、どの高血圧治療薬が最新世代に属しているか、そしてそれらが以前の降圧薬よりも本当に優れているかどうかを調べます。
記事の公開日:2017年7月14日
記事の更新日:2019年6月2日
降圧薬の「最新世代」には、正確な定義や発売年はありません。 ほとんどの場合、この用語は広告目的で使用され、医薬品市場で特定の薬(必ずしも最も効果的または新しい薬ではない)を宣伝します。 しかし、医学は静止していません。 高血圧症の新薬は絶えずテストされていますが、臨床診療への導入は1年の問題ではありません。 すべての新製品が古い製品と比較して高い有効性と安全性を示すわけではありませんが、より適切にテストされた製品です。 ほぼ毎年、高血圧のための新しい錠剤が薬理学的市場に導入され、古くから知られている活性物質またはそれらの組み合わせが含まれています。
それでも、いくつかの降圧薬には世代があります。そのような場合、高血圧用の最新世代の薬について話すことができます。
新世代の高血圧症治療薬のリストにある代表者のほとんどは、経口使用用の錠剤の形で入手できます。 例外は、静脈内溶液として利用可能なベータ遮断薬であるラベタロールです。 非経口使用のための他の薬(例えば、硝酸塩、ベンゾヘキソニウム、ニトロプルシドナトリウム)がありますが、それらは新薬として分類するのが難しいです。 静脈内降圧薬は、ほとんどの場合、治療に使用されます。
いずれにせよ、高血圧の治療に新製品を使用する前に、心臓専門医に相談する必要があります。 また、すでに十分に研究されている手段と比較して、この薬の有効性と安全性に関する科学的研究に関する情報を独自に検索することもできます。
アンジオテンシン変換酵素阻害剤
アンジオテンシン変換酵素阻害薬(ACE阻害薬)は、主に高血圧や心不全の治療に使用される医薬品です。 このグループの薬は、不活性なアンギオテンシン1を活性なアンギオテンシン2に変換するアンギオテンシン変換酵素の活性を阻害し、それによって血管を拡張し、心臓への負担を軽減します。
最初のACE阻害薬(カプトプリル)は40年以上前に発見されて以来、このグループの12種類の薬剤が臨床現場に導入されています。
現在、最も一般的に使用されているACE阻害剤で、1990年代に発明されました。 彼らのリスト:
- ラミプリル。
- ペリンドプリル。
- ゾフェノプリル。
- キナプリル。
- フォシノプリル。

臨床診療への導入がかなり長いにもかかわらず、これらの薬剤はすべてのACE阻害剤の中で自信を持ってリードし続けており、多くの研究で高い有効性と安全性が証明されています。 さらに、多くの科学的証拠は、ACE阻害剤のさまざまな代表者の有効性と安全性にほとんど有意差がないことを示唆しています。 リシノプリルとフォシノプリルはどちらも効果的に血圧を下げることができますが、薬局でのこれらの薬の費用は大幅に異なる可能性があります。
動脈性高血圧症の治療に加えて、ACE阻害薬は次の目的で使用されます。
- 心不全-これらの薬は心臓へのストレスを軽減します。
- 糖尿病性腎症-ACE阻害薬は腎臓の機能状態を維持するのに役立ちます。
- 慢性腎臓病-ACE阻害薬はこれらの病気の進行を遅らせるのに役立ちます。
- 心筋梗塞。

ACE阻害薬を服用してはいけない人:
- 妊娠中および授乳中の女性。
- これらの薬に過敏症のある患者。
- 腎動脈狭窄などの特定の腎臓の問題を抱えている患者。
すべての最も一般的な副作用-最新のものでさえ-ACE阻害剤は乾いた咳であり、これらの薬を服用している人々の約10%で発症します。 あまり一般的ではないのは、唇、舌、または目の周りの腫れ、および腎機能の低下です。
カルシウムチャネル遮断薬。
(CCBと略される)カルシウム拮抗薬と呼ばれることもあるのは、特定の筋細胞へのカルシウムイオンの侵入を妨げる薬物のグループです。 それらは、高血圧、狭心症、レイノー症候群、心調律障害などのさまざまな状態を治療し、妊娠中の早産を止めるために使用されます。
CCLの3つの主要なグループのリスト:
- ニフェジピングループ(ジヒドロピリジン)。
- ジルチアゼムグループ(ベンゾチアゼピン)。
- ベラパミル基(フェニルアルキルアミン)。
血圧を下げるために最も一般的に使用されるのは、1960年代に開発されたジヒドロピリジンです。
ニフェジピングループには4世代の薬があります。
- 第一世代-ニフェジピン;
- 第2世代-ニカルジピン、フェロジピン;
- 第3世代-アムロジピン;
- 第4世代-シルニジピン。

臨床診療では、最初の3世代の薬が最も頻繁に使用され、医師がシルニジピンを処方することはめったにありません。
アムロジピンは、おそらくCCBグループで最も一般的に処方されている薬です。 1990年に使用され始めました。 アムロジピンは、動脈性高血圧の治療と安全性に非常に効果的であることが示されています。
チルニジピンは 新薬 CCBグループの第4世代で、他のカルシウム拮抗薬に比べて一定の利点があります。 L型カルシウムチャネルのみに影響を与える最初の3世代の代表と比較して、シルニジピンはN型も遮断することができます。 この特性は、アムロジピンや他の古いCCBの使用で観察されることがある、反射性頻脈の抑制と浮腫の減少によって明らかになる、有用な臨床的重要性を持っている可能性があります。 シルニジピンは親油性が高く、作用が長引くためです。 シルニジピンは、Duocard、Tsilakar、Atelekの商品名で製造されています。
ジヒドロピリジンの投与に対する禁忌には、特定の薬物に対するアレルギー反応が含まれます。
| また、カルシウム拮抗薬は以下の状況で注意して使用する必要があります | ジヒドロピリジンCCBの考えられる副作用には以下が含まれます |
|---|---|
| 心筋梗塞と不安定狭心症 | 足のむくみ |
| 動脈性低血圧 | 倦怠感 |
大動脈弁狭窄症  写真をクリックすると拡大します 写真をクリックすると拡大します |
吐き気 |
| 妊娠と母乳育児 | めまい |
| 腎機能障害および肝機能障害 | Cardiopalmus |
| 重度の心不全 | ほてり(体全体、特に顔や首に広がる熱感) |
ベータ遮断薬
ベータ遮断薬(BB)は、内因性カテコールアミン(ノルエピネフリンとアドレナリン)の受容体を遮断する薬剤のクラスであるため、血圧を下げ、心不整脈、および続発性心筋を治療するために使用されます。
最初のBB(プロプラノロール)は1964年に合成されました。 多くの医師や科学者は、このグループの薬の発見が20世紀の臨床医学と薬理学における最も重要な出来事の1つであることに同意しています。
それ以来、多くの掲示板が開発されてきました。 それらのいくつかはすべてのタイプのベータアドレナリン受容体に作用し、他のものはそれらの1つだけに作用します。 3世代のBBが区別されるのは、これらの特性です。
- 第1世代-プロプラノロール、チモロール、ソタロール(非選択的、ベータ1およびベータ2アドレナリン受容体を遮断)
- 第2世代-メトプロロール、ビソプロロール、エスモロール(選択的、ベータ1アドレナリン受容体のみを遮断)
- 第3世代-カルベジロール、ネビボロール、ラベタロール(追加の血管拡張特性があります)。

カルベジロールは、血管拡張という追加の特性を持つ第3世代のBBの1つです。 ベータ1およびベータ2アドレナリン受容体に作用し、血管内のアルファアドレナリン受容体も遮断します。 これらの効果により、カルベジロールは血圧をより強く低下させ、心拍数に影響を与えず、脂質と血糖値を上昇させません。 この薬の欠点は、ベータ2アドレナリン受容体への影響であり、気管支痙攣のリスクが高まります。 カルベジロールは1日2回服用する必要がありますが、これは患者にとってあまり便利ではありません。
ネビボロールは、ベータ1アドレナリン受容体に選択的に作用する薬剤であり、血管内皮における一酸化窒素(NO)の合成が増加するため、血管拡張作用があります。 これらの効果により、ネビボロールは血圧を下げるのに優れており、心拍数への影響が少なく、血糖値とブドウ糖レベルを上昇させず、勃起不全を引き起こしません。 この薬の負の特性は、ベータ遮断薬に対する効果がかなり弱いため、心不全のある高齢者に最もよく使用されます。

ラベタロールは、非選択的なベータ遮断特性とアルファ受容体への影響を持つ薬です。 ラベタロールは主に静脈内投与の形で使用され、作用の持続時間が非常に短いため、薬の効果を適切に制御することができます。 これは、高血圧クリーゼの治療に最も効果的なベータ遮断薬です。 褐色細胞腫(副腎腫瘍)および子癇前症(妊婦の後期中毒症)によく使用されます。
ベータ遮断薬に共通する副作用のリスト:
アンジオテンシン2受容体遮断薬
アンジオテンシン2受容体遮断薬(ARB)、またはサルタンは、高血圧の治療に広く使用されている最新の薬剤グループです。 最初のサルタン(ロサルタン)は1986年に実用化されました。
サルタンの作用は、レニン-アンギオテンシン系の最後のレベルをブロックすること、つまり、アンギオテンシン2がその受容体に結合するのを防ぐことに基づいています。 これらの効果のおかげで、ARBは血管拡張を引き起こし、バソプレッシンとアルドステロン(体内の水分とナトリウムの保持を促進するホルモン)の分泌を減少させ、血圧の低下をもたらします。
臨床使用が承認されている最新のARBは、オルメサルタン(Cardosal)、フィマサルタン(Canarb)、およびアジルサルタン(Edarbi)です。

最新の薬を含むサルタンの使用の適応症:
- 動脈性高血圧症。
- 心不全。
- 糖尿病における腎臓の病理。
- 慢性腎臓病。
ご覧のとおり、サルタンの使用の適応症は、レニン-アンジオテンシン系に影響を与える別のグループの薬剤であるACE阻害薬の使用と実質的に同じです。 ほとんどの場合、ARBは、ACE阻害薬で副作用(乾いた咳)が発生した状況に処方されます。 古いACE阻害薬は、血圧を下げるのにほぼ同じ効果があり、コストが低く、糖尿病患者の治療においてサルタンよりも一定の利点があることに留意する必要があります。
サルタンの服用は通常、ほとんどの患者に十分に許容されます。
直接レニン阻害剤(アリスキレン)
アリスキレンは、まだ普及していない新世代の高血圧治療薬です。 このクラスの唯一の薬は、2007年に臨床使用が承認されたアリスキレンです。

アリスキレンはレニンに結合し、アンギオテンシノーゲンとの相互作用を抑制し、それによってアンギオテンシン1とアンギオテンシン2の形成を防ぎます。
アリスキレンは動脈性高血圧症の治療にのみ使用されており、この病気であっても、治療の第一線として使用することはお勧めできません。
講義2動脈性高血圧治療の臨床薬理学講義2動脈性高血圧治療の臨床薬理学
動脈性高血圧症は、血圧の長期にわたる持続的な上昇を特徴とする病的状態です。 患者の約90%で血圧が持続的に上昇する理由は不明なままです。 この場合、彼らは本態性高血圧症または高血圧症について話します。 2003年に、欧州動脈性高血圧学会(EOSH)および欧州心臓病学会(EOC)の専門家が、これまで根本的な変化を遂げていない成人(18歳以上)の血圧レベルの分類を提案しました(表2.1)。
表2.1。血圧レベルの決定と分類(推奨事項EOAG-EOC 2003および2007、高血圧の予防、診断、および治療に関する国内ガイドライン、第2版、2004年)
血圧の分類から、高血圧と正常血圧を分離する個別の「閾値」血圧は存在せず、治療の適応と計画された血圧低下の程度は、心血管疾患と合併症の総リスクによって決定されます。特定の患者。 したがって、高血圧患者の薬物療法の決定は、血圧レベルだけでなく、特定された危険因子、病的状態、または付随する疾患も考慮して行う必要があります(表2.2)。
2.1。 動脈性高血圧症の患者の予測に影響を与える主な要因(推奨事項EOAG-EOK、2007年)
私。危険因子
収縮期血圧(BP)および拡張期血圧(BP)のレベルI-III度。
脈拍血圧(高齢者)。
年齢:男性> 55; 65歳以上の女性。
喫煙。
脂質異常症:
総コレステロール> 5.0ミリモル/ L、または
LDLコレステロール> 3.0ミリモル/ L、または
HDLコレステロール:男性の場合<1,0 ммоль/л; у женщин <1,2 ммоль/л, или
トリグリセリド> 1.7ミリモル/ L。
空腹時血漿グルコース-5.6-6.9ミリモル/リットル。
腹部肥満:男性の胴囲> 102 cm; 88cmを超える女性の場合。
心血管疾患の初期症状の家族歴(55歳未満の男性、65歳未満の女性における脳卒中または心臓発作)。
II。無症候性臓器損傷
左室肥大の兆候。
ECG(Sokolov-Lyon基準> 38 mm; Cornell基準> 2440 mm-ms)または心エコー検査(男性のLMMI> 125 g / m2;女性のLMMI> 110 g / m2)*
頸動脈の0.9mmを超える中内層の肥厚またはアテローム性動脈硬化症のプラーク。
足首上腕血圧指数<0,9.
血漿クレアチニンの軽度の増加:
男性-115-133μmol/ l;
*-同心左心室肥大の最大のリスク(拡張期の半径に対する左心室壁の厚さの比率が> 0.42の場合);
女性-107-124μmol/ L。
糸球体濾過率の低下(<60 мл/мин на 1,73 м 2)** или клиренса креатинина (<60 мл/мин).***
微量アルブミン尿(24時間あたり30-300mg)または「アルブミン/クレアチニン」の比率:男性では> 22mg / g; 女性の場合> 31 mg / gクレアチニン。
III。糖尿病
反復測定で空腹時血漿グルコース≥7.0ミリモル/ L。
運動後の血漿グルコース> 11ミリモル/ L。
IV。心臓血管系または腎臓の病気
脳血管疾患:虚血性脳卒中、出血性脳卒中、一過性脳虚血発作。
心臓病:心筋梗塞、狭心症、冠状動脈血行再建術、心不全。
腎疾患:糖尿病性腎症、腎不全(男性の血漿クレアチニン>133μmol/ L;女性の血漿クレアチニン>124μmol/ L)。
末梢動脈疾患。
重度の網膜症:出血または滲出液、視神経の乳頭の腫れ。
予後に対するいくつかの危険因子と病的状態の累積的影響は、リスクを4つのカテゴリー(低追加リスク、中程度の追加リスク、高および非常に高い追加リスク)に階層化することによって半定量的に評価できますが、「追加」という用語は平均を超えるリスク(表2.2を参照)。
心血管疾患と合併症のリスクの程度は、の性質と緊急性を決定します 治療法、その中で薬物療法が中心的な位置を占めています(表2.3)。 したがって、高血圧の定義は、全体的な心血管リスクの重症度に応じて異なる場合があります。
高血圧治療の重要な仮定:に限定されない 薬物セラピー..。 重篤な状態の多くの患者のために 効果的な治療ダイエット(食卓塩、アルコール、飽和脂肪、コレステロールの消費を制限し、果物や野菜の消費を増やす)、回避する
**-Cockroft-Gaultの公式によると; ***-MDRDの式による。
表2.2。心血管疾患と合併症のリスクの層別化(EOAG-EOKの推奨事項、2007年)

ノート:FR-危険因子; STR-無症候性臓器損傷; MS-メタボリックシンドローム(5つの可能なRFのうち少なくとも3つの存在:腹部肥満、空腹時血糖値の上昇、血圧≥130/ 85 mm Hg; 低レベル HDLコレステロール、トリグリセリドレベルの上昇); DM-糖尿病; CCC-心血管系; BP-収縮期血圧; BPd-拡張期血圧。
表2.3。リスク層別化に応じた降圧治療の開始と性質(EOAG-EOK勧告、2007年)

ノート:FR-危険因子; STR-無症候性臓器損傷; MS-メタボリックシンドローム(考えられるRFの5つのうち少なくとも3つが存在する:腹部肥満、空腹時血糖値の上昇、血圧が130/85 mm Hg以上、HDLコレステロールの低下、トリグリセリドの上昇); DM-糖尿病; CCC-心血管系; BP-収縮期血圧; BPd-拡張期血圧; MOZH-ライフスタイルの変更。
喫煙、減量、定期的 体操..。 非薬理学的介入は、高血圧患者が利用できる必要があり、定期的な観察と医師からのあらゆる励ましを受けて、継続的に実施する必要があります。
2.2。 動脈性高血圧治療の一般原則。
治療の目標は、心血管疾患と合併症のリスクを軽減することです。したがって、高血圧治療の積極性と目標血圧レベルは、関連する危険因子の重症度、無症候性臓器損傷の重症度、および心血管系の明らかな疾患によって決定されます。 。
高血圧症患者の薬物療法の対象は、血圧だけでなく、他の可逆的な危険因子、および心血管連続体内の患者の予後を決定する状態です。
降圧薬と並んで、高血圧患者の治療において最も重要な場所は、低リスクグループに属する患者の治療を開始するために使用されるライフスタイルの変化によって占められています。
降圧療法の課題は、血圧を一定のレベルまで着実に低下させることです。<140/90 мм рт. ст. и максимально близкого к оптимальному АД (см. классификацию АД) в зависимости от переноси- мости лечения.
血圧の低下は徐々に起こるはずです。 低血圧および局所血液循環の悪化に関連する望ましくない副反応を回避するために、必要最小限の手段で目標血圧レベルを達成および維持するよう努めるべきであり、これは以下を意味する。 b)降圧薬の適切な組み合わせ; c)薬物の合理的な投与量。
単回投与で24時間効果のある長時間作用型または長時間作用型降圧薬の使用をお勧めします。 これにより、安定した降圧効果、24時間体制の標的臓器の保護、および処方された治療への患者のアドヒアランスの向上を実現することができます。
急性の状況(脳血管事故、急性左心室不全、動脈塞栓症、急性の痛み、高カテコラミン血症、さまざまな)で高血圧を治療するための最良の方法
起源)-病的状態の根底にある原因への影響。
高血圧の治療に使用される医薬品は、高血圧の病因における1つまたは複数の関連に影響を与えるはずです。
1)総末梢血管抵抗(OPSS)を減らします。
2)分時換気量(MVV)を減らします。
3)循環血液(BCC)の量を減らします。
4)血管壁のリモデリングと左心室心筋肥大の発症を防ぎます。
さらに、それらは「理想的な」降圧薬に対して以下の特性を持たなければなりません(Mustone A. L.、2006、修正済み)。
単剤療法として使用する場合は非常に効果的です。
他の薬と組み合わせるのは良いことです。
目標血圧値をすばやく達成します。
患者の治療への高い順守を維持するために1回(1日)処方されます。
24時間以上の効果的な行動期間があります。
直接的な用量依存的効果を与える;
最適な許容プロファイルを持っています。
現在、使用されている薬剤のいずれもこれらすべての特性を完全に備えているわけではありませんが、薬理学の急速な進歩により、そのような薬剤が近い将来に発見されるという希望が生まれています。
降圧薬の有効性を比較評価するために、いわゆるT / P比(タフ/ピーク比)を使用することをお勧めします。これは、投与間隔の終了時(次の薬物摂取量)血圧低下へ。最大作用の期間中。 T / P比を使用すると、降圧薬の作用の持続時間と均一性を知ることができます。 1日1回処方される降圧薬は、T / Pが少なくとも50%で、顕著な降圧効果があり、少なくとも67%で、わずかなピーク効果があるはずです。 100%に近いT / P値は、日中の血圧の均一な低下と、変動に対する薬剤の悪影響がないことを示しています。
血圧の能力、薬の投与量と単回投与の有効性を確認します。 T / Pが高い薬も後遺症が最大になるため、服用をスキップしたときに血圧をコントロールできます。 50%未満のT / P値は、投与間隔の終了時の不十分な降圧効果、または薬物作用のピーク時の過剰な低血圧を示し、投与の頻度および/または薬物の用量の修正が必要です。 さらに、低いT / Pは、血圧の変動が大きいことを示している可能性があります。
2.3。 降圧薬
さまざまなリンクで交感神経支配のトーンを減らす手段
1.アドレノブロッカー。
1.1。 β遮断薬。
1.2。 α遮断薬。
1.3。 混合アドレナリン遮断薬。
2.血管運動中枢に影響を与える手段。
2.1。 Α2-アドレナリン受容体アゴニスト。
2.2。 イミダゾリン受容体アゴニスト。
Ca2 +チャネル遮断薬。
レニン-アンギオテンシンおよびエンドセリン系に影響を与える薬。
1.アンジオテンシン変換酵素阻害剤。
2.アンジオテンシンII受容体遮断薬。
3.レニン合成の阻害剤。
4.エンドセリン受容体の遮断薬。
利尿薬
1.チアジドおよびチアジド様利尿薬。
2.ループ利尿薬。
3.カリウム保持性利尿薬。
現在、降圧薬には5つの主要なグループがあります-いわゆる第一段階の薬です。 これらには以下が含まれます:
1)チアジド系利尿薬(TD);
2)カルシウムチャネル遮断薬(CCB);
3)アンジオテンシン変換酵素の阻害剤(ACE阻害剤);
4)アンジオテンシンII受容体遮断薬(BAR);
5)β遮断薬。
降圧効果の重症度から進んだ場合、第一段階の薬剤による単剤療法はほぼ同じ効果をもたらします。 それらは軽度から中等度の動脈性高血圧症の症例の55-45%で効果的です。
アンジオテンシン変換酵素阻害剤
ACE阻害薬は3つのクラスに分類されます(表2.4)。 クラスIには、カプトプリルなどの親油性ACE阻害薬が含まれます。 クラスIIACE阻害剤は、肝臓での生体内変化後に活性化するプロドラッグです。 これらの薬の原型はエナラプリルです。 クラスIIの薬は3つのサブクラスに分けられます。 サブクラスIIaには薬物が含まれ、その活性代謝物は主に(60%以上)腎臓から排泄されます。 サブクラスIIbの薬物の活性代謝物には、2つの主要な排泄経路(肝臓と腎臓)があり、サブクラスIIcの代謝物は、主に肝臓(60%以上)の排泄を特徴としています。 クラスIIIACE阻害薬は、リシノプリルなどの親水性薬物であり、体内で代謝されず、タンパク質に結合せず、腎臓から排泄されます。
表2.4。アンジオテンシン変換酵素阻害剤の分類

アンギオテンシン変換酵素は、アンギオテンシンIからアンギオテンシンII(AT-II)への変換に関与し、追加のキニナーゼ活性により、ブラジキニンを不活性化します。 AT-IIの生理学的効果は、主に2種類のアンジオテンシン受容体(AT1とAT2)によって実現されます。 AT 1受容体の活性化の結果として、血管収縮が起こり、OPSSと血圧の上昇につながり、それぞれアルドステロンの合成と分泌を刺激し、Na +と水の再吸収を増加させ、BCCと血液を増加させます圧力は、血管壁の心筋細胞と平滑筋細胞の肥大と増殖を増加させます。 AT 2受容体の活性化を通じて、血管拡張、一酸化窒素(内皮弛緩因子)の放出、および血管拡張プロスタグランジン(PG)、特にPGI2が媒介されます。
ACE阻害剤は、ACE活性を抑制し、レニン-アンギオテンシン-アルドステロン(RAAS)とカリクレイン-キニン系に同時に影響を及ぼします(スキーム2.1)。 同時に、AT-IIの形成が減少することにより、RAAS活性化の心血管および腎臓への影響が弱まり、ブラジキニンの蓄積により、ACE阻害剤の血管拡張作用が増強されます。 さらに、キナプリルは、血管内皮に位置し、血管拡張に関与するシナプス外M1-コリン作動性受容体の機能の回復を特徴としています。
したがって、ACE阻害薬は以下の血行力学的効果をもたらします。
動脈の拡張、全身の血管抵抗の減少、血圧の低下、後負荷の減少;
静脈の拡張、前負荷の減少;
前負荷と後負荷を減らすことによる心拍出量の二次的減少;
ナトリウム利尿の増加、利尿、BCCの減少;
左心室肥大の逆発症;
血管拡張に寄与する、動脈壁における平滑筋肥大および線維性変化の発生の抑制。
ACE阻害薬は、薬物の有効性とその作用の持続時間が用量の増加とともに急激に増加する可能性がある非線形の薬物動態によって特徴付けられます。 ACE阻害薬の投与量は、血圧の制御下で、推奨される最低用量から始めて、経験的に選択されます。 地獄が必要です

スキーム2.1。細胞および全身レベルでのACE阻害剤の作用機序
薬の最大効果と投与間隔の終わりに測定します(通常、長時間作用型ACE阻害薬を服用してから24時間後)。 ACE阻害薬の作用のピーク時の血圧低下の程度は、投与間隔の終了時の血圧低下の程度を1.5〜2倍以上超えてはなりません。
高血圧症におけるACE阻害薬の使用の主な適応症
心不全。
左心室機能障害。
MIを転送しました。
糖尿病性腎症。
腎症。
左心室肥大。
心房細動。
メタボリック・シンドローム。
高血圧症におけるACE阻害薬の使用に対する絶対禁忌
妊娠。
血管浮腫。
高カリウム血症。
ACE阻害薬に対する耐性は3〜5日目に評価でき、臨床効果は10〜14日以内に評価できます。 推奨用量の薬剤を表に示します。 2.5。
ACE阻害薬の副作用
1.動脈性低血圧。これは、重度の左心室機能障害または腎動脈狭窄のある患者に初回投与後に最も頻繁に発症します。 さらに、血圧の低下は、高齢の患者だけでなく、硝酸塩、利尿剤、または血圧を下げる他の薬を服用している患者でも可能です。 これらのカテゴリーの患者の低血圧のリスクを減らすために、以下が推奨されます:
少量の薬で治療を開始します。
ACE阻害薬を指定する前の24〜48時間は、利尿薬をキャンセルします。
最初の服用後、患者は数時間ベッドにいる必要があります。

テーブルの終わり。 2.5

ノート:*-高齢の患者では、用量が2分の1に減らされます。
2.タンパク尿と血清クレアチニンの増加。 腎機能障害は通常、腎疾患の病歴がある患者、および片側または両側の腎動脈狭窄のある患者に発生します。 この副作用を防ぐには、次のことを行う必要があります。
低用量でACE阻害薬療法を開始します。
糸球体濾過率に応じて薬剤の投与量を修正します。
排泄の二重経路を持つ薬物を優先する(グループIIbおよびIIc)。
治療の最初の3〜5日間、その後3〜6か月に1回クレアチニンレベルを監視します。
3.高カリウム血症(> 5.5ミリモル/ L)。 糖尿病、尿路閉塞、間質性腎炎の患者にカリウム保持性利尿薬、カリウム製剤、NSAIDを同時に投与すると、発症の可能性が高まります。
4.好中球減少症。 この合併症は、免疫抑制剤、プロカインアミド(ノボカインアミド)、ピラゾロンの同時投与により、腎機能が不十分な患者によく発生します。
5.乾いた、痛みを伴う咳-上気道の組織の間質性浮腫の結果(ブラジキニンの含有量の増加による)は、気管支肺病変のある患者でのACE阻害薬の使用を制限することがよくあります。 女性、黒人、モンゴロイドの人々、喫煙者によく見られます。 咳は通常、ACE阻害薬による治療の最初の数日で発生しますが、薬の投与開始から数か月または数年後の場合もあります。 ACE阻害薬の中止後1〜2週間で消失します。
6.クインケの浮腫。 これは主に治療の最初の週に女性に発生し、薬が中止されてから数時間以内に消えます。 発生の可能性は化学構造に依存しません
ACE阻害剤。
ACE阻害薬、β遮断薬、利尿薬、非ステロイド性抗炎症薬(NSAID)を服用している患者を同時に予約することは避けてください。後者はプロスタグランジンの合成を阻害し、疾患の悪化を伴う体内の体液貯留を引き起こす可能性があるためです(スキーム2.2 )。 最も危険なのはインドメタシンとロフェコキシブで、最も安全なのはアセチルサリチル酸です。
アンジオテンシンII受容体遮断薬
ロサルタン(コザール)。
バルサルタン(ディオバン)。
オルメサルタン(オルメテック)。
イルベサルタン(4月)。
カンデサルタン(アタカンド)。
テルミサルタン(Pritor)。
エプロサルタン(テベテン)。
タソサルタン。
アンジオテンシン変換酵素は、体内でAT-IIの形成を確実にする唯一の酵素ではありません(AT-IIの20%以下を占めます)が、残りの80%は他の酵素の作用下で合成されます(キマーゼなど)。 したがって、RAASの過剰な活性を阻害するための効果的なアプローチの1つは、アンジオテンシン受容体の遮断です。 現在、アンジオテンシンIIの1型受容体を遮断するかなり大きなグループの薬があります。 それらの降圧作用のメカニズムは、AT 1受容体を介して実現されるアンジオテンシンIIの効果の弱体化に関連しています(スキーム2.1を参照)。 AT 1受容体の遮断は、末梢血管の拡張、全身の血管抵抗および血圧の低下につながります。 さらに、アルドステロンの分泌が減少し、その結果、Na +と水、BCC、および血圧の再吸収が減少します。 心筋細胞および血管平滑筋細胞に対するアンジオテンシンIIの増殖効果は弱まります。
AT 1受容体遮断薬(BAR)は、アンジオテンシノーゲンとレニンの合成と血中への放出を調節する負のフィードバックメカニズムを破壊します。 したがって、このグループの薬物を血中に長期間投与すると、アンギオテンシノーゲン、レニン、アンギオテンシンIおよびIIの含有量が増加します。 AT 1受容体薬による遮断条件下では、結果として生じるアンジオテンシンIIはそれらと相互作用できず、AT 2受容体の追加刺激を引き起こし、内皮弛緩因子(ERF)、PGI 2の合成と放出の増加、および増加をもたらします。動脈血管拡張において(スキーム2.1を参照)。

スキーム2.2。想定される緩和メカニズム 降圧薬 NSAIDの影響下(Preobrazhensky D.V. et al。、2002)
テーブルの終わり


それらの降圧作用に関して、BAPは第一段階の他の降圧薬に匹敵し、よりよく許容されます。 さらに、双極性障害(特にバルサルタン)を受けている高血圧症の患者では、心房細動の新しい症例を発症する可能性は17%低く、持続性心房細動のリスクはカルシウムチャネル遮断薬を受けている患者よりも32%低くなっています(特に、アムロジピン)。
双極性障害の最大の降圧効果は、治療の3〜4週間までに、そしていくつかの報告によれば、さらに後で発症します。 BARは、毎日(昼夜)の圧力曲線の生理学的経過を乱さないことに注意することが重要です。BARは、初回投与の低血圧または薬物の突然の中止後の血圧の急激な上昇を特徴としません。 双極性障害と同じ降圧効果と忍容性が、さまざまな年齢(65歳以上を含む)、性別、人種の患者で確立されています。
高血圧症におけるBARの使用の適応症
心不全。
糖尿病性腎症。
タンパク尿/微量アルブミン尿。
心房細動。
メタボリック・シンドローム。
ACE阻害剤に対する不耐性。
高血圧症におけるBARの使用に対する絶対禁忌
妊娠。
両側腎動脈狭窄。
高カリウム血症。
BARを使用すると発生する可能性のある副作用の数は少なく、頭痛、めまい、全身の脱力感、吐き気が生じることがあります。 それらの器官保護特性に関して、BARはおそらくACE阻害剤に劣らず、今日、それらは動脈性高血圧の治療における第一線の薬剤であるが、高血圧の治療におけるこれらの薬剤の最終的な位置はまだ明らかにされているかもしれない。
エンドセリン受容体遮断薬
ダルセンタン。
最も強力な血管作用物質の1つは、エンドセリン(ET)の内皮ペプチドです。 これの3つの代表
Meistas(ET-1、ET-2、ET-3)は、血管緊張、細胞増殖、ホルモン合成のモジュレーターとして存在するさまざまな組織によって産生されます。 エンドセリンの心臓血管作用は、A型(血管収縮)およびB型(血管拡張)の特定の受容体を介して媒介され、前者の作用が優勢です。 血管収縮作用の強さにより、ETはAT-IIを30倍上回っています。
動脈性高血圧症(主に耐性)の治療のためのエンドセリン受容体(ボセンタン、シタキセンタン、テゾセンタン、アンブリセンタン、ダルセンタン)の遮断薬の中で、これまでダルセンタンのみが提案されてきましたが、その有効性と安全性に関する最終判断はその後にのみ行うことができます広範な臨床試験。 このグループの他の薬は、心不全と肺高血圧症の治療に使用されています。
レニン合成ブロッカー
アリスキレン(ラシレス)。
RAAS遮断へのアプローチの1つは、レニン合成の特定の阻害剤の助けを借りて、活性化(レニン形成)の初期段階での阻害です。 このグループの薬剤は、アンジオテンシノーゲンのAG-Iへの変換を選択的にブロックする能力を持っており、これがそれらの特異性を決定します。 このため、血中のアンギオテンシンIとアンギオテンシンIIのレベルが低下し、同時に血圧が低下します。 血漿レニン活性の最大の低下は、薬剤(300 mg)を服用してから1時間以内に観察され、24時間継続します。投与の過程で、この影響の重症度は低下しません。
単剤療法におけるアリスキレンの有効性(予備データによる)は、2つの伝統的に処方された降圧薬の組み合わせの有効性に匹敵します。 さらに、利尿薬、カルシウムチャネル遮断薬、ACE阻害薬と組み合わせることができます。
有害事象(下痢、頭痛、鼻炎)の発生率に関して、アリスキレンはロサルタンに匹敵します。 薬の有効性と安全性に関する最終的な判断は、大規模な臨床試験の最後に行うことができます。
β -アドレナリン遮断薬および混合アドレナリン遮断薬
顕著な降圧効果を持つ別のグループの薬はβ遮断薬です。 β遮断薬の分類は、講義「 臨床薬理学救済策 虚血性疾患ハーツ」。
β遮断薬の降圧作用のメカニズムは、主に心臓のβ1アドレナリン受容体の遮断に関連しており、心臓収縮の強度と頻度、したがって心拍出量の低下につながります。 腎臓の傍糸球体装置のβ1-アドレナリン受容体を遮断することにより、薬剤はレニンの放出を減らし、その結果、アンジオテンシンIIとアルドステロンの形成を減らします。 さらに、シナプス前β2アドレナリン受容体を遮断する非選択的BABは、シナプス間隙へのカテコールアミンの放出を減少させます。 SASの活性を低下させることにより、β遮断薬は心筋肥大の退行を引き起こします。 追加の血管拡張特性を備えたβ1-アドレナリン遮断薬は、末梢血管を拡張することによって全身の血管抵抗を減少させることができます(講義「冠状動脈性心臓病の治療のための薬物の臨床薬理学」を参照)。 高血圧症におけるβ遮断薬の使用に関する基本的な情報を表に示します。 2.7。
β遮断薬の副作用については、「虚血性心疾患の治療の臨床薬理学」の講義で詳しく説明されています。
このグループの薬は選択の手段です:
SASおよびRAASの顕著な活性化を伴う高血圧症の治療用。
高血圧と虚血性心疾患、頻脈性不整脈、心不全の組み合わせ;
妊娠中の女性(選択的BAB);
不寛容の場合、またはACE阻害薬とBARの任命に対する禁忌がある場合。
使用の適応症 β -高血圧のアドレナリン遮断薬
狭心症。
心筋梗塞の延期。
心不全(ビソプロロール、コハク酸メトプロロール、カルベジロール、ネビボロール-70歳以上の患者向け)。
頻脈性不整脈。
妊娠(妊娠中期には、アテノロール、プロプラノロール、酒石酸メトプロロール、ラベタロールの使用が許可されます)。
緑内障。

表2.7の終わり

使用のための絶対禁忌 β -高血圧のアドレナリン遮断薬
気管支ぜんそく。
AVブロックII-III度(恒久的なペースメーカーがない場合)。
β -高血圧のアドレナリン遮断薬
末梢血管疾患、レイノー症候群。
メタボリック・シンドローム。
耐糖能異常。
運動選手および身体的に活動的な患者。
慢性閉塞性肺疾患。
β遮断薬(主にアテノロール)は、他のクラスの降圧薬(ACE阻害薬、BAR、利尿薬、カルシウムチャネル遮断薬)と比較して、脳卒中の発症を予防する効果が最も低いことに注意してください。 さらに、β遮断薬は、特にチアジド系利尿薬と組み合わせて、メタボリックシンドロームの患者や糖尿病を発症するリスクが高い患者には使用すべきではないという証拠があります。 一方、真性糖尿病の患者では、β遮断薬は真性糖尿病のない患者と同様に心血管合併症のリスクを減らすのに効果的です。
高血圧の治療のための混合アドレナリン遮断薬のグループの中で、カルベジロールが最も一般的に使用されています。 この薬はβ1-およびα1-アドレナリン受容体を遮断し、さらに抗酸化作用と抗増殖作用を持っています(平滑筋細胞に関連して)。 治療は12.5mgの用量で開始され、平均治療用量は1日1回25-50mgです。 別の混合アドレナリン遮断薬であるラベタロールは、妊婦の高血圧に使用できます。
カルシウムチャネル遮断薬。
カルシウムチャネル遮断薬の分類は、「冠状動脈性心臓病の治療のための薬剤の臨床薬理学」の講義で提示されます。
化学クラスに応じて、カルシウムチャネル遮断薬は主要な病態生理学に影響を与える可能性があります
高血圧の論理的メカニズム-OPSS(例えば、ジヒドロピリジン)の増加またはIOC(主にフェニルアルキルアミン)の増加。 さらに、これらの薬は腎血管を拡張し、腎血流を改善し、抗血小板効果があります。 CCBは、炭水化物と脂質の代謝に悪影響を与えず、気管支痙攣や起立性低血圧を引き起こしません。
CCBは、発作性頻脈(フェニルアルキルアミン誘導体)、気管支喘息と組み合わせた高血圧の治療に最適な薬剤の1つです。
カルシウムチャネル遮断薬の降圧作用のメカニズム
心筋と伝導系の遅いカルシウムチャネルの遮断は、心拍出量の減少(一回拍出量とIOCの減少)を伴う強度と心拍数の減少につながります。 この作用機序は、フェニルアルキルアミン誘導体でより一般的です。
血管平滑筋細胞のカルシウムチャネルの遮断は、細動脈の拡張、全身の血管抵抗および血圧の低下を引き起こします。 この作用機序は、ジヒドロピリジン誘導体の降圧効果の根底にあります。
適切な降圧効果に加えて、CCBは左心室肥大の発症を遅らせ、これは非常に重要なことですが、頸動脈と冠状動脈のアテローム性動脈硬化症の進行を遅らせます。
高血圧症におけるCCBの使用の適応症
ジヒドロピリジンCCB(長時間作用型および長時間作用型ジヒドロピリジン:ニフェジピン、アムロジピン、ラシジピンなど)
狭心症。
左心室肥大。
頸動脈、冠状動脈のアテローム性動脈硬化症。
妊娠。
ネグロイド種族の人のAH。
非ジヒドロピリジンCCB(ベラパミル、ジルチアゼム)
狭心症。
頸動脈のアテローム性動脈硬化症。
上室性頻脈性不整脈。
高血圧症におけるCCBの使用に対する絶対禁忌
AVブロックII-III度(非ジヒドロピリジンカルシウムチャネル遮断薬)。
心不全(非ジヒドロピリジンカルシウムチャネル遮断薬)。
高血圧症におけるCCBの使用に対する相対的な禁忌
頻脈性不整脈(長時間作用型および長時間作用型ジヒドロピリジン)。
心不全(長時間作用型および長時間作用型ジヒドロピリジン)。
CCBには、さまざまな「エンドポイント」に影響を与えるいくつかの特性があります。 したがって、このグループの薬剤による治療の背景に対して、心不全および心筋梗塞を発症するリスクは、他の降圧薬による治療の背景に対してわずかに高くなります。 同時に、CCBは、他の降圧薬よりも脳卒中のリスクをわずかに大幅に低減します。
ジヒドロピリジンCCBの指定に関する追加の適応症は、高齢患者、孤立性収縮性動脈性高血圧、付随する労作性狭心症の存在、末梢動脈疾患、頸動脈のアテローム性動脈硬化症の兆候、妊娠です。 非ジヒドロピリジンカルシウムチャネル遮断薬の場合、予約の追加の適応症は、付随する労作性狭心症、頸動脈のアテローム性動脈硬化症の兆候、上室性リズム障害です。
高血圧症におけるカルシウムチャネル遮断薬の使用に関するいくつかの情報を表に示します。 2.8。
長時間使用すると短時間作用型のニフェジピン(長時間作用型とは対照的)は高血圧、冠状動脈性心臓病の患者の予後を悪化させるため、高血圧の体系的な治療には使用されません。
CCBの副作用
心臓のカルシウムチャネルの遮断は、徐脈、房室ブロック、心臓うつ病につながる可能性があります。 これらの副作用はフェニルアルキルアミンに共通しています。
末梢血管のカルシウムチャネルの遮断の結果は、起立性低血圧、反射性頻脈です。 さらに、患者は、顔の赤み、血管拡張、歯肉炎、および便秘によって引き起こされる非心臓起源の足首の腫れを経験する可能性があります。
利尿薬
降圧療法のための利尿薬の普及は、それらの治療が経済的に有益であり、血圧の過度の低下を引き起こさないという事実によるものであり、したがって、頻繁な医学的監督の必要はありません。 さらに、薬はリバウンド現象を誘発しません。 利尿薬は、心不全の人を含む高齢者の高血圧の治療に最適な薬です。
利尿薬の分類
1.ヘンレループの厚い上昇部分に作用する(ループ利尿薬):
フロセミド(Lasix)。
ブメタニド(ブフェノックス)。
ピレタニド(アレリックス)。
エタクリン酸(Uregit)。
トラセミド(Diuver)。
2.遠位尿細管の最初の部分に作用する:
2.1。 チアジド系利尿薬(ベンゾチアジアジン誘導体):
ジクロチアジド(ヒポチアジド)。
メトラゾン(ザロキソリン)。
シクロメチアジド(シクロペンチアジド)。
ポリチアジド(ルネーゼ)。
2.2。 非チアジド(チアジド様)利尿薬:
クロパミド(Brinaldix)。
クロルタリドン(オキソドリン)。
インダパミド(アリフォン)。
Xypamide(Aquaphor)。
3.行動する エンドパート遠位尿細管および集合管(カリウム保持性利尿薬):
3.1。 競争力のあるアルドステロン拮抗薬:
スピロノラクトン(Veroshpiron)。
エプレレノン(Inspra)。

表2.8の終わり

ノート:*-長時間の行動の形態のため。
3.2。 ブロッカー ナトリウムチャネル:
トリアムテレン(ダイテック)。
アミロライド(モダミド)。
4.近位尿細管に作用する(炭酸脱水酵素阻害剤):
アセタゾラミド(Diacarb)。
5.併用薬:
トリアムテレン(トリアムテレン+ジクロチアジド)。
モジュレティック(アミロライド+ジクロチアジド)。
フレシス(フロセミド+トリアムテレン)。
スピロ-D(フロセミド+スピロノラクトン)。
チアジドおよびチアジド様利尿薬は、高血圧の治療に最も一般的に使用されています。 それらの降圧作用のメカニズムでは、2つの要素を従来通り区別することができます。 1つ目は利尿作用自体に関連しており、遠位尿細管の管腔膜を介したNa +およびCl-の電気的に中性の輸送が抑制され、ナトリウムの排泄が増加するため、細胞レベルで実現されます。その結果、水。 これは、BCCの減少を伴い、したがって、心臓への血液の戻りと心拍出量の減少を伴います。 このメカニズムは、高血圧治療の最初の数週間におけるチアジド系利尿薬のプラスの効果の根底にあり、用量依存的です(利尿薬の用量で現れます)。
2番目の成分は、非利尿薬で投与された場合でも現れ、次の理由によるOPSSの減少によるものです。
血管壁からのNa +と水の排泄を強化し、その厚さの減少と昇圧の影響への応答をもたらします。
カテコールアミンに対するアドレナリン受容体の感受性の低下;
血管拡張性プロスタグランジンの合成の刺激;
血管平滑筋細胞におけるCa2 +およびNa +代謝の障害。
比較研究では、低用量(1日あたり25 mg未満のヒドロクロロチアジドまたは同等の用量の他の薬剤)と高用量(25 mgを超える)のチアジド利尿薬の降圧活性に有意差がないことが示されています。 同時に、低用量の利尿薬は患者の忍容性がはるかに高く、電解質や代謝障害を伴うことはありません。
β遮断薬とは異なり、利尿薬は中高年および老人性高血圧症の患者の心血管合併症を予防するのに等しく効果的であり、これらの動脈性高血圧症の患者の長期予後を改善することができます。 利尿薬は、冠状動脈疾患の発症を予防するのにβ遮断薬よりも効果的です。 死亡者(数、それはそれらを高血圧の初期治療における第一選択薬の1つにします。
高血圧症に対する利尿薬の使用の適応症
チアジドおよびチアジド様利尿薬(低用量):
高齢者における孤立性収縮期高血圧。
心不全。
ネグロイド種族の人のAH。 アルドステロン拮抗薬:
心不全。
心筋梗塞の延期。 ループ利尿薬:
心不全。
腎臓病の末期。
高血圧症における利尿薬の使用に対する絶対禁忌
痛風(チアジド系利尿薬)。
腎不全(アルドステロン拮抗薬)。
高カリウム血症(アルドステロン拮抗薬)。
高血圧症における利尿薬の使用に対する相対的な禁忌
妊娠。
メタボリックシンドローム(高用量およびβ遮断薬との併用)。
チアジド系利尿薬の副作用
1.腎臓(低カリウム血症、低ナトリウム血症、低マグネシウム血症、高カルシウム血症、代謝性アルカローシス)。
2.腎外(ランゲルハンス島のβ細胞によるインスリン分泌の阻害に関連する高血糖症;グーティ症候群の発症を伴う高尿酸血症;血中コレステロールおよびトリグリセリドレベルの上昇;長期使用による続発性高アルドステロン症)。
チアジド系利尿薬とは異なり、ループ利尿薬のナトリウム利尿作用はより顕著ですが、降圧作用はそれほど顕著ではありません。

ノート:*-併用降圧療法の一部としての非利尿用量のチアジドによる長期治療の可能性。
ループ利尿薬の作用機序は、Na +、K +および2つのC1-イオンの共輸送のネフロンのループ(ヘンレループ)の上行膝の厚い部分の遮断に関連しています。 その結果、尿量が増加し、BCCが減少し、血液が心臓に戻り、心拍出量が減少します。 さらに、血管拡張性プロスタグランジンの合成を増加させることにより 血管壁細動脈と静脈が拡張し、全身レベルでOPSSの減少、負荷後および前負荷、心拍出量の減少、腎臓の減少、腎血流量の増加、その結果としての濾過とナトリウム利尿につながります。
ループ利尿薬の副作用は、チアジド系利尿薬の副作用と同様です(カルシウムレベルへの影響(低カルシウム血症)を除く)。さらに、吐き気、食欲減退、腹痛、消化不良症状などの胃腸機能障害が発生する場合があります。
さらに、利尿薬による長期治療では、二次性高アルドステロン症の発症により、利尿作用が低下する可能性があります。
アルドステロン拮抗薬の作用機序は、アルドステロン受容体の遮断とそれに続く鉱質コルチコイドの主な効果の実施の違反に基づいています。 腎上皮の細胞の核装置では、これは特定の遺伝子の発現の違反につながり、その結果、パーミアーゼの合成が減少し、その結果、ナトリウム利尿と利尿が増加します。尿中のカリウム分泌の減少。 全身レベルでは、これはRAASの活動の低下、尿量のわずかな増加(最大200ml /日)およびBCCの低下によって明らかになります。 スピロノラクトンの降圧効果は、原発性および続発性高アルドステロン症の状態で特に顕著です。
ほとんどの場合、アルドステロン拮抗薬は、二次性高アルドステロン症および低カリウム血症を予防するために、チアジドまたはループ利尿薬(長期使用が必要な場合)と組み合わせて使用されます。 薬の使用による効果は約3日で現れ、詳細な臨床効果が得られるまでに最大3〜4週間かかる場合があります。 副作用には、高カリウム血症、ホルモン障害(女性化乳房、性欲減退、男性のインポテンス、 月経周期、女性の声の粗大化)。
スピロノラクトンと比較して、アルドステロン受容体のより選択的な遮断薬は、新薬エプレレノン(Inspra)です。 その高い選択性は、からのほとんどの副作用を回避します 内分泌系..。 薬の実際の利尿作用は重要ではありません。
別のカリウム保持性利尿薬であるトリアムテレンの作用機序は、集合管上皮の管腔膜におけるナトリウムチャネルの遮断に関連しています。 その結果、尿細管の内腔から細胞へのNa +の放出が減少します。 これにより、基底膜を介したK +の供給が減少し、尿への分泌が減少します。 トリアムテレンの降圧効果は、循環血液量と心拍出量の減少に関連しています。 副作用:結晶尿、円柱尿、尿路結石。
アゴニストα 2-アドレナリン受容体
クロニジン(クロニジン)。
Guanfatsin(Estulik)。
メチルドパ(ドペギット)。
近年、高血圧の治療のためのα2-アドレナリン受容体アゴニストであるクロニジンおよびグアンファシンの使用頻度は大幅に減少しており、その降圧作用のメカニズムは抑制性α2-アドレナリンおよびイミダゾリンIの活性化に関連しています。 1-中枢神経系の受容体。 クロニジンは現在、高血圧の体系的な治療には推奨されておらず、主に高血圧クリーゼの緩和に使用されています。 薬の副作用は、α2-アドレナリン受容体の活性化の結果であり、口渇、嗜眠、うつ病、徐脈、反動症候群、および耐性の発達が含まれます。
メチルドパ(ドペギット)はメチルノレピネフリンに代謝され、血管運動中枢の抑制性α2アドレナリン受容体を活性化し、交感神経インパルスと血圧の低下をもたらします。 さらに、それはシナプス間隙でノルエピネフリンと競合することによってシナプス伝達を妨害する「偽の」メディエーターです。 治療は250mgを1日2〜3回開始し、その後 1日量 2〜3回の投与で1gに増やすことができます。 メチルドパは、妊婦の高血圧治療のための伝統的な薬です。
副作用には、無気力、眠気、夜驚症、うつ病、およびパーキンソニズムの発症が含まれます。 長期間使用すると、自己免疫性心筋炎、溶血性貧血、肝炎が発生する可能性があります。
イミダゾリン受容体アゴニスト
モクソニジン(フィジオテンス)。
リルメニジン(アルバレル)。
イミダゾリン受容体作動薬は新しいクラスの降圧薬であり、高血圧の治療におけるその場所が現在特定されています。 薬の作用機序は、主に中枢イミダゾリンI 1受容体の活性化に関連しており、交感神経系の活動の抑制と血圧の低下につながります。 さらに、それらは尿細管の上皮のイミダゾリン受容体と相互作用し、ナトリウム利尿を増強します。 それらは抑制性の2-アドレナリン受容体を活性化することもできますが、それらに対する薬物の親和性はイミダゾリン受容体よりもはるかに低いです。 クロニジンと比較して、薬は副作用が少なく、耐性がいくらか発生する頻度が低く、実際には反動症候群を引き起こしません。
高血圧症におけるイミダゾリン受容体アゴニストの使用の適応症
メタボリック・シンドローム
高血圧症におけるイミダゾリン受容体アゴニストの使用に対する絶対禁忌
房室ブロック。
重度の心不全。
憂鬱症。
モクソニジンは0.1mgを1日1回経口投与されます。 5〜7日後、用量を0.2mg /日1回(血圧の制御下)に増やすことができ、2〜3週間後、用量を0.4mg /日1回(または0.2mgを1日2回)に増やすことができます。 ..。。 最大1日量は0.6-0.8mgです。
リルメニジンは1日1回1mgを処方されています。 1ヶ月の治療で効果が不十分な場合は、2回に分けて2mg /日まで増量することができます。
交感神経遮断薬
中枢交感神経遮断薬(ラウウルフィアアルカロイド)は、その有効性が低く、副作用が多いため、現在、高血圧の体系的な治療には推奨されていません。 シナプス終末のレセルピンは、細胞質ゾルから顆粒へのカテコールアミンの能動輸送を選択的かつ持続的に妨害し、その結果、神経伝達物質はモノアミンオキシダーゼによって破壊されます。 これは、カテコールアミン貯蔵の枯渇、シナプス伝達の障害、および血圧の低下につながります。 レセルピンは、ゆっくりと発達する中等度の降圧効果と顕著な精神鎮静効果を特徴としています。
副作用:うつ病、自殺行動の増加、恐怖、眠気、悪夢。 さらに、自律神経系の副交感神経分裂の活性化により、徐脈、房室閉塞、胃の酸形成機能の増加、気管支痙攣、および鼻づまりが起こり得る。
NS -アドレナリン遮断薬
プラゾシン(Adversuten)。
テラゾシン(ハイトリン)。
ドキサゾシン(トノカルディン)。
高血圧の治療には、α1-アドレナリン遮断薬が使用されることがあります-プラゾシン、ドキサゾシン、テラゾシン。 これらの薬剤は、末梢血管のα1アドレナリン受容体を遮断し、細動脈の拡張、全身の血管抵抗および血圧の低下をもたらします。 さらに、後負荷が減少し、心拍出量が二次的に減少します。
使用の適応症 NS -高血圧のアドレナリン遮断薬
良性の前立腺肥大症。
耐糖能異常。
脂質異常症。
使用のための相対的な禁忌 α -高血圧のアドレナリン遮断薬
起立性低血圧。
心不全。
α1-アドレナリン遮断薬による治療は、患者が就寝前に服用する必要のある最小用量から始まります。
利尿薬の変更(起立性低血圧によって現れる「初回投与」の現象を回避するため)。 このグループの薬の主な利点は、代謝パラメーターに対する有益な効果です(β遮断薬や利尿薬とは対照的です)。 ただし、これは、起立性低血圧、非心臓性の浮腫、頻脈、急速に進行する耐性などの副作用によって平準化されます。 さらに、患者が比較的忍容性の高い低用量では、α1-アドレナリン遮断薬の降圧効果は通常不十分であり、高用量では、副作用の数が急激に増加します。 推奨用量の薬剤を表に示します。 2.10。
表2.10。動脈性高血圧症の治療に使用されるα1-ブロッカーの推奨用量と選択された薬物動態パラメーター

2.4。 動脈性高血圧の薬物療法
血圧目標
血圧を一定のレベルまで下げるよう努力する必要があります< 140/90 мм рт. ст. и ниже (при хорошей переносимости) у всех больных АГ. У больных сахарным диабетом и у пациентов с высоким и очень
心血管リスクが高い(心血管系と腎臓の併発疾患-脳卒中、心筋梗塞、腎機能障害、タンパク尿)、目標血圧は<130/80 мм рт. ст. К сожалению, достичь этого уровня АД непросто, даже при комбинированной антигипертензивной терапии, особенно у пожилых пациентов, у больных сахарным диабетом и в целом у пациентов с сопутствующими повреждениями сердечнососудистой системы. Таким образом, для скорейшего и простейшего достижения целевого АД следует начинать антигипертензивную терапию еще до появления значимых кардиоваскулярных повреждений.
降圧療法
以前は、高血圧の段階的治療レジメンが広く使用されていました。これには、少量または中用量の1つの降圧薬の最初の指定と、その後の用量漸増、および(または)前の治療段階で効果が不十分な他の薬剤との組み合わせが含まれます。 。 現在、初期の併用療法の必要性は、かなりの数の高血圧患者で仮定されています。
降圧薬の選択
降圧治療の主な利点は、それ自体が血圧の低下によるものです。 高血圧に関するヨーロッパのガイドライン(2007年)によると、降圧薬の5つの主要なクラス(チアジド利尿薬、カルシウムチャネル遮断薬、ACE阻害薬、アンジオテンシン受容体拮抗薬、β遮断薬)の代表は、単剤療法の初期および維持降圧治療の両方に適していますまたは互いに組み合わせて。 この場合、特にチアジド系利尿薬と組み合わせたβ遮断薬は、メタボリックシンドロームの患者や糖尿病を発症するリスクが高い患者には使用しないでください。 多くの患者が降圧薬の組み合わせを必要とするため、最初の薬の選択にあまり注意を払う必要がないことがよくあります。 それにもかかわらず、他の薬よりもいくつかの薬の優先順位が証明されている多くの病的状態があります。
付随する疾患または状態に応じて、降圧治療を処方する際に選択する薬剤(推奨EOAG-EOK、2007年)

ノート:ACE阻害剤-アンジオテンシン変換酵素阻害剤; CCB-カルシウムチャネル遮断薬; BAR-アンジオテンシンII受容体遮断薬; BAB- β -アドレナリン遮断薬; AAはアルドステロン拮抗薬です。
*-非ジヒドロピリジンCCB。
最終的に、特定の薬剤または薬剤の組み合わせの選択は、以下の要因に依存します。
特定の患者における薬物(薬物のクラス)の以前の経験;
特定の心血管リスクプロファイルに対する薬剤の主な有効性と安全性。
特定のクラスの降圧薬の使用を制限する可能性のある、付随する(心臓以外の)病状の存在と性質(表2.11)。
他の降圧薬および他の状態のために処方された薬との相互作用の可能性;
患者の年齢と人種;
血行動態の特徴;
治療費。
表2.11。付随する疾患および状態に応じた、降圧薬の指定に対する主な禁忌

ノート:PEX-埋め込まれたペースメーカー; AAB-α- アドレナリン遮断薬; BKKdgp-ジヒドロピリジンカルシウムチャネル遮断薬; CCB n / dgp-非ジヒドロピリジンカルシウムチャネル遮断薬; AIRはイミダゾリン受容体アゴニストです。
降圧薬の単剤療法または併用療法を選択するための基準
臨床経験によると、高血圧の単剤療法では、ごく一部の患者で目標血圧レベルに到達できますが、圧倒的多数の患者は2つ以上の降圧薬の組み合わせを必要とします。
高血圧の治療は、単剤療法または2つの低用量降圧薬の組み合わせで開始できます。 将来的には、必要に応じて、使用する薬の投与量や数を増やすことができます。
心血管リスクが低または中程度のグレードIの高血圧患者では、単剤療法で治療を開始することをお勧めします(スキーム2.3)。 最初は、1つの薬が低用量で処方されます。 それが十分に効果的でない場合、用量は完全に増加します。 効果がないか、忍容性が低い場合は、別のクラスの薬を低用量で処方し、次に全用量で処方します。 治療に対する「陽性反応」の基準:20mmHg以上の血圧の低下。 美術。 収縮期および10mmHg以上の場合。 美術。 拡張期血圧用。 これは、順次単剤療法と呼ばれます。 その欠点は、単剤療法の背景に対する血圧の目標値が患者の20〜30%でしか達成できないことであり、薬物と用量の頻繁な変更は治療の複雑さを増し、信頼度を低下させます医師と患者が治療を順守し、また不必要に時間を遅らせます。血圧を正常化するために必要です。 単剤療法が効果的でない場合、彼らは併用療法に切り替えます。
グレードII-IIIの高血圧症、または心血管リスクが非常に高い患者には、最初は降圧薬の組み合わせが必要です(スキーム2.3を参照)。 治療は「低用量」の組み合わせで開始できます。これにより、全用量の単剤療法よりも副作用や合併症が少なくなります。 低用量の組み合わせが部分的に有効である場合、成分の一方または両方の用量を増やすか、または低用量の第3の薬剤を処方することができる。 一部の患者は、目標血圧を達成するために3つ以上の全用量薬を必要とする場合があります。 ほとんどの場合、併用療法は、真性糖尿病、腎臓病、および心血管系の重度の併発疾患の患者に必要です。 初期(初期)併用降圧療法の戦術の不利な点を考慮する必要があります:「余分な」薬の不必要な処方のリスク、決定の難しさ

スキーム2.3。動脈性高血圧治療の戦術:単剤療法と併用療法の選択(推奨EOAG-EOK、2007年)
アレルギーまたは治療耐性の低下の原因である薬を分割します。 併用療法の利点:
効果的な単剤療法よりも早く目標血圧を達成する。
一般的に高血圧のより効果的な制御;
あまり目立たない副作用でより良い耐性;
効果的な治療法を選択するために必要な時間と試行回数を減らし、医師の信頼と患者の彼への信頼を高めるのに役立ちます。
1錠に固定された薬剤の組み合わせを処方し、治療を簡素化し、患者の治療への順守を高める可能性。
ただし、すべての降圧薬を効果的かつ安全に組み合わせることができるわけではありません。 薬物の合理的な組み合わせには、次の特性が必要です。
組み合わせを構成する薬の降圧効果の合計または増強;
組み合わせを構成する各薬剤の使用によって引き起こされる逆調節メカニズムの補償;
併用薬の相互作用による副作用はありません。
対照試験において、無症状の標的臓器損傷を効果的に予防し、心血管合併症のリスクを軽減する能力。
ほとんどのクラスの降圧薬のさまざまな組み合わせの有効性を表に示します。 2.12。
表2.12。降圧薬のさまざまな組み合わせ(Chazova I.E.、Ratova L.G.、2006年、修正済み)

2007年、ヨーロッパの専門家は、高血圧の治療のために5つの主要な降圧薬の6つの合理的な組み合わせのみを推奨しました。
1)チアジド系利尿薬+ ACE阻害薬(TD + ACE阻害薬);
2)チアジド系利尿薬+アンジオテンシンII受容体拮抗薬(TD +
バー);
3)カルシウムチャネル遮断薬+ ACE阻害薬(CCB + ACE阻害薬);
4)カルシウムチャネル遮断薬+アンジオテンシンII受容体遮断薬(CCB + BAR);
5)カルシウムチャネル遮断薬+チアジド系利尿薬(CCB + TD);
6)β遮断薬+カルシウムチャネル遮断薬(ジヒドロプ-
readin)(BAB + BKK)。
チアジド系利尿薬とカリウム保持性利尿薬(トリアムテレン、アミロライド、スピロノラクトン)の組み合わせも好都合であると認識されており、ACE阻害薬とBAR、レニン遮断薬、チアジド系利尿薬の組み合わせの合理性が研究されています。 チアジド系利尿薬とβ遮断薬の間違いなく効果的な組み合わせは、以前に推奨され、成功裏に使用されていましたが、負の代謝効果が増加しているため、現在では望ましくないと認識されています。 糖尿病やメタボリックシンドロームのリスクがある患者には使用しないでください。
最も効果的な薬物の組み合わせ
1.現在、ACE阻害薬と利尿薬の組み合わせは最も広く処方されているものの1つです。 その使用により、80%以上の患者で目標血圧レベルを達成することが可能になります。 この場合:
薬の降圧効果の増強があります。
ACE阻害薬はRAASの活性を低下させ、利尿薬の長期投与により増加します。
利尿薬は、正常および低レニン型の高血圧症の患者におけるACE阻害薬の有効性を高めます。
ACE阻害薬は利尿薬の存在下で低カリウム血症の発症を予防します。
ACE阻害薬は脂質代謝に影響を与えず、利尿薬の服用中に発生する高尿酸血症と高血糖を軽減します。
この組み合わせは、主に心不全、左心室肥大、糖尿病性腎症の患者に推奨されます。 また、重度の高血圧症の患者、単剤療法が効果のない高齢患者にも有効です。
ACE阻害剤。
2.降圧効果に関して、BARはACE阻害薬に近いため、利尿薬との組み合わせには、ACE阻害薬と利尿薬の組み合わせとほぼ同じ利点があります。
BARと利尿剤を併用すると、レニン活性が高い患者と低い患者の両方で血圧が著しく低下します。
3.ACE阻害薬+ CCB(およびBAR + CCB)の組み合わせは、高血圧の高根型と低根型の両方で効果的です。 これらの薬の使用は以下を可能にします:
降圧効果を強化するために;
ナトリウム利尿効果を強化します。
正常および低レニン型の高血圧症の患者におけるACE阻害薬の有効性を高めること。
SASのACE阻害剤活性を抑制することにより、ジヒドロピリジンCCBの効率を高める。
CCB(ジヒドロピリジンCCBで最も一般的)を服用している間、下肢浮腫の重症度を軽減します。
ACE阻害薬を服用している間、乾いた咳を減らします。
有機保護作用を達成する(ACE阻害薬の影響下での腎臓の輸入細動脈および非ジヒドロピリジンCCBの影響下での輸入細動脈および輸出細動脈の拡大による腎保護作用を含む);
脂質、炭水化物、プリン代謝への悪影響の可能性を排除します。
4.β遮断薬とCCB(ジヒドロピリジン誘導体)の組み合わせにより、次のことが可能になります。
降圧効果の相加性を達成します。
β遮断薬の助けを借りて、ジヒドロピリジンの使用の初期段階で発生するSASの活性化を減少させます
BPC;
服用中の脚の浮腫の重症度を軽減します
BKK。
この組み合わせは、虚血性心疾患を伴う高血圧症の患者、および単剤療法に抵抗性の重度の高血圧症の患者に適応されます。
5. CCBと利尿薬の組み合わせは、起立性有害反応の増加とレニン-アンジオテンシン系の活性の代償的増加を可能にするため、明らかではないようです。 同じ時に:
両方の薬の降圧効果は著しく強化されています。
高齢患者における孤立性収縮期高血圧の治療の有効性が高まります。
有機保護効果の重症度はますます高まっています。
6.β遮断薬と利尿薬の組み合わせは今でも非常に頻繁に使用されています。 この場合:
薬の降圧効果が強化されます。
-β遮断薬は、利尿薬の背景で低カリウム血症の発症を防ぎます。
-β遮断薬は、利尿薬の任命を背景に、SASおよびRAASの活性化を防ぎます。
この組み合わせは、非常に効率的であるだけでなく、費用効果も高くなります。 同時に、β遮断薬と利尿薬の同時投与により、炭水化物と脂質代謝に対するそれらの悪影響が増強され、効力が低下します。 この組み合わせは、メタボリックシンドロームと糖尿病のリスクが高い患者には使用されません。脂質と糖代謝への悪影響を減らすために、少量の利尿薬が使用されます(ヒドロクロロチアジドの6.25-12.5mg以下に相当)。
7.β遮断薬をα1-アドレナリン受容体遮断薬と併用すると、以下のことが起こります。
降圧効果の増強;
α1-アドレナリン遮断薬の使用の初期段階で発症するSASの活性化のβ遮断薬による減少;
非選択的β遮断薬によって引き起こされる血管痙攣の1-アドレナリン遮断薬の減少;
脂質および炭水化物代謝に対するβ遮断薬の悪影響の1-アドレナリン遮断薬の減少。
ただし、降圧薬のこの組み合わせの長期的な効果はよくわかっていません。
8.中枢作用の現代の薬(イミダゾリン受容体のアゴニスト)は、他のすべてのクラスの降圧薬とうまく組み合わされています。 ただし、β遮断薬と組み合わせる場合は、徐脈を発症するリスクがあるため、注意が必要です。 この組み合わせが長期予後に及ぼす影響は研究されていません。
主な降圧薬の組成が固定された低用量と全用量の併用薬があります(表2.13)。 固定有理数の組み合わせの利点は次のとおりです。
投与の容易さと用量漸増プロセス、治療への患者のアドヒアランスの向上。
併用剤形に含まれる薬剤の降圧効果の相互増加;
構成成分の多方向降圧効果により、血圧が安定して低下する患者数の増加。
併用降圧薬の低用量とこれらの効果の相互中和の両方による副作用の発生率を減らす。
治療費の削減;
不合理な組み合わせを使用する可能性の排除。
最も効果的な有機保護と心血管合併症のリスクと数の削減。
固定の組み合わせには、2つの主な欠点があります。
用量固定は、薬物の投与量を変える能力を制限します。 ただし、これは、同じ成分の異なる用量を含む組み合わせを発行することによって克服されます。
有害事象を特定し、薬物の1つまたは別の成分の影響と関連付けることにおける特定の困難。
効果の低い薬剤の組み合わせ
現在、β遮断薬+ ACE阻害薬とβアドレナリン遮断薬+ BARの組み合わせの使用を支持する説得力のある証拠はありません。 両方の薬は一方向に作用すると考えられています-それらはRAASの活性を低下させるので、それらが一緒に投与された場合、降圧作用の増強は起こりません。 それにもかかわらず、それらの降圧効果の相乗効果を決定することができる薬物作用のいくつかの特異性があります。 したがって、ACE阻害から生じる高レニン血症は、腎臓の傍糸球体装置によるレニン分泌を抑制するβ遮断薬の助けを借りて大幅に減らすことができると考えられています。 次に、BABの指定で発生する血管収縮は、血管拡張特性を持つACE阻害薬を使用することで大幅に減らすことができます。 重度の頻脈が持続し、RAAS活性が低い場合は、このような組み合わせが推奨されることがあります。 慢性心不全の患者では、β遮断薬と組み合わせたACE阻害薬の必要性は疑いの余地がありませんが、高血圧症の患者では、この組み合わせは最適とは見なされません。
表2.13。 いくつかの複合降圧薬の組成

表2.13の続き

テーブルの終わり。 2.13

表2.13の終わり

ノート:*-コハク酸塩の形で。
ACE阻害薬とBARの組み合わせは、臨床現場ではめったに使用されません。これは、両方の薬剤が同じシステムの異なるレベル(RAAS)に作用すると考えられており、BARが原因で、一緒に投与された場合、降圧作用の増強は起こらないためです。 RAAS活動の完全な減少。 同時に、ACE阻害薬はBARによって引き起こされるAT-II合成の反応性増加を抑制し、したがって、BARの降圧作用の重要なメカニズムの1つと考えられているII型アンジオテンシン受容体の間接刺激を弱めます。腎保護動脈性高血圧症の患者で。
不合理な薬物の組み合わせ
不合理な組み合わせには、降圧作用を増強しないか、副作用が増加する薬物の組み合わせが含まれます。 これらには、β遮断薬+フェニルアルキルアミンシリーズのCCA、β遮断薬+中枢作用薬、ジヒドロピリジンシリーズのCCB +α1-アドレナリン遮断薬の組み合わせが含まれます。
高血圧の治療の効果を最大化するために、医師はいくつかの規則に従う必要があります:
レジメンを簡素化し、患者のコンプライアンスを改善する、固定された組み合わせの薬剤を(1錠で)処方することをお勧めします。
単回投与で24時間効果を発揮するためには、作用の長い薬剤を優先する必要があります。 これにより、安定した降圧効果と標的臓器の永続的な保護を達成することが可能になり、さらに、患者の治療への順守を高めることができます。
血圧の24時間モニタリングの有効性は、次の薬の服用前または外来患者のモニタリング中に血圧を測定することによって評価できます。
薬の副作用は治療を拒否する最も重要な理由であるため、特別な注意を払う必要があります(治療への順守の欠如)。
合併症のない高血圧症および高齢患者では、目標血圧に達するまで治療量を徐々に増やします。
心血管リスクが高い場合、目標血圧は
実際の降圧治療とともに、用量を比較的急速に増加させる併用療法の方法によって、できるだけ早く達成されるために、除去可能な危険因子(高血糖、高コレステロール血症など)は、一般的に受け入れられている基準に従って修正されます。 -患者の治療への高い順守を維持することは、高血圧治療の基本的に重要な要素であり、以下が含まれます。定期的な患者の診察の計画、患者の医学教育(高血圧学校を含む)。 薬物の作用の本質の明確化と起こりうる副作用の議論; 患者の達成されたライフスタイルの変化に関連する定期的な励まし。 血圧の自制心を促す; 日常生活に結びついた、薬を服用する簡単で理解しやすいレジメンである医学的推奨を実施するプロセスへの親戚の関与。
降圧療法の有効性の基準
治療の結果は、短期(即時)、中期(中期)、長期(長期)に分けることができます。 即時の結果は、治療の数週間または数ヶ月後に決定され、許容可能なレベルへの血圧の低下、副作用なし、改善された検査パラメーター、医師の処方に対する適切な患者のコンプライアンス、生活の質への有益な効果が含まれます。 代理治療エンドポイントと呼ばれることもある中間結果は、降圧療法および臓器保護療法の有効性の指標です。 それらには、心臓と腎臓の機能状態への影響、左心室肥大、アテローム性動脈硬化症の進行、狭心症、炭水化物と脂質代謝の状態への影響が含まれます。 長期転帰は治療のエンドポイントを表し、心臓、脳血管、腎の合併症、大動脈および末梢動脈病変、死亡率(心臓および非心臓の原因による)などの指標が含まれます。
降圧療法の有効性に関する短期的な基準(治療開始から1〜6か月)
血圧および/または血圧が10%以上低下するか、目標血圧レベルに到達します。
高血圧クリーゼの欠如。
生活の質の維持または改善。
変更可能な危険因子への影響。
降圧療法の有効性に関する中期基準(治療開始から6か月以上)
血圧の目標値の達成。
標的臓器への損傷や既存の合併症の可逆的ダイナミクスはありません。
変更可能なリスク要因の排除。
降圧療法の有効性に関する長期基準
目標レベルでの血圧の安定した維持。
標的器官損傷の進行の欠如。
既存の心血管合併症の補償。
2.5。 高張の危機の治療
高血圧クリーゼ(HCR)は通常、血圧が突然上昇する状態として理解されます。これは、臨床症状と予後が不均一であり、生命や健康に脅威を与える可能性があります。 HCRは高血圧のすべての段階を複雑にする可能性がありますが、ほとんどの場合、II-IIIstで発生します。 血圧の突然の上昇は、神経精神的外傷、アルコール摂取、大気圧の急激な変動、降圧療法の中止などによって引き起こされる可能性があります。HCRの病因には次のようなものがあります。
血管メカニズム-細動脈の血管運動(神経液性効果)および基底(ナトリウム保持を伴う)緊張の増加の結果としての総末梢抵抗の増加;
心臓のメカニズムは、心拍数、循環血液量の増加に応じた心拍出量、心収縮、駆出率の増加です。
M.S. Kushakovsky(2004)は、3種類の高血圧クリーゼを区別しています。
神経栄養性。 このタイプの高血圧クリーゼは最も頻繁に発生します。 血圧は夜間または覚醒中に上昇し、興奮、激しい頭痛、頻脈を伴います。 血圧は急速に上昇します:収縮期最大230-250mmHg。 アート、120-125mmHgまでの拡張期。 美術。
で 浮腫性フォーム患者は抑制され、肥満で、無気力であり、顔はふくらんでおり、尿量は急激に減少します。
けいれん性 まれにしか発生せず、高血圧の最も重篤な経過で観察され、意識の喪失、強直間代発作によって現れます。
高血圧クリーゼの中で、緊急事態と緊急事態は区別されます。 緊急高血圧危機(HCRタイプI)は、血圧の顕著な上昇(> 180/120 mm Hg)を特徴とする高血圧状態を意味し、標的臓器の発症または進行性機能障害(不安定狭心症、急性左心室不全、解離)の兆候を合併します。大動脈瘤、子癇、脳卒中、視神経乳頭の浮腫などの)。 ただし、血圧の上昇が180/120 mmHgを超えない場合でも。 アートですが、標的臓器への損傷の症状の出現または悪化につながるため、そのような状態はタイプIHCRと見なされるべきです。
この場合、標的臓器への損傷を防止または制限するために、非経口薬の助けを借りて、最初の数分および数時間(必ずしも正常である必要はありません)に血圧を即座に下げる必要があります。
高血圧クリーゼの緊急事態
高血圧性脳症。
左心室不全の兆候を伴うAH。
心筋梗塞のAH。
不安定狭心症を伴うAH。
大動脈解離を伴うAH。
くも膜下出血または脳血管障害に関連する重度の高血圧。
褐色細胞腫を伴う危機。
アンフェタミン、LSD、コカインまたはエクスタシーによる中毒の場合の高血圧。
手術中の高血圧。
重度の子癇前症または子癇。
緊急高血圧状態の治療の最初の目標は、非経口投与された降圧薬の助けを借りて、数分から1時間の間隔で平均血圧を25%以下に下げることです。 その後、血圧が安定していれば、
次の2〜6時間で160 mmHgに減らします。 (収縮期)および100-110 mmHg。 美術。 (拡張期)(経口への切り替え 剤形)。 この場合、腎臓、脳、または冠状動脈の虚血を引き起こす可能性のある血圧の過度の低下は避ける必要があります。 このレベルの血圧が十分に許容され、患者の状態が臨床的に安定している場合は、次の24〜48時間で、血圧をさらに徐々に正常レベルまで下げることができます。
臨床研究で緊急の降圧治療の利点が示されていない虚血性脳卒中の患者。
大動脈解離の患者で、収縮期血圧を< 100 мм рт. ст., если они это переносят.
緊急高血圧状態(HAタイプII)は、標的臓器の進行性機能障害を伴わない血圧の急激な上昇に関連する状況として理解されています。 これには、220 mmHg以上の無症候性の血圧上昇の場合も含まれます。 美術。 および/またはBPd≥120mmHg。 美術。
これらの状況では、血圧を初期の15〜25%または≤160/ 110mmHgずつ徐々に下げる必要があります。 美術。 12〜24時間以内(経口降圧薬を使用)。 効率の評価と修正 緊急治療薬の降圧効果の開始に必要な時間(15-30分)の後に実行されます。
高血圧クリーゼのけいれん型を緩和するために、ジアゼパム(Seduxen、Relium、Sibazon)がさらに10〜20 mg(2〜4 mlの0.5%溶液)の用量で処方されます。 発作がなくなるまで、薬をゆっくりと静脈内投与します。 硫酸マグネシウム2.5gをゆっくりと静脈内に処方することもできます(0.9%塩化ナトリウム溶液10ml中の25%溶液10ml)。 この場合、主な危険は呼吸停止です。 硫酸マグネシウムの点滴(0.9%塩化ナトリウム溶液250ml中の25%溶液10ml)は危険性が低くなります。 呼吸抑制では、塩化カルシウムの静脈内投与が必要です。
高血圧クリーゼの治療のために、医師は比較的小さいが完全な、そして最も重要なことに、よく知られている降圧薬のセットを持っている必要があります(表2.14)。
テーブル 2.14. 高血圧クリーゼを緩和するために使用される主な薬

テーブルの続き。 2.14

表2.14の続き

テーブルの続き。 2.14

表2.14の続き

テーブルの終わり。 2.14

表2.14の終わり

ノート:* - で 静脈内投与クロニジン、血管の末梢α1-およびα2-アドレナリン受容体の活性化により、血圧の短期間の上昇が可能です。 **-特別なシステムによる紹介。 ***-5分後にボーラス注射を繰り返すか、注入を300μg/分まで増やすことができます。
高血圧クリーゼの治療のための非経口薬の要件
降圧効果の発現と投与終了後3〜4時間のその保存の短い時間。
用量依存的な予測可能な効果。
脳および腎臓の血流、心収縮への影響は最小限です。
ほとんどの患者での有効性。
ほとんどの患者に使用するための禁忌はありません。
副作用の最小範囲。
高血圧クリーゼの治療のための経口薬の要件
経口摂取した場合の血圧降下作用の急速な(20-30分)開始、4-6時間続く。
用量依存的な予測可能な降圧効果。
ほとんどの患者に適しています(副作用なし)。
可用性。
降圧療法の開始後、タイムリーな検出のために少なくとも6時間医師を観察することをお勧めします 起こりうる合併症ГКр(主に違反 脳循環および梗塞)および薬物療法の副作用(例えば、起立性低血圧)。 起立性低血圧の発症に伴い、血圧モニタリングを伴う安静が推奨されます。 血圧が過度に低下すると、液体(たとえば、等張塩化ナトリウム溶液)の静脈内点滴が可能になり、持続的な低血圧では、治療に昇圧剤(たとえば、ドーパミン)を追加することができます。
文学
アルマゾフV.A.高血圧症/ V。A. Almazov、E。V.Shlyakhto。 -M。、2000 .-- 118p。
Belousov Yu.B.臨床薬理学および薬物療法。 -第2版、ステレオタイプ/Yu。B.Belousov、V。S。Moiseev、V。K。Lepakhin --M。:Universum Publishing、2000 .-- 539p。
ボンダレンコB.B.テルミサルタンは、新しいアンジオテンシンII受容体遮断薬/ B.B. Bondarenko、Yu。B。Winter //動脈性高血圧症です。 -2002。-T8、? 3.-S.82-84。
ヴァートキンA.L.高血圧クリーゼ:伝統的な概念から現代の臨床ガイドラインまで/ A. L. Vertkin、M。I。Lukashov、O。B。Polosyants、N。I。Pentkovsky //主治医。 -2007。-? 6.-http://old.osp.ru/doctore/2007/06/062.htm。
Gilyarevsky S.R. ALLHATの証拠と疑いの後の1-アドレナリン受容体の遮断薬/ S。R. Gilyarevsky //心臓:開業医のためのジャーナル
医者。 -2003。-T。2、? 4.-S.202-206。
コバラバJ.D.高血圧クリーゼ:分類と治療に本当の矛盾はありますか? / Zh.D. Kobalava、K.M。Gudkov // Heart:開業医のためのジャーナル。 -2003。-T2、? 3.-S.116-127。
コバラバJ.D.動脈性高血圧の治療の基本原則:改訂および新規/Zh。D.Kobalava、Yu。V。Kotovskaya //心臓:開業医のためのジャーナル。 -2004。-T。3、? 2.-S.75-79。
コンラディA.O.動脈性高血圧症の治療における中枢作用薬の使用:成果と展望/ A. O. Konradi //動脈性高血圧症。 -2002。-エクストラエディション。 -S.7-9。
マコルキンV.I.動脈性高血圧症の治療におけるカルシウム拮抗薬/
V.I. Makolkin //ロシアの医学ジャーナル。 -2003。-T。11、? 九。 -
S.511-513。
Metelitsa V.I.心血管医学の臨床薬理学ハンドブック。 -第3版、Rev。 と追加します。 /V.I。ブリザード。 --M。:MIA、2005 .-- 1528p。
モイセーエフS.V.動脈性高血圧症におけるカルシウム拮抗薬:実用的側面/ SV Moiseev //臨床薬理学および治療。 -2006。-T15、? 3.-S.32-36。
Preobrazhensky D.V. 臨床診療におけるACE阻害薬とAT1遮断薬/ D。V. Preobrazhensky、B。A. Sidorenko、T。A.Batyraliev。 - NS 。:
Alliance-PRESID、2002 .-- 224p。
Preobrazhensky D.V. 動脈性高血圧症の診断と治療。 -パート1。問題。 A / D. V. Preobrazhensky、B。A。Sidorenko -M。:Alliance-PRESID、
2002 .-- 99p。
Preobrazhensky D.V. 動脈性高血圧症の診断と治療。 -パート1。問題。 B / D. V. Preobrazhensky、B。A。Sidorenko -M。:Alliance-PRESID、
2002 .-- 254p。
動脈性高血圧症の予防、診断および治療。 ロシアの推奨事項(2回目の改訂)。 -M。、2004 .-- 20p。
B.A.シドレンコAT1-アンジオテンシン受容体遮断薬/ BA Sidorenko、DVPreobrazhensky。 --M。:Informatik、2001 .-- 200p。
ワシントン大学の治療ディレクトリ/編。 M.ウッドリー、A。ウェラン。 --M 。:練習、1995 .-- 831p。
Fofanova T.V.ACE阻害薬+低用量のチアジド系利尿薬:動脈性高血圧の治療に理想的な組み合わせ/ T. V. Fofanova、F。T。Ageev //心臓:開業医のためのジャーナル。 -2004。-T。3、? 2.-
S.99-103。
Chazova I.E.動脈性高血圧の診断と治療のためのアルゴリズム/ I。E. Chazova // Consilium-Medicum。 -2003。-T。4、? 3.-S.130-133。
Chazova I.E.動脈性高血圧の併用療法:複合体について簡単/ IE Chazova、LG Ratova // Consilium-Medicum。 -2006.-T. 8、? 5.-http://www.polyclinic.spb.ru/articles。 php?subaction = showfull&id = 118672 9987&archive =&start_from =&ucat = 10&action = 10。
2003年欧州高血圧学会-動脈性高血圧の管理に関する欧州心臓病学会ガイドライン//J.Hypertens。 -2003.-Vol。 21.-P.1011-1053。
アトラスS.A。レニン-アンギオテンシンアルドステロン系:病態生理学的役割と薬理学的阻害/ S. A. Atlas // Managについて。 ケアファーム。 -2007.-Vol。 13 、? 8、Suppl。 B.-P.9-20。
Aulakh G.K.。非ペプチドアンジオテンシン受容体拮抗薬および関連するRAASモジュレーターに関する最新情報/ Aulakh G. K.、Sodhi R. K.、Singh M. // LifeSci。 -2007.-Vol。 81、? 8.-P.615-639。
ビソニャーノJ.D.カルシウムチャネル遮断薬、アンジオテンシン受容体遮断薬、およびアンジオテンシン変換酵素阻害薬:高血圧治療のための利尿薬またはベータ遮断薬との併用での有効性/ J. D. Bisognano、T McLaughlin、C。S。Roberts、S。S。Tang // Vasc。 健康リスク管理。 -2007.-Vol。 3、? 5.-P.579-585。
心血管薬//未来の薬。 -2002.-Vol。 27、? 1.-P.61-103。
ケイリーW.E.ジュニアベータ遮断薬は高血圧の第一選択治療として効果的ですか? / W. E. Jr. ケイリー//午前 ファム。 医師。 -2007.-Vol。 76、? 9.-P.1306-1308。
チャーマーズJ。WHO-ISH高血圧ガイドライン委員会。 1999 WorldHeathOrganization-高血圧の管理のための国際高血圧学会ガイドライン/ J。Chalmers // J.Hypertens。 -1999.-Vol。 17.-P.151-185。
Chobanian A. V.高血圧の予防、検出、評価および治療に関する合同全国委員会の第7回報告/ A. V. Chobanian、G。L。Barkis、H。R。Black etal。 //ハート:開業医のための雑誌。 -2004。-T。3、? 5.-S.224-261。
グッドマン&ギルマンS。治療法の薬理学的基礎/編。 J.G.ハードマン第9版。 New York et al。:McGraw-Hill 1998.1905p。
Gradman A. H.、Kad R.高血圧症におけるレニン阻害// J Am CollCardiol。 -2008.-Vol。 51、? 5.-P.519-528。
ガイドライン委員会。 2003年欧州高血圧学会-動脈性高血圧の管理に関する欧州心臓病学会のガイドライン// J。高血圧。 -2003.-Vol。 21.-P.1011-1053。
Hansson L.、Zanchetti H.、Carruthers S. G.、他 Westerink、HOT研究グループ。 高血圧患者における集中的な血圧低下と低用量アスピリンの効果:高血圧最適治療(HOT)無作為化試験の主な結果/ I. Hanson、A。Zanchetti、S。Carruthersetal。 //ランセット。 -1998.-Vol。 351.-P
1755-1762.
心臓転帰評価(HOPE)研究調査員。 高リスク患者の心血管イベントに対する阻害剤、ラミプリルのアンギオテンシン変換酵素の効果//
N.Engl。 J.Med。 -2000。-巻。 342.-P.145-153。
Katzung B. G.基礎および臨床薬理学。 -第8版/ B。G.Katzung。 --New York et al。:McGraw-Hill、2001 .-- 1217p。
マンシアG。動脈性高血圧の管理のためのガイドライン:欧州高血圧学会(ESH)および欧州心臓病学会(ESC)の動脈性高血圧管理のためのタスクフォース/ G. Mancia、G。DeBacker、
A. Dominiczak etal。 // J。ハイパーテンス。 -2007.-Vol。 25、? 6.-P.1105-1187。
マッチャーD.B。系統的レビュー:本態性高血圧症の治療におけるアンジオテンシン変換酵素阻害薬とアンジオテンシンII受容体遮断薬の有効性の比較/ D. B. Matchar、D。C。McCrory、L。A。Orlando etal。 //アンインターンメッド。 -2008.-Vol。 148、? 1.-P.16-29。
マイヤーP。心臓血管医学におけるアンジオテンシンII阻害の将来/ R。Meier、M。Maillard、M。Burnier// Curr Drug Targets Cardiovasc HaematolDisord。 -2005.-Vol。 5、? 1.-P.15-30。
Mustone A. L.最適な降圧薬の望ましい治療特性/ A。L. Mustone //薬。 -2006.-Vol。 66、? 9.-P.1239-1252。
ネスビットS.D.降圧併用療法:血圧制御と心血管リスク低減の最適化/ S. D. Nesbitt // J.Clin。 高血圧。 -2007.-Vol。 九、 ? 11、Suppl。 4.-P.26-32。
ヌスバーガーJ。健康なボランティアに繰り返し経口投与した後のレニン阻害剤SPP100の忍容性、薬物動態および薬物動態効果/ J. Nussberger、H。Brunner、C。Jensen、J。Mann// Eur。 ハートJ.-2001.-Vol。 22.-
Abst。 P2294。
ああB.-H.経口レニン阻害剤であるアリスキレンは、高血圧/ B.-Hの患者に、用量依存的な有効性と持続的な24時間の血液貯留制御を提供します。 おお、
J. Mitchell、J。R。Herron etal。 // 混雑する。 コルカルディオール。 -2007.-Vol。 49、? 11.-P.1157-1163。
Remme W. J.ベータ遮断薬またはアンジオテンシン変換酵素阻害薬/アンジオテンシン受容体遮断薬:最初に何をすべきか? / W. J. Remme // CardiolClin。 -2007年。-
巻 25、? 4.-P.581-594。
リチャードS。カルシウムチャネル拮抗薬の血管作用:新しい証拠/ S。リチャード//薬物。 -2005.-Vol。 65、Suppl。 2.-P.1-10。
シュミーダーR.E.アンジオテンシンII受容体遮断による新たに発症した心房細動の発生率の低下:VALUE試験/ R. E. Schmieder、S。E。Kjeldsen、S。Julius
etal。 // J。ハイパーテンス。 -2008.-Vol。 26、? 3.-P.403-411。
高血圧の検出、評価、および治療に関する合同全国委員会の第6回報告書(JNC VII)// Arch InternMed。 -1997.-Vol。 157.-
P.2413-2446。
Triggle D. J.カルシウムチャネル拮抗薬:臨床用途-過去、現在、未来/ D. J. Triggle // BiochemPharmacol。 -2007.-Vol。 74、? 1.-P.1-9。









