Учебное пособие: Патогенез некроза. Основные морфологические виды некроза.
Некроз (от греч. nekros - мертвый) - омертвение, гибель клеток и тканей в живом организме под воздействием болезнетворных факторов. Этот вид гибели клеток генетически не контролируется.
Факторы, вызывающие некроз:
ü физические (огнестрельное ранение, радиация, электричество, низкие и высокие температуры - отморожение и ожог);
ü токсические (кислоты, щелочи, соли тяжелых металлов, ферменты, лекарственные препараты, этиловый спирт и др.);
ü биологические (бактерии, вирусы, простейшие и др.);
ü аллергические (эндо- и экзоантигены, например, фибриноидный некроз при инфекционно-аллергических и аутоиммунных заболеваниях, феномен Артюса);
ü сосудистый (инфаркт - сосудистый некроз);
ü трофоневротический (пролежни, незаживающие язвы).
В зависимости от механизма действия патогенного фактора различают:
- прямой некроз, обусловленный непосредственным действием фактора (травматические, токсические и биологические некрозы);
- непрямой некроз, возникающий опосредованно через сосудистую и нервно-эндокринную системы (аллергические, сосудистые и трофоневротические некрозы).
Морфологические признаки некроза
Некрозу предшествует период некробиоза, морфологическим субстратом которого являются дистрофические изменения.
Изменения в ядрах .
Хроматин мертвой клетки конденсируется в крупные глыбки. Ядро уменьшается в объеме, становится сморщенным, плотным, интенсивно базофильным, то есть, окрашивается в темно-синий цвет гематоксилином. Этот процесс назван кариопикнозом (сморщиванием). Пикнотическое ядро может затем разрываться на многочисленные маленькие базофильные частицы (кариорексис) или подвергнуться лизису (растворению) в результате действия лизосомной дезоксирибонуклеазы (кариолизис). Тогда оно увеличивается в объеме, слабо окрашивается гематоксилином, постепенно теряются контуры ядра. При быстро развивающемся некрозе ядро подвергается лизису без пикнотической стадии.
Цитоплазматические изменения.
- цитоплазма клетки становится гомогенной и выражено ацидофильной в результате коагуляции цитоплазматических белков и разрушения (исчезновения) рибосом.
- набухание митохондрий и деструкция (разрушение) мембран органелл вызывают вакуолизацию цитоплазмы.
- переваривание клетки ферментами, которые высвобождаются из собственных лизосом, вызывает лизис клетки (аутолиз).
Таким образом, в цитоплазме происходит коагуляция белков, сменяемая обычно их колликвацией.
Изменения межклеточного вещества охватывают как межуточное вещество, так и волокнистые структуры. Чаще всего развиваются изменения, характерные для фибриноидного некроза: коллагеновые, эластические и ретикулиновые волокна превращаются в плотные, гомогенные розовые, иногда базофильные массы, которые могут подвергаться фрагментации, глыбчатому распаду либо лизироваться. Реже может наблюдаться отек, лизис и ослизнение волокнистых структур, что свойственно колликвационному некрозу.
Клинико-морфологические формы некроза
Различают коагуляционный (сухой) некроз и колликвационный (влажный) некроз.
А. Коагуляционный (сухой) некроз.
Коагуляционный некроз обычно происходит в органах, богатых белками и бедных жидкостями, например, в почках, миокарде, надпочечниках, селезенке, обычно в результате недостаточного кровообращения и аноксии, действия физических, химических и других повреждающих факторов, например, коагуляционный некроз клеток печени при вирусном поражении или при действии токсических агентов бактериального и небактериального генеза. Коагуляционный некроз еще называют сухим, поскольку он характеризуется тем, что возникающие при нем мертвые участки сухие, плотные, крошащиеся, белого или желтого цвета.
К коагуляционному некрозу относят:
Инфаркт - разновидность сосудистого (ишемического) некроза внутренних органов (кроме мозга). Это самый частый вид некроза.
Инфаркт (от лат. infarcire - начинять, набивать) - это мертвый участок органа или ткани, выключенный из кровообращения в результате внезапного прекращения кровотока (ишемии). Инфаркт - разновидность сосудистого (ишемического) коагуляционного либо колликвационного некроза. Это самый частый вид некроза.
Некрозу подвергаются как паренхиматозные клетки, так и интерстициальная ткань. Наиболее часто инфаркт возникает при тромбозе или эмболии, спазме, сдавлении артериальных сосудов. Очень редко причиной инфаркта может быть нарушение венозного оттока.
Причины развития инфаркта:
- острая ишемия, обусловленная длительным спазмом, тромбозом или эмболией, сдавлением артерии;
- функциональное напряжение органа в условиях недостаточного его кровоснабжения. Огромное значение для возникновения инфаркта имеет недостаточность анастомозов и коллатералей, которая зависит от степени поражения стенок артерий и сужения их просветов (атеросклероз, облитерирующий эндартериит), от степени нарушения кровообращения (например, венозного застоя) и от уровня выключения артерии тромбом или эмболом.
Поэтому инфаркты возникают обычно при тех заболеваниях, для которых характерны тяжелые изменения стенок артерий и общие расстройства кровообращения. Это:
- ревматические болезни;
- пороки сердца;
- атеросклероз;
- гипертоническая болезнь;
- бактериальный (инфекционный) эндокардит.
Морфология инфарктов
Макроскопическая картина инфарктов. Форма, величина, цвет и консистенция инфаркта могут быть различными.
Форма инфаркта. Обычно инфаркты имеют клиновидную форму. При этом заостренная часть клина обращена к воротам органа, а широкая часть выходит на периферию, например, под капсулу органа, под брюшину (инфаркты селезенки), под плевру (инфаркты легких) и т.д. Характерная форма инфарктов в почках, селезенке, легких определяется характером ангиоархитектоники этих органов - магистральным (симметричным дихотомическим) типом ветвления артерий. Реже инфаркты имеют неправильную форму. Такие инфаркты встречаются в сердце, мозге, кишечнике, поскольку в этих органах преобладает не магистральный, а рассыпной или смешанный тип ветвления артерий.
Величина инфарктов. Инфаркт может охватывать большую часть или весь орган (субтотальный или тотальный инфаркт) или обнаруживаться лишь под микроскопом (микроинфаркт).
Цвет и консистенция инфарктов. Если инфаркт развивается по типу коагуляционного некроза, то ткань в области омертвения уплотняется, становится суховатой, бело-желтого цвета (инфаркт миокарда, почек, селезенки). Если инфаркт образуется по типу колликвационного некроза, то мертвая ткань размягчается и разжижается (инфаркт мозга или очаг серого размягчения).
В зависимости от механизма развития и внешнего вида различают:
- белый (ишемический) инфаркт;
- красный (геморрагический) инфаркт;
- белый инфаркт с геморрагическим венчиком.
Белый (ишемический) инфаркт возникает в результате полного прекращения притока артериальной крови в органах, например, в сердце, почках, селезенке, головном мозге выше виллизиева круга. Обычно он возникает в участках с одной системой притока крови (магистральным типом ветвления артерий), в которых коллатеральное кровообращение развито слабо. Благодаря ненарушенному венозному оттоку из ишемизированной ткани и вследствие спазма дистального участка артерий после прекращения кровотока наблюдается бледность этих инфарктов. Белый (ишемический) инфаркт представляет собой участок, четко отграниченный от окружающих тканей, бело-желтого цвета, бесструктурный.
Белый инфаркт с геморрагическим венчиком представлен участком бело-желтого цвета, но этот участок окружен зоной кровоизлияний. Она образуется в результате того, что спазм сосудов по периферии инфаркта сменяется паретическим их расширением и развитием кровоизлияний. Такой инфаркт может возникать в почках, миокарде.
Красный (геморрагический) инфаркт характеризуется тем, что участок омертвения пропитан кровью, он темно-красный и хорошо отграничен. Инфаркт становится красным из-за выхода в зоне инфаркта крови из некротизированных сосудов микроциркуляторного русла. Для развития красного инфаркта имеют значение особенности ангиоархитектоники органа - две и более системы притока крови, развитость коллатералей: в легких - наличие анастомозов между бронхиальной и легочной артериями, в кишечнике - обилие анастомозов между ветвями брыжеечных артерий, в головном мозге в области виллизиева круга анастомозы между внутренними сонными и ветвями базилярной артерий. Красные инфаркты могут также возникать в ткани при растворении или фрагментации (распаде) обтурирующего тромба, что возобновляет артериальный кровоток в зоне инфаркта.
Геморрагический инфаркт редко встречается в почках и сердце. Необходимым условием для такого геморрагического пропитывания является венозный застой.
Венозный инфаркт возникает при окклюзии всей венозной дренажной системы ткани (например, тромбоз верхнего сагиттального синуса, тромбоз почечной вены, тромбоз верхней брыжеечной вены). При этом возникают тяжелый отек, застой, кровоизлияния и прогрессивное увеличение гидростатического давления в тканях. При сильном увеличении гидростатического давления затрудяется приток артериальной крови в ткань, что ведет к ишемии и инфаркту. Венозные инфаркты всегда геморрагические.
Микроскопически мертвый участок отличается потерей структуры, контуров клеток и исчезновением ядер.
Наибольшее клиническое значение имеют инфаркты сердца (миокарда), головного мозга, кишечника, легких, почек, селезенки.
В сердце инфаркт обычно белый с геморрагическим венчиком, имеет неправильную форму, встречается чаще в левом желудочке и межжелудочковой перегородке, крайне редко - в правом желудочке и предсердиях. Омертвение может локализоваться под эндокардом (субэндокардиальный инфаркт), эпикардом (субэпикардиальный инфаркт), в толще миокарда (интрамуральный) или охватывать всю толщу миокарда (трансмуральный инфаркт). В области инфаркта на эндокарде нередко образуются тромботические, а на перикарде - фибринозные наложения, что связано с развитием реактивного воспаления вокруг участков некроза. Чаще всего инфаркт миокарда встречается на фоне атеросклероза и гипертонической болезни с присоединением спазма или тромбоза артерий, являясь острой формой ишемической болезни сердца.
В головном мозге выше виллизиева круга возникает белый инфаркт, который быстро размягчается (очаг серого размягчения мозга). Если инфаркт образуется на фоне значительных расстройств кровообращения, венозного застоя, то очаг омертвения мозга пропитывается кровью и становится красным (очаг красного размягчения мозга). В области ствола мозга, ниже виллизиева круга также развивается красный инфаркт. Инфаркт локализуется обычно в подкорковых узлах, разрушая проводящие пути мозга, что проявляется параличами. Инфаркт мозга, как и инфаркт миокарда, чаще всего встречается на фоне атеросклероза и гипертонической болезни и является одним из проявлений цереброваскулярных заболеваний.
В легких в подавляющем большинстве случаев образуется геморрагический инфаркт. Причиной его чаще служит тромбоэмболия, реже - тромбоз при васкулите. Участок инфаркта хорошо отграничен, имеет форму конуса, основание которого обращено к плевре. На плевре в области инфаркта появляются наложения фибрина (реактивный плеврит). У острия конуса, обращенного к корню легкого, нередко обнаруживается тромб или эмбол в ветви легочной артерии. Омертвевшая ткань плотна, зерниста, темно-красного цвета. Геморрагический инфаркт легких обычно возникает на фоне венозного застоя, причем развитие его в значительной мере определяется особенностями ангиоархитектоники легких, наличием анастомозов между системами легочной и бронхиальных артерий. В условиях застойного полнокровия и закрытия просвета ветви легочной артерии в область омертвения ткани легкого из бронхиальной артерии поступает кровь, которая разрывает капилляры и изливается в просвет альвеол. Вокруг инфаркта нередко развивается воспаление легочной ткани (периинфарктная пневмония). Массивный геморрагический инфаркт легкого может быть причиной надпеченочной желтухи. Белый инфаркт в легких - исключительная редкость. Возникает он при склерозе и облитерации просвета бронхиальных артерий.
В почках инфаркт, как правило, белый с геморрагическим венчиком, конусовидный участок некроза охватывает либо корковое вещество, либо всю толщу паренхимы. При закрытии основного артериального ствола развивается тотальный или субтотальный инфаркт почки. Своеобразной разновидностью инфарктов являются симметричные некрозы коркового вещества почек, ведущие к развитию острой почечной недостаточности. Развитие ишемических инфарктов почек связано обычно с тромбоэмболией, реже - с тромбозом ветвей почечной артерии при ревматизме, бактериальном эндокардите, гипертонической болезни, ишемической болезни сердца. Редко при тромбозе почечных вен возникает венозный инфаркт почек.
В селезенке встречаются белые инфаркты, нередко с реактивным фибринозным воспалением капсулы и последующим образование спаек с диафрагмой, париетальным листком брюшины, петлями кишечника Ишемические инфаркты селезенки связаны с тромбозом и эмболией. При тромбозе селезеночной вены иногда, очень редко, образуются венозные инфаркты.
В кишечнике инфаркты геморрагические и всегда подвергаются септическому распаду, что ведет к прободению стенки кишки и развитию перитонита. Причиной, чаще всего, служит заворот, инвагинация кишечника, ущемленная грыжа, реже - атеросклероз с присоединением тромбоза.
Казеозный (творожистый) некроз развивается и при туберкулезе, сифилисе, лепре, а также при лимфогрануломатозе. Его еще называют специфическим, поскольку чаще всего встречается при специфических инфекционных гранулемах. Во внутренних органах выявляется сухой, крошащийся ограниченный участок ткани беловато-желтого цвета. В сифилитических гранулемах очень часто такие участки не крошащиеся, а пастообразные, напоминают аравийский клей. Это смешанный (то есть экстра- и интрацеллюлярный) тип некроза, при котором одновременно гибнет и паренхима, и строма (и клетки, и волокна). Микроскопически такой участок ткани выглядит как бесструктурный, гомогенный, окрашен гематоксилином и эозином в розовый цвет, хорошо видны глыбки хроматина ядер (кариорексис).
Восковидный, или ценкеровский некроз (некроз мышц, чаще передней брюшной стенки и бедра, при тяжелых инфекциях - брюшном и сыпном тифах, холере);
Фибриноидный некроз - тип некроза соединительной ткани. Наблюдается при аллергических и аутоиммунных болезнях (например, ревматизме, ревматоидном артрите и системной красной волчанке). Повреждаются коллагеновые волокна и гладкая мускулатура средней оболочки кровеносных сосудов. Фибриноидный некроз артериол наблюдается при злокачественной гипертензии. Этот некроз характеризуется потерей нормальной структуры коллагеновых волокон и накоплением гомогенного, ярко-розового некротического материала, который похож микроскопически на фибрин.
Жировой некроз.
Ферментный жировой некроз: жировой некроз наиболее часто происходит при остром панкреатите и повреждениях поджелудочной железы, когда панкреатические ферменты выходят из протоков в окружающие ткани. При этом в жировой ткани, окружающей поджелудочную железу, появляются непрозрачные, белые (как мел) бляшки и узелки (стеатонекроз).
Неферментный жировой некроз: неферментный жировой некроз наблюдается в молочной железе, подкожной жировой ткани и в брюшной полости. Большинство пациентов имеют в анамнезе травмы. Неферментный жировой некроз вызывает воспалительный ответ, характеризуемый наличием многочисленных макрофагов с пенистой цитоплазмой, нейтрофилов и лимфоцитов. Затем следует фиброзирование, при этом данный процесс бывает трудно отличить от опухоли.
Гангрена (от греч. gangraina - пожар): это некроз тканей, сообщающихся с внешней средой и изменяющихся под ее воздействием. Различают сухую, влажную, газовую гангрены и пролежни.
Сухая гангрена - это некроз тканей, соприкасающихся с внешней средой, протекающий без участия микроорганизмов. Сухая гангрена наиболее часто возникает на конечностях в результате ишемического коагуляционного некроза тканей. Некротизированные ткани кажутся черными, сухими, они четко отграничены от смежной жизнеспособной ткани. На границе со здоровыми тканями возникает демаркационное воспаление. Изменение цвета обусловлено превращением гемоглобиногенных пигментов в присутствии сероводорода в сульфид железа. Примерами может служить сухая гангрена:
- конечности при атеросклерозе и тромбозе ее артерий (атеросклеротическая гангрена), облитерирующем эндартериите;
- при отморожении или ожоге;
- пальцев при болезни Рейно или вибрационной болезни;
- кожи при сыпном тифе и др. инфекциях.
Влажная гангрена: развивается в результате наслоения на некротические изменения ткани тяжелой бактериальной инфекции. Под действием ферментов микроорганизмов возникает вторичная колликвация. Влажная гангрена развивается обычно в тканях, богатых влагой. Она может встречаться на конечностях, но чаще - во внутренних органах, например, в кишечнике при непроходимости брыжеечных артерий (тромбоз, эмболия), в легких как осложнение пневмонии (грипп, корь). У ослабленных инфекционным заболеванием (чаще корью) детей может развиться влажная гангрена мягких тканей щек, промежности, которую называют номой (от греч. nome - водяной рак).
Пролежень (decubitus): как разновидность гангрены выделяют пролежни - омертвение тканей (кожа, мягкие ткани), подвергающихся длительному давлению. Пролежни чаще появляются в области крестца, остистых отростков позвонков, большого вертела бедренной кости (у лежачих больных). По своему генезу это трофоневротический некроз, так как сдавливаются сосуды и нервы, что усугубляет нарушения трофики тканей у тяжелобольных, страдающих сердечно-сосудистыми, онкологическими, инфекционными или нервными болезнями.
Б. Колликвационный (влажный) некроз
Характеризуется расплавлением мертвой ткани. Он развивается в тканях, относительно бедных белками и богатых жидкостью, где имеются благоприятные условия для гидролитических процессов. Лизис клеток происходит в результате действия собственных ферментов (аутолиз). Типичным примером влажного колликвационного некроза является очаг серого размягчения (ишемический инфаркт) головного мозга.
Исход некроза.
Благоприятные исходы некроза:
- лизис;
- организация, на месте некроза в таких случаях образуется рубец (рубец на месте инфаркта).
- инкапсуляция;
- петрификация;
- оссификация;
- образование кисты.
Неблагоприятные исходы некроза:
- гнойное (септическое) расплавление очага омертвения;
- секвестрация - это формирование участка мертвой ткани, который не подвергается аутолизу и организации. Секвестры обычно возникают в костях при воспалении костного мозга - остеомиелите. Вокруг такого секвестра образуется секвестральная капсула и полость, заполненная гноем;
- мутиляция - отторжение некротизированных тканей.
Апоптоз , или запрограммированная смерть клетки, представляет собой процесс, посредством которого внутренние или внешние факторы, активируя генетическую программу, приводят к гибели клетки и ее эффективному удалению из ткани. Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток, что сопровождается формированием округлых, окруженных мембраной телец (“апоптотические тельца”), которые тут же фагоцитируются окружающими клетками.
Это энергозависимый процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он играет большую роль в морфогенезе и является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример - опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример - атрофия.
Морфологические проявления апоптоза
Апоптотические клетки выглядят как округлые или овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина. Поскольку сжатие клетки и формирование апоптотических телец происходит быстро и также быстро они фагоцитируются, распадаются или выбрасываются в просвет органа, то на гистологических препаратах он обнаруживается в случаях его значительной выраженности. К тому же апоптоз - в отличие от некроза - никогда не сопровождается воспалительной реакцией, что также затрудняет его гистологическое выявление.
Сравнительная характеристика некроза и апоптоза
|
Индукция |
Активируется физиологическими или патологическими стимулами |
Различная в зависимости от повреждающего фактора |
|
Распространенность |
Одиночная клетка |
Группа клеток |
|
Биохимические изменения |
Энергозависимая фрагментация ДНК эндогенными эндонуклеазами. |
Нарушение или прекращение ионного обмена. |
|
Распад ДНК |
Внутриядерная конденсация с расщеплением на фрагменты |
Диффузная локализация в некротизированной клетке |
|
Целостность клеточной мембраны |
Сохранена |
Нарушена |
|
Морфология |
Сморщивание клеток и фрагментация с формированием апоптотических телец с уплотненным хроматином |
Набухание и лизис клеток |
|
Воспалительный ответ |
Обычно есть |
|
|
Удаление погибших клеток |
Поглощение (фагоцитоз) соседними клетками |
Фагоцитоз нейтрофилами и макрофагами |
Рис. 1. Последовательность ультраструктурных изменений при апоптозе (справа) и некрозе (слева)
1 - нормальная клетка; 2 - начало апоптоза; 3 - фрагментация апоптотической клетки; 4 - фагоцитоз апоптотических телец окружающими клетками; 5 - гибель внутриклеточных структур при некрозе; 6 - разрушение клеточной мембраны.
Апоптоз принимает участие в следующих физиологических и патологических процессах:
ü запрограммированном разрушении клеток во время эмбриогенеза (включая имплантацию, органогенез);
ü гормон-зависимой инволюции органов у взрослых, например, отторжение эндометрия во время менструального цикла, атрезии фолликулов в яичниках в менопаузе и регрессия молочной железы после прекращения лактации;
ü удалении некоторых клеток при пролиферации клеточной популяции;
ü гибели отдельных клеток в опухолях, в основном при ее регрессии, но также и в активно растущей опухоли;
ü гибели клеток иммунной системы, как В-, так и Т-лимфоцитов, после истощения запасов цитокинов, а также гибели аутореактивных Т-клеток при развитии в тимусе;
ü патологической атрофии паренхиматозных органов после обтурации выводных протоков, что наблюдается в поджелудочной и слюнных железах, почках;
ü гибели клеток, вызванных действием цитотоксических Т-клеток, например, при отторжении трансплантата и болезни “трансплантат против хозяина”;
ü повреждении клеток при некоторых вирусных заболеваниях, например, при вирусном гепатите, когда фрагменты апоптотических клеток обнаруживаются в печени, как тельца Каунсильмана.
Регуляция апоптоза
Апоптоз это генетически контролируемая смерть клетки. В настоящее время выявлено большое число генов, которые кодируют вещества, необходимые для регуляции апоптоза.
Апоптоз может регулироваться:
- внешними факторами,
- автономными механизмами.
Коагуляционный некроз развивается при низкой активности гидролитических процессов, высоком содержании белков и умеренном содержании жидкости в тканях. Некротизированная ткань имеет плотную и сухую консистенцию. Примером могут служить восковидный или ценкеровский некроз мышц при брюшном и сыпном тифе; фибриноидный некроз при аллергических и аутоиммунных заболеваниях. Разновидностью коагуляционного некроза является казеозный (творожистый) некроз , получивший своё название за сходство по консистенции, цвету и виду с творогом. Он развивается при таких заболеваниях как туберкулёз , сифилис , проказа и лимфогранулематоз. Химический анализ некротических тканей выявляет в них большое количество липидов.
Причины появления
Коагуляционный некроз чаще всего вызывается условиями, не связанными с тяжёлыми травмами, токсинами или иммунной реакций хронического заболевания. Недостаток кислорода (гипоксия) вызывает отмирание клеток в локализованной области, которую кровеносные сосуды не в состоянии обеспечить кислородом и другими важными питательными веществами. Следует отметить, что при ишемии большинство тканей организма будут испытывать коагуляционный некроз, ишемия в центральной нервной системе вызывается колликвационным некрозом , так как в нервных тканях очень небольшие плотные структуры.
Патология
Макроскопия
Макроскопическая картина участка с коагуляционным некрозом выглядит как бледный сегмент тканей, контрастирующий с окружающими участками, а также отличается васкуляризованной тканью и иссушенной тканью на разрезе. Позже ткань может стать красной из-за воспалительной реакции. Выжившие окружающие клетки могут помочь в регенерации повреждённой ткани, если повреждение не является стабильным или постоянным.
Некроз (от греч. nekros - мертвый) - омертвение, гибель клеток и тканей в живом организме; при этом жизнедеятельность их полностью прекращается. Некротический процесс проходит ряд стадий, что позволяет говорить о морфогенезе некроза: 1) паранекроз - подобные некротическим, но обратимые изменения; 2) некробиоз - необратимые дистрофические изменения, характеризующиеся преобладанием катаболических реакций над анаболическими; 3) смерть клетки, время наступления которой установить трудно; 4) аутолиз - разложение мертвого субстрата под действием гидролитических ферментов погибших клеток и макрофагов. В морфологическом выражении некроз равнозначен аутолизу. Своеобразной формой некроза является апоптоз (от греч. аро - разделение и ptosis - опущение, падение). В основе апоптоза лежат разделение клетки на части с образованием апоптозных тел (фрагменты клетки, окруженные мембраной и способные к жизнедеятельности) и последующий фагоцитоз этих тел макрофагами.
Некробиотические и некротические процессы (некроз, апоптоз) происходят постоянно как проявление нормальной жизнедеятельности организма, так как отправление любой функции требует затрат материального субстрата, восполняемых физиологической регенерацией. Кроме того, большая часть клеток организма постоянно подвергается старению, естественной смерти с последующим их разрушением путем апоптоза и физиологического аутолиза.
Таким образом, в организме постоянно совершаются процессы физиологической деструкции, т.е. некротические, аутолитические и восстановительные, т.е. репаративные, регенераторные процессы, что обеспечивает нормальную его жизнедеятельность.
Некроз возникает чаще и раньше в функционально-активных паренхиматозных структурах (функционально отягощенные отделы миокарда, проксимальные и дистальные отделы почек, нейроны головного мозга и т.д.). Некрозу могут подвергаться часть клетки, клетка, группа клеток, участок ткани, органа, целый орган или часть тела. Поэтому в одних случаях он определяется лишь при микроскопическом исследовании, в других - хорошо различим невооруженным глазом.
Микроскопические признаки некроза. К ним относятся характерные изменения клетки и межклеточного вещества. Изменения клетки касаются как ядра, так и цитоплазмы. Ядро сморщивается, при этом проис-
ходит конденсация хроматина - кариопикноз (рис. 44, а), распадается на глыбки - кариорексис (рис. 44, б) и растворяется - кариолизис. Пикноз, рексис и лизис ядра являются последовательными стадиями процесса и отражают динамику активации гидролаз - рибонуклеазы и дезоксирибонуклеазы, что ведет к отщеплению от нуклеотидов фосфатных групп и высвобождению нуклеиновых кислот, которые подвергаются деполимеризации. В цитоплазме происходят денатурация и коагуляция белков, сменяемая обычно колликвацией, ультраструктуры ее погибают. Изменения могут охватывать часть клетки (фокальный коагуляционный некроз), которая отторгается, или всю клетку (коагуляция цитоплазмы). Коагуляция завершается плазморексисом - распадом цитоплазмы на глыбки. На заключительном этапе разрушение мембранных структур клетки ведет к ее гидратации, наступает гидролитическое расплавление цитоплазмы - плазмолиз. Расплавление в одних случаях охватывает всю клетку (цитолиз), в других - лишь часть ее (фокальный колликвационный некроз, или баллонная дистрофия) (см. рис. 28, б). При фокальном некрозе может произойти полное восстановление наружной мембраны клетки. Изменения цитоплазмы (коагуляция, плазморексис, плазмолиз), так же как и изменения ядра клетки, являются морфологическим выражением ферментативного процесса, в основе которого лежит активация гидролитических ферментов лизосом.
Рис. 44. Изменения ядра при некрозе:
а - кариопикноз; ядро (Я) уменьшено в размерах, кариоплазма высокой электронной плотности, ядрышко не дифференцируется; в цитоплазме много вакуолей (В), митохондрии (М) гомогенизированы, комплекс Гольджи (КГ) уменьшен в размерах; ЭС - эндоплазматическая сеть. Электронограмма. х17 500 (по В.Г. Шарову); б - кариорексис. Некроз фолликула селезенки при возвратном тифе
Изменения межклеточного вещества при некрозе охватывают как межуточное вещество, так и волокнистые структуры. Межуточное вещество вследствие деполимеризации его гликозаминогликанов и пропитывания белками плазмы крови набухает и расплавляется. Коллагеновые волокна также набухают, пропитываются белками плазмы (фибрин), превращаются в плотные гомогенные массы, распадаются или лизируются. Изменения эластических волокон подобны описанным выше: набухание, базофилия, распад, расплавление - эластолиз. Ретикулярные волокна нередко сохраняются в очагах некроза длительное время, но затем подвергаются фрагментации и глыбчатому распаду; аналогичны изменения и нервных волокон. Распад волокнистых структур связан с активацией специфических ферментов - коллагеназы и эластазы. Таким образом, в межклеточном веществе при некрозе чаще всего развиваются изменения, характерные для фибриноидного некроза. Реже они проявляются резко выраженными отеком и ослизнением ткани, что свойственно колликвационному некрозу. При некрозе жировой ткани преобладают липолитические процессы. Происходит расщепление нейтральных жиров с образованием жирных кислот и мыл, что ведет к реактивному воспалению, образованию липогранулем (см. Воспаление).
Итак, в динамике некротических изменений, особенно клетки, существует смена процессов коагуляции и колликвации, однако нередко отмечается преобладание одного из них, что зависит как от причины, вызвавшей некроз, и механизма его развития, так и от структурных особенностей органа или ткани, в которых некроз возникает.
При распаде клеток и межклеточного вещества в очаге некроза образуется тканевый детрит. Вокруг очага некроза развивается демаркационное воспаление.
При некрозе тканей изменяются их консистенция, цвет, запах. В одних случаях мертвая ткань становится плотной и сухой (мумификация), в других - дряблой и расплавляется (миомаляция, энцефаломаляция от греч. malakas - мягкий). Мертвая ткань нередко бывает бледной и имеет бело-желтый цвет. Таковы, например, очаги некроза в почках, селезенке, миокарде при прекращении притока крови, очаги некроза при действии микобактерий туберкулеза. Иногда, напротив, она пропитана кровью, имеет темно-красный цвет. Примером могут служить возникающие на фоне венозного застоя очаги циркуляторного некроза в легких. Фокусы некроза кожи, кишечника, матки часто приобретают грязно-бурый, серозеленый или черный цвет, так как пропитывающие их кровяные пигменты претерпевают ряд изменений. В некоторых случаях фокусы некроза прокрашиваются желчью. При гнилостном расплавлении мертвая ткань издает характерный дурной запах.
Классификация. Учитываются причина, вызывающая некроз, механизм развития, клинико-морфологические особенности.
В зависимости от причины некроза различают следующие его виды: травматический, токсический, трофоневротический, аллергический, сосудистый.
Травматический некроз является результатом прямого действия на ткань физических или химических факторов. Такой некроз возникает при воздействии радиации, низких (отморожение) и высоких (ожог) температур, в краях раневого канала, при электротравме. Токсический некроз развивается в результате действия на ткани токсинов как бактериального, так и небактериального происхождения, химических соединений различной природы (кислоты, щелочи, лекарственные препараты, этиловый спирт и др.). Таков, например, некроз эпителия проксимального отдела нефрона при отравлении сулемой, некроз кардиомиоцитов при воздействии дифтерийного экзотоксина. Трофоневротический некроз возникает при нарушениях нервной трофики тканей. В результате этих нарушений развиваются циркуляторные расстройства, дистрофические и некробиотические изменения, завершающиеся некрозом. Таковы некрозы при заболеваниях и травмах центральной и периферической нервной системы (незаживающие язвы при повреждении периферических нервов). Примером трофоневротического некроза являются пролежни.
Аллергический некроз ткани наступает в сенсибилизированном организме и является, как правило, выражением реакций гиперчувствительности немедленного типа. Обычно это фибриноидный некроз, часто встречающийся при инфекционно-аллергических и аутоиммунных заболеваниях. Классическим примером аллергического некроза может служить феномен Артюса. Сосудистый некроз, который называют инфарктом, возникает при нарушении или прекращении кровотока в артериях вследствие тромбоза, эмболии, длительного спазма (антиогенный некроз). Недостаточный приток крови вызывает ишемию, гипоксию и гибель ткани вследствие прекращения окислительно-восстановительных процессов (ишемический некроз). В развитии сосудистого некроза большое значение имеет функциональное напряжение органа в условиях недостаточности коллатерального кровообращения при сужении просвета основных артерий, питающих орган. Таковы, например, ишемические некрозы миокарда в условиях функциональной нагрузки при стенозирующем атеросклерозе венечных (коронарных) артерий сердца.
Механизм развития. Механизмы возникновения некроза сложны и определяются характером патогенных факторов, структурнофункциональными особенностями ткани, в которой развивается некроз, реактивностью организма, наследственно-конституциональными факторами. В зависимости от механизма действия патогенного фактора различают прямой некроз, обусловленный непосредственным воздействием (травматический и токсический некрозы), и непрямой некроз, возникающий опосредованно через сосудистую и нервно-эндокринную системы (трофоневротический, аллергический, сосудистый некрозы).
Во внутриутробном периоде и в детском возрасте преобладает прямой некроз, связанный с непосредственным воздействием инфекционного агента или токсического вещества на ткани (множественные ареактивные некрозы внутренних органов и слизистых оболочек у плодов, новорожденных и недоношенных при генерализованной ветряной оспе, генерали-
зованной оспенной вакцине, сепсисе, токсоплазмозе) или вследствие побочного токсического воздействия некоторых лекарственных препаратов (цитостатические средства, аминазин и др.). Непрямые некрозы, часто встречающиеся у взрослых, наблюдаются у детей в виде исключения при пороках развития сосудистого русла того или иного органа или нарушениях обмена электролитов.
Клинико-морфологические формы некроза выделяют, учитывая структурно-функциональные особенности органов и тканей, в которых возникает некроз, а также причины его возникновения и условия развития. Среди них различают коагуляционный некроз, колликвационный некроз, гангрену, секвестр, инфаркт.
Коагуляционный (сухой) некроз характеризуется тем, что возникающие при нем мертвые участки сухие, плотные, серо-желтого цвета. В основе сухого некроза лежат процессы денатурации белков с образованием труднорастворимых соединений, которые могут длительное время не подвергаться гидролитическому расщеплению, ткани при этом обезвоживаются. Условия для развития сухого некроза имеются прежде всего в тканях, богатых белками и бедных жидкостями. Примером могут служить восковидный, или ценкеровский (описан Ценкером), некроз мышц при инфекциях (брюшной и сыпной тифы), травме; творожистый некроз при туберкулезе, сифилисе, лепре, лимфогранулематозе; фибриноидный некроз при аллергических и аутоиммунных заболеваниях.
Колликвационный (влажный) некроз характеризуется расплавлением мертвой ткани, образованием кист. Развивается он в тканях, относительно бедных белками и богатых жидкостью, где существуют благоприятные условия для гидролитических процессов. Типичным влажным некрозом является очаг серого размягчения (ишемический инфаркт) головного мозга. При расплавлении масс сухого некроза говорят о вторичной колликвации.
Гангрена (от греч. gangraina - пожар) - некроз тканей, соприкасающихся с внешней средой, при этом ткани становятся серо-бурыми или черными, что связано с превращением кровяных пигментов в сульфид железа. Различают сухую и влажную гангрены.
При сухой гангрене мертвая ткань под воздействием воздуха высыхает, уплотняется, сморщивается, становится похожей на ткань мумий. Поэтому сухую гангрену называют также мумификацией (рис. 45). Сухая гангрена возникает в тканях,
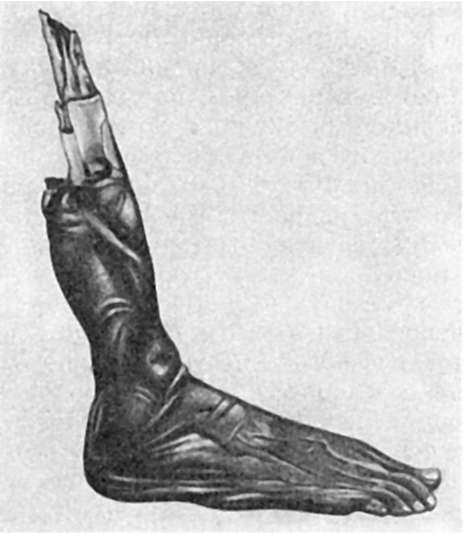 Рис. 45.
Сухая гангрена нижней конечности
Рис. 45.
Сухая гангрена нижней конечности
бедных влагой. Таковы сухая гангрена конечностей при атеросклерозе и тромбозе ее артерии (атеросклеротическая гангрена), при отморожении или ожоге, пальцев - при болезни Рейно или вибрационной болезни, кожи - при инфекциях (сыпной тиф), сопровождающихся глубокими нарушениями трофики, и т.д.
При влажной гангрене мертвая ткань подвергается действию, гнилостных микроорганизмов (Вас. perfringens, fusiformis, putrificans, histolyticus, proteus и др.), набухает, становится отечной, издает зловонный запах. Влажная гангрена развивается чаще в тканях, богатых влагой. Ее возникновению способствуют расстройства кровообращения (венозный застой) и лимфообращения (лимфостаз, отек). Влажная гангрена встречается в легких, осложняя воспалительные процессы (пневмонии), в кишечнике при непроходимости брыжеечных артерий (тромбоз, эмболия). У ослабленных инфекционным заболеванием (чаще корь) детей может развиться влажная гангрена мягких тканей щек, промежности, которую называют номой (от греч. nome - водяной рак).
От сухой и влажной гангрены следует отличать анаэробную гангрену, представляющую собой самостоятельное инфекционное заболевание, которое вызывается группой определенных микроорганизмов (прежде всего Вас. perfringens). Она возникает чаще при огнестрельных и других ранениях, сопровождающихся массивной деструкцией мышц и размозжением костей.
Как разновидность гангрены выделяют пролежни - омертвение поверхностных участков тела (кожа, мягкие ткани), подвергающихся давлению. Поэтому пролежни чаще появляются в области крестца, остистых отростков позвонков, большого вертела бедренной кости. По своему генезу это трофоневротический некроз, который возникает обычно у тяжелобольных, страдающих сердечно-сосудистыми, онкологическими, инфекционными или нервными болезнями.
Секвестр - участок мертвой ткани, который не подвергается аутолизу, не замещается соединительной тканью и свободно располагается среди живых тканей. Секвестры обычно возникают в костях при воспалении костного мозга - остеомиелите. Вокруг такого секвестра образуются секвестральная капсула и полость, заполненная гноем. Нередко секвестр выходит из полости через свищи, которые закрываются лишь после полного его выделения. Секвестрируются и мягкие ткани (например, участки некроза легкого, пролежня); такие секвестры, как правило, быстро расплавляются.
Инфаркт (от лат. infarcire - начинять, набивать) - это сосудистый (ишемический) некроз, следствие и крайнее выражение ишемии. Инфаркт - самый частый вид некроза.
Форма, величина, цвет и консистенция инфаркта могут быть различными. Чаще инфаркты бывают клиновидными (рис. 46-49), основание клина обращено к капсуле, а острие - к воротам органа. Они образуются в селезенке, почках, легких, что определяется характером ангио-
 Рис. 46.
Инфаркт селезенки:
Рис. 46.
Инфаркт селезенки:
а - ишемический инфаркт в виде светлого треугольного участка, обращенного основанием к капсуле; б - ангиорентгенограмма той же селезенки. Отсутствие сосудов в области инфаркта
архитектоники этих органов - магистральным типом ветвления их артерий. Реже инфаркты имеют неправильную форму (см. рис. 49). Такие инфаркты встречаются в сердце, мозге, кишечнике, т.е. в тех органах, где преобладает не магистральный, а рассыпной или смешанный тип ветвления артерий. Инфаркт может охватывать большую часть или весь орган (субтотальный или тотальный инфаркт) или обнаруживается лишь под микроскопом (микроинфаркт). Если инфаркт развивается по типу коагуляционного некроза, то ткань в области омертвения уплотняется, становится суховатой (инфаркт миокарда, почек, селезенки); если же инфаркт образуется по типу колликвационного некроза, она размягчается и разжижается (инфаркт мозга, кишки).
В зависимости от внешнего вида (в основном цвета) различают три вида инфаркта: белый, белый с геморрагическими венчиком и красный.
Белый (ишемический) инфаркт представляет собой участок бело-желтого цвета, хорошо отграниченный от окружающей ткани (рис. 46). Обычно он возникает в участках с недостаточным коллатеральным кровообращением. Особенно часто встречается в селезенке, почках.
Белый инфаркт с геморрагическим венчиком представлен участком беложелтого цвета, но этот участок окружен зоной кровоизлияний (рис. 47 и 49).
 Рис. 47.
Инфаркт почки:
Рис. 47.
Инфаркт почки:
а - белый инфаркт почки с геморрагическим венчиком (вид на разрезе); б - ангиорентгенограмма той же почки. Отсутствие сосудов в области инфаркта
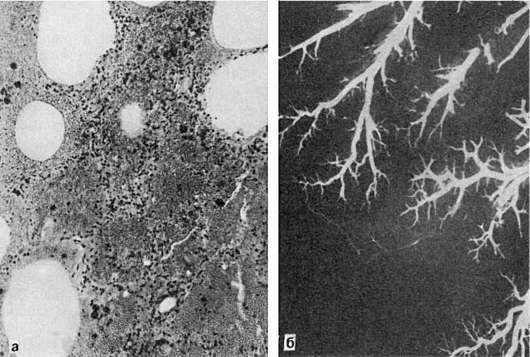 Рис. 48.
Геморрагический инфаркт легкого:
Рис. 48.
Геморрагический инфаркт легкого:
а - альвеолы заполнены кровью; б - ангиорентгенограмма легкого
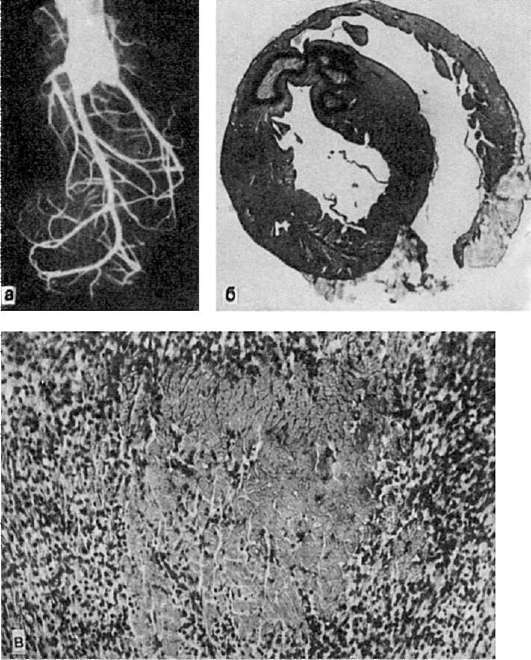 Рис. 49.
Инфаркт миокарда:
Рис. 49.
Инфаркт миокарда:
а - ангиорентгенограмма сердца кролика, у которого был воспроизведен инфаркт миокарда (перевязка нисходящей ветви левой венечной артерии); сосуды зоны ишемии не инъецированы; б - фокусы ишемического инфаркта, окруженные зоной геморрагий; в - участок некроза миокарда, окруженный грануляционной тканью
Она образуется в результате того, что спазм сосудов по периферии инфаркта сменяется паретическим их расширением и развитием кровоизлияний. Такой инфаркт находят в почках, миокарде.
При красном (геморрагическом) инфаркте участок омертвения пропитан кровью, он темно-красный и хорошо отграничен (см. рис. 48). Благоприятным условием для такого геморрагического пропитывания является венозный застой. Определенное значение для развития красного инфаркта имеют и особенности ангиоархитектоники органа (анастомозы между бронхиальной и легочной артериями). Встречается геморрагический инфаркт, как правило, в легких, редко - в кишечнике, селезенке, почках.
Наибольшее клиническое значение имеют инфаркты сердца (миокарда), головного мозга, легких, почек, селезенки, кишечника.
В сердце инфаркт обычно белый с геморрагическим венчиком, имеет неправильную форму, встречается чаще в левом желудочке и межжелудочковой перегородке (рис. 49), крайне редко - в правом желудочке и предсердиях. Омертвение может локализоваться под эндокардом (субэндокардиальный инфаркт), эпикардом (субэпикардиальный инфаркт) или охватывать всю толщу миокарда (трансмуральный инфаркт). В области инфаркта на эндокарде нередко образуются тромботические, а на перикарде - фибринозные наложения, что связано с развитием реактивного воспаления вокруг участков некроза. Чаще всего инфаркт миокарда встречается на фоне атеросклероза и гипертонической болезни и рассматривается как самостоятельное заболевание (см. Ишемическая болезнь сердца).
В головном мозге чаще возникает белый инфаркт, который быстро размягчается (очаг серого размягчения мозга, рис. 50). Если инфаркт образуется на фоне значительных расстройств кровообращения, венозного застоя, то очаг омертвения мозга пропитывается кровью и становится красным (очаг красного размягчения мозга). Инфаркт локализуется обычно в подкорковых узлах, разрушая проводящие пути мозга, что проявляется параличами. Инфаркт мозга, как и инфаркт миокарда, чаще всего встречается на фоне атеросклероза и гипертонической болезни и является одним из проявлений цереброваскулярных заболеваний.
В легких в подавляющем большинстве случаев образуется геморрагический инфаркт (см. рис. 48). Он хорошо отграничен, имеет форму конуса, основание которого обращено к плевре. На плевре в области инфаркта появляются наложения фибрина (реактивный плеврит). У острия конуса, обращенного к корню легкого, нередко обнаруживается тромб или эмбол в ветви легочной артерии. Омертвевшая ткань плотна, зерниста, темно-красного цвета.
Геморрагический инфаркт легких обычно возникает на фоне венозного застоя, причем развитие его в значительной мере определяется особенностями ангиоархитектоники легких, наличием анастомозов между системами легочной и бронхиальных артерий. В условиях застойного полнокровия и закрытия просвета ветви легочной артерии в область
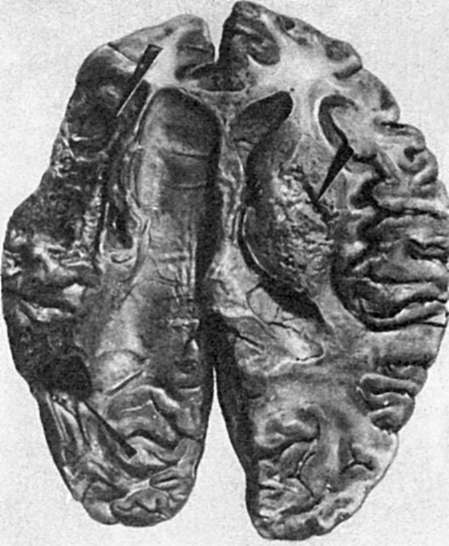 Рис. 50.
Очаг размягчения (справа) и киста (слева) в головном мозге (показано стрелками)
Рис. 50.
Очаг размягчения (справа) и киста (слева) в головном мозге (показано стрелками)
омертвения ткани легкого из бронхиальной артерии поступает кровь, которая разрывает капилляры и изливается в просвет альвеол. Вокруг инфаркта нередко развивается воспаление легочной ткани (периинфарктная пневмония). Массивный геморрагический инфаркт легкого может быть причиной надпеченочной желтухи. Белый инфаркт в легких - исключительная редкость. Возникает он при склерозе и облитерации просвета бронхиальных артерий.
В почках инфаркт, как правило, белый с геморрагическим венчиком, конусовидный участок некроза охватывает либо корковое вещество, либо всю толщу паренхимы (см. рис. 47). При закрытии основного артериального ствола развивается тотальный или субтотальный инфаркт почки. Своеобразной разновидностью инфарктов являются симметричные некрозы коркового вещества почек, ведущие к острой почечной недостаточности. Развитие ишемических инфарктов почек связано обычно с тромбоэмболией, реже - с тромбозом ветвей почечной артерии, осложняющим ревматизм, затяжной септический эндокардит, гипертоническую болезнь, ишемическую болезнь сердца. Редко при тромбозе почечных вен возникает венозный инфаркт почек.
В селезенке встречаются белые инфаркты (см. рис. 46), нередко с реактивным фибринозным воспалением капсулы и последующим образованием спаек с диафрагмой, париетальным листком брюшины, петлями кишечника. Ишемические инфаркты селезенки связаны с тромбозом и эмболией. При тромбозе селезеночной вены иногда образуются венозные инфаркты.
В кишечнике инфаркты геморрагические и нередко подвергаются гангренозному распаду, что ведет к прободению стенки кишки и развитию перитонита.
Редко инфаркты встречаются в сетчатке глаза, печени, мышцах, костях.
Причины развития инфаркта - длительный спазм, тромбоз или эмболия артерии, а также функциональное напряжение органа в условиях недостаточного его кровоснабжения. Огромное значение для возникновения инфаркта имеет недостаточность анастомозов и коллатералей, которая зависит от степени поражения стенок артерий и сужения их просветов (атеросклероз, облитерирующий эндартериит), от степени нарушения кровообращения (например, венозного застоя) и от уровня выключения артерии тромбом или эмболом.
Поэтому инфаркты возникают обычно при тех заболеваниях, для которых характерны тяжелые изменения артерий и общие расстройства кровообращения (ревматические болезни, пороки сердца, атеросклероз, гипертоническая болезнь, затяжной септический эндокардит). Острой недостаточностью коллатерального кровообращения обусловлено и развитие инфаркта при функциональном отягощении органа, обычно сердца, кровообращение которого нарушено. С недостаточностью анастомозов и коллатералей связано развитие венозных инфарктов при тромбозе
вен в условиях застойного полнокровия. Для возникновения инфаркта большое значение имеет также состояние тканевого обмена, т.е. метаболический фон, на котором развивается ишемический инфаркт. Обмен веществ в органах и тканях, в которых возникает инфаркт, как правило, нарушен в связи с гипоксией, обусловленной общими расстройствами кровообращения. Лишь закупорка крупных магистральных артерий может привести к омертвению без предшествующих расстройств кровообращения и метаболических нарушений в ткани.
Исход инфаркта. Исход зависит от особенностей причинного фактора и заболевания, которое осложняет инфаркт, от состояния организма и органа, в котором он развивается, и от размеров инфаркта.
Небольшие фокусы ишемического некроза могут подвергаться аутолизу с последующей полной регенерацией. Наиболее частый благоприятный исход инфаркта, развивающегося по типу сухого некроза, - его организация и образование рубца (рис. 51). Организация инфаркта может завершиться его петрификацией или гемосидерозом, если речь идет об организации геморрагического инфаркта. На месте инфаркта, развивающегося по типу колликвационного некроза, например в мозге, образуется киста.
Неблагоприятный исход инфаркта - его гнойное расплавление, которое обычно связано с тромбобактериальной эмболией при сепсисе.
Значение инфаркта. Для организма значение инфаркта чрезвычайно велико и прежде всего потому, что инфаркт - это ишемический некроз. Все, что было сказано о значении некроза, относится и к инфаркту. Однако важно отметить, что инфаркт является одним из самых частых и
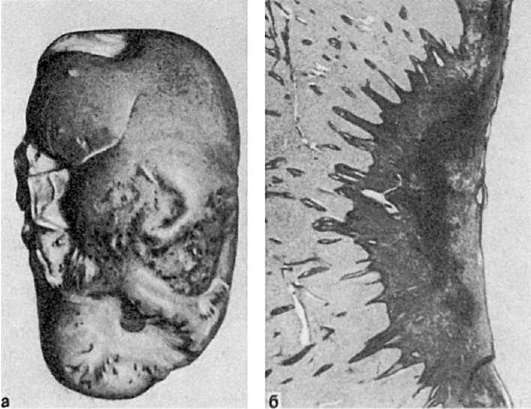 Рис. 51.
Организация инфаркта:
Рис. 51.
Организация инфаркта:
а - втянутые рубцы на поверхности почки после заживления инфаркта; б - рубец на месте инфаркта в селезенке (лупа)
грозных осложнений ряда сердечно-сосудистых заболеваний. Это прежде всего атеросклероз и гипертоническая болезнь. Необходимо отметить также, что инфаркты при атеросклерозе и гипертонической болезни наиболее часто развиваются в жизненно важных органах - сердце и головном мозге, и это определяет высокий процент случаев скоропостижной смерти и инвалидизации. Медико-социальное значение инфаркта миокарда и его последствий позволило выделить его как проявление самостоятельного заболевания - ишемической болезни сердца.
Исход некроза. При благоприятном исходе вокруг омертвевших тканей возникает реактивное воспаление, которое отграничивает мертвую ткань. Такое воспаление называется демаркационным, а зона отграничения - демаркационной зоной. В этой зоне кровеносные сосуды расширяются, возникают полнокровие, отек, появляется большое число лейкоцитов, которые высвобождают гидролитические ферменты и расплавляют (рассасывают) некротические массы. Вслед за этим размножаются клетки соединительной ткани, которая замещает или обрастает участок некроза. При замещении мертвых масс соединительной тканью говорят об их организации. На месте некроза в таких случаях образуется рубец (рубец на месте инфаркта - см. рис. 51). Обрастание участка некроза ведет к его инкапсуляции (рис. 52). В мертвые массы при сухом некрозе и в очаг омертвения, подвергшийся организации, могут откладываться соли кальция. В этом случае развивается обызвествление (петрификация) очага некроза (см. Минеральные дистрофии). В некоторых случаях в участке омертвения отмечается образование кости - оссификация. При рассасывании тканевого детрита и формировании капсулы, что встречается обычно при влажном некрозе и чаще всего в головном мозге, на месте омертвения появляется полость - киста (см. рис. 50).
Неблагоприятный исход некроза - гнойное расплавление очага омертвения. Таково гнойное расплавление инфарктов при сепсисе (такие инфаркты называют септическими). В исходе некроза на ранних этапах внутриутробного развития возникает порок органа, части тела.
Значение некроза. Оно определяется его сущностью - «местной смертью», поэтому некроз жизненно важных органов нередко ведет к смерти. Таковы инфаркты миокарда, ишемические некрозы головного мозга, некрозы коркового
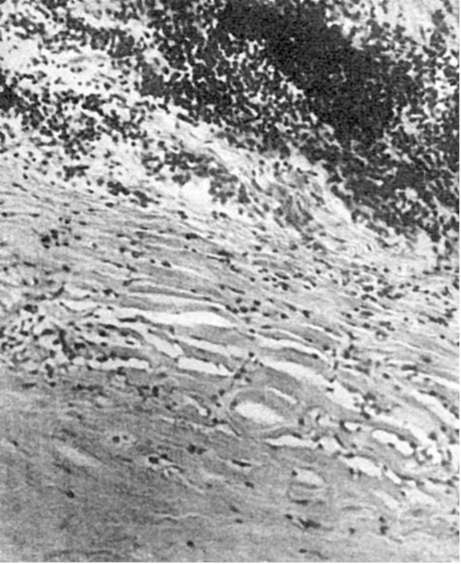 Рис. 52.
Участок некроза (внизу), окруженный фиброзной капсулой (инкапсуляция некроза)
Рис. 52.
Участок некроза (внизу), окруженный фиброзной капсулой (инкапсуляция некроза)
вещества почек, прогрессирующий некроз печени, острый панкреонекроз. Нередко омертвение ткани является причиной тяжелых осложнений многих заболеваний (разрыв сердца при миомаляции, параличи при гипертоническом инсульте, инфекции при массивных пролежнях и т.д.), а также интоксикации в связи с воздействием на организм продуктов тканевого распада (например, при гангрене конечности). Гнойное расплавление очага омертвения может быть причиной гнойного воспаления серозных оболочек, кровотечения, сепсиса. При так называемом благоприятном исходе некроза его последствия бывают весьма значительными, если он имел место в жизненно важных органах (киста в головном мозге, рубец в миокарде).
Смерть, признаки смерти, посмертные изменения
Смерть как биологическое понятие является выражением необратимого прекращения жизнедеятельности организма. С наступлением смерти человек превращается в мертвое тело, труп (cadaver).
В зависимости от причины, ведущей к наступлению смерти, различают естественную (физиологическую), насильственную и смерть от болезней.
Естественная смерть наступает у людей старческого возраста и долгожителей в результате естественного (физиологического) изнашивания организма (физиологическая смерть). Срок жизни человека не установлен, однако, если руководствоваться продолжительностью жизни долгожителей нашей планеты, он может составлять 150 лет и больше.
Понятен интерес к проблеме старости и старения, которой занимается особая отрасль медико-биологической науки - геронтология (от греч. geron - старый и logos - учение), и к заболеваниям старческого возраста, изучаемым гериатрией (от греч. geron - старый и iatreia - лечение), являющейся разделом геронтологии.
Насильственная смерть наблюдается в результате таких действий (умышленных или неумышленных), как убийство, самоубийство, смерть от различного рода травм (например, уличная, производственная или бытовая травма), несчастных случаев (например, транспортная катастрофа). Насильственная смерть, являясь социально-правовой категорией, изучается судебной медициной и органами юстиции.
Смерть от болезней возникает в результате несовместимости жизни с теми изменениями в организме, которые вызваны патологическими (болезненными) процессами. Обычно смерть от болезни наступает медленно и сопровождается постепенным угасанием жизненных функций. Но иногда смерть наступает неожиданно, как бы среди полного здоровья - внезапная, или скоропостижпая смерть. Наблюдается она при скрыто протекающем или достаточно компенсированном заболевании, при котором внезапно развивается смертельное осложнение (обильное кровотечение при разрыве аневризмы аорты, острая ишемия миокарда при тромбозе венечной артерии сердца, кровоизлияние в мозг при гипертонической болезни и т.д.).
В зависимости от развития обратимых или необратимых изменений
жизнедеятельности организма различают смерть клиническую и биологическую.
Клиническая смерть характеризуется остановкой дыхания и кровообращения, однако эти изменения жизнедеятельности организма в течение нескольких минут (время переживания коры головного мозга) обратимы. В основе клинической смерти лежит своеобразное гипоксическое состояние (прежде всего ЦНС) в связи с прекращением кровообращения и отсутствием центральной его регуляции.
Наступлению клинической смерти предшествует агония (от греч. agon - борьба), отражающая некоординированную деятельность гомеостатических систем в терминальном периоде (аритмии, паралич сфинктеров, судороги, отек легких). Поэтому агонию, которая может длиться от нескольких минут до нескольких часов, относят к так называемым терминальным состояниям, заканчивающимся клинической смертью. При терминальных состояниях (агония, шок, кровопотеря и т.д.) и клинической смерти используют комплекс реанимационных (от лат. re и animatio - оживление) мероприятий. Основные закономерности угасания и восстановления жизненных функций человека изучает особый раздел медицины, называемый реаниматологией.
Биологическая смерть - необратимые изменения жизнедеятельности организма, начало аутолитических процессов. Однако гибель клеток и тканей при наступлении биологической смерти происходит не одновременно. Первой погибает ЦНС; уже через 5-6 мин после остановки дыхания и кровообращения происходит разрушение ультраструктурных элементов паренхиматозных клеток головного и спинного мозга. В других органах и тканях (кожа, почки, сердце, легкие и т.д.) этот процесс растягивается на несколько часов и даже суток, общая структура многих органов и тканей, наблюдаемая после смерти под световым микроскопом, довольно долго сохраняется, лишь при электронно-микроскопическом исследовании отмечается деструкция ультраструктур клеток. Поэтому патологоанатом, изучая микроскопически материал, взятый от трупа, может судить о характере патологических изменений органов и тканей.
В связи с тем что после смерти гибель многих органов и тканей растягивается на сравнительно долгое время, материал, взятый от трупа, используют для трансплантации (пересадки) органов и тканей. В настоящее время в клинической практике широко применяются трупная кровь для переливания, консервированные ткани (роговица, кожа, кости, сосуды) и органы (почка) трупа для трансплантации.
Вскоре после наступления биологической смерти появляется ряд признаков смерти и посмертных изменений: охлаждение трупа; трупное окоченение; трупное высыхание; перераспределение крови; трупные пятна; трупное разложение.
Охлаждение трупа (algor mortis) развивается в связи с прекращением после смерти выработки в теле тепла и выравниванием температуры
мертвого тела и окружающей среды. Если перед смертью у больного была очень высокая температура или в длительном атональном периоде наблюдались судороги, то охлаждение трупа происходит медленно. В ряде случаев (смерть от столбняка, отравления стрихнином) в ближайшие часы после смерти температура трупа может повышаться.
Трупное окоченение (rigor mortis) выражается в уплотнении произвольных и непроизвольных мышц. Оно обусловлено исчезновением после смерти из мышц аденозинтрифосфорной кислоты и накоплением в них молочной кислоты. Трупное окоченение развивается обычно через 2-5 ч после смерти и к концу суток охватывает всю мускулатуру. Сначала окоченению подвергаются жевательные и мимические мышцы лица, затем мышцы шеи, туловища и конечностей. Мышцы становятся плотными: чтобы согнуть в суставе конечность, приходится применять значительное усилие. Трупное окоченение сохраняется в течение 2-3 сут, а затем исчезает (разрешается) в той же последовательности, в какой и возникает. При насильственном разрушении трупного окоченения оно вновь не появляется.
Трупное окоченение сильно выражено и развивается быстро у лиц с хорошо развитой мускулатурой, а также в тех случаях, когда смерть наступает при судорогах (например, при столбняке, отравлении стрихнином). Слабо выражено трупное окоченение у стариков и детей, у лиц, истощенных и умерших от сепсиса; у недоношенных плодов трупное окоченение отсутствует. Низкая температура окружающей среды затрудняет наступление трупного окоченения и удлиняет сроки его существования, высокая температура ускоряет разрешение трупного окоченения.
Трупное высыхание возникает вследствие испарения влаги с поверхности тела. Оно может ограничиваться отдельными участками, но высыханию может подвергнуться и весь труп (мумификация трупа). Прежде всего высыхание затрагивает кожные покровы, глазные яблоки, слизистые оболочки. С высыханием связано помутнение роговиц, появление на склере при открытой глазной щели сухих буроватых пятен треугольной формы; основание этих пятен обращено к роговице, а вершина - к углу глаза. Слизистые оболочки становятся сухими, плотными, буроватого цвета. На коже сухие, желто-бурые, пергаментного вида пятна появляются прежде всего в местах мацерации или повреждений эпидермиса. Так называемые пергаментные пятна от высыхания могут быть приняты за прижизненные ссадины и ожоги.
Перераспределение крови в трупе выражается в переполнении кровью вен, тогда как артерии оказываются почти пустыми. В венах и полостях правой половины сердца происходит посмертное свертывание крови. Образующиеся посмертные сгустки крови имеют желтую или красную окраску, гладкую поверхность, эластическую консистенцию (тянутся) и лежат свободно в просвете или камере сердца, что отличает их от тромбов. При быстром наступлении смерти посмертных сгустков бывает мало, при медленном - много.
При смерти в состоянии асфиксии (например, асфиксия новорожденных) кровь в трупе не свертывается. Со временем наступает трупный гемолиз.
Трупные пятна возникают в связи с перераспределением крови в трупе и зависят от его положения. В силу того что кровь стекает в вены нижележащих частей тела и там накапливается, через 3-6 ч после наступления смерти образуются трупные гипостазы. Они имеют вид темно-фиолетовых пятен и при надавливании бледнеют. Трупные гипостазы отсутствуют в участках тела, подвергающихся давлению (область крестца, лопаток при положении трупа на спине). Они хорошо выражены при смерти от заболеваний, ведущих к общему венозному застою, и плохо - при малокровии, истощении.
В последующем, когда наступает посмертный гемолиз эритроцитов, область трупных гипостазов пропитывается диффундирующей из сосудов и окрашенной гемоглобином плазмой крови. Возникают поздние трупные пятна, или трупная имбибиция. Эти пятна имеют красно-розовую окраску и не исчезают при надавливании.
Трупное разложение связано с процессами аутолиза и гниения трупа. Посмертный аутолиз раньше возникает и интенсивнее выражен в железистых органах (печень, поджелудочная железа, желудок), клетки которых богаты гидролитическими (протеолитическими) ферментами. Очень рано возникает посмертное самопереваривание поджелудочной железы. В связи с активностью желудочного сока происходит посмертное самопереваривание желудка (гастромаляция). При забрасывании желудочного содержимого в пищевод возможно самопереваривание его стенки (эзофагомаляция), а при аспирации желудочного содержимого в дыхательные пути - «кислое» размягчение легких (pneumomalacia acida).
К посмертному аутолизу быстро присоединяются гнилостные процессы в связи с размножением гнилостных бактерий в кишечнике и последующим заселением ими тканей трупа.
Гниение усиливает посмертный аутолиз, ведущий к расплавлению тканей, которые окрашиваются в грязно-зеленый цвет (от действия сероводорода на продукты распада гемоглобина образуется сульфид железа) и издают дурной запах.
Газы, образующиеся при гниении трупа, раздувают кишечник, проникают в ткани и органы, которые приобретают пенистый вид, и при ощупывании слышна крепитация (трупная эмфизема). Быстрота трупного аутолиза и гниения зависит от температуры окружающей среды. В связи с этим трупы хранят в холодильных камерах. Приостанавливает трупное разложение и бальзамирование, с помощью которого можно сохранять трупы длительное время. Однако бальзамирование изменяет внешний вид органов и затрудняет оценку характера их изменений при патологоанатомическом или судебно-медицинском исследовании.
Тема 4. Некроз, апоптоз и атрофия
4.1. Некроз
Необходимо знать, что смерть клетки - постоянное проявление жизнедеятельности организма и в здоровом состоянии оно сбалансировано физиологической регенерацией клеток. Как структурные компоненты клеток, так и целые клетки изнашиваются, стареют, гибнут и требуют замены. Поддержание различных органов и тканей в здоровом состоянии невозможно без “естественного” физиологического обновления, а следовательно без смерти отдельных клеток. Такая смерть клеток получила в 1972 году название “апоптоз”. Апоптоз - это запрограммированная смерть клетки . Но смерть клетки может происходить в живом организме в результате “насильственных” действий внешних повреждающих (патогенных) факторов. Такая смерть клетки носит название “некроз”. Мертвые клетки полностью прекращают свое функционирование. Гибель клетки сопровождается необратимыми биохимическими и структурными изменениями.
Таким образом, смерть клетки может происходить двумя путями: некроза и апоптоза . Некроз (от греч. nekros - мертвый) - омертвение, гибель клеток и тканей в живом организме под воздействием болезнетворных факторов. Этот вид гибели клеток генетически не контролируется.
Причины некроза . Факторы вызывающие некроз:
-физические
(огнестрельное ранение, радиация, электричество, низкие и высокие температуры -
отморожение и ожог);
-токсические
(кислоты, щелочи, соли тижелых металлов, ферменты,
лекарственные препараты, этиловый спирт и др.);
-биологические
(бактерии, вирусы, простейшие и др.);
-аллергические
(эндо- и экзоантигены, например, фибриноидный
некроз при инфекционно-аллергических и аутоиммунных заболеваниях, феномен
Артюса);
-сосудистый
(инфаркт - сосудистый некроз);
-трофоневротический
(пролежни, незаживающие язвы).
В зависимости от механизма действия патогенного фактора различают:
-прямой
некроз
, обусловленный непосредственным действием фактора (травматические,
токсические и биологические некрозы),
-непрямой некроз
, возникающий опосредованно через сосудистую и
нервно-эндокринную системы (аллергические, сосудистые и трофоневротические
некрозы).
Морфологические признаки некроза
Некрозу предшествует период некробиоза, морфологическим субстратом которого являются дистрофические изменения.
A. Ранние изменения: В начальном периоде некробиоза клетка морфологически не изменена. Должно пройти 1-3 часа, прежде чем появятся изменения, распознаваемые при электронной микроскопии или гистохимически, и по крайней мере 6-8 часов, прежде чем появятся изменения, выявляемые при световой микроскопии; еще позже развиваются макроскопические изменения. Например, если больной с инфарктом миокарда умирает спустя несколько минут от момента начала приступа стенокардии (боль при недостаточном притоке крови к миокарду), то на аутопсии не будет выявлено никакого структурного свидетельства некроза; если же смерть наступает на 2-й день после острого приступа, то изменения будут очевидны.
Б. Гистохимические изменения: приток ионов кальция в клетку тесно связан с необратимым повреждением и появлением морфологических проявлений некроза. В нормальной клетке внутриклеточная концентрация кальция составляет приблизительно 0.001 от концентрации его во внеклеточной жидкости. Этот градиент поддерживается мембраной клетки, которая активно транспортирует ионы кальция из клетки. Экспериментально доказано, что при повреждении клеток в результате ишемии или под воздействии различных токсических агентов, накопление кальция внутри клеток наблюдается только тогда, когда изменения необратимы. Кальций активирует эндонуклеазы (гидролиз, расщепление ДНК), фосфолипазы (разрушение мембран) и протеазы (деструкция, переваривание цитоскелета). Повышение их активности выявляется гистохимическими методами. Активность окислительно-восстановительных ферментов (например, сукцинатдегидрогеназы) резко падает или исчезает.
B. Изменения в ядрах: изменения в ядрах - самое лучшее свидетельство некроза клетки. Хроматин мертвой клетки конденсируется в крупные глыбки и ядро становится уменьшенным в объеме, сморщенным, плотным, интенсивно базофильным, то есть окрашивается в темно-синий цвет гематоксилином. Этот процесс назван пикнозом (сморщиванием). Пикнотическое ядро может затем разрываться на многочисленные маленькие базофильные частицы (кариорексис ) или подвергнуться лизису (растворению) в результате действия лизосомальной дезоксирибонуклеазы (кариолизис ). Тогда оно увеличивается в объеме, слабо окрашивается гематоксилином, постепенно теряются контуры ядра. При быстро развивающемся некрозе ядро подвергается лизису без пикнотической стадии.
Г. Цитоплазматические изменения: приблизительно через 6 часов после того, как клетка подверглась некрозу, цитоплазма ее становится гомогенной и выраженно ацидофильной, то есть окрашивается интенсивно кислыми красителями, например, в розовый цвет при окраске эозином. Это- первое изменение, выявляемое световой микроскопией, которое возникает в результате коагуляции цитоплазматических белков и разрушения (исчезновения) рибосом. РНК рибосом придает базофильный оттенок нормальной цитоплазме. Специализированные органеллы клетки, например, миофибриллы в миокардиальных клетках, исчезают в первую очередь. Набухание митохондрий и деструкция (разрушение) мембран органелл вызывают вакуолизацию цитоплазмы. Наконец, переваривание клетки ферментами, которые высвобождаются из собственных лизосом, вызывает лизис клетки (аутолиз). Таким образом, в цитоплазме происходит коагуляция белков , сменяемая обычно их колликвацией.
Д. Изменения межклеточного вещества охватывают как межуточное вещество, так и волокнистые структуры. Чаще всего развиваются изменения, характерные для фибриноидного некроза: коллагеновые, эластические и ретикулиновые волокна превращаются в плотные, гомогенные розовые, иногда базофильные массы, которые могут подвергаться фрагментации, глыбчатому распаду либо лизироваться. Реже может наблюдаться отек, лизис и ослизнение волокнистых структур, что свойственно колликвационному некрозу.
Клинико-морфологические формы некроза
Некроз проявляется различными клиническими и морфологическими изменениями. Различия зависят от структурно-функциональных особенностей органов и тканей, скорости и типа некроза, а также причины его возникновения и условий развития. Среди клинико-морфологических форм некроза различают коагуляционный (сухой) некроз и колликвационный (влажный) некроз.
А. Коагуляционный (сухой) некроз: при этом типе некроза погибшие клетки сохраняют свои очертания в течение нескольких дней. Клетки, лишенные ядра, выглядят как масса коагулированной, гомогенной, розовой цитоплазмы.
Механизм коагуляционного некроза недостаточно ясен. Коагуляция цитоплазматических белков делает их резистентными к действию лизосомальных ферментов и в связи с этим замедляется их разжижение.
Коагуляционный некроз обычно происходит в органах, богатых белками и бедных жидкостями , например, в почках, миокарде, надпочечниках, селезенке, обычно в результате недостаточного кровообращения и аноксии, действия физических, химических и других повреждающих факторов, например, коагуляционный некроз клеток печени (рис. 6.1) при вирусном поражении или при действии токсических агентов бактериального и небактериального генеза. Коагуляционный некроз еще называют сухой , поскольку он характеризуется тем, что возникающие при нем мертвые участки сухие, плотные, крошащиеся, белого или желтого цвета.
К коагуляционному некрозу относят:
-инфаркт - разновидность сосудистого (ишемического) некроза внутренних органов (кроме мозга). Это самый частый вид некроза.
-казеозный (творожистый) некроз развивается и при туберкулезе, сифилисе, лепре, а также при лимфогрануломатозе. Его еще называют специфическим, поскольку чаще всего встречается при специфических инфекционных гранулемах. Во внутренних органах выявляется ограниченный участок ткани сухой, крошащийся, беловато-желтого цвета. В сифилитических гранулемах очень часто такие участки не крошащиеся, а пастообразные, напоминают аравийский клей. Это смешанный (то есть экстра- и интрацеллюлярный) тип некроза, при котором одновременно гибнет и паренхима, и строма (и клетки, и волокна). Микроскопически такой участок ткани бесструктурный, гомогенный, окрашен гематоксилином и эозином в розовый цвет, хорошо видны глыбки хроматина ядер (кариорексис).
-восковидный, или ценкеровский некроз (некроз мышц, чаще передней брюшной стенки и бедра, при тяжелых инфекциях - брюшном и сыпном тифах, холере);
-фибриноидный некроз - тип некроза соединительной ткани.Наиболее часто он наблюдается при аллергических и аутоиммунных болезнях (например, ревматизме, ревматоидном артрите и системной красной волчанке). Наиболее сильно повреждаются коллагеновые волокна и гладкая мускулатура средней оболочки кровеносных сосудов. Фибриноидный некроз артериол наблюдается при злокачественной гипертензии. Фибриноидный некроз характеризуется потерей нормальной структуры и накоплением гомогенного, ярко-розового некротического материала, который похож микроскопически на фибрин. Обратите внимание, что понятие "фибриноидный" отличается от понятия "фибринозный", так как последнее обозначает накопление фибрина, например, при свертывании крови или при воспалении. Участки фибриноидного некроза содержат различное количество иммуноглобулинов и комплемента, альбуминов, продуктов распада коллагена и фибрина.
-жировой некроз:
1. Ферментный жировой некроз: жировой некроз наиболее часто происходит при остром панкреатите и повреждениях пожделудочной железы, когда панкреатические ферменты выходят из протоков в окружающие ткани. Панкреатическая липаза действует на триглицериды в жировых клетках, расщепляя их на глицерин и жирные кислоты, которые, взаимодействуя с плазменными ионами кальция, образуют мыла кальция. При этом в жировой ткани, окружающей поджелудочную железу, появляются непрозрачные, белые (как мел) бляшки и узелки (стеатонекроз).
При панкреатитах возможно попадание липазы в кровоток с последующим широким распространением, что является причиной жирового некроза во многих участках организма. Наиболее часто повреждаются подкожная жировая клетчатка и костный мозг.
2. Неферментный жировой некроз: неферментный жировой некроз наблюдается в молочной железе, подкожной жировой ткани и в брюшной полости. Большинство пациентов имеют в анамнезе травмы. Неферментный жировой некроз называют также травматическим жировым некрозом, даже если травма не определена как основная причина. Неферментный жировой некроз вызывает воспалительный ответ, характеризуемый наличием многочисленных макрофагов с пенистой цитоплазмой, нейтрофилов и лимфоцитов. Затем следует фиброзирование, при этом данный процесс бывает трудно отличить от опухоли.
-гангрена (от греч. gangraina - пожар): это некроз тканей, сообщающихся с внешней средой и изменяющихся под ее воздействием. Термин "гангрена" широко используется для обозначения клинико-морфологического состояния, при котором некроз ткани зачастую осложняется вторичной бактериальной инфекцией различной степени выраженности либо, находясь в соприкосновении с внешней средой, претерпевает вторичные изменения. Различают сухую, влажную, газовую гангрены и пролежни.
1. Сухая гангрена - это некроз тканей, соприкасающихся с внешней средой, протекающий без участия микроорганизмов. Сухая гангрена наиболее часто возникает на конечностях в результате ишемического коагуляционного некроза тканей. Некротизированные ткани кажутся черными, сухими, они четко отграничены от смежной жизнеспособной ткани. На границе со здоровыми тканями возникает демаркационное воспаление. Изменение цвета обусловлено превращением гемоглобиногенных пигментов в присутствии сероводорода в сульфид железа. Примерами может служить сухая гангрена :
Конечности
при атеросклерозе и тромбозе ее артерий (атеросклеротическая гангрена
),
облитерирующем эндартериите;
-при отморожении или ожоге;
-пальцев при болезни Рейно или вибрационной болезни;
-кожи при сыпном тифе и др. инфекциях.
Лечение состоит в хирургическом удалении мертвой ткани, ориентиром при этом служит демаркационная линия.
2. Влажная гангрена : развивается в результате наслоения на некротические изменения ткани тяжелой бактериальной инфекции. Под действием ферментов микроорганизмов возникает вторичная колликвация. Лизис клетки ферментами, которые возникают не в самой клетке, а проникают извне, называется гетеролизисом . Тип микроорганизмов зависит от локализации гангрены. Влажная гангрена развивается обычно в тканях, богатых влагой. Она может встречаться на конечностях, но чаще - во внутренних органах, например, в кишечнике при непроходимости брыжеечных артерий (тромбоз, эмболия), в легких как осложнение пневмонии (грипп, корь). У ослабленных инфекционным заболеванием (чаще корью) детей может развиться влажная гангрена мягких тканей щек, промежности, которую называют номой (от греч. nome - водяной рак). Острое воспаление и рост бактерий являются причиной того, что некротическая область становится отечной и красно-черной, с обширным разжижением мертвой ткани. При влажной гангрене может возникнуть распространяющееся некротизирующее воспаление, которое не четко ограничено от смежной здоровой ткани и, таким образом, трудно поддается хирургическому лечению. В результате жизнедеятельности бактерий возникает специфический запах. Очень высок процент летальности.
3. Газовая гангрена : газовая гангрена возникает при инфицировании раны анаэробной флорой, например, Clostridium perfringens и другими микроорганизмами этой группы. Она характеризуется обширным некрозом ткани и образованием газов в результате ферментативной активности бактерий. Основные проявления сходны с влажной гангреной, но с дополнительным присутствием газа в тканях. Крепитация (феномен потрескивания при пальпации) - частый клинический симптом при газовой гангрене. Процент летальности также очень высок.
4. Пролежень (decubitus): как разновидность гангрены выделяют пролежни - омертвение поверхностных участков тела (кожа, мягкие ткани), подвергающихся сдавлению между постелью и костью. Поэтому пролежни чаще появляются в области крестца, остистых отростков позвонков, большого вертела бедренной кости. По своему генезу это трофоневротический некроз, так как сдавливаются сосуды и нервы, что усугубляет нарушения трофики тканей у тяжелобольных, страдающих сердечно-сосудистыми, онкологическими, инфекционными или нервными болезнями.
B. Колликвационный (влажный) некроз: характеризуется расплавлением мертвой ткани. Он развивается в тканях, относительно бедных белками и богатых жидкостью, где имеются благоприятные условия для гидролитических процессов . Лизис клеток происходит в результате действия собственных ферментов (аутолиз ). Типичным примером влажного колликвационного некроза является очаг серого размягчения (ишемический инфаркт) головного мозга.
Инфаркт мозга часто называют размягчением, так как основным макроскопическим признаком является понижение упругости ткани мозга в очаге поражения во все сроки. В течение первых суток он представлен нечетко ограниченным участком синюшного оттенка, мягковатого на ощупь. К концу первых суток очаг становится более четким и бледнеет. В последующие дни вещество мозга в этой зоне становится еще более дряблым, цвет его становится желтоватым или даже с зеленоватым оттенком. В первые недели объем мозга несколько увеличивается из-за отека его. Через 1-1.5 мес на месте инфаркта образуется довольно четко ограниченная полость, содержащая мутную жидкость и детрит. Определение точных сроков инфаркта весьма затруднительно не только по внешнему виду его, но и по гистологической картине.
Микроскопически ткань мозга гомогенная, бесструктурная, слабо розового цвета при окраске гематоксилином и эозином. Рассасывание мертвых тканей осуществляется макрофагами, которые имеют вид жиро-зернистых шаров.
Клинические проявления некроза
Системные проявления: при некрозе обычно появляется лихорадка (вследствие выхода пирогенных веществ из некротизированных клеток и тканей) и нейтрофильный лейкоцитоз (вследствие наличия острой воспалительной реакции - демаркационного воспаления). Высвобождение содержимого некротических клеток: высвобождающиеся компоненты цитоплазматического содержимого некротизированных клеток (например, ферменты) поступают в кровоток, где их присутствие имеет диагностическое значение для определения локализации некроза. Эти ферменты могут быть обнаружены различными лабораторными методами (таблица 6.1). Специфичность появления ферментов зависит от преимущественной локализации фермента в различных тканях организма; например, повышение уровня МВ-изофермента креатинкиназы характерно для некроза миокарда, потому что этот фермент найден только в миокардиальных клетках. Повышение уровня аспартатаминотрансферазы (АСТ) менее специфично, так как этот фермент найден не только в миокарде, но также в печени и других тканях. Появление трансаминаз характерно для некроза печеночных клеток.
Местные проявления: Изъязвление слизистой оболочки желудочно-кишечного тракта может осложняться кровоизлиянием или кровотечением (пример - кровоточащая пептическая язва). Увеличение объема тканей в результате отека может вести к серьезному повышению давления в ограниченном пространстве (например, в полости черепа при ишемическом или геморрагическом некрозе).
Нарушение функции: некроз ведет к функциональной недостаточности органа, например, возникновение острой сердечной недостаточности в результате обширного некроза (инфаркта) миокарда (острая ишемическая болезнь сердца). Тяжесть клинических проявлений зависит от типа, объема пораженной ткани относительно общего ее количества, сохранности функции оставшейся живой ткани. Некроз в одной почке не вызывает почечной недостаточности, даже когда теряется целая почка, потому что другая почка может компенсировать потерю. Однако, некроз маленькой области двигательной коры головного мозга приводит к параличу соответствующей группы мышц.
Исход некроза. Некроз - процесс необратимый. При относительно благоприятном исходе вокруг омертвевших тканей возникает реактивное воспаление , которое отграничивает мертвую ткань. Такое воспаление называется демаркационным , а зона отграничения - демаркационной зоной. В этой зоне кровеносные сосуды расширяются, возникают полнокровие, отек, появляется большое число лейкоцитов, которые высвобождают гидролитические ферменты и расплавляют некротические массы. Некротические массы рассасываются макрофагами. Вслед за этим размножаются клетки соединительной ткани, которая замещает или обрастает участок некроза. При замещении мертвых масс соединительной тканью говорят об их организации . На месте некроза в таких случаях образуется рубец (рубец на месте инфаркта). Обрастание участка некроза соединительной тканью ведет к его инкапсуляци и . В мертвые массы при сухом некрозе и в очаг омертвения, подвергшийся организации, могут откладываться соли кальция. В этом случае развивается обызвествление (петрификация) очага некроза. В некоторых случаях в участке омертвения отмечается образование кости - оссификация . При рассасывании тканевого детрита и формировании капсулы, что встречается обычно при влажном некрозе и чаще всего в головном мозге, на месте омертвения появляется полость- киста.
Неблагоприятный исход некроза - гнойное (септическое) расплавление очага омертвения. Секвестрация - это формирование участка мертвой ткани, который не подвергается аутолизу, не замещается соединительной тканью и свободно располагается среди живых тканей. Секвестры обычно возникают в костях при воспалении костного мозга - остеомиелите. Вокруг такого секвестра образуется секвестральная капсула и полость. заполненная гноем. Нередко секвестр выходит из полости через свищи, которые закрываются лишь после полного его выделения. Разновидность секвестрации - мутиляция - отторжение концов пальцев.
Значение некроза. Оно определяется его сущностью - «местной смертью» и выключением из функции таких зон, поэтому некроз жизненно важных органов, особенно крупных участков их, нередко ведет к смерти. Таковы инфаркты миокарда, ишемические некрозы головного мозга, некрозы коркового вещества почек, прогрессирующий некроз печени, острый панкреатит, осложнившийся панкреонекрозом. Нередко омертвение ткани является причиной тяжелых осложнений многих заболеваний (разрыв сердца при миомаляции, параличи при геморрагическом и ишемическом инсультах, инфекции при массивных пролежнях, интоксикации в связи с воздействием на организм продуктов тканевого распада, например, при гангрене конечности и т.д.). Клинические проявления некроза могут быть самыми разнообразными. Патологическая электрическая активность, возникающая в областях некроза в мозге или миокарде, может приводить к эпилептическим припадкам или сердечной аритмии. Нарушение перистальтики в некротизированной кишке может вызвать функциональную (динамическую) кишечную непроходимость. Нер"e5дко наблюдаются кровоизлияния в некротизированную ткань, например, кровохаркание (hemoptysis) при некрозе легкого.
| Предыдущая |
НЕКРОЗ
Некроз - это необратимый процесс, который характеризуется гибелью отдельных клеток, части органов и тканей в живом организме. Некроз в патологических условиях наблюдается при различных болезнях, и знание общих закономерностей этого процесса, его морфологических и клинических признаков поможет в диагностике и лечении заболеваний, протекающих с процессами омертвения, поэтому изучением некроза заняты представители различных специальностей. Главная цель его - возможность управления этими процессами, поиск средств, которые позволили бы помещать прогрессирующее разрушение клеток, тканей, органов под воздействием собственных ферментов. Естественно, поэтому, что особый интерес представляет изучение морфо- и патогенеза некроза, а также запрограммированную генотипическими особенностями гибель клетки в физиологических условиях (апоптоз) с акцентом на самые начальные изменения и самые ранние стадии. Поэтому изучение некроза и апоптоза на различных уровнях открывает перспективы более глубокого познания процессов умирания. При этом важно видеть причины возникновения, механизмы проявления, исходы, а также специфику некроза в зависимости от структурно-функциональных особенностей органов, тканей, клеток, а также индивидуальных особенностей макроорганизма.
Терминология
Гангрена (gangraina - пожар) - некроз тканей, соприкасающихся с внешней средой.
Инфаркт (infarcire - нафаршировать) – некроз ткани внутренних органов (1), некроз ткани, возникающий при нарушении кровообращения (2). Вид некроза, который развивается при остром нарушении кровообращения (тромбоз, эмболия, длительный сосудистый спазм) в органах с функционально-концевыми сосудами (т.е. сосудистый некроз). Макроскопически видимый участок мертвой ткани внутренних органов (3).
Марантический некроз - пролежни у истощенных больных, старых людей, с явлениями кахексии и маразма.
Миомаляция (malakas - мягкий) - расплавление мертвой ткани.
Мумификация (mumificatio - высыхание) - высыхание, уплотнение мертвой ткани.
Нома (nome – «водяной рак») - влажная гангрена мягких тканей щек у детей.
Некроз (nekros - мертвый) - омертвление, гибель клеток и тканей в живом организме.
Некробиоз (nekros - мертвый, bios - жизнь) - изменения, предшествующие некрозу, обратимые дистрофические процессы. Процесс медленного отмирания.
Секвестр (sequestrum) - участок мертвой ткани, который не подвергается аутолизу, не замещается соединительной тканью и свободно располагается среди живой ткани.
Эластолиз - набухание, распад, расплавление эластических волокон.
СМЕРТЬ
Смерть как биологическое понятие является выражением необратимого прекращения жизнедеятельности организма. С наступлением смерти человек превращается в мертвое тело, труп (cadaver).
С юридической точки зрения в большинстве стран организм считается мертвым, когда наступает полное и необратимое прекращение деятельности мозга .
Но при этом большое количество клеток и тканей в юридически мертвом организме остаются жизнеспособными в течение некоторого времени после смерти.
Эти органы и ткани составляют главный источник органов для трансплантации.
НЕКРОЗ (МЕСТНАЯ СМЕРТЬ)
Необходимо знать, что смерть клетки - постоянное проявление жизнедеятельности организма и в здоровом состоянии оно сбалансировано физиологической регенерацией клеток. Как структурные компоненты клеток, так и целые клетки изнашиваются, стареют, гибнут и требуют замены. Поддержание различных органов и тканей в здоровом состоянии невозможно без “естественного” физиологического обновления, а, следовательно без смерти отдельных клеток. Такая смерть клеток получила в 1972 году название “апоптоз”. Апоптоз - это запрограммированная смерть клетки . Но смерть клетки может происходить в живом организме в результате “насильственных” действий внешних повреждающих (патогенных) факторов. Такая смерть клетки носит название “некроз”. Мертвые клетки полностью прекращают свое функционирование. Гибель клетки сопровождается необратимыми биохимическими и структурными изменениями.
Апоптоз - смерть клеток без предварительных необратимых повреждений клеток, но в результате включения генетической программы, предопределяющей их гибель, была названа запрограммированной клеточной смертью в 1964 г. Запрограммированная клеточная гибель встречается в случаях, когда при развитии, росте и выживании тканей, а также при конструировании развивающихся структур в ходе морфогенеза возникает необходимость избавиться от части клеток (в том числе от повреждённых и закончивших свой жизненный цикл). Возникает парадоксальная ситуация: клетка жертвует своей жизнью, идёт на самоубийство ради сохранения целого - ткани, органа, организма. Таким образом, биологическое значение программной клеточной гибели заключается в поддержании жизни. Запрограммированная клеточная гибель является составной частью таких биологических процессов, как эмбриональное развитие, морфогенез и метаморфоз организмов. В многоклеточных организмах баланс между запрограммированной клеточной гибелью и митозом и обеспечивает тканевый гомеостаз.
Термины «запрограммированная клеточная гибель» и «апоптоз» не являются синонимами. Термин «запрограммированная клеточная гибель» используют в литературе как в узком, так и в широком смысле этого слова.
В узком смысле запрограммированная клеточная гибель противопоставляется апоптозу, поскольку первая совершается в норме в ходе развития организма и при обеспечении тканевого гомеостаза. В то же время апоптоз - самоубийство клетки - развивается в условиях патологии.
В широком смысле понятие «запрограммированная клеточная гибель» подразумевает не только смерть клетки путём апоптоза, но и ряд других видов клеточной гибели: вакуолярная, или аутофагическая, атрофическая смерть, а также гибель по достижении клеткой терминальной дифференцировки.
Таким образом, смерть клетки может происходить двумя путями: некроза и апоптоза . Поскольку биологические признаки, а также значение некроза и апоптоза значительно различаются, эти процессы рассматриваются отдельно.
Некроз (от греч. nekros - мертвый) - омертвение, гибель клеток и тканей в живом организме под воздействием болезнетворных факторов. Этот вид гибели клеток генетически не контролируется.
Причины некроза . Факторы вызывающие некроз:
- физические (огнестрельное ранение, радиация, электричество, низкие и высокие температуры - отморожение и ожог);
- токсические (кислоты, щелочи, соли тяжелых металлов, ферменты, лекарственные препараты, этиловый спирт и др.);
- биологические (бактерии, вирусы, простейшие и др.);
- аллергические (эндо- и экзоантигены, например, фибриноидный некроз при инфекционно-аллергических и аутоиммунных заболеваниях, феномен Артюса);
- сосудистый (инфаркт - сосудистый некроз);
- трофоневротический (пролежни, незаживающие язвы).
В зависимости от механизма действия патогенного фактора различают:
- прямой некроз , обусловленный непосредственным действием фактора (травматические, токсические и биологические некрозы),
- непрямой некроз , возникающий опосредованно через сосудистую и нервно-эндокринную системы (аллергические, сосудистые и трофоневротические некрозы).
Этиологические виды некроза:
1. Травматический - возникает при действии физических и химических факторов.
2. Токсический - возникает при действии токсинов бактериальной и другой природы.
3. Трофоневротический - связан с нарушением микроциркуляции и иннервации тканей.
4. Аллергический - развивается при иммунопатологических реакциях.
5. Сосудистый - связан с нарушением кровоснабжения органа или ткани.
Механизмы некроза
Механизмы некроза отличаются от механизмов аутолиза, они разнообразны, во многом зависят от характера повреждающего фактора и структурно-функциональных особенностей клеток, тканей и органов, в которых развивается некроз. Конечный результат всех патогенетических механизмов некроза - возникновение внутриклеточного хаоса. Из всего многообразия патогенетических путей некроза, вероятно, можно выделить пять наиболее значимых: 1) связывание клеточных белков с убиквитином, 2) дефицит АТФ, 3) генерация активных форм кислорода, 4) нарушение кальциевого гомеостаза и 5) потеря клеточными мембранами селективной проницаемости.
• Убиквитин - один из наиболее консервативных белков - в составе протеосом формирует ковалентные связи с остатками лизина полипептидных цепочек других белков. Синтез убиквитина, как и белков из семейства белков теплового шока, потенцируют различные повреждения. Так, в клетках ЦНС при болезни Альцхаймера и болезни Паркинсона, а также в гепатоцитах при алкогольном поражении печени обнаруживают протеосомы - комплексы белков с убиквитином. Такие комплексы в гепатоцитах издавна известны как тельца Мэллори.
• Дефицит АТФ постоянно обнаруживается в гибнущих клетках. Долгое время полагали, что основной причиной некроза кардиомиоцитов при ишемии является снижение образования макроэргических соединений до определённого уровня. В последние годы было показано, что в ишемическом повреждении участвуют и другие механизмы. Так, если ишемизированный миокард подвергнуть реперфузии, то некротические изменения наступают гораздо быстрее и в больших масштабах. Описанные изменения были названы реперфузионными повреждениями. Использование ингибиторов кальция (таких как хлорпромазин) и антиоксидантов, несмотря на низкий уровень АТФ, уменьшает реперфузионные повреждения, что указывает на то, что для развития некроза одного дефицита АТФ ещё недостаточно.
• Генерация активных форм кислорода (синглетный кислород, супероксид анион-радикал, анион гидроксила, пероксид водорода и др.) постоянно происходит в живых клетках. Вступая во взаимодействия с липидами мембран, молекулами ДНК, вызывая оксидативный стресс, активные формы кислорода повышают проницаемость мембран, ингибируют ка-тионные насосы, потенцируют дефицит АТФ и избыток внутриклеточного кальция, что приводит к развитию повреждения клетки и ткани. Наибольшее значение активные формы кислорода играют в патогенезе некроза пневмоцитов при дистресс-синдроме новорождённых, развивающемся в результате оксигенотерапии, реперфузионных повреждений при инфаркте миокарда и некрозе гепатоцитов при передозировке парацетамола.
• Нарушения кальциевого гомеостаза характеризуются накоплением внутриклеточного кальция в гибнущих клетках. В живых клетках внутриклеточная концентрация ионов кальция примерно в тысячу раз меньше по сравнению с внеклеточной. Инициальные изменения при повреждении связаны с нарушением работы катионных помп в связи с дефицитом АТФ. При этом кальций накапливается внутри клеток, прежде всего в митохондриях. Происходит активация Са2+-зависимых протеаз и фосфолипаз, что приводит к необратимым повреждениям мембран (митохондриальных, цитоплазматических), к ещё большим нарушениям их проницаемости и смерти клетки.
Потеря способности к избирательной проницаемости цитоплазматических мембран является одним из характерных признаков некроза при воздействии комплемента, вирусных инфекциях и гипоксических повреждениях. При этом происходит повреждение трансмембранных белков, рецепторов и ферментных систем, регулирующих прохождение в клетку определённых веществ. При воздействии комплемента и перфоринов в цитоплазматическую мембрану встраиваются протеиновые полимеразы. Литические вирусы также взаимодействуют с липидами мембран, встраивают в них белки вирусных капсидов, что приводит к разрушению цитоплазматических мембран в момент выхода вируса из инфицированной клетки. В клетках, подвергшихся ишемии, нарушается расположение трансмембранных белков с формированием характерных белковых «гипоксических» уплотнений.
МОРФОГЕНЕЗ НЕКРОЗА Некротический процесс проходит ряд морфогенетических стадий: паранекроз, некробиоз, смерть клетки, аутолиз.
Паранекроз - подобные некротическим, но обратимые изменения.
Некробиоз - необратимые дистрофические изменения, характеризующиеся преобладанием катаболических реакций над анаболическими.
Смерть клетки, время которой установить трудно.
Аутолиз - разложение мёртвого субстрата под действием гидролитических ферментов погибших клеток и клеток воспалительного инфильтрата.
Для определения смерти клетки наиболее часто используют морфологические критерии. Такими достоверными критериями необратимости повреждения клетки в ЭМ являются отложения в митохондриях электроноплотных депозитов, содержащих белки и соли кальция, и разрушение их внутренних мембран. В СМ изменения в структуре клетки становятся видимыми лишь на стадии аутолиза. Поэтому, говоря о микроскопических признаках некроза, мы фактически говорим о морфологических изменениях на стадии аутолиза.
МОРФОЛОГИЯ НЕКРОЗА
Макроскопические признаки некроза
Общими для всех форм некроза являются изменения цвета, консистенции и в ряде случаев - запаха некротических тканей. Некротизированная ткань может иметь плотную и сухую консистенцию, что наблюдается при коагуляционном некрозе. Ткань при этом может подвергнуться мумификации. В других случаях мёртвая ткань дряблая, содержит большое количество жидкости, подвергается миомаляции (от греч. malakas - мягкий). Такой некроз по консистенции называется колликвационным. Цвет некротических масс зависит от наличия примесей крови и различных пигментов, а также обусловлен развитием на границе между мёртвой и живой тканью зоны демаркационного воспаления, имеющей красно-бурый цвет. Мёртвая ткань бывает белой или желтоватой, нередко окружена красно-бурым венчиком. При пропитывании некротических масс кровью они могут приобретать окраску от красной до бурой, жёлтой и зелёной (в зависимости от преобладания в них тех или иных гемоглобинных пигментов). В некоторых случаях фокусы некроза прокрашиваются жёлчью. При гнилостном расплавлении мёртвая ткань издаёт характерный дурной запах. По цвету инфаркт может быть белым (селезёнка, головной мозг), белым с геморрагическим венчиком (сердце, почки) и красным (геморрагическим). Геморрагический венчик формируется за счёт зоны демаркационного воспаления, которая закономерно возникает на границе мёртвых и живых тканей. Красный цвет инфаркта обусловлен пропитыванием некротических тканей кровью, как это бывает при инфарктах лёгкого на фоне хронического венозного полнокровия.
Морфологические признаки некроза
Некрозу предшествует период некробиоза, морфологическим субстратом которого являются дистрофические изменения.
A. Ранние изменения: В начальном периоде некробиоза клетка морфологически не изменена. Должно пройти 1-3 часа, прежде чем появятся изменения, распознаваемые при электронной микроскопии или гистохимически, и по крайней мере 6-8 часов, прежде чем появятся изменения, выявляемые при световой микроскопии; еще позже развиваются макроскопические изменения. Например, если больной с инфарктом миокарда умирает спустя несколько минут от момента начала приступа стенокардии (боль при недостаточном притоке крови к миокарду), то на аутопсии не будет выявлено никакого структурного свидетельства некроза; если же смерть наступает на 2-й день после острого приступа, то изменения будут очевидны.
Б. Гистохимические изменения: приток ионов кальция в клетку тесно связан с необратимым повреждением и появлением морфологических проявлений некроза. В нормальной клетке внутриклеточная концентрация кальция составляет приблизительно 0.001 от концентации его во внеклеточной жидкости. Этот градиент поддерживается мембраной клетки, которая активно транспортирует ионы кальция из клетки. Экспериментально доказано, что при повреждении клеток в результате ишемии или под воздействии различных токсических агентов, накопление кальция внутри клеток наблюдается только тогда, когда изменения необратимы. Кальций активирует эндонуклеазы (гидролиз, расщепление ДНК), фосфолипазы (разрушение мембран) и протеазы (деструкция, переваривание цитоскелета). Повышение их активности выявляется гистохимическими методами. Активность окислительно-восстановительных ферментов (например, сукцинатдегидрогеназы) резко падает или исчезает.
B. Изменения в ядрах: изменения в ядрах - самое лучшее свидетельство некроза клетки. Хроматин мертвой клетки конденсируется в крупные глыбки и ядро становится уменьшенным в объеме, сморщенным, плотным, интенсивно базофильным, то есть окрашивается в темно-синий цвет гематоксилином. Этот процесс назван кариопикнозом (сморщиванием). Пикнотическое ядро может затем разрываться на многочисленные маленькие базофильные частицы (кариорексис ) или подвергнуться лизису (растворению) в результате действия лизосомальной дезоксирибонуклеазы (кариолизис ). Тогда оно увеличивается в объеме, слабо окрашивается гематоксилином, постепенно теряются контуры ядра. При быстро развивающемся некрозе ядро подвергается лизису без пикнотической стадии.
Г. Цитоплазматические изменения: приблизительно через 6 часов после того, как клетка подверглась некрозу, цитоплазма ее становится гомогенной и выраженно ацидофильной, то есть окрашивается интенсивно кислыми красителями, например, в розовый цвет при окраске эозином. Это - первое изменение, выявляемое световой микроскопией, которое возникает в результате коагуляции цитоплазматических белков и разрушения (исчезновения) рибосом. РНК рибосом придает базофильный оттенок нормальной цитоплазме. Специализированные органеллы клетки, например, миофибриллы в миокардиальных клетках, исчезают в первую очередь. Набухание митохондрий и деструкция (разрушение) мембран органелл вызывают вакуолизацию цитоплазмы. Наконец, переваривание клетки ферментами, которые высвобождаются из собственных лизосом, вызывает лизис клетки (аутолиз). Таким образом, в цитоплазме происходит коагуляция белков , сменяемая обычно их колликвацией.
Д. Изменения межклеточного вещества охватывают как межуточное вещество, так и волокнистые структуры. Чаще всего развиваются изменения, характерные для фибриноидного некроза: коллагеновые, эластические и ретикулиновые волокна превращаются в плотные, гомогенные розовые, иногда базофильные массы, которые могут подвергаться фрагментации, глыбчатому распаду либо лизироваться. Реже может наблюдаться отек, лизис и ослизнение волокнистых структур, что свойственно колликвационному некрозу.
Клинико-морфологические формы некроза
Некроз проявляется различными клиническими и морфологическими изменениями. Различия зависят от структурно-функциональных особенностей органов и тканей, скорости и типа некроза, а также причины его возникновения и условий развития. Среди клинико-морфологических форм некроза различают коагуляционный (сухой) некроз и колликвационный (влажный) некроз.
А. Коагуляционный (сухой) некроз: при этом типе некроза погибшие клетки сохраняют свои очертания в течение нескольких дней. Клетки, лишенные ядра, выглядят как масса коагулированной, гомогенной, розовой цитоплазмы.
Механизм коагуляционного некроза недостаточно ясен. Коагуляция цитоплазматических белков делает их резистентными к действию лизосомальных ферментов и в связи с этим замедляется их разжижение.
Коагуляционный некроз обычно происходит в органах, богатых белками и бедных жидкостями , например, в почках, миокарде, надпочечниках, селезенке, обычно в результате недостаточного кровообращения и аноксии, действия физических, химических и других повреждающих факторов, например, коагуляционный некроз клеток печени при вирусном поражении или при действии токсических агентов бактериального и небактериального генеза. Коагуляционный некроз еще называют сухой , поскольку он характеризуется тем, что возникающие при нем мертвые участки сухие, плотные, крошащиеся, белого или желтого цвета.
К коагуляционному некрозу относят:
- инфаркт - разновидность сосудистого (ишемического) некроза внутренних органов (кроме мозга - инсульт). Это самый частый вид некроза.
- казеозный (творожистый) некроз развивается и при туберкулезе, сифилисе, лепре, а также при лимфогранулематозе. Его еще называют специфическим, поскольку чаще всего встречается при специфических инфекционных гранулемах. Во внутренних органах выявляется ограниченный участок ткани сухой, крошащийся, беловато-желтого цвета. В сифилитических гранулемах очень часто такие участки не крошащиеся, а пастообразные, напоминают аравийский клей. Это смешанный (то есть экстра- и интрацеллюлярный) тип некроза, при котором одновременно гибнет и паренхима, и строма (и клетки, и волокна). Микроскопически такой участок ткани бесструктурный, гомогенный, окрашен гематоксилином и эозином в розовый цвет, хорошо видны глыбки хроматина ядер (кариорексис).
- восковидный, или ценкеровский некроз (некроз мышц, чаще передней брюшной стенки и бедра, при тяжелых инфекциях - брюшном и сыпном тифах, холере);
- фибриноидный некроз - тип некроза соединительной ткани, который уже изучен как исход фибриноидного набухания, наиболее часто он наблюдается при аллергических и аутоиммунных болезнях (например, ревматизме, ревматоидном артрите и системной красной волчанке). Наиболее сильно повреждаются коллагеновые волокна и гладкая мускулатура средней оболочки кровеносных сосудов. Фибриноидный некроз артериол наблюдается при злокачественной гипертензии. Фибриноидный некроз характеризуется потерей нормальной структуры и накоплением гомогенного, ярко-розового некротического материала, который похож микроскопически на фибрин. Обратите внимание, что понятие "фибриноидный" отличается от понятия "фибринозный", так как последнее обозначает накопление фибрина, например, при свертывании крови или при воспалении. Участки фибриноидного некроза содержат различное количество иммуноглобулинов и комплемента, альбуминов, продуктов распада коллагена и фибрина.
- жировой некроз:
1. Ферментный жировой некроз: жировой некроз наиболее часто происходит при остром панкреатите и повреждениях поджелудочной железы, когда панкреатические ферменты выходят из протоков в окружающие ткани. Панкреатическая липаза действует на триглицериды в жировых клетках, расщепляя их на глицерин и жирные кислоты, которые, взаимодействуя с плазменными ионами кальция, образуют мыла кальция. При этом в жировой ткани, окружающей поджелудочную железу, появляются непрозрачные, белые (как мел) бляшки и узелки (стеатонекроз).
При панкреатитах возможно попадание липазы в кровоток с последующим широким распространением, что является причиной жирового некроза во многих участках организма. Наиболее часто повреждаются подкожная жировая клетчатка и костный мозг.
2. Неферментный жировой некроз: неферментный жировой некроз наблюдается в молочной железе, подкожной жировой ткани и в брюшной полости. Большинство пациентов имеют в анамнезе травмы. Неферментный жировой некроз называют также травматическим жировым некрозом, даже если травма не определена как основная причина. Неферментный жировой некроз вызывает воспалительный ответ, характеризуемый наличием многочисленных макрофагов с пенистой цитоплазмой, нейтрофилов и лимфоцитов. Затем следует фиброзирование, при этом данный процесс бывает трудно отличить от опухоли.
- гангрена ( от греч. gangraina - пожар): это некроз тканей, сообщающихся с внешней средой и изменяющихся под ее воздействием. Термин "гангрена" широко используется для обозначения клинико-морфологического состояния, при котором некроз ткани зачастую осложняется вторичной бактериальной инфекцией различной степени выраженности либо, находясь в соприкосновении с внешней средой, претерпевает вторичные изменения. Различают сухую, влажную, газовую гангрены и пролежни.
1. Сухая гангрена - это некроз тканей, соприкасающихся с внешней средой, протекающий без участия микроорганизмов. Сухая гангрена наиболее часто возникает на конечностях в результате ишемического коагуляционного некроза тканей. Некротизированные ткани кажутся черными, сухими, они четко отграничены от смежной жизнеспособной ткани. На границе со здоровыми тканями возникает демаркационное воспаление. Изменение цвета обусловлено превращением гемоглобиногенных пигментов в присутствии сероводорода в сульфид железа. Примерами может служить сухая гангрена :
Конечности при атеросклерозе и тромбозе ее артерий (атеросклеротическая гангрена ), облитерирующем эндартериите;
При отморожении или ожоге;
Пальцев при болезни Рейно или вибрационной болезни;
Кожи при сыпном тифе и др. инфекциях.
Лечение состоит в хирургическом удалении мертвой ткани, ориентиром при этом служит демаркационная линия.
2. Влажная гангрена : развивается в результате наслоения на некротические изменения ткани тяжелой бактериальной инфекции. Под действием ферментов микроорганизмов возникает вторичная колликвация. Лизис клетки ферментами, которые возникают не в самой клетке, а проникают извне, называется гетеролизисом . Тип микроорганизмов зависит от локализации гангрены. Влажная гангрена развивается обычно в тканях, богатых влагой. Она может встречаться на конечностях, но чаще - во внутренних органах, например, в кишечнике при непроходимости брыжеечных артерий (тромбоз, эмболия), в легких как осложнение пневмонии (грипп, корь). У ослабленных инфекционным заболеванием (чаще корью) детей может развиться влажная гангрена мягких тканей щек, промежности, которую называют номой (от греч. nome - водяной рак). Острое воспаление и рост бактерий являются причиной того, что некротическая область становится отечной и красно-черной, с обширным разжижением мертвой ткани. При влажной гангрене может возникнуть распространяющееся некротизирующее воспаление, которое не четко ограничено от смежной здоровой ткани и, таким образом, трудно поддается хирургическому лечению. В результате жизнедеятельности бактерий возникает специфический запах. Очень высок процент летальности.
3. Газовая гангрена : газовая гангрена возникает при инфицировании раны анаэробной флорой, например, Clostridium perfringens и другими микроорганизмами этой группы. Она характеризуется обширным некрозом ткани и образованием газов в результате ферментативной активности бактерий. Основные проявления сходны с влажной гангреной, но с дополнительным присутствием газа в тканях. Крепитация (феномен потрескивания при пальпации) - частый клинический симптом при газовой гангрене. Процент летальности также очень высок.
4. Пролежень (decubitus): как разновидность гангрены выделяют пролежни - омертвение поверхностных участков тела (кожа, мягкие ткани), подвергающихся сдавлению между постелью и костью. Поэтому пролежни чаще появляются в области крестца, остистых отростков позвонков, большого вертела бедренной кости. По своему генезу это трофоневротический некроз, так как сдавливаются сосуды и нервы, что усугубляет нарушения трофики тканей у тяжелобольных, страдающих сердечно-сосудистыми, онкологическими, инфекционными или нервными болезнями.
B. Колликвационный (влажный) некроз: характеризуется расплавлением мертвой ткани. Он развивается в тканях, относительно бедных белками и богатых жидкостью, где имеются благоприятные условия для гидролитических процессов . Лизис клеток происходит в результате действия собственных ферментов (аутолиз ). Типичным примером влажного колликвационного некроза является очаг серого размягчения (ишемический инфаркт) головного мозга.
Инфаркт мозга часто называют размягчением, так как основным макроскопическим признаком является понижение упругости ткани мозга в очаге поражения во все сроки. В течение первых суток он представлен нечетко ограниченным участком синюшного оттенка, мягковатого на ощупь. К концу первых суток очаг становится более четким и бледнеет. В последующие дни вещество мозга в этой зоне становится еще более дряблым, цвет его становится желтоватым или даже с зеленоватым оттенком. В первые недели объем мозга несколько увеличивается из-за отека его. Через 1-1.5 мес. на месте инфаркта образуется довольно четко ограниченная полость, содержащая мутную жидкость и детрит. Определение точных сроков инфаркта весьма затруднительно не только по внешнему виду его, но и по гистологической картине.
Микроскопически ткань мозга гомогенная, бесструктурная, слабо розового цвета при окраске гематоксилином и эозином. Рассасывание мертвых тканей осуществляется макрофагами, которые имеют вид жиро-зернистых шаров.
Клинические проявления некроза
Системные проявления: при некрозе обычно появляется лихорадка (вследствие выхода пирогенных веществ из некротизированных клеток и тканей) и нейтрофильный лейкоцитоз (вследствие наличия острой воспалительной реакции - демаркационного воспаления). Высвобождение содержимого некротических клеток: высвобождающиеся компоненты цитоплазматического содержимого некротизированных клеток (например, ферменты) поступают в кровоток, где их присутствие имеет диагностическое значение для определения локализации некроза. Эти ферменты могут быть обнаружены различными лабораторными методами. Специфичность появления ферментов зависит от преимущественной локализации фермента в различных тканях организма; например, повышение уровня МВ-изофермента креатинкиназы характерно для некроза миокарда, потому что этот фермент найден только в миокардиальных клетках. Повышение уровня аспартатаминотрансферазы (АСТ) менее специфично, так как этот фермент найден не только в миокарде, но также в печени и других тканях. Появление трансаминаз характерно для некроза печеночных клеток.
Местные проявления: Изъязвление слизистой оболочки желудочно-кишечного тракта может осложняться кровоизлиянием или кровотечением (пример - кровоточащая пептическая язва). Увеличение объема тканей в результате отека может вести к серьезному повышению давления в ограниченном пространстве (например, в полости черепа при ишемическом или геморрагическом некрозе).
Нарушение функции: некроз ведет к функциональной недостаточности органа, например, возникновение острой сердечной недостаточности в результате обширного некроза (инфаркта) миокарда (острая ишемическая болезнь сердца). Тяжесть клинических проявлений зависит от типа, объема пораженной ткани относительно общего ее количества, сохранности функции оставшейся живой ткани. Некроз в одной почке не вызывает почечной недостаточности, даже когда теряется целая почка, потому что другая почка может компенсировать потерю. Однако некроз маленькой области двигательной коры головного мозга приводит к параличу соответствующей группы мышц.
Исход некроза. Некроз - процесс необратимый. При относительно благоприятном исходе вокруг омертвевших тканей возникает реактивное воспаление , которое отграничивает мертвую ткань. Такое воспаление называется демаркационным , а зона отграничения - демаркационной зоной. В этой зоне кровеносные сосуды расширяются, возникают полнокровие, отек, появляется большое число лейкоцитов, которые высвобождают гидролитические ферменты и расплавляют некротические массы. Некротические массы рассасываются макрофагами. Вслед за этим размножаются клетки соединительной ткани, которая замещает или обрастает участок некроза. При замещении мертвых масс соединительной тканью говорят об их организации . На месте некроза в таких случаях образуется рубец (рубец на месте инфаркта). Обрастание участка некроза соединительной тканью ведет к его инкапсуляци и . В мертвые массы при сухом некрозе и в очаг омертвения, подвергшийся организации, могут откладываться соли кальция. В этом случае развивается обызвествление (петрификация) очага некроза. В некоторых случаях в участке омертвения отмечается образование кости - оссификация . При рассасывании тканевого детрита и формировании капсулы, что встречается обычно при влажном некрозе и чаще всего в головном мозге, на месте омертвения появляется полость - киста.
Неблагоприятный исход некроза - гнойное (септическое) расплавление очага омертвения. Секвестрация - это формирование участка мертвой ткани, который не подвергается аутолизу, не замещается соединительной тканью и свободно располагается среди живых тканей. Секвестры обычно возникают в костях при воспалении костного мозга - остеомиелите. Вокруг такого секвестра образуется секвестральная капсула и полость, заполненная гноем. Нередко секвестр выходит из полости через свищи, которые закрываются лишь после полного его выделения. Разновидность секвестрации - мутиляция - отторжение концов пальцев.
Значение некроза. Оноопределяется его сущностью - «местной смертью» и выключением из функции таких зон, поэтому некроз жизненно важных органов, особенно крупных участков их, нередко ведет к смерти. Таковы инфаркты миокарда, ишемические некрозы головного мозга, некрозы коркового вещества почек, прогрессирующий некроз печени, острый панкреатит, осложнившийся панкреонекрозом. Нередко омертвение ткани является причиной тяжелых осложнений многих заболеваний (разрыв сердца при миомаляции, параличи при геморрагическом и ишемическом инсультах, инфекции при массивных пролежнях, интоксикации в связи с воздействием на организм продуктов тканевого распада, например, при гангрене конечности и т.д.). Клинические проявления некроза могут быть самыми разнообразными. Патологическая электрическая активность, возникающая в областях некроза в мозге или миокарде, может приводить к эпилептическим припадкам или сердечной аритмии. Нарушение перистальтики в некротизированной кишке может вызвать функциональную (динамическую) кишечную непроходимость. Нерeдко наблюдаются кровоизлияния в некротизированную ткань, например, кровохаркание (hemoptysis) при некрозе легкого.
АПОПТОЗ
Апоптоз, или запрограммированная смерть клетки , представляет собой процесс, посредством которого внутренние или внешние факторы активируя генетическую программу приводят к гибели клетки и ее эффективному удалению из ткани. Апоптоз - это механизм гибели клеток, который имеет ряд отличительных биохимических и морфологических признаков от некроза.
Апоптоз - это биохимически специфический тип гибели клетки , который характеризуется активацией нелизосомальных эндогенных эндонуклеаз , которые расщепляют ядерную ДНК на маленькие фрагменты. Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток , что сопровождается формированием округлых, окруженных мембраной телец (“апоптотические тельца”), которые тут же фагоцитируются окружающими клетками.
Это энергозависимый процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он играет большую роль в морфогенезе и является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример - опухолевый рост . При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример - атрофия .
Морфологические проявления апоптоза
Апоптоз имеет свои отличительные морфологические признаки как на светооптическом, так и на ультраструктурном уровне. При окраске гематоксилин-эозином апоптоз определяется в единичных клетках или небольших группах клеток . Апоптотические клетки выглядят как округлые или овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина. Поскольку сжатие клетки и формирование апоптотических телец происходит быстро и также быстро они фагоцитируются, распадаются или выбрасываются в просвет органа, то на гистологических препаратах он обнаруживается в случаях его значительной выраженности . К тому же апоптоз - в отличие от некроза - никогда не сопровождается воспалительной реакцией , что также затрудняет его гистологическое выявление.
Сравнительная характеристика некроза и апоптоза
| Признак | Апоптоз | Некроз |
| Индукция | Активируется физиологическими или патологическими стимулами | Различная, в зависимости от повреждающего фактора |
| Распространенность | Одиночная клетка | Группа клеток |
| Биохимические изменения | Энергозависимая фрагментация ДНК эндогенными эндонуклеазами. Лизосомы интактные. |
Нарушение или прекращение ионного обмена. Из лизосом высвобождаются ферменты. |
| Распад ДНК | Внутриядерная конденсация с расщеплением на фрагменты | Диффузная локализация в некротизированной клетке |
| Целостность клеточной мембраны | Сохранена | Нарушена |
| Морфология | Сморщивание клеток и фрагментация с формированием апоптотических телец с уплотненным хроматином | Набухание и лизис клеток. |
| Воспалительный ответ | Нет | Обычно есть |
| Удаление погибших клеток | Поглощение (фагоцитоз) соседними клетками | Поглощение (фагоцитоз) нейтрофилами и макрофагами. |
Наиболее четко морфологические признаки выявляются при электронной микроскопии . Для клетки, подвергающейся апоптозу характерно (морфогенез апоптоза ):
Сжатие клетки.
Клетка уменьшается в размерах; цитоплазма уплотняется; органеллы, которые выглядят относительно нормальными, располагаются более компактно.
Предполагается, что нарушение формы и объема клетки происходит в результате активации в апоптотических клетках трансглютаминазы. Этот фермент вызывает прогрессивное образование перекрестных связей в цитоплазматических белках, что приводит к формированию своеобразной оболочки под клеточной мембраной, подобно ороговевающим клеткам эпителия.
Конденсация хроматина.
Это наиболее характерное проявление апоптоза. Хроматин конденсируется по периферии, под мембраной ядра, при этом образуются четко очерченные плотные массы различной формы и размеров. Ядро же может разрываться на два и более фрагментов.
Механизм конденсации хроматина
изучен достаточно хорошо. Эти изменения связаны с расщеплением ядерной ДНК в местах, связывающих отдельные нуклеосомы, что приводит к развитию большого количества фрагментов, в которых число пар оснований делится на 180-200. Эти фрагменты дают характерную картину лестницы при электрофорезе. Эта картина отличается от таковой при некрозе клеток, где длина фрагментов ДНК варьирует. Фрагментация ДНК в нуклеосомах происходит под действием кальций-чувствительной эндонуклеазы. Эндонуклеаза в некоторых клетках находится постоянно (например, тимоцитах), где она активируется появлением в цитоплазме свободного кальция, а в других клетках она синтезируется перед началом апоптоза. Однако еще не установлено, каким образом после расщепления ДНК эндонуклеазой происходит конденсация хроматина.
Формирование в цитоплазме полостей и апоптотических телец. В апоптотической клетке первоначально формируются глубокие впячивания поверхности с образованием полостей, что приводит к фрагментации клетки с формированием окруженных мембраной апоптотических телец, состоящих из цитоплазмы и плотно расположенных органелл, с или без фрагментов ядра.
Фагоцитоз апоптотических клеток или телец окружающими здоровыми клетками, или паренхиматозными, или макрофагами . Апоптотические тельца быстро разрушаются в лизосомах, а окружающие клетки либо мигрируют, либо делятся, чтобы заполнить освободившееся после гибели клетки пространство.
Фагоцитоз апоптотических телец макрофагами или другими клетками активируется рецепторами на этих клетках, которые захватывают и поглощают апоптотические клетки. Одним из таких рецепторов на макрофагах является рецептор витронектина, который является b 3 -интегрином и активирует фагоцитоз апоптотических нейтрофилов.
Апоптоз принимает участие в следующих физиологических и патологических процессах:
Запрограммированном разрушении клеток во время эмбриогенеза (включая имплантацию, органогенез) и метаморфоза. Несмотря на то, что при эмбриогенезе апоптоз не всегда является отражением “запрограммированной смерти клетки”, это определение апоптоза широко используется различными исследователями.
Гормон-зависимая инволюция органов у взрослых , например, отторжение эндометрия во время менструального цикла, атрезия фолликулов в яичниках в менопаузе и регрессия молочной железы после прекращения лактации.
Удаление некоторых клеток при пролиферации клеточной популяции
Гибель отдельных клеток в опухолях, в основном при ее регрессии, но также и в активно растущей опухоли.
Гибель клеток иммунной системы , как В-, так и Т-лимфоцитов, после истощения запасов цитокинов, а также гибель аутореактивных Т-клеток при развитии в тимусе.
Патологическая атрофия гормон-зависимых органов, например, атрофия предстательной железы после кастрации и истощение лимфоцитов в тимусе при терапии глюкокортикоидами.
Патологическая атрофия паренхиматозных органов после обтурации выводных протоков , что наблюдается в поджелудочной и слюнных железах, почках.
Гибель клеток, вызванная действием цитотоксических Т-клеток , например, при отторжении трансплантата и болезни “трансплантат против хозяина”.
Повреждение клеток при некоторых вирусных заболеваниях , например, при вирусном гепатите, когда фрагменты апоптотических клеток обнаруживаются в печени как тельца Каунсильмана.
Гибель клеток при действии различных повреждающих факторов, которые способны вызвать некроз, но действующих в небольших дозах, например, при действии высокой температуры, ионизирующего излучения, противоопухолевых препаратов.
Регуляция апоптоза
Апоптоз это генетически контролируемая смерть клетки . В настоящее время выявлено большое число генов, которые кодируют вещества, необходимые для регуляции апоптоза. Многие из этих генов сохранились в ходе эволюции - от круглых червей до насекомых и млекопитающих. Некоторые из них обнаруживаются также в геноме вирусов. Таким образом, основные биохимические процессы апоптоза в разных экспериментальных системах (в основном исследования ведутся на круглых червях и мухах) являются идентичными, поэтому результаты исследований можно прямо переносить на другие системы (например, организм человека).
Апоптоз может регулироваться:
- внешними факторами ,
- автономными механизмами .
А. Воздействие внешних факторов.
Апоптоз может регулироваться действием многих внешних факторов, которые ведут к повреждению ДНК . При невосстановимом повреждении ДНК путем апоптоза происходит элиминация потенциально опасных для организма клеток. В данном процессе большую роль играет ген супрессии опухолей р53 . К активации апоптоза также приводят вирусные инфекции , нарушение регуляции клеточного роста, повреждение клетки и потеря контакта с окружающими или основным веществом ткани. Апоптоз - это защита организма от персистенции поврежденных клеток, которые могут оказаться потенциально опасными для многоклеточного организма.
При стимуляции тканей каким-либо митогеном ее клетки переходят в состояние повышенной митотической активности, которая обязательно сопровождается некоторой активацией апоптоза . Судьба дочерних клеток, выживут ли они или подвергнутся апоптозу, зависит от соотношения активаторов и ингибиторов апоптоза :
ингибиторы включают факторы роста, клеточный матрикс, половые стероиды, некоторые вирусные белки;
активаторы включают недостаток факторов роста, потеря связи с матриксом, глюкокортикоиды, некоторые вирусы, свободные радикалы, ионизирующая радиация.
При воздействии активаторов или отсутствии ингибиторов происходит активация эндогенных протеаз и эндонуклеаз . Это приводит к разрушению цитоскелета, фрагментации ДНК и нарушению функционирования митохондрий. Клетка сморщивается, однако мембрана ее остается интактной, но повреждение ее приводит к активации фагоцитоза. Погибшие клетки распадаются на небольшие окруженные мембраной фрагменты, которые обозначаются как апоптотические тельца. Воспалительная реакция на апоптотические клетки не возникает .
В. Автономный механизм апоптоза.
При развитии эмбриона различают три категории автономного апоптоза: морфогенетический, гистогенетический и филогенетический.
Морфогенетический апоптоз участвует в разрушении различных тканевых зачатков. Примерами являются:
- разрушение клеток в межпальцевых промежутках;
гибель клеток приводит к разрушению избыточного эпителия при слиянии небных отростков при формировании твердого неба.
- гибель клеток в дорсальной части нервной трубки во время смыкания, что необходимо для достижения единства эпителия, двух сторон нервной трубки и связанной с ними мезодермы.
Нарушение морфогенетического апоптоза в этих трех локализациях приводят к развитию синдактилии, расщеплению твердого неба и spina bifida соответственно.
Гистогенетический апоптоз наблюдается при дифференцировке тканей и органов, что наблюдается, например, при гормональнозависимой дифференцировке половых органов из тканевых зачатков. Так, у мужчин клетками Сертоли в яичках плода синтезируется гормон, который вызывает регрессию протоков Мюллера (из которых у женщин формируются маточные трубы, матка и верхняя часть влагалища) путем апоптоза.
Филогенетический апоптоз участвует в удалении рудиментарных структур у эмбриона, например, пронефроса.
При различных состояниях может наблюдаться как ускорение, так и замедление апоптоза . Несмотря на то, что апоптоз может быть активирован различными факторами, характерными для определенных типов клеток, однако конечный путь апоптоза регулируется точно установленными генами и является общим, независимо от причины активации апоптоза.
Все факторы, усиливающие или ослабляющие апоптоз, могут действовать
- прямо на механизм гибели клетки ,
- опосредованно путем влияния на регуляцию транскрипции .
В некоторых случаях влияние этих факторов на апоптоз является решающим (например, при глюкокортикоид-зависимом апоптозе тимоцитов ), а в других не имеет особой важности (например, при Fas- и TNF-зависимом апоптозе ). В процессе регуляции принимает участие большое количество веществ, наиболее изученными из них являются вещества из семейства bcl-2
Bcl-2 ген впервые был описан как ген, который транслоцируется в клетках фолликулярной лимфомы и ингибирует апоптоз. При дальнейших исследованиях оказалось, что Bcl-2 является мультигеном , который обнаруживается даже у круглых червей. Также гомологичные гены были обнаружены в некоторых вирусах. Все вещества, относящиеся к данному классу делятся на активаторы и ингибиторы апоптоза .
К ингибиторам относятся: bcl-2, bcl-xL, Mcl-1, bcl-w, аденовирусный E1B 19K, Эпштейн-Барр-вирусный BHRF1.
К активаторам относятся bax, bak, Nbk/Bik1, Bad, bcl-xS.
Члены этого семейства взаимодействуют друг с другом. Одним из уровней регуляции апоптоза является взаимодействие белок-белок . Белки семейства bcl-2 формируют как гомо- так и гетеродимеры. Например, bcl-2-ингибиторы могут образовать димеры bcl-2-активаторами. Таким образом жизнеспособность клеток зависит от соотношения активаторов и ингибиторов апоптоза . Например, bcl-2 взаимодействует с bax, при этом при преобладании первого жизнеспособность клетки повышается, при избытке второго - уменьшается. К тому же белки семейства bcl-2 могут взаимодействовать с белками, не относящимися к этой системе. Например, bcl-2 может соединятся с R-ras , который активирует апоптоз. Другой белок, Bag-1, усиливает способность bcl-2 ингибировать апоптоз.
В настоящее время принято считать, что гены , участвующие в регуляции роста и развития опухолей (онкогены и гены-супрессоры опухолей ), играют регулирующую роль в индукции апоптоза. К ним относятся:
bcl-2 онкоген , который ингибирует апоптоз, вызванный гормонами и цитокинами, что приводит к повышению жизнеспособности клетки;
белок bax (также из семейства bcl-2 ) формирует димеры bax-bax , которые усиливают действие активаторов апоптоза. Отношение bcl-2 и bax определяет чувствительность клеток к апоптотическим факторам и является “молекулярным переключателем”, который определяет, будет ли происходит рост или атрофия ткани.
c-myc онкоген , чей белковый продукт может стимулировать либо апоптоз, либо рост клеток (при наличии других сигналов выживания, например, bcl-2 )
ген р53 , который в норме активирует апоптоз (wildtype – дикий тип), но при мутации (мутантный тип – обычно именно на него проводятся иммуногистохимические исследования в клетках опухолей, в данном случае количеством дикого типа пренебрегают, исходя из этого строится прогноз поведения опухолевой ткани, т.е. много белка-продукта гена р53 – прогноз неблагоприятный, т.к. речь идет об ингибировании апоптоза) или отсутствии (что обнаружено в некоторых опухолях) повышает выживаемость клеток. Установлено, что р53 необходим для апоптоза при повреждении клетки ионизирующим излучением, однако при апоптозе, вызванном глюкокортикоидами и при старении, он не требуется.
Снижение апоптоза
Продукт р53 гена следит за целостностью генома при митозе. При нарушении целостности генома клетка переключается на апоптоз. Наоборот, белок bcl-2 ингибирует апоптоз . Таким образом, недостаток р53 или избыток bcl-2 приводит к накоплению клеток : эти нарушения наблюдаются в различных опухолях. Изучение факторов регулирующих апоптоз имеет важное значение в разработке лекарственных препаратов, усиливающих гибель клеток злокачественных новообразований.
Аутоиммунные заболевания могут отражать нарушения в индукции апоптоза лимфоидных клеток, способных реагировать с собственными антигенами. Например, при системной красной волчанке наблюдается нарушение Fas-рецепторов на клеточной поверхности лимфоцитов, что ведет к активации апоптоза. Некоторые вирусы повышают свою выживаемость путем ингибирования апоптоза инфицированных клеток, например, вирус Эпштейна-Барра может воздействовать на обмен bcl-2 .
Ускорение апоптоза
Ускорение апоптоза доказано при синдроме приобретенного иммунодефицита (СПИД), нейротрофических заболеваниях и некоторых заболеваниях крови, при которых наблюдается дефицит каких-либо форменных элементов. При СПИДе вирус иммунодефицита может активировать CD4 рецептор на неинфицированных Т-лимфоцитах , ускоряя таким образом апоптоз, что приводит к истощению клеток данного типа.
Значение апоптоза в развитии организма и патологических процессах
Апоптоз играет важную роль в развитии млекопитающих и различных патологических процессах. Функционирование bcl-2 требуется для поддержания жизнеспособности лимфоцитов, меланоцитов, эпителия кишечника и клеток почек во время развития эмбриона. bcl-x необходим для ингибирования смерти клеток в эмбриогенезе, особенно в нервной системе. Bax необходим для апоптоза тимоцитов и поддержания жизнеспособности сперматозоидов во время их развития. р53 является геном супрессии опухолей, поэтому в эмбриогенезе особой роли не играет, но обязательно необходим для супрессии опухолевого роста. У мышей, у которых отсутствовали оба р53 гена, наблюдалась чрезвычайно высокая склонность к развитию злокачественных опухолей в результате полного или частичного нарушения апоптоза предопухолевых клеток. Усиленный синтез белка, кодируемого bcl-2 геном, приводит к подавлению апоптоза и, соответственно, развитию опухолей; данный феномен обнаружен в клетках В-клеточной фолликулярной лимфомы.
При лимфопролиферативных заболеваниях и похожей на системную красную волчанку болезни у мышей наблюдается нарушение функции Fas-лиганда или Fas-рецептора. Повышенный синтез Fas-лиганда может предупреждать отторжение трансплантата.
Апоптоз является частью патологического процесса при инфицировании клетки аденовирусами, ВИЧ и вирусами гриппа. Ингибирование апоптоза наблюдается при персистировании инфекции, в латентном периоде, а при усиленной репликации аденовирусов, возможно герпесвирусов, вируса Эпштейн-Барра и ВИЧ, наблюдается активация апоптоза, что способствует широкому распространению вируса.Итак, прямая связь апоптоза и многих патологических состояний очевидна. Исследования нарушения функции многих генов, регулирующих апоптоз дают возможность разрабатывать совершенно новые направления в терапии этих заболеваний. Разработка лекарственных средств, которые смогут регулировать апоптоз, откроет новые возможности в лечении злокачественных опухолей, вирусных инфекций, некоторых заболеваний нервной системы, иммунодефицитов и аутоиммунных заболеваний. Например, при злокачественных опухолях и лимфопролиферативных заболеваниях требуется усилить апоптоз, а при заболеваниях, характеризующихся поражением клеток, необходимо ослабить его.