Определенные химические реакции катализируются определенными. Физическая химия. Классификация химических реакций
Общая химия: учебник / А. В. Жолнин; под ред. В. А. Попкова, А. В. Жолнина. - 2012. - 400 с.: ил.
Глава 2. ОСНОВЫ КИНЕТИКИ ХИМИЧЕСКИХ РЕАКЦИЙ
Глава 2. ОСНОВЫ КИНЕТИКИ ХИМИЧЕСКИХ РЕАКЦИЙ
Разница между дыханием и горением только в скорости процесса.
А.-Л. Лавуазье
2.1. ХИМИЧЕСКАЯ КИНЕТИКА. ПРЕДМЕТ И ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ. СКОРОСТЬ РЕАКЦИИ
О направлении, глубине и принципиальной возможности протекания процесса судят по величине изменения свободной энергии (ΔG ≤0). Однако эта величина не говорит о реальной возможности протекания реакции в данных условиях.
Например, реакция взаимодействия закиси азота с кислородом протекает мгновенно при комнатной температуре:
В то же время 2Н 2 (г) + О 2 (г) = 2Н 2 О(ж), Δ°G = -286,8 кДж/моль - реакция, характеризующаяся значительно большим уменьшением свободной энергии, в обычных условиях взаимодействие не протекает, но при 700 °С или в присутствии катализатора процесс протекает мгновенно. Следовательно, термодинамика не отвечает на вопрос условий и скорости протекания процесса. В этом проявляется ограниченность термодинамического подхода. Для описания химической реакции необходимо знать также закономерности ее протекания во времени, которые изучает кинетика.
Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов.
В зависимости от того, в одной или нескольких фазах находятся компоненты реакции, различают кинетику гомогенных и гетерогенных реакций. По механизму реакции делятся на простые и сложные, поэтому выделяют кинетику простых и сложных реакций.
Основным понятием кинетики реакции является скорость химической реакции. Определение скорости химических реакций имеет биологическое и народно-хозяйственное значение.
Скорость химической реакции определяется количеством вещества, прореагировавшего за единицу времени в единице объема (в случае гомогенных реакций, когда реагирующие вещества находятся в одной фазе) или на единице поверхности раздела фаз (в случае гетерогенных реакций, когда реагирующие вещества находятся в различных фазах).
Скорость реакции характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в функции времени. Уравнение, описывающее зависимость скорости реакции (v) от концентрации (с) реагирующих веществ, называется кинетическим. Скорость реакции чаще выражают в моль/л-с, в биохимии в мг/100мл-с, или в массовой доле, в %/100 мл-с. Различают среднюю скорость реакции в интервале времени и истинную скорость реакции в определенный момент времени. Если в интервале времени t 1 и t 2 концентрация одного из исходных веществ или продуктов реакции равна соответственно с 1 и с 2 , то среднюю скорость реакции (v) в интервале времени t 1 и t 2 можно выразить:
Поскольку речь идет в данном случае об убыли концентрации исходного вещества, т.е. изменение концентрации вещества берется в этом случае со знаком «минус» (-). Если скорость реакции оценивается изменением (увеличением) концентрации одного из продуктов реакции, то со знаком «плюс» (+):
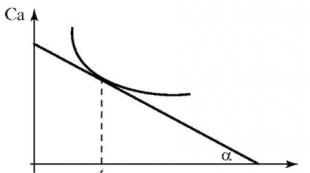
По уравнению (2.2) определяют среднюю скорость химической реакции. Истинную (мгновенную) скорость реакции определяют графически. Строят график зависимости концентрации исходного вещества или продукта реакции (Са) от времени (t) - кинетическую кривую реакции Са - f(t) для нелинейного процесса (рис. 2.1).
В каждый момент времени (например, t 1) истинная скорость реакции равна тангенсу угла наклона касательной к кинетической кривой в точке, соответствующей данному моменту времени. Согласно графику мгновенная скорость реакции будет рассчитываться по формуле:
В биохимии для описания кинетики ферментативных реакций используется уравнение Михаэлиса- Ментен, которое показывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса: E + S ↔ ES → E + P:

Рис. 2.1. Кинетическая кривая
где V m - максимальная скорость реакции; К м - константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной; S - концентрация субстрата.
Исследование скорости химической реакции позволяют получить информацию о ее механизме. Помимо концентрации скорость реакции зависит от природы реагентов, внешних условий и наличия катализатора.
2.2. МОЛЕКУЛЯРНОСТЬ И ПОРЯДОК РЕАКЦИИ. ПЕРИОД ПОЛУПРЕВРАЩЕНИЯ
В кинетике химические реакции различаются по признаку моле-кулярности и порядка реакции. Молекулярность реакции определяется числом частиц (атомов, молекул или ионов), одновременно участвующих в элементарном акте химического превращения. В элементарном акте реакции могут принимать участие одна, две или три молекулы. Вероятность соударения большего числа частиц очень мала. По этому признаку различают мономолекулярные, бимолекулярные и тримоле-кулярные реакции. Экспериментально молекулярность реакции можно определить только для элементарных (простых) реакций, протекающих в одну стадию в соответствии со стехиометрическим уравнением. Для протекания большинства подобных реакций требуется большая энергия активации (150-450 кДж/моль).
Большая часть реакций - сложные. Совокупность элементарных стадий, составляющих сложную реакцию, называется механизмом реак-
ции. Поэтому для характеристики кинетики реакции вводится понятие порядка реакции, который определяется по стехиометрическому уравнению.
Сумма стехиометрических показателей всех исходных веществ, входящих в уравнение реакции (2.5) (a + b), определяет общий порядок реакции. Показатель, с которым данный реагент входит в уравнение, называют порядком реакции по веществу (частный порядок реакции), например, показатель а - порядок реакции по веществу А, b - по веществу В. Порядок реакции и молекулярность совпадают только для простых реакций. Определяют порядок реакции те вещества, которые влияют на скорость реакции.
К мономолекулярным относятся реакции разложения и изомеризации.
Реакции, в уравнение скорости которых входит концентрация одного реагирующего вещества в первой степени, называют реакциями первого порядка.
В кинетическое уравнение входят вещества, концентрация которых изменяется в процессе реакции. Концентрации веществ, находящихся в значительном избытке, не изменяются в процессе реакции.
Вода в реакции гидролиза карбоната натрия находится в значительном избытке и в кинетическое уравнение не входит.
В гетерогенных системах столкновение частиц происходит на границе раздела фаз, поэтому масса твердой фазы не влияет на скорость реакции и поэтому не учитывается в выражении для скорости реакции.
К бимолекулярным относятся реакции димеризации и реакции замещения, протекающие через стадию активированного комплекса.
Реакции, скорость которых пропорциональна произведению концентраций двух веществ в первой степени или квадрату концентрации одного вещества, называются реакциями второго порядка.
Тримолекулярные реакции редки, а четырехмолекулярные не известны.
Среди биохимических процессов реакции третьего порядка не встречаются.
Реакции, скорость которых не зависит от концентрации исходных веществ, называются реакциями нулевого порядка (v = k).
Пример реакций нулевого порядка - каталитические реакции, скорость которых зависит только от концентрации катализатора. Частным случаем таких реакций являются ферментативные реакции.
В биохимических процессах участвуют, как правило, несколько реагентов (субстрат, кофермент, кофактор). Иногда не все они известны. Поэтому за ходом процесса судят по одному веществу. При этом количественной характеристикой протекания реакций во времени является период (время) полупревращения реагента - время, за которое количество или концентрация исходного вещества уменьшается в два раза (на 50%) или образуется половина продуктов реакции. Таким способом характеризуют, в частности, распад радионуклидов, так как их период полупревращения не зависит от исходного количества.
Анализируя зависимость периода полупревращения реакции от начальной концентрации, можно определить порядок реакции (способ Оствальда-Нойеса). Постоянством периода полупревращения (при данной температуре) характеризуются многие реакции разложения и вообще реакции первого порядка. С увеличением концентрации реагента период полупревращения уменьшается для реакций второго порядка и увеличивается для реакций нулевого порядка.
2.3. КОНСТАНТА СКОРОСТИ РЕАКЦИИ, ЕЕ ОПРЕДЕЛЕНИЕ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС
Скорость гомогенных реакций зависит от числа встреч реагирующих частиц в единицу времени в единице объема. Вероятность соударения взаимодействующих частиц пропорциональна произведению концентраций реагирующих веществ. Таким образом, скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции. Указанная закономерность называется законом действующих масс (закон скорости химической реакции), который является
основным законом химической кинетики. Закон действующих масс установлен норвежскими учеными К. Гульдбергом и П. Ваге в 1867 г.
Например, для реакции, протекающей в общем виде, согласно схеме
будет справедливо кинетическое уравнение:
где v - скорость химической реакции; с А и с В - концентрации веществ А и В [моль/л]; v a и v b - показатели порядка по реагентам A и B; k - константа скорости химической реакции - коэффициент, не зависящий от концентрации реагирующих веществ.
Константа скорости химической реакции (k) представляет собой скорость химической реакции в условиях, когда произведение концентраций реагирующих веществ равно 1 моль/л. В этом случае v = k.
Например, если в реакции Н 2 (г) + I 2 (г) = 2НI(г) c(H 2) и c(I 2) равны по 1 моль/л или если c(H 2) равна 2 моль/л, а c(I 2) 0,5 моль/л, то v = k.
Единицы измерения константы равновесия определяются стехиометрией реакции. Константы скорости реакций разных порядков сравнивать между собой некорректно, поскольку они являются разными по смыслу величинами, имеющими разные размерности.
2.4. МЕХАНИЗМ ХИМИЧЕСКИХ РЕАКЦИЙ. КЛАССИФИКАЦИЯ СЛОЖНЫХ РЕАКЦИЙ
Механизм реакций рассматривает все столкновения индивидуальных частиц, которые происходят одновременно или последовательно. Механизм дает детальную стехиометрическую картину каждой ступени реакции, т.е. понимание механизма означает установление молеку-лярности каждой ступени реакции. Изучение механизма химических реакций является очень сложной задачей. Ведь мы же не можем проводить прямые наблюдения за ходом взаимодействия молекул. Полученные результаты иногда зависят от размеров и формы сосуда. В некоторых случаях одни и те же результаты можно объяснить, используя разные механизмы.
Реакция газообразных водорода с йодом Н 2 (г) + I 2 (г) = 2НI(г) считалась классическим примером бимолекулярной реакции второго
порядка, но в 1967 г. Н.Н. Семенов, Г. Эйринг и Дж. Салливэн показали, что она имеет сложный характер и состоит из 3 элементарных реакций: I 2 = 2I; 2I = I 2 ; 2I + H 2 = 2HI. Хотя реакция формально может быть отнесена к тримолекулярным, ее скорость описывается кинетическим уравнением, напоминающим уравнение реакции второго порядка:

В сложных реакциях молекулярность и порядок реакции, как правило, не совпадают. Необычный - дробный или отрицательный - порядок реакции однозначно указывает на ее сложный механизм.
Кинетическое уравнение реакции окисления угарного газа кислородом 2СО(г) + O 2 (г) = СO 2 (г) имеет отрицательный (минус первый) порядок по СО:
при увеличении концентрации угарного газа скорость реакции уменьшается.
По механизму протекания реакции можно разделить на несколько типов.
Последовательными реакциями называют сложные реакции, в каждой из которых продукт (Х 1) первой элементарной стадии вступает в реакцию с продуктом второй стадии, продукт (Х 2) второй стадии вступает в третью и т.д., пока не образуется конечный продукт:

где S - субстрат (исходный реагент); k 1 , k 2 , k 3 ... - константа скорости 1, 2 и т.д. стадий реакции; P - конечный продукт.
Стадии последовательных реакций протекают с различной скоростью. Стадия, константа скорости которой минимальна, называется лимитирующей. Она определяет кинетическую закономерность реакции в целом. Вещества, образующиеся в промежуточных стадиях, называются промежуточными продуктами или интермедиатами, которые являются субстратами последующих стадий. Если интермедиат медленно образуется и быстро распадается, то его концентрация в течение длительного времени не изменяется. Практически все процессы метаболизма являются последовательными реакциями (например, метаболизм глюкозы).
Параллельными реакциями называют реакции, имеющие одни и те же исходные реагенты, которым соответствуют различные продукты. Скорость параллельных реакций равна сумме скоростей отдельных реакций. Это правило применимо и для бимолекулярных параллельных химических реакций.
Последовательно-параллельными реакциями называют реакции, имеющие одни и те же исходные реагенты, которые могут реагировать по двум путям (механизмам) и более, в том числе с разным количеством промежуточных стадий. Данный случай лежит в основе явления катализа, когда интермедиат одного из путей будет способствовать увеличению скорости других путей.
Конкурирующими реакциями называют сложные реакции, в которых одно и тоже вещество А одновременно взаимодействует с одним или несколькими реагентами В 1 , В 2 и т.д., участвует в одновременно протекающих реакциях: А + В 1 → Х 1 ; А + В 2 → Х 2 . Эти реакции конкурируют друг с другом за реагент А.
Сопряженными реакциями называют сложные реакции, в которых одна реакция протекает только в присутствии другой. В сопряженных реакциях промежуточное вещество служит связывающим звеном между первичным и вторичным процессами и обусловливает протекание обоих.
Живая клетка для своего существования нуждается в энергии. Универсальным источником энергии в живых организмах является аде-нозинтрифосфорная кислота (АТФ). Это соединение выполняет функцию аккумулятора энергии, так как при его взаимодействии с водой, т.е. гидролизе, образуются аденозиндифосфорная (АДФ) и фосфорная (Ф) кислоты и выделяется энергия. Поэтому АТФ называется макро-эргическим соединением, а разрывающаяся при его гидролизе связь Р-О-Р - макроэргической. Макроэргической связью называется химическая связь, при разрыве которой в результате реакции гидролиза выделяется значительная энергия:
Как известно, разрыв любой связи (в том числе и макроэргической) всегда требует затраты энергии. В случае же гидролиза АТФ, кроме процесса разрыва связи между фосфатными группами, для которого ΔG >0, происходят процессы гидратации, изомеризации и нейтрализации продуктов, образующихся при гидролизе. В результате всех этих процессов суммарное изменение энергии Гиббса имеет отрицательное
значение. Следовательно, макроэргическим является не разрыв связи, а энергетический результат ее гидролиза.
Для того чтобы в живых системах протекали эндэргонические реакции (ΔG >0), необходимо, чтобы они были сопряжены с экзэрго-ническими реакциями (ΔG <0). Такое сопряжение возможно, если обе реакции имеют какое-либо общее промежуточное соединение, и на всех стадиях сопряженных реакций суммарный процесс характеризуется отрицательным значением изменения энергии Гиббса (∑ΔG сопр.р <0). Например, синтез сахарозы является эндэргонической реакцией и самопроизвольно происходить не может:
Однако сопряжение этой реакции с экзэргонической реакцией гидролиза АТФ, сопровождающееся образованием общего промежуточного соединения глюкозо-1-фосфата, приводит к тому, что суммарный процесс имеет ∑ΔG <0:
Цепными реакциями называют химические и ядерные реакции, в которых появление активной частицы (свободного радикала или атома в химических, нейтрона в ядерных процессах) вызывает большое число (цепь) последовательных превращений неактивных молекул или ядер. Цепные реакции распространены в химии. По цепному механизму протекают многие фотохимические реакции, процессы окисления (горение, взрыв), полимеризации, крекинга. Теория цепных реакций разработана академиком H.H. Семеновым, С.Н. Хиншельвудом (Англия) и др. Основными стадиями цепных реакций являются: зарождение (инициация), продолжение (элонгация) и обрыв цепи (терминация). Различают два типа цепных реакций: реакции с неразветвленными и с разветвленными цепями. Особенность цепных реакций состоит в том, что один первичный акт активации приводит к превращению огромного числа молекул исходных веществ. Биохимические реакции свободно-радикального окисления являются цепными.
Периодическими (автоколебательными) реакциями называют сложные многостадийные автокаталитические реакции с участием нескольких веществ, в которых происходит периодическое колебание концентраций окисленной и восстановленной форм. Колебательные реакции открыты Б.П. Белоусовым, исследованы А.М. Жаботинским и др. Частота и форма колебаний зависят от концентраций исходных веществ, кислот-
ности, температуры. Примером таких реакций может являться взаимодействие броммалоновой кислоты с броматом калия в кислой среде, катализатором служит соль церия (III). Периодические реакции имеют большое значение для биологических объектов, где реакции подобного рода широко распространены.
Реакции твердофазного горения (реакции самораспространяющегося высокотемпературного синтеза, СВС) открыты в 1967 году в Институте химической физики АН СССР А.Г. Мержановым и И.Г. Боровинской. Сущность метода СВС заключается в том, что после локального инициирования реакции взаимодействия реагентов фронт реакции горения самопроизвольно распространяется по всей системе благодаря теплопередаче от горячих продуктов к исходным веществам, инициируя протекание в них реакции взаимодействия. Таким образом, осуществляется процесс горения, который является и причиной, и следствием протекания реакции. Механизм протекания реакций СВС является достаточно сложным и включает в себя процессы реакционной диффузии. Термин «реакционная диффузия» определяет совокупность явлений, происходящих при взаимодействии двух химически различных компонентов, способных образовывать химические соединения в виде твердых фаз. Продукты химического взаимодействия образуют сплошной слой, отличающийся по своему строению от исходных компонентов, но не мешающий протеканию дальнейшего взаимодействия.
2.5. ТЕОРИЯ АКТИВНЫХ СОУДАРЕНИЙ. ЭНЕРГИЯ АКТИВАЦИИ. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ И ТЕМПЕРАТУРЫ
Для того чтобы совершился элементарный акт химического взаимодействия, реагирующие частицы должны столкнуться друг с другом. Однако не каждое столкновение приводит к химическому взаимодействию. Последнее происходит в том случае, когда частицы приближаются на расстояния, при которых возможно перераспределение электронной плотности и возникновение новых химических связей. Взаимодействующие частицы должны обладать энергией, достаточной для преодоления сил отталкивания, возникающих между их электронными оболочками.
Переходное состояние - состояние системы, при котором уравновешены разрушение и создание связи. В переходном состоянии система
находится в течение небольшого (10 -15 с) времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации. В многоступенчатых реакциях, которые включают в себя несколько переходных состояний, энергия активации соответствует наибольшему значению энергии. После преодоления переходного состояния молекулы вновь разлетаются с разрушением старых связей и образованием новых или с преобразованием исходных связей. Оба варианта возможны, так как происходят с высвобождением энергии. Существуют вещества, способные уменьшить энергию активации для данной реакции.
Активные молекулы А 2 и B 2 при столкновении объединяются в промежуточный активный комплекс А 2 ...В 2 с ослаблением, а затем и разрывом связей А-А и В-В и упрочнением связей А-В.

«Энергия активации» реакции образования HI (168 кДж/моль) значительно меньше, чем энергия, необходимая для полного разрыва связи в исходных молекулах Н 2 и I 2 (571 кДж/моль). Поэтому путь реакции через образование активного (активированного) комплекса энергетически более выгоден, чем путь через полный разрыв связей в исходных молекулах. Через образование промежуточных активных комплексов происходит подавляющее большинство реакций. Положения теории активного комплекса разработаны Г. Эйрингом и М. Поляни в 30 годах XX в.
Энергия активации представляет собой избыток кинетической энергии частиц относительно средней энергии, необходимой для химического превращения сталкивающихся частиц. Реакции характеризуются различными величинами энергии активации (Е а). В большинстве случаев энергия активации химических реакций между нейтральными молекулами составляет от 80 до 240 кДж/моль. Для биохимических процессов значения Е а зачастую ниже - до 20 кДж/моль. Это объясняется тем, что абсолютное большинство биохимических процессов протекает через стадию фермент-субстратных комплексов. Энергетические барьеры ограничивают протекание реакции. Благодаря этому в принципе возможные реакции (при G <0) практически всегда не протекают
или замедляются. Реакции с энергией активации выше 120 кДж/моль настолько медленны, что их протекание трудно заметить.
Для осуществления реакции молекулы при столкновении должны быть определенным образом ориентированы и обладать достаточной энергией. Вероятность надлежащей ориентации при столкновении характеризуют с помощью энтропии активации ΔS a . Перераспределению электронной плотности в активном комплексе благоприятствует условие, когда при столкновении молекулы А 2 и В 2 ориентированы, как это показано на рис. 2.2, а, тогда как при ориентации, показанной на рис. 2.2, б, вероятность реакции еще гораздо меньше - на рис. 2.2, в.

Рис. 2.2. Благоприятная (а) и неблагоприятные (б, в) ориентации молекул А 2
и В 2 при столкновении
Уравнение, характеризующее зависимость скорости и реакции от температуры, энергии активации и энтропии активации, имеет вид:
где k - константа скорости реакции; A - в первом приближении общее число столкновений между молекулами за единицу времени (секунду) в единице объема; е - основание натуральных логарифмов; R - универсальная газовая постоянная; Т - абсолютная температура; Е а - энергия активации; ΔS a - изменение энтропии активации.
Уравнение (2.8) выведено Аррениусом в 1889 году. Предэкспо-ненциальный множитель A пропорционален общему числу соударений между молекулами в единицу времени. Его размерность совпадает с размерностью константы скорости и, следовательно, зависит от суммарного порядка реакции. Экспонента равна доле активных соударений от их общего числа, т.е. столкнувшиеся молекулы должны иметь доста-
точную энергию взаимодействия. Вероятность же их нужной ориентации в момент соударения пропорциональна e ΔSa/R
При обсуждении закона действующих масс для скорости (2.6) специально было оговорено, что константа скорости есть постоянная величина, не зависящая от концентраций реагентов. При этом предполагалось, что все химические превращения протекают при постоянной температуре. Вместе с тем хорошо известно, что быстрота химического превращения может существенно изменяться при понижении или повышении температуры. С точки зрения закона действующих масс это изменение скорости обусловлено температурной зависимостью константы скорости, так как концентрации реагирующих веществ лишь незначительно меняются вследствие теплового расширения или сжатия жидкости.
Наиболее хорошо известным фактом является возрастание скорости реакций с увеличением температуры. Такой тип температурной зависимости скорости называется нормальным (рис. 2.3, а). Этот тип зависимости характерен для всех простых реакций.

Рис. 2.3. Типы температурной зависимости скорости химических реакций: а - нормальная; б - аномальная; в - ферментативная
Однако в настоящее время хорошо известны химические превращения, скорость которых падает с увеличением температуры. В качестве примера можно привести газофазную реакцию азота (II) оксида с бромом (рис. 2.3, б). Такой тип температурной зависимости скорости называется аномальным.
Особый интерес для медиков представляет зависимость от температуры скорости ферментативных реакций, т.е. реакций с участием ферментов. Практически все реакции, протекающие в организме, относятся к этому классу. Например, при разложении водородперок-сида в присутствии фермента каталазы скорость разложения зависит от температуры. В интервале 273-320 °K температурная зависимость имеет нормальный характер. С увеличением температуры скорость возрастает, с уменьшением - падает. При подъеме температуры выше
320 °K наблюдается резкое аномальное падение скорости разложения пероксида. Сходная картина имеет место и для других ферментативных реакций (рис. 2.3, в).
Из уравнения Аррениуса для k видно, что, поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Зависимость скорости гомогенной реакции от температуры может быть выражена правилом Вант-Гоффа, согласно которому при увеличении температуры на каждые 10° скорость реакции возрастает в 2-4 раза; число, показывающее во сколько раз возрастает скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом скорости реакции - γ.
где k - константа скорости при температуре t °C. Зная величину γ, можно рассчитать изменение скорости реакции при изменении температуры от T 1 до T 2 по формуле:
При повышении температуры в арифметической прогрессии скорость возрастает в геометрической.
Например, если γ = 2,9, то при возрастании температуры на 100° скорость реакции увеличивается в 2,9 10 раз, т.е. в 40 тыс. раз. Отклонения от этого правила составляют биохимические реакции, скорость которых увеличивается в десятки раз при незначительном повышении температуры. Это правило справедливо лишь в грубом приближении. Реакции, в которых участвуют крупные молекулы (белка), характеризуются большим температурным коэффициентом. Скорость денатурации белка (яичного альбумина) возрастает в 50 раз при повышении температуры на 10 °С. После достижения некоторого максимума (50-60 °С) скорость реакции резко понижается в результате термоденатурации белка.
Для многих химических реакций закон действующих масс для скорости неизвестен. В таких случаях для описания температурной зависимости скорости превращения может применяться выражение:
Предэкспонента А с не зависит от температуры, однако зависит от концентрации. Единицей измерения является моль/л с.
Теоретическая зависимость позволяет заранее рассчитывать скорость при любой температуре, если известны энергия активации и предэкспонента. Таким образом, прогнозируется влияние температуры на быстроту протекания химического превращения.
2.6. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ РЕАКЦИИ. СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ. УРАВНЕНИЕ ИЗОТЕРМЫ РЕАКЦИИ
Химическая реакция не всегда «доходит до конца», другими словами, исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаться условия для протекания реакции в противоположном направлении. Действительно, если, например, смешать пары йода с водородом при температуре ~200 °С, то произойдет реакция: Н 2 + I 2 = 2HI. Однако известно, что йодоводород уже при нагревании до 180 °С начинает разлагаться на йод и водород: 2HI = Н 2 + I 2 .
Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называют обратимыми. При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k 1), справа налево - обратной (константа скорости обратной реакции k 2).
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере нарастания концентрации продуктов реакции. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными. Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называют химическим равновесием.
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. В момент достижения состояния химического равновесия скорости прямой и обратной реакций равны (кинетическое условие).
где K - константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций.
В правой части уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии - равновесные концентрации. Это уравнение представляет собой математическое выражение закона действующих масс при химическом равновесии. Особо следует отметить, что в отличие от закона действующих масс для скорости реакции в данном уравнении показатели степени a, b, d, f и т.д. всегда равны стехиометрическим коэффициентам в равновесной реакции.
Численное значение константы равновесия данной реакции определяет ее выход. Выходом реакции называют отношение количества получаемого в действительности продукта к тому количеству, которое получилось бы при протекании реакции до конца (выражается обычно в процентах). Так, при K >>1 выход реакции велик и, наоборот, при K <<1 выход реакции очень мал.
Константа равновесия связана со стандартной энергией Гиббса реакции следующим соотношением:
Используя уравнение (2.12), можно найти значение энергии Гиббса реакции через равновесные концентрации:

Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при ΔG <0 - реакция идет в прямом направлении, слева направо;
При ΔG = 0 - реакция достигла равновесия (термодинамическое условие);
при ΔG >0 - реакция идет в обратном направлении.
Важно понять, что константа равновесия не зависит от концентраций веществ. Справедливо обратное утверждение: в состоянии равновесия сами концентрации принимают такие значения, что отношение их произведений в степенях стехиометрических коэффициентов
оказывается постоянной величиной при данной температуре. Данное утверждение соответствует закону действующих масс и даже может использоваться в качестве одной из его формулировок.
Как было сказано выше, обратимые реакции не протекают до конца. Однако если один из продуктов обратимой реакции покидает сферу реакции, то по существу обратимый процесс протекает практически до конца. Если в обратимой реакции участвуют электролиты и один из продуктов этой реакции представляет собой слабый электролит, осадок или газ, то в этом случае реакция также протекает практически до конца. Необратимыми реакциями называют такие реакции, продукты которых не взаимодействуют друг с другом с образованием исходных веществ. Необратимые реакции, как правило, «доходят до конца», т.е. до полного израсходования хотя бы одного из исходных веществ.
2.7. ПРИНЦИП ЛЕ ШАТЕЛЬЕ
Состояние химического равновесия при неизменных внешних условиях теоретически может сохраняться бесконечно долго. В реальной действительности при изменении температуры, давления или концентрации реагентов равновесие может «сместиться» в ту или иную сторону протекания процесса.
Изменения, происходящие в системе в результате внешних воздействий, определяются принципом подвижного равновесия - принципом Ле Шателье.
Внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Применительно к трем основным типам внешнего воздействия - изменению концентрации, давления и температуры - принцип Ле Шателье трактуется следующим образом.
При увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации равновесие смещается в сторону образования этого вещества.
Влияние давления очень напоминает эффект изменения концентраций реагирующих веществ, но сказывается оно только на газовых системах. Сформулируем общее положение о влиянии давления на химическое равновесие.
При увеличении давления равновесие смещается в сторону уменьшения количеств газообразных веществ, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону возрастания
количеств газообразных веществ, т.е. в сторону увеличения давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на положение равновесия в этой системе.
При изменении температуры изменяются как прямая, так и обратная реакции, но в разной степени. Следовательно, для выяснения влияния температуры на химическое равновесие необходимо знать знак теплового эффекта реакции.
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры - в сторону экзотермической реакции.
Применительно к биосистемам принцип Ле Шателье гласит, что в биосистеме на каждое действие формируется такое же по силе и характеру противодействие, которое уравновешивает биологические регуляторные процессы и реакции и формирует сопряженный уровень их неравновесности.
При патологических процессах существующая замкнутость регу-ляторного контура нарушается. В зависимости от уровня неравновесности изменяется качество межсистемных и межорганных отношений, они приобретают все более нелинейный характер. Структуру и специфику этих взаимоотношений подтверждает анализ зависимости между показателями системы перекисного окисления липидов и уровнем антиоксидантов, между гармоническими показателями в условиях адаптации и патологии. Данные системы участвуют в поддержании антиокислительного гомеостаза.
2.8. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОПРОВЕРКИ ПОДГОТОВЛЕННОСТИ К ЗАНЯТИЯМ И ЭКЗАМЕНАМ
1.Какие реакции называются гомогенными, а какие гетерогенными? Приведите по одному примеру каждого типа реакций.
2.Какие реакции называют простыми, а какие сложными? Приведите по два примера простых и сложных реакций.
3.В каком случае молекулярность и порядок кинетического уравнения могут численно совпадать?
4.Скорость некоторой реакции с течением времени не изменяется. Изменится ли с течением времени период полупревращения этой реакции, и если изменится, то как? Дайте объяснение.
5.В каком случае истинная (мгновенная) скорость и средняя скорость реакции (в достаточно большом интервале времени) могут совпадать?
6.Вычислите константу скорости реакции A + B → AB, если при концентрациях веществ A и B, равных соответственно 0,5 и 0,1 моль/л, ее скорость равна 0,005 моль/л мин.
7.Период полупревращения некоторой реакции первого порядка равен 30 мин. Какая часть от первоначального количества вещества останется через час?
8.Дать понятие общего порядка реакции и порядка реакции по веществу.
9.Методы определения скорости реакции.
10.Основной закон химической кинетики.
11.Дать понятие механизма химических реакций.
12.Простые и сложные реакции.
13.Сопряженные реакции. От каких факторов зависит константа скорости химических реакций?
14.Скорость реакции действительно пропорциональна произведению концентраций реагирующих веществ в степени их стехиометри-ческих коэффициентов?
15.Какие требуются экспериментальные данные для определения порядка реакций?
16.Напишите кинетическое уравнение реакции H 2 O 2 + 2HI → I 2 + + 2H 2 O, если смешаны равные объемы 0,02 моль/л раствора H 2 O 2 и 0,05 моль/л раствора HI. Константа скорости 0,05 л/моль с.
17.Напишите кинетическое уравнение реакции H 2 O 2 + 2HI → I 2 + + 2H 2 O, учитывая, что она характеризуется первым порядком реакции по концентрациям обоих исходных веществ.
18.Докажите, что скорость химической реакции максимальна при стехиометрическом соотношении компонентов.
19.Перечислите возможные объяснения влияния температуры на скорость реакции.
2.9. ТЕСТОВЫЕ ЗАДАНИЯ
1. Согласно правилу Вант-Гоффа при повышении температуры на 10° скорость многих реакций:
а)уменьшается в 2-4 раза;
б)уменьшается в 5-10 раз;
в)увеличивается в 2-4 раза;
г)увеличивается в 5-10 раз.
2. Количество элементарных актов взаимодействия в единицу времени определяет:
а)порядок реакции;
б)скорость реакции;
в)молекулярность реакции;
г)период полупревращения.
3. Какие факторы влияют на увеличение скорости реакции?
а)природа реагирующих веществ;
б)температура, концентрация, катализатор;
в)только катализатор;
г)только концентрация;
д)только температура.
4. Во сколько раз увеличится скорость реакции 2А(г) + В(г) → А 2 В(г) при увеличении концентрации вещества А в 2 раза?
а)скорость не изменится;
б)увеличится в 18 раз;
в)увеличится в 8 раз;
г)увеличится в 4 раза;
д)увеличится в 2 раза.
5. Элементарная реакция А(тв) + 2В(г) → АВ 2 (г). Укажите правильное кинетическое уравнение этой реакции:
а)k[A][B] 2 ;
б)k[A][B];
в)к[В];
г)к[В] 2 ;
д)к[А].
6. Как нужно изменить давление в системе, чтобы увеличить скорость реакции А(тв) + 2В(г) → АВ 2 (г) в 9 раз?
а)увеличить давление в 9 раз;
б)уменьшить давление в 9 раз;
в)увеличить давление в 3 раза;
г)уменьшить давление в 3 раза.
7. Чему равен температурный коэффициент реакции γ 10 , если при охлаждении реакционной смеси на 30° скорость реакции уменьшилась в 8 раз?
а)16;
б)8;
в)6;
г)4;
д)2.
8. Какая реакция идет быстрее?
а)Е акт = 40 кДж/моль;
б) Е акт = 80 кДж/моль;
в) Е акт = 160 кДж/моль;
г) Е акт = 200 кДж/моль.
Кинетика химических реакций - учение о химических процессах, о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности: разработка рациональных принципов управления химическими процессами; стимулирование полезных, торможение и подавление нежелательных химических реакций; создание новых и усовершенствование существующих процессов и аппаратов в химической технологии; изучение поведения химических продуктов, материалов и изделий из них в различных условиях применения и эксплуатации.
Ввиду сложности реальных химических систем и необходимости учета большого числа факторов и условий проведения процесса, при выяснении оптимальных режимов получения нужных продуктов в современной К. х. широко используются быстродействующие электронные вычислительные машины.
Основные понятия химической кинетики
Система- совокупность находящихся во взаимодействии веществ, мысленно (или фактически) обособленная от окружающей среды.
Фаза- это часть системы, однородная во всех точках по составу и свойствам и отделённая от других частей системы поверхностью раздела, Вещество может находиться в трёх фазах: жидкой, твёрдой и газообразной.
В зависимости от количества фаз все системы и реакции в них делят на гомогенные и гетерогенные .
Гомогенные реакции протекают в одной фазе (как правило- газовой). Например, реакция взаимодействия между хлором и водородом, приводящая к образованию хлороводорода (однофазная система): Cl 2 + H 2 =2 HCl
Гетерогенные реакции протекают на поверхности раздела фаз. Примерам гетерогеннойреакции может служить реакция горения, протекающая на границе уголь-кислород (система, состоящая из двух фаз): С + О 2 =СО 2 : При 0 °С лед, вода и находящийся над ними пар образуют гетерогенную систему из трех фаз: твердой - льда, жидкой - воды и газообразной - водяного пара.
Молекулярность реакции определяется числом молекул, участвующих в самой медленной, лимитирующей стадии. Реакции бывают моно-, би-, три- и т.д. молекулярными. Мономолекулярной называется такая реакция, в которой лимитирующей стадией является превращение одной молекулы, например распад ее на составляющие (диссоциация молекул иода I 2 = 2I ) или превращение в другую молекулу в результате внутримолекулярной перестройки:

Бимолекулярная реакция – это взаимодействие двух молекул (например, молекулярного водорода с молекулярным иодом, H 2 + I 2 = 2HI ). Реакция, протекающая одновременно с участием трех молекул, называется тримолекулярной . Поскольку вероятность столкновения сразу трех молекул, да еще в правильной взаимной ориентации, очень мала, такие реакции происходят редко.
Порядок реакции. Порядок реакции – это эмпирическая величина, равная сумме показателей степеней, с которыми концентрации реагентов входят в выражение для скорости реакции. Так, для реакции
a A + b B = m M + n N
Порядок реакции в этом случае равен а + b .
Реакции первого порядка- это реакции, в которых скорость зависит от концентрации только одного реагента в первой степени. Уравнению первого порядка следуют многие химические реакции. Например, С 2 Н 5 ОН = С 2 Н 4 + Н 2 О
Реакции второго порядка – это реакция, в которой скорость пропорциональна квадрату концентрации отдельного реагента или концентрациям каждого из двух реагирующих веществ в первой степени. Например: 1) 2НВ r = Н 2 + В r 2 или 2) CH 3 Br + KOH = CH 3 OH + KBr
Реакции третьего порядка это реакция, в которой скорость может зависеть от концентрации одного реагента в третьей степени, либо концентрации одного реагента во второй степени и второго реагента в первой степени, либо от концентрации каждого из трех реагентов в первой степени.
Исследования кинетики различных взаимодействий показывают, что чаще других встречаются реакции 1-го, 2-го и иногда третьего порядков. Но существуют реакции и других порядков.
Реакции нулевого порядка - это реакция, в которой скорость не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях).
Как правило, для большинства простых реакций порядок реакции и её молекулярность совпадают и определяются вышеописанными способами. Но для реакций, протекающих в несколько стадий, порядок реакции определяется экспериментально или на основании сложных математических расчётов.
Основным понятием в химической кинетике является, понятие о скорости реакции.
Одни реакции протекают практически мгновенно (например, нейтрализация кислоты основанием), другие при обычных условиях идут настолько медленно, что заметные изменения концентраций реагентов наблюдаются лишь через несколько лет (например, взаимодействие водорода с кислородом с образованием воды в отсутствие катализатора). При этом существует множество реакций, протекающих с вполне измеримыми скоростями в обычных условиях. Химическая кинетика занимается определением скоростей химических реакций и изучением их механизма.
Скорость химической реакции
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени (вступившего в реакцию или образовавшегося в результате реакции) в единице объема системы (для гомогенной р-и) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
С(концентрация)
Где 1 -изменение концентрации исходного вещества; 2 - изменение концентрации продукта реакции
Из
этого графика следует, что при химическом
взаимодействии концентрация каждого
из исходных веществ уменьшается во
времени (С 2  С>0).
С>0).
В химической кинетике различают среднюю и истинную (мгновенную) скорость.
Средняя скорость.
Если при неизменных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от С 1 до С 2 за промежуток времени от t 1 до t 2 , то в соответствии с определением средняя скорость прямой реакции за данный промежуток времени равна:
=
-
Знак “-” в правой части уравнения появляется т. к. по мере протекания реакции (t 2 -t 1 > 0) концентрация реагентов убывает, следовательно, С 2 -С 1 < О, а так как скорость реакции всегда положительна, то перед дробью следует поставить знак “-”.
Если речь идёт о скорости как прямой, так и обратной реакции, то эта формула имеет вид:
=

Истинная скорость.
Истинная
скорость реакции определяется пределом,
к которому стремится отношение
 С/
С/ t
при
t
при
 t
0
,
т. е. производной концентрации по времени:
t
0
,
т. е. производной концентрации по времени:
=
Обычно для реакций, протекающих в газах или растворах, концентрации реагентов выражают в моль/л, а скорость реакции - в моль/(л* с).
Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции - энергией сталкивающихся молекул.
Химическая кинетика — это раздел химии, изучающий скорости реакций и влияние на них различных факторов.
В гомогенном (однофазном) процессе реакция протекает во всём объёме системы и её скорость характеризуется изменением концентрации любого реагента , или любого продукта в единицу времени. Различают среднюю скорость v ср = ±ΔС/Δt, где ΔC - изменение молярной концентрации за период времени Δt , и истинную скорость в момент времени t, представляющую собой производную от концентрации по времени: v = ±dС/dt.
Скорость каждой конкретной реакции в отсутствие катализатора зависит от концентраций реагентов и от температуры. Скорость гетерогенных реакций, протекающих на межфазной поверхности раздела, зависит также от величины этой поверхности.
Влияние концентраций реагентов на скорость реакций устанавливается законом дейст-вующих масс: при фиксированной температуре скорость реакции пропорциональна произве-дению концентраций реагентов в степенях, равных стехиометрическим коэффициентам.
Для реакции аА + bВ = сС + dD математическое выражение закона действующих масс, называемое кинетическим уравнением реакции, записывается: v = kС А а С B b , где k — коэффициент пропорциональности, носящий название константы скорости, С A и С B — молярные концентрации реагентов, а и b — их стехиометрические коэффициенты. Сумма показателей степеней в кинетическом уравнении называется порядком реакции. В многостадийных реакциях порядок реакции может быть дробным, но не более 3.
Вкинетических уравнениях реакций концентрации веществ в конденсированном со-стоянии ввиду их неизменности не указываются . Эти постоянные концентрации в качестве составных частей входят в константу скорости.
Механизмом реакции называют совокупность стадий химической реакции, в результате которых исходные вещества превращаются в конечные. Реакции могут быть одностадийными и многостадийными. Скорость реакции определяется скоростью самой медленной ее стадии (лимитирующей стадии).
Различают гомогенные и гетерогенные химические реакции . Реакции, протекающие в однофазной (однородной) системе, например, жидкой или газообразной, называются гомогенными . Такие реакции протекают во всем объеме системы. Реакции, протекающие в многофазных системах (состоящих из двух или более фаз, например, газообразной и твердой фазы) называются гетерогенными . Такие реакции протекают только на поверхности раздела фаз. Скорость гетерогенной реакции определяется изменением концентрации реагирующих веществ на единице поверхности в единицу времени.
Молекулярностью реакции называется число частиц, участвующих в элементарном акте химического взаимодействия. В реальных реакциях молекулярность может быть равна 1, 2, 3. В простых реакциях, протекающих в одну стадию, порядок совпадает с молекулярностью. Закон действующих масс справедлив для простых реакций. В случае сложных реакций, протекающих в несколько стадий, закон применим к любой отдельной реакции, но не к их сумме.
Зависимость скорости реакции от температуры объясняется тем, что, как уже отмечалось, скорость реакции зависит от числа соударений участвующих в реакции частиц (атомов, молекул, ионов). Но не все соударения приводят к химическому взаимодействию. Для того чтобы реакция произошла, частицы должны обладать некоторым избыточным количеством энергии (по сравнению со средней величиной), называемым энергией активации (E А). Чем выше температура, тем больше частиц имеет энергию, большую или равную E А. Поэтому скорость реакции увеличивается с повышением температуры. Константа скорости химической реакции определяется числом эффективных столкновений, т.е. числом активных молекул, способных вступить в химическую реакцию. Зависимость константы скорости реакции от температуры и энергии активации выражается уравнением Аррениуса :
где k - константа скорости реакции, Z - постоянная, называемая стерическим фактором и зависящая от числа столкновений, приводящих к реакции; е - основание натурального логарифма (е = 2,7183...); - энергия активации, Дж/моль; R - газовая постоянная (R = 8,314 Дж/К·моль), Т - температура, К.
Химическое равновесие устанавливается в обратимых реакциях — в реакциях, которые могут протекать как в прямом, так и в обратном направлении. Если реакция аА + bВ ↔ cC + dD) обратима, это означает, что реагенты А и В способны превращаться в продукты С и D (прямая реакция), а продукты С и D в свою очередь могут, реагируя между собой, вновь образовывать исходные вещества А и В (обратная реакция).
Термодинамическим условием химического равновесия является неизменность энергии Гиббса реакции, т.е. rG = 0, а кинетическим условием равновесия — равенство скоростей прямой (v 1) и обратной (v 2) реакции: v 1 = v 2.
Так как в состоянии химического равновесия и прямая, и обратная реакции протекают с одинаковыми скоростями, концентрации реагентов и продуктов во времени не изменяются. Эти не изменяющиеся во времени концентрации называются равновесными. Равновесные концентрации, в отличие от неравновесных, изменяющихся в ходе реакции, принято обозначать особым образом, а именно, формулой вещества, заключённой в квадратные скобки. Например, записи [Н 2 ], означают, что речь идёт о равновесных концентрациях водорода и аммиака.
При заданной температуре соотношение равновесных концентраций реагентов и продуктов есть величина постоянная и характерная для каждой реакции. Это соотношение количественно характеризуется величиной константы химического равновесия Кс, равной отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций реагентов, возведённых в степени, равные их стехиометрическим коэффициентам.
Для обратимой реакции аА + bВ ↔ cС + dD выражение Кс имеет вид:
Кс= . Так же как в кинетических уравнениях реакций, в выражениях констант равновесия концентрации веществ в конденсированном состоянии, ввиду их постоянства, не записы-ваются.
Для реакций с участием газов константа химического равновесия может быть выражена не только через равновесные концентрации, но и через равновесные парциальные давления газов. В этом случае символ константы равновесия "К" индексируется не символом концентрации "с", а символом давления "р".
В равновесном состоянии, характеризующимся равенством скоростей прямой и обратной реакции, система может находиться сколь угодно долго, если не происходит изменения условий. При изменении условий равенство скоростей v 1 = v 2 нарушается, одна из двух реакций начинает протекать с большей скоростью. Это выражают, говоря, что в системе происходит смещение (сдвиг) химического равновесия.
Если в результате изменения условий в системе с большей скоростью начинает протекать прямая реакция, т.е. v 1 > v 2 , равновесие смещается в сто-рону прямой реакции — вправо и, наоборот, если скорость обратной реакции становится больше скорости прямой реакции, т.е. выполняется условие v 2 > v 1 , происходит сдвиг равно-весия в сторону обратной реакции — влево.
Сдвиг химического равновесия можно осуществить изменением концентраций реагентов или продуктов и изменением температуры, а для реакций с участием газов ещё и изменением давления . Направление смещения равновесия при таких изменениях условий определяется принципом Ле Шателье (принципом противодействия): если в равновесной системе изменить условия, в ней произойдёт сдвиг равновесия в сторону той реакции, которая противодействует произведённому изменению.
Задача 1. Для данной химической реакции напишите кинетическое уравнение и определите теоретический порядок реакции. Рассчитайте, как изменится скорость реакции при указанных изменениях условий протекания реакции: Fe 2 O 3 (тв) + 3CO(г) → 2Fe(тв) + 3CO 2 (г)
Во сколько раз изменится (увеличится или уменьшится) скорость реакции если:
а) увеличить давление в 2 раза;
б) увеличить объем реакционной смеси в 2 раза
в) повысить температуру на 40?С (γ = 2)
г) понизить температуру на 20?С (γ = 2)
Fe 2 O 3 (тв) + 3CO(г) → 2Fe (тв) + 3CO 2 (г) - реакция гетерогенная (участвуют вещества в различающихся фазовых состояниях).
Кинетическое уравнение: υ 1 = k · с 3 (CO),
k - константа скорости. В кинетическое уравнение гетерогенных реакций входят только концентрации газов или растворенных в растворителе веществ .
Теоретический порядок реакции: 3 (cумма показателей степеней концентраций в кинетическом уравнении называется теоретическим порядком реакции).
Расчет изменения скорости реакции:
а) при увеличении давления в 2 раза: скрость реакции до увеличения давления описывается кинетическим уравнением:
υ 1 = k · с 3 (CO), где с 3 (CO) - начальная (исходная) концентрация оксида углерода (II).
При увеличении давления происходит и увеличение концентрации, т.е. если давление увеличить в 2 раза, то и концентрация увеличится в 2 раза, поэтому кинетическое уравнение реакции после изменения давления имеет следующий вид:
υ 2 = k · (2с) 3 (CO), где (2с) 3 (CO) концентрация оксида углерода (II) после повышения давления в системе в 2 раза.
= = = 2 3 = 8 - скорость реакции возрастет в 8 раз.
б) при увеличении объема реакционной смеси в 2 раза:
увеличение объема реакционной смеси в 2 раза приведет к уменьшению концентрации газа в 2 раза: υ 1 = k · с 3 (CO), где с 3 (CO) - начальная (исходная) концентрация оксида углерода (II).
υ 2 = k (CO), где (CO) - концентрация оксида углерода (II) после увеличении объема реакционной смеси в 2 раза.
Изменение скорости реакции () :
= = = - скорость реакции уменьшится в 8 раз.
в) повышение температуры на 40°С (γ = 2):
При изменении температуры скорость реакции изменяется по правилу Вант-Гоффа :
По данным условия задачи температура повышалась на 40°С , следовательно
ΔТ = Т 2 - Т 1 = 40,
= 2 40/10 = 2 4 = 16 - скорость реакции возрастет в 16 раз.
г) понижение температуры на 20°С (γ = 2):
При изменении температуры скорость реакции изменяется по правилу Вант-Гоффа:
= γ ΔТ/10 , где γ - температурный коэффициент реакции, ΔТ - изменение температуры (Т 2 - Т 1), υ 1 - скорость реакции при температуре Т 1 , υ 2 - скорость реакции при температуре Т 2 .
По данным условия задачи температура понижалась на 20°С ,
следовательно ΔТ =Т 1 - Т 2 = -20,
= 2 -20/10 = 2 -2 = - скорость реакции уменьшится в 4 раза.
Задача 2. 1) Для обратимых реакций
CuO(тв) + CO(г) ↔ Cu(тв) + CO 2 (г) + QN 2 (г) + O 2 (г) ↔ 2NO (г) - Q, определите, в какую сторону сместится равновесие реакции, если:
а) увеличить температуру; б) уменьшить температуру
2) Для обратимых реакций:
C 2 H 2 (г) + 2H 2 (г) ↔ C 2 H 6 (г)
3S(тв) + H 2 О(г) ↔ 2H 2 S(г) + SО 2 (г)
С(тв) + О 2 (г) ↔ СО 2 (г), определите, в какую сторону сместится равновесие реакции, если:
а) увеличить давление; б) уменьшить давление
3) Для обратимой реакции:
Fe 2 O 3 (тв) + 3H 2 (г) ↔ 2Fe(тв) + 3H 2 O (г), определите, в какую сторону сместится равновесие реакции, если:
а) увеличить концентрацию Н 2 ;
б) уменьшить концентрацию Н 2 ;
в) увеличить концентрацию H 2 O
г) уменьшить концентрацию H 2 O
Направление, в котором смещается химическое равновесие, определяется по принципу Ле Шателье : если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
1) Увеличение температуры смещает равновесие в сторону эндотермической реакции (-Q), уменьшение температуры смещает равновесие в сторону экзотермической реакции (+ Q).
CuO(тв) + CO(г) ↔ Cu(тв) + CO 2 (г) + Q
В данном случае:
- прямая реакция CuO(тв) + CO(г) → Cu(тв) + CO 2 (г) + Q - экзотермическая ,
- обратная реакция Cu(тв) + CO 2 (г) → CuO(тв) + CO(г) - Q - эндотермическая ,
следовательно :
а) при увеличении температуры равновесие сместится в сторону обратной реакции (в сторону образования реагентов, влево (←)),
б) при уменьшении температуры равновесие сместится в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
N 2 (г) + O 2 (г) ↔ 2NO (г) - Q
В данном случае:
прямая реакция N 2 (г) + O 2 (г) → 2NO(г) - Q - эндотермическая ,
обратная реакция 2NO (г) → N 2 (г) + O 2 (г) + Q - экзотермическая ,
следовательно :
а) при увеличении температуры равновесие сместится в сторону прямой реакции (в сторону образования продуктов, вправо(→))
б) при уменьшении температуры равновесие сместится в сторону обратной реакции (в сторону образования реагентов, влево(←)).
2) Увеличение давления смещает равновесие в сторону той реакции, в которой количество молекул газов уменьшается . Уменьшение давления смещает равновесие в сторону той реакции, в которой количество молекул газов увеличивается .
В системе C 2 H 2 (г) + 2H 2 (г) ↔ C 2 H 6 (г) прямая реакция (C 2 H 2 (г) + 2H 2 (г) → C 2 H 6 (г)) протекает с уменьшением количества молекул газов (из трех молекул исходных газов образуется одна молекула конечного продукта), а обратная реакция
(C 2 H 6 (г) → C 2 H 2 (г) + 2H 2 (г)) - протекает с увеличением числа молекул (из одной молекулы C 2 H 6 образуется три новые (одна молекула C 2 H 2 и две молекулы H 2).
Следовательно :
а) увеличение давления смещает равновесие в сторону прямой реакции (в сторону образования продуктов, вправо(→));
б) уменьшение давления смещает равновесие в сторону обратной реакции (в сторону образования реагентов, влево(←)).
В системе 3S(тв) + H 2 О(г) ↔ 2H 2 S(г) + SО 2 (г) прямая реакция (3S(тв) + H 2 О(г) → 2H 2 S(г) + SО 2 (г)) протекает с увеличением количества молекул газов, а обратная (2H 2 S(г) + SО 2 (г) → 3S(тв) + H 2 О(г)) - протекает с уменьшением молекул газов (S(сера) - твердое вещество, количества молекул твердых веществ не учитываются).
Следовательно:
а) увеличение давления смещает равновесие в сторону обратной реакции (в сторону образования реагентов, влево (←));
б) уменьшение давления смещает равновесие в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
В системе С(тв) + О 2 (г) ↔ СО 2 (г) количества молекул газов среди реагентов и среди продуктов равны (одна молекула О 2 и одна молекула СО 2 (г)), следовательно изменение давления (увеличение или уменьшение) не повлияет на смещение химического равновесия в данной системе.
а) увеличение давления равновесие не смещает;
б) уменьшение давления равновесие не смещает.
3) а) увеличение концентрации реагентов смещает равновесие в сторону образования продуктов, следовательно:
для данной реакции Fe 2 O 3 (тв) + 3H 2 (г) ↔ 2Fe(тв) + 3H 2 O (г) увеличение концентрации реагента Н 2 приведет к смещению равновесия в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
б) уменьшение концентрации реагентов смещает равновесие в сторону образования реагентов, следовательно:
для данной реакции Fe 2 O 3 (тв) + 3H 2 (г) ↔ 2Fe(тв) + 3H 2 O (г) увеличение концентрации реагента Н 2 приведет к смещению равновесия в сторону обратной реакции (в сторону образования реагентов, влево (←));
в) увеличение концентрации продуктов смещает равновесие в сторону образования реагентов, следовательно:
для данной реакции Fe 2 O 3 (тв) + 3H 2 (г) ↔ 2Fe(тв) + 3H 2 O (г) увеличение концентрации продукта Н 2 О приведет к смещению равновесия в сторону обратной реакции (в сторону образования реагентов, влево (←));
г) уменьшение концентрации продуктов смещает равновесие в сторону образования продуктов, следовательно:
для данной реакции Fe 2 O 3 (тв) + 3H 2 (г) ↔ 2Fe(тв) + 3H 2 O (г) уменьшение концентрации продукта Н 2 О приведет к смещению равновесия в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
Задача 3. 1) Для обратимой реакции Fe 2 O 3 (тв) + 3CO(г) ↔ 2Fe(тв) + 3CO 2 (г) рассчитайте константу равновесия, если начальная концентрация СО равна 3 моль/л, к моменту наступления равновесия прореагировало 75% СО.
2) Для обратимой реакции S(тв) + H 2 (г) ↔ H 2 S(г) рассчитайте равновесные концентрации веществ, если начальная концентрация H 2 равна 3 моль/л, а константа равновесия Кр = 15.
В) Для обратимой реакции 2NH 3 (г) ↔ 3H 2 (г) + N 2 (г) рассчитайте начальную концентрацию NH 3 и константу равновесия данной реакции, если равновесные концентрации веществ равны = 0,4 моль/л, = 1,2 моль/л, [Н 2 ] = 3,6 моль/л.
Для решения данных задач удобно пользоваться таблицей следующего вида :
1) Константа равновесия в гетерогенных реакциях зависит только от концентрации газов, поэтому количества твердых веществ (Fe 2 O 3 (тв) и Fe(тв)) не учитываются.
В строку начальных концентраций вписываем начальную концентрацию CO - 3 моль/л. Начальная концентрация CO 2 равна нулю (это продукт реакции, которого в момент начала реакции еще не образовалось).
По условию к моменту наступления равновесия прореагировало 75% СО, т.е. 3 моль 0,75 = 2,25 моль.
В результате реакции образовалось 2,25 моль CO 2 , т.к. по уравнению реакции количество CO 2 равно количеству CO.
После реакции останется следующие количество CO:
С нач - С прореаг = 3 моль - 2,25 моль = 0,75 моль.
Таким образом, равновесные концентрации будут равны: = 0,75 моль/л = 2,25 моль/л
Рассчитываем константу химического равновесия (в соответствии с Законом действующих масс: в состоянии химического равновесия при определенной температуре произведение концентраций продуктов реакции в степенях, показатели которых равны соответствующим коэффициентам в стехиометрическом уравнении реакции, деленное на аналогичное произведение концентраций реагентов в соответствующих степенях, представляет собой постоянную величину)
Кр = = =27
2)
В гетерогенных реакциях учитываются только концентрации газов.
Начальная концентрация H 2 равна по условию 3 моль/л. Начальная концентрация H 2 S равна нулю (это продукт реакции, которого в момент начала реакции еще не образовалось).
Пусть образоваллось хмоль H 2 . В этом случае концентрация H 2 S также будет равна хмоль (т.к. по уравнению реакции их соотношение 1:1). Равновесная концентрация H 2 рассчитывается:
С равн = С нач - С прореаг = (3 - х) моль, а равновесная концентрация H 2 S: С равн =
= С нач + С прореаг = 0 + х = х моль.
Выражение для константы равновесия данной реакции имеет следующий вид:
Кр = , подставляя известные данные, получим уравнение:
15 = , отсюда х = 45-15х;
16х = 45; х = 2,8
Таким образом, равновесная концентрация H 2 S:
= х = 2,8моль/л
Равновесная концентрация H 2:
= 3-х = 3 - 2,8 = 0,2 моль/л
3) Составляем таблицу по уравнению реакции:
В строку равновесных концентраций записываем данные в задаче концентрации веществ. Количество прореагировавшего NH 3 можно рассчитать по количеству любого из полученных веществ: например, соотношение NH 3 и N 2 по уравнению реакции составляет 2:1, значит, если после реакции образовалось 1,2 моль N 2 , то NH 3 прореагировало в 2 раза больше: n(NH 3) = 2 · 1,2 = 2,4 моль.
Начальная концентрация NH 3 рассчитывается:
С нач = С прореаг + С равн = 2,4 + 0,4 = 2,8 моль/л.
Химическая кинетика - один из важнейших разделов химии, задача которого - трактовка качественных и количественных изменений химического процесса, происходящих во времени. Обычно эту общую задачу подразделяют на две более конкретные:
1) выявление механизма реакции - установление элементарных стадий процесса и последовательности их протекания (качественные изменения);
2) количественное описание химической реакции - установление строгих соотношений, которые могли бы удовлетворительно предсказывать изменения количеств исходных реагентов и продуктов по мере протекания реакции.
Как правило, химическая реакция протекает в несколько промежуточных стадий, которые, складываясь, дают суммарную реакцию.
Кинетическое уравнение химической реакции (с учетом механизма реакции) может быть получено только в результате экспериментального изучения реакции и не может быть выведено из стехиометрического уравнения суммарной реакции. При обсуждении механизмов реакций принято различать реакции по их молекулярности, т.е. по числу молекул, участвующих в каждом элементарном акте взаимодействия. По этому признаку различают реакции мономолекулярные, бимолекулярные и тримолекулярные.
Мономолекулярными называются реакции, в которых элементарный акт представляет собой химическое превращение одной молекулы, которое в общем виде можно описать уравнением
Бимолекулярные - это такие реакции, элементарный акт в которых осуществляется при столкновении двух молекул
![]()
В тримолекулярных реакциях элементарный акт осуществляется при одновременном столкновении трех молекул
![]()
Столкновение более чем трех молекул одновременно практически невероятно, поэтому реакции большей молекулярности на практике не обнаружены.
Основным понятием в химической кинетике является понятие о скорости реакции:
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Если при неизменных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от до за промежуток времени от до то в соответствии с определением скорость реакции за данный промежуток времени равна:
Знак в правой части уравнения появляется по следующей причине. По мере протекания реакции концентрация реагентов убывает, следовательно, , а так как скорость реакции всегда положительна, то перед дробью следует поставить знак
Обычно для реакций, протекающих в газах или растворах, концентрации реагентов выражают в моль/л, а скорость реакции - в моль/(л с).
Скорость каждой химической реакции зависит как от природы реагирующих веществ, так и от условий, в которых реакция протекает. Важнейшими из этих условий являются: концентрация, температура и присутствие катализатора (явление катализа рассмотрено ниже). Природа реагирующих веществ оказывает решающее влияние на скорость химической реакции. Так, например, водород с фтором реагирует очень энергично уже при комнатной температуре, тогда как с бромом значительно медленнее даже при нагревании.
Влияние концентрации реагирующих веществ может быть объяснено из представлений, согласно которым химическое взаимодействие является результатом столкновения частиц. Увеличение числа частиц в заданном объеме приводит к более частым их столкновениям, т.е. к увеличению скорости реакции.
Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики - законом действующих масс.
Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ.
Для мономолекулярной реакции типа (5.3) скорость реакции v определяется концентрацией молекул вещества А:
![]()
где k - коэффициент пропорциональности, который называется константой скорости реакции; - молярная концентрация вещества A.
В случае бимолекулярной реакции типа (5.4) ее скорость определяется концентрацией молекул не только вещества А, но и вещества В:
![]()
В случае тримолекулярной реакции типа (6.5) скорость реакции выражается уравнением:
![]()
В общем случае, когда в реакцию вступают одновременно m молекул вещества молекул вещества В, т.е.
![]()
уравнение скорости реакции имеет вид
![]()
Это уравнение есть математическое выражение закона действующих масс в общем виде.
Чтобы понять физический смысл константы скорости реакции, надо принять в написанных выше уравнениях, что (либо приравнять единице их произведение) и тогда Отсюда ясно, что константа скорости k численно равна скорости реакции, когда концентрации реагирующих веществ (или их произведение в уравнениях скорости) равны единице.
Особенно нужно подчеркнуть, что выражение (5.7) получено для данной, фиксированной температуры. В общем же случае, поскольку скорость реакции зависит от температуры, закон действующих масс нужно зависать как
где v и k являются функциями температуры.
Зависимость скорости химической реакции от концентрации реагирующих веществ типа (5.7) справедлива для газов и реакций, протекающих в растворах.
Она не распространяется на реакции с участием твердых веществ, так как в этих случаях взаимодействие молекул происходит не во всем объеме реагирующих веществ, а лишь на поверхности, от размера которой также зависит скорость реакции. Поэтому реакции в гетерогенных системах протекают значительно сложнее.
Гетерогенной называется система, состоящая из отдельных частиц, находящихся в различных агрегатных состояниях и разграниченных между собой определенными поверхностями раздела. Отдельные однородные части гетерогенной системы называются ее фазами. Например, при О °С лед, вода и находящийся над ними пар образуют гетерогенную систему из трех фаз: твердой - льда, жидкой - воды и газообразной - водяного пара; кислота и реагирующие с нею кусочки металла образуют систему из трех фаз и т.д.
В гетерогенной системе реакция всегда происходит на поверхности раздела двух фаз, так как только здесь молекулы различных фаз могут сталкиваться между собой. Поэтому скорость гетерогенной реакции зависит не только от рассмотренных ранее факторов, но и от величины поверхности соприкосновения между реагирующими фазами. Всякое увеличение поверхности приводит и к увеличению скорости реакции. Например, растворение металлов в кислотах протекает намного быстрее, если брать металлы в виде порошков.
Влияние температуры.
Многочисленные опыты показывают, что при повышении температуры скорость большинства химических реакций существенно увеличивается, причем для реакций в гомогенных системах при нагревании на каждые десять градусов скорость реакции возрастает в 2-4 раза (правило Вант-Гоффа).
Это правило связано с понятием температурного коэффициента скорости реакции у и определяется соотношением
![]()
полученным из соотношения (5.8).
При температурах, не очень значительно изменяющихся, для многих реакций в соответствии с правилом Вант-Гоффа
Значение температурного коэффициента у дает возможность рассчитать изменение скорости реакции при увеличении температуры на некоторое число градусов от до по формуле
Иначе говоря, из (5.10) очевидно, что при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической. Как можно объяснить столь высокую температурную зависимость скорости реакции?
Казалось бы, такая зависимость связана с увеличением числа молекулярных столкновений. Оказалось, что это не так. Было доказано, что общее число столкновений молекул при повышении температуры на десять градусов возрастает всего на несколько процентов, тогда как число прореагировавших молекул возрастает на 200-400 %.
Чтобы объяснить наблюдаемые расхождения, С. Аррениус впервые показал, что влияние температуры сводится к увеличению числа активных молекул, т.е. таких молекул, которые в момент столкновения обладают энергией, не меньше определенной для данной реакции величины, называемой энергией активации химической реакции.
Энергия активации - это некоторое избыточное количество энергии (по сравнению со средней), необходимое для вступления молекул в реакцию.
Согласно Аррениусу, константа скорости химической реакции в (5.8) зависит от температуры экспоненциально
![]()
Здесь Е - энергия активации - универсальная газовая постоянная, Т - температура в К, А - константа.
Различие между энергией активации и тепловым эффектом реакции
наглядно иллюстрируется схемой на рис. 5.1.

Рис. 5.1. Соотношение между энергией активации и изменением энтальпии (теплового эффекта) реакции
Сама энергия активации обусловлена энергетическим барьером, который необходимо преодолеть сталкивающимся молекулам в прямом () или обратном направлениях, прежде чем произойдет перераспределение связей.
Понятие о катализе.
Одно из наиболее сильных средств воздействия на скорость химических реакций - использование катализаторов.
Катализатором называется вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.
Влияние катализаторов на скорость реакции называется катализом. Когда взаимодействующие вещества и катализатор находятся в одном агрегатном состоянии, говорят о гомогенном катализе. При гетерогенном катализе реагирующие вещества и катализатор находятся в различных агрегатных состояниях: обычно катализатор - в твердом, а реагирующие вещества - в жидком или газообразном (например, в случае окисления в присутствии платины или оксида ванадия (V) происходит гетерогенный катализ).
Механизм действия катализаторов может быть самым разнообразным и, как правило, очень сложным. Основной гипотезой, объясняющей влияние катализатора на скорость реакции, является предположение об образовании промежуточных продуктов при взаимодействии катализатора и реагирующего вещества. Бели химическая реакция без катализатора происходит медленно, а в присутствии катализатора К быстро, то его действие объясняется тем, что катализатор реагирует с одним из исходных веществ, образуя непрочное (как правило, очень реакционноспособное) промежуточное соединение АК (или ВК):
Образовавшееся промежуточное соединение (например, АК) взаимодействует с другим исходным веществом В, образуя конечный продукт реакции АВ и выделяя катализатор К в первоначальном виде:
Приведенная простейшая схема катализа (5.12), (5.13) ясно показывает, почему каждая частица катализатора может принимать участие в реакции бесчисленное множество раз. (Правда, «бесчисленное» - только теоретически, потому что практически некоторые вещества, даже в очень малых количествах, могут резко снижать скорость каталитической реакции, уменьшая или полностью уничтожая активность катализатора. Такие вещества называют каталитическими ядами, а само явление снижения активности катализатора - отравлением.) Отсюда ясно, почему катализатор после окончания реакции остается количественно и химически неизменным.
Скорость химической реакции
Скорость химической реакции
определяется как изменение молярной концентрации одного из реагирующих веществ за единицу времени. Скорость химической реакции - величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на -1.
Например для реакции скорость можно выразить так:
В 1865 году Н.Н. Бекетовым и в 1867 году К.М. Гульдбергом и П. Вааге был сформулирован закон действующих масс , согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени . Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности реагирующих веществ.
Порядок химической реакции
ПОРЯДОК РЕАКЦИИ по данному веществу - показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Переходное состояние
Катализ
Катализ - процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами.
Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Каталитические реакции - реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) - при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного - снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.
Катализаторы, замедляющие химическую реакцию, называются ингибиторами.
В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе.
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
Н О + I = H O + IO
Н O + IO = Н O + O + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела - катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель. Механизм гетерогенного катализа сложнее, чем у гомогенного.
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия реагирующих веществ к поверхности твердого вещества.
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их.
3. Химическая реакция между реагирующими молекулами.
4. Десорбция продуктов с поверхности катализатора.
5. Диффузия продукта с поверхности катализатора в общий поток.
Примером гетерогенного катализа является окисление SO в SO на катализаторе V O при производстве серной кислоты (контактный метод).
Промоторы (или активаторы) - вещества, повышающие активность катализатора. При этом промоторы могут сами и не обладать каталитическими свойствами.
Каталитические яды - посторонние примеси в реакционной смеси, приводящие к частичной или полной потере активности катализатора. Так, следы мышьяка, фосфора вызывают быструю потерю катализатором V O активности (контактный метод производства H SO).
Многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов.
Биохимические реакции в растительных и животных организмах ускоряются биохимическими катализаторами - ферментами.
Скорость процесса - чрезвычайно важный фактор, определяющий производительность оборудования химических производств. Поэтому одна из основных задач, поставленных перед химией научно-технической революцией, это поиск путей увеличения скорости реакций. Другая важ- ная задача современной химии, обусловленная резко возрастающими масштабами производства химических продуктов,- повышение избирательности химических превращений в полезные продукты, уменьшение количества выбросов и отходов. С этим связана, кроме того, и охрана окружающей среды и более рациональное использование истощающихся, к сожалению, природных ресурсов.
Для достижения всех этих целей нужны верные средства, и такими средствами служат прежде всего катализаторы. Однако изыскивать их не так просто. B процессе познания внутреннего устройства окружающих нас вещей ученые установили определенную градацию, иерархию уровней микромира. Мир, описываемый в нашей книге,- это мир молекул, взаимные превращения которых составляют предмет химии. Нас будет интересовать не вся химия, а только часть ее, посвященная изучению динамики изменения химической структуры молекул. Видимо нет надобности говорить о том, что молекулы построены из атомов, а последние- из ядра и окружающей его электронной оболочки; что свойства молекул зависят от природы составляющих их атомов и последовательности соединения их друг с другому что химические и физические свойства веществ зависят от свойств молекул и характера их взаимосвязи. Будем считать, что все это в общих чертах известно читателю, и потому главный упор сделаем на вопросах, связанных с представлением о скорости химических реакций.
Взаимные превращения молекул протекают с самой различной скоростью. Скорость можно изменять, нагревая или охлаждая смесь реагирующих молекул. При нагревании скорость реакции, как правило, возрастает, но это не единственное средство ускорения химических превращений. Существует еще один, более эффективный способ - каталитический, широко используемый в наше время в производстве самых разнообразных продуктов.
Первые научные представления о катализе возникли одновременно с развитием атомной теории строения вещества. В 1806 г., через год после того, как один из создателей современной атомистической теории Дальтон сформулировал в «Записках Манчестерского литературного и философского общества» закон кратных отношений, Клеман и Дезорм опубликовали подробные данные об ускорении процесса окисления сернистого газа в присутствии окислов азота при камерном производстве серной кислоты. Шесть лет спустя в «Технологическом журнале» Кирхгоф изложил результаты своих наблюдений об ускоряющем действии разбавленных минеральных кислот на гидролиз крахмала до глюкозы. Этими двумя наблюдениями была открыта эпоха экспериментального изуче- ния необычных для того времени химических явлений, которым шведский химик Берцелиус дал в 1835 г. общее название «катализ» от греческого слова «каталоо» - разрушать. Такова, в двух словах, история открытия ка- тализа, который с полным основанием следует отнести к одному из фундаментальных явлений природы.
Теперь нам следует дать современное и наиболее общепринятое определение катализа, а затем и некоторую общую классификацию каталитических процессов, так как именно с этого начинается любая точная наука. Как известно, «физика - это то, чем занимаются физики (то же самое можно сказать и о химии)». Следуя этому наставлению Бергмана, можно было бы ограничиться утверждением, что «катализ - это то, чем занимаются и химики и физики». Но, естественно, такого шутливого объяснения недостаточно, и со времен Берцелиуса давалось множество научных определений понятию «катализ». На наш взгляд наилучшее определение сформулировано Г. К. Вересковым: «Феноменологически катализ можно определить как возбуждение химических реакций или изменение их скорости под действием веществ - катализаторов, многократно вступающих в промежуточные химические взаимодействия с участниками реакции и восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав».
Самое странное в этом определении его заключительная часть - вещество, ускоряющее химический процесс, не расходуется. Если нужно ускорить движение тяжелого тела, его подталкивают и, следовательно, затрачивают на это энергию. Чем больше потрачено энергии, тем большую скорость приобретает тело. В идеальном случае количество затраченной энергии будет точно равно приобретенной телом кинетической энергии. В этом проявляется фундаментальный закон природы - сохранение энергии.
Видные деятели химии о катализе
И. Берцелиус (1837): «Известные вещества оказывают при соприкосновении с другими веществами такое влияние на последние, что возникает химическое действие,- одни вещества разрушаются, другие образуются вновь без того, чтобы тело, присутствие которого вызывает эти превращения, принимало в них какое-либо участие. Мы называем причину, вызывающую эти явления, каталитической силой».
М. Фарадей (1840). «Каталитические явления можно объяснить известными свойствами материи, не снабжая ее при этом никакой новой силой».
П. Рашиг (1906): «Катализ представляет вызываемое внешними причинами изменение строения молекулы, имеющее следствием изменение химических свойств».
Э. Абель (1913): «Я пришел к выводу, что катализ осуществляется в результате реакции, а не простого присутствия вещества».
Л. Гурвич (1916): «Каталитически действующие тела, притягивая к себе движущиеся молекулы гораздо сильнее, чем тела, лишенные каталитического действия, тем самым увеличивают силу удара, попадающих на их поверхность молекул».
Г. К. Боресков (1968): «Когда-то катализ рассматривался как особое, немного таинственное явление, со специфическими законами, раскрытие которых должно было сразу в общей форме решить задачу подбора. Сейчас мы знаем, что это не так. Катализ по своей сущности - химическое явление. Изменение скорости реакции при каталитическом воздействии обусловлено промежуточным химическим взаимодействием реагирующих веществ с катализатором».
Если не принимать во внимание неудачную попытку Берцелиуса связать наблюдаемые явления с действием скрытой «каталитической силы», то, как можно заметить из приведенных выступлений, дискуссия шла в основном вокруг физических и химических аспектов катализа. Длительное время особенно популярной была энергетическая теория катализа, связывающая процесс возбуждения молекул с резонансной миграцией энергии. Катализатор вступает во взаимодействие с реагирующими молекулами, образуя неустойчивые промежуточные соединения, которые распадаются с выделением продукта реакции и химически неизменного катализатора. Современные наши знания лучше всего отражены в высказывании Борескова. Здесь, однако, возникает вопрос, а не может ли катализатор, поскольку он сам химически участвует в реакции, создать новое равновесное состояние? Если бы это было так, то идея о химическом участии катализатора немедленно вступала бы в противоречие с законом сохранения энергии. Чтобы избежать этого, ученые были вынуждены принять, а затем и экспериментально доказать, что катализатор ускоряет реакцию не только в прямом, но и в обратном направлениях. Те же соединения, которые изменяют и скорость и равновесие реакции, в строгом смысле этого слова не являются катализаторами. Нам остается добавить, что обычно в присутствии катализатора имеет место ускорение химических реакций, и это явление называют «положительным» катализом в отличие от «отрицательного», при котором введение катализатора в реакционную систему вызывает снижение скорости. Строго говоря, катализ всегда повышает скорость реакции, но иногда ускорение одной из стадий (например, появление нового пути обрыва цепей) приводит к наблюдаемому торможению химической реакции.
Мы будем рассматривать только положительный катализ, который принято подразделять на следующие типы:
а) гомогенный, когда реакционная смесь и катализатор находятся или в жидком или в газообразном состоянии; б) гетерогенный - катализатор находится в виде твердого вещества, а реагирующие соединения в виде раствора или газообразной смеси; (Это наиболее распространенный тип катализа, осуществляемого, таким образом, на границе раздела двух фаз.) в) ферментативный - катализатором служат сложные белковые образования, ускоряющие течение биологически важных реакций в организмах растительного и животного мира. (Ферментативный катализ может быть как гомогенным, так и гетерогенным, но из-за специфических особенностей действия ферментов целесообразно выделение этого вида катализа в самостоятельную область.) Гомогенный катализ
Среди многочисленных каталитических реакций особое место занимает катализ в цепных реакциях. «Цепными реакциями, как известно, называются такие химические и физические процессы, в которых образование в веществе или в смеси веществ некоторых активных частиц (активных центров) приводит к тому, что каждая из активных частиц вызывает целый ряд (цепь) последовательных превращений вещества» (Эмануэль, 1957).
Такой механизм развития процесса возможен благодаря тому, что активная частица взаимодействует с веществом, образуя не только продукты реакции, но и новую активную частицу (одну, две или более), способную к новой реакции превращения вещества, и т. д. Возникающая при этом цепь превращений вещества продолжается до тех пор, пока активная частица не исчезает из системы (происходит «гибель» активной частицы и обрыв цепи). Наиболее трудная стадия при этом - зарождение активных частиц (например, свободных радикалов), после же зарождения цепь превращений осуществляется легко. Цепные реакции широко распространены в природе. Полимеризация, хлорирование, окисление и многие другие химические процессы идут по цепному, а точнее - по радикально-цепному (с участием радикалов) механизму. Механизм окисления органических соединений (на ранних стадрях) в настоящее время установлен достаточно тщательно. Если обозначить окисляющееся вещество R-H (где Н - атом водорода, имеющий наименьшую прочность связи с остальной молекулой R), то этот механизм можно записать в следующем виде:
Катализаторы, например соединения металлов переменной валентности, могут оказывать влияние на любую из рассмотренных стадий процесса. Остановимся теперь на роли катализаторов в процессах вырожденного разветвления цепей. Взаимодействие гидроперекиси с металлом может приводить как к ускорению так и к торможению реакции окисления органических веществ соединениями металлов переменной валентности в зависимости от характера продуктов, образующихся при распаде гидроперекиси. Соединения металлов образуют с гидроперекисями комплекс, который распадается в «клетке» растворителя среды, если обра-зующиеся при распаде комплекса радикалы успеют выйти из клетки, то они инициируют процесс (положительный катализ). Если же эти радикалы не успеют выйти и рекомбинируют в клетке в молекулярные неактивные продукты, то это приведет к замедлению радикально-цепного процесса (отрицательный катализ), поскольку в этом случае гидроперекись - потенциальный поставщик новых радикалов- расходуется вхолостую.
До сих пор мы рассматривали лишь неглубокие стадии процессов окисления; на более глубоких стадиях например в случае окисления углеводородов, образуются кислоты, спирты, кетоны, альдегиды, которые также могут реагировать с катализатором и служить дополнительным источником свободных радикалов в реакции, т. е. в этом случае будет налицо дополнительное вырожденное разветвление цепей.
Гетерогенный катализ
К сожалению, до сих пор, несмотря на достаточно большое число теорий и гипотез в области катализа, многие основополагающие открытия были сделаны случайно или в результате простого эмпирического подхода. Как известно, случайно был найден ртутный катализатор сульфирования ароматических углеводородов М. А. Ильинским, который нечаянно разбил ртутный термометр: ртуть попала в реактор, и реакция пошла. Аналогичным образом были обнаружены теперь всем хорошо известные, а в свое время открывшие новую эру в процессе полимеризации катализаторы стереоспецифической полимеризации Циглера. Естественно, что такой путь развития учения о катализе не соответствует современному уровню науки, и именно этим объясняется повышенный интерес к изучению элементарных стадий процессов в гетерогенно-каталитических реакциях. Эти исследования - прелюдия для создания строго научных основ подбора высокоэффективных катализаторов. Во многих случаях роль гетерогенных катализаторов в процессе окисления сводится к адсорбции органического соединения и кислорода с образованием на поверхности катализатора адсорбированного комплекса этих веществ. Такой комплекс разрыхляет связи компонентов и делает их более реакционноспособными. В некоторых случаях катализатор адсорбирует лишь один компонент, который диссоциирует на радикалы. Например, пропилен на закиси меди диссоциирует с образованием аллильного радикала, легко вступающего затем в реакцию с кислородом. Выяснилось, что каталитическая активность металлов переменной валентности в значительной мере зависит от заполнения d-орбиталей в катионах окислов металлов.
По каталитической активности в реакции разложения многих гидроперекисей соединения металлов располагаются следующим ря-
Мы рассмотрели один из возмжных путей инициирования процесса - взаимодействие гидроперекиси с катализатором. Однако в случае окисления реакция гетерогенного инциирования цепей может протекать как путем распада на радикалы гидроперекиси, так и путем взаимодействия углеводорода с кислородом, активированным поверхностью катализатора. Инициирование цепей может быть обусловлено участием заряженной формы органического соединения RH+, образующегося при взаимодействии RH с катализатором. Так обстоит дело с катализом в реакциях инициирования (зарождения и разветвления) цепей. Роль гетерогенных катализаторов в реакциях продолжения цепи особенно четко подчеркивается изменением скорости и направления изомеризации перекисных радикалов.
Катализ в биохимии
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира. Многие жизненно важные химические реакции, протекающие в клетке (что-то около десяти тысяч), управляются особыми органическими катализаторами, именуемыми ферментами или энзимами. Термину «особый» не следует уделять пристального внимания, так как уже известно, из чего построены эти ферменты. Природа избрала для этого один единственный строительный материал - аминокислоты и соединила их в полипептидные цепи различной длины и в разной последовательности
Это так называемая первичная структура фермента, где R - боковые остатки, или важнейшие функциональные группы белков, возможно, выступающие в качестве активных центров ферментов. На эти боковые группы и ложится основная нагрузка при работе фермента, пептидная же цепь играет роль опорного скелета. Согласно структурной модели Полинга - Кори, она свернута в спираль, которая в обычном состоянии стабилизирована водродными связями между кислотными и основными центрами:
Для некоторых ферментов установлены полный аминокислотный состав и последовательность расположения их в цепи, а также сложная пространственная структура. Но это все же очень часто не может помочь нам ответить на два главных вопроса: 1) почему ферменты так избирательны и ускоряют химические превращения молекул только вполне определеyyой структуры (которая нам тоже известна); 2) каким образом фермент снижает энергетический барьер, т. е. выбирает энергетически более выгодный путь, благодаря чему реакции могут протекать при обычной температуре.
Строгая избирательность и высокая скорость - два основных признака ферментативного катализа, отличающие его от лабораторного и производственного катализа. Ни один из созданных руками человека катализаторов (за исключением, пожалуй, 2-оксипиридина) не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы. Активность фермента, как и любого другого катализатора, тоже зависит от температуры: с повышением температуры возрастает и скорость ферментативной реакции. При этом обращает на себя внимание резкое снижение энергии активации Е по сравнению к некаталитической реакцией. Правда, это происходит не всегда. Известно много случаев, когда скорость возрастает благодаря увеличению независящего от температуры предэкспоненциального множителя в уравнении Аррениуса.
Равновесие
Константа химического равновесия
Свободная энергия
Ссылки
Химическая кинетика и катализ Лекции А. А. Кубасова, к. хим. н, доцента кафедры физической химии Химического факультета МГУ.
См. также
- Теория столкновений
- Теория переходного состояния
Wikimedia Foundation . 2010 .
Смотреть что такое "Кинетика химическая" в других словарях:
Раздел физической химии, учение о скоростях и механизмах химических реакций. Кинетика химическая научная основа создания новых и совершенствования существующих процессов химической технологии. Методы кинетики химической используются в биологии и… … Большой Энциклопедический словарь
Область физ. химии, в к рой изучают механизмы и скорости хим. реакций. К. х. включает три осн. задачи: изучение закономерностей протекания хим. реакций во времени и зависимость их скоростей от концентраций реагентов, темп ры и др. факторов;… … Физическая энциклопедия
КИНЕТИКА ХИМИЧЕСКАЯ - (от греч. kinesis движение), отдел теоретической химии, посвященный изучению законов хим. реакций. Можно наметить несколько типов хим. взаимодействий и прежде всего отличать реакции, протекающие в гомогенной (однородной) среде, от реакций,… … Большая медицинская энциклопедия
Кинетика химическая - – раздел физической химии, изучающей скорость и механизмы химических реакций, закономерности изменения во времени концентраций исходных, промежуточных компонентов и конечных продуктов реакций, описываемых кинетическими кривыми. [Ушеров… … Энциклопедия терминов, определений и пояснений строительных материалов
Раздел физической химии; учение о скоростях и механизмах химических реакций. Химическая кинетика научная основа создания новых и совершенствования существующих процессов химической технологии. Методы химической кинетики используются в биологии и … Энциклопедический словарь
Кинетика химических реакций, учение о химических процессах о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической… … Большая советская энциклопедия
- (от греч. kinetikos движущий), раздел физ. химии, изучающий хим. р цию как процесс, протекающий во времени, механизм этого процесса, его зависимость от условий осуществления. К. х. устанавливает временные закономерности протекания хим. р ций,… … Химическая энциклопедия
Учение о скоростях и механизмах (совокупности и последовательности стадий) хим. реакции; раздел физической химии. Скорость хим. реакций в замкнутых системах определяется по изменению концентрации исходных, промежуточных или конечных в в (молекул … Большой энциклопедический политехнический словарь