آلية عمل PNO. عامل نخر الورم (TNF): دوره في الجسم ، التحديد في الدم ، الإعطاء على شكل أدوية. عندما يتم جدولة الدراسة
المحرر العلمي: M. Merkusheva ، جامعة سانت بطرسبرغ الطبية الحكومية سميت بعد أكاد. بافلوفا ، الطب العام.
سبتمبر 2018.
المرادفات:عامل نخر الورم ، عامل نخر الورم - ألفا ، TNF-alpha ، сachectin.
معلومات عامة
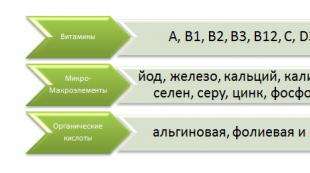
يعتبر عامل نخر الورم (TNF) مكونًا مهمًا في قتل الخلايا السرطانية. يقوم هذا البروتين (أو مزيج منهما) بتحفيز استجابة الجسم المناعية لأي منبه خارجي ، سواء كان التهابًا أو عدوى أو إصابة أو ورمًا.
يسمح لك اختبار TNF بتحديد وجود و / أو مرحلة السرطان أو مرض جهازي آخر واختيار استراتيجية علاج فعالة.
لأول مرة ، تم العثور على هذا المكون في دم فئران التجارب بعد مجموعة من التطعيمات الروتينية.
تلعب TNF دورًا في تطوير:
- أمراض المناعة الذاتية (التهاب المفاصل الروماتويدي) ،
- تلف الدماغ الإقفاري ،
- تصلب متعدد،
- الخرف عند مرضى الإيدز ،
- تعتبر واحدة من العلامات الهامة للضرر الذي يصيب حمة الكبد في التهاب الكبد الوبائي سي ، إلخ.
يتم تطوير طرق لاستخدام الأجسام المضادة وحيدة النسيلة لعامل نخر الورم في علاج الإنتان والأمراض الالتهابية والأورام.
TNF هو بروتين شبيه بالهرمونات (السيتوكين) تنتجه خلايا الدم البيضاء - الكريات البيض. يتداخل مع عملية التمثيل الغذائي للدهون والكربوهيدرات ويسبب الإرهاق والدنف في المرضى الذين يعانون من الأورام والأمراض المعدية طويلة الأمد ، ويؤثر على عمليات تخثر الدم ، وهو المسؤول عن عمل الخلايا البطانية (الخلايا التي تبطن جدران الأوعية الدموية من الداخل) ، إلخ. ينشط إنتاج البروتينات في المرحلة الحادة من الالتهاب في الكبد ، ويعزز تدفق الخلايا الليمفاوية التائية والبائية من نخاع العظام إلى الدم والهجرة إلى بؤرة الالتهاب ، ويلعب دورًا رئيسيًا في تطور الإنتان و الصدمة الإنتانية.
هناك نوعان من عامل نخر الورم: ألفا وبيتا.
- نادرا ما يتم اكتشاف TNF-alpha في دم شخص سليم ، فقط في حالة تغلغل الكائنات الحية الدقيقة المرضية والسموم. وقت استجابة الجسم حوالي 40 دقيقة ، وبعد 1.5-3 ساعات يصل تركيز TNF-alpha في مصل الدم إلى ذروته.
- يتم الكشف عن TNF-beta في الدم بعد 2-3 أيام فقط من ملامسة المستضد (مهيج).
يعتمد التأثير البيولوجي لعامل نخر الورم على تركيزه: في التركيزات المنخفضة ، يعمل بشكل أساسي في مكان الإنتاج ، في التركيزات المتوسطة ، يدخل مجرى الدم ، ويعمل كهرمون ، ويمارس تأثيرًا بيروجينيًا ، ويحفز تكوين الخلايا البلعمية ، ويعزز تخثر الدم ، يقلل الشهية ، بتركيزات عالية يمكن أن يؤدي إلى تعفن الدم.
يلعب عامل نخر الورم ، جنبًا إلى جنب مع السيتوكينات الأخرى ، دورًا رئيسيًا في تطور الأمراض التنكسية العصبية مثل مرض الزهايمر ومرض باركنسون. تبدأ الخلايا العصبية النشطة في تصنيع عامل نخر الورم ، مما يؤدي إلى حدوث التهاب في الجهاز العصبي المركزي وتدمير الخلايا العصبية.
TNF في علم الأورام
جعلت التجارب مع الفئران من الممكن إثبات اعتماد عملية الأورام على تركيز عامل نخر الورم في الجسم - فكلما ارتفع مستواه ، تموت الأنسجة السرطانية بشكل أسرع. ينشط عامل نخر الورم مستقبلات خاصة تحدد الخلية الخبيثة ، وتمنع انقسامها الإضافي وتساهم في موتها (النخر). يعمل عامل نخر الورم بنفس الطريقة على الخلايا المصابة بالفيروسات والكائنات الدقيقة المسببة للأمراض. في الوقت نفسه ، لا تشارك الأنسجة السليمة المحيطة في عملية تدمير الخلايا المرضية.
بالإضافة إلى حقيقة أن TNF له تأثير سام للخلايا (مضاد للورم) ، فإن هذا البروتين:
- يشارك في التنظيم الذاتي لجهاز المناعة ، وينشط الدفاعات ؛
- مسؤول عن العمليات التالية في الجسم:
- هجرة (حركة) خلايا المناعة (الكريات البيض) ؛
- موت الخلايا المبرمج (انهيار وموت الخلايا الخبيثة) ؛
- منع تكوين الأوعية الدموية (تكوين وانتشار الأوعية الدموية الورمية) ؛
- قد تؤثر على الخلايا السرطانية المقاومة لأدوية العلاج الكيميائي.
اختبار عامل نخر الورم هو تحديد تركيز شكل ألفا من البروتين في مصل الدم. عيب هذه التقنية هو انخفاض خصوصيتها ، أي عدم القدرة على إنشاء علم أمراض معين. لذلك ، فإن إجراء تشخيص دقيق يتطلب عددًا من الاختبارات المعملية الأخرى ( التحليل العامالدم والبول ، الأشعة المقطعية ، الموجات فوق الصوتية ، تخطيط القلب ، الأشعة السينية ، إلخ).
مؤشرات لتحليل TNF
قد يصف الطبيب هذا الاختبار لتقييم الحالة العامة لجهاز المناعة في حالة تكرار الأمراض المنتظمة وانتكاسات أمراض المناعة الذاتية.
كما أن هذا الفحص مفيد للغاية في تشخيص الأمراض التالية:
- مرض الرئة المزمن
- الحروق والإصابات.
- علم أمراض النسيج الضام.
- عمليات الأورام
- تصلب الشرايين في أوعية الدماغ والقلب ، ومرض الشريان التاجي (IHD) ، وفشل القلب المزمن.
- اضطرابات المناعة الذاتية (تصلب الجلد ، الذئبة الحمامية الجهازية ، إلخ) ؛
- التهاب البنكرياس الحاد (التهاب البنكرياس).
- تلف الكبد (تسمم الكحول) ، تلف لحمة في التهاب الكبد الوبائي سي ؛
- الصدمة الإنتانية (مضاعفات الأمراض المعدية) ؛
- الانتباذ البطاني الرحمي (تكاثر أنسجة الجدران الداخلية للرحم) ؛
- رفض الزرع أو الكسب غير المشروع بعد الزرع ؛
- اعتلالات الأعصاب (العمليات المرضية في الأعصاب).
أي طبيب يصف التحليل
يعطي إحالة للتحليل ويحلل النتائج
- طبيب الأورام
- أخصائي الأمراض المعدية ،
- علم المناعة
- طبيب عام.
نورم لـ TNF
الأهمية!تختلف الأسعار اعتمادًا على الكواشف والمعدات المستخدمة في كل مختبر محدد. لذلك ، عند تفسير النتائج ، من الضروري استخدام المعايير المعتمدة في المختبر حيث تم تقديم التحليل.
ومع ذلك ، في المختبرات الحديثة ، تعتبر القيمة هي القاعدة
يجب أن يؤخذ في الاعتبار أن هذا المؤشر تمت دراسته في الديناميات ، أي يجب إجراء العديد من الاختبارات للحصول على نتائج موثوقة.
الأهمية!يتم تفسير النتائج دائمًا بطريقة شاملة. من المستحيل إجراء تشخيص دقيق بناءً على تحليل واحد فقط.
زاد TNF
غالبًا ما يتم ملاحظة وجود فائض في معيار TNF في الحالات التالية:
- وجود المعدية و أمراض فيروسية(التهاب الشغاف ، التهاب الكبد سي ، السل ، الهربس ، إلخ) ؛
- صدمة بعد الإصابة والحرق.
- مرض الحروق (حروق من 15٪ من السطح بالكامل) ؛
- متلازمة DIC (اضطراب تخثر الدم ، حيث يحدث تكوين جلطات دموية في الأوعية الدقيقة) ؛
- تعفن الدم (تسمم شديد للجسم بالنباتات الدقيقة المسببة للأمراض ومنتجات نشاطها الحيوي ، سالبة الجرام بشكل أساسي) ؛
- أمراض المناعة الذاتية (الذئبة الحمامية ، التهاب المفاصل الروماتويدي ، تصلب الجلد ، إلخ) ؛
- عمليات الحساسية في الجسم ، بما في ذلك. انتكاس الربو القصبي.
- رفض الكسب غير المشروع بعد الزرع ؛
- الصدفية (جلاد غير معدي) ؛
- عمليات الأورام في الجسم.
- المايلوما المتعددة (ورم خلايا البلازما) ؛
- الخرف على خلفية تصلب الشرايين في أوعية الدماغ.
- اضطرابات الدورة الدموية (انخفاض في قوة تقلصات القلب ، ارتفاع نفاذية الأوعية الدموية ، انخفاض النتاج القلبي ، إلخ) ؛
- تصلب الشرايين التاجية (تلف الأوعية الدموية التي تغذي القلب) ؛
- التهاب الشعب الهوائية المزمن (التهاب الشعب الهوائية).
- داء الكولاجين (تلف جهازي أو موضعي للنسيج الضام) ؛
- خراجات والتهاب البنكرياس.
- بدانة؛
- الفطريات الفطرية.
يشير ارتفاع عامل نخر الورم عند النساء الحوامل إلى حدوث اضطرابات في تكوين الجنين داخل الرحم وتطور الجنين أو إصابة السائل الأمنيوسي ، فضلاً عن خطر الإجهاض أو الولادة المبكرة.
خفض القيم
لوحظ انخفاض في مؤشر TNF في الحالات التالية:
- نقص المناعة الخلقي أو المكتسب ، بما في ذلك. المعينات؛
- أورام المعدة.
- فقر الدم الخبيث (انتهاك تكون الدم الناجم عن نقص فيتامين ب 12) ؛
- الأمراض المعدية الشديدة من المسببات الفيروسية.
- متلازمة التأتبي (المريض يعاني من الربو أو التهاب الجلد التأتبي مع التهاب الأنف التحسسي).
يمكن تسهيل انخفاض تركيز عامل نخر الورم عن طريق تناول الهرمونات ، بما في ذلك. الستيرويدات القشرية ، التثبيط الخلوي ، مضادات الاكتئاب ، مثبطات المناعة ، إلخ.
التحضير للتحليل
لتحديد عامل نخر الورم ، مطلوب مصل الدم الوريدي بحجم يصل إلى 5 مل.
- تؤخذ المواد الحيوية في الصباح (في ذروة تركيز عامل نخر الورم) وعلى معدة فارغة. يجب تحضير الوجبة الأخيرة قبل 8-10 ساعات على الأقل. كما يحظر شرب أي سائل غير الماء العادي غير الغازي.
- عشية أخذ عينات الدم ونصف ساعة قبل الإجراء مباشرة ، من الضروري اتباع نظام الراحة. يحظر تمرين جسدي، والتمارين الرياضية ، ورفع الأثقال ، والمشي السريع ، والإثارة والتوتر.
- يتم إجراء الاختبار قبل الاختبارات المعملية الأخرى (الموجات فوق الصوتية ، والأشعة السينية ، والتصوير المقطعي المحوسب ، والتصوير بالرنين المغناطيسي ، والتصوير الفلوري ، وما إلى ذلك).
- 2-3 ساعات قبل التلاعب ، يُنصح بعدم التدخين ، وفي الليلة السابقة يُمنع تناول المشروبات الكحولية والمخدرات والمنشطات.
UDC 612.017.11: 616.98-092: 578.828.6: 615.37 O1
خصائص ودور عامل التنخر في أورام ألفا في علم الأمراض
عدوى فيروس نقص المناعة البشرية
بافيل دميترييفيتش دوناييف * ، سيرجي فاسيليفيتش بويتشوك ، إيلشات غانييفيتش موستافين ولاية كازان الجامعة الطبية
تقدم المراجعة الفهم الحالي لعامل نخر الورم ألفا: أصله ، ومستقبلاته ، وخصائصه الأساسية ، بالإضافة إلى دوره في التسبب في عدوى فيروس العوز المناعي البشري (العدوى التي يسببها فيروس نقص المناعة البشرية). يحفز عامل نخر الورم ألفا على تكاثر الفيروس في الخلايا الليمفاوية التائية CD4 + T ، وحيدات الخلايا الضامة ، ويعزز موت الخلايا الليمفاوية التائية CD4 غير المصابة ، وكذلك CDS * بواسطة آلية موت الخلايا المبرمج ، والتي تضمن تطور نقص المناعة. يحافظ عامل نخر الورم ألفا على حيوية الخلايا اللمفاوية التائية CD4 * المصابة ، مما يساهم في تكوين خزان للفيروس في جسم المريض. يجب اعتبار زيادة محتوى عامل نخر الورم ألفا في بلازما الدم للمصابين بفيروس نقص المناعة البشرية كعلامة على تطور المرض.
الكلمات المفتاحية: عامل نخر الورم ألفا ، تكاثر الفيروس ، موت الخلايا المبرمج لمفاوي ، عدوى فيروس العوز المناعي البشري.
خصائص ودور عامل نخر الورم ألفا في مسبب الإصابة بفيروس نقص المناعة البشرية P.D. دوناييف ، S.V. Boychuk ، آي جي. Mustafin. جامعة قازان الطبية الحكومية ، قازان ، روسيا. تقدم هذه المراجعة الفهم الحالي لعامل نخر الورم ألفا: أصله ، ومستقبلاته ، وخصائصه الرئيسية ودوره في التسبب في عدوى فيروس العوز المناعي البشري (العدوى ، التي يسببها فيروس نقص المناعة البشرية). يحفز عامل نخر الورم ألفا على تكاثر الفيروس في الخلايا الليمفاوية CD4 + T والوحيدات والضامة ، ويعزز موت الخلايا الليمفاوية CD4 + T غير المصابة وكذلك CD8 + بآلية موت الخلايا المبرمج ، مما يسمح بتطور نقص المناعة. يحافظ عامل نخر الورم ألفا على حيوية الخلايا الليمفاوية التائية CD4 + T ، مما يساهم في تكوين الخزان الفيروسي في المريض. يجب اعتبار المستويات المرتفعة لعامل نخر الورم ألفا في بلازما الدم للأفراد المصابين بفيروس نقص المناعة البشرية كعلامة على تطور المرض. الكلمات المفتاحية: عامل نخر الورم ألفا ، تكاثر الفيروس ، موت الخلايا المبرمج لمفاوي ، عدوى فيروس العوز المناعي البشري.
تم وصف عامل نخر الورم ألفا (TNFa ، في أدبيات اللغة الإنجليزية TNFa - من عامل نخر الورم ألفا) في عام 1975. تم عزله من مصل الدم لفئران المختبر ونخر الورم المستحث (الساركوما الليفية) في هذه الحيوانات (ومن هنا اسمه ).
TNFa هو بروتين سكري مع الوزن الجزيئي الغرامي 17.4 كيلو دالتون. هيكل هذا الجزيء متماثل مع TNFr ، عامل نمو الأعصاب ، رابط Fas ، جزيئات الغشاء CD30 و CD40 ، والتي توحدهم في عائلة عظمى مشتركة من بروتينات TNF (عائلة عامل نخر الورم).
الخلايا المنتجة لـ TNFa هي: (1) الكريات البيض ، بما في ذلك الخلايا الوحيدة / الضامة ، الخلايا القاعدية ، العدلات ، الخلايا الليمفاوية التائية (T-Lf) - تنشيط CD4 + و CD8 + ، وكذلك الخلايا القاتلة الطبيعية (الخلايا القاتلة الطبيعية ، من اللغة الإنجليزية) القاتل الطبيعي) ، خلايا LAK (الخلايا القاتلة الطبيعية التي تنشط السيتوكين) ؛ (2) أنواع أخرى من الخلايا - الخلايا البطانية ، والخلايا البدينة ، والخلايا التغصنية ، والخلايا الليفية ، وخلايا عضلة القلب ، والخلايا اللحمية لنخاع العظم الأحمر ، وخلايا الخلايا العصبية ، وخلايا الأنسجة الدهنية (الخلايا الشحمية). وتجدر الإشارة إلى أن المنتجين المهيمنين لهذا السيتوكين هم الضامة المنشطة و T-Lf.
هناك نوعان من مستقبلات TNFα: النوع 1 (TNF-R1 ، p55 ، CD120a) والنوع 2 (TNF-R2 ، p75 ، CD120b). تسود TNF-R1 ، والتي من خلالها تنفذ TNFa معظم آثارها البيولوجية.
عنوان المراسلة: [بريد إلكتروني محمي] 290
النوبات. يمكن أن يؤدي تفاعل TNF-a مع TNF-R1 أو TNF-R2 على سطح الخلية المستهدفة إلى عواقب مختلفة.
أولاً ، من الممكن تحريض موت الخلايا المبرمج للخلايا المستهدفة. لقد ثبت أن الجزء السيتوبلازمي من جزيء مستقبلات TNF-R1 يحتوي على "مجال الموت" TRADD (TNFR-Associated Death Domen) ، والذي يوجد أيضًا في مستقبل Fas. ينقل مجال TRADD إشارة من TNF-R1 إلى الخلية المستهدفة. لبدء برنامج موت الخلايا المبرمج ، يجب أن تصل إشارة من هذا المجال إلى جزيئات FADD (مجال الموت المرتبط بفاس) و RIP (بروتين تفاعل مستقبلات). تنشط هذه البروتينات الإنزيمات المحددة كاسباس-بروتياز FLICE (بروتين تحويل FADD-Like IL-1b-Converting) و نوكليازات داخلية (DNases I و II) ، مما يؤدي إلى انقسام حمض الديوكسي ريبونوكلييك (DNA) والموت اللاحق للخلية المستهدفة. لقد ثبت أن ارتباط TNF-a بمستقبل الغشاء TNF-R2 للخلية المستهدفة قادر أيضًا على إحداث موت الخلايا المبرمج. في هذه الحالة ، يتم تعطيل جزيئات TRAF2 (العامل المرتبط بـ TNFR). تدعم جزيئات TRAF2 نشاط المانع الخلوي لبروتينات موت الخلايا المبرمج (cIAP).
ثانيًا ، الوضع المعاكس ممكن - تحريض سلسلة من التفاعلات الأنزيمية (بمشاركة عامل النسخ النووي NF-cr ، وبروتين AP-1 ، وبروتين كيناز MAPK والبروتينات الأخرى) ، مما يؤدي إلى تنشيط الخلية وإعاقة التطور موت الخلايا المبرمج بواسطة مثبطاته Bcl-2 و c-FLIP.
العوامل التي تحدد استجابة الخلية ل
TNFa ، لا تزال مثيرة للجدل. تلعب البيئة المكروية للخلية دورًا مهمًا. على وجه الخصوص ، في عدوى فيروس نقص المناعة البشرية ، تعزز البروتينات الفيروسية موت الخلايا المبرمج بوساطة TNFa لـ T-Lf CD4 + و CD8 + (انظر أدناه).
المشاركة في تنفيذ الاستجابة الالتهابية
يتم تصنيع TNFa في بؤرة الالتهاب الحاد عن طريق T-Lf و B-Lf ، الخلايا القاتلة الطبيعية ، وحيدات / الضامة. إنه يحث على تنشيط العدلات والضامة ، وكذلك الانجذاب الكيميائي. في البلاعم ، يزيد TNFα من تخليق عوامل النمو (عامل تحفيز المستعمرة للخلايا المحببة والوحيدات ، عامل تحفيز المستعمرات للخلايا الوحيدة) ، مضاد للفيروسات y ، إنترلوكين (IL-1 ، IL-8) ، البروستاجلاندين (PGE2). جنبا إلى جنب مع IL-1 و IL-6 ، يحفز TNFα تخليق بروتينات المرحلة الحادة بواسطة خلايا النظام البلعمي أحادي النواة للكبد (مثل بروتين سي التفاعلي، الفيبرينوجين ، السيرولوبلازمين ، إلخ). التأثيرات الموصوفة لـ TNFa لها تأثير وقائي ، لأنها تعزز البلعمة للكائنات الدقيقة المسببة للأمراض عن طريق العدلات المنشطة والضامة. بالإضافة إلى ذلك ، فإن البروتين التفاعلي C قادر على ربط وتحييد السموم الداخلية البكتيرية والمجمعات المناعية ، وكونه أوبسونين ، فإنه يسهل البلعمة البكتيرية.
TNFa و IL-1 و IL-6 هي بروتينات ثانوية (خلايا الدم البيضاء). تخترق الحاجز الدموي الدماغي مع مجرى الدم وتتفاعل مع الخلايا العصبية في مركز التنظيم الحراري في الوطاء ، مما يؤدي إلى تطور الحمى.
TNFa في التركيز الفسيولوجي يمكن أن يزيد من نفاذية جدار الأوعية الدموية ، مما يساهم في تلف الخلايا البطانية والتخثر وتشكيل النخر النزفي.
يقدم بعض المؤلفين بيانات عن مشاركة TNFa في تكوين المزمن العملية الالتهابية... على وجه الخصوص ، تم إثبات أن زيادة تركيز TNFα في رئتي الفئران يسبب عملية التهابية شديدة مع تطور التليف الخلالي. تم اقتراح تعطيل TNF-a كعلاج إمراضي للمرضى المصابين بالتليف الرئوي مجهول السبب.
المشاركة في الاستجابة المناعية
يحفز TNFα هجرة الخلايا المتغصنة التي استولت على مادة مستضدية الغدد الليمفاويةومزيد من نضوجهم. أثناء النضج ، تطور هذه الخلايا جزيئات غشائية محددة تحور العظام CD80 / 86 ، والتي تسمح لها بأداء وظيفتها الرئيسية - تقديم المستضدات الملتقطة جنبًا إلى جنب مع جزيئات معقد التوافق النسيجي الرئيسي (MHC - من التوافق النسيجي الرئيسي باللغة الإنجليزية
الخلايا الليمفاوية المعقدة من الصنف الأول أو الثاني (T و B) والبدء في تطوير استجابة مناعية. TNFα قادرة على إحداث تنشيط وانتشار T-Lf.
في الوقت نفسه ، تُظهر أعمال السنوات الأخيرة أن TNFα قادرة أيضًا على إحداث تأثير معاكس - تحفيز تطور الورم ، وتعزيز الانتشار وتكوين الأوعية. تُظهر مستقبلات TNFα خلايا سرطان المعدة والكبد والبنكرياس وسرطان القولون والمستقيم وسرطان الجلد وسرطان الرئة وما إلى ذلك. تعتبر الزيادة في التعبير عن مستقبلات TNFα في الخلايا السرطانية في معظم الحالات علامة تنبؤية غير مواتية. في هذا الصدد ، يمكن اعتبار استخدام الأجسام المضادة وحيدة النسيلة ضد TNFα ومستقبلاته لعلاج الأورام الخبيثة اتجاهًا واعدًا.
تأثيرات التمثيل الغذائي
TNFa يثبط نشاط ليباز البروتين الدهني في خلايا الأنسجة الدهنية (الخلايا الشحمية) ، مما يؤدي إلى تعطيل ترسب الدهون (تكوين الدهون) فيها. يمكن أن يساهم هذا التأثير في استنفاد الجسم - دنف (كان يُطلق على TNFa سابقًا اسم cachexin).
دور TNFa في التسبب في الإصابة بفيروس نقص المناعة البشرية
يزداد تخليق وإفراز TNFα بواسطة T-Lf CD4 + والوحيدات والضامة المصابة مع تطور عدوى فيروس العوز المناعي البشري. تحفز بروتينات الفيروس (على سبيل المثال ، البروتين السكري السطحي gp120) على تخليق TNF α.
مع انخفاض كمية T-Lp CD4 + في بلازما دم المريض ، يزداد محتوى TNFa ، والذي يرتبط عكسياً بمحتوى الحمض النووي الريبي الفيروسي (RNA) في البلازما. لهذا السبب ، فإن زيادة تركيز عامل نخر الورم-أ في بلازما المصابين بفيروس نقص المناعة البشرية يعتبر علامة على تطور المرض.
TNFa يحث على تكرار HIV-1 في
T-Lf CD4 + بسبب تفعيلها. عند تنشيطه على الغشاء ، يزيد T-Lf CD4 + من تعبير جزيئات CXCR4 ، مما يعزز تغلغل الفيروس في هذه الخلايا. علاوة على ذلك ، باستخدام عوامل النسخ النووي (على وجه الخصوص ، NF-kR) ، التي يزداد نشاطها ، يكرر الفيروس نفسه. TNFα ، المرتبط بـ TNF-R1 ، يحث على تكاثر HIV-1 في الخلايا الوحيدة والبلاعم المصابة. ترتبط آلية النسخ أيضًا بتنشيط هذه الخلايا تحت تأثير TNF α.
بعد الارتباط بأي من مستقبلاته ، يحفز TNFα موت الخلايا المبرمج في CD4 + T-Lp غير المصاب ، وكذلك CD8 + في الأفراد المصابين بفيروس نقص المناعة البشرية. لقد تم إثبات أن البروتين السكري المغلف بسطح HIV-1 gp120 ، من خلال الارتباط بمستقبلات CXCR4 على سطح CD8 + T-Lf ، يؤدي إلى زيادة التعبير عن مستقبلات TNF-R2 فيها. هذا يزيد من حساسية هذه الخلايا لموت الخلايا المبرمج بوساطة TNFa. تحدث بداية برنامج موت الخلايا المبرمج بعد تفاعل التلامس مع CD8 + مع الضامة ، على الغشاء الذي تم إصلاح جزيئات TNF-a منه. بالإضافة إلى ذلك ، فإن gp120 الفيروسي نفسه قادر على إحداث الموت المبرمج لـ CD8 + T-Lf عن طريق الارتباط بـ TNF-R1 على غشاءه. لقد ثبت أن موت الخلايا المبرمج TNF-a-mediation لـ CD4 + T-Lf غير المصاب يتم بواسطة آليات مماثلة. أظهرت دراساتنا أنه في وجود هذا السيتوكين ، يموت CD4 + T-Lf غير المصاب بشكل رئيسي بواسطة آلية موت الخلايا المبرمج ، بينما تظل الخلايا المصابة قابلة للحياة في الثقافة. تشير بيانات الأدبيات إلى أن صلاحية CD4 + المصابة يتم توفيرها بواسطة بروتينات HIV-1. يعمل بروتين فيروس Nef على تثبيط نشاط محفز موت الخلايا المبرمج داخل الخلايا Bax. يزيد بروتين تات الفيروسي من نشاط بروتين مثبط موت الخلايا المبرمج c-FLIP في الخلية. في الوقت نفسه ، كما أظهرت دراساتنا ، فإن TNFa نفسها تشارك في هذه العملية. يعمل مع البروتينات الفيروسية ، ويحدد مستوى التنشيط الأمثل للنشاط الحيوي للمصابين بـ T-Lf CD4 + (الخلايا ذات التكاثر الفيروسي ، على عكس خلايا CD4 + غير المصابة ، لديها الحد الأدنى من التعبير عن علامات التنشيط). هذه الميزات تمنع تطور موت الخلايا المبرمج التنشيط في T-Lf CD4 + المصاب بفيروس نقص المناعة البشرية.
وبالتالي ، يمكن استنتاج أن TNFα تلعب دورًا سلبيًا في التسبب في عدوى فيروس العوز المناعي البشري. يعزز عدوى الخلايا المؤهلة مناعيا ، فضلا عن تكاثر الفيروس. يتسبب TNFα في وفاة CD4 + و CD8 + T-Lp غير المصاب عبر آلية موت الخلايا المبرمج ، والتي تضمن تطور نقص المناعة. يحافظ TNFa على حيوية infi-292
استشهد T-Lf CD4 + ، مما يساهم في تكوين خزان لفيروس HIV-1 في جسم المريض. وبالتالي ، يجب اعتبار الزيادة في مستويات TNFa في البلازما في المرضى المصابين بفيروس نقص المناعة البشرية كعلامة على تطور المرض.
المؤلفات
1. Dunaev P.D.، Ivankova A.V.، Boychuk S.V.، Mustafin I.G. تأثير السيتوكينات على تكرار فيروس نقص المناعة البشرية -1 وتنظيم موت الخلايا المبرمج في الخلايا الليمفاوية في عدوى فيروس العوز المناعي البشري في المختبر // أستراخان. عسل. F. - 2010. - ت 5 ، رقم 1 (ملحق). - س 100-102.
2. Dunaev P.D.، Ivankova A.V.، Boychuk S.V.، Mustafin I.G. دراسة دور السيتوكينات في التسبب في عدوى فيروس العوز المناعي البشري // عدوى فيروس العوز المناعي البشري. وكابت للمناعة. -2010. - ت 2 ، رقم 3. - ص 55-57.
3. أكورنيرو ب ، رادريزاني إم ، ديليا د. وآخرون. القابلية التفاضلية لموت الخلايا المبرمج ذو الحساسية 120 لفيروس HIV-GP في استنساخ الخلايا التائية CD4 + T مع أنماط ظاهرية مختلفة للمساعدة: دور تفاعلات CD95 / CD95L // الدم. - 1997. - المجلد. 89. - ص 558-569.
4. ألفانو إم ، بولي ج.دور السيتوكينات والكيموكينات في تنظيم المناعة الفطرية وعدوى فيروس العوز المناعي البشري // مول. إمونول. - 2005. - المجلد. 42. - ص 161-182.
5. Badley A. D. ، Dockrell D. Simpson M. et al. موت الخلايا المبرمج المعتمد على البلاعم للخلايا الليمفاوية التائية CD4 + من الأفراد المصابين بفيروس نقص المناعة البشرية يتم توسطه بواسطة عامل نخر الورم و FasL // J. Exp. ميد. - 1997. - المجلد. 185. - ص 55-64.
6. Baqui A.A.، Jabra-Rizk M.A.، Kelley J.I. وآخرون. حفز إنترلوكين -1 بيتا المحسن ، وإنترلوكين -6 وعامل نخر الورم ألفا بواسطة LPS حيدات بشرية معزولة عن مرضى فيروس نقص المناعة البشرية // مناعة. والسموم المناعية. - 2000. - المجلد. 22. - ص 401-421.
7. Bazzoni F ، Beutler B. يجند عامل نخر الورم وعائلات المستقبلات // N. Engl. جيه ميد. - 1996. - المجلد. 334. - ص 1717-1725.
8. بوتلر ب ، سيرامي أ. كاشكتين. أكثر من عامل نخر الورم // N. Engl. جيه ميد. - 1987. - المجلد. 316. -P. 379-385.
9. Biswas P. ، Mantelli B ، Delfanti F. et al. TNF يقود النسخ المتماثل HIV-1 في استنساخ الخلايا U937 وينظم CXCR4 // Cytokine. - 2001. - المجلد. 13. - ص 55-59.
10. Carswell E.A.، Old L.J.، Kassel R.L. وآخرون. عامل مصل يسببه الذيفان الداخلي يسبب نخر الأورام // بروك. ناتل. أكاد. علوم. الولايات المتحدة الأمريكية. - 1975. - المجلد. 72. - ص 3666-3670.
11. دي أوليفيرا بينتو L.M ، Garcia S. ، Lecoeur H. et al. زيادة حساسية الخلايا الليمفاوية التائية لمستقبل عامل نخر الورم 1 (TNFR1) - وموت الخلايا المبرمج بوساطة TNFR2 في عدوى فيروس العوز المناعي البشري: علاقة بالتعبير عن Bcl-2 و caspase-8 و caspase-3 // الدم. - 2002. - المجلد. 99. - ص 1666-1675.
12. Esparza I. ، Mdnnel D ، Ruppel A. et al. يعمل إنترفيرون جاما والليمفوتوكسين أو عامل نخر الورم بشكل تآزري للحث على قتل البلاعم للخلايا السرطانية والشيستوسومولا في Shistosoma mansoni // J. Exp. ميد. - 1987. - المجلد. 166. - ص 589-594.
13. Esser R ، Glienke W ، Andreesen R et al. تحليل الخلية الفردي لذخيرة السيتوكينات في حيدات / بلاعم مصابة بفيروس نقص المناعة البشرية 1 عن طريق مزيج من الكيمياء المناعية والتهجين في الموقع // الدم. - 1998. - المجلد. 91. - ص 4752-4760.
14. فولي أ ، سافيل إم دبليو ، مايو إل تي. وآخرون. آثار فيروس نقص المناعة البشرية وعوامل تحفيز المستعمرات على إنتاج إنترلوكين 6 وعامل نخر الورم ألفا بواسطة الخلايا الوحيدة / الضامة // الإيدز Res. وهمهمة. الفيروسات القهقرية. - 1997. - المجلد. 13. - ص 829-839.
15. Gibellini D. ، Re M. C. ، Ponti C. et al. يقوم بروتين HIV-1 Tat بالتزامن بخفض تنظيم الكاسباس القمي وينظم c-FLIP في الخلايا اللمفاوية التائية: آلية جزيئية محتملة للهروب من TRAIL السامة للخلايا // J. Cell. فيسيول. - 2005. - المجلد. 203. - ص 547-556.
16. Godfried M.H.، van der Poll T، Weverling G.J. وآخرون. المستقبلات القابلة للذوبان لـ TNF كمتنبئات للتقدم إلى الإيدز في عدوى فيروس نقص المناعة البشرية من النوع 1 بدون أعراض // J. Infect. ديس. - 1994. - المجلد. 169. - ص 739-745.
17. Herbein G. ، Mahlknecht U ، Batliwalla F. et al. يتم التوسط في موت الخلايا المبرمج لخلايا CD8 + T بواسطة الضامة من خلال تفاعل HIV gp120 مع مستقبلات chemokine CXCR4 // Nature. - 1998. - المجلد. 395. - ص 189-194.
18. Herbein G، Khan K.A. هل عدوى فيروس العوز المناعي البشري مرض تحركه إشارات مستقبلات عامل نخر الورم؟ // اتجاهات إمونول. - 2008. - المجلد. 2. - ص 61-67.
19. Hsu H، Xiong J.، Goeddel D.V. يشير بروتين TRADD لمستقبل TNF 1 المرتبط بموت الخلايا وتفعيل NF-kB // خلية. - 1995. - المجلد. 81. - ص 495-504.
20. حسين S.P.، Hofseth L.J.، Harris C.C. الأسباب الجذرية للسرطان // Nat. القس. سرطان. - 2003. - المجلد. 3. - ص 276-285.
21. Janeway CA، Travers P.، Walport M، Shlomchik M.J. البيولوجيا المناعية: جهاز المناعة في الصحة والمرض. - نيويورك: دار نشر جارلاند ، 2001. - 732 ص.
22. Keane M.P.، Strieter R.M. أهمية الآليات المتوازنة المؤيدة للالتهابات والمضادة للالتهابات في أمراض الرئة المنتشرة // التنفس. الدقة. - 2002. - المجلد. 3. - ص 5.
23. Kedzierska K.، Crowe S.M. السيتوكينات و HIV-1: التفاعلات والآثار السريرية // مضادات الفيروسات. علم. كيميائي. - 2001. - المجلد. 12. - ص 133-150.
24. Kedzierska K، Crowe S. M.، Turville S.، Cunningham A. L. تأثير السيتوكينات والكيموكينات ومستقبلاتها على تكاثر HIV-1 في الخلايا الوحيدة والضامة // القس. ميد. فيرول. - 2003. - المجلد. 13. - ص 39-56.
25. Lee C ، Tomkowicz B ، Freedman BD ، Collman R.G. يتم التوسط في إنتاج TNF-a الناجم عن HIV-1 gp120 بواسطة الضامة البشرية الأولية بواسطة فسفاتيديلينوسيتول -3 (PI-3) كيناز ومسار كيناز البروتين المنشط بالميتوجين (MAP) // J. Leucoc. بيول. - 2005. - المجلد. 78. - ص 1016-1023.
26. Legler D.F.، Micheau O، Doucey M.A. وآخرون. يعد تجنيد مستقبل TNF 1 لطوافات الدهون أمرًا ضروريًا لتفعيل TNFa بوساطة NF-kB // المناعة. - 2003. - المجلد. 18. - ص 655-664.
27. Lin WJ.، Yeh W.C. تأثير مستقبلات تشبه Toll وعامل نخر الورم ألفا في الصدمة الإنتانية // الصدمة. - 2005. - المجلد. 24. - ص 206-209.
28. لين دبليو دبليو ، كارين م. ارتباط خلوي بوساطة بين المناعة الفطرية والالتهاب والسرطان // J. Clin. استثمار. - 2007. - المجلد. 117. - ص 1175-1183.
29. Locksley R.M، Killeen N.، Lenardo M. J. العائلات الفائقة لمستقبلات TNF و TNF: دمج بيولوجيا الثدييات // الخلية. - 2001. - المجلد. 104. - ص 487-501.
30. McDermott M.F. بيولوجيا TNF و TNFR في الصحة والمرض // الخلية. مول. بيول. - 2001. - المجلد. 47. - ص 619-635.
31. Ming W. J. ، Bersani L. ، Mantovani A. عامل نخر الورم هو عامل كيماوي للخلايا الوحيدة والكريات البيض متعددة الأشكال // J. Immunol. - 1987. - المجلد. 138. - ص 1469-1474.
32. Mocellin S. ، Rossi C.R. ، Pilati P. ، Nitti D. عامل نخر الورم ، السرطان والعلاج المضاد للسرطان // Cytokine Growth Factor Rev. - 2005. - المجلد. 16. - ص 35-53.
33. موكوز-فيرنسنديز م أ ، نافارو جيه ، جارسيا إيه وآخرون. يعتمد تكرار فيروس نقص المناعة البشرية -1 في الخلايا التائية البشرية الأولية على إفراز الأوتوكرين لعامل نخر الورم على الرغم من التحكم في تنشيط العامل النووي كابا ب // J. Allergy Clin. إمونول. - 1997. - المجلد. 100. - ص 838-845.
34. نابورز إل بي ، سوسوام إي ، هوانغ واي وآخرون. يؤدي عامل نخر الورم ألفا إلى زيادة تنظيم العامل الوعائي في خلايا الورم الدبقي الخبيث: دور في استقرار الحمض النووي الريبي و HuR // Cancer Res. - 2003. - المجلد. 63. - ص 4181-4187.
35. نايف هـ ، هو شون م ، تشانغ ج ، كننغهام أ. الآليات الجزيئية لتأثير IL-4 على تعبير فيروس نقص المناعة البشرية في خطوط الخلايا الصافية والوحيدات البشرية الأولية // J. Leukoc. بيول. - 1994. - المجلد. 56. - ص 335-339.
36. Prevost-Blondel A.، Roth E.، Rosenthal F. M.، Pircher H. - 2000. - المجلد. 164. - ص 3645-3651.
37. رامبارت إم ، دي سميت دبليو ، فيرس دبليو ، هيرمان إيه جي. الخصائص الالتهابية لعامل نخر الورم المؤتلف في جلد الأرانب في الجسم الحي // J. Exp. ميد. - 1989. - المجلد. 169. - ص 2227-2232.
38. ريزاردي جي بي ، ماريوت جي بي ، كوكسون إس وآخرون. عامل نخر الورم (TNF) والجزيئات المرتبطة بـ TNF في الأفراد HIV-1 +: العلاقة مع الاستجابة في المختبر من النوع Th1 / Th2 // Clin. وإكسب. إمونول. - 1998. - المجلد. 114- ص 61-65.
39. Sedgwick J.D.، Riminton DS، Cyster J.G.، Kneer H.
عامل نخر الورم: منظم رئيسي لخلايا الدم البيضاء
حركة // إيمونول. اليوم. - 2000. - المجلد. 21. - ص 110-113.
40. Sime P. J.، Marr R. A.، Gauldie D. et al. يؤدي نقل عامل نخر الورم إلى رئة الفئران إلى التهاب رئوي حاد وتليف خلالي غير مكتمل مع تحريض تحويل عامل النمو بيتا 1 والخلايا الليفية العضلية // صباحا. جيه باتول. - 1998. - المجلد. 153. - ص 825-832.
41. Spriggs D.R.، Deutsch S.، Kufe D.W. جينوم
هيكل وتحريض وإنتاج TNF-alpha // Immunol. سر. - 1992. - المجلد. 56. - ص 3-34.
42. تورتي إف إم ، ديكمان ب ، بوتلر ب. وآخرون. أ
عامل البلاعم يثبط التعبير الجيني للخلايا الشحمية: نموذج مختبري للدنف // علم. - 1985. - المجلد. 229. - ص 867-869.
43. فالديز هـ ، ليدرمان م. السيتوكينات والعلاجات السيتوكينية في عدوى فيروس العوز المناعي البشري / عيادات الإيدز. القس. - 1997-1998. - ص 187-228.
44. Vyakarnam A.، McKeating J.، Meager A.، Beverley P. C. عوامل نخر الورم (ألفا ، بيتا) التي يسببها فيروس نقص المناعة البشرية -1 في الخلايا وحيدة النواة الحيوية المحيطية تحفز تكاثر الفيروس // الإيدز. - 1990. - المجلد. 4. - ص 21-27.
45. Wajant H. ، Pfizenmaier K. ، Scheurich P. Tumor necrosis factoring / H. Wajant // Cell Death Different. - 2003. - المجلد. 10. - ص 45-65.
46. Wolf D. ، Witte V. ، Laffert B. et al. يحفز HIV-1 Nef المرتبط بـ PAK و PI3-kinases تحفيز الفسفرة السيئة المستقلة عن Akt للحث على الإشارات المضادة للاستماتة // Nat. ميد. - 2001. - المجلد. 7. - ص 1217-1224.
عامل نخر الورم ألفا - تحديد تركيز البروتين في الدم الذي تنتجه الخلايا ذات الكفاءة المناعية والمشاركة في التنظيم المعقد للعمليات الالتهابية والمناعة في جسم الإنسان.
المرادفات الروسية
TNF-α ، مخبأ.
المرادفات الإنجليزية
عامل نخر الورم ألفا ، TNF-α ، كاشكتين.
الوحدات
PG / مل (بيكوجرام لكل مليلتر).
ما هي المواد الحيوية التي يمكن استخدامها للبحث؟
الدم الوريدي.
كيف تستعد للدراسة بشكل صحيح؟
- تجنب الكحول في النظام الغذائي لمدة 24 ساعة قبل الدراسة.
- لا تأكل لمدة 12 ساعة قبل الدراسة ، يمكنك شرب ماء نظيف غير مكربن.
- التخلص من الإجهاد البدني والعاطفي لمدة 24 ساعة قبل الدراسة.
- لا تدخن لمدة 30 دقيقة قبل الفحص.
معلومات عامة عن الدراسة
ينتمي عامل نخر الورم إلى فئة السيتوكينات - وهي بروتينات تنتجها خلايا مختلفة من الجهاز المناعي لتنظيم مجموعة معقدة من التفاعلات بين الخلايا في الاستجابة المناعية. يعكس اسم البروتين واحدًا فقط من آثاره البيولوجية ، الموجودة في التجارب على الفئران ، والتي تم بعدها اكتشاف عامل نخر الورم. ومع ذلك ، لا يقتصر دور هذا السيتوكين على تدمير الخلايا السرطانية - بالإضافة إلى ذلك ، يلعب عامل نخر الورم دورًا رئيسيًا في تنظيم الاستجابة المناعية.
الخلايا الرئيسية المنتجة لعامل نخر الورم هي الخلايا الوحيدة النشطة والضامة. يمكن أيضًا إفراز عامل نخر الورم عن طريق الخلايا الحبيبية في الدم المحيطي والخلايا القاتلة الطبيعية والخلايا اللمفاوية التائية. المحفزات الرئيسية لإفراز عامل نخر الورم هي الفيروسات والكائنات الدقيقة ومنتجاتها الأيضية (على سبيل المثال ، عديدات السكاريد الدهنية للبكتيريا سالبة الجرام). بالإضافة إلى ذلك ، يمكن لعب دور المنشطات بواسطة السيتوكينات الأخرى التي تنتجها الخلايا المناعية: الإنترلوكينات ، والعوامل المحفزة للمستعمرات ، والإنترفيرون.
الآثار البيولوجية الرئيسية لعامل نخر الورم:
النشاط السام للخلايا - يسبب عامل نخر الورم نخرًا نزفيًا للخلايا السرطانية ، كما يتسبب أيضًا في موت الخلايا المصابة بالفيروسات ؛
له تأثير مناعي - ينشط الخلايا المحببة ، الضامة ، خلايا الكبد (يتم تحسين إنتاج بروتينات المرحلة الحادة) ، ويحفز تخليق السيتوكينات الأخرى المؤيدة للالتهابات ؛
يحفز تكاثر وتمايز العدلات والخلايا اللمفاوية التائية والبائية ، ويعزز دخولها من نخاع العظم إلى الدم والهجرة إلى بؤرة الالتهاب.
تعتمد شدة التأثيرات البيولوجية لعامل نخر الورم على تركيزه. لذلك ، في التركيزات المنخفضة ، يعمل بشكل أساسي في مكان الإنتاج ، ويتوسط في عمليات الالتهاب المناعي المحلي. ومع ذلك ، عند التركيزات العالية ، يمكن أن يؤدي إلى فرط نشاط السيتوكينات وفقدان السيطرة على الجسم على الالتهابات والاستجابات المناعية.
يلعب عامل نخر الورم دورًا رئيسيًا في تطور بعض الحالات الحرجة. الخامس المراحل الأوليةتطور متلازمة الاستجابة الالتهابية الجهازية (SIRS) والإنتان ، يحدث زيادة في تركيز عامل نخر الورم في الدم (تحت تأثير السموم الداخلية البكتيرية). حاليًا ، يُعتقد أن التركيزات العالية من عامل نخر الورم على خلفية العدوى الشديدة والإنتان تؤدي إلى تطور الصدمة الإنتانية. عامل نخر الورم قادر على التدخل في عملية التمثيل الغذائي للدهون والكربوهيدرات ويسبب الإرهاق والدنف في المرضى الذين يعانون من الأورام والأمراض المعدية طويلة الأمد.
بالإضافة إلى نشاطه السام للخلايا ضد الورم والخلايا المصابة ، يشارك عامل نخر الورم أيضًا في رفض الأعضاء والأنسجة المزروعة. زيادة تركيز السيتوكين في الدم التواريخ المبكرةبعد الزرع ، يمكن أن يشير بشكل غير مباشر إلى بداية رد فعل الرفض. يشارك عامل نخر الورم في التسبب في العديد من أمراض المناعة الذاتية ، بما في ذلك التهاب المفصل الروماتويدي.
هذه ليست بأي حال من الأحوال قائمة شاملة للتأثيرات البيولوجية لعامل نخر الورم. ومع ذلك ، فإن التأثيرات المدرجة لعامل نخر الورم تحدد الاحتياجات التشخيصية الرئيسية لدراسة تركيزه.
ما هو استخدام البحث؟
- لتحديد تركيز عامل نخر الورم في الدم.
متى يتم تحديد موعد الدراسة؟
- تحديد تركيز عامل نخر الورم ليس اختبارًا روتينيًا. بالنظر إلى أن هذا السيتوكين متورط في مجموعة واسعة من العمليات المناعية ، فإن الحاجة إلى دراسته تحددها حالة سريرية محددة. في كثير من الأحيان ، يُدرس مستوى عامل نخر الورم مع السيتوكينات الأخرى لتشخيص اضطرابات الحالة المناعية. في المرضى الذين يعانون من التهابات شديدة وتعفن الدم ، ترتبط مستويات السيتوكين مع شدة المرض ونتائجه. يُنصح أحيانًا بتحديد مستوى عامل نخر الورم أثناء العلاج بأدوية من فئة مثبطات عامل نخر الورم.
ماذا تعني هذه النتائج؟
القيم المرجعية:
- لوحظ زيادة في مستوى عامل نخر الورم في الأمراض المعدية الشديدة ، وتعفن الدم (سلبي الغرام في المقام الأول) والصدمة الإنتانية ؛ أمراض الحساسية والمناعة الذاتية. الحروق وردود فعل رفض الزرع وأمراض الأورام.
- يمكن أن يكون الانخفاض في تركيز عامل نخر الورم ناتجًا عن نقص المناعة ، بما في ذلك حالات العدوى الشديدة والممتدة باعتباره انعكاسًا لاستنفاد دفاعات الجسم.
من الذي يأمر بالدراسة؟
أخصائي أمراض الروماتيزم والأورام وزراعة الأعضاء والمعالج والممارس العام.
المؤلفات
التشخيص السريري والإدارة من قبل هنري بالطرق المعملية ، 23 هـ بقلم ريتشارد إيه ماكفرسون ، دكتوراه في الطب ، ماجستير (مؤلف) ، ماثيو آر بينكوس ، دكتوراه في الطب (مؤلف) ، سانت لويس ، ميزوري: إلسفير ، 2016. صفحة 974.
دليل الاختبارات المعملية والتشخيصية ، الإصدار التاسع ، بقلم فرانسيس فيشباخ ، مارشال ب. دانينغ الثالث. ولترز كلوير هيلث ، 2015. صفحة 644.
مرضي التشخيص المختبري: القيادة الوطنية: في مجلدين - T. I / Ed. في.دولجوف ، في في.منشيكوفا. - م: GEOTAR-Media، 2012.S236-237.
يعد عامل نخر الورم البشري (المشار إليه فيما يلي بـ TNF) أحد البروتينات العديدة التي تؤدي إلى موت الخلايا السرطانية. يتم إنتاجه بنشاط عند وجود أي أمراض في الجسم - الالتهاب ، والتحصين الذاتي ، والتكوينات الخبيثة.
وتجدر الإشارة إلى أن الأدبيات العلمية الحديثة تحتوي على تسمية المصطلح بـ TNF و TNF-alpha. الثاني يعتبر غير ذي صلة ، ومع ذلك ، يستشهد به بعض المؤلفين في أعمالهم.
يتم إنتاج عامل نخر الورم عن طريق خلايا الدم - الخلايا الوحيدة ، والخلايا الدقيقة ، والخلايا الليمفاوية ، وكذلك البطانة الوعائية. لوحظ تركيزه الأقصى بعد ساعتين من ظهور المستضد في الجسم. في الوقت نفسه ، لا تتضرر الخلايا السليمة.
القليل من التاريخ
في عام 1975 ، بعد الإدخال التجريبي لـ BCG والسموم الداخلية في دم القوارض ، تم تحديد عامل نخر الخلايا السرطانية لأول مرة. تم الكشف عن الآتي: يحتوي مصل الدم على مادة لها تأثير سام للخلايا ومثبط للخلايا على مجموعة خلايا معينة. وهكذا ، تم تسجيل نخر نزفي للأورام التي سبق تلقيحها في القوارض. هذا هو المكان الذي يأتي منه الاسم. دور TNF مهم جدًا ليس فقط في وجود الأورام. هذا العامل ضروري أيضًا لصحة الجسم. لكن لم يتم دراستها بالكامل بعد.
المظاهر
كيف يتصرف TNF في الجسم؟
- يشارك في ردود الفعل المناعية.
- ينظم الالتهاب.
- يؤثر على تكون الدم.
- له تأثير سام للخلايا.
- يظهر تأثير بين النظام.
عندما تدخل الميكروبات والفيروسات والبروتينات الأجنبية إلى الجسم ، فهذا يؤدي إلى تنشيط المناعة. بفضل TNF ، يزداد عدد الخلايا اللمفاوية التائية والبائية ، ويتم إنشاء حركة العدلات إلى بؤرة الالتهاب. العدلات ، الخلايا الليمفاوية ، الضامة "تلتصق" بغشاء الأوعية الدموية في موقع العملية الالتهابية. تزداد نفاذية الأوعية الدموية في منطقة الالتهاب ، وهذا أيضًا نتيجة عامل نخر الورم.
تم العثور على عامل نخر الورم في البول والدم والسائل النخاعي ، مما يشير إلى وجود تأثير بين الجهازين. ينظم هذا البروتين عمل الغدد الصماء والجهاز العصبي. يكون للشكل بيتا من عامل نخر الورم تأثير موضعي ، ويتم تنشيط المناعة بشكل منهجي ويتم تنظيم التمثيل الغذائي ، والذي يحدث بسبب وجود شكل ألفا.
التشخيص
نادرًا ما يتم إجراء التشخيص المختبري لمستويات عامل نخر الورم ، ولكن متى يتم ذلك أنواع معينةالأمراض ضرورية ببساطة. لذلك ، يظهر هذا التحليل إذا كان لدى الشخص:
- العمليات المعدية والتهابات متكررة وطويلة الأمد.
- أمراض المناعة الذاتية.
- الأورام الخبيثة.
- الحروق من أصول مختلفة.
- إصابات.
- الكولاجين والتهاب المفاصل الروماتويدي.

متى يرتفع عامل نخر الورم؟
يكون مستوى عامل نخر الورم في الدم أعلى من المعدل الطبيعي في الحالات التالية:
- تسمم الدم (تعفن الدم) ؛
- متلازمة مدينة دبي للإنترنت
- التهابات المسببات المختلفة.
- ردود الفعل التحسسية
- عمليات الأورام
- في حالة رفض العضو المتبرع المزروع من المتلقي.
إذا كنت تعاني من مرض مثل التهاب المفاصل الروماتويدي ، فإن الأجسام المضادة لعامل نخر الورم البشري ألفايتحدد في البول ، وكذلك إذا كانت هناك عملية تراكم السوائل في الكيس المفصلي.
يتم تحديد عدد متزايد من الكاشكتين في وجود الأمراض التالية:
- السل الرئوي.
- التهاب الكبد ج؛
- تلف في الدماغ؛
- ضعف الكبد تحت تأثير الكحول.
- تصلب متعدد؛
- التهاب المفصل الروماتويدي؛
- بدانة؛
- خراج البنكرياس.
ارتفاع مستويات مصل الدم لعامل نخر الورم الدموي ألفاتفاقم حالة الشخص المصاب بقصور القلب والأوعية الدموية والربو القصبي.

من الأهمية بمكان تحديد الكاشكتين في دم المرأة الحامل في الوقت المناسب ، مما يساعد على تحديد أمراض تطور الجنين والعدوى التي يحيط بالجنين وخطر الولادة المبكرة. تجاوز القاعدة قد يشير إلى وجود مرض التهابفي المرأة الحامل ، والذي يسببه مكون بكتيري.
يمكن أن يكون سبب الارتفاع المفاجئ والسريع في عامل نخر الورم في اختبار الدم هو الذيفان الداخلي البكتيري ويؤدي إلى صدمة إنتانية.
كمية TNF مهمة للتنبؤ الأولي بالنسبة المئوية لمتلازمة الرفض أثناء زرع الأعضاء من المتبرع إلى المتلقي.
إذا تجاوزت كمية الأجسام المضادة لعامل نخر الورم القاعدة ، فإن هذا يؤدي إلى تغييرات في ديناميكا الدم: تقل قوة تقلصات عضلة القلب ، ويصبح جدار الأوعية الدموية نافذًا ، وتتعرض خلايا الكائن الحي بأكمله لتأثيرات سامة للخلايا.
مانع يمنع تأثير عامل نخر الورم الطبيعي ويتداخل مع الأداء الأمثل لجهاز المناعة.
يؤدي هذا الوضع إلى الأمراض التالية: الصدفية والتهاب المفاصل الروماتويدي والتهاب المفاصل الصدفي وما إلى ذلك.
عامل نخر الورم هو بروتين شبيه بالهرمونات تنتجه خلايا الجسم الدفاعية ، ويؤثر على التغيير في تكوين الدهون ، وتجلط وظائف الخلايا البطانية المبطنة للأوعية الدموية.
العوامل المذكورة أعلاه تسبب موت الخلايا.
متى يتم تقليل TNF؟

لوحظ انخفاض مؤشر عامل نخر الورم في اختبار الدم في وجود الشروط التالية:
- نقص المناعة الأولية والثانوية (بما في ذلك الإيدز) ؛
- مسار شديد من عدوى فيروسية.
- حروق واسعة ، مرض حروق.
- إصابة شديدة؛
- تورم في المعدة.
- وجود متلازمة التأتبي المتفاقمة.
- العلاج بمضادات الخلايا ، مثبطات المناعة ، الكورتيكوستيرويدات.
أنواع عامل نخر الورم وتطبيقه في علم الأورام

حاليًا ، هناك فئتان من TNF:
- عامل نخر الورم ، أو ألفا - ينطوي على الخلايا الوحيدة في عملية انحدار الورم ، مما يؤدي إلى حدوث صدمة إنتانية. يتم تحديث هذا البروتين بالذات إلى نوع من طليعة الهرمون مع صف طويل جدًا من العناصر غير النمطية.
- بيتا هو سيتوكين ، والإنترلوكين يبطئ أو يوقف تفاعله.
إن الاستخدام الهادف للعوامل التي تثبط إنتاج الأجسام المضادة لعامل نخر الورم البشري في تشخيص الأورام جعل من الممكن تحديد الأنماط التالية:
- أكدت الدراسات التي أجريت على الفئران المختبرية حقيقة انخفاض المؤشر العددي للخلايا السرطانية أو تباطؤ عملية الأورام الحالية بسبب نخر الأنسجة السرطانية ؛
- يكمن الدور المركزي في الحفاظ على متوسط ثبات المناعة في تحفيز وظيفتها الوقائية ؛
- يثير نشاط موت الخلايا المبرمج وتكوين الأوعية والتمايز وهجرة الخلايا المناعية.
مع التغيير في معلمات طاقة النظام ، تدخل العديد من مستقبلات TNF حيز التنفيذ ، والتي تحدد الاحتمالات المتغيرة لعلاج الورم الخبيث.
علاج السرطان بعامل نخر الورم
يتم وصف الأدوية التي تحتوي على هذه المادة للعلاج الموجه. هم الخصائص الطبيةهم كالآتي:
- بالاشتراك مع melphalan TNF على نطاق واسع في علاج ساركوما الأنسجة الرخوة في الأطراف.
- بسبب الزيادة في كمية الإنترلوكين (1.8-1.6) ، يتم تكوين مادة تتصدى لورم معين ؛
- يستخدم كدواء إضافي لتوفير تأثير معادل ، فيما يتعلق بالمضاعفات التي نشأت ؛
- مضاد عامل نخر الورم هو الدواء الأمثل للمرضى الذين لديهم تاريخ من سرطان الجلد غير الميلانيني: سرطان الخلايا القاعدية ، سرطان الخلايا الحرشفية ، سرطان الغدد الليمفاوية.
الأدوية

تستخدم نظائر TNF بنشاط في علم الأورام. جنبا إلى جنب مع العلاج الكيميائي ، فهي فعالة في سرطان الثدي والأورام الأخرى.
مثبطات عامل نخر الورم لها تأثيرات مضادة للالتهابات. لكن بالنسبة لأي عملية معدية ، لا يستحق وصفها على الفور ، لأن الجسم نفسه يجب أن يحارب المرض.
تظهر نتيجة جيدة من خلال:
- "Refnot".
- "ريميتساد".
- إنربيل.
- "هيوميرا".
- سيرتوليزوماب.
- غوليموماب.
أسيتروبين أو ميركابتوبورين يوصف لعلاج سرطان الغدد الليمفاوية التائية.
"Refnot" هو دواء روسي جديد يحتوي على TNF و thymosin-alpha 1. يمتلك سمية منخفضة ، مع كونه فعالًا تقريبًا كعامل طبيعي ، له تأثير محفز للمناعة. تم تطوير عقار عام 1990 وبعد اجتياز جميع الاختبارات تم تسجيله عام 2009. وهكذا متى الأورام الخبيثةيوصف في العلاج المعقد.
يجب أن يكون المرضى الذين يعانون من تشخيص السرطان على دراية بنتائج الدراسات التي تم فيها تسجيل التأثير السلبي لعامل نخر الورم. يحدث هذا غالبًا إذا تم حساب جرعة الدواء بشكل غير صحيح.
ثم عامل نخر الورم thymosin (o العمل الرئيسي الذي يهدف إلى تحفيز نضوج الخلايا اللمفاوية التائية)، يعزز مظهر ردود الفعل المناعية ، ويقلل من تكوين الأجسام المضادة الذاتية ويتم تضمينه في آلية تطور السرطان.
في هذا الصدد ، لا يتم استخدام الأدوية في هذه الفئة إلا تحت إشراف صارم من أخصائي.

السعر
سؤال متكرر من المرضى - ما تكلفة هذا التحليل؟ البحوث المخبريةتكاليف FNO من 800 إلى 3400 روبل (متوسط السعر حوالي 1700 روبل). لا يقوم الجميع بالتحليل المؤسسات الطبية... في الخارج ، ستتراوح التكلفة من 100 دولار إلى 250 دولار. لكن هذه أرقام تقريبية فقط ، لأن الكثير يعتمد على العيادة نفسها ونطاق خدماتها.
مع الحالة المزاجية المتفائلة للشفاء ، يمكن هزيمة أي مرض! لقد درسنا بالتفصيل عامل نخر الورم ، إلى أي مدى تمت دراسة تأثيره على الخلايا السرطانية والجسم ككل.
يؤدي كبت نشاط عامل نخر الورم إلى انخفاض في تخليق الوسطاء الالتهابيين في الجسم ، مما يؤدي إلى تحقيق التأثير العلاجي الضروري في علاج المرض.
- هل أنت هنا:
- الصفحة الرئيسية
- الإخبارية
2018 الأورام. يتم نشر جميع المواد الموجودة على الموقع لأغراض إعلامية فقط ولا يمكن أن تكون أساسًا لاتخاذ أي قرارات بشأنها العلاج الذاتي، بما فيها. جميع حقوق الطبع والنشر للمواد مملوكة لأصحابها.
عامل نخر الورم
عامل نخر الورم (TNF): تحديد عامل نخر الورم ؛ قيمة TNF العلاج بالأدوية المضادة لعامل نخر الورم ؛ الاسترداد الأمني للمزيد كفاءة عالية
- يتم تصنيع عامل نخر الورم عن طريق الضامة المنشطة وله تأثيرات سامة للخلايا ومعدلة للمناعة ومضادة للالتهابات.
- يعمل عامل نخر الورم في المناعة ضد الفيروسات والأورام والزرع.
- بالنسبة لبعض الأورام ، يكون لعامل نخر الورم تأثير تثبيط للخلايا ومزيل للخلايا.
- عامل نخر الورم يحفز الضامة.
- في التركيزات العالية ، عامل نخر الورم قادر على إتلاف الخلايا البطانية وزيادة نفاذية الأوعية الدموية الدقيقة ، وتفعيل نظام الإرقاء والمكملات ، يليه تراكم العدلات وتكوين المخثرات الدقيقة داخل الأوعية (DIC).
- يؤثر عامل نخر الورم على التمثيل الغذائي للدهون ، والتخثر ، وحساسية الأنسولين ، والصحة البطانية ، بالإضافة إلى عدد من الوظائف الأخرى.
- يمنع عامل نخر الورم نمو الخلايا السرطانية وينظم عددًا من عمليات التمثيل الغذائي ، فضلاً عن نشاط الاستجابة المناعية للعوامل المعدية ، مما يمنع الاستخدام غير المنضبط للأدوية المضادة لعامل عامل نخر الورم ويثير تساؤلات حول سلامتها.
ما هي آليات عمل TNF المضاد للورم:
- TNF له تأثير استهداف على خلية خبيثة من خلال مستقبلات TNF ، مما يؤدي إلى موت الخلية المبرمج أو قمع عملية الانقسام ؛ يحفز أيضًا إنتاج المستضدات في الخلية المصابة ؛
- يحفز نخر الورم "النزفي" (موت الخلايا السرطانية).
- منع تكوين الأوعية الدموية - قمع عملية تكاثر الأوعية الورمية ، وتلف الأوعية الورمية دون الإضرار بالأوعية السليمة.
ميزات التأثير المضاد للورم لـ TNF:
- لا يؤثر عامل نخر الورم على جميع الخلايا السرطانية ؛ تنتج الخلايا المقاومة للعمل السام للخلايا نفسها TNF داخليًا وعامل النسخ النووي النشط NF-kB.
- يظهر عدد من الخلايا تأثيرًا معتمدًا على الجرعة لـ TNF ، والاستخدام المشترك للسيتوكينات TNF و IFN-gamma في كثير من الحالات يعطي تأثيرًا أكثر وضوحًا من العلاج بأحد هذه الأدوية ؛
- يعمل عامل نخر الورم على الخلايا السرطانية المقاومة للعلاج الكيميائي ، ويمكن أن يقتل العلاج القائم على عامل نخر الورم مع العلاج الكيميائي الخلايا المصابة بشكل فعال.
- نقص المناعة الأولية والثانوية.
- المعينات؛
- الالتهابات الفيروسية الشديدة.
- حروق شديدة وإصابات.
- العلاج بمضادات الخلايا ، مثبطات المناعة ، الكورتيكوستيرويدات.
- متلازمة مدينة دبي للإنترنت
- تعفن الدم.
- أمراض معدية؛
- أمراض الحساسية والمناعة الذاتية.
- أزمة رفض المتبرعين بالأعضاء لدى المتلقين ؛
- أمراض الأورام.
الصك - Microlab Star ELISA.
نورم: ما يصل إلى 87 رطل / مل
القيم المرجعية: 0 - 8.21 بيكوغرام / مل.
- تعفن الدم (يمكن أن يكون المحتوى مرحليًا - زيادة في البداية وانخفاض مع عدوى طويلة الأمد واضحة بسبب استنفاد آليات الحماية).
- الصدمة الإنتانية.
- متلازمة مدينة دبي للإنترنت.
- أمراض الحساسية.
- الفترة الأولية في المصابين بفيروس نقص المناعة البشرية.
- بدانة.
- في الفترة الحادة من الالتهابات المختلفة.
- الالتهابات الفيروسية الشديدة والمستمرة.
- أمراض الأورام.
- المعينات.
- حالات نقص المناعة الثانوية.
- إصابات وحروق (شديدة).
- التهاب عضل القلب.
- تناول الأدوية: مثبطات المناعة ، التثبيط الخلوي ، الكورتيكوستيرويدات.
ما هي أهمية وظيفة TNF في جسم الإنسان؟
تتميز الآليات التالية لتأثير TNF:
- سيتو تأثير سامكل من الخلايا السرطانية والخلايا المصابة بالفيروسات.
- يحفز تكوين المواد الفعالة الأخرى - الليكوترين والبروستاجلاندين والثرموبوكسان.
- له تأثيرات مناعية ومضادة للالتهابات (عندما يتم تنشيط الضامة والعدلات).
- زيادة نفاذية الغشاء.
- زيادة مقاومة الأنسولين (وهو تأثير يؤدي إلى تطور ارتفاع السكر في الدم ، ربما بسبب تثبيط نشاط مستقبلات الأنسولين التيروزين كيناز ، وكذلك تحفيز تحلل الدهون وزيادة تركيز الأحماض الدهنية الحرة).
- تلف البطانة الوعائية وزيادة نفاذية الشعيرات الدموية.
- تفعيل نظام الارقاء.
- دراسة معمقة للحالة المناعية في حالة الأمراض الحادة والمزمنة والمعدية وأمراض المناعة الذاتية.
- علم الأورام.
- إصابات وحروق ميكانيكية شديدة.
- آفات تصلب الشرايين لأوعية الدماغ والقلب.
- التهاب المفاصل الروماتويدي وداء الكولاجين.
- أمراض الرئة المزمنة.
نشاط الخلايا التائية CD4 التهابية
في ظل ظروف تفاعل البلاعم مع الخلايا التائية الالتهابية ، لوحظ اندماج أكثر فعالية من البلعمة التي غزت البكتيريا مع الجسيمات الحالة ، والتي تعتبر حافظة للأنزيمات المحللة للبروتين التي تدمر مسببات الأمراض داخل الخلايا. تترافق عملية البلعمة مع ما يسمى بانفجار الأكسجين - تكوين جذور الأكسجين وأكسيد النيتريك ، والتي لها نشاط مبيد للجراثيم.
لا ينبغي وصف العلاج المضاد لعامل نخر الورم للمرضى المنهكين ، وكذلك لأولئك الذين سبق أن أصيبوا بمرض معدي ، لأن في كلتا الحالتين ، يكون لديهم مخاطر عالية للإصابة بالعدوى.
المراجعات
أود أيضًا أن أرى قائمة المراجع
لن يقدموا لك الأدب. إنه متناقض. لم يثبت. التجارب.
خضعت لدورة علاجية مع دكتور أوجنيفا لمرض الصدفية ، وهي بالمناسبة فعالة للغاية. ولذا فهي تجعل TNF لتسليمها !! ربما شخص ما سوف يشرح لماذا وماذا يظهر مع الصدفية. على الرغم من أن المعدل قد انخفض. تضاعف TNF !! والجلد نظيف
أين يمكنك شراء هذا الدواء؟
من أين تشتري عامل نخر الورم
متعدد البيبتيد الانصهار له نشاط عامل ألفا α1 -تيموزين- النخر OPUHOLEY- ثيموسين a1 ، طريقة لإنتاج بولي ببتيد الانصهار له نشاط α1 - TIMOZIN- α- عامل نخر الورم - ثيموسين a1 ، البلازميد المؤتلف ، التعبير عن جزيء الحمض النووي له نشاط α1 - THYMOSIN α FACTOR OF TUMOR NECROSIS - THYMOSIN - a1 براءة اختراع من الاتحاد الروسي
الأدوية المضادة للبنو
الروماتيزم هو تخصص في الطب الباطني ، ويتعامل مع تشخيص وعلاج الأمراض الروماتيزمية.
حسب المعطيات الأبحاث السريريةنشرت في مجلة الجمعية الطبية الأمريكية ، الأدوية التي لا تعتبر مثبطات عامل نخر الورم (TNF) أكثر فعالية في علاج مرضى التهاب المفاصل الروماتويدي الذين لا يستجيبون للأدوية المضادة لعامل نخر الورم.
تُستخدم الأدوية المضادة لعامل نخر الورم في جميع أنحاء العالم لعلاج التهاب المفاصل الروماتويدي. يقومون بإلغاء تنشيط عامل نخر الورم ، وهو جزيء ينتجه الجهاز المناعي ويسبب الالتهاب. ومع ذلك ، لا يستجيب حوالي ثلث المرضى لهذا النوع من العلاج.
اشتملت الدراسة على 300 مريض مصاب بالتهاب المفاصل الروماتويدي والذين لديهم استجابة غير كافية للأدوية المضادة لعامل نخر الورم.
تم تقسيم جميع المشاركين إلى مجموعتين. في المجموعة الأولى ، تناول المرضى الأدوية المضادة لعامل نخر الورم مثل adalimumab و etanercept و certolizumab و infliximab لمدة 52 أسبوعًا. في المجموعة الثانية ، تناول المرضى عقاقير لا تحتوي على عامل نخر الورم مثل توسيليزوماب وريتوكسيماب وأباتاسيبت.
أظهرت نتائج الدراسة أن 54٪ من المرضى الذين يتناولون الأدوية المضادة لعامل نخر الورم و 69٪ من المشاركين الذين كانوا يتناولون أدوية لا تحتوي على عامل نخر الورم كان لديهم استجابة معتدلة للعلاج.
بالإضافة إلى ذلك ، كان لدى المزيد من المرضى الذين يتناولون أدوية لا تحتوي على عامل نخر الورم نشاط مرض منخفض في 24 و 52 أسبوعًا من الدراسة.
وخلص الباحثون إلى أن مرضى التهاب المفاصل الروماتويدي الذين لم يستجيبوا للأدوية المضادة لعامل نخر الورم قد يستفيدون من الأدوية التي لا تحتوي على عامل نخر الورم.
العلاج بالأدوية المضادة لعامل نخر الورم: ثمن الأمان من أجل فعالية أعلى؟
عامل نخر الورم (TNF) هو بروتين خارج الخلية ، وهو سيتوكين التهابي له طيف واسع من الإجراءات ، يتم تصنيعه بشكل أساسي بواسطة الخلايا الوحيدة والبلاعم. يمتد تأثيره إلى التمثيل الغذائي للدهون والتخثر وحساسية الأنسولين والصحة البطانية ، بالإضافة إلى عدد من الوظائف الأخرى.
لأول مرة تم الكشف عن عامل نخر الورم في مصل دم الفئران المحقونة بـ BCG والذيفان الداخلي. اتضح أن مصل هذه الفئران له تأثير سام للخلايا ، وكشفت دراسة أخرى عن وجود بروتين مسؤول عن تطور هذا التأثير.
في السنوات الأخيرة ، أصبحت أهمية TNF ذات أهمية متزايدة. يرتبط الاهتمام المتزايد بالعمل ثنائي الاتجاه لهذا السيتوكين. من ناحية ، يلعب دورًا مهمًا في تنظيم التمايز الطبيعي والنمو والتمثيل الغذائي للخلايا المختلفة ، ومن ناحية أخرى ، يعمل كوسيط لعمليات الالتهاب المناعي المرضي في امراض عديدةشخص.
علاج التهاب المفاصل
التهاب المفاصل هو نوع من التهاب المفاصل تتأثر فيه عدة مفاصل. يصيب الناس من جميع الأجناس والأعمار وغالبًا ما يرتبط باضطرابات المناعة الذاتية المختلفة.
علاج او معاملة
العلاج الأساسي لالتهاب المفاصل (يحدده طبيب الروماتيزم) ؛
علاج الأعراض (يهدف إلى تخفيف الألم).
في الحالة الثانية ، يتم استخدام العقاقير غير الستيرويدية المضادة للالتهابات (بأشكال مختلفة) ، على سبيل المثال ، brufen ، indomethacin-Acri ، flugalin ، ortofen ، roxicam. لكن الأمر يستحق النظر في الآثار الجانبية ، وكذلك موانع تناول هذه الأدوية (على سبيل المثال ، القرحة الهضمية).
العلاج الدوائي
غير الستيرودية المضادة للالتهابات
تساعد مضادات الالتهاب غير الستيروئيدية في تقليل الالتهاب. إنها تمنع نشاط البروستاجلاندين (المواد التي تلعب دورًا مهمًا في الالتهاب). كما أنها تساعد في تخفيف الآلام الخفيفة إلى المتوسطة. تعمل NVIDs بسرعة وغالبًا ما يكون لها آثار جانبية مختلفة أقل من الأدوية الأخرى الأقوى والأكثر سمية المستخدمة في علاج التهاب المفاصل. في بعض الحالات ، يمكن أن يؤدي تناول هذه الأدوية إلى عسر الهضم والتقرح.
الستيرويدات القشرية
يساعد علاج التهاب المفاصل بهذه الأدوية على تخفيف الالتهاب ، فضلاً عن تثبيط الاستجابة المناعية. نظرًا لأن التهاب المفاصل غالبًا ما يكون ناتجًا عن اضطرابات المناعة الذاتية ، مثل الذئبة الجهازية ، تُستخدم هذه الأدوية لقمع الاستجابة المناعية المصاحبة لمثل هذه الاضطرابات.
في معظم الحالات ، تعتبر الكورتيكوستيرويدات أول ما يتم وصفه للمرضى الذين يعانون من هذه الحالات. من أجل الوقاية من هشاشة العظام التي يسببها الستيرويد ، يوصى باستخدام ، على سبيل المثال ، البايفوسفونيت. غالبًا ما تساعد هذه الأدوية في تقليل الألم والأعراض الأخرى بشكل أسرع بكثير من الأدوية الأخرى.
الأدوية الأساسية المضادة للروماتيزم (BPRP)
PRP يعدل مسار المرض. يمكنهم تغيير مسار العديد من الأمراض التي تسبب التهاب المفاصل. نظرًا لحقيقة أنهم بدأوا في العمل فقط بعد 6-8 أسابيع من بدء القبول ، خلال هذه الفترة ، غالبًا ما يتم وصف الإدارة المتزامنة الإضافية لمضادات الالتهاب غير الستيروئيدية والكورتيكوستيرويدات. تحقق الأدوية المعدلة للسرطان ، وكذلك الكورتيكوستيرويدات ، تأثيرًا علاجيًا عن طريق قمع جهاز المناعة.
غالبًا ما يتم علاج التهاب المفاصل بالميثوتريكسات ، وهو نفس الدواء المستخدم أحيانًا لعلاج مرضى السرطان (بجرعات عالية). يتسبب الميثوتريكسات أحيانًا في تلف الكبد ، لذلك ، أثناء استخدامه ، من الضروري تحليل دم المريض بانتظام من أجل اكتشاف هذا والآثار الجانبية المحتملة الأخرى في أقرب وقت ممكن.
لعلاج التهاب المفاصل ، يتم أيضًا استخدام PDRPs التالية:
- سلفاسالازين.
- هيدروكسي كلوروكوين (دواء مضاد للملاريا). في حالة واحدة ، يتسبب ison في أضرار جسيمة للعيون.
الأدوية المضادة لعامل نخر الورم
في العديد من أنواع التهاب المفاصل ، بما في ذلك التهاب المفاصل ، يمكن أن يتسبب عامل نخر الورم في حدوث التهاب. الأدوية التي تمنع عامل نخر الورم تسمى الأدوية المضادة لعامل نخر الورم.
يتطلب علاج التهاب المفاصل استخدام الأدوية التالية المضادة لعامل نخر الورم:
تدار عن طريق الحقن تحت الجلد أو عن طريق الوريد. قد يؤدي تناول مضادات عامل نخر الورم في بعض الحالات إلى قشعريرة وآلام في المفاصل والعضلات وحمى وزيادة التعرض للعدوى والصداع وآثار جانبية أخرى.
العلاج الطبيعي
يمكن أن يساعد العلاج الطبيعي في تقليل الألم والالتهاب والتورم. يتم استخدام علاج التهاب المفاصل ، مثل العلاج المغناطيسي ، البارافين ، العلاج بالأوزون ، الموجات فوق الصوتية ، العلاج بالتبريد في وقت واحد مع العلاج الدوائي. إنها تجعل من الممكن استعادة تدفق الدم إلى المفاصل التي تضررت ، وكذلك تبطئ عملية فقدان العظام وتطبيع عملية التمثيل الغذائي.
من المستحيل القضاء على هذا المرض تمامًا. في هذا الصدد ، فإن علاج التهاب المفاصل ضروري دائمًا. بمساعدة العلاج المستمر ، سيتمكن المريض من الحفاظ على جودة حياته لفترة طويلة ، بالإضافة إلى مستوى النشاط المعتاد والرفاهية الممتازة.
يرجى ملاحظة: المعلومات المنشورة على هذا الموقع ليست نصيحة طبية أو نصيحة أو إرشادات للعمل. قبل استخدام المعلومات المقدمة على بوابتنا ، تأكد من استشارة طبيبك!
عامل نخر الورم - ألفا
عامل نخر الورم ألفا (TNF-) عبارة عن 157 بروتين من الأحماض الأمينية. إنه أول سيتوكين متعدد الوظائف من عائلة TFN التي تم تحديد خصائصها لعلاج السرطان. يتم تنظيم نشاطها البيولوجي بواسطة مستقبلات TNF-alpha القابلة للذوبان 1 و 2.
يتم التعبير عن التأثير الطبيعي بشكل مباشر من خلال تحفيز إنتاج الإنترلوكين 1 ، القادر على التعرف على الهياكل الصحية والأورام على المستوى الخلوي. في هذا الصدد ، يؤثر عامل نخر الورم ألفا على خلية الأورام من خلال سطحها.
يتم إنتاج عامل نخر الورم ألفا في الجسم بشكل أساسي عن طريق الضامة النشطة والخلايا اللمفاوية التائية والخلايا القاتلة الطبيعية للأنسجة المصابة. يلعب دورًا رئيسيًا في موت الخلايا المبرمج وتكاثر الخلايا.
ومع ذلك ، فإن تأثير هذا العنصر الطبيعي يرتبط ارتباطًا وثيقًا بسمية المادة. لذلك ، اليوم ، يتم استخدام متغيرات أكثر فعالية وأقل سمية لعامل نخر الورم ، على سبيل المثال ، مثل Thymosin-alpha. يقوم أطباء الأورام أيضًا بتطوير طرق للإيصال المباشر لعامل النخر إلى الورم ، دون التأثير على الأنسجة الأخرى ودون تضمينه في مجرى الدم العام.
عامل نخر الورم ألفا والسرطانات
حتى الآن ، تأثير هذا العنصر ، وكذلك مضاداته والعناصر البيولوجية اللاحقة ، على أشكال الآفات السرطانية مثل:
أورام المعدة والثدي الخبيثة:
يؤدي عامل نخر الورم ألفا إلى موت الخلايا السرطانية المحتملة.
سرطان الرئة ذو الخلايا غير الصغيرة:
يحمي عامل نخر الورم ألفا الجسم من تأثيرات مجموعة متنوعة من مسببات الأمراض ، وبالتالي يمنع ظهور المرض.
ساركوما وسرطان الجلد:
في هذه الأنواع من السرطانات ، يكون عامل نخر الورم فعال بشكل خاص عامل ألفا المؤتلف.
تكوين سرطان الرحم والمبيض:
هم أيضا حساسون لهذا العنصر.
نظرًا لقدرته على تدمير تدفق الدم إلى الورم ، يمكن أيضًا استخدام عامل نخر الورم ألفا في العلاج السريري للسرطان النقيلي.
المخدرات
عامل نخر الورم ألفا هو سيتوكين. فهي قادرة على تثبيط نشاط الورم ليس فقط من خلال مقاومة الخلايا غير الطبيعية ، ولكن أيضًا من خلال الدمج مع الآليات الخلوية الرئيسية. لذلك ، عند إنشاء الأدوية ، يتم استخدام هذه الأنواع الأدويةممثلة بمثبطات TNF:
- الأجسام المضادة وحيدة النسيلة (إنفليكسيماب ، أداليموماب هيوميرا ، ريتوكسيماب ، يمثلها عقار ريتوكسان) ؛
- البروتينات المؤتلفة ، والتي تشمل مجالات الغلوبولين المناعي ومستقبلات عامل نخر الورم ، ولا سيما مضاد للفيروسات -1 و 2 (إيتانرسبت "إنبريل" ، غوليموماب "سيمبوني").
من بين الأدوية الروسية للمجموعة السيتوكينية ، تبرز "Refnot" و "Reaferon" و "Roferon" و "Intron" وغيرها.
تعتمد تكلفة أدوية المجموعة السيتوكينية بشكل مباشر على بلد الصنع. الأدوية ذات المنشأ الأوروبي والأمريكي ستكون أغلى بكثير من الأدوية الروسية والأوكرانية.
ومع ذلك ، هذا لا يعني على الإطلاق أن الأدوية المحلية ستختلف في خصوصية عملها عن الأدوية المستوردة. لذلك ، على سبيل المثال ، دعونا نقدر الأسعار المقارنة لتعبئة الدواء بنفس السعة البالغة 100 يو. الوحدات:
- المستحضرات التي تحتوي على الأجسام المضادة وحيدة النسيلة (روسيا): زجاجة واحدة - من 1500 روبل. ما يصل إلى 2000 روبل. 5 زجاجات - مقطعة. دروب.
- الأدوية ذات الأجسام المضادة وحيدة النسيلة (أوكرانيا): زجاجة واحدة - من 500 غريفنا. حتى 800 غريفنا ؛ 5 زجاجات السعر من 2000 غريفنا. حتى 3500 غريفنا ؛
- عامل نخر الورم مؤتلف: التكلفة في روسيا للزجاجة الواحدة من 2000 روبل. حتى 3000 روبل روسي في أوكرانيا ، السعر أعلى: من 1000 غريفنا. حتى 1800 غريفنا ما يرتبط بالحاجة إلى النقل ؛
- يتراوح سعر الأدوية المستوردة المحتوية على عامل نخر الورم ألفا للزجاجة الواحدة من 1000 دولار أمريكي. يصل إلى 1300 دولار أمريكي
من أين تشتري عامل نخر الورم ألفا؟
تتوفر عقاقير عامل نخر الورم ألفا في جميع البلدان تقريبًا حول العالم. في الصيدلة المحلية ، تُباع أدوية المجموعة السيتوكينية في الصيدليات في المدن الكبيرة. لكن في معظم الحالات ، لا تُعطى الأدوية للمريض إلا بناءً على وصفة طبية وأمر مسبق.
يمكن للمرضى في بلدان رابطة الدول المستقلة شراء دواء من مصنع روسي ، لأن سعر الأدوية المستوردة أعلى عدة مرات.
المراجعات
هناك آراء مختلفة حول الأدوية في هذه المجموعة ، ليس فقط لمرضى السرطان وأقاربهم ، ولكن أيضًا لأطباء الأورام أنفسهم:
- يشير البعض إلى قدرة العوامل ذات عامل نخر الورم ألفا على محاربة السرطان بشكل مستقل.
- يؤكد خبراء آخرون فقط قدرة الأدوية السيتوكينية على تعزيز تأثير العلاج التقليدي.
- أكد على الآثار الجانبية المحتملة ، خاصة بالنسبة للمرضى الذين يعانون من المرض الكامن العدوى الفيروسيةوالسل وأمراض القلب والأوعية الدموية وأمراض الكبد المزمنة.
على أي حال ، فإن المدة القصوى للعلاج بعامل نخر الورم ألفا هي دورتان فقط. يمكن إجراؤها في المنزل بعد تشخيص شامل وجمع الاختبارات.
هناك عدد قليل من آراء المرضى حول الدواء ، لكن معظم المرضى الذين لديهم استخدام علاجي لعامل نخر الورم ألفا لاحظوا تحسنًا في حالتهم الصحية العامة ، خاصة في وجود سرطان متقدم أو متكرر. البعض ، في المراحل المتأخرة من تطور المرض ، يعتبرون الدواء هو الدواء الشافي الوحيد. ومع ذلك ، فإن هذا الموقف غير كاف. حتى على الرغم من المراجعات الإيجابية ، في الممارسة العالمية ، لا يزال البحث جاريًا فيما يتعلق بسلامة المنتج.
يعتبر عامل نخر الورم ألفا من أحدث الأسلحة البيولوجية ، ولا يزال هناك الكثير من النقاش حوله في علم الأورام.
من المهم أن تعرف:
أضف تعليق إلغاء الرد
التصنيفات:
يتم تقديم المعلومات الموجودة على الموقع لأغراض إعلامية فقط! لا ينصح باستخدام الطرق والوصفات الموصوفة لعلاج السرطان بشكل مستقل ودون استشارة الطبيب!
عامل نخر الورم (TNF): دوره في الجسم ، التحديد في الدم ، الإعطاء على شكل أدوية
عامل نخر الورم (TNF) هو بروتين خارج الخلية غائب عمليًا في دم الشخص السليم. تبدأ هذه المادة في الإنتاج بنشاط في علم الأمراض - الالتهاب ، والتحصين الذاتي ، والأورام.
في الأدب الحديث ، يمكنك العثور على تصنيفها كـ TNF و TNF-alpha. يعتبر الاسم الأخير قديمًا ، ولكن لا يزال يستخدمه بعض المؤلفين. بالإضافة إلى alpha-TNF ، هناك شكل آخر منه - بيتا ، الذي تتشكله الخلايا الليمفاوية ، ولكنه أبطأ بكثير من الأول - على مدار عدة أيام.
يتم إنتاج عامل نخر الورم بواسطة خلايا الدم - البلاعم ، والخلايا الأحادية ، والخلايا الليمفاوية ، وكذلك البطانة البطانية للأوعية الدموية. عندما يدخل مستضد بروتيني غريب (كائن دقيق ، سمه ، منتجات نمو الورم) إلى الجسم ، يصل عامل نخر الورم إلى أقصى تركيز له في غضون 2-3 ساعات الأولى.
لا يضر عامل نخر الورم بالخلايا السليمة ، ولكنه في نفس الوقت له تأثير قوي مضاد للأورام. لأول مرة ، تم إثبات مثل هذا التأثير لهذا البروتين في تجارب على الفئران ، حيث لوحظ تراجع الورم. في هذا الصدد ، حصل البروتين على اسمه. أظهرت الدراسات اللاحقة أن دور عامل نخر الورم لا يقتصر على تحلل الخلايا السرطانية ، فعمله متعدد الأوجه ، فهو لا يشارك فقط في ردود الفعل في علم الأمراض ، ولكنه ضروري أيضًا لصحة الجسم. في الوقت نفسه ، لا تزال جميع وظائف هذا البروتين وجوهره الحقيقي تثير الكثير من الأسئلة.
الدور الرئيسي لعامل نخر الورم هو المشاركة في الاستجابات الالتهابية والمناعية. هاتان العمليتان متصلتان ارتباطًا وثيقًا ، ولا يمكن التمييز بينهما. في جميع مراحل تكوين الاستجابة المناعية والالتهابات ، يعمل عامل نخر الورم كأحد البروتينات المنظمة الرئيسية. في الأورام ، تحدث أيضًا بشكل نشط العمليات الالتهابية والمناعة ، "التي تتحكم فيها" السيتوكينات.
التأثيرات البيولوجية الرئيسية لعامل نخر الورم هي:
- المشاركة في الاستجابات المناعية.
- تنظيم الالتهاب
- التأثير على عملية تكون الدم.
- العمل السام للخلايا.
- تأثير Intersystem.
عندما تدخل الميكروبات والفيروسات والبروتينات الأجنبية إلى الجسم ، يتم تنشيط المناعة. يعمل عامل نخر الورم على زيادة عدد الخلايا الليمفاوية التائية والبائية ، وحركة العدلات إلى بؤرة الالتهاب ، و "التصاق" العدلات ، والخلايا الليمفاوية ، والضامة في البطانة الداخلية للأوعية الدموية في موقع الالتهاب. زيادة نفاذية الأوعية الدموية في منطقة تطور الاستجابة الالتهابية هي أيضًا نتيجة لعمل عامل نخر الورم.
تأثير عامل نخر الورم على خلايا الجسم
يؤثر عامل نخر الورم على تكون الدم. يمنع تكاثر كريات الدم الحمراء والخلايا الليمفاوية وخلايا الخط الأبيض لتكوين الدم ، ولكن إذا تم قمع تكون الدم لأي سبب من الأسباب ، فإن عامل نخر الورم سوف يحفزه. العديد من البروتينات النشطة ، السيتوكينات ، لها تأثير وقائي ضد الإشعاع. TNF أيضا له هذه التأثيرات.
يمكن اكتشاف عامل نخر الورم ليس فقط في الدم والبول ولكن أيضًا في السائل النخاعي ، مما يشير إلى تأثيره بين الجهازين. ينظم هذا البروتين نشاط الجهاز العصبي و أنظمة الغدد الصماء... TNF beta له تأثير محلي في الغالب ، و المظاهر الجهازيةالمناعة والالتهابات وتنظيم التمثيل الغذائي ، يلتزم الجسم بدقة إلى شكل ألفا من السيتوكين.
يتم التعرف على أحد أهم تأثيرات عامل نخر الورم على أنه سام للخلايا ، أي تدمير الخلايا ، والذي يتجلى تمامًا أثناء تطور الأورام. يعمل عامل نخر الورم على الخلايا السرطانية ، مما يتسبب في موتها من خلال إطلاق الجذور الحرة وأنواع الأكسجين التفاعلية وأكسيد النيتريك. بما أن الخلايا السرطانية المفردة تتشكل في أي كائن حي طوال الحياة ، فإن عامل نخر الورم ضروري و الأشخاص الأصحاءلتحييدها في الوقت المناسب وبسرعة.
يصاحب زرع الأعضاء والأنسجة وضع مستضدات أجنبية في الجسم ، حتى لو كان العضو هو الأنسب لمجموعة من المستضدات الفردية المحددة. غالبًا ما يكون الزرع مصحوبًا بتنشيط التفاعلات الالتهابية الموضعية ، والتي تستند أيضًا إلى تأثير عامل نخر الورم. أي بروتين غريب يحفز الاستجابة المناعية ، والأنسجة المزروعة ليست استثناء.
بعد الزرع ، يمكن اكتشاف زيادة في محتوى السيتوكين في مصل الدم ، مما قد يشير بشكل غير مباشر إلى بداية تفاعل الرفض. هذه الحقيقة تكمن وراء البحث حول استخدام الأدوية - الأجسام المضادة لـ TNF ، القادرة على تثبيط رفض الأنسجة المزروعة.
يمكن تتبع التأثير السلبي للتركيزات العالية من عامل نخر الورم في صدمة شديدة على خلفية ظروف الصرف الصحي. يتجلى إنتاج هذا السيتوكين بشكل خاص أثناء الإصابة بالبكتيريا ، عندما يتم الجمع بين تثبيط حاد للمناعة مع فشل القلب والكلى والكبد ، مما يؤدي إلى وفاة المرضى.
TNF قادر على تكسير الدهون وإلغاء تنشيط إنزيم يشارك في تخزين الدهون. تؤدي التركيزات الكبيرة من السيتوكين إلى نضوب (دنف) ، وهذا هو سبب تسميته أيضًا بـ cachectin. تتسبب هذه العمليات في الإصابة بالدنف السرطاني والهزال في المرضى الذين يعانون من أمراض معدية طويلة الأمد.
بالإضافة إلى الخصائص الموصوفة ، يلعب TNF أيضًا وظيفة تعويضية. بعد الضرر في بؤرة الالتهاب والاستجابة المناعية النشطة ، تزداد عمليات الشفاء. يعمل عامل نخر الورم على تنشيط نظام تخثر الدم ، والذي يتم من خلاله تحديد منطقة الالتهاب عن طريق الأوعية الدموية الدقيقة. يمنع Microthrombi انتشار العدوى. تنشيط الخلايا الليفية وتكوين ألياف الكولاجين يعزز التئام الآفة.
تحديد مستوى عامل نخر الورم وقيمته
لا يعد البحث المختبري لمستويات عامل نخر الورم اختبارًا شائعًا ، ولكن هذا المؤشر مهم جدًا في أنواع معينة من علم الأمراض. يظهر تحديد عامل نخر الورم عندما:
- العمليات المعدية والتهابات متكررة وطويلة الأمد ؛
- أمراض المناعة الذاتية؛
- الأورام الخبيثة؛
- مرض الحروق
- إصابات
- أمراض الكولاجين والتهاب المفاصل الروماتويدي.
لا يمكن أن تكون الزيادة في مستوى السيتوكينات بمثابة تشخيص فحسب ، بل أيضًا كمعيار تنبؤي. وبالتالي ، في حالة تعفن الدم ، تلعب الزيادة الحادة في عامل نخر الورم دورًا مميتًا ، مما يؤدي إلى صدمة شديدة وموت.
بالنسبة للدراسة ، يتم أخذ الدم الوريدي من المريض ، قبل التحليل لا يُسمح بشرب الشاي أو القهوة ، يُسمح فقط بالماء العادي. يجب استبعاد أي طعام لمدة 8 ساعات على الأقل.
لوحظ زيادة في عامل نخر الورم في الدم عندما:
- علم الأمراض المعدية
- الإنتان.
- الحروق؛
- تفاعلات تحسسية
- عمليات المناعة الذاتية.
- تصلب متعدد؛
- التهاب السحايا والتهاب الدماغ من طبيعة بكتيرية أو فيروسية ؛
- متلازمة مدينة دبي للإنترنت
- الكسب غير المشروع مقابل ردود فعل المضيف ؛
- صدفية؛
- داء السكري من النوع الأول.
- المايلوما وأورام الدم الأخرى.
- صدمة.
بالإضافة إلى الزيادة ، من الممكن أيضًا حدوث انخفاض في مستوى عامل نخر الورم ، لأنه يجب أن يكون موجودًا بشكل طبيعي ، وإن كان بكميات ضئيلة ، للحفاظ على الصحة والمناعة. انخفاض تركيز عامل نخر الورم هو سمة مميزة لما يلي:
- متلازمات نقص المناعة.
- سرطان الأعضاء الداخلية.
- استخدام بعض الأدوية - تثبيط الخلايا ، مثبطات المناعة ، الهرمونات.
TNF في علم الأدوية
دفعت مجموعة متنوعة من التفاعلات البيولوجية بوساطة عامل نخر الورم البحث في الاستخدام السريري لعقاقير عامل نخر الورم ومثبطاته. أكثر الأجسام المضادة الواعدة هي التي تقلل من كمية عامل نخر الورم في الأمراض الشديدة وتمنع المضاعفات المميتة ، بالإضافة إلى السيتوكين الاصطناعي المؤتلف الموصوف لمرضى السرطان.
تُستخدم نظائر الأدوية لعامل نخر الورم البشري بنشاط في علم الأورام. على سبيل المثال ، هذا العلاج ، إلى جانب العلاج الكيميائي القياسي ، فعال للغاية ضد سرطان الثدي وبعض الأورام الأخرى.
مثبطات عامل نخر الورم ألفا مضاد للالتهابات. مع تطور الالتهاب ، ليست هناك حاجة لوصف أدوية هذه المجموعة على الفور ، لأنه من أجل التعافي ، يجب أن يمر الجسم نفسه بجميع مراحل العملية الالتهابية ، وتشكيل مناعة وضمان الشفاء.
قمع مبكر الآليات الطبيعيةالحماية محفوفة بالمضاعفات ، لذلك يشار إلى مثبطات TNF فقط مع تفاعل مفرط وغير كافٍ ، عندما يكون الجسم غير قادر على التحكم في العملية المعدية.
تُوصف أدوية مثبطات عامل نخر الورم - ريميكاد ، إنبريل - لالتهاب المفاصل الروماتويدي ومرض كرون عند البالغين والأطفال ، التهاب القولون التقرحيوالتهاب المفاصل الفقاري والصدفية. كقاعدة عامة ، تُستخدم هذه الأدوية لعدم فعالية العلاج القياسي بالهرمونات ، ومضادات الخلايا ، والعوامل المضادة للأورام ، إذا كانت غير متسامحة أو إذا كانت هناك موانع لأدوية المجموعات الأخرى.
تعمل الأجسام المضادة لـ TNF (infliximab و rituximab) على تثبيط إنتاج TNF الزائد ويشار إليها للإنتان ، خاصة مع خطر الإصابة بالصدمة ، وعندما تحدث الصدمة ، فإنها تقلل من معدل الوفيات. يمكن وصف الأجسام المضادة للسيتوكينات في حالة استمرارها أمراض معديةمع دنف.
يتم تصنيف ثيموسين ألفا (ثيماكتيد) كعامل مناعي. يوصف للأمراض التي تعاني من ضعف المناعة ، والأمراض المعدية ، وتعفن الدم ، لتطبيع تكون الدم بعد الإشعاع ، مع عدوى فيروس نقص المناعة البشرية ، والمضاعفات المعدية الشديدة بعد الجراحة.
العلاج الخلوي هو اتجاه منفصل في علاج أمراض الأورام ، والذي تطور منذ نهاية القرن الماضي. تظهر مستحضرات السيتوكين كفاءة عالية ، لكن استخدامها المستقل غير مبرر. أفضل نتيجةممكن فقط من خلال نهج متكامل والاستخدام المشترك للسيتوكينات وأدوية العلاج الكيميائي والإشعاع.
تدمر الأدوية القائمة على عامل نخر الورم الورم ، وتمنع انتشار النقائل ، وتمنع الانتكاسات بعد إزالة الأورام. عند استخدامها في وقت واحد مع التثبيط الخلوي ، تقلل السيتوكينات من تأثيرها السام واحتمال حدوث ردود فعل سلبية. بالإضافة إلى ذلك ، بسبب التأثير المفيد على المناعة ، يمكن منع السيتوكينات المضاعفات المعديةعلى خلفية العلاج الكيميائي.
من بين أدوية TNF ذات النشاط المضاد للورم ، يتم استخدام refnot و ingaron المسجلة في روسيا. هذه عوامل أثبتت فعاليتها ضد الخلايا السرطانية ، لكن سميتها أقل من السيتوكين المنتج في جسم الإنسان.
Refnot له تأثير مدمر مباشر على الخلايا السرطانية ، ويمنع انقسامها ، ويسبب نخر الورم النزفي. ترتبط جدوى الورم ارتباطًا وثيقًا بإمدادات الدم ، وتقلل refnot من تكوين الأوعية الجديدة في الورم وتنشط نظام التخثر.
من الخصائص المهمة لـ refnot قدرتها على تعزيز التأثير السام للخلايا للأدوية القائمة على الإنترفيرون وعوامل أخرى مضادة للأورام. وبالتالي ، فإنه يزيد من فعالية السيتارابين والدوكسوروبيسين وغيرها ، مما يؤدي إلى تحقيق نشاط مضاد للأورام مرتفع من الاستخدام المشترك للسيتوكينات وأدوية العلاج الكيميائي.
لا يمكن وصف Refnot ليس فقط لسرطان الثدي ، كما هو موضح في التوصيات الرسمية للاستخدام ، ولكن أيضًا للأورام الأخرى - سرطان الرئة وسرطان الجلد وأورام الجهاز التناسلي الأنثوي
الآثار الجانبية مع استخدام السيتوكينات قليلة العدد ، وعادة ما تكون زيادة قصيرة المدى في درجة الحرارة ، والحكة. الأدوية هي بطلان في حالة التعصب الفردي ، للنساء الحوامل والمرضعات.
يتم وصف العلاج السيتوكيني حصريًا من قبل أخصائي ، والعلاج الذاتي في هذه الحالة غير وارد ، ولا يمكن شراء الأدوية إلا بوصفة طبية من الطبيب. تم تطوير نظام علاج فردي ومُدمج مع عوامل أخرى مضادة للأورام لكل مريض.
مثبطات عامل نخر الورم - الأدوية الحديثة لعلاج التهاب المفاصل الروماتويدي
يلعب عامل نخر الورم ألفا (TNF-α) دورًا رئيسيًا في تحفيز العملية الالتهابية والحفاظ عليها في التهاب المفاصل الروماتويدي (RA). يؤدي كبت نشاط عامل نخر الورم إلى انخفاض في تخليق الوسطاء الالتهابيين في الجسم ، مما يؤدي إلى تحقيق التأثير العلاجي الضروري في علاج المرض.
من عيوب العلاج بمثبطات TNF-α التكلفة العالية. ومع ذلك ، فإن طريقة العلاج هذه لها أيضًا مزايا مهمة: فعالية مثبتة ؛ سلامة؛ استقرار المغفرة المحققة.
دعونا نفكر في استخدام مثبطات TNF-α في الممارسة السريرية باستخدام مثال etanercept ، وهو دواء استخدم على نطاق واسع على مدى السنوات العشر الماضية في الولايات المتحدة الأمريكية وكندا والدول الأوروبية. تم تصميم مثبط عامل نخر الورم هذا للإعطاء تحت الجلد ، وبالتالي تجنب الاستشفاء المكلف والمطول لمرضى التهاب المفاصل الروماتويدي.
يستخدم Etanercept في علاج التهاب المفاصل الروماتويدي ، والذي يحدث مع نشاط معتدل إلى مرتفع لعملية الالتهاب. الدواء له تأثير محفز على مستقبلات TNF-α الموجودة في جسم المريض. نتيجة لذلك ، تلتقط المستقبلات بشكل أكثر نشاطًا فائضًا من TNF-α ، مما يقلل من تركيزها ، مما يؤدي إلى انخفاض في عملية الالتهاب.
مثل أدوية مثبطات TNF-α الأخرى ، يختلف etanercept بشكل كبير في العمل الدوائيمن مثبطات المناعة المستخدمة أيضًا في بعض أنظمة التهاب المفاصل الروماتويدي. تؤثر مثبطات المناعة فعليًا على جهاز المناعة بأكمله ، بينما تنشط مثبطات TNF-α ضد أهداف محددة تمثل مناطق معينة من التسبب في التهاب المفاصل الروماتويدي.
وقد أظهرت نتائج أبحاث Etanercept أن الجديد المنتجات الطبية- مثبط عامل نخر الورم - يؤدي إلى انخفاض كبير في شدة أعراض المرض ، وتحقيق مغفرات مستمرة وطويلة الأجل. يمكن استخدام Etanercept لكل من علاج RA الأحادي (العلاج بهذا الدواء فقط) وكجزء منه علاج معقد... يمكن دمج مثبطات عامل نخر الورم مع مضادات الالتهاب غير الستيرويدية (المسكنات) ومثبطات المناعة (الميثوتريكسات) والقشرانيات السكرية (GCs) ومسكنات الألم.
يتم حقن Etanercept تحت الجلد. يتم إجراء "الحقن" مرتين في الأسبوع. مواقع الحقن المحتملة: تحت جلد الكتف أو جدار البطن الأمامي أو الفخذ. لا يلزم دخول المرضى إلى المستشفى لتلقي العلاج بمثبطات عامل نخر الورم ، ويمكن إجراء الحقن ممرضفي غرفة العلاج في العيادة أو في المنزل.
وتجدر الإشارة إلى أن استخدام مثبطات عامل نخر الورم قد يكون مصحوبًا ببعض الآثار غير المرغوب فيها: الحمى ، والإسهال ، وآلام البطن ، ونقص الكريات البيض (انخفاض في عدد الكريات البيض) ، والصداع ، والدوخة ، واضطرابات الجهاز التنفسي. بالإضافة إلى ذلك ، تحدث أحيانًا تفاعلات موضعية في موقع الحقن (حكة وطفح جلدي).
لم يتم تحديد تأثير مثبطات TNF-α على الوظيفة الوقائية لجهاز المناعة. لذلك ، يجب تحذير المرضى الذين يتلقون etanercept من أن الاستخدام المحتمل للدواء يمكن أن يؤدي إلى الإصابة بعدوى مختلفة. لا ينبغي استخدام Etanercept لعلاج المرضى الذين يعانون من ضعف الجهاز المناعيحيث في هذه الحالة ، قد يصاب المرضى بأمراض معدية خطيرة محفوفة بالإنتان والموت. يُمنع استخدام Etanercept في المرضى الذين يعانون من أمراض قلبية معينة (يمكن أن يؤدي الدواء إلى قصور حاد في القلب والأوعية الدموية). لا تهدف مثبطات TNF-α إلى علاج التهاب المفاصل الروماتويدي دون استشارة طبية.
يمكن اعتبار إدخال مثبطات TNF-α في الممارسة السريرية الواسعة الانتشار أحد التطورات الطبية الرئيسية في علاج التهاب المفاصل الروماتويدي في العقود الأخيرة. إن استخدام عقاقير هذه المجموعة يجعل من الممكن تحقيق مغفرة المرض أو انخفاض كبير في نشاط العملية الالتهابية ، حتى في المرضى الذين تبين أنهم مقاومون (غير حساسين) لأنواع أخرى من العلاج الأساسي بمضادات الروماتيزم. يبطئ استخدام مثبطات TNF-α لعلاج التهاب المفاصل الروماتويدي بشكل كبير من تقدم تدمير (تدمير) المفاصل المصابة ، وهو ما تؤكده طرق البحث بالأشعة السينية.
موجز أخبار Spinet.ru
- 08.02 هل من الممكن ارتداء الأحذية كعب عاليلمشاكل الظهر؟
- 01.02 كيف تحدث كسور العظام عند كبار السن
- 27.01 فوائد أو أضرار ممارسة الرياضة في الشتاء
- 22.01 تسجيل Kinesio: الأساطير والواقع
- 15.01 ما هو النظام الغذائي الجيد لعظامك
المواضيع الأخيرة في المنتدى:
التهاب المفاصل
- التهاب المفاصل
- ما هو التهاب المفاصل
- الأسباب
- التهاب المفاصل القيحي الحاد
- التهاب المفاصل السيلاني
- التهاب المفاصل الكلاميديا
- التهاب المفاصل بعد التطعيم
- التهاب المفاصل الرضحي
- التهاب المفاصل المهني
- الروماتيزم
- التهاب المفاصل التفاعلي
- التهاب المفاصل عند الأطفال
- أرثرالجيا
- التهاب مفاصل الكتف
- مضاعفات التهاب المفاصل
- التشخيص
- التشخيص
- طرق التشخيص
- التشخيص المبكر
- التشخيصات المخبرية
- صعوبات في التشخيص
- تقنية التشخيص المبكر
- دور عامل نخر الورم في التهاب المفاصل الروماتويدي
- دور الخلايا التائية في الإصابة بالتهاب المفاصل الروماتويدي
- علاج او معاملة
- علاج التهاب المفاصل الروماتويدي
- علاج النظام الغذائي
- العلاج بالتبريد
- بيروكسيد الهيدروجين
- Hondoprotectors
- غذاء حمية
- العلاج الطبيعي
- الجمباز المشترك
- ابدأ العلاج في أقرب وقت ممكن
- الأدوية
- تخفيف الآلام في المنزل
- كيف يتم علاج التهاب المفاصل؟
- منع تدمير المفاصل في التهاب المفاصل
- العناية بالمتجعات
- الطرق التقليدية
- علاج سم النحل
- استخدام البارافين
- كيف تعالج التهاب المفاصل؟
- العلاج البديل لالتهاب المفاصل
- استخدم (GCS) في العلاج
- دور العلاج الدوائي
- علاج التهاب المفاصل النقرسي
- العلاج بالطرق الشعبية
- استخدام المكملات الغذائية في العلاج
- طب الاعشاب في علاج التهاب المفاصل
- مثبطات عامل نخر الورم
- منع
- المفاصل تؤلم
- تجريب التهاب المفاصل
- أيروبيكس
- النظام الغذائي لالتهاب المفاصل
صحة العمود الفقري ©
جميع المعلومات الموجودة على الموقع للأغراض الإعلامية فقط. لا تستخدم هذه المعلومات للتطبيب الذاتي. موانع الاستعمال ممكنة. تأكد من استشارة طبيبك.