عفونت های هرپس ویروس تولید مثل ویروس هرپس سیمپلکس
ویروس شکل خاصی از حیات است که دستگاه خود را برای تولید مثل ندارد، بنابراین ذرات ویروسی به داخل سلول میزبان نفوذ کرده و از قابلیت ها و دستگاه آن برای تولید مثل خود استفاده می کنند.
در خارج از سلول، یک ویروس را می توان با نوار نواری که روی طاقچه قرار دارد مقایسه کرد: برخی از اطلاعات روی نوار ضبط شده است، اما شما نمی توانید موسیقی را بشنوید. در حالی که کاست روی طاقچه است، هیچ اتفاقی برای آن نمی افتد. یک کاست صوتی را نمی توان به تنهایی کپی یا پخش کرد، برای این کار به یک ضبط صوت نیاز است. به همین ترتیب، ویروس نمی تواند در خارج از سلول تکثیر شود، علاوه بر این، هیچ فرآیند متابولیکی در آن انجام نمی شود: نیازی به تنفس، نوشیدن یا خوردن ندارد.
تولید مثل ویروس هرپس سیمپلکسدر چندین مرحله متوالی و جایگزین یکدیگر انجام می شود. در مرحله اول، ویروس به سلول میزبان می چسبد (جذب می شود).
داخل می شود و "لباس هایش را بیرون می اندازد" (پوسته های بیرونی). سپس وارد هسته سلول می شود، جایی که یک ویروس جدید سنتز می شود. بر آخرین مرحلهویروس از سلول خارج می شود.
پس از مقاربت یا رابطه جنسی دهانی، ویروس ها وارد می شوند تعداد زیادیبر روی غشاهای مخاطی یا پوستشریک جنسی غیر آلوده بسیاری از ذرات ویروسی با سلول های اپیتلیال انسان برخورد می کنند. در مرحله اول، بخشی از ذرات ویروسی با کمک "خارهای" گلیکوپروتئین ها به غشای خارجی سلول می چسبند (چسب می کنند). برای 1000 برخورد با یک سلول، تنها در 1 مورد ویروس به پوسته بیرونی خود می چسبد. در این مرحله که «مرحله چسبندگی برگشت پذیر» نامیده می شود، همچنان امکان جدا شدن ویروس از غشای خارجی سلول وجود دارد.
به تدریج، پوسته خارجی ویروس با غشای سلولی ادغام می شود و ساختار سطحی آن را تغییر می دهد.
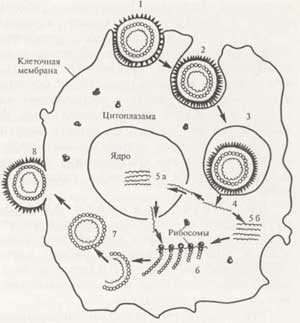
شکل "مراحل تولید مثل ویروس (نمودار)".
1 - جذب ویروس بر روی سلول.
2 - نفوذ ویروس به داخل سلول.
3 - ویروس داخل واکوئل سلولی;
4 - "برهنه کردن" ویروس;
5- تکثیر اسید نوکلئیک ویروسی در هسته سلول (الف)
6 - سنتز پروتئین های ویروسی بر روی ریبوزوم های سلول.
7 - تشکیل ویروس؛
8- خروج ویروس از سلول با جوانه زدن.
ویروس "لخت می کند" و غشاهای محافظی را که به آنها نیاز ندارد در داخل سلول بیرون می اندازد. فقط یک کپسید 20 وجهی روی DNA ویروسی باقی می ماند.
سپس در اطراف ویروس تزریق شده به سلول تشکیل می شود حباب کوچک- واکوئل در این وزیکول، ویروس به هسته سلول منتقل می شود. کپسید به هسته سلول می چسبد. بخشی از غشای هسته سلول را حل می کند و DNA ویروسی در داخل هسته است.
پس از 2 ساعت از لحظه ورود ویروس به سلول، DNA ویروسی از تولید DNA خود در هسته سلول جلوگیری می کند و سلول را مجبور می کند تا DNA ویروس را تولید کند.
در عرض 7-9 ساعت، هسته سلول DNA ویروسی را جمع می کند. کپسید ویروس نیز در اینجا تشکیل می شود. ساختارهای هسته از بین می روند. پس از 9 ساعت از شروع لحظه سنتز DNA ویروسی، ویروس ها از هسته به داخل سیتوپلاسم سلول خارج می شوند. در اینجا، با استفاده از غشای هسته ای و غشای سلولی، آنها یک پوسته بیرونی به دست می آورند - یک سوپر کپسید.
پس از 24 ساعت، ویروس ها با جوانه زدن از سلول خارج می شوند. به دلیل آسیب، سلول پر از مایع می شود و به زودی می میرد.
یک سلول چندین میلیون ویروس تولید می کند. از سلول اپیتلیال در محل نفوذ، ویروس ها وارد جریان خون شده و به گلبول های قرمز می چسبند و همراه با خون در سراسر بدن حمل می شوند.
راه دوم انتشار ویروس ها از طریق رشته های عصبی... ویروس از طریق شاخه های حساس وارد عصب می شود و در آنجا با جریان مایع آکسوپلاسمی به نورون های حساس گانگلیون شبکه خاجی نفوذ می کند. در سلولهای عصبی، ویروس یک کپسید و سوپرکپسید را از خود دفع میکند و به عنوان یک مولکول DNA دو رشتهای در سلولها زندگی میکند. در این حالت، سیستم ایمنی قادر به تشخیص ویروس و حذف آن از بدن نیست.
در صورت تأثیر عوامل خارجی: الکل، استرس، تروما، بیماری که منجر به کاهش ایمنی می شود، ویروس شروع به تکثیر در گانگلیون خاجی می کند و با جریان مایع آکسوپلاسمی به سمت اندام تناسلی حرکت می کند. جایی که در سلول های اپیتلیال عود عفونت وجود دارد.
منابع: طرح تکثیر ویروس ها از کتاب درسی میکروبیولوژی توسط Vorobiev، Bykov، Pashkov و Rybakova M، "پزشکی" 1994، ص 47 وام گرفته شده است.
دانشگاه علوم پزشکی تحقیقاتی.
N.I. Pirogova
وزارت بهداشت و توسعه اجتماعی روسیه
دپارتمان میکروب شناسی و ویروس شناسی
رئیس بخش– کافارسکایا لیودمیلا ایوانونا
چکیده با موضوع: "هرپس سیمپلکس"
تکمیل شده توسط دانش آموز گروه 244
کولپاکوف دیمیتری
بررسی شده توسط معلم:
خاریتونوف آناتولی آرکادیویچ
مسکو 2013
1) موقعیت طبقه بندی - جنس خانواده، گونه 2) مورفولوژی. 3) تولید مثل ویروس های تبخال 4) خواص آنتی ژنی. 5) پاتوژنز; 6) تشخيص 7) درمان 8) ايمني
1) موقعیت طبقه بندی - جنس خانواده، گونه
هرپس سیمپلکس، خانواده herpesviridae، زیرخانواده آلفا herpesviridae، جنس ویروس سیمپلکس، HHP انواع 1 و 2
2) مورفولوژی
DNA پوشش دار بزرگ حاوی ویروس. اندازه ویریون 150-200 نانومتر است. این ویروس دارای کپسید 162 کپسومر و همچنین سوپرکپسید است. کپسید حاوی DNA خطی دو رشته ای است که حاوی حدود 80 ژن است. نوع تقارن آن مکعبی است.
آنها در کشت سلول های زنده کشت می شوند و باعث چند هسته ای شدن آنها می شوند. حساس به گرما، به سرعت توسط ضد عفونی کننده های UV غیر فعال می شود.
3) تولید مثل ویروس های تبخال
تفاوت های اصلی بین چرخه تولید مثل ویروس های تبخال از سایر ویروس های DNA با ساختار ژنوم پیچیده تری مرتبط است. جذب ویروس ها روی سلول ها از طریق گیرنده های خاص انجام می شود. پس از تعامل با گیرنده ها، پوشش ویروسی با غشای سلولی ترکیب می شود و نوکلئوکپسید به سیتوپلاسم آزاد می شود. جداسازی (پروتئین زدایی) ژنوم ویروس در غشای هسته اتفاق می افتد و DNA ویروس در هسته سلول میزبان به دام می افتد. تولید مثل شامل مراحل اولیه و اواخر است، اما آنها به وضوح مشخص نیستند. مراحل اولیه تولید مثل هرپس ویروس. در مراحل اولیه، "پروتئین های اولیه" سنتز می شوند که توسط یک سوم پروگزیمال مولکول DNA کدگذاری می شوند. آنها خواص تنظیمی، از جمله فعال کردن رونویسی سایر مناطق ژنوم ویروسی را نشان می دهند که DNA پلیمراز و پروتئین های متصل شونده به DNA را کد می کند. مراحل پایانی تولید مثل ویروس هرپس. در مرحله آخر، DNA پلیمراز ویروسی تکثیر DNA مادر را القا می کند. در نتیجه، مولکول های DNA جمعیت دختر تشکیل می شود. بخشی از DNA دختر توسط پلیمرازهای سلولی خوانده می شود که باعث رونویسی ژن های پایانی کد کننده پروتئین های ساختاری (پروتئین های پوشش و گلیکوپروتئین های خار) می شود. تجمع جمعیت دختر ویروس های تبخال در هسته انجام می شود، جایی که پروتئین های کپسید مولکول های DNA را احاطه کرده و نوکلئوکپسیدها را تشکیل می دهند. مرحله نهایی مورفوژنز ویروس هرپس، تشکیل یک سوپر کپسید در سطح داخلی غشای هسته است. جمعیت دختر بالغ از غشای هسته ای اصلاح شده جوانه می زنند، از طریق سیتوپلاسم منتقل می شوند و دفع می شوند.
4) خواص آنتی ژنی؛
آنتی ژن های نوع خاص توسط گلیکوپروتئین های کپسید نشان داده می شوند که بر اساس آن دو نوع ویروس جدا می شوند: HSV-1 و HSV-2... آنتی ژن های گروه خاص توسط نوکلئوپروتئین ها نشان داده می شوند. گلیکوپروتئین سطحی gpC برای گروه خاص است، گلیکوپروتئین های سطحی gpB، gpD نوع خاص هستند.
5) پاتوژنز;
ویروس تبخال به دلیل عدم وجود گیرنده های خاص روی آن، قادر به نفوذ از لایه شاخی پوست دست نخورده نیست. تبخال از طریق تماس مستقیم پوسته های آسیب دیده با نواحی آسیب دیده پوست یا مایعات بیولوژیکی یک فرد آلوده منتقل می شود. ویروس HSV-2 منحصراً از طریق پوست (از طریق پوست) منتقل می شود.
پوشش خارجی ویروس با غشای سلولی ترکیب می شود. علاوه بر این، نوکلئوکپسید ویروسی در نوروپلاسم است، جایی که انتشار DNA ویروسی رخ می دهد. سپس در امتداد دندریت های انتهای عصبی به بدن یک نورون حساس که در گانگلیون حسی قرار دارد منتقل می شود، جایی که آنها برای همیشه در دستگاه ژنتیکی آن جاسازی می شوند. پس از نفوذ ویروس، روند تولید مثل فعال آن در سلول آغاز می شود - تداوم. با ضایعات لبی، ماندگاری ویروس در سلول های عصبی گانگلیون های حساس عصب سه قلو مشخص است و با ضایعات تناسلی، کمر.
در بیشتر افراد، تولید مثل و دفع ویروس بلافاصله پس از عفونت بدون علامت است. این می تواند بیش از یک هفته قبل یا بعد از ظاهر شدن اولین علائم در 50 درصد موارد رخ دهد. عامل ایجاد کننده به شدت در آن تکثیر می شود و نوعی عفونت لیتیک و مولد ایجاد می کند. دژنراسیون کانونی اپیتلیوم رخ می دهد: اندازه سلول ها افزایش می یابد، سپس می میرند و کانون های نکروز تشکیل می دهند.
ویروسهای تبخال دارای دورههای فعالیت چرخهای هستند (حبابهای حاوی ذرات ویروسی در عرض ۲۱-۲ روز تشکیل میشوند) و دورههای بهبودی، که در طی آن زخمها ناپدید میشوند. تبخال تناسلی (HSV-2) معمولاً بدون علامت است، اگرچه ویروس تکثیر می شود و می تواند به افراد دیگر منتقل شود. این بیشتر در مورد ویروس HSV-2 دیده می شود. عود بیماری به موقع مشخص نمی شود، اگرچه برخی از محرک های بیماری شناسایی شده اند. این عوامل شامل اثرات داروهای سرکوب کننده سیستم ایمنی ( زیر را ببینید). با عود، ویروسی که در مرحله نهفته است فعال می شود و در نتیجه ذرات عفونی زیادی تشکیل می شود که در امتداد فرآیندهای نورون حرکت می کنند و متعاقباً به اپیتلیوم پوست و غشاهای مخاطی منتقل می شوند. وزیکول ها اغلب دوباره ظاهر می شوند که با آسیب نکروزه به اپیتلیوم همراه است. چرخه تولید مثل ویروس 10 ساعت است. با گذشت زمان، بدن ایمنی ضد ویروسی ایجاد می کند و دفعات و شدت عودها کاهش می یابد.
حمل اغلب در طول 12 ماه اول پس از عفونت ادامه می یابد. مدت زمان چنین حاملی با نقص ایمنی (به عنوان مثال، با عفونت HIV) بیشتر. پس از آلوده شدن، بدن شروع به سنتز آنتی بادی علیه ویروس خاص HSV می کند و از گسترش عفونت جلوگیری می کند. در صورت عفونت با ویروس HSV-1، این تبدیل سروی (تولید آنتی بادی) از بدن در برابر سایر فرآیندهای عفونی ناشی از این ویروس مانند تبخال تناسلی، کراتیت هرپس و پاناریتیوم محافظت می کند.
آنتی بادی هایی که پس از اولیه تولید می شوند عفونت تبخالاز عفونت با همان نوع ویروس جلوگیری کنید: افرادی که تبخال دهانی HSV-1 داشته اند، پاناریتیوم یا تبخال تناسلی ناشی از HSV-1 ندارند.
در ازدواج تک همسری، خطر ابتلا به عفونت از یک مرد مثبت سرم در یک زن دارای سرم منفی بیش از 30 درصد در سال است. در طول اولین عفونت دهان، تولید آنتی بادی های محافظ 6 هفته طول می کشد و پس از آن ایمنی هومورال می تواند از بدن در برابر عفونت های مکرر تناسلی محافظت کند.
6) تشخیص
روش سرولوژیکیروش سرولوژیکی با IgM بین آنتی بادی های ویروس های HSV-1 و HSV-2 تمایز قائل نمی شود. با این حال، آزمایش HSV اختصاصی گلیکوپروتئین G-ایمونو نقطه ای جدید بیش از 98 درصد ویژگی را ارائه می دهد و بنابراین امکان تشخیص انواع تبخال HSV-1 و HSV-2 را فراهم می کند. برخی از پزشکان خارجی بر این باورند که آزمایش IgM به زودی با آزمایش جدیدی جایگزین خواهد شد.
روش سیتولوژیدر خراش دادن ناحیه آسیب دیده اپیتلیوم، رنگ آمیزی شده طبق رومانوفسکی - گیمسا، سلول های چند هسته ای با ادخال های داخل سلولی یافت می شود.
روش ویروس شناسیکشتهای سلولی آلوده میشوند و عمل سیتوپاتولوژیک (CPE) به شکل سلولهای چند هستهای غولپیکر با انکلوزیونهایی که از بین میروند شناسایی میشود. شناسایی در واکنش خنثی سازی CPP انجام می شود. تپه دریاییبا آنتی بادی های مونوکلونال پلاک های سفید روی غشای کوریونالانتوئیک جنین مرغ پس از 2-3 روز تشکیل می شود.
روش بیولوژیکیهنگامی که از مواد ویروسی برای زخم شدن قرنیه خرگوش استفاده می شود، کراتیت رخ می دهد و آنسفالیت در مغز موش های تازه متولد شده رخ می دهد.
روش ایمونوفلورسانس، تست حساسیت پوستی، PCR
7) درمان
در حال حاضر هیچ روشی برای حذف ویروس از بدن وجود ندارد. داروهای ضد ویروسی فقط دفعات، مدت و شدت عود را کاهش می دهند. مسکن هایی مانند ایبوپروفن و پاراستامول فقط درد و تب را کاهش می دهند. بی حس کننده های موضعی مانند پریلوکائین، لیدوکائین، بنزوکائین یا تتراکائین نیز خارش و درد را تسکین می دهند.
موثر در برابر عفونت های تبخال: آسیکلوویر، والاسیکلوویر، فامسیکلوویر، پنسیکلوویر. آسیکلوویر اولین کسی بود که کشف شد و ژنتیک زیادی وجود دارد.
ثابت شده است که آسیکلوویر و والاسیکلوویر در درمان تبخال صورت (لب) از جمله در بیماران سرطانی موثر هستند. شواهدی برای حمایت از استفاده از آسیکلوویر در درمان ژنژیووستوماتیت هرپسی اولیه کمتر قوی است.
8) مصونیت
با عفونت اولیه، آنتی بادی های IgM تشکیل می شود، با عود - IgG و IgA. با توجه به تداوم ویروس در افراد آلوده، ایمنی غیر استریل و موقت است - با کاهش ایمنی، به ویژه با کمبود سلول های کشنده طبیعی (NK)، عود رخ می دهد. علاوه بر این، ویروس تبخال خود قادر به القای نقص ایمنی است که یکی از مکانیسم های آن تحریک سنتز آنتی بادی های IgG "بی اثر" است که ایمنی را سرکوب می کند و NK را سرکوب می کند. در افراد مقاوم به عفونت، ایمنی توسط سیستم اینترفرون، سلول های کشنده طبیعی و T-قاتل و همچنین آنتی بادی های sIgA اعمال می شود. 80-90 درصد بزرگسالان دارای آنتی بادی IgG برای HSV-1 هستند. سطح ایمنی به طور قابل توجهی بر تعداد و شدت عود تأثیر می گذارد.
در سال های اخیر، ویروس های هرپس (از هرپس یونانی - خزنده) در آسیب شناسی عفونی اهمیت فزاینده ای پیدا کرده اند. توجهی که ویروس شناسان و پزشکان در 25 سال گذشته به بیماری های هرپس ویروس انسانی نشان داده اند با نقش اپیدمیولوژیک و اهمیت اجتماعی قابل توجه آنها در دنیای مدرن... افزایش مداوم تعداد بیماری های تبخال در بزرگسالان و کودکان، مطالعه جامع عفونت تبخال و توسعه روش های موثر برای پیشگیری و درمان اشکال مختلف این عفونت را ضروری می کند. در میان عفونت های ویروسیتبخال به دلیل انتشار همه جا ویروس ها، انواع تظاهرات بالینی، به عنوان یک قاعده، دوره مزمن، و همچنین راه های مختلف انتقال ویروس ها، یکی از مکان های پیشرو را اشغال می کند.
این بیماری در میان شایع ترین و ضعیف ترین عفونت های انسانی قرار دارد. ویروسهای هرپس میتوانند بدون علامت در بدنهایی با سیستم ایمنی طبیعی گردش کنند، اما باعث بیماریهای جدی و کشنده در افراد دچار سرکوب سیستم ایمنی میشوند. بر اساس WHO، مرگ و میر ناشی از عفونت تبخال در میان بیماری های ویروسیپس از هپاتیت (35.8%) در جایگاه دوم (15.8%) قرار دارد.
ویروس های هرپس در یک خانواده بزرگ ترکیب می شوند هرپس ویریدو در حال حاضر به وضوح طبقه بندی شده است. خانواده هرپس ویریدبیش از 80 نماینده را شامل می شود که 8 نفر از آنها بیماری زاترین برای انسان هستند (ویروس هرپس انسانی-HHV). ویروسهای هرپس - یک خانواده باستانی فیلوژنتیکی از ویروسهای DNA بزرگ - بسته به نوع سلولهایی که فرآیند عفونی در آنها انجام میشود، ماهیت تولید مثل ویروس، ساختار ژنوم، ویژگیهای بیولوژیکی و ایمنی مولکولی به 3 زیر خانواده تقسیم میشوند: α، β. و γ ( ، به گفته N.G. Perminov، I.V. Timofeeva و دیگران، مرکز تحقیقات دولتی ویروس شناسی و بیوتکنولوژی).
ویروس های آلفا هرپس، از جمله HSV-1، HSV-2 و VZV، با تکثیر سریع ویروسی و عملکرد سیتوپاتیک در کشت های سلولی آلوده مشخص می شوند. تولید مثل ویروس های آلفا هرپس در آن اتفاق می افتد انواع متفاوتسلولها، ویروسها میتوانند به شکل نهفته، عمدتاً در گانگلیون، باقی بمانند.
ویروس های بتا هرپس گونه های خاص هستند، عفونی می کنند انواع مختلفسلول هایی که اندازه آنها افزایش می یابد (سیتومگالی) می توانند باعث ایجاد شرایط سرکوب کننده سیستم ایمنی شوند. عفونت می تواند به شکل عمومی یا نهفته باشد؛ عفونت پایدار به راحتی در کشت سلولی رخ می دهد. این گروه شامل CMV، HHV-6، HHV-7 است.
ویروسهای γ-هرپس با تروپیسم سلولهای لنفوئیدی (لنفوسیتهای T و B) مشخص میشوند که در آنها برای مدت طولانی باقی میمانند و میتوانند تبدیل شوند و باعث لنفوم و سارکوم شوند. این گروه شامل ویروس Epstein-Barr و HHV-8-Herpes، یک ویروس مرتبط با سارکوم کاپوزی (KSHV) است. KSHV از نظر سازماندهی ژنومی به ویروس هرپس سیمپلکس سیمیری (HVS) نزدیکترین نوع سلول T است.
ویروسهای هرپس با بدخیمی مرتبط هستند و میتوانند (حداقل EBV و HVS) سلولها را در شرایط آزمایشگاهی تغییر دهند. همه ویروسهای هرپس از نظر ویژگیهای مورفولوژیکی، اندازه، نوع اسید نوکلئیک (DNA دو رشتهای)، کپسید ایکوزادلت وجهی، که تجمع آن در هسته یک سلول آلوده، پوشش، نوع تولید مثل و توانایی ایجاد مزمن مشابه است. و عفونت نهفته در انسان.
شبیه سازی ویروس های تبخال بر اساس طرح زیر انجام می شود: جذب تصادفی خود به خود ویروس "مادر" اصلی روی سطح سلول هدف، "برهنه کردن ویریون" - برش پاکت و کپسید، نفوذ DNA ویروسی به هسته سلول هدف، تشکیل و بلوغ ویریون های "دختری" با جوانه زدن روی غشای هسته ای. پس از عفونت یک سلول، به عنوان مثال با ویروس هرپس سیمپلکس 1 یا 2 نوع، سنتز پروتئین های ویروسی جدید در 2 ساعت شروع می شود و تعداد آنها در حدود 8 ساعت به حداکثر می رسد. کپسیدها و DNA غشاهای آنها از غشاهای موجود در آمینو اسیدها، پروتئین ها، لیپوپروتئین ها و نوکلئوزیدهای سلول آلوده تشکیل می شوند. این مولکول ها از فضاهای بینابینی وارد سلول آلوده می شوند، زیرا ذخایر داخل سلولی تمام می شود. از این نظر، ویروس ها به شدت متابولیسم داخل سلولی بستگی دارند که به نوبه خود توسط ماهیت سلول هدف تعیین می شود. بنابراین بیشترین میزان متابولیسم مربوط به سلول های کوتاه مدت از نوع اپیتلیوئید است ویروس های تبخالبه ویژه سلول های اپیتلیوم و غشاهای مخاطی، خون و بافت های لنفاوی را به خوبی کلونیزه می کند. ویریونهای عفونی «دختری» که کاملاً تشکیل شده و برای تولید مثل فعال بعدی آماده شدهاند، پس از 10 ساعت در داخل سلول آلوده ظاهر میشوند و تعداد آنها پس از حدود 15 ساعت به حداکثر میرسد.تعداد ویریونها تا حدی بر سرعت انتشار عفونت و ناحیه ضایعه
اولین نسل از ویروس های تبخال "دختری" پس از حدود 18 ساعت شروع به ورود به محیط (فضاهای بین سلولی، خون، لنف و سایر رسانه های بیولوژیکی) می کند. ، عفونت سیتومگالوویروس عمومی) - عناصر یک بثورات تبخال بر روی پوست یا غشاهای مخاطی به صورت امواج ظاهر می شوند. در حالت آزاد، ویروس های تبخال برای یک دوره بسیار کوتاه (از 1 تا 4 ساعت) هستند - این مدت زمانی است که مشخصه دوره است. مسمومیت حادبا عفونت های ویروسی تبخال طول عمر هر نسل از ویروس های هرپس تشکیل شده و جذب شده به طور متوسط 3 روز است.
از نظر اپیدمیولوژیک، اطلاعات زیر در مورد ویروس های تبخال جالب است: ویریون ها به شدت حرارت پذیر هستند - آنها در دمای 50-52 درجه سانتیگراد به مدت 30 دقیقه غیرفعال می شوند، در دمای 37.5 درجه سانتیگراد - در عرض 20 ساعت، پایدار هستند. دمای 70 درجه سانتیگراد؛ لیوفیلیزاسیون را به خوبی تحمل می کند، برای مدت طولانی در بافت ها در محلول گلیسیرین 50٪ باقی می ماند. بر روی سطوح فلزی (سکه، دستگیره در، شیر آب)، ویروس های تبخال به مدت 2 ساعت، روی پلاستیک و چوب - تا 3 ساعت، در پنبه و گاز پزشکی مرطوب - تا زمانی که در دمای اتاق خشک شوند (تا 6 ساعت) زنده می مانند.
خواص بیولوژیکی منحصر به فرد همه ویروس های هرپس انسانی عبارتند از تروپیسم بافتی، توانایی ماندگاری و تاخیر در بدن یک فرد آلوده. ماندگاری توانایی ویروس های تبخال برای تکثیر مداوم یا چرخه ای (تکثیر) در سلول های عفونی بافت های استوایی است که یک تهدید دائمی برای توسعه فرآیند عفونی ایجاد می کند. نهفتگی ویروس های تبخال، حفظ مادام العمر ویروس ها به شکل اصلاح شده از نظر مورفولوژیکی و ایمونوشیمیایی در سلول های عصبی ناحیه ای (در رابطه با محل معرفی ویروس تبخال) گانگلیون اعصاب حسی است. سویههای ویروس تبخال به دلیل ویژگیهای سیستم آنزیمیشان، توانایی نابرابر ماندگاری و تأخیر و حساسیت به داروهای ضد تبخال را دارند. هر ویروس هرپس میزان ماندگاری و تاخیر خاص خود را دارد. در بین نمونههای مورد مطالعه، فعالترین ویروسهای هرپس سیمپلکس در این زمینه و کمترین نوع آن ویروس اپشتین بار است.
بر اساس مطالعات متعدد، تا سن 18 سالگی، بیش از 90 درصد از ساکنان شهری به یک یا چند سویه از حداقل 7 ویروس هرپس با اهمیت بالینی (هرپس سیمپلکس انواع 1 و 2، واریسلا زوستر، سیتومگالوویروس، اپشتین بار، تبخال انسانی انواع 6 و 8). در بیشتر موارد، عفونت اولیه و مجدد توسط قطرات معلق در هوا، از طریق تماس مستقیم یا از طریق وسایل خانگی و بهداشتی (حوله های مشترک، دستمال، و غیره) رخ می دهد. راه های انتقال دهانی، تناسلی، تناسلی، انتقال خون، پیوند و انتقال از طریق جفت نیز ثابت شده است.
عفونت های ویروسی تبخال در جهان گسترده است و به طور پیوسته رشد می کند. یکی از ویژگیهای عفونت ویروسی تبخال، امکان درگیر شدن بسیاری از اندامها و سیستمها در فرآیند عفونی است که انواع بیماریهای ناشی از ویروسهای تبخال را توضیح میدهد، از عفونتهای پوستی مخاطی ساده تا عفونتهای عمومی تهدیدکننده زندگی. یکی از ویژگی های مهم ویروس های تبخال این است که پس از عفونت اولیه، توانایی آن را دارد دوران کودکیمادام العمر در بدن باقی می مانند و تحت تأثیر عوامل مختلف تحریک کننده خارجی و درون زا دوباره فعال می شوند.
عفونت انسان با ویروس های تبخال نشان داده شده همراه است علائم بالینیحاد مناسب بیماری عفونیبه طور متوسط، بیش از 50٪ افراد، عمدتا در کودکان: اریتم ناگهانی (ویروس هرپس نوع 6 انسانی)، استوماتیت آفتی (ویروس هرپس سیمپلکس 1 یا 2 نوع)، آبله مرغان (ویروس واریسلا زوستر)، مونونوکلئوز عفونی (ویروس اپشتین - Barr)، سندرم شبه مونونوکلئوز (سیتومگالوویروس). در سایر بیماران، عفونت بدون علامت است، که به ویژه برای نوجوانان و بزرگسالان معمول است. علاوه بر خواص بیولوژیکی سویه ویروس هرپس، ویژگیهای فردی (مربوط به سن، جنسی، فیلوژنتیکی و انکوژنتیک) پاسخ ایمنی فرد آلوده به آنتیژنهای متعدد ویروس بر روند حاد و حاد تأثیر میگذارد. بیماری های عود کننده تبخال-ویروسی.
اغلب، بهویژه با کاهش واکنشپذیری ایمنی بدن، ویروسهای تبخال بهعنوان ویروسهای فرصتطلب عمل میکنند که منجر به شدیدتر و غیرعادیتر میشود. تظاهرات بالینی، سیر بیماری زمینه ای. ویروس های هرپس سیمپلکس نوع 1 و 2 و همچنین CMV از عوامل ایجاد کننده عفونت TORCH هستند. آنها نقش مهمی در نقض عملکرد تولید مثل انسان، ایجاد بیماری های جدی مادر، جنین، نوزادان و کودکان خردسال دارند.
بیماری های ناشی از ویروس های HSV، CMV، EBV به دلیل تشخیص مکرر آنها در این آسیب شناسی به عنوان شاخص های ایدز در نظر گرفته می شوند. در سال 1988، آنها در تعریف گسترده موارد ایدز گنجانده شدند. نتایج مطالعات اخیر نقش برخی از ویروس های تبخال (HHV-8، CMV، EBV و غیره) را در ایجاد تعدادی از ویروس ها نشان می دهد. نئوپلاسم های بدخیم: کارسینوم نازوفارنکس، لنفوم بورکیت، لنفوم سلول B، سرطان سینه، آدنوکارسینوم روده و پروستات، کارسینوم کانال دهانه رحم، سارکوم کاپوزی، نوروبلاستوم و غیره.
بزرگترین تهدید برای سلامتی ناشی از عفونت های عصبی تبخال (کشندگی به 20٪ و بروز ناتوانی 50٪ است)، تبخال چشمی (تقریباً در نیمی از بیماران منجر به ایجاد آب مروارید یا گلوکوم می شود) و تبخال تناسلی است.
ظاهراً همه عفونتهای ویروس هرپس شناخته شده میتوانند عود کنند، با این حال، آستانه و دلایل تبدیل شکل حاد به عودکننده برای هر نوع ویروس هرپس متفاوت است. به طور کلی، عفونت های ویروسی تبخال در بیش از 8 تا 20 درصد از بیماران یک دوره عود کننده به خود می گیرد. بیماریهای ویروسی تبخال مکرر در برخی از افراد زمانی که طی سالهای متمادی ایجاد میشوند، میتوانند به عنوان "مزمن" تلقی شوند، نه تنها سلامت جسمی و عملکرد سیستمهای حیاتی را از بین میبرند، بلکه از نظر روانی نیز بر بیمار تأثیر منفی میگذارند. بنابراین، برای اهداف عملی، عفونت های ویروسی تبخال با در نظر گرفتن محلی سازی روند، عود و علت طبقه بندی می شوند. ).
دلایل دوره مکرر عفونت های ویروسی هرپسی بسیار متنوع است. یکی از آنها این است که تبدیل یک فرآیند حاد تبخال-ویروسی به یک مزمن با "همدستی" آشکار رخ می دهد. سیستم ایمنی... اگر نقص ایمنی اکتسابی در نتیجه شیمی درمانی یا عفونت HIV به راحتی توضیح داده شود، پس تمام تلاش ها برای یافتن علت نقص اصلی در پاسخ ایمنی در افراد سالم از نظر ایمنی با عفونت مکرر هرپس ویروس ناموفق بوده است. دلیل دیگر ظاهراً در ویژگی های کمی و کیفی ماندگاری و تأخیر یک سویه ویروس هرپس خاص در بدن بیمار است.
تشخیص عفونت تبخال
تمام روش های نشان دادن و شناسایی ویروس ها بر اساس اصول زیر است:
- تشخیص ویروس فی نفسه (میکروسکوپ الکترونی)؛
- شناسایی و شناسایی ویروس ها با استفاده از سلول هایی که با آنها تعامل دارند (انباشته شدن ویروس ها در سلول های حساس به آنها).
- شناسایی و شناسایی ویروس ها با استفاده از آنتی بادی ها (MFA، ELISA، RAL، IB، RN، RSK).
- تشخیص و شناسایی اسیدهای نوکلئیک (PCR، MG).
میکروسکوپ الکترونی: تشخیص سریع امکان تشخیص HS یا اجزای آن را مستقیماً در نمونه های گرفته شده از بیمار و دادن پاسخ سریع پس از چند ساعت فراهم می کند. پاتوژن با استفاده از میکروسکوپ الکترونی مواد بالینی با کنتراست منفی شناسایی می شود.
روش های سرولوژیکی از نظر محتوای اطلاعاتی و حساسیت نسبت به روش های دیگر پایین تر است تشخیص آزمایشگاهیو اجازه نمی دهد تا با درجه اطمینان کافی علت این یا آن شکل از بیماری مشخص شود. افزایش تیتر آنتی بادی رخ می دهد
v تاریخ های دیرهنگام(چند هفته) پس از عفونت یا فعال شدن مجدد ویروس و در عین حال ممکن است در افراد دارای نقص ایمنی مشاهده نشود. برای ایجاد افزایش 4 برابری در تیتر آنتی بادی ها به عفونت ویروسی تبخال (شاخص عفونت اولیه)، مطالعه سرم های جفت ضروری است. واکنشهای سرولوژیکی (RSK، RN) دارای ویژگی بالا، اما حساسیت نسبتاً کم، و علاوه بر این، انجام آن دشوار است.
روش ایمونوفلورسانس، ELISA، RAL، IB کاربرد عملی گسترده ای دریافت کرده است.
دقیق ترین روش برای تشخیص عفونت ویروسی تبخال، جداسازی ویروس از کشت های مختلف سلولی است.
روش های بیولوژیکی مولکولی برای تشخیص ویروس هرپس: پلیمراز استفاده می شود واکنش زنجیره ایو یک واکنش هیبریداسیون مولکولی، که می تواند وجود اسید نوکلئیک ویروسی را در ماده آزمایش تشخیص دهد. PCR را می توان حساس ترین و سریع ترین واکنش در نظر گرفت. حساسیت این روش امکان تعیین یک مولکول DNA مورد نظر را در نمونه های حاوی 10 سلول فراهم می کند.
درمان عفونت تبخال
تا به امروز، درمان عفونت تبخال یک کار دشوار باقی مانده است. سیر مزمن این فرآیند منجر به بازسازی سیستم ایمنی بدن می شود: ایجاد نقص ایمنی ثانویه، مهار واکنش ایمنی سلولی و کاهش دفاع غیراختصاصی بدن. با وجود تنوع مواد مخدربرای درمان عفونت تبخال استفاده می شود، داروهافراهم آوردن درمان کاملاز تبخال وجود ندارد. عفونت ویروسی تبخالبه بیماری هایی اشاره دارد که کنترل آنها دشوار است. این اول از همه به دلیل انواع ضایعات بالینی، ایجاد مقاومت ویروس در برابر داروها و وجود تقلید مولکولی در ویروس های هرپس است. بنابراین، برای درمان موفقیت آمیز عفونت تبخال، انتخاب مناسب ضروری است داروی ضد ویروسی، دوز و مدت درمان آن، از ترکیبی از داروهای مختلف استفاده کنید. به منظور افزایش اثربخشی درمان، همچنین لازم است داروهای ایمونوبیولوژیکی که به اصلاح وضعیت ایمنی کمک می کنند، و همچنین عوامل بیماری زا که وضعیت بیمار را کاهش می دهند، وارد شوند.
در حال حاضر تمام داروهای ضد تبخال به 3 گروه اصلی از داروهای ضد ویروسی تقسیم می شوند. ).
مکانیسم اثر داروهای شیمی درمانی (نوکلئوزیدهای غیرطبیعی: والترکس، وکتاویر، فامویر، سایمون) با مهار سنتز DNA ویروسی و تکثیر ویروس با مهار رقابتی DNA پلیمراز ویروسی همراه است.
در داروها - تعدیل کننده های ایمنی (آلپیزارین، ایمونوفان، لیکوپید، پلی اکسیدونیوم) به طور فعال عناصر فعالدارای خواص تحریک کننده ایمنی در رابطه با ایمنی سلولی و هومورال، فرآیندهای ردوکس، سنتز سیتوکین است.
داروهای القاکننده IFN (آمیکسین، نئوویر، سیکلوفرون) اثرات اتیوتروپیک و تعدیل کننده ایمنی را ترکیب می کنند. این داروها باعث ایجاد IFN درون زا (α، β، γ) توسط لنفوسیت های T و B، انتروسیت ها، سلول های کبدی می شوند.
واکسن تبخال برای فعال کردن ایمنی سلولی، تصحیح ایمنی آن در مرحله بهبودی، جایگاه ویژه ای در میان ابزارهای درمان ضد تبخال-ویروسی دارد. واکسیناسیون 2 هدف دارد: پیشگیری از عفونت اولیه و پیدایش حالت نهفتگی و همچنین پیشگیری یا تسکین سیر بیماری.
با این حال، علیرغم وجود فهرست گسترده ای از داروهای ضد تبخال، تبخال همچنان یک عفونت کنترل نشده باقی می ماند. این به دلیل ویژگی های ژنوتیپی پاتوژن و ماندگاری طولانی مدت ویروس در بدن و تشکیل سویه های مقاوم به داروهای ضد ویروسی است. حداکثر اثر بالینی را می توان تنها با درمان پیچیده منطقی از داروهایی با مکانیسم های مختلف عمل به دست آورد.
گروه ویروس شناسان و متخصصان بیماری های عفونی سن پترزبورگ به سرپرستی V. A. Isakov برنامه ای را برای درمان و پیشگیری از عفونت تبخال پیشنهاد کردند (جدول 4).
مزایای درمان پیچیده GI.
- استفاده ترکیبی از شیمی درمانی ضد تبخال و عوامل ایمونوبیولوژیکی یک اثر هم افزایی ایجاد می کند.
- با کاهش دوز HPP ضد ویروسی، احتمال ایجاد اثرات جانبی، اثر سمی روی بدن بیمار کاهش می یابد.
- احتمال ظهور سویه های مقاوم ویروس تبخال به این دارو کاهش می یابد.
- یک اثر اصلاح کننده ایمنی حاصل می شود.
- مدت دوره حاد بیماری و مدت درمان کاهش می یابد.
بنابراین، درمان دستگاه گوارش یک کار پیچیده و چند جزئی است.
برای سوالات ادبیات، لطفا با تحریریه تماس بگیرید.
تی کی کوسکووا، کاندیدای علوم پزشکی
E. G. Belova, کاندیدای علوم پزشکی
MGMSU، مسکو
1. ویروس شناسی. تاریخچه ویروس شناسی. چمبرلین RU. پاستور. ایوانوفسکی
2. تولید مثل ویروس ها. تولید مثل ویروس های + RNA. پیکورناویروس ها تولید مثل پیکورناویروس ها
3. توگا ویروس ها. تولید مثل توگا ویروس ها. رتروویروس ها تولید مثل رتروویروس ها
4. تولید مثل ویروس های -RNA. تولید مثل ویروس ها با RNA دو رشته ای.
5. تولید مثل ویروس های DNA. چرخه همانندسازی ویروس های حاوی DNA تولید مثل پاپووا ویروس ها. تولید مثل آدنوویروس ها
7. تولید مثل ویروس هپاتیت B. چرخه تکثیر ویروس هپاتیت B.
8. ژنتیک ویروس ها. خصوصیات جمعیت ویروسی مخزن ژنی جمعیت های ویروسی
9. جهش های ویروسی. جهش خود به خودی ویروس ها جهش های ناشی از ویروس ها تظاهرات جهش های ویروسی در فنوتیپ.
10. فعل و انفعالات ژنتیکی بین ویروس ها. نوترکیبی و توزیع مجدد ژن ها توسط ویروس ها. تبادل قطعات ژنوم توسط ویروس ها شیفت آنتی ژنی
تفاوت های اصلی در چرخه تولید مثل هرپس ویروس هااز جانب سایر ویروس های DNAمرتبط با ساختار ژنوم پیچیده تر است. جذب ویروس ها روی سلول ها از طریق گیرنده های خاص انجام می شود. پس از تعامل با گیرنده ها، پوشش ویروسی با غشای سلولی ترکیب می شود و نوکلئوکپسید به سیتوپلاسم آزاد می شود. جداسازی (پروتئین زدایی) ژنوم ویروس در غشای هسته اتفاق می افتد و DNA ویروس در هسته سلول میزبان به دام می افتد. تولید مثل شامل مراحل اولیه و اواخر است، اما آنها به وضوح مشخص نیستند.
مراحل اولیه تولید مثل هرپس ویروس... در مراحل اولیه، "پروتئین های اولیه" سنتز می شوند که توسط یک سوم پروگزیمال مولکول DNA کدگذاری می شوند. آنها خواص تنظیمی، از جمله فعال کردن رونویسی سایر مناطق ژنوم ویروسی را نشان می دهند که DNA پلیمراز و پروتئین های متصل شونده به DNA را کد می کند.
مراحل پایانی تولید مثل ویروس هرپس... در مرحله آخر، DNA پلیمراز ویروسی تکثیر DNA مادر را القا می کند. در نتیجه، مولکول های DNA جمعیت دختر تشکیل می شود. بخشی از DNA دختر توسط پلیمرازهای سلولی خوانده می شود که باعث رونویسی ژن های پایانی کد کننده پروتئین های ساختاری (پروتئین های پوشش و گلیکوپروتئین های خار) می شود.
جمع آوری جمعیت های دختر هرپس ویروس هادر هسته اتفاق می افتد، جایی که پروتئین های کپسید مولکول های DNA را احاطه کرده و نوکلئوکپسیدها را تشکیل می دهند. مرحله نهایی مورفوژنز ویروس هرپس، تشکیل یک سوپر کپسید در سطح داخلی غشای هسته است. جمعیت دختر بالغ از غشای هسته ای اصلاح شده جوانه می زنند، از طریق سیتوپلاسم منتقل می شوند و دفع می شوند.
ویروس های پوکس. تولید مثل ویروس آبله.
ویروس های پوکسپیچیده ترین چرخه تولید مثل را دارند، در حالی که بیش از 100 پروتئین مختلف سنتز می شوند که ویریون ها را تشکیل می دهند (بیشتر آنها پوسته بیرونی را تشکیل می دهند). تولید مثل ویروس پوکس با ویژگی های زیر مشخص می شود.
رونویسی DNAقبل از پروتئین زدایی کامل ویروس شروع می شود، زیرا به طور کامل توسط پلیمرازهای ویروسی انجام می شود.
همانند سازیفقط در سیتوپلاسم رخ می دهد و کاملاً مستقل از پلیمرازهای سلولی است، زیرا برخلاف سایر ویروس ها، ویروس های پوکس دارای RNA پلیمراز وابسته به DNA خود هستند که بیش از نیمی از ژنوم ویروس را در مراحل اولیه و اولیه می خواند.
V چرخه تولید مثل سه وجود دارد مراحل - اولیه، زود و دیر.
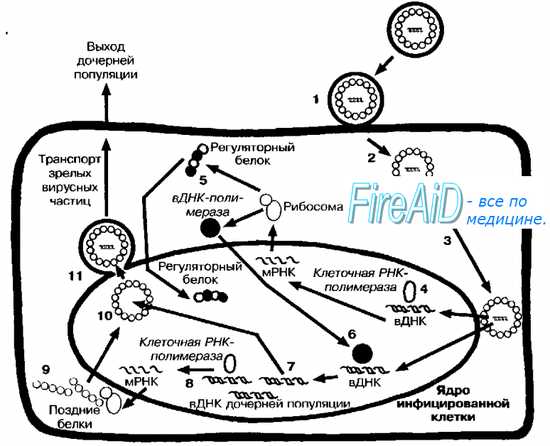 برنج. 5-4. چرخه همانندسازی ویروس های DNA(به عنوان مثال تولید مثل ویروس هرپس). پس از جذب (1) ویروس با همجوشی با غشاء وارد سلول می شود (2). نوکلئوکپسید به پوشش هسته ای منتقل می شود (3)، و DNA ویروسی (vDNA) وارد هسته سلول می شود، جایی که رونویسی آن توسط RNA پلیمراز وابسته به DNA سلولی آغاز می شود (4). ابتدا "ژن های اولیه" رونویسی می شوند. در نتیجه ترجمه "بخش اولیه" ژنوم ویروسی، "پروتئین های اولیه" سنتز می شوند (5)، از جمله پلیمرازهای تنظیمی، ماتریکس و ویروسی. پلیمراز ویروسی وارد ژنوم سلول می شود (6)، جایی که سنتز مولکول های DNA جمعیت های دختر را آغاز می کند (7). بخشی از DNA ویروسی ("ژن های دیررس") جمعیت های دختر توسط RNA پلیمراز سلولی (8) رونویسی می شود، که منجر به سنتز "پروتئین های دیررس" (9) مورد نیاز برای تجمع جمعیت های دختر می شود (10). دومی هسته را ترک می کند و از غشای آن جوانه می زند (11) که قطعات آن در پوسته آنها وجود دارد.
برنج. 5-4. چرخه همانندسازی ویروس های DNA(به عنوان مثال تولید مثل ویروس هرپس). پس از جذب (1) ویروس با همجوشی با غشاء وارد سلول می شود (2). نوکلئوکپسید به پوشش هسته ای منتقل می شود (3)، و DNA ویروسی (vDNA) وارد هسته سلول می شود، جایی که رونویسی آن توسط RNA پلیمراز وابسته به DNA سلولی آغاز می شود (4). ابتدا "ژن های اولیه" رونویسی می شوند. در نتیجه ترجمه "بخش اولیه" ژنوم ویروسی، "پروتئین های اولیه" سنتز می شوند (5)، از جمله پلیمرازهای تنظیمی، ماتریکس و ویروسی. پلیمراز ویروسی وارد ژنوم سلول می شود (6)، جایی که سنتز مولکول های DNA جمعیت های دختر را آغاز می کند (7). بخشی از DNA ویروسی ("ژن های دیررس") جمعیت های دختر توسط RNA پلیمراز سلولی (8) رونویسی می شود، که منجر به سنتز "پروتئین های دیررس" (9) مورد نیاز برای تجمع جمعیت های دختر می شود (10). دومی هسته را ترک می کند و از غشای آن جوانه می زند (11) که قطعات آن در پوسته آنها وجود دارد.
مرحله اولیه تولید مثل ویروس های آبلهبلافاصله پس از برهنه شدن ویروس و رها شدن DNA ویروس در سیتوپلاسم شروع می شود.
مراحل اولیه تولید مثل ویروس آبله... در این مرحله حدود نیمی از DNA ویروس رونویسی می شود. آنزیمها سنتز میشوند، توسط «ژنهای اولیه» کدگذاری میشوند و در تکثیر DNA ویروسی نقش دارند. به موازات آن، پروتئین های ساختاری در مقادیر کم تشکیل می شوند.
مرحله آخر تولید مثل ویروس آبلههمزمان با آغاز همانندسازی DNA (که مکانیسم های رونویسی را برای خواندن نیمه دوم ژنوم تغییر می دهد). پروتئین های تنظیم کننده ترجمه "mRNA اولیه" را مسدود می کنند و باعث سنتز پروتئین های دیررس (ساختاری) می شوند. مونتاژ ویریون ها فقط در سیتوپلاسم از طریق واکنش های سنتز غشایی انجام می شود. آزادسازی جمعیت های بالغ با لیز سلولی همراه است.