ヘルペスウイルス感染症。 単純ヘルペスウイルスの繁殖
ウイルスは、独自の生殖装置を持たない特殊な生命体であるため、ウイルス粒子が宿主細胞に侵入し、その能力と装置を利用して独自の生殖を行います。
細胞の外では、ウイルスは窓辺にあるテープカセットと比較することができます。一部の情報はテープに記録されていますが、音楽を聞くことはできません。 カセットが窓辺にある間は、何も起こりません。 オーディオカセットを単独でコピーまたは再生することはできません。これにはテープレコーダーが必要です。 同様に、ウイルスは細胞の外で増殖することはできません。さらに、ウイルスは代謝プロセスを起こさず、呼吸したり、飲んだり、食べたりする必要はありません。
ウイルスの繁殖 単純ヘルペスいくつかの連続した段階で実行され、互いに置き換えられます。 最初の段階では、ウイルスは宿主細胞に「付着」(吸着)し、次に
中に入ると、「服を脱ぎ捨てる」(外殻)。 その後、細胞核に入り、そこで新しいウイルスが合成されます。 に 最終段階ウイルスは細胞を離れます。
性交またはオーラルセックスの後、ウイルス 多数粘膜に乗るか、 肌感染していない性的パートナー。 多くのウイルス粒子がヒトの上皮細胞と衝突します。 最初の段階では、糖タンパク質の「棘」の助けを借りてウイルス粒子の一部が細胞の外膜に付着(付着)します。 細胞との1000回の衝突の場合、ウイルスがその外殻に付着するのは1つの場合のみです。 「可逆的接着の段階」と呼ばれるこの段階では、ウイルスが細胞の外膜から分離する可能性があります。
徐々に、ウイルスの外殻が細胞膜と融合し、その表面構造が変化します。
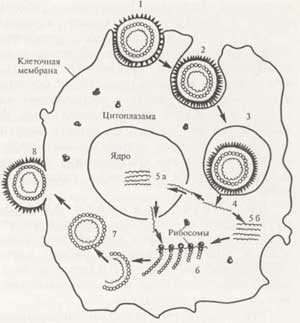
図「ウイルス複製の段階(図)」。
1-細胞へのウイルスの吸着;
2-細胞へのウイルスの侵入;
3-細胞液胞内のウイルス;
4-ウイルスを「脱衣」する。
5-細胞核におけるウイルス核酸の複製(a)
6-細胞のリボソームでのウイルスタンパク質の合成;
7-ウイルスの形成;
8-出芽による細胞からのウイルスの退出。
ウイルスは「脱衣」し、細胞内に必要のない保護膜を剥がします。 ウイルスDNAには20ファセットのキャプシドが1つだけ残っています。
次に、細胞に注入されたウイルスの周りに形成されます 小さな泡-液胞。 この小胞では、ウイルスは細胞核に輸送されます。 キャプシドは細胞核に付着します。 それは細胞核の膜の一部を溶解し、ウイルスDNAは核の中にあります。
ウイルスが細胞に入った瞬間から2時間後、ウイルスDNAは細胞核での自身のDNAの生成をブロックし、細胞にウイルスのDNAを生成させます。
7〜9時間以内に、細胞の核はウイルスDNAを蓄積します。 ウイルスのキャプシドもここで形成されます。 核の構造が破壊されます。 ウイルスのDNA合成の瞬間の始まりから9時間後、ウイルスは核を離れて細胞の細胞質に入る。 ここでは、核膜と細胞膜を使用して、外殻(スーパーキャプシド)を取得します。
24時間後、出芽によるウイルスは細胞を離れます。 損傷により、セルは液体で満たされ、すぐに死にます。
1つの細胞が数百万のウイルスを生成します。 ウイルスは、侵入部位の上皮細胞から血流に入り、赤血球に付着し、血液とともに全身に運ばれます。
ウイルスを広める2番目の方法は 神経線維..。 ウイルスは敏感な枝を通って神経に入り、軸索原形質液の流れで仙骨神経叢の神経節の敏感なニューロンに侵入します。 神経細胞では、ウイルスはそれ自体がキャプシドとスーパーキャプシドを放出し、二本鎖DNA分子として細胞内に「生きる」。 この状態では、免疫系はウイルスを検出して体から取り除くことができません。
外的要因の場合:アルコール、ストレス、外傷、免疫力の低下につながる病気、ウイルスは仙骨神経節で増殖し始め、軸索原形質液の流れで生殖器に向かって漂流します。 ここで、上皮細胞では、感染が再発します。
出典:ウイルスの繁殖計画は、Vorobiev、Bykov、Pashkov、Rybakova Mによる教科書Microbiology、 "Medicine" 1994、p。47から借用しています。
研究医科大学。
N.I. Pirogova
ロシア保健社会開発省
微生物学およびウイルス学科
部門長– カファルスカヤリュドミライワノフナ
トピックの要約:「単純ヘルペス」
グループ244の学生によって完成
コルパコフドミトリー
先生によるチェック:
ハリトーノフアナトリーアルカディエビッチ
モスクワ2013
1)分類学的位置-属科、種2)形態; 3)ヘルペスウイルスの繁殖4)抗原性; 5)病因; 6)診断7)治療8)免疫
1)分類学的位置-科の属、種
単純ヘルペス、ヘルペスウイルス科、アルファヘルペスウイルス亜科、単純ヘルペスウイルス属、HHPタイプ1および2
2)形態;
ウイルスを含む大きなエンベロープDNA。 ビリオンのサイズは150〜200nmです。 このウイルスには、162個のカプソメアのキャプシドとスーパーキャプシドがあります。 キャプシドには、約80個の遺伝子を含む線状の二本鎖DNAが含まれています。 対称タイプは3次です。
それらは生細胞の培養で培養され、それらの多核化を引き起こします。 熱に敏感で、UV消毒剤によってすぐに不活化されます。
3)ヘルペスウイルスの繁殖
他のDNAウイルスからのヘルペスウイルスの生殖周期の主な違いは、より複雑なゲノム構造に関連しています。 細胞へのウイルスの吸着は、特定の受容体を介して行われます。 受容体と相互作用した後、ウイルスエンベロープは細胞膜と融合し、ヌクレオカプシドが細胞質に放出されます。 ウイルスゲノムのストリッピング(除タンパク)は核膜で起こり、ウイルスDNAは宿主細胞の核にトラップされます。 繁殖には初期段階と後期段階が含まれますが、それらは明確に描写されていません。 ヘルペスウイルスの繁殖の初期段階。 初期の段階では、「初期タンパク質」が合成され、DNA分子の近位3分の1によってコードされます。 それらは、DNAポリメラーゼおよびDNA結合タンパク質をコードするウイルスゲノムの他の領域の転写の活性化を含む調節特性を示します。 ヘルペスウイルスの繁殖の後期。 後期では、ウイルスDNAポリメラーゼが母体DNAの複製を誘導します。 その結果、娘集団のDNA分子が形成されます。 娘DNAの一部は細胞のポリメラーゼによって読み取られ、構造タンパク質(コートタンパク質ととげの糖タンパク質)をコードする末端遺伝子の転写を引き起こします。 ヘルペスウイルスの娘集団の集合は、キャプシドタンパク質がDNA分子を取り囲み、ヌクレオカプシドを形成する核内で行われます。 ヘルペスウイルスの形態形成の最終段階は、核膜の内面でのスーパーキャプシドの形成です。 成熟した娘集団は、改変された核膜から出芽し、細胞質を通って輸送され、排泄される。
4)抗原性;
型特異的抗原はキャプシド糖タンパク質で表され、これに基づいて2種類のウイルスが分離されます:HSV-1と HSV-2..。 群特異抗原は核タンパク質で表されます。 表面糖タンパク質gpCはグループ固有であり、表面糖タンパク質gpB、gpDはタイプ固有です。
5)病因;
ヘルペスウイルスは、特定の受容体がないため、皮膚の無傷の角質層を貫通することができません。 ヘルペスは、損傷した外皮が皮膚の患部または感染者の体液と直接接触することによって感染します。 HSV-2ウイルスは、(皮膚を介して)経皮的にのみ感染します。
ウイルスの外皮は細胞膜と融合します。 さらに、ウイルスヌクレオカプシドは、ウイルスDNAの放出が起こる神経質にあります。 次に、神経終末の樹状突起に沿って、感覚神経節にある敏感なニューロンの体に運ばれ、そこで永久にその遺伝子装置に埋め込まれます。 ウイルスの侵入後、細胞内での活発な繁殖のプロセスが始まります-持続性。 陰唇病変の場合、ウイルスの持続性は、三叉神経の敏感な神経節の神経細胞に特徴的であり、生殖器病変の場合、腰部に特徴的です。
ほとんどの人では、感染直後のウイルスの繁殖と排出は無症候性です。 これは、50%の症例で最初の症状が現れる前または後に1週間以上発生する可能性があります。 原因物質はその中で集中的に増殖し、溶解性で生産的なタイプの感染を引き起こします。 上皮の限局性変性が起こります:細胞はサイズが大きくなり、次に死んで、壊死の病巣を形成します。
ヘルペスウイルスには周期的な活動期間(ウイルス粒子を含む泡が2〜21日以内に形成される)と寛解期間があり、その間に痛みは消えます。 性器ヘルペス(HSV-2)は通常無症候性ですが、ウイルスは増殖し、他の人に感染する可能性があります。 これはHSV-2ウイルスで最も一般的です。 病気のいくつかの引き金は確認されていますが、病気の再発は時間内に決定されていません。 これらの要因には、免疫抑制剤の効果が含まれます( 下記参照)。 再発すると、潜伏期にあるウイルスが活性化され、ニューロンのプロセスに沿って移動する多くの感染性粒子が形成され、そこから皮膚や粘膜の上皮に侵入します。 小胞は、上皮への壊死性損傷を伴って、しばしば再出現します。 ウイルスの再生サイクルは10時間です。 時間が経つにつれて、体は抗ウイルス免疫を発達させ、再発の頻度と重症度は減少します。
保菌は、ほとんどの場合、感染後の最初の12か月間継続します。 免疫不全を伴うそのような保因者の期間(例えば、 HIV感染) もっと。 感染すると、体は特定のHSV型ウイルスに対する抗体の合成を開始し、感染の拡大を防ぎます。 HSV-1ウイルスに感染した場合、このセロコンバージョン(抗体の産生)は、性器ヘルペス、ヘルペス性角膜炎、パナリティウムなど、このウイルスによって引き起こされる他の感染過程から体を保護します。
最初の後に生成される抗体 ヘルペス感染同じタイプのウイルスによる感染を防ぎます。HSV-1口腔顔面ヘルペスにかかったことがある人は、HSV-1によって引き起こされた汎発性ヘルペスや性器ヘルペスを持っていません。
一夫一婦制の結婚では、血清反応陰性の女性は、血清反応陽性の男性から年間30%以上感染するリスクがあります。 最初の口腔感染症では、防御抗体の産生に6週間かかります。その後、体液性免疫により、性器感染症の繰り返しから体を保護することができます。
6)診断
血清学的方法。 IgMを用いた血清学的方法では、HSV-1型とHSV-2型のウイルスに対する抗体を区別しません。 ただし、新しい免疫点糖タンパク質G特異的HSV検査は、98%以上の特異性を提供するため、HSV-1型とHSV-2型のヘルペスを区別することができます。 一部の外国人臨床医は、IgM検査がまもなく新しい検査に置き換えられると信じています。
細胞学的方法。ロマノフスキー-ギムザに従って染色された上皮の患部の掻き取りでは、細胞内封入体を伴う多核細胞が見られます。
ウイルス学的方法。細胞培養物が感染し、細胞病理学的作用(CPE)が、破壊された封入体を伴う巨大な多核細胞の形で検出されます。 同定は、CPPの中和反応で行われます。 リーフモノクローナル抗体を使用します。 2〜3日後にニワトリ胚の絨毛膜に白いプラークが形成されます。
生物学的方法。ウサギの角膜の乱切にウイルス物質を適用すると、角膜炎が発生し、新生児マウスの脳に脳炎が発生します。
蛍光抗体法、皮膚アレルギー検査、PCR
7)治療
現時点では、体からウイルスを取り除く方法はありません。 抗ウイルス薬は、再発の頻度、期間、および重症度を軽減するだけです。 イブプロフェンやパラセタモールなどの鎮痛薬は、痛みと発熱を軽減するだけです。 プリロカイン、リドカイン、ベンゾカイン、テトラカインなどの局所麻酔薬もかゆみや痛みを和らげます。
ヘルペス感染症に対して効果的:アシクロビル、バラシクロビル、ファムシクロビル、ペンシクロビル。 アシクロビルが最初に発見され、多くの遺伝学があります。
アシクロビルとバラシクロビルは、癌患者を含む顔面ヘルペス(唇)の治療に効果的であることが証明されています。 原発性ヘルペス性歯肉口内炎の治療におけるアシクロビルの使用を支持する証拠はそれほど強力ではありません。
8)イミュニティ
一次感染では、IgM抗体が形成され、再発します-IgGとIgA。 感染した人々のウイルスの持続性のために、免疫は非滅菌で一時的です-免疫の低下、特にナチュラルキラー細胞(NK)の欠乏により、再発が起こります。 さらに、ヘルペスウイルス自体が免疫不全を誘発する可能性があり、そのメカニズムの1つは、免疫を抑制し、NKを抑制する「無効な」IgG抗体の合成を刺激することです。 感染に抵抗力のある人々では、免疫はインターフェロンシステム、ナチュラルキラー細胞とTキラー細胞、およびsIgA抗体によって行使されます。 成人の80〜90%がHSV-1に対するIgG抗体を持っています。 免疫のレベルは、再発の数と重症度に大きく影響します。
近年、(ギリシャのヘルペスからの-忍び寄る)ヘルペスウイルスは、感染性病理学においてますます重要になっています。 ウイルス学者と臨床医が過去25年間にヒトヘルペスウイルス病に示した注目は、それらの重要な疫学的役割と社会的重要性に関連しています。 現代世界..。 成人と小児のヘルペス病の数が着実に増加しているため、ヘルペス感染症の包括的な研究と、この感染症のさまざまな形態の予防と治療のための効果的な方法の開発が必要です。 の中 ウイルス感染ヘルペスは、ウイルスの遍在的な広がり、原則としてさまざまな臨床症状、慢性的な経過、およびウイルスのさまざまな感染方法のために、主要な場所の1つを占めています。
これは、最も一般的で制御が不十分な人間の感染症の1つです。 ヘルペスウイルスは、免疫系が正常な体内を無症状で循環する可能性がありますが、免疫抑制状態の人に深刻で致命的な病気を引き起こします。 WHOによると、ヘルペス感染による死亡率は ウイルス性疾患肝炎(35.8%)に次ぐ2位(15.8%)です。
ヘルペスウイルスは大家族に統合されます ヘルペスウイルス科現在、最も明確に分類されています。 家族 ヘルペスウイルス科 80人以上の代表者が含まれており、そのうち8人がヒトに対して最も病原性が高い(ヒトヘルペスウイルス-HHV)。 ヘルペスウイルス(系統発生的に古代の大きなDNAウイルスのファミリー)は、感染プロセスが発生する細胞のタイプ、ウイルス複製の性質、ゲノム構造、分子生物学的および免疫学的特徴に応じて、3つのサブファミリーに細分されます:α、βおよびγ( 、N.G。Perminov、I.V。Timofeevaなどによると、ウイルス学およびバイオテクノロジーの国家研究センター)。
HSV-1、HSV-2、VZVなどのαヘルペスウイルスは、感染した細胞培養物に対する迅速なウイルス複製と細胞変性作用を特徴としています。 αヘルペスウイルスの繁殖は 他の種類細胞、ウイルスは、主に神経節に潜伏している可能性があります。
βヘルペスウイルスは種特異的で、感染します 異なる種類サイズが大きくなる(サイトメガロ)細胞は、免疫抑制状態を引き起こす可能性があります。 感染は一般化された形または潜在的な形をとることがあります;持続感染は細胞培養で簡単に起こります。 このグループには、CMV、HHV-6、HHV-7が含まれます。
γ-ヘルペスウイルスは、リンパ球(Tリンパ球およびBリンパ球)の向性を特徴とし、長期間持続し、形質転換してリンパ腫、肉腫を引き起こす可能性があります。 このグループには、エプスタインバーウイルスとカポジ肉腫(KSHV)に関連するウイルスであるHHV-8ヘルペスが含まれます。 KSHVは、T細胞指向性のSimiri単純ヘルペスウイルス(HVS)に最も近いゲノム構成です。
ヘルペスウイルスは悪性腫瘍に関連しており、invitroで細胞を形質転換することができます(少なくともEBVおよびHVSの能力があります)。 すべてのヘルペスウイルスは、形態的特徴、サイズ、核酸の種類(二本鎖DNA)、感染細胞の核で集合が起こるイコサデルタヘドラルキャプシド、エンベロープ、複製の種類、および慢性を引き起こす能力が類似しています。人間の潜伏感染。
ヘルペスウイルスのクローニングは、次のスキームに従って行われます。標的細胞の表面への元の「母」ウイルスの自発的なランダム吸着、「ビリオンの脱衣」-エンベロープとキャプシドの切断、ウイルスDNAの核への浸潤標的細胞、核膜への出芽による「娘」ビリオンの形成および成熟。 たとえば1型または2型の単純ヘルペスウイルスに細胞を感染させた後、新しいウイルスタンパク質の合成は2時間で始まり、その数は約8時間で最大に達します。「娘」ウイルスの成熟中、それらの膜キャプシドおよびDNAは、感染した細胞のアミノ酸、タンパク質、リポタンパク質、およびヌクレオシドの内部で利用可能なものから形成されます。 これらの分子は、細胞内の予備が枯渇すると、間質腔から感染細胞に入ります。 この点で、ウイルスは細胞内代謝の強度に依存し、細胞内代謝は標的細胞の性質によって決定されます。 最高の代謝率は類上皮型の短命細胞に特徴的であり、したがって ヘルペスウイルス特に上皮や粘膜、血液、リンパ組織の細胞によくコロニーを形成します。 完全に形成され、その後の活発な繁殖の準備ができている「娘」感染性ビリオンは、感染細胞内に10時間後に現れ、その数は約15時間後に最大になります。ビリオンの数は、感染の拡大率と病変の領域。
第一世代の「娘」ヘルペスウイルスは、約18時間後に環境(細胞間空間、血液、リンパ液、その他の生物学的媒体)に侵入し始めます。これは、制御されていないプロセス(たとえば、鶏痘、ヘルペス帯状疱疹)を伴う臨床診療で観察できます。 、一般化サイトメガロウイルス感染症)-ヘルペス性発疹の要素が波状に皮膚または粘膜に現れます。 自由な状態では、ヘルペスウイルスは非常に短い期間(1〜4時間)です-これは期間の特徴である期間です 急性中毒ヘルペスウイルス感染症。 形成され吸着されたヘルペスウイルスの各世代の寿命は平均3日です。
疫学的には、ヘルペスウイルスに関する次の情報が最も興味深いものです。ビリオンは非常に熱に不安定です。50〜52°Cの温度で30分間不活化され、37.5°Cの温度で20時間以内に安定します。 70°Cの温度; 凍結乾燥によく耐え、50%グリセリン溶液中の組織で長期間持続します。 金属表面(コイン、ドアノブ、水栓)では、ヘルペスウイルスは、プラスチックと木材で2時間、湿った医療用綿とガーゼで最大3時間、室温で乾燥するまで(最大6時間)生き残ります。
すべてのヒトヘルペスウイルスのユニークな生物学的特性は、組織向性、持続する能力、および感染した人の体内での潜伏期です。 持続性とは、熱帯組織の感染細胞でヘルペスウイルスが継続的または周期的に増殖(複製)する能力であり、感染過程の発達に対する絶え間ない脅威を生み出します。 ヘルペスウイルスの潜伏期は、感覚神経の局所(ヘルペスウイルスの導入場所に関連して)神経節の神経細胞において、形態学的および免疫化学的に改変された形態のウイルスの生涯にわたる保存である。 ヘルペスウイルスの株は、それらの酵素システムの特殊性のために、持続性と潜伏性、および抗ヘルペス薬に対する感受性に不平等な能力を持っています。 各ヘルペスウイルスには、独自の持続率と潜伏率があります。 研究された中で、この点で最も活性が高いのは単純ヘルペスウイルスであり、最も活性が低いのはエプスタインバーウイルスです。
多くの研究によると、18歳までに、都市住民の90%以上が、少なくとも7つの臨床的に重要なヘルペスウイルス(単純ヘルペス1型および2型、水痘帯状疱疹、サイトメガロウイルス、エプスタインバー、ヒトヘルペス6型および8型)。 ほとんどの場合、一次感染と再感染は、空気中の飛沫、直接の接触、または家庭用品や衛生用品(共有タオル、ハンカチなど)によって発生します。 経口、生殖器、口腔生殖器、輸血、移植、経胎盤感染経路も証明されています。
ヘルペスウイルス感染症は世界中に蔓延しており、着実に増殖する傾向があります。 ヘルペスウイルス感染の特徴は、感染過程に多くの臓器やシステムが関与する可能性があることです。これは、単純な粘膜皮膚感染から生命を脅かす全身感染に至るまで、ヘルペスウイルスによって引き起こされるさまざまな病気を説明しています。 ヘルペスウイルスの重要な特性は、一次感染後、 子供時代体内で一生持続し、さまざまな外因性および内因性の誘発因子の影響下で再活性化します。
示されたヘルペスウイルスによるヒトの感染は、 臨床症状適切な急性 感染症平均して、主に子供たちの50%以下の人々:突然の紅斑(ヒトヘルペスウイルス6型)、アフタ性口内炎(単純ヘルペスウイルス1または2型)、チキンポックス(水痘帯状疱疹ウイルス)、伝染性単核球症(エプスタインウイルス- Barr)、単核球症様症候群(サイトメガロウイルス)。 他の患者では、感染は無症候性であり、これは特に青年および成人に典型的です。 ヘルペスウイルス株の生物学的特性に加えて、ウイルスの多数の抗原に対する感染者の免疫応答の個々の(年齢に関連した、性的、系統発生的および腫瘍形成的)特性は、急性および再発性ヘルペスウイルス性疾患。
多くの場合、特に体の免疫反応性が低下すると、ヘルペスウイルスは日和見ウイルスとして作用し、異常な状態でより重症になります。 臨床症状、基礎疾患の経過。 タイプ1および2の単純ヘルペスウイルスとCMVは、TORCH感染の原因物質の1つです。 それらは、人間の生殖機能の侵害、母親、胎児、新生児および幼児の深刻な病気の発症に重要な役割を果たします。
HSV、CMV、EBVウイルスによって引き起こされる病気は、この病状で頻繁に検出されるため、AIDS指標と見なされます。 1988年に、それらはエイズ症例の拡張された定義に含まれました。 最近の研究の結果は、いくつかのヘルペスウイルス(HHV-8、CMV、EBVなど)の発生における役割を示しています。 悪性新生物:鼻咽頭癌、バーキットリンパ腫、B細胞リンパ腫、乳癌、腸および前立腺の腺癌、子宮頸管の癌、カポジ肉腫、神経芽細胞腫など。
健康への最大の脅威は、ヘルペス神経感染症(致死率は20%に達し、障害の発生率は50%)、眼科ヘルペス(患者のほぼ半数で白内障または緑内障の発症につながる)および性器ヘルペスによって引き起こされます。
明らかに、すべての既知のヘルペスウイルス感染が再発する可能性がありますが、ヘルペスウイルスの種類ごとに急性型が再発型に変化するしきい値と理由は異なります。 一般に、ヘルペスウイルス感染症は、患者の8〜20%以下で再発します。 一部の人々の再発性ヘルペスウイルス性疾患は、長年にわたって発症すると「慢性」と見なされる可能性があり、身体の健康と生命システムの機能を破壊するだけでなく、患者に心理的に非常に悪影響を及ぼします。 したがって、実用的な目的のために、ヘルペスウイルス感染症は、プロセスの局在化、再発および病因を考慮して分類されます( ).
ヘルペスウイルス感染が再発する理由は多岐にわたります。 それらの1つは、急性ヘルペスウイルスプロセスの慢性プロセスへの変換が明らかな「気づき」で起こるということです 免疫系..。 化学療法またはHIV感染の結果として後天性免疫不全が説明しやすい場合、再発性ヘルペスウイルス感染症の免疫学的に健康な人々の免疫応答の主な欠陥の原因を突き止める試みはすべて失敗しています。 別の理由は、明らかに、患者の体内の特定のヘルペスウイルス株の持続性と潜伏性の量的および質的特徴にあります。
ヘルペス感染の診断
ウイルスの適応と識別のためのすべての方法は、次の原則に基づいています。
- ウイルス自体の検出(電子顕微鏡);
- それらと相互作用する細胞によるウイルスの検出および同定(それらに感受性のある細胞におけるウイルスの蓄積);
- 抗体(MFA、ELISA、RAL、IB、RN、RSK)を使用したウイルスの検出と識別。
- 核酸の検出と同定(PCR、MG)。
電子顕微鏡:迅速な診断により、患者から採取したサンプルからHSまたはその成分を直接検出し、数時間後に迅速に応答することができます。 病原体は、ネガティブコントラストの臨床材料の電子顕微鏡を使用して検出されます。
血清学的方法は、情報内容と感度が他の方法より劣っています 実験室診断そして、この病気またはその形態の病気の病因を十分な程度の確実性で確立することを許可しないでください。 抗体価の上昇が起こります
v 遅い日付(数週間)ウイルスの感染または再活性化後、同時に、免疫不全の人には観察されない場合があります。 ヘルペスウイルス感染(一次感染の指標)に対する抗体価の4倍の増加を確立するには、ペア血清を研究する必要があります。 血清学的反応(RSK、RN)は特異性は高いが感度が比較的低く、さらに実行が困難です。
蛍光抗体法、ELISA、RAL、IBは広く実用化されています。
ヘルペスウイルス感染を診断するための最も正確な方法は、さまざまな細胞培養からウイルスを分離することです。
分子生物学的方法は、ヘルペスウイルスを検出するために使用されます:ポリメラーゼ 連鎖反応試験材料中のウイルス核酸の存在を検出することができる分子ハイブリダイゼーション反応。 PCRは、最も感度が高く、最も速い反応と見なすことができます。 このメソッドの感度により、10個の細胞を含むサンプルから目的のDNAの1分子を決定することができます。
ヘルペス感染症の治療
今日まで、ヘルペス感染症の治療は依然として困難な作業です。 プロセスの慢性的な経過は、体の免疫再構築につながります:二次免疫不全の発症、細胞性免疫反応の阻害、および体の非特異的防御の低下。 多様性にもかかわらず 薬物ヘルペス感染症の治療に使用され、 薬提供する 完全な治療ヘルペスからは存在しません。 ヘルペスウイルス感染制御が難しい病気を指します。 これは、まず第一に、さまざまな臨床的病変、薬物に対するウイルスの耐性の発達、およびヘルペスウイルスにおける分子模倣の存在によるものです。 したがって、ヘルペス感染症の治療を成功させるには、適切なものを選択する必要があります 抗ウイルス薬、その用量と治療期間は、異なる薬の組み合わせを使用します。 治療の効果を高めるためには、免疫状態の改善に寄与する免疫生物学的薬剤や、患者の状態を緩和する病因物質も含める必要があります。
現在、すべての抗ヘルペス薬は、抗ウイルス薬の3つの主要なグループに分けられています( ).
化学薬品(異常なヌクレオシド:valtrex、vectavir、famvir、cymeven)の作用機序は、ウイルスDNAポリメラーゼの競合阻害によるウイルスDNA合成およびウイルス複製の阻害に関連しています。
薬物中-免疫調節剤(アルピザリン、イムノファン、リコピッド、ポリオキシドニウム)を積極的に 有効成分細胞性および体液性免疫、酸化還元プロセス、サイトカイン合成に関連する免疫刺激特性を持っています。
IFN誘導薬(アミクシン、ネオビル、シクロフェロン)は、作用の病因と免疫調節効果を組み合わせています。 これらの薬剤は、Tリンパ球およびBリンパ球、腸細胞、肝細胞による内因性IFN(α、β、γ)の形成を誘導します。
抗ヘルペスウイルス療法の手段の中で特別な場所は、細胞性免疫を活性化するヘルペスワクチン、寛解期の免疫矯正によって占められています。 予防接種には2つの目標があります。一次感染の予防と潜伏状態の出現、および病気の経過の予防または緩和です。
しかし、抗ヘルペス薬の広範なリストが存在するにもかかわらず、ヘルペスは依然として不十分に制御された感染症です。 これは、病原体の遺伝子型の特徴、体内でのウイルスの長期持続、および抗ウイルス薬に耐性のある菌株の形成によるものです。 最大の臨床効果は、異なる作用機序を持つ薬物の合理的な複雑な治療によってのみ得ることができます。
V. A. Isakovが率いるウイルス学者と感染症専門家のサンクトペテルブルクグループは、ヘルペス感染の治療と予防のためのプログラムを提案しました(表4)。
複雑なGI療法の利点。
- 抗ヘルペス化学療法と免疫生物学的薬剤の併用は、相乗効果をもたらします。
- 抗ウイルスHPPの投与量を減らすことにより、発症の可能性 副作用、患者の体への毒性作用が減少します。
- この薬に対するヘルペスウイルスの耐性株が出現する可能性は低くなります。
- 免疫矯正効果が得られます。
- 病気の急性期の期間と治療の期間が短縮されます。
したがって、GI療法は複雑で多要素のタスクです。
文学に関する質問については、編集部にお問い合わせください。
T. K. Kuskova、 医学の候補者
E. G. Belova, 医学の候補者
MGMSU、モスクワ
1.ウイルス学。 ウイルス学の歴史。 侍従。 RU。 パスツール。 イワノフスキー。
2.ウイルスの繁殖。 + RNAウイルスの複製。 ピコルナウイルス。 ピコルナウイルスの繁殖。
3.トガウイルス。 トガウイルスの繁殖。 レトロウイルス。 レトロウイルスの繁殖。
4.-RNAウイルスの複製。 二本鎖RNAによるウイルスの複製。
5.DNAウイルスの複製。 DNAを含むウイルスの複製サイクル。 パポバウイルスの繁殖。 アデノウイルスの繁殖。
7.B型肝炎ウイルスの繁殖B型肝炎ウイルスの複製サイクル。
8.ウイルスの遺伝学。 ウイルス集団の特徴づけ。 ウイルス集団の遺伝子プール。
9.ウイルスの突然変異。 ウイルスの自然突然変異。 ウイルスの誘発された突然変異。 表現型におけるウイルス変異の発現。
10.ウイルス間の遺伝的相互作用。 ウイルスによる遺伝子の組換えと再分布。 ウイルスによるゲノム断片の交換。 抗原不連続変異。
生殖周期の主な違い ヘルペスウイルスから 他のDNAウイルスより複雑なゲノム構造に関連付けられています。 細胞へのウイルスの吸着は、特定の受容体を介して行われます。 受容体と相互作用した後、ウイルスエンベロープは細胞膜と融合し、ヌクレオカプシドが細胞質に放出されます。 ウイルスゲノムのストリッピング(除タンパク)は核膜で起こり、ウイルスDNAは宿主細胞の核にトラップされます。 繁殖には初期段階と後期段階が含まれますが、それらは明確に描写されていません。
ヘルペスウイルスの繁殖の初期段階..。 初期の段階では、「初期タンパク質」が合成され、DNA分子の近位3分の1によってコードされます。 それらは、DNAポリメラーゼおよびDNA結合タンパク質をコードするウイルスゲノムの他の領域の転写の活性化を含む調節特性を示します。
ヘルペスウイルスの繁殖の後期..。 後期では、ウイルスDNAポリメラーゼが母体DNAの複製を誘導します。 その結果、娘集団のDNA分子が形成されます。 娘DNAの一部は細胞のポリメラーゼによって読み取られ、構造タンパク質(コートタンパク質ととげの糖タンパク質)をコードする末端遺伝子の転写を引き起こします。
ヘルペスウイルスの娘集団の集合キャプシドタンパク質がDNA分子を取り囲み、ヌクレオカプシドを形成する核内で起こります。 ヘルペスウイルスの形態形成の最終段階は、核膜の内面でのスーパーキャプシドの形成です。 成熟した娘集団は、改変された核膜から出芽し、細胞質を通って輸送され、排泄される。
ポックスウイルス。 ポックスウイルスの繁殖。
ポックスウイルス最も複雑な生殖サイクルを持ち、ビリオンを構成する100以上の異なるタンパク質が合成されます(ほとんどが外殻を形成します)。 ポックスウイルスの繁殖は、以下の特徴があります。
DNA転写それはウイルスのポリメラーゼによって完全に実行されるため、ウイルスの完全な除タンパクの前に始まります。
レプリケーションポックスウイルスは、他のウイルスとは異なり、初期および初期段階でウイルスゲノムの半分以上を読み取る独自のDNA依存性RNAポリメラーゼを持っているため、細胞質でのみ発生し、細胞のポリメラーゼから完全に独立しています。
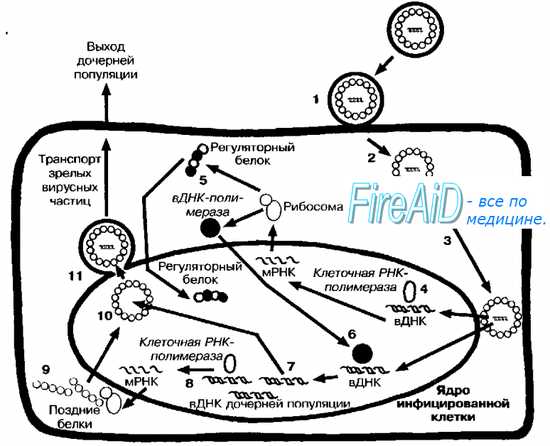 米。 5-4。 DNAウイルスの複製サイクル(ヘルペスウイルスの繁殖の例について)。 吸着後(1)、ウイルスは膜との融合により細胞に侵入します(2)。 ヌクレオカプシドは核膜に輸送され(3)、ウイルスDNA(vDNA)が細胞核に入り、そこで細胞DNA依存性RNAポリメラーゼによる転写が始まります(4)。 まず、「初期遺伝子」が転写されます。 ウイルスゲノムの「初期部分」の翻訳の結果として、調節、マトリックス、およびウイルスポリメラーゼを含む「初期タンパク質」が合成されます(5)。 ウイルスポリメラーゼは細胞ゲノムに入り(6)、そこで娘集団のDNA分子の合成を開始します(7)。 娘集団のウイルスDNA(「後期遺伝子」)の一部は、細胞RNAポリメラーゼ(8)によって転写され、娘集団の集合に必要な「後期タンパク質」(9)の合成につながります(10)。 後者は核を離れ、その膜から出芽し(11)、その断片はそれらの殻に含まれています。
米。 5-4。 DNAウイルスの複製サイクル(ヘルペスウイルスの繁殖の例について)。 吸着後(1)、ウイルスは膜との融合により細胞に侵入します(2)。 ヌクレオカプシドは核膜に輸送され(3)、ウイルスDNA(vDNA)が細胞核に入り、そこで細胞DNA依存性RNAポリメラーゼによる転写が始まります(4)。 まず、「初期遺伝子」が転写されます。 ウイルスゲノムの「初期部分」の翻訳の結果として、調節、マトリックス、およびウイルスポリメラーゼを含む「初期タンパク質」が合成されます(5)。 ウイルスポリメラーゼは細胞ゲノムに入り(6)、そこで娘集団のDNA分子の合成を開始します(7)。 娘集団のウイルスDNA(「後期遺伝子」)の一部は、細胞RNAポリメラーゼ(8)によって転写され、娘集団の集合に必要な「後期タンパク質」(9)の合成につながります(10)。 後者は核を離れ、その膜から出芽し(11)、その断片はそれらの殻に含まれています。
ポックスウイルスの繁殖の初期段階ウイルスが脱衣され、ウイルスDNAが細胞質に放出された直後に始まります。
ポックスウイルスの繁殖の初期段階..。 この段階で、ウイルスDNAの約半分が転写されます。 酵素は合成され、「初期遺伝子」によってコードされ、ウイルスDNAの複製に関与します。 並行して、構造タンパク質が少量形成されます。
ポックスウイルスの繁殖の後期 DNA複製の開始と一致します(これは、ゲノムの後半を読み取るために転写メカニズムを切り替えます)。 調節タンパク質は「初期mRNA」の翻訳をブロックし、後期(構造)タンパク質の合成を引き起こします。 ビリオンの集合は、膜合成反応を介して細胞質内でのみ実行されます。 成熟した集団の放出は、細胞溶解を伴う。