カドミウム:事実と事実。 その貴重な特性により、カドミウムの範囲は毎年拡大しています。カドミウムの質量
意味
カドミウム周期表の48番目の要素です。 指定-ラテン語の「カドミウム」からのCD。 第5期、IIBグループに位置します。 金属を指します。 コアチャージは48です。
その特性において、カドミウムは亜鉛に類似しており、通常、亜鉛鉱石の不純物として見られます。 自然界での有病率の点では、亜鉛よりも大幅に劣っています。地殻中のカドミウムの含有量はわずか約10 -5%(wt。)です。
カドミウムは銀白色(図1)で、柔らかく、可鍛性があり、可鍛性のある金属です。 一連の電圧では、亜鉛よりも遠くにありますが、水素よりも先にあり、最後の酸を置き換えます。 Cd(OH)2は弱い電解質であるため、カドミウム塩は加水分解され、その溶液は酸性になります。
米。 1.カドミウム。 外観。
カドミウムの原子量と分子量
物質の相対分子量(M r)は、与えられた分子の質量が炭素原子の質量の1/12より大きい回数を示す数値であり、 元素の相対原子質量(A r)-化学元素の平均原子量が炭素原子の質量の1/12より大きい回数。
カドミウムは単原子Cd分子の形で自由状態で存在するため、その原子質量と分子量の値は一致します。 それらは112.411に等しい。
カドミウムの同位体
カドミウムは8つの安定同位体の形で自然界に見られることが知られており、そのうちの2つは放射性(113 Cd、116 Cd)です:106 Cd、108 Cd、110 Cd、111 Cd、112 Cd、114Cd。 それらの質量数は、それぞれ106、108、110、111、112、113、114、および116です。 カドミウム同位体106Cdの原子核には、48個の陽子と58個の中性子が含まれており、残りの同位体は中性子の数だけが異なります。
カドミウムイオン
カドミウム原子の外部エネルギーレベルには、原子価である2つの電子があります。
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 105s2。
化学的相互作用の結果として、カドミウムはその価電子を放棄します。 はドナーであり、正に帯電したイオンに変わります。
Cd0-2e→Cd2+。
カドミウムの分子と原子
遊離状態では、カドミウムは単原子Cd分子の形で存在します。 カドミウムの原子と分子を特徴付けるいくつかの特性は次のとおりです。
カドミウムの合金
一部の合金にはカドミウムが成分として含まれています。 たとえば、約1%のカドミウム(カドミウムブロンズ)を含む銅合金は、銅よりも強度と耐摩耗性が高いため、電信、電話、トロリーバスのワイヤーの製造に使用されます。 自動消火器で使用されるものなど、多くの軽合金にはカドミウムが含まれています。
問題解決の例
例1
例2
| エクササイズ | 1×10-2Mカドミウム(II)と1 Mアンモニアを含む溶液では、どのような複合体が優勢ですか? |
| 解決 | カドミウムイオンとアンモニアを含む溶液では、次の平衡が確立されます。 Cd 2+ + NH3↔Cd(NH 3)2+; Cd(NH 3)2+ + NH3↔Cd(NH 3)2 2+; Cd(NH 3)3 2+ + NH3↔Cd(NH 3)42+。 ルックアップテーブルからb1=3.24×102、b 2 =2.95×104、b 3 =5.89×105、b 4=3.63×106。 c(NH 3)>> c(Cd)を考慮して、\ u003d c(NH 3)\u003d1Mと仮定します。 0を計算します: |
カドミウム
カドミウム-私; m。[緯度。 ギリシャのカドミウム。 kadmeia-亜鉛鉱石]
1. 化学元素(Cd)、亜鉛鉱石(原子力産業で使用される多くの可溶合金の一部)に含まれる銀白色の柔らかく可鍛性のある金属。
2. さまざまな色合いの人工黄色塗料。
◁ カドミウム、th、th。 K合金。 K番目の黄色(染料)。
カドミウム(緯度カドミウム)、周期系のグループIIの化学元素。 名前はギリシャのカドメイア、亜鉛鉱石に由来しています。 青みがかった色合いの銀色の金属で、柔らかくて溶けやすい。 密度8.65g/ cm 3、 t pl321.1ºC。 鉛-亜鉛および銅鉱石の処理中に採掘されます。 強力なバッテリー、原子力(原子炉の制御棒)のカドミウムめっきに使用され、顔料を取得します。 低融点およびその他の合金に含まれています。 硫化カドミウム、セレン化物、テルル化物は半導体材料です。 多くのカドミウム化合物は有毒です。
カドミウムCADMIUM(緯度カドミウム)、Cd(「カドミウム」と読みます)、原子番号48、原子量112.41の化学元素。
天然カドミウムは、106 Cd(1.22%)、108 Cd(0.88%)、110 Cd(12.39%)、111 Cd(12.75%)、112 Cd(24.07%)、113 Cd(12.26%)の8つの安定同位体で構成されています。 114 Cd(28.85%)および116 Cd(12.75%)。 これは、元素の周期系のグループIIBの5番目の期間にあります。 2つの外側の電子層の構成4 s 2
p 6
d 10
5s 2
。 酸化状態は+2(原子価II)です。
原子の半径は0.154nm、Cd2+イオンの半径は0.099nmです。 シーケンシャルイオン化エネルギー-8.99、16.90、37.48eV。 ポーリングによる電気陰性度 (cm。ポーリングライナス) 1,69.
発見履歴
ドイツの教授F.Stromeyerによって発見されました (cm。 STROMEYERフリードリヒ) 1817年。酸化亜鉛の研究におけるマクデブルクの薬剤師 (cm。 ZINC(化学元素)) ZnOにはヒ素が含まれている疑いがありました (cm。砒素)。 F. Stromeyerは、ZnOから茶色がかった茶色の酸化物を分離し、水素で還元しました。 (cm。水素)そしてカドミウムと呼ばれる銀白色の金属を受け取りました(ギリシャのカドメイアから-亜鉛鉱石)。
自然の中にいる
地球の地殻の含有量は1.3510-5質量%であり、海と海の水では0.00011 mg/lです。 いくつかの非常にまれな鉱物が知られています。たとえば、硫カドミウム鉱GdS、菱カドミウム鉱CdCO 3、モンテポナイトCdOなどです。 カドミウムは多金属鉱石に蓄積します:閃亜鉛鉱 (cm。閃亜鉛鉱)(0.01-5%)、方鉛鉱 (cm。ガリーナ)(0.02%)、黄銅鉱 (cm。黄銅鉱)(0.12%)、黄鉄鉱 (cm。パイライト)(0.02%)、ファロア (cm。 FAIL ORES)とベッド (cm。スタニン)(最大0.2%)。
レシート
カドミウムの主な供給源は、亜鉛生産の中間製品、鉛および銅製錬所からの粉塵です。 原料を濃硫酸で処理し、溶液中でCdSO4を得る。 Cdは、亜鉛末を使用して溶液から分離されます。
CdSO 4 + Zn = ZnSO 4 + Cd
得られた金属は、アルカリの層の下で再溶解して亜鉛と鉛の不純物を除去することによって精製されます。 高純度のカドミウムは、電解質の中間精製を伴う電気化学的精製またはゾーンメルト法によって得られます。 (cm。ゾーンメルト法).
物理的及び化学的性質
カドミウムは、六角形の格子を持つ銀白色の軟質金属です( a = 0,2979, と= 0.5618 nm)。 融点321.1°C、沸点766.5°C、密度8.65 kg /dm3。 カドミウムスティックが曲がっている場合、かすかな亀裂が聞こえます-これらは互いに擦れ合う金属微結晶です。 カドミウムの標準電極電位は、一連の標準電位で-0.403Vです。 (cm。標準容量)水素の前にあります (cm。水素).
乾燥した雰囲気ではカドミウムは安定していますが、湿気の多い雰囲気では徐々に酸化カドミウムの膜で覆われます。 融点を超えると、カドミウムは空気中で燃焼して茶色の酸化物CdOを形成します。
2Cd + O 2 \ u003d 2CdO
カドミウムの蒸気は水蒸気と反応して水素を形成します。
Cd + H 2 O \ u003d CdO + H 2
そのグループIIBの隣人であるZnと比較して、カドミウムは酸とよりゆっくりと反応します。
Сd+2HCl\ u003d CdCl 2 + H 2
反応は硝酸で最も簡単に進行します:
3Cd + 8HNO 3 \ u003d 3Cd(NO 3)2 + 2NO-+ 4H 2 O
カドミウムはアルカリと反応しません。
反応では、それは穏やかな還元剤として作用することができます、例えば、濃縮溶液では、それは硝酸アンモニウムをNH 4 NO2亜硝酸塩に還元することができます:
NH 4 NO 3 + Cd \ u003d NH 4 NO 2 + CdO
カドミウムは、Cu(II)またはFe(III)塩の溶液で酸化されます。
Cd + CuCl 2 \ u003d Cu + CdCl 2;
2FeCl 3 + Cd \ u003d 2FeCl 2 + CdCl 2
融点を超えると、カドミウムはハロゲンと反応します (cm。ハロゲン)ハロゲン化物の形成を伴う:
Cd + Cl 2 \ u003d CdCl 2
硫黄あり (cm。硫黄)および他のカルコゲンはカルコゲニドを形成します:
Cd + S = CdS
カドミウムは、水素、窒素、炭素、シリコン、ホウ素とは反応しません。 Cd 3N2窒化物とCdH2水素化物は間接的に得られます。
水溶液中で、カドミウムイオンCd2+はアクア錯体2+および2+を形成します。
水酸化カドミウムCd(OH)2は、カドミウム塩の溶液にアルカリを加えることによって得られます。
СdSO4+2NaOH\ u003d Na 2 SO 4 + Cd(OH)2Ї
水酸化カドミウムは実際にはアルカリに溶解しませんが、アルカリの非常に濃縮された溶液中での長時間の沸騰中に水酸化物錯体2–の形成が記録されました。 したがって、両性 (cm。両性)酸化カドミウムCdOと水酸化物Cd(OH)2の特性は、対応する亜鉛化合物の特性よりもはるかに弱いです。
錯化による水酸化カドミウムCd(OH)2は、アンモニアNH3の水溶液に容易に溶解します。
Cd(OH)2 + 6NH 3 \ u003d(OH)2
応用
製造されたカドミウムの40%は、金属の防食コーティングに使用されます。 カドミウムの20%は、バッテリー、通常のウェストン電池で使用されるカドミウム電極の製造に使用されます。 カドミウムの約20%は、無機着色剤、特殊はんだ、半導体材料、リン光物質の製造に使用されています。 10%カドミウム-宝飾品および可溶合金、プラスチックの成分。
生理学的作用
カドミウムとその化合物の蒸気は有毒であり、カドミウムは体内に蓄積する可能性があります。 飲料水中のカドミウムのMPCは10mg/m3です。 カドミウム塩による急性中毒の症状は、嘔吐とけいれんです。 血液に吸収された後のカドミウムの可溶性化合物は、中枢神経系、肝臓、腎臓に影響を与え、リン-カルシウム代謝を妨害します。 慢性中毒は貧血と骨破壊につながります。
百科事典辞書. 2009 .
同義語:他の辞書にある「カドミウム」をご覧ください。
-(緯度カドミウム)。 スズに似た色の可鍛性金属。 ロシア語に含まれる外国語の辞書。 Chudinov A.N.、1910年。カドミウム緯度。 カドミウム、kadmeia gea、カドミウムアースから。 スズに似た金属。 25,000人の外国人の説明...... ロシア語の外国語の辞書
カドミウム-カドミウム、カドミウム、化学。 要素、文字。 Cd、原子量112.41、原子番号48。ほとんどの亜鉛鉱石に少量含まれており、亜鉛採掘中に副産物として得られます。 入手することもできます...... ビッグメディカル百科事典
カドミウム-カドミウム(Cd)を参照してください。 それは多くの産業企業、特に電気めっきを使用する鉛亜鉛および金属加工プラントの支流に含まれています。 リン酸肥料に含まれています。 硫酸は水に溶けます、......。 魚の病気:ハンドブック
カドミウム-(Cd)銀色のホワイトメタル。 原子力工学および電気めっきで使用され、合金の一部であり、半導体の製造における印刷版、はんだ、溶接電極の準備に使用されます。 コンポーネントです。。。 ロシアの労働保護百科事典
-(カドミウム)、Cd、周期系のグループIIの化学元素、原子番号48、原子量112.41; 金属、mp321.1shC。 カドミウムは、金属に防食コーティングを施したり、電極を作ったり、顔料を入手したりするために使用されます... ... 現代百科事典
-(記号Cd)、周期表の2番目のグループからの銀色の白い金属。 1817年に最初に分離されました。硫カドミウム鉱(硫化物の形で)に含まれていますが、主に亜鉛と鉛の抽出からの副産物として得られます。 簡単に鍛造… 科学技術百科事典辞書
Cd(ギリシャのカドミウム亜鉛鉱石から*a。カドミウム;n。カドミウム;f。カドミウム;i。カドミウム)、chem。 要素IIグループ定期的。 メンデレーエフのシステム、at.s。 48、で。 m。112.41。 自然界には、8つの安定同位体106Cd(1.225%)108Cd(0.875%)、......があります。 地質百科事典
夫。 亜鉛鉱石に含まれる金属(化学原理または分解不可能な元素の1つ)。 カドミウム、カドミウムに関連します。 カドミウムを含むKアドミスティ。 ダールの説明辞書。 ANDで。 ダル。 18631866..。 ダールの説明辞書
カドミウム-(カドミウム)、Cd、周期系のグループIIの化学元素、原子番号48、原子量112.41; 金属、mp321.1°C。 カドミウムは、金属に防食コーティングを施したり、電極を作ったり、顔料を入手したりするために使用されます... ... 図解百科事典辞書
カドミウム-化学。 元素、記号Cd(緯度カドミウム)、で。 n。 48、で。 m。112.41; 銀白色の光沢のある軟質金属、密度8650 kg / m3、tmelt=320.9°C。 カドミウムは希少な微量元素であり、有毒であり、通常、亜鉛と一緒に鉱石に含まれています... ... グレートポリテクニック百科事典
-(緯度カドミウム)Cd、周期系のグループIIの化学元素、原子番号48、原子量112.41。 名前はギリシャのカドメイア亜鉛鉱石に由来しています。 青みがかった色合いの銀色の金属で、柔らかくて溶けやすい。 密度8.65g/ cm&sup3、…… 大きな百科事典辞書
1817年の秋に ドイツのマクデブルク地区にあるいくつかの薬局を調べたところ、酸化亜鉛に何らかの不純物が含まれていることがわかりました。 地区の医師R.Rolovは、その中にヒ素が含まれているのではないかと疑い、薬物の販売を禁止しました。 酸化亜鉛を製造した工場の所有者、 K.ヘルマンこの決定に同意せず、不運な製品の研究を始めました。 彼の実験の結果、彼は自分の工場で製造された酸化亜鉛に未知の金属の混合物が含まれていると結論付けました。 得られたデータは、1818年4月にK.ヘルマンによって「シレジアの酸化亜鉛とその中に見つかったおそらくまだ未知の金属について」という記事で公開されました。 同時に、ヘルマンの結論を確認し、新しい金属をカドミウムと呼ぶことを提案したF.Stromeyerによって好ましい結論が発表されました。
ハノーバー州の薬局の総監察官であったF.シュトロメイヤーは、別のジャーナルに新しい金属に関する詳細な記事を発表しました。 1818年4月26日付けの記事は、表紙に1817年付けの号で掲載されましたが、この状況と、Strohmeyer(Hermannの同意を得て)が発見された金属に名前を付けたという事実と相まって、日付と発見の作者の両方を決定する際のエラー。
物理的特性。
カドミウム- シルバーホワイトきらめく青 金属、保護酸化膜の形成により空気中で変色します。 融点-321°C、沸点-770°C。 純粋なカドミウムの棒は、曲げるとスズのように砕けますが、金属に不純物が含まれていると、この効果が失われます。 カドミウムはスズよりも硬いですが、チンクよりも柔らかいので、ナイフで切ることができます。 80°C以上に加熱すると、カドミウムはその弾力性を失い、粉末に粉砕することができます。
カドミウムは多くの金属と合金や化合物を形成し、水銀に非常によく溶けます。
カドミウムの一般的な化学的性質。
加熱すると酸化が激しくなり、金属の発火が可能になります。 粉末状のカドミウムは、空気中で真っ赤な炎で容易に発火し、酸化物を形成します。
粉末状のカドミウムを水と激しく混合すると、水素の発生が観察され、過酸化水素の存在を検出できます。
希塩酸と希硫酸は、加熱すると徐々にカドミウムと反応し、水素を放出します。 乾燥塩化水素は、440°Cの温度でカドミウムと相互作用します。 乾燥二酸化硫黄も金属と反応して、硫化カドミウムCdSとその一部の硫酸塩CdSO4を形成します。 硝酸は、通常の条件下でカドミウムと相互作用し、アンモニアを放出し、加熱すると窒素酸化物を放出します。
カドミウムは亜鉛とは異なり、 苛性アルカリに不溶、しかし水酸化アンモニウムにも可溶。 カドミウムが硝酸アンモニウム溶液と反応すると、硝酸塩が形成されます。
アルミニウム、亜鉛、鉄は、カドミウムをその化合物の溶液から置き換えます。 彼自身、溶液から銅やその他のより電気陽性の元素を沈殿させます。 カドミウムは、加熱するとリン、硫黄、セレン、テルル、ハロゲンと直接結合しますが、水素や窒素と直接相互作用して水素化物や窒化物を得ることができません。
カドミウムの最も重要な化合物。
酸化カドミウムCdO金属を空気または酸素中で燃焼させるか、硫化物を焙焼するか、特定の化合物を熱分解することで得られます。 これは、得られた温度に応じて異なる色の粉末です:緑がかった黄色(350-370°C)、濃い紺(800°C)、茶色、黒。
水酸化カドミウムCD(おー) 2 白いゼラチン状の沈殿物の形で、アルカリの作用下でその塩の溶液から放出されます。
硫化カドミウムCDS-カドミウムの最も重要な化合物の1つ。 得られる物理化学的条件に応じて、レモンイエローからレッドになります。
ハロゲナイトカドミウムは、元素の直接相互作用によって、およびカドミウム、その酸化物または炭酸塩を対応する酸に溶解することによって、非常に簡単に得られます。 形成する塩はすべて無色の結晶性物質です。
炭酸カドミウムCDC約3炭酸アルカリをカドミウム溶液に加えると、白い無定形の沈殿物がカドミウム溶液から沈殿します。
カドミウムの生の供給源。 カドミウムを入手する。
カドミウムは 散らばっている要素、すなわち それはほとんどそれ自身の鉱物を形成せず、そのような鉱物の堆積物は全く知られていません。 カドミウムは、他の金属の鉱石に100分の1パーセントと1000分の1パーセントの濃度で存在します。 1〜1.5%のカドミウムを含む一部の鉱石は、この金属が非常に豊富であると考えられています。
いくつかの関心のある唯一のカドミウム鉱物は、その天然硫化物、硫カドミウム鉱、または閃亜鉛鉱です。 亜鉛鉱石の鉱床を開発するとき、硫カドミウム鉱はフェライトと一緒に採掘され、亜鉛プラントに行き着きます。 処理中、カドミウムはプロセスのいくつかの中間生成物に濃縮され、そこから抽出されます。
したがって、カドミウムを生産するための実際の原材料は、亜鉛電解質プラント、鉛および銅製錬所のケーキです。
最初の作品は1829年にアッパーシレジアで組織されました。
現在、世界は年間1万トン以上のカドミウムを生産しています。
カドミウムの適用。
カドミウムの産業消費の大部分はカドミウムにあります 保護コーティング金属を腐食から保護します。 これらのコーティングは、ニッケル、亜鉛、またはスズのコーティングに比べて大きな利点があります。 変形中に部品から剥離しないでください。
カドミウムコーティングは、1)海水からの保護、2)湿度の高い密閉された空間で動作する部品、3)電気接点の保護など、他のすべてのコーティングよりも優れている場合があります。
カドミウムの適用の2番目の領域は 合金生産。 カドミウム合金は銀白色で延性があり、機械加工が容易です。 ニッケル、銅、銀を少量添加したカドミウム合金は、強力な船舶、航空機、自動車のエンジン用のベアリングの製造に使用されています。
カドミウムを1%しか添加していない銅線は2倍の強度がありますが、電気伝導率はわずかに低下します。
ジルコニウムを添加した銅・カドミウム合金はさらに強度が高く、高圧送電線に使用されています。
純粋なカドミウムは、その優れた特性(高い熱中性子捕獲断面積)により、制御ロッドおよび非常用ロッドの製造に使用されます。 原子炉遅い中性子について。
で ジュエリー事業金とカドミウムの合金が使用されています。 成分の比率を変えることにより、異なる色合いが得られます。
ニッケルカドミウム アキュムレータ、完全に放電しても完全に使用できなくなることはありません。
カドミウムアマルガムを使用 歯科で詰め物を作るため。
カドミウムの生物学的特性。
カドミウムコーティングは、食品と接触しなければならない場合には受け入れられません。 金属自体は無毒ですが、非常に 有毒可溶性カドミウム化合物。 さらに、それらが体に入る方法や状態(溶液、ほこり、煙、霧)は危険です。 毒性に関しては、カドミウムは水銀やヒ素に劣っていません。 カドミウム化合物は、神経系に抑うつ効果をもたらし、気道に影響を与え、内臓の変化を引き起こします。
高濃度のカドミウムは急性中毒を引き起こす可能性があります。2500mg/m3の化合物を含む部屋に1分間滞在すると、死亡につながります。 急性中毒では、病変の症状はすぐには発症しませんが、1〜2〜30〜40時間続く可能性のある特定の潜伏期間の後に発症します。
毒性にもかかわらず、カドミウムは生物の発達に不可欠な微量元素であることが証明されています。 その機能はまだ不明です。 植物に餌を与えることは、それらの発達に好影響を与えます。
意味
カドミウム周期表の二次(B)サブグループのIIグループの第5周期にあります。
要素に関連する d-家族。 金属。 指定-CD。 序数-48。相対原子質量-112.41a.m.u.
カドミウム原子の電子構造
カドミウム原子は正に帯電した原子核(+48)で構成され、その中には48個の陽子と64個の中性子があり、48個の電子が5つの軌道を移動します。
図1。 カドミウム原子の概略構造。
軌道上の電子の分布は次のとおりです。
48Cd)2)8)18)18)2;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 .
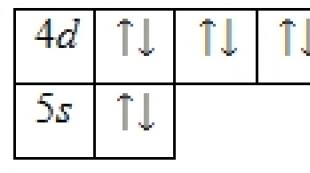
カドミウム原子の価電子は4にあるものです d-および5 s-軌道。 基底状態のエネルギー図は次の形式を取ります。

カドミウム原子の価電子は、次の4つの量子数のセットによって特徴付けることができます。 n(チーフクォンタム)、 l(軌道)、 ml(磁気)および s(スピン):
|
サブレベル |
||||
問題解決の例
例1
| エクササイズ | 原子軌道の数 p-シリアル番号35および54の要素のサブレベルが入力されていますか? 彼らの電子式を書き留めてください。 |
| 答え | シリアル番号35と54の元素は、臭素とキセノンです。 基底状態での電子式を書き留めます。 35 Br1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 ; 54 Xe1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 . pサブレベルには3つの軌道があり、各軌道には2つ以下の電子(合計6つ)を含めることができます。 臭素原子とキセノン原子のp軌道が満たされています。 |
例2
| エクササイズ | 量子数はどのような値を取ることができますか? n, l, mlと MS原子内の電子の状態を特徴づける。 それらはカルシウム原子の外部電子に対してどのような値を取りますか? | |||||||||||||||
| 答え | 主量子数nは1から無限大までの値を取ることができますが、実際にはその限界は数7です。軌道量子数lは0から3までの値を取ることができます。磁気量子数 ml-lから0から+lまでの値を取ります。 スピン量子数で MS+1/2と-1/2の2つの値しか存在できません。 マグネシウム原子の基底状態の電子配置を書き留めましょう(価電子を太字で強調表示します)。 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . 外部エネルギー準位の電子は、次の量子数のセットによって特徴付けられます。
|
カドミウム-珍しい毒性と未知
幅広い銀の危険金属
有毒で有毒な石や鉱物
カドミウム(ラテンカドミウム、記号Cdで示される)は、原子番号48、原子量112.411の元素です。 これは、第2グループの第2サブグループの要素であり、D.I。の化学元素の周期系の第5周期です。 メンデレーエフ。 通常の条件下では、単体のカドミウムは重い(密度8.65 g / cm3-ウランより軽い)柔らかい可鍛性の延性遷移金属です。 シルバーホワイト色(ウクライナのジトームィル地域の「ケルベルスキー石」のように、肉をむさぼり食うことはありません。酸化ウラン鉱石、茶色の危険な石ではありません)。 写真で- 硫化カドミウム, 硫カドミウム鉱(土の皮 黄色色)。
天然カドミウムは8つの同位体で構成され、そのうち6つは安定しています:106Cd(同位体存在比1.22%)、108Cd(0.88%)、110Cd(12.39%)、111Cd(12.75%)、112Cd(24、07%)、114Cd(28.85 %)。 他の2つの天然同位体で放射性が検出されました:113Cd(同位体存在量12.22%、半減期7.7∙1015年のβ崩壊)および116Cd(同位体存在量7.49%、半減期3.0∙の二重β崩壊) 1019年)。
周期系のカドミウムは、1817年にドイツのフリードリヒシュトロメイヤー教授によって部分的に説明されました(亜鉛と区別されます)。 マクデブルクの薬剤師は、酸化亜鉛ZnOを含む製剤を研究しているときに、それらの中にヒ素(硫化物からの酸化触媒)が存在するのではないかと疑っていました。 酸化亜鉛は、さまざまな皮膚病に使用される多くの軟膏、粉末、乳濁液に含まれているため、検査官は疑わしい薬の販売を断固として禁止しました。
当然のことながら、医薬品の製造業者は、彼の個人的な利益を擁護して、検査を要求しました。 Stromeyerは専門家として行動しました。 彼はZnOから茶色がかった茶色の酸化物を分離し、水素で還元して銀白色の金属を得ました。これを「カドミウム」と呼びました(ギリシャのカドミウムから-酸化亜鉛、亜鉛鉱石)。 Stromeyer教授に関係なく、カドミウムは1818年に科学者のグループ(K. Hermann、K。Carsten、W。Meisner)によってシレジアの亜鉛鉱石(衛星)で発見されました。
カドミウムは遅い中性子を吸収するため、原子炉では連鎖反応(ChNPP)の速度を制御するためにカドミウム棒が使用されます。 カドミウムはアルカリ電池に使用され、一部の合金の成分として含まれています。 したがって、たとえば、約1%のCd(カドミウムブロンズ)を含む銅合金は、銅よりも強度と耐摩耗性が高いため、電信、電話、トロリーバス、路面電車のワイヤー、地下鉄ケーブルの製造に使用されます。

方解石上の硫カドミウム鉱(黄色のドープ)。 雲南省、中国。 7x5 cm写真:A.A。 Evseev。
消火器で使用されるものなど、多くの可溶合金にはカドミウムが含まれています。 さらに、カドミウムは標準以下の宝飾品合金の一部です(温度によって破裂し、公開販売で禁止されているアマルガム合金からアマルガム成分を蒸発させた後のはんだ付け-有毒な水銀を含む金、銀、プラチナのアマルガム)。
この金属は、表面に酸化皮膜を持ち、保護効果があるため、鉄鋼製品のカドミウムめっきに使用されます。 事実、海水や他の多くの媒体では、カドミウムメッキは亜鉛メッキよりも効果的です。 カドミウムは、ホメオパシー(ハーブと微量投与による基本的な治療-いわゆる「食品中の栄養補助食品」-栄養補助食品と動物飼料)の薬で長い間使用されてきました。 カドミウム化合物も幅広い用途があります。硫化カドミウムは黄色の塗料や色付きガラスの製造に使用され、フルオロホウ酸カドミウムはアルミニウムやその他の金属のはんだ付けに使用されるフラックスです。
カドミウムは脊椎動物(骨、靭帯、腱、筋肉)の体内に見られ、炭素代謝、多くの酵素の活性、肝臓での馬尿酸の合成に影響を与えることが確立されています。 ただし、カドミウム化合物は有毒であり、金属自体が発がん性物質です。 特に危険なのは酸化カドミウムCdOの蒸気の吸入であり、致命的なケースは珍しいことではありません。 カドミウムの胃腸管への浸透も有害ですが、致命的な中毒の症例は記録されていません。これはおそらく、体が毒素を取り除こうとしている(嘔吐)ためです。
生物学的特性
カドミウムはほとんどすべての生物に存在することが判明しています-陸生のカドミウム含有量は、海洋生物(スポンジ、コエレンテレート、エキノダーム、太平洋のワーム)で、質量1kgあたり約0.5mgに等しい-0.15から3 mg / kg、植物中のカドミウムの含有量は約10-4%(乾物上)です。 ほとんどの生物にカドミウムが存在するにもかかわらず、その特定の生理学的重要性は完全には確立されていません(成長ホルモン)。 科学者たちは、この要素が炭水化物代謝、肝臓での馬尿酸の合成、多くの酵素の活性、そして体内の亜鉛、銅、鉄、カルシウムの代謝に影響を与えることを発見しました(スポーツで筋肉量を増やし、骨を強化するボディビルダー-微量投与)。

硫カドミウム鉱(黄色)。 カーリー火山、約。 択周島、千島列島、ロシア。 写真:A.A。 Evseev。
タルク、硫黄、その他のグリーンオクタイト様鉱物に対して発行できます
研究によって裏付けられた、食物中の微量のカドミウムが哺乳類の体の成長を刺激する可能性があるという示唆があります。 このため、科学者たちは長い間、カドミウムを条件付きで不可欠な微量元素、つまり重要であるとランク付けしてきましたが、 特定の用量で有毒。 健康な人の体には少量のカドミウムが含まれています。 古代ギリシャとローマの叙事詩で歌われた- カドメウス(場所 毒物取引ヨーロッパ南東部(「ツァレグラードの門の盾」、イスタンブール)、ギリシャ(柱廊玄関と円形劇場)、トルコ近郊の地中海(麻薬)。 に スラング鉱夫と石鉱夫 カドミウム「 ヘビ毒" (専門用語).
カドミウムは最も 有毒な重金属-ロシア(計量学)では、アンチモン、ストロンチウム、フェノール、その他の有毒物質( ADR危険物N6-毒、ひし形の髑髏と骨)。 1999年4月29日付けのロシア環境安全および毒物輸送技術連盟の会報「化学物質の安全性の問題」では、カドミウムは「千年紀の変わり目に最も危険な生態毒性物質」として登場しています!
他の重金属と同様に、カドミウムは累積毒です。つまり、体内に蓄積する可能性があります。半減期は10〜35年です。 50歳までに、人体は30〜50mgのカドミウムを蓄積することができます。 人体のカドミウムの主な「貯蔵庫」は、体内のこの金属の総量の30〜60%を含む腎臓と肝臓(20〜25%)です。 次のものは、より少ない程度でカドミウムを蓄積することができます:膵臓、脾臓、管状の骨、および他の器官と組織。 血液中にも少量のカドミウムが含まれています。 しかし、鉛や水銀とは異なり、カドミウムは脳に入りません。
ほとんどの場合、体内のカドミウムは結合状態にあります-タンパク質メタロチオネインと組み合わせて-これは一種の保護メカニズムであり、重金属の存在に対する体の反応です。 この形態では、カドミウムは毒性が低いですが、結合しても無害にはなりません-何年にもわたって蓄積すると、この金属は腎臓の破壊と腎臓結石の可能性の増加につながる可能性があります。 はるかに危険なのは、イオン形態のカドミウムです。カドミウムは化学的に亜鉛に非常に近く、生化学反応でそれを置き換えることができ、疑似活性剤または逆に亜鉛含有タンパク質および酵素の阻害剤として機能します。
カドミウムは、生体の細胞の細胞質および核物質に結合してそれらを損傷し、多くのホルモンおよび酵素の活性を変化させます。これは、スルフヒドリル(-SH)基に結合する能力によって説明されます。 さらに、カドミウムは、カルシウムとカドミウムのイオン半径が近接しているため、骨組織のカルシウムを置き換えることができます。 同じ状況は、カドミウムも置き換えることができる鉄の場合です。 このため、体内にカルシウム、亜鉛、鉄が不足していると、消化管からのカドミウムの吸収が最大15〜20%増加する可能性があります。 成人のカドミウムの無害な1日量は体重1kgあたり1μgであると考えられており、大量のカドミウムは健康に非常に危険です。
カドミウムとその化合物が体内に入るメカニズムは何ですか? カドミウムを含む廃棄物で汚染された飲料水(飲料水の最大濃度限界は0.01 mg / l)や、石油精製所や冶金企業の近くにある土地で育つ野菜や穀物を食べると、中毒が発生します。 いくつかの情報によると、彼らは自重1kgあたり100mg以上のカドミウムを蓄積することができるので、そのような地域からのキノコの使用は特に危険です。 金属はタバコの煙に含まれているため、喫煙は喫煙者自身と周囲の人々の両方の体内へのカドミウム摂取のもう1つの原因です。
慢性カドミウム中毒の特徴的な兆候は、前述のように、腎臓の損傷、筋肉の痛み、骨組織の破壊、貧血です。 カドミウムによる急性食中毒は、食物(15-30 mg)または水(13-15 mg)を大量に単回投与すると発生します。 同時に、急性胃腸炎の兆候が観察されます-嘔吐、痛み、上腹部のけいれん、しかし、食物とともに体内に入ったカドミウム化合物による致命的な中毒の症例は科学的に知られていませんが、WHOの推定によると、致死的な単回投与は350〜3500mgである可能性があります。
はるかに危険なのは、蒸気(CdO)またはカドミウム含有ダストの吸入によるカドミウム中毒です(原則として、これはカドミウムの使用に関連する業界で発生します)-液体水銀や赤い辰砂(毒性による)と同様です。 このような中毒の症状は、肺水腫、頭痛、吐き気または嘔吐、悪寒、脱力感、および下痢(下痢)です。 そのような中毒の結果として、死者が記録されました。
カドミウム中毒の解毒剤はセレンであり、カドミウムの吸収を減らすのに役立ちます(これらは、最新のデータセンターのコピー機やプリンター、およびオフィス機器の詰め替えカートリッジで機能します)。 しかし、セレンのバランスの取れた摂取が依然として必要です、これは体内の過剰が硫黄含有量の減少につながるという事実によるものです(硫化硫黄を形成します-それを結合します)、そしてこれは確かにカドミウムという事実につながります再び体に吸収されます。
興味深い事実
1本の紙巻きタバコには1〜2マイクログラムのカドミウムが含まれていることが確認されています。 1日1パック(20本)のタバコを吸う人は、約20マイクログラムのカドミウムを摂取することがわかりました! 危険は、肺からのカドミウムの吸収という事実にあります 最大-10から20%、したがって、喫煙者の体内では、2から4マイクログラムのカドミウムがタバコの各パックで吸収されます! タバコの煙に含まれるニコチンの発がん性効果は、原則としてカドミウムの存在と関連しており、カーボンフィルター(肺がん)によっても保持されません。
多数の致命的な結果を伴う慢性カドミウム中毒の例は、1950年代後半に説明されました。 日本の領土では、地元の人が「イタイイタイ病」と呼んでいる病気の症例があります。これは、地元の方言に「ああ、なんて痛いのか!」と訳されることもあります。 (中毒)。 この病気の症状は重度の腰痛でした。これは後で判明したように、不可逆的な腎臓の損傷によって引き起こされました。 重度の筋肉痛。 この病気の蔓延とその深刻な経過は、当時の日本の高い環境汚染と日本人の特定の食事(米とシーフードは大量のカドミウムを蓄積する)によって引き起こされました。 この病気で病気になった人は、毎日約600マイクログラムのカドミウムを消費していることがわかりました!
カドミウムは最も有毒な物質の1つとして認識されているという事実にもかかわらず、それは医学にも応用されています! したがって、心不全を患っている患者の胸部に挿入されたニッケルカドミウム電池は、心臓の機械的刺激装置にエネルギーを提供します。 このようなバッテリーの便利さは、患者が手術台に横になって充電または交換する必要がないことです。 バッテリーの寿命が途切れないようにするには、特別な磁化されたジャケットを週に1回、わずか1時間半着用するだけで十分です。
カドミウムはホメオパシー、実験医学で使用されており、最近では新しい抗がん剤の作成に使用されています。
ビスマス50%、スズ12.5%、鉛25%、カドミウム12.5%を含むウッドの金属合金は、沸騰したお湯で溶かすことができます。この合金は、1860年にエンジニアBによって発明されました。ウッドいくつかの興味深い事実がこれに関連しています。低融点合金:まず、ウッドの合金の成分の最初の文字が「WAX」という略語を形成し、次に、本発明は、B。ウッドの名前の由来である8年後に生まれたアメリカの物理学者ロバートウィリアムズウッド(仲間はVAKで戦った)。
少し前まで、周期表のカドミウムは警察や法医学の専門家の「兵器」に入りました。検査対象の表面に堆積したカドミウムの最薄層の助けを借りて、人間の指紋を識別することができます。
科学者たちは、そのような興味深い事実を確立しました。農村地域の大気中のカドミウムスズは、工業地域の大気中よりもはるかに高い耐食性を持っています。 このようなコーティングは、無水硫黄または無水硫酸の含有量が空気中で増加すると、特に急速に失敗します。
1968年、米国の保健当局の1人(キャロル博士)は、心血管疾患による死亡率と大気中のカドミウム含有量との直接的な関係を発見しました。 彼は28の都市のデータを分析することによってそのような結論に達しました。 それらのうちの4つ(ニューヨーク、シカゴ、フィラデルフィア、インディアナポリス)では、空気中のカドミウムの含有量は他の都市よりも高かった。 心臓病による死亡の割合も高かった。
大気、水、土壌へのカドミウムの排出を制限するための「標準的な」対策(企業のフィルターとクリーナー、そのような企業からの住宅と作物畑の撤去)に加えて、科学者は新しい有望なものも開発しています。 そのため、ミシシッピ川の湾の科学者たちは、彼らの助けを借りてカドミウムや水銀などの元素の水をきれいにすることが可能であると信じて、ホテイアオイを植えました。
話
歴史は、架空のチェック、レビュー、改訂中に行われた多くの「発見」を知っています。 しかし、そのような発見は、科学的というよりも本質的に犯罪的です。 それでも、始まった改訂がやがて新しい化学元素の発見につながったというケースがありました。 それは19世紀の初めにドイツで起こりました。 地区の医師R.Rolovは、監査中に、マクデブルク近郊の多くの薬局で、彼の地区の薬局をチェックしました。彼は酸化亜鉛を発見しました。 仮定を確認するために、ロロフは押収された薬物を酸に溶解し、硫化水素の溶液に通しました。これにより、硫化ヒ素と同様に黄色の沈殿物が沈殿しました。 軟膏、粉末、乳濁液、粉末などの疑わしい医薬品はすべて、直ちに販売を中止しました。
そのような動きは、ロロフによって拒絶されたすべての薬を生産したシェネベックの工場の所有者を激怒させました。 このビジネスマン-職業によって化学者であるハーマンは、商品の彼自身の検査を行いました。 当時知られているヒ素の検出実験のすべてを試した結果、彼の製品はこの点で純粋であると確信し、監査人を混乱させた鉄は酸化亜鉛の黄色を与えました。
彼の実験の結果をロロフとハノーバーの土地の当局に報告した後、ハーマンは彼の製品の独立した検査と完全な「リハビリテーション」を要求しました。 その結果、ゲッティンゲン大学の化学科を率い、同時にすべてのハノーバー薬局の監察官を務めたストロメイヤー教授の意見を知ることが決定されました。 当然のことながら、Stromeyerは、酸化亜鉛だけでなく、この酸化物が得られた炭酸亜鉛を含む、シェネベック工場からの他の亜鉛製剤も検証のために送られました。
フリードリヒ・シュトロメイヤーは、炭酸亜鉛ZnCO3を煆焼することにより、酸化物を取得しましたが、本来の白色ではなく、黄色がかっていました。 さらなる研究の結果、ロロフが示唆したように、薬にはヒ素もドイツ人が考えたように鉄も含まれていないことが判明しました。 異常な色の理由は完全に異なる金属でした-以前は知られておらず、亜鉛と特性が非常に似ていました。 唯一の違いは、その水酸化物はZn(OH)2とは異なり、両性ではなく、顕著な基本特性を持っていたことです。
Stromeyerは、新しい元素が亜鉛と強い類似性があることを示唆して、新しい金属カドミウムと名付けました。ギリシャ語のκαδμεια(カドメイア)は、長い間、亜鉛鉱石(たとえば、菱亜鉛鉱ZnCO3)と酸化亜鉛を示してきました。 同様に、この言葉はフェニキアのカドモスの名前に由来します。彼は伝説によれば、亜鉛石を最初に見つけ、銅(鉱石から製錬されたとき)に黄金色を与える能力を発見しました。 古代ギリシャ神話によると、別のカドモスがいました-ドラゴンを倒し、彼が倒した敵の土地にカドモスの要塞を建設した英雄であり、その周りに偉大な7門の都市テーベがその後成長しました。 セム語では、「カドモス」は「東部」または「蛇紋石」(フェルガナ、キルギスタン、中央アジア-ヘビが蓄積する場所があります)を意味し、おそらく、その抽出または輸出の場所から鉱物の名前を構築します東部の国または州から。
1818年、フリードリヒシュトロメイヤーは金属の詳細な説明を発表しましたが、その特性についてはすでによく研究されています。 その自由な形では、新しい要素は白い金属で、柔らかく、あまり強くなく、上部に茶色がかった酸化膜で覆われていました。 間もなく、よくあることですが、カドミウムの発見におけるStrohmeyerの優先順位に異議が唱えられ始めましたが、すべての主張は却下されました。 しばらくして、別の化学者であるカーステンがシレジアの亜鉛鉱石に新しい元素を発見し、それをメリンと名付けました(ラテン語のメリンから「マルメロのような黄色」)。 この名前の理由は、硫化水素の作用下で形成された沈殿物の色でした。
カーステンの悔しさに、「メリン」はストロメイヤーの「カドミウム」であることが判明した。 その後、48番目の元素に他の名前が提案されました。1821年、ジョンは新しい元素を「クラプロチウム」と呼ぶことを提案しました。有名な化学者マルティンクラプロスに敬意を表して、ウラン、ジルコニウム、チタンの発見者、ギルバートは「ジュノニウム」です。 -1804年のジュノで発見された小惑星の後。 しかし、クラプロスの科学へのメリットがどれほど大きいとしても、彼の名前は化学元素のリストに足場を築く運命にはありませんでした。カドミウムはカドミウムのままでした。 確かに、19世紀前半のロシアの化学文献では、カドミウムはしばしばカドミウムと呼ばれていました。
自然の中にいる
カドミウムは一般的に希少でかなり散乱した元素であり、地殻(クラーク)中のこの金属の平均含有量は約1.3 * 10–5%または1.6 * 10–5重量%と推定されます。リソスフェアは約130mg/tです。 私たちの惑星の腸にはカドミウムがほとんどないので、珍しいと考えられているゲルマニウムでさえ25倍です! カドミウムと他の希土類金属のほぼ同じ比率:ベリリウム、セシウム、スカンジウム、インジウム。 カドミウムはアンチモンに豊富に近く(2 * 10–5%)、水銀の2倍一般的です(8 * 10–6%)。
カドミウムは、亜鉛(カドミウムは多くの鉱物で、常に亜鉛鉱物で同形の不純物として見られます)および他の好色性元素、つまり、天然の硫化物、セレン化物、テルル化物、スルホ塩であり、天然状態で見られることもあります。 さらに、カドミウムは熱水鉱床に濃縮されています。 火山岩はカドミウムが非常に豊富で、1kgあたり最大0.2mgのカドミウムを含んでいます。 堆積岩の中で、粘土は48番目の元素が最も豊富で0.3 mg / kgまでです(比較のために、石灰岩にはカドミウム0.035 mg / kg、砂岩には0.03 mg / kgが含まれています)。 土壌中のカドミウムの平均含有量は0.06mg/kgです。
また、このレアメタルは水中に存在します-溶解した形(硫酸塩、塩化物、硝酸カドミウム)および有機鉱物錯体の一部として懸濁液中に存在します。 自然条件下では、カドミウムは非鉄金属鉱石の浸出の結果として、またそれを蓄積することができる水生植物や生物の分解の結果として地下水に入ります。 20世紀の初め以来、カドミウムによる天然水の人為的汚染は、カドミウムが水や土壌に侵入する主な要因になっています。 水中のカドミウムの含有量は、媒体のpH(アルカリ性媒体では、カドミウムは水酸化物の形で沈殿します)、および収着プロセスによって大きく影響されます。 同じ人為的理由で、カドミウムも空気中に存在します。
農村地域では、空気中のカドミウムの含有量は0.1〜5.0 ng / m3(1ngまたは1ナノグラム=10〜9グラム)、都市では2〜15 ng / m3、工業地域では15〜150ngです。 /m3。 カドミウムは、火力発電所で燃やされる多くの石炭にこの元素が含まれているため、主に大気中に放出されます。 カドミウムは空気から沈着し、水や土壌に入ります。 土壌中のカドミウムの含有量の増加は、ミネラル肥料の使用によって促進されます。なぜなら、それらのほとんどすべてがこの金属の少量の不純物を含んでいるからです。 カドミウムは水や土壌から植物や生物に入り、さらに食物連鎖に沿って人間に「供給」される可能性があります。
カドミウムには独自の鉱物があります:ハウライト、オタバイトCdCO3、モンテンポナイトCdO(87.5%Cdを含む)、硫カドミウムCdS(77.8%Cd)、キサントクロイトCdS(H2O)x(77.2%Cd)カドミウムCdSe(47%Cd)。 しかし、それらは独自の堆積物を形成しませんが、カドミウムの工業生産の主な供給源である亜鉛、銅、鉛、および多金属鉱石(50以上)に不純物として存在します。 さらに、主な役割は、カドミウムの濃度が0.01〜5%(閃亜鉛鉱型ZnS)の範囲である亜鉛鉱石によって果たされます。 ほとんどの場合、閃亜鉛鉱中のカドミウムの含有量は0.4〜0.6%を超えません。 カドミウムは方鉛鉱(0.005〜0.02%)、黄錫鉱(0.003〜0.2%)、黄鉄鉱(最大0.02%)、黄銅鉱(0.006〜0.12%)に蓄積し、これらの硫化物からカドミウムが抽出されます。
カドミウムは植物(とりわけ菌類)や生物(特に水中)に蓄積する可能性があるため、カドミウムは海洋堆積岩であるシェール(マンスフェルト、ドイツ)に見られます。
応用
カドミウムの主な消費者は、化学電流源の生産です。ニッケル-カドミウムおよび銀-カドミウム電池、バックアップ電池の鉛-カドミウムおよび水銀-カドミウム電池、通常のウェストン電池。 産業界で使用されているカドミウムニッケル電池(AKN)は、他の化学電流源の中で最も人気のあるものの1つです。
このような電池の負極板は、活性剤としてスポンジカドミウムを含む鉄メッシュでできており、正極板は酸化ニッケルでコーティングされています。 電解液は苛性カリ(水酸化カリウム)の溶液です。 ニッケルカドミウムアルカリ電池は、鉛蓄電池よりも信頼性があります。 カドミウムを使用した化学電流源は、長寿命、安定した動作、高い電気的特性が特徴です。 さらに、これらのバッテリーの再充電には1時間もかかりません。 ただし、AKNは完全な予備放電なしでは再充電できず、この点ではもちろん、金属水素化物電池より劣っています。
カドミウムの別の広い応用分野は、金属への保護防食コーティングの堆積です(カドミウムメッキ)。 カドミウムコーティングは、鉄鋼製品を大気腐食から確実に保護します。 以前は、カドミウムめっきは金属を溶融カドミウムに浸漬することによって行われていましたが、現在のプロセスは電気分解のみによって行われています。 カドミウムメッキは、航空機、船舶の最も重要な部品、および熱帯気候で動作するように設計された部品とメカニズムに適用されます。
亜鉛とカドミウムのいくつかの特性は類似していることが知られていますが、カドミウムコーティングには亜鉛メッキコーティングに比べて特定の利点があります。1つは耐食性が高く、2つ目は均一で滑らかにするのが簡単です。 さらに、亜鉛とは異なり、カドミウムはアルカリ性環境で安定しています。 カドミウムスズは非常に広く使用されていますが、カドミウムコーティングの使用が厳しく禁止されている分野があります。これは食品産業です。 これはカドミウムの毒性が高いためです。
ある時点まで、カドミウムコーティングの広がりも別の理由で制限されていました-カドミウムが鋼部品に電解的に適用されると、電解質に含まれる水素が金属に浸透する可能性があり、知られているように、この元素は水素脆化を引き起こします高強度鋼。負荷がかかると金属が予期せず破壊されます。 この問題は、ソ連科学アカデミーの物理化学研究所のソビエト科学者によって解決されました。 チタンの添加はごくわずかであることが判明しました(カドミウム1000原子あたり1原子のチタン)。チタンはコーティングプロセス中に鋼からすべての水素を吸収するため、カドミウムメッキ鋼部品は水素脆化の発生から保護されます。
世界のカドミウム生産の約10分の1が合金の生産に費やされています。 低融点は、低融点合金にカドミウムが広く使用されている理由の1つです。 そのようなものは、例えば、12.5%のカドミウムを含むウッドの合金です。 このような合金は、はんだとして、薄くて複雑な鋳造物を得るための材料として、自動消火システムで、ガラスを金属ではんだ付けするために使用されます。 カドミウムを含むはんだは、温度変動に対して非常に耐性があります。
カドミウム合金のもう1つの際立った特徴は、その高い減摩特性です。 したがって、99%のカドミウムと1%のニッケルを含む合金は、自動車、航空機、および船舶用エンジンで動作するベアリングの製造に使用されます。 カドミウムは、潤滑剤に含まれる有機酸を含む酸に対して十分な耐性がないため、カドミウムベースの軸受合金はインジウムでコーティングされています。 カドミウムを少量(1%未満)添加して銅を合金化すると、電気輸送ラインでより耐摩耗性の高いワイヤを作成できます。 このようなカドミウムのごくわずかな添加は、実際にはその電気的特性を悪化させることなく、銅の強度と硬度を大幅に向上させることができます。 カドミウムアマルガム(水銀中のカドミウムの溶液)は、歯科用充填物の製造のための歯科技術で使用されます。
20世紀の40年代に、カドミウムは新しい役割を獲得しました-彼らはそれから原子炉の制御と非常用ロッドを作り始めました。 カドミウムがすぐに戦略的材料になった理由は、カドミウムが熱中性子を非常によく吸収するためです。 しかし、「核時代」の初めの最初の原子炉は、熱中性子のみに取り組んでいました。 その後、高速中性子炉はエネルギーと核燃料の取得の両方でより有望であることが判明しました-239Pu、そしてカドミウムは高速中性子に対して無力であり、それらを遅らせることはありません。 熱中性子炉の時代には、カドミウムはその支配的な役割を失い、ホウ素とその化合物(実際には石炭とグラファイト)に取って代わった。
カドミウム(化合物の形で)の約20%が無機着色剤の製造に使用されます。 硫化カドミウムCdSは、以前はカドミウムイエローと呼ばれていた重要な鉱物染料です。 すでに20世紀初頭には、カドミウムイエローはレモンイエローからオレンジまでの6つの色合いで入手できることが知られていました。 得られた塗料は、弱アルカリや弱酸に耐性があり、硫化水素に完全に反応しません。
CdSをベースにした塗料は、塗装、印刷、磁器塗装など多くの分野で使用され、乗用車を覆い、機関車の煙から保護していました。 硫化カドミウムを含む染料は、繊維および石鹸産業で使用されていました。 しかし、現在、かなり高価な硫化カドミウムは、より安価な染料、つまりカドモポン(硫化カドミウムと硫酸バリウムの混合物)および亜鉛-カドミウムリトポン(カドモポンと硫化亜鉛のような組成)に置き換えられることがよくあります。
別のカドミウム化合物であるセレン化カドミウムCdSeが赤色染料として使用されます。 しかし、カドミウム化合物は染料の製造だけでなく、たとえば硫化カドミウムもフィルム太陽電池の製造に使用されており、その効率は約10〜16%です。 さらに、CdSはかなり優れた熱電材料であり、半導体材料やリン光物質の成分として使用されます。 カドミウムは極低温技術で使用されることがあります。これは、絶対零度(真空)に近い最大熱伝導率(他の金属と比較して)に関連しています。
製造
カドミウムの主な「供給者」は、亜鉛、銅-亜鉛、鉛-亜鉛鉱石の処理の副産物です。 カドミウムの天然鉱物に関しては、カドミウムを得るために関心のある唯一のものは、いわゆる「閃亜鉛鉱」である硫カドミウム鉱CdSです。 硫カドミウム鉱は、亜鉛鉱石の開発中にフェライトと一緒に採掘されます。 リサイクルプロセス中に、カドミウムはプロセスの副産物に蓄積し、そこから回収されます。
先に述べたように、多金属鉱石の処理では、カドミウムは亜鉛生産の副産物であることがよくあります。 これらは、2〜12%のCdを含む銅-カドミウムケーキ(硫酸亜鉛ZnSO4の溶液を亜鉛粉の作用によって洗浄した結果として得られる金属沈殿物)、またはプシエール(亜鉛の蒸留中に形成される揮発性画分)のいずれかです。 、0.7〜1.1%のカドミウムを含みます。
48番目の元素の中で最も豊富なのは、亜鉛の精留精製中に得られる濃縮物であり、最大40%のカドミウムを含むことができます。 カドミウムを多く含む銅カドミウムケーキやその他の製品からは、通常、硫酸H2SO4と同時空気曝気で浸出されます。 このプロセスは、酸化剤(マンガン鉱石または電解浴からのリサイクルマンガンスラッジ)の存在下で実行されます。
さらに、カドミウムは鉛および銅製錬所からの粉塵から回収されます(それぞれ0.5〜5%および0.2〜0.5%のカドミウムを含むことができます)。 このような場合、通常、粉塵は濃H2SO4硫酸で処理され、その後、得られた硫酸カドミウムが水で浸出されます。 得られた硫酸カドミウム溶液から亜鉛粉の作用によりカドミウムスポンジが沈殿し、その後硫酸に溶解し、炭酸ナトリウムNa2CO3または酸化亜鉛ZnOの作用により溶液を不純物から精製し、使用することも可能です。イオン交換法。
カドミウム金属は、アルミニウムカソードでの電気分解、または遠心分離反応器を使用した亜鉛による還元(亜鉛によるCdSO4溶液からの酸化カドミウムCdOの置換)によって分離されます。 カドミウム金属の精製は通常、アルカリ層の下で金属を溶かすことで構成されます(亜鉛と鉛を除去するため)が、Na2CO3を使用することもできます。 溶融物をアルミニウム(ニッケルを除去するため)および塩化アンモニウムNH4Cl(タリウムを除去するため)で処理します。
より高純度のカドミウムは、電解質の中間精製を伴う電解精製によって得られます。これは、イオン交換または抽出を使用して実行されます。 金属の精留(通常は減圧下)、ゾーンメルト法またはその他の結晶化法。 上記の精製方法を組み合わせると、主な不純物(亜鉛、銅など)の含有量がわずか10〜5重量%の金属カドミウムを得ることができます。 さらに、液体カドミウムでの電解採取、水酸化ナトリウムNaOHの溶融物での電解精製、およびアマルガム電解の方法を使用して、カドミウムを精製することができます。 ゾーンメルト法をエレクトロトランスファーと組み合わせると、精製とともにカドミウム同位体の分離が発生する可能性があります。
世界のカドミウム生産量は亜鉛生産量に大きく関係しており、過去数十年で大幅に増加しています。2006年のデータによると、世界で約21,000トンのカドミウムが生産されましたが、1980年にはこの数字はわずか15,000トンでした。 。 カドミウム消費量の増加は今も続いています。 この金属の主な生産国はアジア諸国です:中国、日本、韓国、カザフスタン。 それらは総生産量の12000トンを占めています。
ロシア、カナダ、メキシコもカドミウムの主要な生産国と見なすことができます。 カドミウムの大量生産がアジアにシフトしたのは、ヨーロッパではカドミウムの使用が減少し、逆にアジア地域ではニッケル・カドミウム元素の需要が高まっているためです。多くはアジア諸国に生産を移すために。
物理的特性
カドミウムは銀白色の金属で、切りたてのときに青く光りますが、保護酸化膜の形成により空気中で変色します。 カドミウムはやや柔らかい金属です。スズよりも硬いですが、亜鉛よりも柔らかいので、ナイフで切ることはかなり可能です。 カドミウムは、柔らかさと相まって、延性や延性などの産業にとって重要な品質を備えています。完全にシート状に圧延され、ワイヤーに引き込まれ、問題なく研磨できます。
80°C以上に加熱すると、カドミウムは弾力性を失い、非常に多く、簡単に粉砕して粉末にすることができます。 ブリネル(焼きなましされたサンプルの場合)200〜275 MPaによると、モースによるカドミウムの硬度は2に等しくなります。 引張強度64MN/m2または6.4kgf/ mm2、相対伸び50%(20 o C)、降伏強度9.8MPa。
カドミウムは、周期がa = 0.296 nm、c = 0.563 nm、c /a比=1.882、z = 2、結晶格子エネルギー116μJ/kmolの六角形の最密結晶格子を持っています。 空間群С6/mmm、原子半径0.156 nm、イオン半径Cd2 + 0.099 nm、原子体積13.01∙10-6m3/mol。
純粋なカドミウムで作られたロッドは、曲げるとスズのような弱い亀裂を放出します(「スズの悲鳴」)。これは金属の微結晶が互いに擦れ合っていますが、金属に不純物が含まれているとこの効果が失われます。 一般に、カドミウムは、その物理的、化学的、薬理学的特性の観点から、亜鉛や水銀と最も類似している重金属のグループに属しています。
カドミウム(321.1 o C)の融点は非常に低く、鉛(327.4 o C)またはタリウム(303.6 o C)の融点と比較できます。 ただし、多くの特性が類似している金属の融点とは異なります。亜鉛の融点(419.5 o C)よりも低く、スズの融点(231.9 o C)よりも高くなっています。 カドミウムの沸点も低く、非常に興味深いのは770°Cだけです。鉛は、他のほとんどの金属と同様に、融点と沸点の間に大きな違いがあります。
したがって、鉛の沸点(1745 o C)は融点の5倍であり、スズの沸点は2620 o Cであり、融点の11倍です。 同時に、亜鉛はカドミウムと同様に、419.5°Cの融点でわずか960°Cの沸点を持っています。カドミウムの熱膨張係数は29.8 * 10-6(25°Cの温度で)です。 。 0.519 K未満では、カドミウムは超伝導体になります。 0oCでのカドミウムの熱伝導率は97.55W/(m * K)または0.233 cal /(cm * sec * o C)です。
カドミウムの比熱容量(25 o Cの温度で)は225.02 j /(kg * K)または0.055 cal /(g * o C)です。 0°Cから100°Cの温度範囲でのカドミウムの電気抵抗の温度係数は4.3*10-3であり、カドミウムの比電気抵抗(20°Cの温度で)は7.4*10-8オーム*です。 m(7.4 *10-6オーム*cm)。 カドミウムは反磁性であり、その磁化率は-0.176.10-9(20°Cの温度で)です。 標準電極電位は-0.403Vです。カドミウムの電気陰性度は1.7です。 熱中性子の捕獲の有効断面積は2450-2900-10〜28m2です。 電子の仕事関数=4.1eV。
カドミウムの密度(室温)は8.65 g / cm3であり、カドミウムを重金属として分類することができます。 N. Reimersの分類によると、密度が8 g/cm3を超える金属は重いと見なす必要があります。 したがって、重金属には、Pb、Cu、Zn、Ni、Cd、Co、Sb、Sn、Bi、Hgが含まれます。 また、カドミウムは鉛(密度11.34 g / cm3)や水銀(13.546 g / cm3)よりも軽いですが、スズ(7.31 g / cm3)よりも重いです。
化学的特性
化学化合物では、カドミウムは常に原子価2を示します(外側の電子層の構成は5s2です)-実際には、2番目のグループの2番目のサブグループの元素(亜鉛、カドミウム、水銀)の原子は、銅サブグループの要素は、2番目の外側の電子層のdサブレベルが完全に満たされています。 ただし、亜鉛サブグループの元素の場合、このサブレベルはすでに非常に安定しており、そこから電子を除去するには非常に大きなエネルギーを消費する必要があります。 亜鉛サブグループの元素の別の特徴は、それらを銅サブグループの元素に近づけることであり、それらは複雑に形成される傾向があります。
すでに述べたように、カドミウムは亜鉛と水銀と同じ周期系のグループにあり、それらの間の中間の位置を占めています。このため、これらすべての元素の多くの化学的性質は類似しています。 たとえば、これらの金属の酸化物や硫化物は実際には水に溶けません。
乾燥した空気ではカドミウムは安定していますが、湿気のある空気では、CdO酸化物の薄膜が金属表面にゆっくりと形成され、金属をさらなる酸化から保護します。 強い白熱により、カドミウムは燃え尽き、酸化カドミウムにも変わります-薄茶色から暗褐色への結晶性粉末(色の範囲の違いは部分的に粒子サイズによるものですが、大部分は結晶格子欠陥の結果です) )、CdO密度8.15 g / cm3; 900°Cを超えると酸化カドミウムは揮発性であり、1570°Cを超えると完全に昇華します。 カドミウムの蒸気は水蒸気と反応して水素を放出します。
酸はカドミウムと反応してこの金属の塩を形成します。 硝酸HNO3はカドミウムを容易に溶解し、一酸化窒素が放出されて硝酸塩が形成され、水和物Cd(NO3)2*4H2Oが生成されます。 他の酸(塩酸と希硫酸)から、カドミウムはゆっくりと水素を置換します。これは、一連の電圧でカドミウムが亜鉛よりも遠いが、水素よりも進んでいるという事実によって説明されます。 亜鉛とは異なり、カドミウムはアルカリ溶液と相互作用しません。 カドミウムは、濃縮溶液中の硝酸アンモニウムNH4NO3を亜硝酸アンモニウムNH4NO2に還元します。
融点を超えると、カドミウムはハロゲンと直接結合し、無色の化合物(ハロゲン化カドミウム)を形成します。 CdCl2、CdBr2、CdI2は水に非常に溶けやすく(20°Cで53.2質量%)、エタノールに完全に溶けないフッ化カドミウムCdF2(20°Cで4.06質量%)を溶かすのははるかに困難です。 金属にフッ素を、炭酸カドミウムにフッ化水素を作用させることで得られます。 塩化カドミウムは、カドミウムを濃塩酸または金属塩素化と500°Cで反応させることによって得られます。
臭化カドミウムは、金属臭素化または臭化水素の炭酸カドミウムへの作用によって得られます。 加熱すると、カドミウムは硫黄と反応してCdS硫化物(レモンイエローからオレンジレッド)を形成し、水と希酸に不溶性になります。 カドミウムがリンおよびヒ素と融合すると、組成Cd3P2およびCdAs2のリン化物およびヒ化物がそれぞれアンチモン-カドミウムアンチモンと形成されます。 カドミウムは、水素、窒素、炭素、シリコン、ホウ素とは反応しません。 加熱すると容易に分解するCdH2水素化物とCd3N2窒化物が間接的に得られた。
カドミウム塩の溶液は加水分解により酸性であり、苛性アルカリはそれらから白色水酸化物Cd(OH)2を沈殿させます。 非常に濃縮されたアルカリ溶液の作用下で、Na2などのヒドロキソカドメートに変換されます。 水酸化カドミウムはアンモニアと反応して可溶性錯体を形成します。
Cd(OH)2 + 6NH3 * H2O→(OH)2 + 6H2O
さらに、Cd(OH)2はシアン化アルカリの作用下で溶液になります。 170o以上でCdOに分解します。 水溶液中の水酸化カドミウムと過酸化水素(過酸化物)との相互作用により、さまざまな組成の過酸化物(過酸化物)が形成されます。
ウェブサイトhttp://i-think.ru/の資料を使用する
ADR 6.1
有毒物質(毒物)
吸入、皮膚接触、または飲み込んだ場合の中毒の危険性。 水生環境または下水道システムに危険(水銀輸送用のADR危険物に類似、危険性が低い)
非常口マスクを使用する
ホワイトダイヤモンド、ADR番号、黒い髑髏と骨
ADRフィッシュ
環境に有害な物質(溶融、可溶性、粉末状、流動性の物質を含む生態学)
水生環境または下水道システムに危険(水銀輸送用のADR危険物に類似、危険性が低い)