Kadmiy: faktlar va faktlar. O'zining qimmatli xususiyatlari tufayli kadmiyning ko'lami yil sayin kengayib bormoqda.Kadmiyning massasi.
TA'RIF
kadmiy davriy sistemaning qirq sakkizinchi elementi. Belgilanishi - lotincha "kadmiy" dan CD. Beshinchi davrda joylashgan, IIB guruhi. Metalllarga ishora qiladi. Asosiy zaryad - 48.
O'z xususiyatlariga ko'ra kadmiy ruxga o'xshaydi va odatda rux rudalarida nopoklik sifatida topiladi. Tabiatda tarqalishi nuqtai nazaridan u sinkdan sezilarli darajada past: er qobig'idagi kadmiy miqdori atigi 10 -5% ni tashkil qiladi (og'ir.).
Kadmiy kumushsimon oq rangga ega (1-rasm), yumshoq, egiluvchan, cho'ziluvchan metalldir. Bir qator kuchlanishlarda u sinkdan uzoqroq, ammo vodoroddan oldinda va oxirgi kislotalarni siqib chiqaradi. Cd (OH) 2 kuchsiz elektrolit bo'lgani uchun kadmiy tuzlari gidrolizlanadi va ularning eritmalari kislotali bo'ladi.
Guruch. 1. Kadmiy. Tashqi ko'rinish.
Kadmiyning atom va molekulyar og'irligi
Moddaning nisbiy molekulyar og'irligi(M r) - berilgan molekulaning massasi uglerod atomi massasining 1/12 qismidan necha marta katta ekanligini ko'rsatadigan raqam va elementning nisbiy atom massasi(A r) - kimyoviy element atomlarining o'rtacha massasi uglerod atomi massasining 1/12 qismidan necha marta katta.
Kadmiy erkin holatda monotomik Cd molekulalari shaklida mavjud bo'lganligi sababli, uning atom va molekulyar massalarining qiymatlari bir-biriga mos keladi. Ular 112,411 ga teng.
Kadmiyning izotoplari
Ma'lumki, kadmiy tabiatda sakkizta barqaror izotop shaklida bo'lishi mumkin, ulardan ikkitasi radioaktiv (113 Cd, 116 Cd): 106 Cd, 108 Cd, 110 Cd, 111 Cd, 112 Cd va 114 Cd. Ularning massa raqamlari mos ravishda 106, 108, 110, 111, 112, 113, 114 va 116 ga teng. 106 Cd kadmiy izotopi atomining yadrosi qirq sakkizta proton va ellik sakkizta neytronni o'z ichiga oladi, qolgan izotoplar undan faqat neytronlar soni bilan farq qiladi.
Kadmiy ionlari
Kadmiy atomining tashqi energiya darajasida ikkita valentlik elektron mavjud:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2.
Kimyoviy o'zaro ta'sir natijasida kadmiy o'zining valentlik elektronlarini beradi, ya'ni. ularning donoridir va musbat zaryadlangan ionga aylanadi:
Cd 0 -2e → Cd 2+.
Kadmiyning molekulasi va atomi
Erkin holatda kadmiy monotomik Cd molekulalari shaklida mavjud. Kadmiyning atomi va molekulasini tavsiflovchi ba'zi xususiyatlar:
Kadmiy qotishmalari
Kadmiy ba'zi qotishmalarning tarkibiy qismi sifatida mavjud. Masalan, tarkibida taxminan 1% kadmiy (kadmiy bronza) bo'lgan mis qotishmalari telegraf, telefon, trolleybus simlarini ishlab chiqarish uchun ishlatiladi, chunki bu qotishmalar misga qaraganda ko'proq kuchga ega va aşınmaya bardoshli. Avtomatik yong'inga qarshi vositalarda ishlatiladigan bir qator engil qotishmalarda kadmiy mavjud.
Muammoni hal qilishga misollar
MISOL 1
2-MISA
| Mashq qilish | 1×10 -2 M kadmiy (II) va 1 M ammiak bo'lgan eritmada qanday kompleks ustunlik qiladi? |
| Yechim | Kadmiy ionlari va ammiak bo'lgan eritmada quyidagi muvozanat o'rnatiladi: Cd 2+ + NH 3 ↔Cd (NH 3) 2+; Cd (NH 3) 2+ + NH 3 ↔ Cd (NH 3) 2 2+; Cd (NH 3) 3 2+ + NH 3 ↔ Cd (NH 3) 4 2+. Qidiruv jadvallaridan b 1 = 3,24×10 2 , b 2 = 2,95×10 4 , b 3 = 5,89×10 5 , b 4 = 3,63×10 6 . c(NH 3) >> c(Cd) ekanligini hisobga olsak, \u003d c (NH 3) \u003d 1M deb faraz qilamiz. Biz 0 ni hisoblaymiz: |
kadmiy
KADMIY-men; m.[lat. yunoncha kadmiy. kadmeia - rux rudasi]
1. Kimyoviy element (Cd), kumush-oq yumshoq, egiluvchan metall rux rudalarida uchraydi (yadro sanoatida qoʻllaniladigan koʻplab eruvchan qotishmalarning bir qismi).
2. Turli xil soyalarda sun'iy sariq bo'yoq.
◁ Kadmiy, th, th. K qotishmalari. K-sariq(bo'yoq).
kadmiy(lat. Kadmiy), davriy tizimning II guruhining kimyoviy elementi. Bu nom yunoncha kadméia, sink rudasidan olingan. Ko'k rangli, yumshoq va eriydigan kumush rangli metall; zichligi 8,65 g / sm 3, t pl 321,1ºC. Qoʻrgʻoshin-rux va mis rudalarini qayta ishlash jarayonida qazib olinadi. Kadmiy qoplamasi uchun, kuchli batareyalarda, yadro energiyasida (reaktorlarning boshqaruv novdalari), pigmentlarni olish uchun ishlatiladi. Past eriydigan va boshqa qotishmalarga kiritilgan. Kadmiy sulfidlari, selenidlar va telluridlar yarim o'tkazgichlardir. Ko'pgina kadmiy birikmalari zaharli hisoblanadi.
KADMIYCADMIUM (lat. Cadmium), Cd ("kadmiy" deb o'qing), atom raqami 48, atom massasi 112,41 bo'lgan kimyoviy element.
Tabiiy kadmiy sakkizta barqaror izotopdan iborat: 106 Cd (1,22%), 108 Cd (0,88%), 110 Cd (12,39%), 111 Cd (12,75%), 112 Cd (24,07%), 113 Cd (12,2), 114 Cd (28,85%) va 116 Cd (12,75%). U elementlar davriy sistemasining IIB guruhida 5-davrda joylashgan. Ikki tashqi elektron qatlamining konfiguratsiyasi 4 s 2
p 6
d 10
5s 2
. Oksidlanish darajasi +2 (valentlik II).
Atomning radiusi 0,154 nm, Cd 2+ ionining radiusi 0,099 nm. Ketma-ket ionlanish energiyalari - 8,99, 16,90, 37,48 eV. Paulingga ko'ra elektronegativlik (sm. PAULING Linus) 1,69.
Kashfiyot tarixi
Nemis professori F.Stromeyer tomonidan kashf etilgan (sm. STROMEYER Fridrix) 1817 yilda Magdeburg farmatsevtlari rux oksidini o'rganishda (sm. rux (kimyoviy element) ZnO tarkibida mishyak borligiga shubha qilingan (sm. ARSENIK). F.Stromeyer ZnO dan jigarrang-jigarrang oksidni ajratib oldi, uni vodorod bilan qaytardi. (sm. vodorod) va kadmiy (yunoncha kadmeia - rux rudasidan) deb nomlangan kumush-oq metallni oldi.
Tabiatda bo'lish
Yer qobig'idagi tarkibi massa bo'yicha 1,35 10 -5%, dengiz va okeanlar suvida 0,00011 mg / l. Bir nechta juda kam uchraydigan minerallar ma'lum, masalan, greenockite GdS, otavit CdCO 3, monteponit CdO. Kadmiy polimetall rudalarda to'planadi: sfalerit (sm. sfalerit)(0,01-5%), galen (sm. GALENA)(0,02%), xalkopirit (sm. xalkopirit)(0,12%), pirit (sm. PIRIT)(0,02%), faxlor (sm. MUVOFIQ rudalar) va to'shak (sm. STANNIN)(0,2% gacha).
Kvitansiya
Kadmiyning asosiy manbalari rux ishlab chiqarishning oraliq mahsulotlari, qo'rg'oshin va mis eritish zavodlarining changlaridir. Xom ashyo konsentrlangan sulfat kislota bilan ishlanadi va eritmada CdSO 4 olinadi. Cd rux kukuni yordamida eritmadan ajratiladi:
CdSO 4 + Zn = ZnSO 4 + Cd
Olingan metall rux va qo'rg'oshin aralashmalarini olib tashlash uchun ishqor qatlami ostida qayta eritish orqali tozalanadi. Yuqori tozalikdagi kadmiy elektrolitlarni oraliq tozalash bilan elektrokimyoviy tozalash yoki zonali eritish yo'li bilan olinadi. (sm. ZONA ERITISH).
Fizikaviy va kimyoviy xossalari
Kadmiy - olti burchakli panjarali kumushsimon oq yumshoq metall ( a = 0,2979, Bilan= 0,5618 nm). Erish nuqtasi 321,1 ° S, qaynash nuqtasi 766,5 ° S, zichligi 8,65 kg / dm 3. Agar kadmiy tayoqchasi egilgan bo'lsa, u holda zaif yoriq eshitiladi - bular bir-biriga ishqalanadigan metall mikrokristallardir. Kadmiyning standart elektrod potentsiali -0,403 V, standart potentsiallar qatorida (sm. STANDART sig'im) u vodoroddan oldin joylashgan (sm. vodorod).
Quruq atmosferada kadmiy barqaror, nam muhitda u asta-sekin CdO oksidi plyonkasi bilan qoplanadi. Erish nuqtasidan yuqorida kadmiy havoda yonib, jigarrang oksidi CdO hosil qiladi:
2Cd + O 2 \u003d 2CdO
Kadmiy bug'lari suv bug'lari bilan reaksiyaga kirishib, vodorod hosil qiladi:
Cd + H 2 O \u003d CdO + H 2
IIB guruhi qoʻshnisi Zn bilan solishtirganda kadmiy kislotalar bilan sekinroq reaksiyaga kirishadi:
Sd + 2HCl \u003d CdCl 2 + H 2
Reaksiya eng oson nitrat kislota bilan boradi:
3Cd + 8HNO 3 \u003d 3Cd (NO 3) 2 + 2NO - + 4H 2 O
Kadmiy ishqorlar bilan reaksiyaga kirishmaydi.
Reaktsiyalarda u engil qaytaruvchi vosita sifatida harakat qilishi mumkin, masalan, konsentrlangan eritmalarda ammoniy selitrani NH 4 NO 2 nitritgacha kamaytirishga qodir:
NH 4 NO 3 + Cd \u003d NH 4 NO 2 + CdO
Kadmiy Cu (II) yoki Fe (III) tuzlari eritmalari bilan oksidlanadi:
Cd + CuCl 2 \u003d Cu + CdCl 2;
2FeCl 3 + Cd \u003d 2FeCl 2 + CdCl 2
Erish nuqtasidan yuqorida kadmiy galogenlar bilan reaksiyaga kirishadi (sm. galogenlar) galoidlar hosil bo'lishi bilan:
Cd + Cl 2 \u003d CdCl 2
Oltingugurt bilan (sm. Oltingugurt) va boshqa xalkogenlar xalkogenidlarni hosil qiladi:
Cd+S=CdS
Kadmiy vodorod, azot, uglerod, kremniy va bor bilan reaksiyaga kirishmaydi. Cd 3 N 2 nitridi va CdH 2 gidridi bilvosita olinadi.
Suvli eritmalarda Cd 2+ kadmiy ionlari 2+ va 2+ suv komplekslarini hosil qiladi.
Kadmiy gidroksid Cd (OH) 2 kadmiy tuzi eritmasiga ishqor qo'shish orqali olinadi:
SdSO 4 + 2NaOH \u003d Na 2 SO 4 + Cd (OH) 2 Ї
Kadmiy gidroksid ishqorlarda deyarli erimaydi, garchi gidroksid komplekslari 2- hosil bo'lishi ishqorlarning juda konsentrlangan eritmalarida uzoq vaqt qaynash paytida qayd etilgan. Shunday qilib, amfoterik (sm. AMFOTERLIK) kadmiy oksidi CdO va gidroksid Cd (OH) 2 ning xossalari mos keladigan sink birikmalariga qaraganda ancha zaifdir.
Kadmiy gidroksid Cd (OH) 2 murakkab birikma tufayli ammiak NH 3 ning suvli eritmalarida oson eriydi:
Cd (OH) 2 + 6NH 3 \u003d (OH) 2
Ilova
Ishlab chiqarilgan kadmiyning 40% metallarga korroziyaga qarshi qoplamalar uchun ishlatiladi. Kadmiyning 20% oddiy Weston hujayralarida ishlatiladigan kadmiy elektrodlarini tayyorlash uchun ishlatiladi. Kadmiyning 20% ga yaqini noorganik rang beruvchi moddalar, maxsus lehimlar, yarim o'tkazgichlar va fosforlarni ishlab chiqarish uchun ishlatiladi. 10% kadmiy - zargarlik buyumlari va erituvchi qotishmalar, plastmassalarning tarkibiy qismi.
Fiziologik harakat
Kadmiy va uning birikmalarining bug'lari zaharli bo'lib, kadmiy organizmda to'planishi mumkin. Ichimlik suvida kadmiy uchun MPC 10 mg/m 3 ni tashkil qiladi. Kadmiy tuzlari bilan o'tkir zaharlanish belgilari qusish va konvulsiyalardir. Eriydigan kadmiy birikmalari qonga so'rilgach, markaziy asab tizimiga, jigar va buyraklarga ta'sir qiladi va fosfor-kaltsiy almashinuvini buzadi. Surunkali zaharlanish anemiya va suyaklarning nobud bo'lishiga olib keladi.
ensiklopedik lug'at. 2009 .
Sinonimlar:Boshqa lug'atlarda "kadmiy" nima ekanligini ko'ring:
- (lat. kadmiy). Rangi qalayga o'xshash, egiluvchan metall. Rus tiliga kiritilgan xorijiy so'zlarning lug'ati. Chudinov A.N., 1910. Kadmiy lat. kadmiy, kadmeia geadan, kadmiy yer. Qalayga o'xshash metall. 25 000 xorijiy tushuntirish ... ... Rus tilidagi xorijiy so'zlar lug'ati
KADMIY- KADMIY, kadmiy, kimyo. element, belgi. Cd, atom og'irligi 112,41, atom raqami 48. Ko'pchilik rux rudalarida oz miqdorda bo'ladi va sink qazib olish jarayonida qo'shimcha mahsulot sifatida olinadi; ham olish mumkin....... Katta tibbiy entsiklopediya
KADMIY- CADMIUM (Cd) ga qarang. U ko'plab sanoat korxonalarining tarmoq suvlarida, ayniqsa elektrokaplamadan foydalanadigan qo'rg'oshin-rux va metallni qayta ishlash zavodlarida mavjud. U fosforli o'g'itlarda mavjud. Sulfat kislota suvda eriydi, ... ... Baliq kasalliklari: qo'llanma
kadmiy- (Cd) kumushsimon oq metall. U atom energetikasida va elektrokaplamada qo'llaniladi, qotishmalarning bir qismidir, bosma plitalar, lehimlar, payvandlash elektrodlarini tayyorlash uchun, yarim o'tkazgichlar ishlab chiqarishda ishlatiladi; komponent hisoblanadi... Rossiya mehnatni muhofaza qilish ensiklopediyasi
- (Kadmiy), Cd, davriy tizimning II guruhining kimyoviy elementi, atom raqami 48, atom massasi 112,41; metall, mp 321,1 shC. Kadmiy metallarga korroziyaga qarshi qoplamalarni qo'llash, elektrodlar tayyorlash, pigmentlarni olish, ... ... Zamonaviy entsiklopediya
- (Cd belgisi), davriy sistemaning ikkinchi guruhidan kumush rangli oq metall. Birinchi marta 1817 yilda ajratilgan. Greenockite tarkibida (sulfid shaklida), lekin asosan rux va qo'rg'oshin ekstraktsiyasidan qo'shimcha mahsulot sifatida olinadi. Osonlik bilan soxtalashtirilgan… Ilmiy-texnik entsiklopedik lug'at
Cd (yunoncha kadmeia rux rudasidan * a. kadmiy; n. kadmiyum; f. kadmiy; i. kadmio), kimyo. element II guruh davriy. Mendeleyev tizimlari, at.s. 48, da. m 112.41. Tabiatda 8 ta barqaror izotoplar mavjud 106Cd (1,225%) 108Cd (0,875%), ... ... Geologik entsiklopediya
Er. rux rudasida topilgan metall (kimyoviy tamoyillardan biri yoki parchalanmaydigan elementlar). Kadmiy, kadmiyga tegishli. K admisty, tarkibida kadmiy bor. Dahlning tushuntirish lug'ati. IN VA. Dal. 1863 1866 ... Dahlning tushuntirish lug'ati
kadmiy- (Kadmiy), Cd, davriy tizimning II guruhining kimyoviy elementi, atom raqami 48, atom massasi 112,41; metall, mp 321,1 ° S. Kadmiy metallarga korroziyaga qarshi qoplamalarni qo'llash, elektrodlar tayyorlash, pigmentlarni olish, ... ... Illustrated entsiklopedik lug'at
KADMIY- kimyo. element, belgisi Cd (lat. Kadmiy), at. n. 48, da. m 112,41; kumushsimon oq yaltiroq yumshoq metall, zichligi 8650 kg / m3, tmelt = 320,9 ° S. Kadmiy noyob va iz element bo'lib, zaharli bo'lib, odatda rudalarda rux bilan birga topiladi, u ... ... Katta politexnika entsiklopediyasi
- (lat. Kadmiy) Cd, davriy tizimning II guruhining kimyoviy elementi, atom raqami 48, atom massasi 112,41. Bu nom yunoncha kadmeia rux rudasidan olingan. Ko'k rangli, yumshoq va eriydigan kumush rangli metall; zichligi 8,65 g/sm³,…… Katta ensiklopedik lug'at
1817 yil kuzida Germaniyaning Magdeburg tumanidagi ba'zi dorixonalarni tekshirganda rux oksidi tarkibida qandaydir nopoklik borligi aniqlangan. Uchastka shifokori R.Rolov unda margimush borligidan shubhalanib, preparatni sotishni taqiqlagan. Sink oksidi ishlab chiqaradigan zavod egasi, K. Hermann bu qarorga rozi bo'lmadi va baxtsiz mahsulotni o'rganishga kirishdi. Tajribalari natijasida u zavodida ishlab chiqarilgan rux oksidi tarkibida qandaydir noma'lum metall aralashmasi bor degan xulosaga keldi. Olingan ma'lumotlar K. Hermann tomonidan 1818 yil aprel oyida "Sileziya sink oksidi va unda topilgan, ehtimol hali noma'lum bo'lgan metall haqida" maqolasida nashr etilgan. Shu bilan birga, F.Stromeyer tomonidan ijobiy xulosa e'lon qilindi, u Hermanning xulosalarini tasdiqladi va yangi metallni kadmiy deb atashni taklif qildi.
Gannover provintsiyasida dorixonalarning bosh inspektori bo'lgan F. Stromeyer boshqa jurnalda yangi metall haqida batafsil maqola chop etdi. 1818-yil 26-apreldagi maqola muqovasida 1817-yil sanasi bilan nashr etilgan.Ko‘rinib turibdiki, bu holat Strohmeyer (Hermanning roziligi bilan) topilgan metallga nom bergani bilan qo‘shilib, sanalarni ham, kashfiyot muallifini ham aniqlashda xatolar.
jismoniy xususiyatlar.
kadmiy - kumush oq miltillovchi ko'k metall, himoya oksidi plyonkasi hosil bo'lishi tufayli havoda xiralashadi. Erish nuqtasi - 321 ° S, qaynash nuqtasi - 770 ° S. Sof kadmiy tayog'i egilganda qalayga o'xshaydi, ammo metalldagi har qanday iflosliklar bu ta'sirni yo'q qiladi. Kadmiy qalaydan qattiqroq, lekin chinkdan yumshoqroq - uni pichoq bilan kesish mumkin. 80 ° C dan yuqori qizdirilganda, kadmiy o'zining elastikligini shunchalik yo'qotadiki, uni maydalash mumkin.
Kadmiy ko'plab metallar bilan qotishmalar va birikmalar hosil qiladi va simobda yaxshi eriydi.
Kadmiyning umumiy kimyoviy xususiyatlari.
Qizdirilganda oksidlanish kuchayadi va metallning yonishi mumkin. Chang kadmiy havoda yorqin qizil olov bilan osongina yonib, oksid hosil qiladi.
Agar kukunli kadmiy suv bilan kuchli aralashtirilsa, vodorod evolyutsiyasi kuzatiladi va vodorod periks mavjudligini aniqlash mumkin.
Suyultirilgan xlorid va sulfat kislotalar, qizdirilganda, asta-sekin kadmiy bilan reaksiyaga kirishib, vodorodni chiqaradi. Quruq vodorod xlorid 440 ° S haroratda kadmiy bilan o'zaro ta'sir qiladi. Quruq oltingugurt dioksidi ham metall bilan reaksiyaga kirishib, kadmiy sulfid CdS va qisman uning sulfati CdSO 4 ni hosil qiladi. Oddiy sharoitlarda kadmiy bilan o'zaro ta'sir qiladigan nitrat kislota ammiakni, qizdirilganda esa azot oksidlarini chiqaradi.
Kadmiy, sinkdan farqli o'laroq, kaustik ishqorlarda erimaydi, lekin ammoniy gidroksidda ham eriydi. Kadmiy ammiakli selitra eritmasi bilan reaksiyaga kirishganda, nitratlar hosil bo'ladi.
Alyuminiy, rux va temir kadmiyni uning birikmalari eritmalaridan siqib chiqaradi. Uning o'zi eritmalardan mis va boshqa elektromusbat elementlarni cho'kadi. Qizdirilganda kadmiy to'g'ridan-to'g'ri fosfor, oltingugurt, selen, tellur va galogenlar bilan birlashadi, lekin uning gidridi va nitridini vodorod va azot bilan to'g'ridan-to'g'ri o'zaro ta'sir qilish orqali olish mumkin emas.
Kadmiyning eng muhim birikmalari.
kadmiy oksidiCdO metallni havoda yoki kislorodda yoqish, uning sulfidini qovurish yoki ma'lum birikmalarning termik parchalanishi orqali olinishi mumkin. Bu olingan haroratga qarab turli rangdagi kukun: yashil-sariq (350-370 ° S), qalin quyuq ko'k (800 ° S), jigarrang, qora.
kadmiy gidroksidCD(Oh) 2 ishqorlar ta'sirida uning tuzlari eritmalaridan oq jelatinli cho'kma shaklida ajralib chiqadi.
Kadmiy sulfidCDS- kadmiyning eng muhim birikmalaridan biri. Olishning fizik-kimyoviy shartlariga qarab, u limon sariqdan qizil ranggacha bo'lishi mumkin.
Galogenitlar kadmiy elementlarning bevosita o'zaro ta'siri, shuningdek kadmiy, uning oksidi yoki karbonatini tegishli kislotalarda eritish orqali juda oson olinadi. Barcha hosil qiluvchi tuzlar rangsiz kristall moddalardir.
Kadmiy karbonatCDCTaxminan 3 oq amorf cho'kma shaklida kadmiy eritmalariga gidroksidi karbonatlar qo'shilganda cho'kma hosil bo'ladi.
Kadmiyning xom manbalari. Kadmiy olish.
Kadmiy hisoblanadi tarqoq element, ya'ni. u oʻzining foydali qazilmalarini deyarli hosil qilmaydi va bunday foydali qazilmalarning konlari umuman maʼlum emas. Kadmiy boshqa metallar rudalarida foizning yuzdan va mingdan bir qismi konsentratsiyalarda mavjud. Tarkibida 1-1,5% kadmiy boʻlgan baʼzi rudalar bu metalga nihoyatda boy hisoblanadi.
Ba'zi qiziqish uyg'otadigan yagona kadmiy minerali - bu tabiiy sulfid, greenokit yoki kadmiy aralashmasi. Rux rudalari konlarini o'zlashtirishda grinokit faerit bilan birga qazib olinadi va rux o'simliklarida tugaydi. Qayta ishlash jarayonida kadmiy jarayonning ba'zi oraliq mahsulotlarida to'planadi, undan keyin u olinadi.
Shunday qilib, kadmiy ishlab chiqarish uchun haqiqiy xom ashyo sink-elektrolit zavodlari, qo'rg'oshin va mis eritish zavodlarining keklari hisoblanadi.
Birinchi ishlab chiqarish 1829 yilda Yuqori Sileziyada tashkil etilgan.
Hozirgi kunda dunyoda yiliga 10 ming tonnadan ortiq kadmiy ishlab chiqariladi.
Kadmiyni qo'llash.
Kadmiyning sanoat iste'molining asosiy qismi kadmiyga to'g'ri keladi himoya qoplamalar metallarni korroziyadan himoya qilish. Ushbu qoplamalar nikel, sink yoki qalay qoplamalariga nisbatan sezilarli afzalliklarga ega. deformatsiya paytida qismlardan qirib tashlamang.
Kadmiy qoplamalari ba'zi hollarda boshqalardan ustundir: 1) dengiz suvidan himoya qilishda, 2) namlik yuqori bo'lgan yopiq joylarda ishlaydigan qismlar uchun, 3) elektr kontaktlarini himoya qilish uchun.
Kadmiyni qo'llashning ikkinchi sohasi qotishma ishlab chiqarish. Kadmiy qotishmalari kumush-oq, egiluvchan, yaxshi ishlov beriladi. Kichik nikel, mis va kumush qo'shilgan kadmiy qotishmalari kuchli dengiz, samolyot va avtomobil dvigatellari uchun podshipniklar ishlab chiqarish uchun ishlatiladi.
Faqat 1% kadmiy qo'shilgan mis sim ikki baravar kuchli, elektr o'tkazuvchanligi biroz pasayadi.
Tsirkonyum qo'shilgan mis-kadmiy qotishmasi yanada katta kuchga ega va yuqori kuchlanishli elektr uzatish liniyalari uchun ishlatiladi.
Sof kadmiy, o'zining ajoyib xususiyati - yuqori termal neytronni ushlab turish kesimi tufayli, nazorat va favqulodda rodlarni ishlab chiqarish uchun ishlatiladi. yadro reaktorlari sekin neytronlarda.
DA zargarlik biznesi oltin va kadmiy qotishmalaridan foydalaniladi. Komponentlarning nisbatlarini o'zgartirish orqali turli xil rang soyalari olinadi.
Nikel-kadmiy akkumulyatorlar, hatto to'liq zaryadsizlangan bo'lsa ham, butunlay yaroqsiz holga kelmaydi.
Kadmiy amalgam ishlatiladi stomatologiyada plomba tayyorlash uchun.
Kadmiyning biologik xossalari.
Kadmiy qoplamalari oziq-ovqat bilan aloqa qilishlari kerak bo'lganda qabul qilinishi mumkin emas. Metallning o'zi zaharli emas, lekin juda yuqori zaharli eruvchan kadmiy birikmalari. Bundan tashqari, ular tanaga va har qanday holatda (eritma, chang, tutun, tuman) kirib borishi xavflidir. Zaharliligi jihatidan kadmiy simob va mishyakdan kam emas. Kadmiy birikmalari asab tizimiga depressiv ta'sir ko'rsatadi, nafas olish yo'llariga ta'sir qiladi va ichki organlarda o'zgarishlarga olib keladi.
Kadmiyning katta konsentratsiyasi o'tkir zaharlanishga olib kelishi mumkin: 2500 mg / m 3 uning birikmalarini o'z ichiga olgan xonada bir daqiqa qolish o'limga olib keladi. O'tkir zaharlanishda lezyon belgilari darhol rivojlanmaydi, lekin ma'lum bir yashirin davrdan keyin, 1-2 soatdan 30-40 soatgacha davom etishi mumkin.
Zaharliligiga qaramay, kadmiy tirik organizmlarning rivojlanishi uchun zarur bo'lgan iz elementi ekanligi isbotlangan. Uning vazifasi hali ham aniq emas. O'simliklarni oziqlantirish ularning rivojlanishiga ijobiy ta'sir qiladi.
TA'RIF
kadmiy davriy sistemaning ikkilamchi (B) kichik guruhining II guruhining beshinchi davrida joylashgan.
Elementlar bilan bog'liq d- oilalar. Metall. Belgilanishi - CD. Tartib raqami - 48. Nisbiy atom massasi - 112,41 a.m.u.
Kadmiy atomining elektron tuzilishi
Kadmiy atomi musbat zaryadlangan yadrodan (+48) iborat bo'lib, uning ichida 48 ta proton va 64 neytron bo'lib, 48 ta elektron beshta orbita bo'ylab harakatlanadi.
1-rasm. Kadmiy atomining sxematik tuzilishi.
Elektronlarning orbitallarda taqsimlanishi quyidagicha:
48Cd) 2) 8) 18) 18) 2;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 .
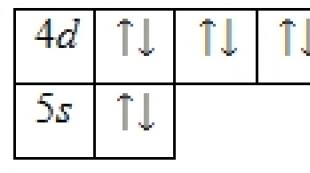
Kadmiy atomining valent elektronlari 4 da joylashgan elektronlardir d- va 5 s-orbitallar. Asosiy holatning energiya diagrammasi quyidagi shaklni oladi:

Kadmiy atomining valentlik elektronlari to'rtta kvant sonlar to'plami bilan tavsiflanishi mumkin: n(bosh kvant), l(orbital), m l(magnit) va s(aylantirish):
|
pastki daraja |
||||
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Qancha atom orbitallari p-pastki daraja 35 va 54 seriya raqamlari bo'lgan elementlar uchun to'ldiriladi? Ularning elektron formulalarini yozing. |
| Javob | Seriya raqamlari 35 va 54 bo'lgan elementlar brom va ksenondir. Biz ularning elektron formulalarini asosiy holatda yozamiz: 35 Br1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5 ; 54 Xe1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 . p-pastki sathida 3 ta orbital mavjud bo'lib, ularning har birida 2 tadan ko'p bo'lmagan elektron (jami 6) bo'lishi mumkin. Brom va ksenon atomlarining p-orbitallari to'ldirilgan. |
2-MISA
| Mashq qilish | Kvant raqamlari qanday qiymatlarni olishi mumkin? n, l, m l va Xonim atomdagi elektronlar holatini tavsiflovchi. Kaltsiy atomining tashqi elektronlari uchun ular qanday qiymatlarni oladi? | |||||||||||||||
| Javob | Asosiy kvant soni n 1 dan cheksizgacha qiymatlarni qabul qilishi mumkin, lekin aslida uning chegarasi 7 raqamidir. Orbital kvant soni l 0 dan 3 gacha qiymatlarni qabul qilishi mumkin. Magnit kvant soni m l-l dan 0 dan +l gacha bo'lgan qiymatlarni oladi. Spin kvant sonida Xonim faqat ikkita qiymat bo'lishi mumkin: +1/2 va -1/2. Keling, magniy atomining asosiy holatining elektron konfiguratsiyasini yozamiz (valentlik elektronlarini qalin qilib ajratib ko'rsatamiz): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 . Tashqi energiya darajasidagi elektronlar quyidagi kvant sonlari bilan tavsiflanadi:
|
Kadmiy - kam uchraydigan zaharli va noma'lum
kumush xavfli metallarning keng assortimenti
Zaharli va zaharli toshlar va minerallar
kadmiy(Lotin kadmiy, Cd belgisi bilan belgilanadi) - atom raqami 48 va atom massasi 112,411 bo'lgan element. Bu ikkinchi guruhning ikkilamchi kichik guruhining elementi, D.I. kimyoviy elementlar davriy tizimining beshinchi davri. Mendeleev. Oddiy sharoitlarda oddiy kadmiy moddasi og'ir (zichligi 8,65 g / sm3 - urandan engilroq) yumshoq egiluvchan egiluvchan o'tish metallidir. kumush oq ranglar (Ukrainaning Jitomir viloyatidagi "Kerberskiy tosh" kabi go'shtni yutib yubormaydi - uran oksidi pitchblendesi emas, jigarrang xavfli tosh). Rasmda - kadmiy sulfid, yashil kit(tuproq qobig'i sariq ranglar).
Tabiiy kadmiy sakkizta izotopdan iborat bo'lib, ulardan oltitasi barqaror: 106Cd (izotop ko'pligi 1,22%), 108Cd (0,88%), 110Cd (12,39%), 111Cd (12,75%), 112Cd (24, 07%),24, 07,2. %). Yana ikkita tabiiy izotoplar uchun radioaktivlik aniqlandi: 113Cd (izotop koʻpligi 12,22%, yarim yemirilish davri 7,7∙1015 yil b-yemirilish) va 116Cd (izotop koʻpligi 7,49%, yarim yemirilish davri 3.0∙2 boʻlgan ikki marta b-emirilish). 1019 yil).
Davriy tizimning kadmiyini qisman nemis professori Fridrix Stromeyer 1817 yilda ta'riflagan (sinkdan ajralib turadi). Magdeburg farmatsevtlari sink oksidi ZnO bo'lgan preparatlarni o'rganishda ularda mishyak (sulfiddan oksidlanish katalizatori) mavjudligiga shubha qilishdi. Sink oksidi turli xil teri kasalliklari uchun ishlatiladigan ko'plab malhamlar, kukunlar va emulsiyalar tarkibiga kiritilganligi sababli, inspektorlar shubhali dori vositalarini sotishni qat'iyan taqiqladilar.
Tabiiyki, dori vositalari ishlab chiqaruvchisi o‘zining shaxsiy manfaatlarini himoya qilib, ekspertiza o‘tkazishni talab qilgan. Stromeyer mutaxassis sifatida harakat qildi. U ZnO dan jigarrang-jigarrang oksidni ajratib olib, uni vodorod bilan qaytardi va kumush-oq metallni oldi, uni "kadmiy" (yunoncha kadmeia - rux oksidi, shuningdek rux rudasi) deb atagan. Professor Stromeyerga qaramasdan, kadmiy Sileziya rux rudalarida (sun'iy yo'ldosh) bir guruh olimlar - K. Hermann, K. Karsten va V. Meysner tomonidan 1818 yilda kashf etilgan.
Kadmiy sekin neytronlarni o'zlashtiradi, shuning uchun kadmiy tayoqchalari yadroviy reaktorlarda zanjirli reaktsiya tezligini (ChNPP) boshqarish uchun ishlatiladi. Kadmiy gidroksidi batareyalarda ishlatiladi va ba'zi qotishmalarning tarkibiy qismi sifatida kiritilgan. Masalan, taxminan 1% Cd (kadmiy bronza) bo'lgan mis qotishmalari telegraf, telefon, trolleybus va tramvay simlari, metro kabellarini ishlab chiqarish uchun ishlatiladi, chunki bu qotishmalar misga qaraganda ko'proq kuchga ega va aşınmaya bardoshli.

Kaltsit ustidagi Greenockite (sariq dop). Yunnan, Xitoy. 7x5 sm.Surat: A.A. Evseev.
Yong'in o'chirgichlarida ishlatiladigan bir qator erituvchi qotishmalarda kadmiy mavjud. Bundan tashqari, kadmiy sifatsiz zargarlik qotishmalarining bir qismidir (harorat ta'sirida yorilib ketgan amalgam qotishmalaridan amalgam komponentini bug'langandan keyin lehimlash va ochiq savdoda taqiqlangan - oltin, kumush va platinaning zaharli simob bilan amalgamlari).
Ushbu metall po'latdan yasalgan buyumlarni kadmiy bilan qoplash uchun ishlatiladi, chunki uning yuzasida himoya ta'siriga ega bo'lgan oksidli plyonka mavjud. Gap shundaki, dengiz suvida va boshqa bir qator vositalarda kadmiy qoplamasi galvanizatsiyadan ko'ra samaraliroqdir. Kadmiy gomeopatik (o'tlar va mikrodozalar bilan asosiy davolash - "Oziq-ovqatdagi parhez qo'shimchalari" - parhez qo'shimchalari va hayvonlar uchun ozuqa) tibbiyotda uzoq vaqtdan beri qo'llanilgan. Kadmiy birikmalari ham keng qo'llanilishini topdi - kadmiy sulfid sariq bo'yoq va rangli ko'zoynaklar tayyorlash uchun ishlatiladi va kadmiy floroborat alyuminiy va boshqa metallarni lehimlash uchun ishlatiladigan oqimdir.
Kadmiy umurtqali hayvonlarning tanasida (suyaklar, ligamentlar, tendonlar va mushaklar) mavjud bo'lib, u uglerod almashinuviga, bir qator fermentlarning faolligiga va jigarda gipurik kislota sinteziga ta'sir qilishi aniqlangan. Biroq, kadmiy birikmalari zaharli va metallning o'zi kanserogendir. Kadmiy oksidi CdO bug'larini inhalatsiyalash ayniqsa xavflidir, o'limga olib keladigan holatlar kam uchraydi. Kadmiyning oshqozon-ichak traktiga kirib borishi ham zararli, ammo halokatli zaharlanish holatlari qayd etilmagan, ehtimol bu tananing toksindan xalos bo'lishga intilishi bilan bog'liq (qusish).
Biologik xossalari
Aniqlanishicha, kadmiy deyarli barcha tirik organizmlarda mavjud - quruqlikdagi kadmiy miqdori taxminan 1 kg massaga 0,5 mg ga teng, dengiz organizmlarida (gubkalar, koelenteratlar, echinodermlar, Tinch okeanining qurtlari) - 0,15 dan 3 gacha. mg / kg, o'simliklardagi kadmiy miqdori taxminan 10-4% ni tashkil qiladi (quruq moddada). Ko'pgina tirik organizmlarda kadmiy mavjudligiga qaramasdan, uning o'ziga xos fiziologik ahamiyati to'liq aniqlanmagan (o'sish gormoni). Olimlar ushbu element uglevod almashinuviga, jigarda gipurik kislota sinteziga, bir qator fermentlarning faolligiga, shuningdek, tanadagi rux, mis, temir va kaltsiy metabolizmiga ta'sir qilishini aniqlashga muvaffaq bo'lishdi (sevimli tosh). mushak massasini oshiradigan va suyaklarini sportda mustahkamlaydigan bodibildingchilar - mikrodozalarda).

Greenokit (sariq). Jingalak vulqon, taxminan. Iturup, Kuril orollari, Rossiya. Foto: A.A. Evseev.
Talk, oltingugurt va boshqa yashil o'xshash minerallar uchun chiqarilishi mumkin
Tadqiqotlar tomonidan tasdiqlangan oziq-ovqat tarkibidagi kadmiyning mikroskopik miqdori sutemizuvchilarning tana o'sishini rag'batlantirishi mumkinligi haqidagi taklif mavjud. Shu sababli, olimlar kadmiyni uzoq vaqtdan beri shartli ravishda muhim iz element, ya'ni hayotiy, ammo ma'lum dozalarda toksik. Sog'lom odamning tanasida oz miqdorda kadmiy mavjud. Qadimgi yunon va rim eposida kuylangan - Kadmey(joy zahar savdosi Evropaning janubi-sharqida ("Tsaregrad darvozasidagi qalqon", Istanbul), Gretsiyada (portiklar va amfiteatrlar) va O'rta er dengizida Turkiya yaqinida - dori). Ustida jargon konchilar va tosh konchilar kadmiy chaqirdi" ilon zahari" (jargon).
Kadmiy eng ko'plaridan biridir toksik og'ir metallar- Rossiyada (metrologiya) 2-xavfli sinfga - o'ta xavfli moddalarga - surma, stronsiy, fenol va boshqa zaharli moddalarni (ekvivalentga teng) kiradi. ADR xavfli tovarlar N 6 - zahar, rombdagi bosh suyagi va ko'ndalang suyaklar). 1999 yil 29 apreldagi "Kimyoviy xavfsizlik muammolari" Atrof-muhit xavfsizligi va zaharli moddalarni tashish texnologiyalari bo'yicha Rossiya Federatsiyasi byulletenida kadmiy "ming yillik boshidagi eng xavfli ekotoksikant" sifatida ko'rsatilgan!
Boshqa og'ir metallar singari, kadmiy ham kümülatif zahardir, ya'ni u tanada to'planishi mumkin - uning yarim umri 10 yildan 35 yilgacha. Ellik yoshga kelib, inson tanasi 30 dan 50 mg gacha kadmiy to'plashi mumkin. Inson tanasidagi kadmiyning asosiy "depolari" buyraklar bo'lib, ular organizmdagi ushbu metalning umumiy miqdorining 30 dan 60% gacha va jigar (20-25%). Quyidagilar kadmiyni kamroq miqdorda to'plashi mumkin: oshqozon osti bezi, taloq, quvurli suyaklar va boshqa organlar va to'qimalar. Kichik miqdordagi kadmiy hatto qonda ham mavjud. Biroq, qo'rg'oshin yoki simobdan farqli o'laroq, kadmiy miyaga kirmaydi.
Ko'pincha organizmdagi kadmiy bog'langan holatda - metallotionin oqsili bilan birgalikda - bu o'ziga xos himoya mexanizmi, tananing og'ir metal mavjudligiga reaktsiyasi. Ushbu shaklda kadmiy kamroq zaharli, ammo u bog'langanda ham zararsiz bo'lib qolmaydi - yillar davomida to'planib, bu metall buyraklarning buzilishiga va buyrak toshlarining paydo bo'lish ehtimoli oshishiga olib kelishi mumkin. Ion shaklida bo'lgan kadmiy ancha xavflidir, chunki u kimyoviy jihatdan sinkga juda yaqin va uni biokimyoviy reaktsiyalarda almashtirishga qodir, psevdoaktivator yoki aksincha, sink o'z ichiga olgan oqsillar va fermentlarning inhibitori.
Kadmiy tirik organizm hujayralarining sitoplazmatik va yadro moddasi bilan bog'lanadi va ularni shikastlaydi, ko'plab gormonlar va fermentlarning faolligini o'zgartiradi, bu uning sulfgidril (-SH) guruhlarini bog'lash qobiliyati bilan izohlanadi. Bundan tashqari, kadmiy, kaltsiy va kadmiyning ion radiuslarining yaqinligi tufayli suyak to'qimasida kaltsiyni almashtirishga qodir. Xuddi shu holat temir bilan bog'liq bo'lib, uni kadmiy ham almashtirishga qodir. Shu sababli organizmda kaltsiy, rux va temirning etishmasligi oshqozon-ichak traktidan kadmiyning so'rilishini 15-20% gacha oshirishga olib keladi. Kattalar uchun kadmiyning zararsiz sutkalik dozasi 1 kg tana vazniga 1 mkg kadmiyni tashkil qiladi, ko'p miqdorda kadmiy sog'liq uchun juda xavflidir.
Kadmiy va uning birikmalarining organizmga kirish mexanizmlari qanday? Zaharlanish kadmiyli chiqindilar bilan ifloslangan ichimlik suvi (ichimlik suvi uchun maksimal konsentratsiya chegarasi 0,01 mg/l), shuningdek, neftni qayta ishlash zavodlari va metallurgiya korxonalari yaqinida joylashgan yerlarda o‘sadigan sabzavot va don mahsulotlari iste’mol qilinganda sodir bo‘ladi. Bunday hududlardan qo'ziqorinlardan foydalanish ayniqsa xavflidir, chunki ba'zi ma'lumotlarga ko'ra, ular o'z vazniga 100 mg dan ortiq kadmiy to'plashi mumkin. Chekish ham chekuvchining o'zi va uning atrofidagi odamlarning tanasiga kadmiyni olishning yana bir manbaidir, chunki metall tamaki tutunida mavjud.
Surunkali kadmiy zaharlanishining xarakterli belgilari, avval aytib o'tilganidek, buyrak shikastlanishi, mushaklarning og'rig'i, suyak to'qimasini yo'q qilish va anemiya. Kadmiy bilan o'tkir oziq-ovqat zaharlanishi oziq-ovqat (15-30 mg) yoki suv (13-15 mg) bilan bir martalik katta dozalarda qabul qilinganda sodir bo'ladi. Shu bilan birga, o'tkir gastroenterit belgilari kuzatiladi - epigastral mintaqada qusish, og'riq va konvulsiyalar, ammo organizmga oziq-ovqat bilan kirgan kadmiy birikmalari bilan halokatli zaharlanish holatlari fanga noma'lum, ammo JSST hisob-kitoblariga ko'ra, a o'limga olib keladigan yagona doz 350-3500 mg bo'lishi mumkin.
Suyuq simob va qizil kinobarga o'xshash (toksikligi bo'yicha) - uning bug'lari (CdO) yoki kadmiy o'z ichiga olgan chang (qoida tariqasida, bu kadmiydan foydalanish bilan bog'liq sohalarda sodir bo'ladi) bilan nafas olish orqali kadmiy bilan zaharlanish ancha xavflidir. Bunday zaharlanishning belgilari o'pka shishi, bosh og'rig'i, ko'ngil aynishi yoki qusish, titroq, zaiflik va diareya (diareya). Bunday zaharlanish natijasida o'lim holatlari qayd etilgan.
Kadmiy bilan zaharlanishning antidoti selen bo'lib, kadmiyning so'rilishini kamaytirishga yordam beradi (ular zamonaviy ma'lumotlar markazlarida nusxa ko'chirish va printerlarda ishlaydi va ofis jihozlari uchun kartridjlarni to'ldiradi). Biroq, selenni muvozanatli iste'mol qilish hali ham talab qilinadi, bu uning tanadagi ortiqcha miqdori oltingugurt miqdorining pasayishiga olib keladi (oltingugurt sulfidini hosil qiladi - uni bog'laydi) va bu, albatta, kadmiyga olib keladi. yana organizm tomonidan so'riladi.
Qiziq faktlar
Bitta sigaretda 1 mikrogramdan 2 mikrogramgacha kadmiy borligi aniqlangan. Ma'lum bo'lishicha, kuniga bir quti sigaret chekadigan odam (20 dona) taxminan 20 mikrogram kadmiy oladi! Xavf kadmiyning o'pka orqali so'rilishidadir maksimal- 10 dan 20% gacha, shuning uchun chekuvchining tanasida har bir sigaret qutisi bilan 2 dan 4 mikrogramgacha kadmiy so'riladi! Tamaki tutuni tarkibidagi nikotinning kanserogen ta'siri, qoida tariqasida, kadmiy mavjudligi bilan bog'liq va u hatto uglerod filtrlari - o'pka saratoni bilan ham saqlanib qolmaydi.
Ko'p sonli o'limga olib keladigan surunkali kadmiy zaharlanishiga misol 1950-yillarning oxirida tasvirlangan. Yaponiya hududida mahalliy aholi "itai-itai" ("italyan kasalligi") deb ataydigan kasallik holatlari bo'lgan, uni mahalliy shevaga "oh, qanday og'riyapti!" deb ham tarjima qilish mumkin. (zaharlanish). Kasallikning belgilari kuchli bel og'rig'i bo'lib, keyinchalik ma'lum bo'lishicha, buyrakning qaytarib bo'lmaydigan shikastlanishi sabab bo'lgan; kuchli mushak og'rig'i. Kasallikning keng tarqalishi va uning og'ir kechishiga o'sha davrda Yaponiyada atrof-muhitning yuqori darajada ifloslanishi va yaponlarning o'ziga xos ovqatlanishi (guruch va dengiz mahsulotlari ko'p miqdorda kadmiy to'planadi) sabab bo'lgan. Ushbu kasallik bilan kasallanganlar kuniga taxminan 600 mikrogram kadmiy iste'mol qilishlari aniqlandi!
Kadmiy eng zaharli moddalardan biri sifatida tan olinishiga qaramay, u tibbiyotda ham qo'llanilishini topdi! Shunday qilib, yurak etishmovchiligi bilan og'rigan bemorning ko'kragiga kiritilgan nikel-kadmiy batareyasi yurakning mexanik stimulyatoriga energiya beradi. Bunday akkumulyatorning qulayligi shundaki, bemor uni qayta zaryadlash yoki almashtirish uchun operatsiya stoliga yotishi shart emas. Batareyaning uzluksiz ishlash muddati uchun haftada bir marta atigi bir yarim soat maxsus magnitlangan kurtka kiyish kifoya.
Kadmiy gomeopatiyada, eksperimental tibbiyotda qo'llaniladi va yaqinda u saratonga qarshi yangi dorilarni yaratishda qo'llaniladi.
50% vismut, 12,5% qalay, 25% qo'rg'oshin, 12,5% kadmiy o'z ichiga olgan yog'och metall qotishmasi qaynoq suvda eritilishi mumkin. Qotishma 1860 yilda muhandis B. Vud tomonidan ixtiro qilingan ) Bir nechta qiziq faktlar bilan bog'liq. bu past eriydigan qotishma: birinchidan, yog'och qotishmasi tarkibiy qismlarining birinchi harflari "WAX" qisqartmasini hosil qiladi, ikkinchidan, ixtiro ham B. Vudning ismli - sakkiz yildan keyin tug'ilgan amerikalik fizik Robert Uilyams Vudga tegishli. (VAKda tengdoshlar jang qilishdi).
Yaqinda davriy tizimning kadmiylari politsiya va sud-tibbiyot ekspertlarining "qurollanishi" ga kirdi: tekshirilayotgan yuzada yotqizilgan kadmiyning eng yupqa qatlami yordamida inson barmoq izlarini aniqlash mumkin.
Olimlar shunday qiziqarli faktni aniqladilar: qishloq joylari atmosferasidagi kadmiy qalay sanoat hududlari atmosferasiga qaraganda ancha yuqori korroziyaga chidamliligiga ega. Bunday qoplama, ayniqsa, havoda oltingugurt yoki oltingugurt angidridlari miqdori ko'paygan bo'lsa, tezda muvaffaqiyatsiz bo'ladi.
1968 yilda AQSh sog'liqni saqlash xodimlaridan biri (doktor Kerroll) yurak-qon tomir kasalliklaridan o'lim darajasi va atmosferadagi kadmiy miqdori o'rtasidagi bevosita bog'liqlikni aniqladi. U 28 ta shahar ma’lumotlarini tahlil qilib, shunday xulosaga keldi. Ulardan to'rttasida - Nyu-York, Chikago, Filadelfiya va Indianapolisda - havodagi kadmiy miqdori boshqa shaharlarga qaraganda yuqori edi; yurak xastaligidan o'lganlar ulushi ham yuqori bo'lgan.
Atmosferaga, suvga va tuproqqa kadmiy chiqindilarini cheklash bo'yicha "standart" chora-tadbirlardan tashqari (korxonalarda filtrlar va tozalash vositalari, bunday korxonalardan uy-joy va ekin maydonlarini olib tashlash) olimlar yangi - istiqbollilarini ham ishlab chiqmoqdalar. Shunday qilib, Missisipi daryosi ko'rfaziga olimlar, ularning yordami bilan suvni kadmiy va simob kabi elementlardan tozalash mumkinligiga ishonib, suv zambillarini ekishdi.
Hikoya
Tarix uydirma tekshiruvlar, ko'rib chiqishlar va qayta ko'rib chiqishlar paytida qilingan ko'plab "kashfiyotlar" ni biladi. Biroq, bunday topilmalar ilmiy jihatdan ko'proq jinoiydir. Va shunga qaramay, boshlangan qayta ko'rib chiqish oxir-oqibat yangi kimyoviy elementning ochilishiga olib kelgan bir holat bor edi. Bu 19-asrning boshlarida Germaniyada sodir bo'lgan. Uchastka shifokori R.Rolov o‘z tumanidagi dorixonalarni tekshirib ko‘rdi, tekshirish vaqtida – Magdeburg shahri yaqinidagi bir qator dorixonalarda rux oksidi aniqlangan, uning ko‘rinishi shubha uyg‘otib, tarkibida mishyak (farmakolit) borligini taxmin qilgan. Taxminlarni tasdiqlash uchun Rolov olingan dorini kislotada eritib, vodorod sulfidi eritmasidan o'tkazdi, bu esa mishyak sulfidiga o'xshash sariq cho'kmaning cho'kishiga olib keldi. Barcha shubhali dori-darmonlar - malhamlar, kukunlar, emulsiyalar, kukunlar darhol sotuvdan olib tashlandi.
Bunday harakat Rolov rad etgan barcha dori-darmonlarni ishlab chiqaradigan Shenebekdagi zavod egasini g'azablantirdi. Bu tadbirkor - Herman, kasbi bo'yicha kimyogar bo'lib, tovarlarni o'zi ekspertizadan o'tkazdi. O'sha paytda mishyakni aniqlash bo'yicha ma'lum bo'lgan tajribalarning butun arsenalini sinab ko'rib, u o'z mahsulotlari bu jihatdan toza ekanligiga amin bo'ldi va auditorni chalkashtirib yuborgan temir sink oksidining sariq rangini berdi.
O'z tajribalari natijalarini Rolovga va Gannover erlari ma'murlariga ma'lum qilib, Herman mustaqil ekspertiza o'tkazishni va mahsulotini to'liq "qayta tiklashni" talab qildi. Natijada, Gettingen universitetining kimyo kafedrasini boshqargan va bir vaqtning o'zida barcha Gannover dorixonalarining bosh inspektori lavozimini egallagan professor Stromeyerning fikrini bilishga qaror qilindi. Tabiiyki, Stromeyer tekshirish uchun nafaqat rux oksidini, balki Shenebek fabrikasidan boshqa rux preparatlarini, shu jumladan, ushbu oksid olingan rux karbonatini ham tekshirish uchun yuborilgan.
Rux karbonat ZnCO3 ni kaltsiylash orqali Fridrix Stromeyer oksid oldi, ammo oq emas, balki sarg'ish rangda bo'lishi kerak edi. Keyingi izlanishlar natijasida ma'lum bo'ldiki, dorilar tarkibida Rolov taklif qilganidek mishyak ham, nemis o'ylaganidek temir ham yo'q. G'ayrioddiy rangning sababi butunlay boshqa metall edi - ilgari noma'lum va sinkga juda o'xshash. Yagona farq shundaki, uning gidroksidi Zn (OH) 2 dan farqli o'laroq, amfoter emas, balki aniq asosiy xususiyatlarga ega edi.
Stromeyer yangi metallni kadmiy deb atadi va bu yangi elementning sink bilan kuchli o'xshashligini ta'kidladi - yunoncha kalima (kadmeia) uzoq vaqtdan beri rux rudalarini (masalan, smitsonit ZnCO3) va rux oksidini bildirgan. O'z navbatida, bu so'z, afsonaga ko'ra, sink toshini birinchi bo'lib topgan va misga (rudadan eritilganda) oltin rang berish qobiliyatini kashf etgan Finikiyalik Kadmus nomidan kelib chiqqan. Qadimgi yunon afsonalariga ko'ra, yana bir Kadmus bor edi - Ajdahoni mag'lub etgan va u mag'lub etgan dushman erlarida Kadmeus qal'asini qurgan qahramon, keyinchalik uning atrofida etti darvozali buyuk Fiba shahri o'sgan. Semit tillarida “kadmos” “sharqiy” yoki “ilon” degan maʼnoni bildiradi (Fargʻona, Qirgʻiziston, Oʻrta Osiyo – ilonlar toʻplanadigan joylar bor), bu foydali qazilmaning nomini uni qazib olinadigan yoki eksport qilinadigan joylardan tuzgan boʻlsa kerak. har qanday sharqiy mamlakat yoki viloyatdan.
1818 yilda Fridrix Stromeyer metallning batafsil tavsifini e'lon qildi, uning xususiyatlarini u allaqachon yaxshi o'rgangan. Erkin shaklda yangi element oq metall, yumshoq va unchalik kuchli bo'lmagan, tepasida jigarrang oksidli plyonka bilan qoplangan. Tez orada, tez-tez sodir bo'lganidek, Strohmeyerning kadmiyni kashf etishdagi ustuvorligiga e'tiroz bildirila boshlandi, ammo barcha da'volar rad etildi. Biroz vaqt o'tgach, yana bir kimyogar Kersten Sileziya rux rudasida yangi element topdi va uni mellin (lotincha mellinus, "behi kabi sariq") deb nomladi. Bu nomning sababi vodorod sulfidi ta'sirida hosil bo'lgan cho'kmaning rangi edi.
Kerstenning xafa bo'lishiga qaramay, "mellin" Stromeyerning "kadmiy"si bo'lib chiqdi. Keyinchalik qirq sakkizinchi element uchun boshqa nomlar taklif qilindi: 1821 yilda Jon yangi elementni "klaprotium" deb atashni taklif qildi - mashhur kimyogar Martin Klaprot - uran, sirkoniy va titanni kashf etgan Gilbert sharafiga "junonium" - 1804 yilda Juno topilgan asteroiddan keyin. Ammo Klaprotning fanga qilgan xizmatlari qanchalik katta bo'lmasin, uning nomi kimyoviy elementlar ro'yxatida o'z o'rnini topishga mo'ljallanmagan: kadmiy kadmiy bo'lib qoldi. To'g'ri, 19-asrning birinchi yarmidagi rus kimyoviy adabiyotida kadmiy ko'pincha kadmiy deb nomlangan.
Tabiatda bo'lish
Kadmiy odatda kam uchraydigan va juda tarqoq element bo'lib, bu metalning er qobig'idagi o'rtacha miqdori (klark) og'irligi bo'yicha taxminan 1,3 * 10-5% yoki 1,6 * 10-5% ni tashkil qiladi, ma'lum bo'lishicha, kadmiy litosfera taxminan 130 mg / t ni tashkil qiladi. Sayyoramizning ichaklarida kadmiy shunchalik kamki, hatto kamdan-kam hisoblangan germaniy ham 25 barobar ko'p! Kadmiy va boshqa nodir metallar uchun taxminan bir xil nisbatlar: berilliy, seziy, skandiy va indiy. Kadmiy surmaga yaqin (2 * 10-5%) va simobdan ikki baravar ko'p (8 * 10-6%).
Kadmiy sink (kadmiy izomorf aralashma sifatida ko'plab minerallarda va doimo rux minerallarida uchraydi) va boshqa xalkofil elementlar, ya'ni tabiiy sulfidlar, selenidlar, telluridlar hosil bo'lishiga moyil bo'lgan kimyoviy elementlar bilan birga issiq er osti suvlarida migratsiya bilan tavsiflanadi. sulfo tuzlari va ba'zan mahalliy holatda topiladi. Bundan tashqari, kadmiy gidrotermal konlarda to'plangan. Vulkanik jinslar kadmiyga ancha boy, tarkibida 1 kg ga 0,2 mg gacha kadmiy bor; cho'kindi jinslar orasida gil qirq sakkizinchi elementga eng boy - 0,3 mg / kg gacha (taqqoslash uchun ohaktoshlarda kadmiy 0,035 mg / kg, qumtoshlarda - 0,03 mg / kg mavjud). Tuproqdagi kadmiyning o'rtacha miqdori 0,06 mg/kg ni tashkil qiladi.
Shuningdek, bu noyob metall suvda - erigan shaklda (sulfat, xlorid, kadmiy nitrat) va organo-mineral komplekslarning bir qismi sifatida suspenziyada mavjud. Tabiiy sharoitda kadmiy er osti suvlariga rangli metallar rudalarini yuvish natijasida, shuningdek, suv o'simliklari va uni to'plashga qodir organizmlarning parchalanishi natijasida kiradi. 20-asr boshidan tabiiy suvlarning kadmiy bilan antropogen ifloslanishi kadmiyning suv va tuproqqa kirishining asosiy omiliga aylandi. Suvdagi kadmiyning tarkibiga muhitning pH darajasi (ishqoriy muhitda kadmiy gidroksid shaklida cho'kadi), shuningdek sorbsiya jarayonlari sezilarli darajada ta'sir qiladi. Xuddi shu antropogen sababga ko'ra havoda kadmiy ham mavjud.
Qishloq joylarda havodagi kadmiy miqdori 0,1-5,0 ng/m3 (1 ng yoki 1 nanogram = 10-9 gramm), shaharlarda 2-15 ng/m3, sanoat hududlarida 15 dan 150 ng gacha. /m3. Kadmiy asosan issiqlik elektr stansiyalarida yoqiladigan ko'plab ko'mirlarda ushbu element bo'lganligi sababli atmosfera havosiga chiqariladi. Havodan to'planib, kadmiy suv va tuproqqa kiradi. Tuproqdagi kadmiy miqdorining ko'payishi mineral o'g'itlardan foydalanish bilan osonlashadi, chunki ularning deyarli barchasida bu metallning kichik aralashmalari mavjud. Suv va tuproqdan kadmiy o'simliklar va tirik organizmlarga kiradi va keyinchalik oziq-ovqat zanjiri bo'ylab odamlarga "ta'minlanishi" mumkin.
Kadmiyning o'ziga xos minerallari bor: gaulit, otavit CdCO3, montemponit CdO (tarkibida 87,5% Cd), grenokit CdS (77,8% Cd), ksantoxroit CdS(H2O)x (77,2% Cd) kadmoselit CdSe (47% Cd). Biroq, ular o'zlarining konlarini hosil qilmaydi, lekin kadmiyning sanoat ishlab chiqarishining asosiy manbai bo'lgan rux, mis, qo'rg'oshin va polimetall rudalarida (50 dan ortiq) aralashmalar sifatida mavjud. Bundan tashqari, asosiy rolni rux rudalari o'ynaydi, bu erda kadmiy konsentratsiyasi 0,01 dan 5% gacha (sfalerit ZnS tarkibida). Ko'p hollarda sfaleritdagi kadmiy miqdori 0,4 - 0,6% dan oshmaydi. Kadmiy galenada (0,005 - 0,02%), stannitda (0,003 - 0,2%), piritda (0,02% gacha), xalkopiritda (0,006 - 0,12%) to'planadi, bu sulfidlardan kadmiy olinadi.
Kadmiy o'simliklarda (asosan zamburug'larda) va tirik organizmlarda (ayniqsa suvda) to'planishi mumkin, shuning uchun kadmiyni dengiz cho'kindi jinslari - slanetslarda (Mansfeld, Germaniya) topish mumkin.
Ilova
Kadmiyning asosiy iste'molchisi kimyoviy oqim manbalarini ishlab chiqarishdir: nikel-kadmiy va kumush-kadmiy batareyalari, zaxira akkumulyatorlardagi qo'rg'oshin-kadmiy va simob-kadmiy xujayralari, oddiy Weston xujayralari. Sanoatda ishlatiladigan kadmiy nikel batareyalari (AKN) boshqa kimyoviy oqim manbalari orasida eng mashhurlaridan biridir.
Bunday batareyalarning salbiy plitalari faol modda sifatida shimgichli kadmiyli temir to'rlardan yasalgan va ijobiy plitalar nikel oksidi bilan qoplangan. Elektrolit o'yuvchi kaliy eritmasi (kaliy gidroksid). Nikel-kadmiy gidroksidi batareyalar qo'rg'oshin kislotali akkumulyatorlarga qaraganda ancha ishonchli. Kadmiydan foydalanadigan kimyoviy oqim manbalari uzoq xizmat muddati, barqaror ishlash va yuqori elektr xususiyatlari bilan ajralib turadi. Bundan tashqari, ushbu batareyalarni zaryadlash bir soatdan kamroq vaqtni oladi! Biroq, AKN ni to'liq dastlabki zaryadsiz holda qayta zaryadlash mumkin emas va bunda ular, albatta, metall gidridli batareyalardan kam.
Kadmiyni qo'llashning yana bir keng sohasi - bu metallarga himoya antikorozif qoplamalarni cho'ktirish (kadmiy qoplamasi). Kadmiy qoplamasi temir va po'lat mahsulotlarini atmosfera korroziyasidan ishonchli himoya qiladi. Ilgari kadmiy qoplamasi metallni eritilgan kadmiyga botirish orqali amalga oshirilgan, zamonaviy jarayon faqat elektroliz orqali amalga oshiriladi. Kadmiy qoplamasi samolyotlar, kemalar, shuningdek, tropik iqlim sharoitida ishlash uchun mo'ljallangan qismlar va mexanizmlarning eng muhim qismlariga qo'llaniladi.
Ma'lumki, rux va kadmiyning ba'zi xususiyatlari o'xshash, ammo kadmiy qoplamasi galvanizli qoplamaga nisbatan ma'lum afzalliklarga ega: birinchidan, u korroziyaga nisbatan ancha chidamli, ikkinchidan, uni tekis va silliq qilish osonroq. Bundan tashqari, sinkdan farqli o'laroq, kadmiy gidroksidi muhitda barqarordir. Kadmiy qalay juda keng qo'llaniladi, ammo kadmiy qoplamasidan foydalanish qat'iyan taqiqlangan soha mavjud - bu oziq-ovqat sanoati. Bu kadmiyning yuqori toksikligi bilan bog'liq.
Ma'lum bir nuqtaga qadar kadmiy qoplamalarining tarqalishi boshqa sababga ko'ra cheklangan edi - kadmiy po'lat qismga elektrolitik tarzda qo'llanilganda, elektrolit tarkibidagi vodorod metallga kirib borishi mumkin va ma'lumki, bu element vodorodning mo'rtlashishiga olib keladi. yuk ostida metallni kutilmagan tarzda yo'q qilishga olib keladigan yuqori quvvatli po'latlar . Muammoni SSSR Fanlar akademiyasining Fizikaviy kimyo instituti sovet olimlari hal qilishdi. Ma'lum bo'lishicha, titanning arzimas qo'shilishi (kadmiyning ming atomiga bitta titan atomi) kadmiy qoplangan po'lat qismini vodorodning mo'rtlashishidan himoya qiladi, chunki titan qoplama jarayonida po'latdan barcha vodorodni o'zlashtiradi.
Kadmiyning jahon ishlab chiqarishining o'ndan bir qismi qotishma ishlab chiqarishga sarflanadi. Past erish nuqtasi kadmiyning past erituvchi qotishmalarda keng qo'llanilishining sabablaridan biridir. Bu, masalan, 12,5% kadmiy o'z ichiga olgan yog'och qotishmasi. Bunday qotishmalar lehim sifatida, nozik va murakkab quymalarni olish uchun material sifatida, avtomatik yong'inga qarshi tizimlarda, shishani metall bilan lehimlash uchun ishlatiladi. Kadmiyni o'z ichiga olgan lehimlar harorat o'zgarishiga juda chidamli.
Kadmiy qotishmalarining yana bir ajralib turadigan xususiyati ularning yuqori ishqalanishga qarshi xususiyatlaridir. Shunday qilib, 99% kadmiy va 1% nikel o'z ichiga olgan qotishma avtomobil, samolyot va dengiz dvigatellarida ishlaydigan podshipniklarni ishlab chiqarish uchun ishlatiladi. Kadmiy kislotalarga, shu jumladan moylash materiallari tarkibidagi organik kislotalarga etarlicha chidamli bo'lmaganligi sababli, kadmiy asosidagi yotqizish qotishmalari indiy bilan qoplangan. Misni kadmiyning kichik qo'shimchalari (1% dan kam) bilan qotishma elektr transport liniyalarida aşınmaya bardoshli simlarni yasash imkonini beradi. Kadmiyning bunday arzimas qo'shimchalari misning mustahkamligi va qattiqligini sezilarli darajada oshirishi mumkin, deyarli uning elektr xususiyatlarini yomonlashtirmasdan. Kadmiy amalgam (kadmiyning simobdagi eritmasi) stomatologiyada tish plombalarini ishlab chiqarish uchun ishlatiladi.
XX asrning 40-yillarida kadmiy yangi rolga ega bo'ldi - ular undan yadroviy reaktorlarning boshqaruv va favqulodda tayoqchalarini yasashni boshladilar. Kadmiyning tezda strategik materialga aylanishining sababi shundaki, u termal neytronlarni juda yaxshi singdiradi. Ammo "atom davri" boshidagi birinchi reaktorlar faqat termal neytronlarda ishlagan. Keyinchalik ma'lum bo'ldiki, tez neytron reaktorlari energiya uchun ham, yadro yoqilg'isini olish uchun ham ko'proq istiqbolli - 239Pu va kadmiy tez neytronlarga qarshi kuchsiz, ularni kechiktirmaydi. Termal neytron reaktorlari davrida kadmiy o'zining dominant rolini yo'qotib, bor va uning birikmalariga (aslida, ko'mir va grafit) o'rnini bosdi.
Kadmiyning 20% ga yaqini (aralashmalar shaklida) noorganik rang beruvchi moddalar ishlab chiqarish uchun ishlatiladi. Kadmiyum sulfid CdS - ilgari kadmiy sariq deb ataladigan muhim mineral bo'yoq. 20-asrning boshlarida kadmiy sariqini limon sariqidan to'q sariq ranggacha bo'lgan oltita rangda olish mumkinligi ma'lum edi. Olingan bo'yoqlar zaif gidroksidi va kislotalarga chidamli bo'lib, vodorod sulfidiga mutlaqo sezgir emas.
CdS asosidagi bo'yoqlar ko'plab sohalarda - bo'yash, poligrafiya, chinni bo'yashda ishlatilgan, ular yo'lovchi vagonlarini qoplagan, ularni lokomotiv tutunidan himoya qilgan. Kadmiy sulfidli bo'yoqlar to'qimachilik va sovun sanoatida ishlatilgan. Biroq, hozirgi vaqtda ancha qimmat kadmiy sulfidi ko'pincha arzonroq bo'yoqlar bilan almashtiriladi - kadmopon (kadmiy sulfidi va bariy sulfat aralashmasi) va sink-kadmiy litopon (kadmopon tarkibiga o'xshash, shuningdek rux sulfid).
Qizil bo'yoq sifatida yana bir kadmiy birikmasi, kadmiy selenid CdSe ishlatiladi. Biroq, kadmiy birikmalari nafaqat bo'yoqlar ishlab chiqarishda o'z qo'llanilishini topdi - kadmiy sulfid, masalan, samaradorligi taxminan 10-16% ni tashkil etadigan kino quyosh xujayralari ishlab chiqarish uchun ham qo'llaniladi. Bundan tashqari, CdS juda yaxshi termoelektrik material bo'lib, u yarimo'tkazgichlar va fosforlarning tarkibiy qismi sifatida ishlatiladi. Ba'zida kadmiy kriyojenik texnologiyada qo'llaniladi, bu uning maksimal issiqlik o'tkazuvchanligi (boshqa metallarga nisbatan) mutlaq nolga yaqin (vakuum) bilan bog'liq.
Ishlab chiqarish
Kadmiyning asosiy "etkazib beruvchilari" sink, mis-sink va qo'rg'oshin-rux rudalarini qayta ishlashning qo'shimcha mahsulotidir. Kadmiyning tabiiy minerallariga kelsak, kadmiy olishda yagona qiziqish uyg'otadigan yagona narsa bu "kadmiy aralashmasi" deb ataladigan greenockite CdS. Grinokit rux rudalarini oʻzlashtirish jarayonida faerit bilan birga qazib olinadi. Qayta ishlash jarayonida kadmiy jarayonning qo'shimcha mahsulotlarida to'planadi va u erdan qayta tiklanadi.
Polimetall rudalarni qayta ishlashda, avval aytib o'tilganidek, kadmiy ko'pincha sink ishlab chiqarishning qo'shimcha mahsulotidir. Bular mis-kadmiyli keklar (rux changi ta'sirida sink sulfat ZnSO4 eritmalarini tozalash natijasida olingan metall cho'kmalari), ular tarkibida 2 dan 12% gacha Cd yoki pussierlar (ruxni distillash paytida hosil bo'lgan uchuvchi fraktsiyalar) mavjud. , 0,7 dan 1,1% gacha kadmiyni o'z ichiga oladi.
Qirq sakkizinchi elementning eng boylari sinkni rektifikatsiya qilish jarayonida olingan kontsentratlar bo'lib, ular tarkibida 40% gacha kadmiy bo'lishi mumkin. Mis-kadmiyli keklardan va kadmiy miqdori yuqori bo'lgan boshqa mahsulotlardan, odatda, bir vaqtning o'zida havoni shamollatish bilan sulfat kislota H2SO4 bilan yuviladi. Jarayon oksidlovchi vosita - marganets rudasi yoki elektroliz vannalaridan qayta ishlangan marganets shlami ishtirokida amalga oshiriladi.
Bundan tashqari, kadmiy qoʻrgʻoshin va mis eritish zavodlarining changidan olinadi (uning tarkibida mos ravishda 0,5—5% va 0,2—0,5% kadmiy boʻlishi mumkin). Bunday hollarda chang odatda konsentrlangan H2SO4 sulfat kislota bilan ishlanadi, so'ngra hosil bo'lgan kadmiy sulfat suv bilan yuviladi. Kadmiy shimgichni hosil bo'lgan kadmiy sulfat eritmasidan rux changi ta'sirida cho'kadi, shundan so'ng u sulfat kislotada eritiladi va eritma natriy karbonat Na2CO3 yoki sink oksidi ZnO ta'sirida aralashmalardan tozalanadi, undan foydalanish ham mumkin. ion almashinuvi usullari.
Kadmiy metall alyuminiy katodlarda elektroliz yoki rux bilan qaytarilishi (CdSO4 eritmalaridan kadmiy oksidi CdO ni rux bilan almashtirish) markazdan qochma separator reaktorlari yordamida ajratib olinadi. Kadmiy metallini tozalash odatda metallni gidroksidi qatlami ostida eritishdan iborat (rux va qo'rg'oshinni olib tashlash uchun), Na2CO3 dan foydalanish mumkin; eritmani alyuminiy (nikelni olib tashlash uchun) va ammoniy xlorid NH4Cl (talliyni olib tashlash uchun) bilan ishlov berish.
Yuqori tozalikdagi kadmiy elektrolitni oraliq tozalash bilan elektrolitik tozalash orqali olinadi, bu ion almashinuvi yoki ekstraktsiya yordamida amalga oshiriladi; metallni rektifikatsiya qilish (odatda pasaytirilgan bosim ostida), zonali eritish yoki boshqa kristallanish usullari. Yuqoridagi tozalash usullarini birlashtirganda, og'irligi bo'yicha atigi 10-5% asosiy aralashmalar (rux, mis va boshqalar) tarkibidagi metall kadmiyni olish mumkin. Bundan tashqari, kadmiyni tozalash uchun suyuq kadmiyda elektrotransfer, natriy gidroksid NaOH eritmasida elektrotozalash va amalgam elektroliz usullaridan foydalanish mumkin. Zonali eritish elektrotransfer bilan birlashtirilganda, tozalash bilan birga kadmiy izotoplarini ajratish mumkin.
Dunyoda kadmiy ishlab chiqarish ko'p jihatdan sink ishlab chiqarish ko'lami bilan bog'liq va so'nggi o'n yilliklarda sezilarli darajada oshdi - 2006 yil ma'lumotlariga ko'ra, dunyoda 21 ming tonnaga yaqin kadmiy ishlab chiqarilgan bo'lsa, 1980 yilda bu ko'rsatkich atigi 15 ming tonnani tashkil etgan. . Kadmiy iste'molining o'sishi hozir ham davom etmoqda. Ushbu metallning asosiy ishlab chiqaruvchilari Osiyo mamlakatlari: Xitoy, Yaponiya, Koreya, Qozog'iston. Ular jami ishlab chiqarishning 12 ming tonnasini tashkil qiladi.
Rossiya, Kanada va Meksika ham kadmiyning asosiy ishlab chiqaruvchilari hisoblanishi mumkin. Kadmiyni ommaviy ishlab chiqarishning Osiyoga siljishi Yevropada kadmiydan foydalanishning qisqarganligi, Osiyo mintaqasida esa, aksincha, nikel-kadmiy elementlariga talab ortib borayotganligi bilan izohlanadi. ko'pchilik ishlab chiqarishni Osiyo mamlakatlariga o'tkazish uchun.
Jismoniy xususiyatlar
Kadmiy kumushsimon oq metall bo'lib, yangi kesilganda ko'k rangda porlaydi, ammo himoya oksidi plyonkasi hosil bo'lganligi sababli havoda xiralashadi. Kadmiy juda yumshoq metall - qalaydan qattiqroq, lekin sinkdan yumshoqroq, uni pichoq bilan kesish mumkin. Yumshoqlik bilan birgalikda kadmiy sanoat uchun egiluvchanlik va egiluvchanlik kabi muhim fazilatlarga ega - u choyshablarga mukammal o'raladi va simga tortiladi va hech qanday muammosiz sayqallanishi mumkin.
80 o C dan yuqori qizdirilganda kadmiy o'zining elastikligini yo'qotadi va shunchalik ko'pki, uni osonlikcha maydalash mumkin. Mohs bo'yicha kadmiyning qattiqligi ikkiga teng, Brinell bo'yicha (tavlangan namuna uchun) 200-275 MPa. Kuchlanish kuchi 64 MN/m2 yoki 6,4 kgf/mm2, nisbiy cho'zilish 50% (20 o C da), oqish quvvati 9,8 MPa.
Kadmiy olti burchakli yopiq kristall panjaraga ega bo'lib, davrlar: a = 0,296 nm, c = 0,563 nm, c/a nisbati = 1,882, z = 2, kristall panjara energiyasi 116 mkJ/kmol. Fazo guruhi S6/mmmm, atom radiusi 0,156 nm, ion radiusi Cd2+ 0,099 nm, atom hajmi 13,01∙10-6 m3/mol.
Sof kadmiydan yasalgan novda, egilganida, qalay kabi zaif yoriq ("qalay qichqiriq") chiqaradi - bu metall mikrokristallarning bir-biriga ishqalanishi, ammo metalldagi har qanday aralashmalar bu ta'sirni yo'q qiladi. Umuman olganda, fizik, kimyoviy va farmakologik xususiyatlariga ko'ra, kadmiy og'ir metallar guruhiga kiradi, rux va simob bilan eng o'xshashliklarga ega.
Kadmiyning erish nuqtasi (321,1 o C) ancha past va uni qo'rg'oshin (327,4 o C) yoki talliy (303,6 o C) erish nuqtalari bilan solishtirish mumkin. Biroq, u bir qator xossalari bo'yicha o'xshash metallarning erish nuqtalaridan farq qiladi - ruxnikidan past (419,5 o C), lekin qalaynikidan (231,9 o C) yuqori. Kadmiyning qaynash nuqtasi ham past - atigi 770 o C, bu juda qiziq - qo'rg'oshin, boshqa metallar singari, erish va qaynash nuqtalari o'rtasida katta farq bor.
Shunday qilib, qo'rg'oshinning qaynash nuqtasi (1745 o C) erish nuqtasidan 5 baravar yuqori, qaynash nuqtasi 2620 o C bo'lgan qalay esa erish nuqtasidan 11 baravar yuqori! Shu bilan birga, kadmiyga o'xshash sink, 419,5 o S erish nuqtasida faqat 960 o C qaynash nuqtasiga ega. Kadmiy uchun termal kengayish koeffitsienti 29,8 * 10-6 (25 o C haroratda) ga teng. . 0,519 K dan pastda kadmiy supero'tkazgichga aylanadi. 0 o C da kadmiyning issiqlik o'tkazuvchanligi 97,55 Vt / (m * K) yoki 0,233 kal / (sm * sek * o C) ni tashkil qiladi.
Kadmiyning solishtirma issiqlik sig'imi (25 o S haroratda) 225,02 j/(kg * K) yoki 0,055 kal/(g * o S) ga teng. 0 o C dan 100 o S gacha bo'lgan harorat oralig'ida kadmiyning elektr qarshiligining harorat koeffitsienti 4,3 * 10-3, kadmiyning solishtirma elektr qarshiligi (20 o S haroratda) 7,4 * 10-8 ohm * ni tashkil qiladi. m (7,4 * 10-6 ohm * sm). Kadmiy diamagnit, magnit sezuvchanligi -0,176,10-9 (20 o S haroratda). Standart elektrod potensiali -0,403 V. Kadmiyning elektromanfiyligi 1,7 ga teng. Termal neytronlarni tutib olishning samarali kesimi 2450-2900-10 ~ 28 m2 ni tashkil qiladi. Elektronlarning ish funktsiyasi = 4,1 eV.
Kadmiyning zichligi (xona haroratida) 8,65 g/sm3 ni tashkil qiladi, bu kadmiyni og'ir metallar qatoriga kiritish imkonini beradi. N. Reimers tasnifiga ko'ra, zichligi 8 g / sm3 dan ortiq bo'lgan metallarni og'ir deb hisoblash kerak. Shunday qilib, og'ir metallarga Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg kiradi. Va kadmiy qo'rg'oshindan (zichligi 11,34 g / sm3) yoki simobdan (13,546 g / sm3) engilroq bo'lsa ham, qalaydan (7,31 g / sm3) og'irroqdir.
Kimyoviy xossalari
Kimyoviy birikmalarda kadmiy har doim 2 valentlikni namoyon qiladi (tashqi elektron qatlamining konfiguratsiyasi 5s2) - haqiqat shundaki, ikkinchi guruhning ikkilamchi kichik guruhi elementlarining atomlari (sink, kadmiy, simob), elementlarning atomlari kabi. mis kichik guruhining ikkinchi tashqi elektron qatlamining d-pastki sathi to'liq to'ldirilgan. Biroq, sink kichik guruhining elementlari uchun bu pastki daraja allaqachon ancha barqaror va undan elektronlarni olib tashlash juda katta energiya sarfini talab qiladi. Sink kichik guruhi elementlarini mis guruhining elementlariga yaqinlashtiradigan yana bir xarakterli xususiyat ularning murakkab shakllanishga moyilligidir.
Yuqorida aytib o'tilganidek, kadmiy rux va simob bilan davriy tizimning bir guruhida joylashgan bo'lib, ular o'rtasida oraliq pozitsiyani egallaydi, shuning uchun bu barcha elementlarning bir qator kimyoviy xossalari o'xshashdir. Masalan, bu metallarning oksidlari va sulfidlari suvda amalda erimaydi.
Quruq havoda kadmiy barqaror, ammo nam havoda CdO oksidining ingichka plyonkasi metall yuzasida asta-sekin hosil bo'lib, metallni keyingi oksidlanishdan himoya qiladi. Kuchli akkorlanish bilan kadmiy yonib ketadi va kadmiy oksidiga aylanadi - och jigarrangdan to'q jigarrang ranggacha bo'lgan kristalli kukun (ranglar gamutidagi farq qisman zarrachalar hajmiga bog'liq, lekin ko'p jihatdan kristall panjara nuqsonlari natijasidir). ), CdO zichligi 8,15 g / sm3; 900 o C dan yuqori kadmiy oksidi uchuvchan, 1570 o C da esa butunlay sublimatsiyalanadi. Kadmiy bug'lari suv bug'lari bilan reaksiyaga kirishib, vodorodni chiqaradi.
Kislotalar kadmiy bilan reaksiyaga kirishib, bu metalning tuzlarini hosil qiladi. Nitrat kislota HNO3 kadmiyni oson eritadi, azot oksidi esa ajralib chiqadi va nitrat hosil bo'ladi, bu esa Cd (NO3) 2 * 4H2O gidratini beradi. Boshqa kislotalardan - xlorid va suyultirilgan sulfat - kadmiy vodorodni asta-sekin siqib chiqaradi, bu kuchlanishlar qatorida kadmiy ruxdan uzoqroq, lekin vodoroddan oldinda ekanligi bilan izohlanadi. Ruxdan farqli o'laroq, kadmiy gidroksidi eritmalar bilan o'zaro ta'sir qilmaydi. Kadmiy ammiakli selitra NH4NO3 ni konsentrlangan eritmalarda ammoniy nitrit NH4NO2 ga kamaytiradi.
Erish nuqtasidan yuqorida kadmiy to'g'ridan-to'g'ri galogenlar bilan birlashadi va rangsiz birikmalar - kadmiy galogenidlarini hosil qiladi. CdCl2, CdBr2 va CdI2 suvda juda oson eriydi (20 o C da massasi 53,2%), etanolda to'liq erimaydigan kadmiy ftorid CdF2 (20 o C da massa bo'yicha 4,06%) ancha qiyin. Uni ftorning metallga yoki vodorod ftoridning kadmiy karbonatga ta'sirida olish mumkin. Kadmiy xlorid kadmiyni konsentrlangan xlorid kislota bilan reaksiyaga kiritish yoki metallni 500 o S da xlorlash orqali olinadi.
Kadmiy bromid metallni bromlash yoki vodorod bromidning kadmiy karbonatga ta'sirida olinadi. Qizdirilganda kadmiy oltingugurt bilan reaksiyaga kirishib, suvda va suyultirilgan kislotalarda erimaydigan CdS sulfidni (limon sariqdan to‘q sariq ranggacha) hosil qiladi. Kadmiy fosfor va mishyak bilan birlashganda, surma - kadmiy antimonid bilan mos ravishda Cd3P2 va CdAs2 kompozitsiyalarining fosfidlari va arsenidlari hosil bo'ladi. Kadmiy vodorod, azot, uglerod, kremniy va bor bilan reaksiyaga kirishmaydi. Isitishda oson parchalanadigan CdH2 gidrid va Cd3N2 nitridi bilvosita olingan.
Kadmiy tuzlarining eritmalari gidroliz natijasida kislotali bo'lib, o'yuvchi ishqorlar ulardan oq gidroksid Cd (OH) 2 cho'kadi. Juda konsentrlangan gidroksidi eritmalar ta'sirida u gidroksokadmatlarga, masalan, Na2 ga aylanadi. Kadmiy gidroksid ammiak bilan reaksiyaga kirishib, eruvchan komplekslarni hosil qiladi:
Cd(OH)2 + 6NH3 * H2O → (OH)2 + 6H2O
Bundan tashqari, Cd(OH)2 gidroksidi siyanidlar ta'sirida eritmaga kiradi. 170 o dan yuqori CdO ga parchalanadi. Kadmiy gidroksidining suvli eritmadagi vodorod periks (peroksid) bilan o'zaro ta'siri turli tarkibdagi peroksidlar (peroksidlar) hosil bo'lishiga olib keladi.
http://i-think.ru/ veb-saytidan materiallardan foydalanish
ADR 6.1
Zaharli moddalar (zahar)
Nafas olish, teri bilan aloqa qilish yoki yutish orqali zaharlanish xavfi. Suv muhiti yoki kanalizatsiya tizimi uchun xavfli (simobni tashish uchun ADR xavfli yuklarga o'xshash, kamroq xavfli)
Favqulodda chiqish niqobidan foydalaning
Oq olmos, ADR raqami, qora bosh suyagi va suyaklar
ADR baliq
Atrof-muhit uchun xavfli moddalar (ekologiya, shu jumladan erituvchi, eriydigan, chang va oqimli materiallar)
Suv muhiti yoki kanalizatsiya tizimi uchun xavfli (simobni tashish uchun ADR xavfli yuklarga o'xshash, kamroq xavfli)