Прямым ингибитором ренина является. Лекарства от гипертонии нового поколения: список препаратов. Что такое гипертония
Для цитирования:
Леонова М.В. Новые и перспективные лекарственные препараты, блокирующие ренин-ангиотензин-альдостероновую систему // РМЖ. Медицинское обозрение. 2013. №17. С. 886
Роль ренин-ангиотензин-альдостероновой системы (РААС) в развитии артериальной гипертонии (АГ) и других сердечно-сосудистых заболеваний в настоящее время считается главенствующей. В кардиоваскулярном континууме АГ находится среди факторов риска, а главным патофизиологическим механизмом поражения сердечно-сосудистой системы является ангиотензин II (АТII). АТII является ключевым компонентом РААС - эффектором, который реализует вазоконстрикцию, задержку натрия, активацию симпатической нервной системы, клеточную пролиферацию и гипертрофию, развитие оксидативного стресса и процессов воспаления сосудистой стенки.
В настоящее время уже получили развитие и широкое клиническое применение два класса препаратов, блокирующих РААС, - ингибиторы АПФ и блокаторы рецепторов АТII. Фармакологические и клинические эффекты этих классов имеют отличия. АПФ является пептидазой из группы цинк-металлопротеиназ, которая метаболизирует АТI, АТ1-7, брадикинин, субстанцию Р и многие другие пептиды . Механизм действия ингибиторов АПФ главным образом связан с предотвращением образования АТII, что способствует вазодилатации, натрийурезу и устраняет провоспалительный, пролиферативный и другие эффекты АТII. Кроме того, ингибиторы АПФ препятствуют деградации брадикинина и повышают его уровень. Брадикинин - мощный вазодилататор, он потенцирует натрийурез, а главное - обладает кардиопротективным (предотвращает гипертрофию, уменьшает ишемическое повреждение миокарда, улучшает коронарное кровоснабжение) и вазопротективным действием, улучшая эндотелиальную функцию. Вместе с тем, высокий уровень брадикинина - причина развития ангионевротического отека, что является одним из серьезных недостатков ингибиторов АПФ, которые значительно повышают уровень кининов.
Ингибиторам АПФ не всегда удается полностью блокировать образование АТII в тканях. В настоящее время установлено, что в его превращении в тканях могут участвовать и другие ферменты, не связанные с АПФ, прежде всего эндопептидазы, на которые действие ингибиторов АПФ не распространяется. В результате ингибиторы АПФ не могут полностью устранить эффекты АТII, что может быть причиной их недостаточной эффективности.
Решению этой проблемы способствовало открытие рецепторов АТII и первого класса препаратов, селективно блокирующих АТ1-рецепторы. Через АТ1-рецепторы реализуются неблагоприятные эффекты АТII: вазоконстрикция, секреция альдостерона, вазопрессина, норадреналина, задержка жидкости, пролиферация гладкомышечных клеток и кардиомиоцитов, активация САС, а также механизм отрицательной «обратной связи» - образование ренина. АТ2-рецепторы выполняют «полезные» функции, такие как вазодилатация, процессы репарации и регенерации, антипролиферативное действие, дифференцировка и развитие эмбриональных тканей. Клинические эффекты блокаторов рецепторов АТII опосредованы через устранение «вредных» эффектов АТII на уровне АТ1-рецепторов, что обеспечивает более полное блокирование неблагоприятных эффектов АТII и усиление влияния АТII на АТ2-рецепторы, что дополняет вазодилатирующий и антипролиферативный эффекты. Блокаторы рецепторов АТII обладают специфичным действием на РААС, не вмешиваясь в кининовую систему. Отсутствие влияния на активность кининовой системы, с одной стороны, уменьшает выраженность нежелательных эффектов (кашель, ангионевротический отек), но, с другой, лишает блокаторы рецепторов АТII важного антиишемического и вазопротективного действия, что отличает их от ингибиторов АПФ. По этой причине показания к применению блокаторов рецепторов АТII в большинстве повторяют показания к назначению ингибиторов АПФ, делают их альтернативными препаратами.
Несмотря на внедрение блокаторов РААС в широкую практику лечения АГ, проблемы улучшения исходов и прогноза остаются. К ним относятся: возможность улучшения контроля АД в популяции, эффективность лечения резистентной АГ, возможности дальнейшего снижения риска сердечно-сосудистых заболеваний.
Поиск новых путей воздействия на РААС активно продолжается; изучаются другие тесно взаимодействующие системы и создаются препараты с множественным механизмом действия, такие как ингибиторы АПФ и нейтральной эндопептидазы (НЭП), ингибиторы эндотелин-превращающего фермента (ЭПФ) и НЭП, ингибиторы АПФ/НЭП/ЭПФ .
Ингибиторы вазопептидаз
К вазопептидазам кроме известного АПФ относятся еще 2 других цинк-металлопротеиназы - неприлизин (нейтральная эндопептидаза, НЭП) и эндотелин-превращающий фермент, которые также могут быть мишенями для фармакологического воздействия.
Неприлизин - фермент, вырабатываемый эндотелием сосудов и участвующий в деградации натрийуретического пептида, а также брадикинина.
Система натрийуретического пептида представлена тремя разными изоформами: предсердным натрий-уретическим пептидом (А-тип), мозговым натрийуретическим пептидом (В-тип), которые синтезируются в предсердии и миокарде, и эндотелиальным С-пептидом, которые по своим биологическим функциям являются эндогенными ингибиторами РААС и эндотелина-1 (табл. 1) . Кардиоваскулярные и ренальные эффекты натрийуретического пептида заключаются в снижении АД через влияние на сосудистый тонус и водноэлектролитный баланс, а также в антипролиферативном и антифибротическом действии на органы-мишени. По самым последним данным, система натрийуретического пептида участвует в метаболической регуляции: окислении липидов, образовании и дифференцировке адипоцитов, активации адипонектина, секреции инсулина и толерантности к углеводам, что может обеспечивать защиту от развития метаболического синдрома .
К настоящему времени стало известно, что развитие сердечно-сосудистых заболеваний ассоциируется с дизрегуляцией системы натрийуретического пептида. Так, при АГ наблюдается дефицит натрийуретического пептида, приводящий к солечувствительности и нарушению натрийуреза; при хронической сердечной недостаточности (ХСН) на фоне дефицита наблюдается аномалия функционирования гормонов системы натрийуретического пептида .
Поэтому для потенцирования системы натрийуретического пептида с целью достижения дополнительного гипотензивного и протективных кардиоренальных эффектов возможно применение ингибиторов НЭП. Ингибирование неприлизина приводит к потенцированию натрийуретического, диуретического и вазодилатирующего эффектов эндогенного натрийуретического пептида и в результате - к снижению АД. Однако НЭП участвует в деградации и других вазоактивных пептидов, в частности АТI, АТII и эндотелина-1. Поэтому баланс эффектов воздействия на сосудистый тонус ингибиторов НЭП вариабельный и зависит от преобладания констрикторных и дилатирующих влияний. При длительном применении антигипертензивное действие ингибиторов неприлизина выражено слабо вследствие компенсаторной активации образования АТII и эндотелина-1 .
В этой связи сочетание эффектов ингибиторов АПФ и ингибиторов НЭП может существенно потенцировать гемодинамические и антипролиферативные эффекты в результате комплементарного механизма действия, что привело к созданию препаратов с двойным механизмом действия, объединенных названием - ингибиторы вазопептидаз (табл. 2, рис. 1) .
Известные ингибиторы вазопептидаз характеризуются разной степенью селективности к НЭП/АПФ: омапатрилат - 8,9:0,5; фазидоприлат - 5,1:9,8; сампатрилат - 8,0:1,2 . В результате ингибиторы вазопептидаз получили гораздо большие возможности в достижении гипотензивного эффекта вне зависимости от активности РААС и уровня задержки натрия и в органопротекции (регресс гипертрофии, альбуминурии, жесткости сосудов). Наиболее изученным в клинических исследованиях был омапатрилат, который показал более высокую гипотензивную эффективность в сравнении с ингибиторами АПФ, а у пациентов с ХСН приводил к увеличению фракции выброса и улучшению клинических исходов (исследования IMPRESS, OVERTURE), но без преимуществ перед ингибиторами АПФ .
Однако в крупных клинических исследованиях с применением омапатрилата была установлена более высокая частота развития ангионевротического отека в сравнении с ингибиторами АПФ. Известно, что частота развития ангионевротического отека при использовании ингибиторов АПФ составляет от 0,1 до 0,5% в популяции, из них 20% случаев являются жизнеугрожающими, что связано с многократным повышением концентраций брадикинина и его метаболитов . Результаты крупного многоцентрового исследования OCTAVE (n=25 302), которое было специально спланировано для изучения частоты развития ангионевротического отека, показало, что частота развития этого побочного эффекта на фоне лечения омапатрилатом превышает таковую в группе эналаприла - 2,17% против 0,68% (относительный риск 3,4) . Это объяснялось усилением влияния на уровень кининов при синергичном ингибировании АПФ и НЭП, связанным с ингибированием аминопептидазы Р, участвующей в деградации брадикинина .
Новый двойной ингибитор вазопептидаз, блокирующий АПФ/НЭП, - илепатрил, который имеет более высокую аффинность к АПФ в сравнении с НЭП . При изучении фармакодинамических эффектов илепатрила по влиянию на активность РААС и натрийуретического пептида у здоровых добровольцев было установлено, что препарат дозозависимо (в дозах 5 и 25 мг) и значимо (более 88%) подавляет АПФ в плазме крови продолжительностью более 48 ч вне зависимости от солечувствительности. Одновременно препарат значимо повышал активность ренина плазмы в течение 48 ч и уменьшал уровень альдостерона . Эти результаты показали выраженное и более продолжительное подавление РААС в отличие от ингибитора АПФ рамиприла в дозе 10 мг, что объяснялось более значимым тканевым действием илепатрила на АПФ и большей аффинностью к АПФ, и сопоставимую степень блокады РААС в сравнении с комбинацией 150 мг ирбесартана + 10 мг рамиприла. В отличие от действия на РААС, эффект илепатрила на натрийуретический пептид проявлялся кратковременным увеличением уровня его экскреции в период 4-8 ч после приема дозы 25 мг, что свидетельствует о меньшей и слабой аффинности к НЭП и отличает его от омапатрилата. Причем по уровню экскреции электролитов дополнительного натрийуретического действия в сравнении с рамиприлом или ирбесартаном у препарата нет, как впрочем, и у других ингибиторов вазопептидаз. Максимальное гипотензивное действие развивается через 6-12 ч после приема препарата, и снижение среднего АД составляет 5±5 и 10±4 мм рт.ст. при низкой и высокой солечувствительности соответственно . По фармакокинетическим характеристикам илепатрил представляет собой пролекарство с активным метаболитом, который быстро образуется с достижением максимальной концентрации через 1-1,5 ч и медленно элиминирует. В настоящее время проводятся клинические исследования III фазы.
Альтернативный путь к двойному подавлению РААС и НЭП представлен сочетанием блокады рецепторов АТII и НЭП (рис. 2) . Блокаторы рецепторов АТII не влияют на метаболизм кининов в отличие от ингибиторов АПФ, поэтому потенциально имеют меньший риск развития ангионевротических осложнений. В настоящее время проходит фазу III клинических исследований первый препарат - блокатор рецепторов АТII с эффектом ингибирования НЭП в соотношении 1:1 - LCZ696. Объединенная молекула препарата содержит валсартан и ингибитор НЭП (AHU377) в форме пролекарства . В крупном исследовании у больных с АГ (n=1328) препарат LCZ696 в дозах 200-400 мг показал преимущество в гипотензивном эффекте перед валсартаном в дозах 160-320 мг в виде дополнительного снижения АД на 5/3 и 6/3 мм рт.ст. . Гипотензивный эффект LCZ696 сопровождался более выраженным снижением пульсового АД: на 2,25 и 3,32 мм рт.ст. соответственно в дозах 200 и 400 мг, что в настоящее время рассматривается как положительный прогностический фактор по влиянию на жесткость сосудистой стенки и сердечно-сосудистые исходы. При этом изучение нейрогуморальных биомаркеров на фоне лечения LCZ696 показало увеличение уровня натрийуретического пептида при сопоставимой степени увеличения уровня ренина и альдостерона в сравнении с валсартаном. Переносимость у больных с АГ была хорошей, и случаев ангионевротического отека не было отмечено. В настоящее время завершено исследование PARAMOUMT у 685 пациентов с ХСН и ненарушенной ФВ . Результаты исследования показали, что LCZ696 быстрее и выраженнее снижает уровень NT-proBNP (первичная конечная точка - маркер повышения активности натрий-уретического пептида и неблагоприятного прогноза при ХСН) в сравнении с валсартаном, а также уменьшает размеры левого предсердия, что свидетельствует о регрессе его ремоделирования . Исследование у пациентов с ХСН и сниженной ФВ продолжается в настоящее время (исследование PARADIGM-HF).
Ингибиторы системы эндотелина
Система эндотелина играет важную роль в регуляции сосудистого тонуса и регионального кровотока. Среди трех известных изоформ эндотелин-1 является наиболее активным. Кроме известных вазоконстрикторных эффектов эндотелин стимулирует пролиферацию и синтез межклеточного матрикса, а также вследствие прямого воздействия на тонус почечных сосудов участвует в регуляции водно-электролитного гомеостаза. Эффекты эндотелина реализуются через взаимодействие со специфическими рецепторами А-типа и В-типа, функции которых взаимопротивоположны: через А-тип рецепторов происходит вазоконстрикция, а через В-тип - вазодилатация . В последние годы установлено, что рецепторы В-типа играют большую роль в клиренсе эндотелина-1, т.е. при блокаде этих рецепторов нарушается рецепторзависимый клиренс эндотелина-1 и увеличивается его концентрация . Кроме того, рецепторы В-типа участвуют в регуляции почечных эффектов эндотелина-1 и поддержании водно-электролитного гомеостаза, что имеет важное значение.
В настоящее время роль эндотелина доказана в развитии ряда заболеваний, в т.ч. АГ, ХСН, легочной гипертензии, хронических заболеваний почек; показана тесная связь между уровнем эндотелина и метаболическим синдромом, дисфункцией эндотелия и атерогенезом. С 1990-х гг. ведется поиск антагонистов рецепторов эндотелина, пригодных для клинического использования; уже известно 10 препаратов («сентаны») с разной степенью селективности к А/B-типу рецепторов . Первый неселективный антагонист рецепторов эндотелина - бозентан - в клиническом исследовании у больных с АГ показал гипотензивную эффективность, сопоставимую с таковой ингибитора АПФ эналаприла . Дальнейшие исследования эффективности применения антагонистов эндотелина при АГ показали их клиническую значимость в лечении резистентной АГ и при высоком сердечно-сосудистом риске. Эти данные были получены в двух крупных клинических исследованиях DORADO (n=379) и DORADO-АС (n=849), в которых пациентам с резистентной АГ добавлялся дарусентан к тройной комбинированной терапии . В исследовании DORADO у пациентов резистентная АГ сочеталась с хронической болезнью почек и протеинурией, в результате добавления дарусентана наблюдалось не только значительное снижение АД, но и уменьшение экскреции белка. Антипротеинурический эффект антагонистов рецепторов эндотелина был в последующем подтвержден в исследовании у пациентов с диабетической нефропатией при использовании авосентана . Однако в исследовании DORADO-АС преимуществ в дополнительном снижении АД перед препаратами сравнения и плацебо не было выявлено, что послужило поводом к прекращению дальнейших исследований. Кроме того, в 4 крупных исследованиях антагонистов эндотелина (бозентана, дарусентана, энрасентана) у пациентов с ХСН были получены противоречивые результаты, что объяснялось увеличением концентрации эндотелина-1 . Дальнейшее изучение антагонистов рецепторов эндотелина было приостановлено ввиду нежелательных эффектов, связанных с задержкой жидкости (периферические отеки, перегрузка объемом). Развитие этих эффектов связывают с воздействием антагонистов эндотелина на В-тип рецепторов, что изменило поиск препаратов, влияющих на систему эндотелина через другие пути; а антагонисты рецепторов эндотелина в настоящее время имеют только одно показание - лечение легочной гипертензии.
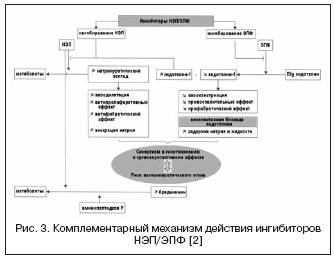
С учетом высокой значимости системы эндотелина в регуляции сосудистого тонуса ведется поиск другого механизма воздействия через вазопептидазу - ЭПФ, участвующий в образовании активного эндотелина-1 (рис. 3) . Блокирование ЭПФ и сочетание с ингибированием НЭП позволяют эффективно подавлять образование эндотелина-1 и потенцировать эффекты натрий-уретического пептида. Преимущества двойного механизма действия заключаются, с одной стороны, в предупреждении недостатков ингибиторов НЭП, связанных с возможной вазоконстрикцией, опосредованной активацией эндотелина, с другой, натрийуретическая активность ингибиторов НЭП позволяет компенсировать задержку жидкости, связанную с неселективной блокадой эндотелиновых рецепторов. Даглутрил является двойным ингибитором НЭП и ЭПФ, который находится во II фазе клинических исследований . В исследованиях показаны выраженные кардиопротективные эффекты препарата благодаря уменьшению ремоделирования сердца и сосудов, регрессу гипертрофии и фиброза.
Прямые ингибиторы ренина
Известно, что ингибиторы АПФ и блокаторы рецепторов АТII по механизму обратной связи повышают активность ренина, что является причиной ускользания эффективности блокаторов РААС. Ренин представляет собой самый первый этап каскада РААС; он вырабатывается юкстагломерулярными клетками почек. Ренин через ангиотензиноген способствует образованию АТII, вазоконстрикции и секреции альдостерона, а также регулирует механизмы обратной связи. Поэтому ингибирование ренина позволяет достичь более полной блокады системы РААС. Поиск ингибиторов ренина ведется с 1970-х гг.; долгое время не удавалось получить пер-оральную форму ингибиторов ренина ввиду их низкой биодоступности в ЖКТ (менее 2%). Первый прямой ингибитор ренина, пригодный для перорального применения, - алискирен - был зарегистрирован в 2007 г. Алискирен имеет низкую биодоступность (2,6%), большой период полувыведения (24-40 ч), внепочечный путь элиминации . Фармакодинамика алискирена связана с 80% уменьшением уровня АТII. В клинических исследованиях у пациентов с АГ алискирен в дозах 150-300 мг/сут приводил к снижению САД на 8,7-13 и 14,1-15,8 мм рт.ст. соответственно и ДАД - на 7,8-10,3 и 10,3-12,3 мм рт.ст. . Гипотензивный эффект алискирена наблюдался в разных подгруппах пациентов, включая больных с метаболическим синдромом, ожирением; по выраженности он был сопоставим с эффектом ингибиторов АПФ, блокаторов рецепторов АТII, а также отмечен аддитивный эффект в комбинации с валсартаном, гидрохлоротиазидом и амлодипином. В ряде клинических исследований были показаны органопротективные эффекты препарата: антипротеинурический эффект у пациентов с диабетической нефропатией (исследование AVOID, n=599) , регресс гипертрофии левого желудочка у пациентов с АГ (исследование ALLAY, n=465) . Так, в исследовании AVOID после 3-месячного лечения лозартаном в дозе 100 мг/сут и достижения целевого уровня АД (<130/80 мм рт.ст.) при компенсированном уровне гликемии (гликированный гемоглобин 8%) больных рандомизировали к приему алискирена в дозах 150-300 мг/сут или плацебо. Отмечено достоверное снижение индекса альбумин/креатинин в моче (первичная конечная точка) на 11% через 3 мес. и на 20% - через 6 мес. в сравнении с группой плацебо. В ночное время экскреция альбумина на фоне приема алискирена снизилась на 18%, а доля пациентов со снижением экскреции альбумина на 50% и более была вдвое большей (24,7% пациентов в группе алискирена против 12,5% в группе плацебо) . Причем нефропротективный эффект алискирена не был связан со снижением АД. Одним из объяснений выявленного нефропротективного эффекта у алискирена авторы считают полученные ранее в экспериментальных исследованиях на моделях диабета данные о способности препарата снижать количество рениновых и прорениновых рецепторов в почках, а также уменьшать профибротические процессы и апоптоз подоцитов, что обеспечивает более выраженный эффект в сравнении с эффектом ингибиторов АПФ . В исследовании ALLAY у пациентов с АГ и увеличением толщины миокарда ЛЖ (более 1,3 см по данным ЭхоКГ) применение алискирена ассоциировалось с одинаковой степенью регресса ИММЛЖ в сравнении с лозартаном и комбинацией алискирена с лозартаном: −5,7±10,6 , −5,4±10,8, −7,9±9,6 г/м2 соответственно. У части пациентов (n=136) проводилось изучение динамики нейрогормонов РААС, и было выявлено достоверное и значительное снижение уровня альдостерона и активности ренина плазмы на фоне применения алискирена или комбинации алискирена с лозартаном, тогда как на фоне применения монотерапии лозартаном эффект влияния на альдостерон отсутствовал, а на активность ренина - был противоположным, что объясняет значимость подавления альдостерона в достижении регресса ГЛЖ.
Кроме того, проводится серия клинических исследований алискирена при лечении других сердечно-сосудистых заболеваний с оценкой влияния на прогноз больных: исследования ALOFT (n=320), ASTRONAUT (n=1639), ATMOSPHERE (n=7000) у пациентов с ХСН, исследование ALTITUDE у пациентов с сахарным диабетом и высоким сердечно-сосудистым риском, исследование ASPIRE у пациентов с постинфарктным ремоделированием.
Заключение
Для решения проблем предупреждения сердечно-сосудистых заболеваний продолжается создание новых лекарственных препаратов со сложным множественным механизмом действия, позволяющих обеспечивать более полную блокаду РААС через каскад механизмов гемодинамической и нейрогуморальной регуляции. Потенциальные эффекты таких препаратов позволяют не только обеспечивать дополнительный гипотензивный эффект, но и достигать контроля уровня АД у пациентов высокого риска, включая резистентную форму АГ. Лекарственные препараты с множественным механизмом действия демонстрируют преимущества в более выраженном органопротективном действии, что позволит предупреждать дальнейшее поражение сердечно-сосудистой системы. Изучение преимуществ новых препаратов, блокирующих РААС, требует дальнейших исследований и оценки их влияния на прогноз больных с АГ и другими сердечно-сосудистыми заболеваниями.



Литература
1. Campbell D.J. Vasopeptidase inhibition: a doubleedged sword? // Hypertension. 2003. Vol. 41. P. 383-389.
2. Laurent S., Schlaich M., Esler M. New drugs, procedures, and devices for hypertension // Lancet. 2012. Vol. 380. P. 591-600.
3. Corti R., Burnett J.C., Rouleau J.L. et al. Vasopeptidase inhibitors: a new therapeutic concept in cardiovascular disease? // Circulation. 2001. Vol. 104. P. 1856-1862.
4. Mangiafico S., Costello-Boerrigter L.C., Andersen I.A. et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics // Eur. Heart J. 2012, doi:10.1093/eurheartj/ehs262.
5. Rouleau J.L., Pfeffer M.A., Stewart D.J. et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial // Lancet. 2000. Vol. 356. P. 615-620.
6. Packer M., Califf R.M., Konstam M.A. et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: The Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE) // Circulation. 2002. Vol. 106. P. 920-926.
7. Warner K.K., Visconti J.A., Tschampel M.M. Angiotensin II receptor blockers in patients with ACE inhibitor-induced angioedema // Ann. Pharmacother. 2000. Vol. 34. P. 526-528.
8. Kostis J.B., Packer M., Black H.R. et al. Omapatrilat and enalapril in patients with hypertension:the Omapatrilat Cardiovascular Treatment vs Enalapril (OCTAVE) trial // Am. J. Hypertens. 2004. Vol. 17. P. 103-111.
9. Azizi M., Bissery A., Peyrard S. et al. Pharmacokinetics and pharmacodynamics of the vasopeptidase inhibitor AVE7688 in humans // Clin. Pharmacol. Ther. 2006. Vol. 79. P. 49-61.
10. Gu J., Noe A., Chandra P. et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dualacting angiotensin receptorneprilysin inhibitor (ARNi) // J. Clin. Pharmacol. 2010. Vol. 50. P. 401-414.
11. Ruilope L.M., Dukat A., Buhm M. et al. Bloodpressure reduction with LCZ696, a novel dualacting inhibitor of the angiotensin II receptor and neprilysin: a randomised, double-blind, placebo-controlled, active comparator study // Lancet. 2010. Vol. 375. P. 1255-1266.
12. Solomon S.D., Zile M., Pieske B. et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial // Lancet. 2012. Vol. 380(9851). P. 1387-1395.
13. Levin E.R. Endothelins // N. Engl. J. Med. 1995. Vol. 333. P. 356-363.
14. Dhaun N., Goddard J., Kohan D.E. et al. Role of endothelin-1 in clinical hypertension: 20 years on // Hypertension. 2008. Vol. 52. P. 452-459.
15. Burnier M., Forni V. Endothelin receptor antagonists: a place in the management of essential hypertension? // Nephrol. Dial. Transplant. 2011. 0: 1-4. doi: 10.1093/ndt/gfr704.
16. Krum H., Viskoper R.J., Lacourciere Y. et al. The effect of an endothelin-receptor antagonist, bosentan, on blood pressure in patients with essential hypertension. Bosentan Hypertension Investigators // N. Engl. J. Med. 1998. Vol. 338. P. 784-790.
17. Weber M.A., Black H., Bakris G. et al. A selective endothelin-receptor antagonist to reduce blood pressure in patients with treatment-resistant hypertension: a randomised, double-blind, placebo-controlled trial // Lancet. 2009. Vol. 374. P. 1423-1431.
18. Bakris G.L., Lindholm L.H., Black H.R. et al. Divergent results using clinic and ambulatory blood pressures: report of a darusentan-resistant hypertension trial // Hypertension. 2010. Vol. 56. P. 824-830.
19. Mann J.F., Green D., Jamerson K. et al. Avosentan for overt diabetic nephropathy // J. Am. Soc. Nephrol. 2010. Vol. 21. P. 527-535.
20. Kalk P., Sharkovska Y., Kashina E. et al. Endothelinconverting enzyme/neutral endopeptidase inhibitor SLV338 prevents hypertensive cardiac remodeling in a blood pressure-independent manner // Hypertension. 2011. Vol. 57. P. 755-763.
21. Nussberger J., Wuerzner G., Jensen C. et al. Angiotensin II suppression in humans by theorally active renin inhibitor Aliskiren (SPP100): comparison with enalapril // Hypertension. 2002. Vol. 39(1). P. E1-8.
22. Alreja G., Joseph J. Renin and cardiovascular disease: Wornout path, or new direction? // World J. Cardiol. 2011. Vol. 3(3). P. 72-83.
23. Ingelfinger J.R. Aliskiren and dual therapy in type 2 diabetes mellitus // N. Engl. J. Med. 2008. Vol. 358(23). P. 2503-2505.
24. Pouleur A.С., Uno H., Prescott M.F., Desai A. (for the ALLAY Investigators). Suppression of aldosterone mediates regression of left ventricular hypertrophy in patients with hypertension // J. Renin-Angiotensin-Aldosterone System. 2011. Vol. 12. P. 483-490.
25. Kelly D.J., Zhang Y., Moe G. et al. Aliskiren, a novel renin inhibitor, is renoprotective in a model of advanced diabetic nephropathy in rats // Diabetol. 2007. Vol. 50. P. 2398-2404.
aetiology of hypothyroidism in the young // Arch. Dis. Child. -2000. - Vol. 83. - P. 207-210.
41. Kadenbach B., Muller-Hocker J. Mutations of mitochondrial DNA and human death // Naturwissenschaften. - 1990. -No. 5. - S. 221-225 .
42. Murray C.J.L., Lopez A.D. Alternative projections of mortality and disability by cause 1990-2002: Global Burden of Disease Study // Lancet. - 1997. - Vol. 349. - P. 1498-1504.
43. Neill J.D., Bonos D.J. Relationship of molecular biology to integrative physiology // News in Physiol. Sci. - 2003. - Vol. 8. - P. 233-235.
44. Reaven G.M. Role of resistance in human disease // Diabetes. -1988. - Vol. 37. - P. 1595-1607.
45. Resnick H.E., Jones K., Ruotolo G. et al. Insulin resistance, the metabolic syndrome, and risk of incident cardiovascular disease in nondiabetic American Indians // The Strong Heart Study. Diabetes Care. - 2003. - Vol. 26. - P. 861-867.
46. Sauvaget C., Jagger C., Arthur A.J. Active and cognitive impairment-free life expectancies: results from the Melton Mowbray 75-health cheeks // Age Ageing. - 2001, Nov. -Vol. 30(6). - P. 509-515.
47. Tutar E., Kapadia S., Ziada K. M. et al. Heart disease begins at a young age // Am. Heart Assoc. meeting. - 1999, Nov. 9. - Abstr. # 2760. - P. 1234-1241.
48. Variation and trends in incidence of childhood diabetes in Europe. EURODIAB ACE Study Group // Lancet. - 2000. -Vol. 355(9207). - P. 873-876.
49. Wallace T.M., Levy J.C., Matthews D.R. Use and abuse of HOME Modeling // Diabetes Care. - 2004. - Vol. 27. - No. 6. - Р. 14871495.
Поступила 10.03.2014
Васильев Александр Петрович, докт. мед. наук, главный научный сотрудник отделения артериальной гипертонии и коронарной недостаточности научного отдела клинической кардиологии Филиала ФГБУ "НИИ кардиологии" СО РАМН "Тюменский кардиологический центр".
Адрес: 625026, г. Тюмень, ул. Мельникайте, 111. E-mail: [email protected] Стрельцова Нина Николаевна, научный сотрудник отделения артериальной гипертонии и коронарной недостаточности научного отдела клинической кардиологии Филиала ФГБУ "НИИ кардиологии" СО РАМН "Тюменский кардиологический центр". Адрес: 625026, г. Тюмень, ул. Мельникайте, 111. E-mail: [email protected]
УДК 616-08-035+616-08-031.81
О ВОЗМОЖНОСТЯХ ПРИМЕНЕНИЯ ПРЯМОГО ИНГИБИТОРА РЕНИНА АЛИСКИРЕНА ДЛЯ ЛЕЧЕНИЯ СОЦИАЛЬНО ЗНАЧИМЫХ ЗАБОЛЕВАНИЙ
А.Ф. Колпакова
ФГБУ "Конструкторско-технологический институт вычислительной техники" СО РАН, Новосибирск
E-mail: [email protected]
PROSPECTS FOR THE USE OF DIRECT RENIN INHIBITOR ALISKIREN FOR THE TREATMENT OF SOCIALLY SIGNIFICANT DISEASES
Design Technological Institute of Digital Techniques SB RAS, Novosibirsk
В обзоре проанализированы результаты рандомизированных исследований эффективности и безопасности прямого ингибитора ренина алискирена при лечении больных артериальной гипертонией в сочетании с ожирением, сахарным диабетом, менопаузой и поражением почек; хронической болезнью почек, метаболическим синдромом. Установлено, что алискирен обладает не только гипотензивным, но кардио- и ренопротективным действием, что может расширить показания к его применению.
Ключевые слова: прямой ингибитор ренина, эффективность и безопасность лечения, органопротективный эффект.
This review analyzes the results of randomized studies of the efficacy and safety of direct renin inhibitor aliskiren in the treatment of patients with arterial hypertension associated with obesity, diabetes, menopause, kidney failure, chronic kidney disease, and metabolic syndrome. The authors conclude that, along with the hypotensive action, aliskiren exerts cardioprotective and renoprotective effects that can expand the indications for the use of this drug. Key words: direct renin inhibitor, efficacy and safety of treatment, organoprotective effect.
Введение
По данным Всемирной организации здравоохранения, на долю социально значимых неинфекционных заболеваний приходится 63% всех смертельных случаев или примерно 36 млн смертей ежегодно, нанося огромный ущерб социально-экономическому развитию большинства стран мира . В экономически развитых странах мира ведущее место в структуре заболеваемости и смертности населения занимают сердечно-сосудистые заболевания (ССЗ), в том числе артериальная гипертония (АГ). Около 40% взрослого населения РФ имеет повышенный уровень артериального давления (АД). Известно, что АГ является важнейшим фактором риска инфаркта миокарда и мозгового инсульта, главным образом, определяющих высокую смертность в нашей стране . Несмотря на прогресс эффективности лечения ССЗ, растет число лиц с неконтролируемой или резистентной АГ. Существует и проблема низкой приверженности пациентов к лечению.
Исследованиями последних десятилетий доказана роль симпатико-адреналовой и ренин-ангиотензин-аль-достероновой (РААС) систем в формировании и прогрес-сировании АГ, сердечной недостаточности, хронических заболеваний почек и системного атеросклероза . Кроме того, РААС участвует в процессах роста и развития тканей, модуляции процессов воспаления и апоп-тоза, а также в потенцировании синтеза и секреции ряда нейрогуморальных субстанций . Ключевым звеном РААС является фермент ренин, обусловливающий трансформацию ангиотензиногена в ангиотензин I (АТ1). АТ1 в дальнейшем с помощью ангиотензин-превращаю-щего фермента (АПФ) преобразуется в наиболее активный у человека ангиотензин II (АТ11). Таким образом, от активности ренина зависит тонус РААС в целом и, следовательно, выраженность связанных с ним позитивных и негативных эффектов ее компонентов на ткани-мишени (миокард, сосудистая стенка, почечная ткань), реализующихся через взаимодействие с рецепторами к АТ1 и АТ11, а также рецепторами к альдостерону. Если последующие этапы активации РААС могут осуществляться при участии разных ферментов, то образование АТ1 из ангиотен-зиногена невозможно без участия ренина . Ориентируясь на результаты клинических исследований, можно утверждать, что активность ренина плазмы представляет собой один из наиболее достоверных маркеров неблагоприятного прогноза течения ССЗ. Так, L. Sechi и соавт. (2008) при обследовании 247 больных АГ продемонстрировали, что рост плазменной активности ренина предрасполагает к активации эндотелий-зависимого и плазменного звена гемостаза и, соответственно, увеличивает вероятность тромбозов, в том числе на уровне микроциркуляции, закономерно усугубляющих выраженность поражения органов-мишеней. Обнаружена прямая корреляция между плазменной активностью ренина, сывороточной концентрацией фибриногена, плазменным уровнем D-димера и ингибитора активатора плазмино-гена типа 1, а также признаками гипертензивного поражения сердца и почек . Кроме того, существуют многие обстоятельства, при которых плазменная активность ренина может оказаться стойко повышенной у больного:
АГ, метаболический синдром, сахарный диабет типа 2, абдоминальное ожирение, хроническая болезнь почек. К росту активности ренина плазмы предрасполагают также препараты, блокирующие последующие уровни РААС, в первую очередь, ингибиторы ангитензин-превращаю-щего фермента (иАПФ), а также увеличивающие экскрецию натрия, в частности тиазидовые диуретики .
В последние годы фармакологический контроль за активностью РААС осуществлялся в направлении ограничения продукции АТ11 за счет ингибирования АПФ, блокады рецепторов АТ11 и альдостерона, а также ограничения секреции ренина, преимущественно путем использования р-адреноблокаторов . Анализ механизма действия современных антигипертензивных препаратов, рекомендуемых в качестве препаратов первого ряда, влияющих на РААС, показал, что все они, за исключением р-блокаторов, приводят к увеличению уровня ренина, проренина и АПФ. Так, применение диуретиков сопровождается повышением уровня проренина, ренина, аПф, АТ1, АТ11 в плазме и АТ11 в тканях. Применение иАПФ ассоциируется с более выраженным увеличением содержания проренина, ренина, АПФ и АТ1. Установлено, что применение блокаторов рецепторов АТ1 (БРА) сопровождается стимуляцией всех медиаторов РААС: значимое повышение проренина, ренина, аПф, АТ1, АТ11 в плазме и АТ11 в тканях .
Многочисленные исследования показали, что адекватное снижение активности РААС с помощью иАПФ, БРА или альдостерона скорее постулируется, чем реально достигается, так как развивается феномен "ускользания". Для преодоления указанного феномена используются комбинации иАПФ + БРА + р-адреноблокатор, иАПФ+ спиронолактон. Таким образом, самой привлекательной мишенью для фармакологов был и остается ренин, поскольку он является ключевым звеном РААС.
Цель исследования: проанализировать литературные данные об эффективности и безопасности монотерапии и комбинированной терапии прямым ингибитором ренина (ПИР) таких социально значимых заболеваний, как сердечно-сосудистые заболевания, хроническая болезнь почек, метаболический синдром, сахарный диабет.
Эффективность и безопасность монотерапии алискиреном
Появление ПИР можно рассматривать как способ достижения более полного контроля активности РААС и преодоления феномена "ускользания" . Прямой ингибитор ренина - алискирен (Novartis, Швейцария) действует, связываясь с активным участком молекулы ренина, предотвращает связывание ренина с ангиотензи-ногеном и тем самым блокирует образование АТ1, предшественника АТП. Алискирен прошел клинические исследования, зарегистрирован во многих странах мира, в том числе в России, рекомендован для лечения артериальной гипертонии в виде монотерапии или комбинации с другими гипотензивными средствами.
В результате анализа контролируемых клинических исследований (РКИ) доказана эффективность и безопасность алискирена в качестве антигипертензивного пре-
парата для монотерапии . Так, в 8-не-дельном плацебо контролируемом исследовании проводилась оценка эффективности и безопасности А у 672 больных АГ I-II степеней, выявлено дозозависимое снижение САД и ДАД. Антигипертензивное действие ПИР сохранялось в течение двух недель после его отмены. Алискирен хорошо переносился, частота нежелательных явлений не отличалась от плацебо . Объединенный анализ клинических исследований, включавших 8481 больного , которые получали монотерапию ПИР или плацебо, показал, что однократный прием ПИР в дозе 150 или 300 мг в сутки обусловливал снижение САД на 12,5 и 15,2 мм рт. ст. соответственно по сравнению со снижением на 5,9 мм рт. ст. у пациентов, получавших плацебо (p<0,0001). ДАД снижалось на 10,1 (на дозе 150 мг) и 11,8 мм рт. ст. (на дозе 300 мг) соответственно (в группе плацебо - на 6,2 мм рт. ст., р<0,0001). Различий в антигипер-тензивном эффекте пИр у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
Исследование антигипертензивного действия ПИР в сравнении с иАПФ у пациентов с мягкой и умеренной АГ установило следующее: ПИР достоверно больше снижает САД и ДАД, чем рамиприл. Через 12 недель лечения САД и ДАД возвращаются к исходному уровню быстрее после отмены рамиприла, чем после отмены алискире-на. Сравнение гипотензивной эффективности алискире-на, ирбесартана и рамиприла после пропущенной дозы показало, что в этом случае достигнутое снижение АД было достоверно больше в группе ПИР, чем в группе ра-миприла .
При сопоставлении терапевтического потенциала ПИР с таковым других антигипертензивных лекарственных средств оказалось, что ПИР в ранжированных дозах 75, 150 и 300 мг/сут так же эффективен, как гидрохлор-тиазид (ГХТ) в дозах 6,25, 12,5 и 25 мг/сут . При этом у пациентов с мягкой и умеренной АГ частота достижения целевого уровня АД при применении ПИР в дозе 75 мг/сут составляла 51,9%, а при повышении суточной дозы до 300 мг - 63,9% . По данным L.A Sica и соавт. (2006), для достижения адекватного контроля за величиной АД почти у 45% пациентов с мягкой и умеренной АГ, получавших алискирен в суточной дозе 150-300 мг, возникла необходимость в дополнительном назначении диуретика . Установлено, что выраженность антигипер-тензивного эффекта алискирена в диапазоне доз 75-300 мг/сут была эквивалентной 100 мг/сут лозартана .
По данным исследования A.H. Gradman и соавт. (2005), алискирен в дозе 150 мг/сут обладал сходной эффективностью и сопоставимой безопасностью с ирбесартаном в той же дозе. В условиях РКИ в течение 8 недель с вовлечением 1123 пациентов с мягкой и умеренной АГ было показано, что монотерапия ПИР в ранжированных дозах 75, 150 и 300 мг/сут так же эффективна, как и монотерапия валсартаном в дозах 80, 160 и 320 мг/сут . M. Weir и соавт. (2006) при проведении мета-анализа восьми РКИ, в которых приняло участие 8570 пациентов, установили, что при мягкой и умеренной АГ монотерапия алискире-ном (75-600 мг/сут) приводит к дозозависимому снижению АД независимо от возраста и гендерной принадлежности пациентов. В целом необходимо заключить, что
ПИР эффективно снижает офисное и суточное АД, так же как и эквивалентные дозы других антигипертензив-ных лекарственных средств; возможно, он несколько более эффективен по сравнению с рутинно используемыми дозами иАПФ и БРА. Последнее обстоятельство, видимо, связано с длительным временем, за которое концентрация ПИР уменьшается на 50%, благодаря чему достигается адекватный контроль за АД в ранние утренние часы. Этот факт, вероятно, может иметь серьезное клиническое значение в предотвращении негативных кардио- и цереброваскулярных событий .
Установлена высокая безопасность алискирена как у здоровых волонтеров при проведении испытаний первой фазы, так и у пациентов с АГ. Частота нежелательных реакций, повлекших за собой отказ пациентов от продолжения исследования, была сопоставима с таковой в группе плацебо. Наиболее часто среди побочных эффектов регистрировались усталость, головная боль, гипотония, головокружение и диарея . Необходимо отметить, что частота возникновения побочных эффектов зависит от дозы препарата . Важно, что ПИР не оказывает влияния на метаболизм эндогенного бра-дикинина и субстанции Р, поэтому не приводит к манифестации кашля и ангионевротического отека так часто, как иАПФ. В целом переносимость ПИР сопоставима с таковой антагонистов рецепторов ангиотензина и плацебо . Алискирен не только хорошо переносится пациентами с нарушениями функции печени, но и имеет фармакокинетический профиль, не зависящий от тяжести печеночной недостаточности . Последнее обстоятельство позволяет рассматривать ПИР как препарат выбора у пациентов с АГ с сопутствующей легкой и умеренной печеночно-клеточной недостаточностью. Более того, существуют данные о безопасности применения алискирена у пациентов с почечной недостаточностью (при скорости клубочковой фильтрации более 35 мл/мин/ 1,73 м2), сахарным диабетом, ожирением, метаболическим синдромом и сердечной недостаточностью , а также у лиц старших возрастных групп . Вместе с тем существует потенциальная опасность ухудшения почечной функции на фоне использования ПИР в монотерапии или при комбинировании его с БРА у больных с клинически значимым стенозом почечных артерий, при проведении парентеральной анестезии, а также у лиц, длительно получающих высокие дозы ингибиторов цик-лооксигеназы-2 .
Комбинированная терапия, включающая алискирен. В большинстве случаев больные АГ нуждаются в комбинированной терапии двумя или тремя гипотензивными препаратами для достижения целевого АД . Клиническими исследованиями доказано, что антигипертензив-ная эффективность ПИР увеличивается при комбинации с другими гипотензивными препаратами . Так, установлено, что комбинированное использование алискирена и валсартана оказывает синергичес-кое влияние на степень редукции АД и превосходит эффективность каждого из этих компонентов в виде монотерапии . Влияние алискирена, валсартана и комбинации этих препаратов на АД было изучено в крупном исследовании в 312 клинических центрах (США, Испа-
ния, ФРГ) с участием 1797 больных АГ. К завершению 8-й недели лечения отмечено, что под действием комбинации алискирена и валсартана АД снижается достоверно в большей степени, чем при применении только алиски-рена или валсартана . В 2009 г опубликованы результаты многоцентрового контролируемого клинического исследования, в котором у 1124 больных АГ сравнивали эффективность ПИР и ГХТ (начальная антигипертензив-ная терапия); при необходимости к этим препаратам присоединяли амлодипин . К завершению периода монотерапии (12-я неделя) стало ясно, что ПИР приводит к более выраженному снижению АД, чем ГХТ (-17,4/ -12,2 против 4,7/-10,3 мм рт. ст., р<0,001). У пациентов с мягкой и умеренной АГ с ожирением и без ПИР+ГХТ обеспечивают достоверное снижение ДАД и САД. . Доказана и эффективность комбинированной терапии, включающей алискирен у пациентов с плохо контролируемой (резистентной) АГ .
W.B. White и соавт. (2010) проанализировали безопасность и переносимость ПИР в комбинации с БРА и тиа-зидных диуретиков при лечении АГ по данным 13 РКИ, из них 9 краткосрочных (8 недель) и 4 долгосрочных (2652 недели) за период до 31 августа 2009 г. В эти исследования было включено 12942 пациента с АГ 1 и 2-й стадии. В результате краткосрочных исследований установлено, что комбинация ПИР с БРА (валсартаном или лозартаном) или тиазидным диуретиком переносится пациентами аналогично монотерапии этими препаратами. Эти данные были подтверждены и в долгосрочных исследованиях . При этом в краткосрочных исследованиях у пациентов, леченных комбинацией алискирен-+валсартан или алискирен+лозартан, нежелательные реакции были выявлены у 32,2-39,6%, а при монотерапии - у 30,0-39,6% пациентов. В долгосрочных исследованиях нежелательные реакции были отмечены у 55,5% пациентов, получавших комбинацию алискирен+лозар-тан, у 45% - алискирен+диуретик, и существенно не отличались от таковых при монотерапии лозартаном (53,%) и диуретиком (48,9%). Другими словами, безопасность и переносимость комбинированной терапии алискиреном с БРА валсартаном или лозартаном были аналогичны монотерапии указанными препаратами .
Y. Liu и соавт. (2014) в результате анализа 19 РКИ, включающих 13614 больных АГ, получавших комбинированную терапию алискирен+амлодипин и алискирен+гид-рохлоптиазид, пришли к выводу, что комбинированная терапия приводила к достоверно (p<0,00001) большему снижению АД по сравнению с монотерапией. При этом не было установлено достоверных различий между комбинированной терапией и монотерапией в отношении побочных эффектов, кроме периферических отеков и гиперкалиемии при лечении только амлодипином. Подобный гипотензивный эффект комбинированной терапии получен у больных с ожирением и без него. Кроме того, выявлено, что лечение комбинацией алискирен+ амлодипин достоверно более эффективно, чем алиски-рен+гидрохлоптиазид, число побочных эффектов и отказов от лечения, обусловленных нежелательными реакциями, существенно не различалось .
Органопротективное действие алискирена. В экспе-
риментах на животных доказана способность алискирена индуцировать вазодилатацию почечных артерий и повышать минутный диурез, приводить к реверсии альбуминурии, снижать образование супероксидных радикалов, оказывать противоспалительное и антиатероскле-ротическое действие, а также способствовать редукции гипертрофии левого желудочка. При этом рено- и кар-диопротекторные качества алискирена были сопоставимы с таковыми валсартана .
Кардиопротективное и нефропротективное действие ПИР подтверждено при лечении больных АГ и хронической болезнью почек во многих клинических исследованиях . S.C. Tang. и соавт. (2012) установили, что у больных недиабетической нефропати-ей добавление ПИР к лозартану существенно уменьшало протеинурию. Авторы связывают нефропротективное действие ПИР с выявленным ими снижением уровней циркуляции интерлейкина-6 и трансформирующего ростового фактора бета (TGF-в) .
Исследование AVOID - Aliskiren in the evaluation of proteinuria in Diabetes (часть программы ASPIRE HIGHER), в котором принимали участие и российские клинические центры, было спланировано для оценки возможностей алискирена в защите органов-мишеней в различных ситуациях, характеризующихся очень высоким риском потенциально фатальных осложнений. У 599 больных диабетической нефропатией с АГ изучали влияние комбинации максимальных доз лозартана и алискирена на мочевую экскрецию альбумина, оцениваемую по отношению альбумин/креатинин мочи. Добавление к лозар-тану (100 мг/сут) алискирена (300 мг/сут) сопровождалось достоверным уменьшением отношения альбумин/ креатинин мочи на 20%, в том числе у 24,7% больных уменьшением данного отношения на 50% и более. В то же время при комбинации лозартана с плацебо уменьшение отношения альбумин/креатинин мочи на 50% и более было достигнуто только у 12,5%. Ренопротектив-ное действие алискирена не зависело от АД . В исследовании M. Ohsawa и соавт. (2013) показано, что добавление алискирена к терапии БРА больных хроническими заболеваниями почек с АГ приводит к более достоверному снижению АД и улучшению функции сердца и почек по сравнению с добавлением беназеприла .
Согласно результатам исследования ALOFT (Aliskiren Observation of Heart Failure Treatment), добавление алис-кирена к стандартной схеме лечения хронической сердечной недостаточности (ХСН) с признаками неблагоприятного прогноза (стойкое повышение в плазме натрий-уретического пептида) и АГ позволило добиться улучшения клинического состояния, снижения соотношения величины митральной регургитации к площади митрального отверстия и трансмитрального кровотока. Благодаря алискирену снизилась концентрация маркеров дез-адаптивной нейрогуморальной активации (уровни в плазме мозгового натрийуретического пептида (МНУП) и его предшественника, концентрации альдостерона в моче, активности ренина в плазме). При этом уровень МНУП на фоне терапии с добавлением 150 мг алискирена снижался в 5 раз больше, чем при стандартной терапии .
В рандомизированом исследовании ALLAY (The
Aliskiren Left Ventricular Assessment of Hypertrophy) приняли участие 465 больных АГ, которые получали алиски-рен в дозе 300 мг, лозартан - 100 мг в сутки или их комбинацию. На фоне приема ПИР снижались активность ренина и концентрация альдостерона плазмы, но данные показатели увеличивались при лечении лозартаном. Алис-кирен также вызывал уменьшение индекса массы миокарда левого желудочка, что отражало регресс гипертрофии у больных с АГ и избыточной массой тела. Комбинация алискирена и лозартана приводила к дальнейшему снижению гипертрофии левого желудочка сердца .
Клиническими исследованиями И.М. Фуштей и соавт. (2013) показано, что антигипертензивная терапия ПИР больных гипертензивной нефропатией и метаболическим синдромом в течение 3 мес. достоверно снижала уровни холестерина, триглицеридов, показатели инсули-норезистентности и улучшала функцию почек (снижение микроальбуминурии и повышение клубочковой фильтрации) и функциональное состояние эндотелия сосудов .
Результаты завершившихся исследований программы ASPIRE HIGHER (AVOID, ALOFT, ALLAY, AGELESS) и ряда других краткосрочных РКИ показали высокую клиническую эффективность и органопротективное действие алис-кирена как в монотерапии, так и в комбинированной терапии . Однако в исследованиях ASPIRE and AVANTGARDE были получены противоречивые результаты. Исследование ASPIRE показало, что добавление алискирена к оптимальной схеме лечения пациентов с инфарктом миокарда не предотвращает развитие ремоделирования левого желудочка, но приводит к более выраженным нежелательным реакциям в виде ренальной дисфункции, гипотензии и гиперкалиемии .
Определенные надежды связывались с двойной блокадой РААС с помощью комбинации алискирена и стандартной терапии (иАПФ или БРА) у больных сахарным диабетом 2-го типа с высоким риском сердечно-сосудистых и почечных осложнений. В исследовании ALTITUDE - Aliskiren Trial I Type 2 Diabetes Using Cardio-renal Diseases Endpoints (часть программы ASPIRE HIGHER) принял участие 8561 пациент. Первичная цель данного исследования состояла в оценке эффективности добавления алис-кирена к стандартной терапии по влиянию на комбинированную конечную точку (сердечно-сосудистая смерть и осложнения: успешная реанимация, нефатальный инфаркт миокарда, нефатальный инсульт, незапланированная госпитализация по причине ХСН; развитие терминальной хронической почечной недостаточности, удвоение сывороточного креатинина, смерть от причин, связанных с поражением почек). Это исследование было досрочно прекращено из-за отсутствия эффективности добавления алискирена к стандартной терапии и нежелательных реакций в виде нефатального инсульта, нарушения функции почек, гиперкалиемии и гипотонии. На основании полученных фактов комбинированная терапия алискиреном и иАПФ или БРА пациентам с АД и диабетом или почечной недостаточностью не рекомендована . Затем Комитет по медицинским продуктам Европейского медицинского Агентства и Управление по контролю за качеством пищевых продуктов и лекарственных средств США сообщили, что гипотензивные средства,
Не противоречит результатам ALTITUDE сообщение G. Mihai и соавт. (2013), установивших в РКИ ускоренное по сравнению с плацебо прогрессирование атеросклероза аорты при приеме алискирена в дозе 300 мг в сутки в течение 36 недель при анализе результатов трехмерной магнитно-резонансной томографии у пациентов с кардиоваскулярной болезнью . В связи с этим фактом исследование было досрочно прекращено.
Еще одно разочарование принесло сообщение о результатах исследования ASTRONAUT. Предполагали, что добавление алискирена к традиционной терапии сердечной недостаточности иАПФ, антагонистами альдостеро-на и блокаторами рецепторов ангиотензина возымеет дополнительный эффект на уровень смертности и риск повторных госпитализаций. Однако полученные результаты продемонстрировали достоверное отсутствие разницы между контрольной группой и группой пациентов, леченных комбинацией препаратов с добавлением алискирена, по первичным конечным точкам - числу регос-питализаций и смертей от ССЗ. Одновременно повысился риск побочных действий в виде гиперкалиемии, гипо-тензии и почечной недостаточности по сравнению с плацебо .
Таким образом, в литературе существуют противоречивые данные о результатах лечения алискиреном в комбинации с иАПФ или БРА. Возможно, эти противоречия связаны с тем, что в исследовании ALTITUDE лечение проводилось высокой дозой (330 мг/сут) алискирена в комбинации с высокими дозами иАПФ или БРА. Недавние исследования W.P. Wu и соавт. (2012) установили, что добавление 150 мг алискирена к терапии иАПФ или БРА 103 китайских пациентов с хронической болезнью почек в течение 6 мес. способствовало контролю АД и уменьшению протеинурии как в группе с сопутствующим диабетом 2-го типа, так и без него. При этом не отмечено существенных изменений скорости клубочковой фильтрации и концентрации калия, кроме того, алискирен не только снижает активность ренина в плазме, но и оказывает влияние на экспрессию рецепторов проренина, которые играют важную роль обмене калия .
В Канаде 903346 пациентов в возрасте 66 лет и старше, которые были госпитализированы с различными заболеваниями (гиперкалиемия, острая ишемия почек, мозговой инсульт), получали лечение алискиреном в сочетании с иАПФ или БРА в течение 28 мес. В результате многофакторного анализа установлено, что терапия алиски-реном не ассоциировалась с существенным увеличением риска госпитализации по поводу гиперкалиемии, инсульта или острой почечной недостаточности. Лечение ПИР в сочетании иАПФ или БРА пациентов с хронической болезнью почек, диабетом, ХСН в течение 28 мес. также не сопровождалось усилением побочных эффектов . К аналогичным выводам пришел исследователь R.M. Touyz (2013) из Канады .
Заключение
Таким образом, на основе анализа приведенных выше
результатов исследований можно заключить, что прямой ингибитор ренина алискирен имеет высокий антигипер-тензивный потенциал, благоприятный терапевтический профиль, высокую безопасность, хорошую переносимость, обладает выраженным органопротективным действием. Многоцентровыми рандомизированными исследованиями доказана эффективность и безопасность комбинированной терапии алискирен+амлодипин, алиски-рен+амлодипин+гидрохлортиазид при АГ различного генеза. Следовательно, алискирен показан большинству пациентов, страдающих АГ, в качестве дополнительного класса антигипертензивных препаратов для комбинированной терапии, и это отражено в российских рекомендациях по диагностике и лечению артериальной гипертонии (2010). В эту группу могут быть отнесены и пациенты с установленной избыточной активацией РААС, имеющие АГ различного генеза, метаболический синдром, ожирение, хроническую почечную недостаточность, хроническую болезнь почек, а также АГ у женщин в менопаузе и постменопаузе.
Тем не менее, остается ряд нерешенных вопросов, в частности комбинированная терапия алискиреном и иАПФ или БРА, которые требуют проведения дополнительных исследований.
Литература
1. Васюк Ю.А., Садулаева И.А., Ющук Е.Н. и др. Ингибиторы ренина - новое направление в лечении артериальной гипертонии // Тер. архив. - 2010. - № 9. - С. 53-59.
2. Доклад ВОЗ о глобальной ситуации по проблемам НИЗ. Анализ глобального бремени неинфекционных болезней, их факторов риска и детерминантов. - Женева: ВОЗ, 2011. - 176 с.
3. Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр) // Системные гипертензии. - 2010. - № 3. - С. 5-26.
4. Мухин Н.А., Фомин В.В. Ренин - мишень прямой фармакологической блокады при артериальной гипертонии // Тер. архив. - 2009. - № 8. - С. 5-9.
5. Фуштей И.М., С.Л. Подсевахина, А.И. Паламарчук и др. Влияние антигипертензивной терапии на функциональное состояние почек, показатели метаболического статуса и активность воспаления у больных с гипертензивной нефро-патией // Вестник неотложной и восстановительной медицины. - 2013. - Т. 14, № 1. - С. 63-67.
6. Чазова И.Е., Фомин В.В., Пальцева Е.М. Прямой ингибитор ренина алискирен - новые возможности защиты почек при артериальной гипертензии // Клиническая нефрология. -2009. - № 1 - С. 44-49.
7. Andersen K., Weinberger M.H., Egan B. et al. Comparative efficacy and safety of aliskiren, an oral direct renin inhibitor, and ramipril in hypertension: a 6-month, randomized, double-blind trial // Hypertension. - 2008. - Vol. 26. - P. 589-599.
8. Azizi M., Webb R., Nussberger J. et al. Renin inhibition with aliskiren: where are we now, and where are we going? // J. Hypertens. - 2006. - Vol. 24. - P. 243-256.
9. Brown M., McInnes G., Papst C. et al. Aliskiren and the calcium channel blocker amlodipine combination as an initial treatment strategy for hypertension control (ACCELERATE): a randomised, parallel-group trial // Lancet. - 2011. - Vol. 377. - P. 312-320.
10. Choi D.E., Jeong J.Y., Lim B.J. et al. Aliskiren ameliorates renal inflammation and fibrosis induced by unilateral ureteral
obstruction in mice // J. Urol. - 2011. - Vol. 186. - P. 694-701.
11. 2013 ESH/ESC Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens.
2013. - Vol. 31. - P. 1281-1357.
12. Danser A.H.J., Deinum J. Renin, prorenin and the putative prorenin receptor // Hypertension. - 2005. - Vol. 46. - P. 10691076.
13. Daugherty K.K. Aliskiren // Am. J. Health Syst. Pharm. - 2008. -Vol. 65, No. 14. - P. 1323-1332.
14 .Fisher N.D., Jan Danser A.H., Nussberger J. et al. Renal and hormonal responses to direct renin inhibition with aliskiren in healthy human // Circulation. - 2008. - Vol. 117. - No. 25. -P. 3199-3205.
15 .Gheorghiade M., Bohm M., Greene S.J. et al. Effect of aliskiren on postdischarge mortality and heart failure readmissions among patients hospitalized for heart failure: the ASTRONAUT randomized trial // JAMA. - 2013. - Vol. 309. - P. 1125-1135.
16. Fukutomi M., Hoshide S., Mizuno H. et al. Differential effects of aliskiren/amlodipine combination and high-dose amlodipine monotherapy on endothelial function in elderly hypertensive patients // Am. J. Hypertens. - 2014. - Vol. 27, No. 1. - P. 1420.
17. Gilbert C.J., Gomes T., Mamdani M.M. et al. No increase in adverse events during aliskiren use among ontario patients receiving angiotensin-converting enzyme inhibitors or angiotensin-receptor blockers // Can. J. Cardiol. - 2013. - Vol. 29. - No. 5. -P. 586-591.
18. Gradman A.H., Schmieder R.E., Lins R.L. et al. Aliskiren, a novel, orally-effective renin inhibitor, provides antihypertensive efficacy and placebo-like tolerability similar to an AT1-receptor blocker in hypertensive patients // Circulation. - 2005. -Vol. 111. - P. 1012-1018.
19. Jordan J., Engeli S., Boye S.W. Direct renin inhibition with aliskiren in obese patients with arterial hypertension // Hypertension. - 2007. - Vol. 49, No. 5. - P. 1047-1055.
20. Imanishi T., Tsujioka H., Ikejima H. et al. Renin inhibitor aliskiren improves impaired nitric oxide bioavailability and protects against atherosclerotic changes // Hypertension. - 2008. -Vol. 52. - P. 563-557.
21. Kario K., Pickering T.G., Umeda Y. et al. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives. A prospective study // Circulation. - 2003. - Vol. 107. - P. 1401-1406.
22. Kim S., Iwao H. Molecular and cellular mechanisms of angiotensin II-mediated cardiovascular and renal diseases // Pharmacol. Rev. - 2000. - Vol. 52, No. 5. - Р. 11-34.
23. Liu Y., Yan R., Song A. Aliskiren/amlodipine vs. aliskiren/ hydrochlorothiazide in hypertension: indirect meta-analysis of trials comparing the two combinations vs. monotherapy // Am. J. Hypertens. - 2014. - Vol. 27, No. 2. - P. 268-278.
24. Mende C.W. Application of direct renin inhibition to chronic kidney disease // Cardiovasc. Drugs Ther. - 2010. - Vol. 14. -P. 130-149.
25. Mihai G., Varghese J., Kampfrath T. et al. Aliskiren effect on plaque progression in established atherosclerosis using high resolution 3D MRI (ALPINE): a double-blind placebo-controlled trial [Электронный ресурс] // J. Am. Heart Assoc. - 2013. - Vol. 2, No. 3.
Doi: 10.1161/JAHA.112.004879.
26. McMurray J., Pitt B., Latini R. et al. Effects of the oral direct renin inhibitor aliskiren in patients with symptomatic heart failure // Circ. Heart Fail. - 2008. - Vol. 1. - P. 17-24.
27. Ogawa M., Suzuki J., Takayama K. et al. Impaired post-infarction cardiac remodeling in chronic kidney disease is due to excessive renin release // Lab. Invest. - 2012. - Vol. 92, No. 12. - P. 17661776.
28. Oh B.-H., Mitchell J., Herron J.R. et al. Aliskiren, an oral renin
inhibitor, provides dose-dependent efficacy and sustained 24hour blood pressure control in patients with hypertension // Am. Coll. Cardiol. - 2007. - Vol. 49. - P. 1157-1163.
29. Ohshawa M., Tamura K., Kanaoka T. et al. Addition of aliskiren to angiotensin receptor blocker improves ambulatory blood pressure profile and cardiorenal function better than addition of benazepril in chronic kidney disease // Int. Mol. Sci. - 2013.
Vol. 14. - P. 15361-15375.
30. Oparil S., Yarows S.A., Patel S. et al. Efficacy and safety of combined use of aliskiren and valsartan in patients with hypertension: a randomised, double-blind trial // Lancet. - 2007.
Vol. 370. - P. 221-229.
31. Parving H.-H., Brenner B.M., McMurray J.J.V. et al. Cardiorenal end points in a trial of aliskiren for type 2 diabetes // N. Engl. J. Med. - 2012. - Vol. 367. - P. 2204-2213.
32. Pool J.L., Schmieder R.E., Azizi M. et al. Aliskiren, an orally effective renin inhibitor, provides antihypertensive efficacy alone and in combination with valsartan // Am. J. Hypertens. - 2007.
Vol. 20. - P. 11-20.
33. Pilz B., Shagdarsuren E., Wellner M. et al. Aliskiren, a human renin inhibitor, ameliorates cardiac and renal damage in double-transgenic rats // Hypertension. - 2005. - Vol. 46. - P. 569576.
34. Shah S., Coakley C., Hough A. et al. Plasma renin activity testing to guide triple antirenin system drug therapy in a patient with difficult-to-treat hypertension // Ann. Pharmacother. - 2013.
Vol. 47, No. 11. - P. 1562-1568.
35. Schmieder R.E., Philipp T., Guerediaga J. et al. Long-term antihypertensive efficacy and safety of the oral direct renin inhibitor aliskiren. A 12-month randomized, double-blind comparator trial with hydrochlorothiazide // Circulation. -2009. - Vol. 119. - P. 417-425.
36. Sechi L.A., Novello M., Colussi G. et al. Relationship of plasma renin with a prothrombotic state in hypertension: relevance for organ damage // Am. J. Hypertens. - 2008. - Vol. 21, No. 12.
37. Sen S., Sabэrlэ S., Ozyigit T. et al. Aliskiren: review of efficacy and safety data with focus on past and recent clinical trials // Ther. Adv. Chronic Dis. - 2013. - Vol. 4, No. 5. - P. 232-241.
38. Sica D., Gradman A., Lederballe O. et al. Aliskiren, a novel renin inhibitor, is well tolerated and has sustained BP-lowering effects alone or in combination with HCTZ during long-term (52-weeks) treatment of hypertension // Eur. Heart J. - 2006. - 27, abstract suppl. - P. 121.
39. Scirica B.M., Morrow D.A., Bode C. et al. Aliskiren in left ventricular hypertrophy (ALLAY) trial investigators. Effect of the direct renin inhibitor aliskiren, the angiotensin receptor blocker losartan, or both on left ventricular mass in patients with hypertension and left ventricular hypertrophy // Circulation. -2009. - Vol. 119. - P. 530-537.
40. Solomon S., Sung H., Shah A. et al. Effect of the direct renin inhibitor aliskiren on left ventricular remodeling following myocardial infarction with systolic dysfunction // Eur. Heart J.
2011. - Vol. 32. - P. 1227-1234.
41. Staessen J.A., Li Y., Thijs L. Blood pressure reduction and cardiovascular prevention: an update including the 2003-2004 secondary prevention trials // Hypertens. Res. - 2005. -Vol. 28. - P. 385-407.
42. Stanton A. Therapeutic potential of renin inhibition in the management of cardiovascular disorders // Am. J. Cardiovasc. Drugs. - 2003. - Vol. 3. - P. 389-394.
43. Stephan D., Grima M., Welsch M. et al. Interruption of prolonged ramipril treatment in hypertensive patients: effects on the reninangiotensin system // Fundam. Clin. Pharmacol. - 1996.
Vol. 10, No. 5. - P. 474-483.
44. Suzuki H., Okada K., Abe M. et al. Aliskiren reduces home blood pressure and albuminuria in patients with hypertensive nephrosclerosis // Clin. Exp. Nephrol. - 2013. - Vol. 17, No 3. -
45. Spence J.D. Physiologic tailoring of treatment in resistant hypertension // Current Cardiology Reviews. - 2010. - Vol. 6. -P. 119-123.
46. Tang S.C., Lin M., Tam S. et al. Aliskiren combined with losartan in immunoglobulin A nephropathy: an open-labeled pilot study // Nephrol. Dial. Transplant. - 2012. - Vol. 27, No. 2. - P. 613618.
47. Touyz R.M. Combination antihypertensive treatment with aliskiren and blockers of the Renin-Angiotensin system-reassurance but with a note of caution // Can. J. Cardiol. - 2013.
Vol. 29, No. 5. - P. 521-523.
48. Turnbull F. Effect of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively-designed overviews of randomized trials // Lancet. - 2003. -Vol. 362. - P. 1527-1535.
49. Uresin Y., Taylor A., Kilo C. et al. Efficacy and safety of the direct renin inhibitor aliskiren and ramipril alone or in combination in patients with diabetes and hypertension // J. Renin Angiotensin Aldosterone Syst. - 2007. - Vol. 8. - P. 190-198.
50. Villamil A., Chrysant S., Calhoun D. et al. Renin inhibition with aliskiren provides additive antihypertensive efficacy when used in combination with hydrochlorothiazide // J. Hypertens. -2007. - Vol. 25. - P. 217-226.
51. Vaidyanathan S., Warren V., Yeh C. et al. Pharmacokinetics, safety, and tolerability of the oral renin inhibitor aliskiren in patients with hepatic impairment // Clin. Pharmacol. - 2007. - Vol. 47, No. 2. - P. 192-200.
52. Vaidyanathan S., Valencia J., Kemp C. et al. Lack of pharmacokinetic interactions of aliskiren, a novel direct renin inhibitor for the treatment of hypertension, with the antihypertensives amlodipine, valsartan, hydrochloro-thiazide (HCTZ) and ramipril in healthy volunteers // Int. J. Clin. Pract.
2006. - Vol. 60. - P. 1343-1356.
53. Watanabe T., Barker T.A., Berk B.C. Angiotensin II and the endothelium: diverse signals and effects // Hypertension. - 2005.
Vol. 45. - P. 163-169.
54. Weir M.R. Opportunities for cardiovascular risk reduction with angiotensin II receptor blockers // Current Hypertensions Reports. - 2002. - Vol. 4. - P. 333-335.
55. Weir M., Bush C., Zhang J. et al. Antihypertensive efficacy and safety of the oral renin inhibitor aliskiren in patients with hypertension: a pooled analysis // Eur. Heart J. - 2006. -Vol. 27, abstract suppl. - P. 299.
56. Whaley-Connell A., Nistala R., Habibi J. et al. Comparative effect of direct renin inhibition and AT1R blockade on glomerular filtration barrier injury in the transgenic Ren2 rat // Am. J. Physiol. Renal Physiol. - 2010. - Vol. 298. - P. 655-661.
57. White W.B., Bresalier R., Kaplan A.P. et al. Safety and tolerability of the direct renin inhibitor aliskiren in combination with angiotensin receptor blockers and thiazide diuretics: A pooled analysis of clinical experience of 12,942 patients // J. Clin. Hypertens. (Greenwich). - 2010. - Vol. 12, No. 10. - P. 765775.
58. Woo K.T., Choong H.L., Wong K.S. et al. A retrospective aliskiren and losartan study in non-diabetic chronic kidney disease // World Journal of Nefrology. - 2013. - Vol. 2, No. 4. - P. 129135.
59. Wu M.T., Tung S.C., Hsu K.T. et al. Aliskiren add-on therapy effectively reduces proteinuria in chronic kidney disease: An open-label prospective trial [Электронный ресурс] // Journal of the Renin-Angiotensin-Aldosteron System. - 2012. -doi:10.1177/ 1470320312467560; PMID: 23223162.
60. Yoshitomi Y., Kawanishi K., Yamaguchi A. et al. Effectiveness of the direct renin inhibitor, aliskiren, in patients with resistant hypertension // Int. Heart J. - 2013. - Vol. 54, No. 2. - P. 88-92.
Поступила 12.03.2014
Колпакова Алла Федоровна, докт. мед. наук, профессор, ведущий научный сотрудник лаборатории био-
информатики ФГБУ "Конструкторско-технологичес-кий институт вычислительной техники" СО РАН. Адрес: 630090, г Новосибирск, ул. акад. Ржанова, 6. E-mail: [email protected]
УДК 616.24-008.331.1-085
АНТАГОНИСТЫ РЕЦЕПТОРОВ ЭНДОТЕЛИНА В ЛЕЧЕНИИ ЛЕГОЧНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ (ОБЗОР ЛИТЕРАТУРЫ)
С.Н. Иванов1, Т.Г. Волкова1, Р.В. Волков2, Ю.А. Хрусталева1, В.Г. Ефименко1
1ФГБУ "Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина" Минздрава России 2Государственная Новосибирская областная клиническая больница E-mail: [email protected]
ENDOTHELIN RECEPTOR ANTAGONIST IN THE TREATMENT OF PULMONARY ARTERIAL HYPERTENSION (LITERATURE REVIEW)
S.N. Ivanov1, T.G. Volkova1, R.V. Volkov2, Yu.A. Khrustaleva1, V.G. Efimenko1
federal State Institution "Novosibirsk Research Institute of Circulation Pathology n.a. асас1. E.N. Meshalkin" of the Ministry of Healthcare of the Russian Federation Novosibirsk State Regional Hospital
В аналитической статье представлен обзор литературы по использованию антагонистов рецепторов эндотелина в лечении легочной артериальной гипертензии (ЛАГ). Обсуждаются основные препараты, широко используемые в практике, - это бозентан (траклир) и амбризентан. В настоящее время в России зарегистрированы оба препарата этой группы. В статье приводятся основные клинические исследования по применению антагонистов рецепторов эндотелина.
Ключевые слова: легочная артериальная гипертензия, бозентан (траклир), амбризентан.
This analytical article provides а review of the literature for using the endothelin receptor antagonists in the treatment of pulmonary arterial hypertension. The authors discuss the use of two main drugs widely used in clinical practice: bosentan (Tracleer) and ambrisentan. Both these drugs have been registered in the Russian Federation. The article presents findings of the main clinical trials of endothelin receptor antagonists. Key words: pulmonary arterial hypertension, bosentan (Tracleer), ambrisentan.
Легочная артериальная гипертензия (ЛАГ) - заболевание, характеризующееся обструкцией сосудов и различной степенью вазоконстрикции, ведущих к повышению резистентности легочных сосудов и правожелудочковой сердечной недостаточности (ПЖН) . Без лечения ЛАГ в конечном итоге приводит к развитию ПЖН и смерти. Медиана выживаемости нелеченных пациентов составляет 2,8 лет . Эпидемиологические данные разнятся, но распространенность заболевания в Европе оценивается на уровне 15 случаев на миллион человек .
Патофизиологические механизмы, лежащие в основе развития ЛАГ, включают в себя дисфункцию легочных сосудов, которая приводит к дисбалансу вазоактивных субстанций и факторов пролиферации, что ведет к развитию ремоделирования сосудов и легочной вазоконст-рикции. Эндотелин (ЭТ) рассматривается в качестве важного медиатора развития ЛАГ. Установлено, что при ЛАГ повышается уровень ЭТ-1, что способствует прогресси-рованию заболевания . Выявлена значимая корреляция
между сывороточным уровнем эндотелина 1 и тяжестью заболевания, определенной по уровню легочного сосудистого сопротивления (ЛСС), среднего давления в легочной артерии (сДЛА) и давления в правом предсердии . Ранее были опубликованы детализированные, основанные на доказательствах рекомендации по лечению ЛАГ .
Существуют два фармакологических подхода к лечению заболевания: применение препаратов группы поддерживающей или симптоматической терапии (направленной на снижение степени вазоконстрикции, одышки и тромбоэмболических осложнений) и применение препаратов, воздействующих на патофизиологические механизмы развития заболевания. Антагонисты рецептора ЭТ-1 являются препаратами, способными ограничивать как вазоконстрикторное, так и пролиферативное влияние эндотелина, и таким образом улучшать клиническое течение заболевания .
Траклир (бозентан) является первым и в настоящее
История изучения ренин-ангиотензинальдостероновой системы (РААС), оказавшаяся наиболее успешной с точки зрения разработки подходов к фармакологической модуляции ее активности, позволяющих продлить жизнь пациентов с сердечно-сосудистыми и почечными заболеваниями, началась 110 лет назад. Когда был идентифицирован ренин – первый компонент. В дальнейшем в экспериментальных и клинических исследованиях удалось уточнить физиологическую роль ренина и его значение в регуляции активности РААС при разных патологических состояниях, ставшие основой для разработки высокоэффективной терапевтической стратегии – прямых ингибиторов ренина.
В настоящее время первый прямой ингибитор ренина Расилез (алискирен) назначение обосновано даже в тех ситуациях, когда другие блокаторы РААС – иАПФ и БРА не показаны или применение их затруднено в связи с развитием нежелательных явлений.
Еще одним обстоятельством, позволяющим рассчитывать на дополнительные по сравнению с другими блокаторами РААС возможности прямых ингибиторов ренина в защите органов-мишеней АГ, является то, что при применении препаратов, блокирующих РААС на других уровнях, по закону отрицательной обратной связи происходит как увеличение концентрации проренина, так и увеличение плазменной активности ренина. Именно этим обстоятельством отменяется нередко отмечаемое снижение эффективности иАПФ, в том числе и с точки зрения их возможностей в снижении повышенной АД. Еще в начале 1990-х годов, когда многие органопротективные эффекты иАПФ не были установлены так достоверно, как сегодня, было показано, что по мере увеличения их дозы достоверно нарастают плазменная активность ренина и плазменная концентрация ангиотензина. Наряду с иаПФ и БРА, провоцировать подъем плазменной активности ренина могут также тиазидовые и петлевые диуретики.
Первым прямым ингибитором ренина, эффективность которого была подтверждена в контролируемых клинических исследованиях III фазы, обладающим достаточной продолжительностью действия и снижающим повышенное АД даже в режиме монотерапии, стал алискирен, и его назначение сегодня можно рассматривать как инновационный подход к лечению АГ. Были проведены сопоставления его влияния на плазменную концентрацию и активность отдельных составляющих РААС с иАПФ и БРА. Оказалось, что алискирен и эналаприл почти в равной степени уменьшают плазменную концентрацию ангиотензина II, но в отличие от алискирена прием эналаприла приводил к более чем 15-кратному росту активности ренина в плазме крови. Способность алискирена предупреждать негативные изменения в балансе активности компонентов РААС была также продемонстрирована при его сопоставлении с БРА.
Объединенный анализ клинических исследования, суммарно включавших 8481 больного, получавших монотерапию алискиреном или плацебо, показал, что однократный прием алискирена в дозе 150 мг/сут. или 300 мг/сут. обуславливал снижение САД на 12,5 и 15,2 мм рт.ст. соответственно в сравнении со снижением на 5,9 мм рт.ст., плацебо (Р<0,0001). Диастолическое АД снижалось на 10,1 и 11,8 мм рт.ст. соответственно (в группе, принимавшей плацебо – на 6,2 мм рт.ст.; Р < 0,0001). Различий в антигипертензивном эффекте алискирена у мужчин и женщин, а также у лиц старше и моложе 65 лет не выявлено.
В 2009 году опубликованы результаты многоцентрового контролируемого клинического исследования, в котором у 1124 больных АГ сравнивали эффективность алискирена и гидрохлортиазида. При необходимости к этим препаратам присоединяли амлодипин. Уже к завершению периода монотерапии стало ясным, что алискирен приводит к более выраженному снижению АД, чем гидрохлортиазиду (-17,4/-12,2 мм рт.ст. против -14,7/-10,3 мм рт.ст.; Р < 0,001)
Из этой статьи вы узнаете: какие лекарства от гипертонии принадлежат к последнему поколению, и действительно ли они лучше более ранних антигипертензивных средств.
Дата публикации статьи: 14.07.2017
Дата обновления статьи: 02.06.2019
Понятие «последнее поколение» антигипертензивных препаратов не имеет точного определения или годов выпуска. Чаще всего этот термин используют в рекламных целях, продвигая определенный препарат – не обязательно самый эффективный или новый – на фармацевтическом рынке. Но медицинская наука не стоит на месте. Постоянно проводятся испытания новых препаратов от гипертонии, однако их введение в клиническую практику – дело не одного года. Не каждое новое средство демонстрирует более высокую эффективность и безопасность, по сравнению с более старыми, но и лучше испытанными средствами. Практически ежегодно на фармакологический рынок выводятся новые таблетки от гипертонии, содержащие уже давно известные действующие вещества или их комбинацию.
Все же стоить отметить, что у некоторых антигипертензивных препаратов действительно существуют поколения, в таких случаях можно говорить о последней генерации лекарственных средств от высокого давления.
Большинство представителей из списка препаратов от гипертонии нового поколения выпускаются в виде таблеток для перорального применения. Исключением является лабеталол – бета-блокатор, доступный в виде раствора для внутривенного введения. Существуют и другие препараты для парентерального использования (например, нитраты, бензогексоний, нитропруссид натрия), но их трудно отнести к новым лекарственных средствам. Практически всегда внутривенное введение антигипертензивных средств используется для лечения .
В любом случае перед применением новинок в лечении гипертонии необходимо проконсультироваться с кардиологом. Можно также самостоятельно поискать информацию о проведенных научных исследованиях эффективности и безопасности данного препарата по сравнению с уже хорошо изученными средствами.
Ингибиторы ангиотензинпревращающего фермента
Ингибиторы ангиотензинпревращающего фермента (сокращенно иАПФ) – это фармацевтические препараты, которые используются преимущественно для лечения повышенного АД и сердечной недостаточности. Эта группа лекарственных средств подавляет активность ангиотензинпревращающего фермента, который конвертирует неактивный ангиотензин 1 в активный ангиотензин 2, благодаря чему расширяет кровеносные сосуды и снижает нагрузку на сердце.
Первый препарат иАПФ (каптоприл) был открыт более 40 лет назад, с того времени в клиническую практику было внедрено 12 лекарственных средств из этой группы.
В настоящее время чаще всего применяются иАПФ, которые были изобретены еще в 1990-е годы. Их список:
- Рамиприл.
- Периндоприл.
- Зофеноприл.
- Квинаприл.
- Фозиноприл.

Несмотря на достаточно давнее внедрение в клиническую практику, эти препараты продолжают уверенно лидировать среди всех иАПФ, доказав свою высокую эффективность и безопасность во многих исследованиях. Более того, многие научные доказательства говорят о том, что существенных различий в эффективности и безопасности разных представителей иАПФ почти нет. Эффективно снизить АД может как лизиноприл, так и фозиноприл, хотя стоимость этих препаратов в аптеке может различаться в разы.
Кроме лечения артериальной гипертензии, иАПФ применяют при:
- Сердечной недостаточности – эти препараты снижают нагрузку на сердце.
- Диабетической нефропатии – иАПФ помогают поддерживать функциональное состояние почек.
- Хронических заболеваниях почек – иАПФ могут помочь замедлить прогрессирование этих болезней.
- Инфаркте миокарда.

Люди, которым не следует принимать иАПФ:
- Беременные и кормящие грудью женщины.
- Пациенты с повышенной чувствительностью к этим препаратам.
- Пациенты, имеющие определенные заболевания почек – например, стеноз почечной артерии.
Самым частым побочным эффектом всех – даже самых новых – иАПФ является сухой кашель, развивающийся примерно у 10% людей, принимающих эти препараты. Реже встречаются отеки на губах, языке или вокруг глаз, а также ухудшение функций почек.
Блокаторы кальциевых каналов
(сокращенно БКК), иногда называемые антагонистами кальция, – это группа лекарственных средств, которые влияют на попадание ионов кальция внутрь определенных мышечных клеток. Они применяются для лечения различных заболеваний, включая артериальную гипертензию, стенокардию, синдром Рейно и нарушения сердечного ритма, а также для остановки преждевременных родов во время беременности.
Список трех основных групп БКК:
- Группа нифедипина (дигидропиридины).
- Группа дилтиазема (бензотиазепины).
- Группа верапамила (фенилалкиламины).
Для снижения АД чаще всего применяются дигидропиридины, которые были разработаны в 1960-х годах.
Существует 4 поколения препаратов из группы нифедипина:
- 1 поколение – нифедипин;
- 2 поколение – никардипин, фелодипин;
- 3 поколение – амлодипин;
- 4 поколение – цилнидипин.

В клинической практике чаще всего применяются препараты первых трех поколений, цилнидипин врачи назначают достаточно редко.
Амлодипин – пожалуй, самый часто назначаемый препарат из группы БКК. Его начали использовать в 1990 году. Амлодипин продемонстрировал высокую эффективность в лечении артериальной гипертензии, а также и безопасность.
Цилнидипин – это новый препарат 4-го поколения из группы БКК, имеющий определенные преимущества над другими антагонистами кальция. По сравнению с представителями первых трех поколений, которые влияют лишь на L-тип кальциевых каналов, цилнидипин может также блокировать их N-тип. Это свойство может иметь полезное клиническое значение, проявляющееся подавлением рефлекторной тахикардии и уменьшением отеков, которые иногда наблюдаются при применении амлодипина и других, более старых, БКК. Цилнидипин обладает высокой липофильностью, благодаря чему имеет пролонгированное действие. Выпускается цилнидипин под торговыми названиями «Дуокард», «Цилакар», «Ателек».
Противопоказания к назначению дигидропиридинов включают аллергические реакции на конкретный препарат.
| Также антагонисты кальция нужно с осторожностью использовать в следующих ситуациях | Возможные побочные эффекты БКК из группы дигидропиридинов включают |
|---|---|
| Инфаркт миокарда и нестабильная стенокардия | Отеки на ногах |
| Артериальная гипотензия | Усталость |
Аортальный стеноз Нажмите на фото для увеличения Нажмите на фото для увеличения
|
Тошноту |
| Беременность и грудное вскармливание | Головокружение |
| Почечная и печеночная недостаточность | Учащенное сердцебиение |
| Тяжелая сердечная недостаточность | Приливы (ощущение жара, распространяющегося по всему телу, особенно в области лица и шеи) |
Бета-блокаторы
Бета-блокаторы (ББ) – это класс лекарственных средств, которые блокируют рецепторы эндогенных катехоламинов (норадреналин и адреналин), благодаря чему применяются для снижения АД, лечения нарушений сердечного ритма, вторичной миокарда.
Первый ББ (пропранолол) был синтезирован в 1964 году. Многие врачи и ученые сходятся во мнении, что открытие этой группы препаратов является одним из самых важных событий в клинической медицине и фармакологииXX века.
С того времени было разработано достаточно много ББ. Одни из них действуют на все типы бета-адренорецепторов, другие – лишь на один из них. Именно на этих свойствах и выделяют три поколения ББ:
- 1 поколение – пропранолол, тимолол, соталол (неселективные, блокируют бета-1 и бета-2 адренорецепторы)
- 2 поколение – метопролол, бисопролол, эсмолол (селективные, блокируют только бета-1 адренорецепторы)
- 3 поколение – карведилол, небиволол, лабеталол (обладают дополнительными сосудорасширяющими свойствами).

Карведилол – один из ББ третьего поколения, обладающий дополнительным свойством расширения сосудов. Он действует на бета-1- и бета-2-адренорецепторы, а также блокирует альфа-адренорецепторы в сосудах. Благодаря этим эффектам, карведилол сильнее снижает артериальное давление, меньше влияет на частоту сердечных сокращений, не повышает уровни липидов и глюкозы в крови. Недостатком препарата является его действие на бета-2-адренорецепторы, из-за чего повышается риск развития спазма бронхов. Принимать карведилол нужно дважды в день, что не очень удобно для пациента.
Небиволол – препарат, селективно действующий на бета-1-адренорецепторы, который дополнительно обладает сосудорасширяющими свойствами благодаря усилению синтеза оксида азота (NO) в эндотелии сосудов. Благодаря этим эффектам, небиволол лучше снижает артериальное давление, меньше влияет на частоту сердечных сокращений, не повышает уровни липидов и глюкозы в крови, не вызывает эректильной дисфункции. Негативным свойством этого препарата является довольно слабое действие на бета-блокаторы, поэтому его чаще всего применяют у пожилых людей с сердечной недостаточностью.

Лабеталол – препарат, обладающий неселективными бета-блокирующими свойствами и влиянием на альфа-рецепторы. Лабеталол используется преимущественно в виде внутривенного введения, при котором он имеет очень короткое время действия, что позволяет добиться хорошего контроля над эффектами препарата. Это наиболее эффективный бета-блокатор для лечения гипертонических кризов. Его часто применяют при феохромоцитоме (опухоль надпочечников) и преэклампсии (поздний токсикоз у беременных).
Список общих для бета-блокаторов побочных эффектов:
Блокаторы рецепторов ангиотензина 2
Блокаторы рецепторов ангиотензина 2 (БРА), или сартаны – самая новая группа лекарственных средств, широко применяемых для лечения артериальной гипертензии. Первый сартан (лозартан) был внедрен в практику в 1986 году.
Действие сартанов основано на блокаде последнего уровня ренин-ангиотензиновой системы, то есть на предотвращении связывания ангиотензина 2 с его рецепторами. Благодаря этим эффектам, БРА вызывают расширение сосудов, сокращают секрецию вазопрессина и альдостерона (гормоны, способствующие задержке жидкости и натрия в организме), что приводит к снижению артериального давления.
Самыми последними БРА, допущенными к клиническому применению, являются олмесартан (Кардосал), фимасартан (Канарб) и азилсартан (Эдарби).

Показания к применению сартанов, включая самые новые препараты:
- Артериальная гипертензия.
- Сердечная недостаточность.
- Патология почек при сахарном диабете.
- Хронические заболевания почек.
Как видно, показания к применению сартанов практически те же, что и для использования другой группы препаратов, влияющих на ренин-ангиотензиновую систему – иАПФ. В большинстве случаев БРА назначают в тех ситуациях, когда прием иАПФ привел к появлению побочного действия (сухого кашля). Следует учитывать, что более старые иАПФ обладают практически такой же эффективностью в снижении артериального давления, стоят меньше и имеют определенные преимущества над сартанами при лечении пациентов с сахарным диабетом.
Прием сартанов обычно хорошо переносится большинством пациентов.
Прямые ингибиторы ренина (алискирен)
Алискирен – лекарство от гипертонии нового поколения, которое еще не приобрело большой распространенности. Единственным препаратом этого класса является алискирен, который получил разрешение для клинического использования в 2007 году.

Алискирен связывается с ренином, подавляя его взаимодействие с ангиотензиногеном, благодаря чему предотвращается образование ангиотензина 1и ангиотензина 2.
Алискирен применяется лишь для лечения артериальной гипертензии, да и при этом заболевании его не рекомендуют использовать в качестве первой линии терапии.
ЛЕКЦИЯ 2 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СРЕДСТВ ЛЕЧЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИЛЕКЦИЯ 2 КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СРЕДСТВ ЛЕЧЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Артериальная гипертензия - патологическое состояние, характеризующееся длительным устойчивым повышением артериального давления. Причина стойкого повышения артериального давления примерно у 90% больных остается невыясненной. В этом случае говорят об эссенциальной гипертензии или гипертонической болезни. Экспертами Европейского общества по артериальной гипертензии (ЕОАГ) и Европейского общества кардиологов (ЕОК) в 2003 г. предложена клас- сификация уровней АД у взрослых (старше 18 лет), которая не претерпела принципиальных изменений до настоящего времени (табл. 2.1).
Таблица 2.1. Определение и классификация уровней артериального давления (Рекомендации ЕОАГ-ЕОК 2003 и 2007, Национальные рекомендации по профилактике, диагностике и лечению артериальной гипертензии, второй пересмотр, 2004)
Из классификации АД следует, что не существует дискретного «порогового» АД, отделяющего АГ от нормотензии, а показания к лечению и степень планируемого снижения АД определяются со- вокупным риском сердечно-сосудистых заболеваний и осложнений у конкретного пациента. Таким образом, решение о фармакотерапии у больных с АГ следует принимать не только на основании уровня АД, но и с учетом выявленных факторов риска, патологических состояний или сопутствующих заболеваний (табл. 2.2).
2.1. ОСНОВНЫЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОГНОЗ БОЛЬНОГО С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ (РЕКОМЕНДАЦИИ ЕОАГ-ЕОК, 2007)
I. Факторы риска
Уровни систолического АД (АДс) и диастолического АД (АДд) I-III степени.
Уровень пульсового АД (у пожилых).
Возраст: мужчины >55 лет; женщины >65 лет.
Курение.
Дислипидемия:
Общий холестерин >5,0 ммоль/л, или
Холестерин ЛПНП >3,0 ммоль/л, или
Холестерин ЛПВП: у мужчин <1,0 ммоль/л; у женщин <1,2 ммоль/л, или
Триглицериды >1,7 ммоль/л.
Глюкоза плазмы натощак - 5,6-6,9 ммоль/л.
Абдоминальное ожирение: окружность талии у мужчин > 102 см; у женщин > 88 см.
Случаи ранних проявлений сердечно-сосудистой патологии в семейном анамнезе (инсульт или инфаркт у мужчин - в возрасте до 55 лет, у женщин - до 65 лет).
II. Субклинические поражения органов
Признаки гипертрофии ЛЖ.
ЭКГ (критерий Соколова-Лайона > 38 мм; Корнельский критерий >2440 мм-мс) или ЭхоКГ (ИММлж у мужчин >125 г/м 2 ; у женщин >110 г/м 2).*
Утолщение медиаинтимального слоя > 0,9 мм или атеросклеротическая бляшка в сонной артерии.
Скорость распространения пульсовой волны (сонные артерии - бедренные артерии) >12 м/с.
Лодыжечно-плечевой индекс АД <0,9.
Легкое увеличение креатинина плазмы:
Мужчины - 115-133 мкмоль/л;
* - наибольший риск при концентрической гипертрофии левого желудочка (если отношение толщины стенки ЛЖ к его радиусу в диастолу >0,42);
Женщины - 107-124 мкмоль/л.
Снижение скорости клубочковой фильтрации (<60 мл/мин на 1,73 м 2)** или клиренса креатинина (<60 мл/мин).***
Микроальбуминурия (30-300 мг за 24 ч) или отношение «альбумин/ креатинин»: у мужчин >22 мг/г; у женщин >31 мг/г креатинина.
III. Сахарный диабет
Глюкоза плазмы натощак ≥7,0 ммоль/л при повторных измерениях.
Глюкоза плазмы после нагрузки >11 ммоль/л.
IV. Болезни сердечно-сосудистой системы или почек
Цереброваскулярные болезни: ишемический инсульт, геморрагический инсульт, транзиторная ишемическая атака.
Болезни сердца: инфаркт миокарда, стенокардия, коронарная реваскуляризация, сердечная недостаточность.
Болезни почек: диабетическая нефропатия, почечная недостаточность (креатинин плазмы у мужчин >133 мкмоль/л; у женщин >124 мкмоль/л).
Болезни периферических артерий.
Выраженная ретинопатия: геморрагии или экссудаты, отек соска зрительного нерва.
Суммарное влияние нескольких факторов риска и патологических состояний на прогноз можно оценить полуколичественно путем стра- тификации риска по четырем категориям (низкий дополнительный риск, умеренный дополнительный риск, высокий и очень высокий дополнительный риск), при этом термин «дополнительный» означает риск, превышающий средний (см. табл. 2.2).
Степень риска сердечно-сосудистых заболеваний и осложнений определяет характер и срочность лечебных мероприятий, среди кото- рых фармакотерапия занимает центральное место (табл. 2.3). Таким образом, определение АГ может варьировать в зависимости от выраженности общего сердечно-сосудистого риска.
Важный постулат лечения АГ: не ограничиваться только медикаментозной терапией. Для многих больных важнейшими условиями эффективного лечения являются: соблюдение диеты (ограничение потребления поваренной соли, алкоголя, насыщенных жиров и холестерина, увеличение потребления фруктов и овощей), отказ от
** - по формуле Cockroft-Gault; *** - по формуле MDRD.
Таблица 2.2. Стратификация риска сердечно-сосудистых заболеваний и осложнений (Рекомендации ЕОАГ-ЕОК, 2007)

Примечание: ФР - факторы риска; СПО - субклинические поражения органов; МС - метаболический синдром (наличие минимум 3 из 5 возможных ФР: абдоминальное ожирение, повышение уровня глюкозы натощак, АД ≥ 130/85 мм рт. ст.; низкий уровень холестерина ЛПВП, повышение уровня триглицеридов); СД - сахарный диабет; ССС - сердечно-сосудистая система; АДс - систолическое АД; АДд - диастолическое АД.
Таблица 2.3. Инициация и характер антигипертензивного лечения в зависимости от стратификации риска (Рекомендации ЕОАГ-ЕОК, 2007)

Примечание: ФР - факторы риска; СПО - субклинические поражения органов; МС - метаболический синдром (наличие минимум 3 из 5 возможных ФР: абдоминальное ожирение, повышение уровня глюкозы натощак, АД ≥130/85 мм рт. ст.; низкий уровень холестерина ЛПВП, повышение уровня триглицеридов); СД - сахарный диабет; ССС - сердечнососудистая система; АДс - систолическое АД; АДд - диастолическое АД; МОЖ - модификация образа жизни.
курения, снижение массы тела, регулярные физические нагрузки. Нефармакологическое вмешательство должно быть доступным для больного АГ и проводиться постоянно при условии регулярного наблюдения и всяческого поощрения со стороны врача.
2.2. ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Цель лечения - снижение риска сердечно-сосудистых заболеваний и осложнений, следовательно, агрессивность лечения АГ и целевые уровни АД определяются тяжестью сопутствующих факторов риска, выраженностью субклинических поражений органов и манифестных заболеваний сердечно-сосудистой системы.
Объектом для фармакотерапии у больных с АГ является не только АД, но и другие обратимые факторы риска, а также состояния, определяющие прогноз пациента в рамках сердечно-сосудистого континуума.
Наряду с антигипертензивной фармакотерапией важнейшее место в лечении больных АГ занимают мероприятия по изменению об- раза жизни, с которых начинают лечение у пациентов, относящихся к группе низкого риска.
Задача антигипертензивной терапии - добиться устойчивого снижения АД до уровня <140/90 мм рт. ст. и максимально близкого к оптимальному АД (см. классификацию АД) в зависимости от переноси- мости лечения.
Снижение АД должно быть постепенным; дабы избежать нежелательных побочных реакций, связанных с гипотензией и ухудшением регионарного кровообращения, следует стремиться к достижению и поддержанию целевого уровня АД минимально необходимыми средствами, что подразумевает: а) рациональный выбор препарата (препаратов); б) адекватное комбинирование антигипертензивных средств; в) рациональное дозирование лекарственных препаратов.
Рекомендуется использовать антигипертензивные препараты длительного или пролонгированного действия, обеспечивающие 24-часовой эффект при однократном приеме. Это позволяет добиться устойчивого гипотензивного действия, круглосуточной защиты органов-мишеней и повышения приверженности больного к назначенному лечению.
Наилучший способ лечения АГ в острыхситуациях (нарушения мозгового кровообращения, острая левожелудочковая недостаточность, артериальные эмболии, острая боль, гиперкатехоламинемия различ-
ного происхождения) - воздействие на причину, лежащую в основе патологического состояния.
Фармакологические препараты, которые используются для лечения АГ, должны воздействовать на одно или несколько звеньев патогенеза АГ:
1) снижать общее периферическое сопротивление сосудов (ОПСС);
2) понижать минутный объем кровотока (МОК);
3) уменьшать объем циркулирующей крови (ОЦК);
4) предупреждать ремоделирование сосудистой стенки и развитие гипертрофии миокарда левого желудочка.
Помимо этого, они должны обладать следующими свойствами, предъявляемыми к «идеальному» антигипертензивному препарату (Mustone A. L., 2006, с изменениями):
Обладать высокой эффективностью при использовании в качестве монотерапии;
Хорошо комбинироваться с другими препаратами;
Быстро достигать целевых значений АД;
Назначаться однократно (в сутки) для поддержания высокой приверженности больного к лечению;
Обладать эффективной длительностью действия свыше 24 ч;
Давать прямой дозозависимый эффект;
Обладать оптимальным профилем переносимости.
Хотя в настоящее время ни один из используемых препаратов в полной мере не обладает всеми этими свойствами, быстрый прогресс фармакологической науки позволяет надеяться на то, что такое средство будет найдено в обозримом будущем.
Для сравнительной оценки эффективности антигипертензивных препаратов рекомендуют использовать так называемый коэф- фициент Т/Р (tough/peak ratio или отношение «провал/пик»), представляющий собой отношение величины снижения АД в конце междозового интервала (перед очередным приемом препарата) к величине снижения АД в период максимума действия. Использование коэффициента Т/Р позволяет получить представление о длительности и равномерности действия антигипертензивного препарата. Антигипертензивные средства, назначаемые 1 раз в сутки, должны иметь Т/Р не менее 50% при выраженном гипотензивном эффекте и не менее 67% при незначительном пиковом эффекте. Величина Т/Р, близкая к 100%, свидетельствует о равномерном снижении АД в течение суток и отсутствии отрицательного влияния препарата на вари-
абельность АД, подтверждая обоснованность дозы и однократного приема препарата. Препараты с большим Т/Р имеют также максимальный эффект последействия, поэтому могут контролировать АД при пропуске дозы. Значение Т/Р менее 50% свидетельствует о недостаточном гипотензивном эффекте в конце междозового интервала или чрезмерной гипотензии на пике действия препарата, что требует коррекции кратности приема и/или дозы лекарственного средства. Кроме того, низкий Т/Р может свидетельствовать о высокой вариабельности АД.
2.3. АНТИГИПЕРТЕНЗИВНЫЕ ПРЕПАРАТЫ
Средства, снижающие тонус симпатической иннервации в различных звеньях
1. Адреноблокаторы.
1.1. β-адреноблокаторы.
1.2. α-адреноблокаторы.
1.3. Смешанные адреноблокаторы.
2. Средства, влияющие на сосудодвигательный центр.
2.1. Агонисты α 2 -адренорецепторов.
2.2. Агонисты имидазолиновых рецепторов.
Блокаторы Са 2+ -каналов.
Средства, влияющие на ренин-ангиотензиновую и эндотелиновую системы.
1. Ингибиторы ангиотензинпревращающего фермента.
2. Блокаторы рецепторов ангиотензина II.
3. Ингибиторы синтеза ренина.
4. Блокаторы эндотелиновых рецепторов.
Диуретики.
1. Тиазидные и тиазидоподобные диуретики.
2. Петлевые диуретики.
3. Калийсберегающие диуретики.
В настоящее время выделяют пять основных групп антигипертензивных средств - так называемые препараты первой очереди. К ним относятся:
1) тиазидные диуретики (ТД);
2) блокаторы кальциевых каналов (БКК);
3) ингибиторы ангиотензинпревращающего фермента (иАПФ);
4) блокаторы рецепторов ангиотензина II (БАР);
5) β-адреноблокаторы.
Если исходить из выраженности антигипертензивного эффекта, то монотерапия препаратами первой очереди дает приблизительно одинаковый эффект. Они эффективны в 55-45% случаев мягкой или умеренной артериальной гипертензии.
Ингибиторы ангиотензинпревращающего фермента
иАПФ подразделяют на три класса (табл. 2.4). К I классу относятся липофильные иАПФ типа каптоприла; иАПФ II класса являются пролекарствами, которые становятся активными после биотрансформации в печени; прототипом этих препаратов служит эналаприл. Препараты II класса делятся на три подкласса. Подкласс IIа включает лекарственные средства, активные метаболиты которых выводятся преимущественно (более 60%) через почки. Активные метаболиты препаратов подкласса IIb имеют два основных пути элиминации (печень и почки), а метаболиты подкласса IIc характеризуются пре- имущественно печеночной (более 60%) элиминацией. иАПФ III класса - это гидрофильные препараты типа лизиноприла, которые не метаболизируются в организме, не связываются с белками, выводятся почками.
Таблица 2.4. Классификация ингибиторов ангиотензинпревращающего фермента

Ангиотензинпревращающий фермент участвует в превращении ангиотензина I в ангиотензин II (АТ-II) и за счет дополнительной кининазной активности инактивирует брадикинин. Физиологические эффекты АТ-II реализуются в основном через два типа ангиотензиновых рецепторов - АТ 1 и АТ 2 . В результате активации АТ 1 -рецепторов возникает вазоконстрикция, что приводит к повышению ОПСС и АД, стимулируется синтез и секреция альдостерона, соответственно увеличивается реабсорбция Na+ и воды, повышается ОЦК и АД, усиливается гипертрофия и пролиферация кардиомиоцитов и гладкомышечных клеток сосудистой стенки. Через активацию АТ 2 -рецепторов опосредуется вазодилатация, высвобождение оксида азота (эндотелиального релаксирующего фактора) и вазодилатирующих простагландинов (PG), в частности, PGI 2 .
Ингибиторы АПФ, подавляя активность АПФ, одновременно оказывают влияние на ренин-ангиотензин-альдостероновую (РААС) и калликреин-кининовую системы (схема 2.1). При этом за счет уменьшения образования АТ-II ослабляются сердечно-сосудистые и почечные эффекты активации РААС, а за счет накопления брадикинина потенцируется вазодилатирующее действие иАПФ. Кроме того, для квинаприла характерно восстановление функции внесинаптических М 1 -холинорецепторов, располагающихся в эндотелии сосудов и участвующих в расширении сосудов.
Таким образом, иАПФ дают следующие гемодинамические эффекты:
Расширение артерий, снижение ОПСС, снижение АД, снижение постнагрузки;
Расширение вен, снижение преднагрузки;
Вторичное уменьшение сердечного выброса за счет снижения пред- и постнагрузки;
Увеличение натрийуреза, диуреза, снижение ОЦК;
Обратное развитие гипертрофии левого желудочка;
Подавление развития гипертрофии гладкой мускулатуры и фиброзных изменений в стенке артерий, что способствует дилатации сосудов.
Ингибиторы АПФ характеризуются нелинейной фармакокинетикой, при которой эффективность препарата и длительность его действия могут скачкообразно нарастать при увеличении дозы. Дозы иАПФ подбирают эмпирически, начиная с наименьших из рекомендованных, под контролем артериального давления. АД необходимо

Схема 2.1. Механизм действия иАПФ на клеточном и системном уровне
измерять на максимуме действия препарата и в конце междозового интервала (обычно через 24 ч после приема иАПФ длительного действия). Степень снижения АД на пике действия иАПФ не должна превышать степень снижения АД в конце междозового интервала более чем в 1,5-2 раза.
Основные показания к применению иАПФ при АГ
Сердечная недостаточность.
Дисфункция левого желудочка.
Перенесенный ИМ.
Диабетическая нефропатия.
Нефропатия.
Гипертрофия ЛЖ.
Фибрилляция предсердий.
Метаболический синдром.
Абсолютные противопоказания к применению иАПФ при АГ
Беременность.
Ангионевротический отек.
Гиперкалиемия.
Переносимость иАПФ может быть оценена на 3-5-е сутки, а клиническая эффективность - не ранее чем через 10-14 дней. Рекомендуемые дозы препаратов представлены в табл. 2.5.
Побочные эффекты иАПФ
1. Артериальная гипотензия, которая чаще всего развивается после приема первой дозы у больных с выраженной дисфункцией левого желудочка или стенозом почечной артерии. Кроме того, снижение АД возможно у пожилых больных, а также у пациентов, получающих нитраты, диуретики или другие препараты, снижающие АД. Для уменьшения риска развития гипотензии у данных категорий больных рекомендуется:
Начинать лечение с малых доз препаратов;
За 24-48 часов до назначения иАПФ отменить диуретические препараты;
После приема первой дозы в течение нескольких часов больной должен находиться в постели.

Окончание табл. 2.5

Примечание: * - у пожилых больных доза уменьшается в 2 раза.
2. Протеинурия и повышение содержания креатинина в сыворотке крови. Нарушение функции почек обычно встречается у больных, перенесших в прошлом заболевание почек, а также при одноили дву- стороннем стенозе почечных артерий. Для профилактики данного побочного эффекта необходимо:
Начинать терапию иАПФ с низких доз;
Корригировать дозу препарата в зависимости от клубочковой фильтрации;
Отдавать предпочтение препаратам с двойным путем выведения (группы IIb и IIc);
Контролировать уровень креатинина в первые 3-5 суток лечения, а затем - один раз в 3-6 месяцев.
3. Гиперкалиемия (>5,5 ммоль/л). Вероятность развития повышается при одновременном назначении калийсберегающих диуретиков, препаратов калия, НПВП, у пациентов с сахарным диабетом, обструк- цией мочевыводящих путей, интерстициальным нефритом.
4. Нейтропения. Это осложнение чаще возникает у пациентов с недостаточностью функции почек, при одновременном назначении иммунодепрессантов, прокаинамида (новокаинамида), пиразолонов.
5. Сухой мучительный кашель - следствие интерстициального отека тканей верхних дыхательных путей (за счет увеличения содержания брадикинина), нередко ограничивает применение иАПФ у больных с бронхолегочной патологией. Чаще встречается у женщин, лиц негроидной и монголоидной расы и у курильщиков. Кашель обычно возникает в первые дни лечения иАПФ, но иногда - через несколько месяцев или даже лет после начала приема препарата. Исчезает через 1-2 недели после отмены иАПФ.
6. Отек Квинке. Возникает в основном у женщин в первую неделю лечения и исчезает в течение нескольких часов после отмены препарата. Вероятность возникновения не зависит от химической структуры
иАПФ.
Следует избегать одновременного назначения больным, получающим иАПФ, β-адреноблокаторы и диуретики, нестероидных противовоспалительных препаратов (НПВП), так как последние блокируют синтез простагландинов и могут вызывать задержку жидкости в организме с обострением заболевания (схема 2.2). Наиболее опасными считаются индометацин и рофекоксиб, самой безопасной - ацетилсалициловая кислота.
Блокаторы рецепторов ангиотензина II
Лосартан (Козаар).
Валсартан (Диован).
Олмесартан (Олметек).
Ирбесартан (Апровель).
Кандесартан (Атаканд).
Телмисартан (Прайтор).
Эпросартан (Теветен).
Тасосартан.
Ангиотензинпревращающий фермент является далеко не единственным ферментом, обеспечивающим образование АТ-II в организме (на его долю приходится не более 20% АТ-II), в то время как остальные 80% синтезируются под действием других ферментов (химазы и др.). Поэтому одним из эффективных подходов к торможению чрезмерной активности РААС является блокада ангиотензиновых рецепторов. В настоящее время существует достаточно большая группа лекарственных препаратов, блокирующих рецепторы 1-го типа к ангиотензину II. Их механизм гипотензивного действия связан с ослаблением эффектов ангиотензина II, которые реализуются через АТ 1 -рецепторы (см. схему 2.1). Блокада АТ 1 -рецепторов приводит к расширению периферических сосудов, снижению ОПСС и АД; кроме того, снижается секреция альдостерона, в результате чего уменьшается реабсорбция Na + и воды, ОЦК и АД. Ослабляются пролиферативные эффекты ангиотензина II в отношении кардиомиоцитов и гладкомышечных клеток сосудистой стенки.
Блокаторы АТ 1 -рецепторов (БАР) нарушают механизм отрицательной обратной связи, регулирующий синтез и высвобождение в кровь ангиотензиногена и ренина. Поэтому при длительном назначении препаратов данной группы в крови повышается содержание ангиотен- зиногена, ренина, ангиотензина I и II. В условиях блокады препаратами АТ 1 -рецепторов образующийся ангиотензин II не может с ними взаимодействовать, что вызывает дополнительную стимуляцию АТ2- рецепторов приводящую к повышению синтеза и высвобождения эндотелиального релаксирующего фактора (ЭРФ), PGI 2 , усилению артериальной вазодилатации (см. схему 2.1).

Схема 2.2. Предполагаемые механизмы ослабления эффектов гипотензивных препаратов под влиянием НПВП (Преображенский Д. В. и др., 2002)
Окончание таблицы


По своей антигипертензивной активности БАР сопоставимы с другими антигипертензивными средствами первой очереди и отличаются лучшей переносимостью. Кроме того, у пациентов с АГ, получающих БАР (в частности, валсартан) вероятность развития новых случаев фибрилляции предсердий ниже на 17%, а риск персистирующей фибрилляции предсердий - на 32%, чем у пациентов, получающих блокаторы кальциевых каналов (в частности, амлодипин).
Максимальный антигипертензивный эффект БАР развивается к 3-4-й неделе лечения, а по некоторым данным и позже. Важно отме- тить, что БАР не нарушают физиологический ход кривой суточного (день-ночь) давления, для них не характерна ни гипотензия первой дозы, ни резкое повышение АД после внезапной отмены препарата. Установлена одинаковая антигипертензивная эффективность и переносимость БАР у больных различного возраста (включая лиц старше 65 лет), пола и расовой принадлежности.
Показания к применению БАР при АГ
Сердечная недостаточность.
Диабетическая нефропатия.
Протеинурия/микроальбуминурия.
Фибрилляция предсердий.
Метаболический синдром.
Непереносимость иАПФ.
Абсолютные противопоказания к применению БАР при АГ
Беременность.
Двусторонний стеноз почечных артерий.
Гиперкалиемия.
Число побочных эффектов, которые могут развиться при применении БАР, небольшое - изредка могут быть головная боль, головокружение, общая слабость, тошнота. По своим органопротективным свойствам БАР, вероятно, не уступают иАПФ, и сегодня они являются средствами первой линии при лечении артериальной гипертензии, хотя окончательное место этих средств в терапии АГ, возможно, еще предстоит уточнить.
Блокаторы эндотелиновых рецепторов
Дарусентан.
Одними из наиболее мощных вазоактивных веществ являются эндотелиальные пептиды эндотелины (ЭТ). Три представителя этого се-
мейства - ЭТ-1, ЭТ-2, ЭТ-3 - продуцируются различными тканями, в которых они присутствуют в качестве модуляторов тонуса сосудов, клеточной пролиферации и синтеза гормонов. Сердечно-сосудистые эффекты эндотелина опосредуются через специфические рецепторы типа А (вазоконстрикция) и типа В (вазодилатация) с преобладанием действия первых. По силе сосудосуживающего эффекта ЭТ превосходит АТ-II в 30 раз.
Среди блокаторов эндотелиновых рецепторов (босентан, ситаксентан, тезосентан, амбрисентан, дарусентан) для лечения артериальной гипертензии (в первую очередь резистентной) пока предложен только дарусентан, однако окончательное суждение о его эффективности и безопасности можно будет вынести только после проведения широких клинических исследований. Другие препараты этой группы нашли применение при лечении сердечной недостаточности и легочной гипертензии.
Блокаторы синтеза ренина
Алискирен (Расилез).
Одним из подходов к блокаде РААС является ее угнетение на наиболее раннем этапе активации (образование ренина) с помощью специфических ингибиторов синтеза ренина. Препараты данной группы обладают способностью селективно блокировать превращение ангиотензиногена в АГ-I, что определяет их специфичность. За счет этого происходит снижение уровней ангиотензина I и ангиотензина II в крови и сопутствующее снижение артериального давления. Максимальное снижение активности ренина плазмы наблюдается уже через 1 ч после приема препарата (300 мг) и продолжается 24 ч. При курсовом введении выраженность указанного эффекта не уменьшается.
Эффективность алискирена в монотерапии (по предварительным данным) сравнима с эффективностью комбинации двух традиционно назначаемых гипотензивных препаратов. Кроме того, он может комбинироваться с диуретиками, блокаторами кальциевых каналов и ингибиторами АПФ.
По частоте развития нежелательных явлений (диарея, головная боль, ринит) алискирен сравним с лосартаном. Окончательное суждение об эффективности и безопасности препарата можно будет сделать по окончании крупных клинических исследований.
β -адреноблокаторы и смешанные адреноблокаторы
Еще одна группа препаратов, обладающих выраженным гипотензивным эффектом - β-адреноблокаторы. Классификация β-адреноблокаторов представлена в лекции «Клиническая фармакология средств лечения ишемической болезни сердца».
Механизм гипотензивного действия β-адреноблокаторов в первую очередь связан с блокадой β 1 -адренорецепторов сердца, что приводит к снижению силы и частоты сердечных сокращений и, со- ответственно, сердечного выброса. Блокируя β 1 -адренорецепторы юкстагломерулярного аппарата почек, препараты снижают выброс ренина, а следовательно, образование ангиотензина II и альдостерона. Кроме того, неселективные БАБ, блокируя пресинаптические β 2 -адренорецепторы, уменьшают выброс катехоламинов в синаптическую щель. Снижая активность САС, β-адреноблокаторы приводят к регрессии гипертрофии миокарда. β 1 -адреноблокаторы с дополнительными вазодилатирующими свойствами способны уменьшать ОПСС, расширяя периферические сосуды (см. лекцию «Клиническая фармакология средств лечения ишемической болезни сердца»). Основные сведения по применению β-адреноблокаторов при АГ представлены в табл. 2.7.
Подробнее побочные эффекты β-адреноблокаторов представлены в лекции «Клиническая фармакология средств лечения ишемической болезни сердца».
Препараты данной группы являются средствами выбора:
Для лечения АГ с выраженной активацией САС и РААС;
При сочетании АГ с ИБС, тахиаритмиями, сердечной недостаточностью;
У беременных (селективные БАБ);
В случае непереносимости или при наличии противопоказаний к назначению иАПФ и БАР.
Показания к применению β-адреноблокаторов при АГ
Стенокардия.
Перенесенный инфаркт миокарда.
Сердечная недостаточность (бисопролол, метопролола сукцинат, карведилол, небиволол - для пациентов старше 70 лет).
Тахиаритмии.
Беременность (во триместрах допустимо применение атенолола, пропранолола, метопролола тартрата, лабеталола).
Глаукома.

Окончание таблицы 2.7

Абсолютные противопоказания к применению β-адреноблокаторов при АГ
Бронхиальная астма.
АВ-блокада II-III степеней (при отсутствии постоянного электрокардиостимулятора).
β-адреноблокаторов при АГ
Болезни периферических сосудов, синдром Рейно.
Метаболический синдром.
Нарушенная толерантность к глюкозе.
Спортсмены и физически активные пациенты.
Хроническая обструктивная болезнь легких.
Следует отметить, что у β-адреноблокаторов (в первую очередь атенолола) наименьшая в сравнении с другими классами антигипертензивных препаратов (иАПФ, БАР, диуретики, блокаторы кальциевых каналов) эффективность в отношении профилактики развития инсультов. Кроме того, есть данные о том, что β-адреноблокаторы, особенно в комбинации с тиазидными диуретиками, не следует использовать у больных с метаболическим синдромом или с высоким риском развития сахарного диабета. Между тем, у больных сахарным диабетом β-адреноблокаторы так же эффективно снижают риск кардиоваскулярных осложнений, как и у пациентов без сахарного диабета.
Из группы смешанных адреноблокаторов для лечения АГ наиболее часто используется карведилол. Препарат блокирует β 1 - и α 1 -адренорецепторы, дополнительно обладает антиоксидантной и антипролиферативной активностью (в отношении гладкомышечных клеток). Начинают лечение с дозы 12,5 мг, средняя терапевтическая доза 25- 50 мг/сут однократно. Другой смешанный адреноблокатор - лабеталол - может быть использован при артериальной гипертензии у беременных.
Блокаторы кальциевых каналов
Классификация блокаторов кальциевых каналов представлена в лекции «Клиническая фармакология средств для лечения ишеми- ческой болезни сердца».
В зависимости от принадлежности к химическому классу блокаторы кальциевых каналов способны влиять на ведущие патофизио-
логические механизмы гипертензии - повышение ОПСС (например, дигидропиридины) или увеличение МОК (преимущественно фени- лалкиламины). Кроме того, эти лекарственные средства расширяют почечные сосуды, улучшают почечный кровоток, оказывают антиагрегантное действие. БКК не оказывают неблагоприятного влияния на метаболизм углеводов и липидов, не вызывают бронхоспазм и ортостатическую гипотензию.
БКК являются одним из препаратов выбора для лечения АГ в сочетании с пароксизмальной тахикардией (производные фенилалкиламина), бронхиальной астмой.
Механизмы гипотензивного действия блокаторов кальциевых каналов
Блокада медленных кальциевых каналов миокарда и проводящей системы приводит к снижению силы и частоты сердечных сокращений, что сопровождается уменьшением сердечного выброса (снижение ударного объема и МОК). Данный механизм действия более характерен для производных фенилалкиламина.
Блокада кальциевых каналов гладкомышечных клеток сосудов вызывает расширение артериол, снижение ОПСС и АД. Этот механизм действия лежит в основе гипотензивного эффекта производных ди- гидропиридинов.
Наряду с собственно антигипертензивным эффектом БКК замедляют развитие гипертрофии левого желудочка, и, что очень важно, прогрессирование атеросклероза сонных и коронарных артерий.
Показания к применению БКК при АГ
Дигидропиридиновые БКК (дигидропиридины пролонгированного и длительного действия: нифедипин, амлодипин, лацидипин и пр.)
Стенокардия.
Гипертрофия левого желудочка.
Атеросклероз сонных, коронарных артерий.
Беременность.
АГ у лиц негроидной расы.
Недигидропиридиновые БКК (верапамил, дилтиазем)
Стенокардия.
Атеросклероз сонных артерий.
Суправентрикулярные тахиаритмии.
Абсолютные противопоказания к применению БКК при АГ
АВ-блокада II-III степеней (недигидропиридиновые блокаторы кальциевых каналов).
Сердечная недостаточность (недигидропиридиновые блокаторы кальциевых каналов).
Относительные противопоказания к применению БКК при АГ
Тахиаритмии (дигидропиридины пролонгированного и длительного действия).
Сердечная недостаточность (дигидропиридины пролонгированного и длительного действия).
БКК обладают некоторыми особенностями влияния на различные «конечные точки». Так, на фоне терапии препаратами данной группы риск развития сердечной недостаточности и инфаркта миокарда несколько выше, чем на фоне терапии другими гипотензивными препаратами. В то же время БКК в несколько большей степени, чем другие гипотензивные препараты, уменьшают риск мозгового инсульта.
Дополнительными показаниями для назначения дигидропиридиновых БКК являются: пожилой возраст больного, изолированная систолическая артериальная гипертензия, наличие сопутствующей стенокардии напряжения, заболевания периферических артерий, признаки атеросклеротических изменений в сонных артериях, беременность. Для недигидропиридиновых блокаторов кальциевых каналов дополнительными показаниями к назначению являются сопутствующая стенокардия напряжения, признаки атеросклеротических изменений в сонных артериях, суправентрикулярные нарушения ритма.
Некоторые сведения по применению блокаторов кальциевых каналов при АГ приведены в табл. 2.8.
Короткодействующий нифедипин (в отличие от его форм пролонгированного действия) при длительном применении ухудшает прогноз больных с АГ, ишемической болезнью сердца, поэтому для систематического лечения АГ не используется.
Побочные эффекты БКК
Блокада кальциевых каналов в сердце может привести к брадикардии, атриовентрикулярной блокаде, кардиодепрессии. Данные побочные эффекты характерны для фенилалкиламинов.
Результатом блокады кальциевых каналов периферических сосудов являются ортостатическая гипотензия, рефлекторная тахикардия. Кроме того, у больных могут возникать: покраснение лица, отеки ло- дыжек несердечного генеза, обусловленные вазодилатацией, гингивиты, запоры.
Диуретики
Широкое использование диуретических препаратов для антигипертензивной терапии обусловлено тем, что лечение ими экономически выгодно и не вызывает чрезмерного снижения АД, в связи с чем нет необходимости в частом врачебном контроле; кроме того, препараты не вызывают феномен отдачи. Диуретики являются препаратами выбора при лечении АГ у лиц пожилого возраста, в том числе с сердечной недостаточностью.
Классификация диуретиков
1. Действующие на толстую восходящую часть петли Генле (петлевые диуретики):
Фуросемид (Лазикс).
Буметанид (Буфенокс).
Пиретанид (Ареликс).
Этакриновая кислота (Урегит).
Торасемид (Диувер).
2. Действующие на начальную часть дистального канальца:
2.1. Тиазидные диуретики (производные бензотиадиазина):
Дихлотиазид (Гипотиазид).
Метолазон (Зароксолин).
Циклометиазид (Циклопентиазид).
Политиазид (Ренезе).
2.2. Нетиазидные (тиазидоподобные) диуретики:
Клопамид (Бринальдикс).
Хлорталидон (Оксодолин).
Индапамид (Арифон).
Ксипамид (Аквафор).
3. Действующие на конечную часть дистального канальца и собирательные трубочки (калийсберегающие диуретики):
3.1. Конкурентные антагонисты альдостерона:
Спиронолактон (Верошпирон).
Эплеренон (Инспра).

Окончание таблицы 2.8

Примечание: * - для форм пролонгированного действия.
3.2. Блокаторы натриевых каналов:
Триамтерен (Дайтек).
Амилорид (Модамид).
4. Действующие на проксимальный каналец (ингибиторы карбоангидразы):
Ацетазоламид (Диакарб).
5. Комбинированные препараты:
Триампур (триамтерен + дихлотиазид).
Модуретик (амилорид + дихлотиазид).
Фурезис (фуросемид + триамтерен).
Спиро-Д (фуросемид + спиронолактон).
Чаще всего для лечения АГ используются тиазидные и тиазидоподобные диуретики. В механизме их гипотензивного действия условно можно выделить два компонента. Первый связан собственно с диуретическим действием и реализуется на клеточном уровне за счет подавления электронейтрального транспорта Na + и Cl - через люминальную мембрану дистальных извитых канальцев, что приводит к увеличению выведения натрия и, следовательно, воды. Это сопровождается снижением ОЦК и, соответственно, уменьшением возврата крови к сердцу и сердечного выброса. Данный механизм лежит в основе позитивного действия тиазидных диуретиков в первые недели лечения АГ и является дозозависимым (проявляется в диуре- тических дозах).
Второй компонент проявляется даже при назначении в недиуретических дозах и обусловлен снижением ОПСС за счет:
Усиления выведения Na+ и воды из сосудистой стенки, приводящего к уменьшению ее толщины и реакции на прессорные воздействия;
Уменьшения чувствительности адренорецепторов к катехоламинам;
Стимуляции синтеза вазодилатирующих простагландинов;
Нарушения обмена Ca 2+ и Na + в гладкомышечных клетках сосудов.
Сравнительные исследования показали, что нет существенной разницы в антигипертензивной активности низких (менее 25 мг гид- рохлортиазида в день или эквивалентные дозы других препаратов) и высоких доз (более 25 мг) тиазидных диуретиков. В то же время низкие дозы диуретиков гораздо лучше переносятся пациентами и не сопровождаются существенными электролитными и метаболическими нарушениями.
В отличие от β-адреноблокаторов, диуретики одинаково эффективно предотвращают сердечно-сосудистые осложнения у больных с АГ как среднего, так пожилого и старческого возраста и способны улучшать отдаленный прогноз у этих пациентов с артериальной гипертензией. Диуретики более эффективны, чем β-адреноблокаторы, в профилактике развития ИБС и летальных исходов, что делает их одними из препаратов первого ряда при начальной терапии АГ.
Показания к применению диуретиков при артериальной гипертензии
Тиазидные и тиазидоподобные диуретики (низкие дозы):
Изолированная систолическая АГ у пожилых.
Сердечная недостаточность.
АГ у лиц негроидной расы. Антагонисты альдостерона:
Сердечная недостаточность.
Перенесенный инфаркт миокарда. Петлевые диуретики:
Сердечная недостаточность.
Конечные стадии болезней почек.
Абсолютные противопоказания к применению диуретиков при АГ
Подагра (тиазидные диуретики).
Почечная недостаточность (антагонисты альдостерона).
Гиперкалиемия (антагонисты альдостерона).
Относительные противопоказания к применению диуретиков при АГ
Беременность.
Метаболический синдром (высокие дозы и сочетание с β-адреноблокаторами).
Побочные эффекты тиазидных диуретиков
1. Почечные (гипокалиемия, гипонатриемия, гипомагниемия, гиперкальциемия, метаболический алкалоз).
2. Внепочечные (гипергликемия, связанная с торможением секреции инсулина β-клетками островков Лангерганса; гиперурикемия с возникновением подагрического синдрома; повышение уровня хо- лестерина и триглицеридов в крови; вторичный гиперальдостеронизм при длительном применении).
В отличие от тиазидных диуретиков, натрийуретический эффект петлевых диуретиков выражен в большей степени, однако антигипертензивное действие проявляется слабее.

Примечание: * - возможно длительное лечение недиуретическими дозами тиазидов в составе комбинированной гипотензивной терапии.
Механизм действия петлевых диуретиков связан с блокадой в толстом отделе восходящего колена петли нефрона (петли Генле) котранспорта Na + , K + и двух ионов С1 - . Результатом является увеличение диуреза, снижение ОЦК, возврата крови к сердцу и сердечного выброса. Кроме того, за счет увеличения синтеза вазоди- латирующих простагландинов в сосудистой стенке расширяются артериолы и вены, что приводит на системном уровне к уменьшению ОПСС, снижению пост- и преднагрузки, сердечного выброса, а в почках - к увеличению почечного кровотока и, следовательно, фильтрации и натрийуреза.
Побочные эффекты петлевых диуретиков близки к таковым тиазидных диуретиков (за исключением влияния на уровень кальция (гипокальциемия). Дополнительно могут возникнуть нарушения функции ЖКТ, проявляющиеся тошнотой, снижением аппетита, болями в животе, диспепсическими явлениями.
Кроме того, при длительной терапии диуретиками их мочегонный эффект может снижаться в связи с развитием вторичного гиперальдостеронизма.
В основе механизма действия антагонистов альдостерона лежит блокада альдостероновых рецепторов с последующим нарушением реализации основных эффектов минералокортикоидов. В ядерном аппарате клеток почечного эпителия это приводит к нарушению экспрессии определенных генов, результатом которой является снижение синтеза пермеаз, и, как следствие, увеличение натрийуреза и диуреза, уменьшение секреции калия в мочу. На системном уровне это проявляется снижением активности РААС, некоторым увеличением диуреза (до 200 мл/сут) и уменьшением ОЦК. Антигипертензивное действие спиронолактона особенно выражено в условиях первичного и вторичного гиперальдостеронизма.
Наиболее часто антагонисты альдостерона используются в комбинации с тиазидными или петлевыми диуретиками (при необходимости их длительного применения) для профилактики вторичного гиперальдостеронизма и гипокалиемии. Эффект при применении препаратов развивается примерно через 3 суток, а для достижения развернутого клинического эффекта может понадобиться до 3 - 4 недель. Побочные эффектывключают гиперкалиемию,гормональные нарушения (гинекомастия, снижение либидо, импотенция у мужчин, нарушение менструального цикла, огрубление голоса у женщин).
Более селективным блокатором альдостероновых рецепторов, по сравнению со спиронолактоном, является новый препарат эплеренон (Инспра). Его высокая селективность позволяет избежать большинства побочных эффектов со стороны эндокринной системы. Собственно мочегонный эффект препарата незначителен.
Механизм действия другого калийсберегающего диуретика - триамтерена - связан с блокадой натриевых каналов люминальной мембраны эпителия собирательных трубочек. В результате снижается выход Na + из просвета канальцев в клетки. Это ведет к уменьшению поступления К + через базальную мембрану и снижению секреции его в мочу. Антигипертензивный эффект триамтерена связан со снижением объема циркулирующей крови и сердечного выброса. Побочные эффекты: кристаллурия, цилиндроурия, уролитиаз.
Агонисты α 2 -адренорецепторов
Клонидин (Клофелин).
Гуанфацин (Эстулик).
Метилдофа (Допегит).
В последние годы значительно уменьшилась частота использования для лечения АГ агонистов α 2 -адренорецепторов - клонидина и гуанфацина, механизм гипотензивного действия которых связан с активацией тормозных α 2 -адрено- и имидазолиновых I 1 -рецепторов в ЦНС. Клонидин в настоящее время не рекомендован для систематического лечения АГ и используется в основном для купирования гипертонических кризов. Побочные эффекты препарата являются следствием активации α 2 -адренорецепторов и включают в себя сухость во рту, заторможенность, депрессию, брадикардию, синдром отдачи, развитие толерантности.
Метилдофа (Допегит) в процессе метаболизма превращается в метилнорадреналин, который активирует тормозные α 2 -адреноре- цепторы сосудодвигательного центра, что приводит к снижению симпатической импульсации и АД. Кроме того, он является «ложным» медиатором, нарушающим синаптическую передачу за счет конкуренции с норадреналином в синаптической щели. Начинают лечение с 250 мг 2-3 раза в сутки, в последующем суточная доза может быть увеличена до 1 г в 2-3 приема. Метилдофа является традиционным препаратом для лечения артериальной гипертензии у беременных.
Побочные эффекты включают вялость, сонливость, ночные страхи, депрессию, развитие паркинсонизма. При длительном применении могут возникать аутоиммунные миокардиты, гемолитическая анемия, гепатиты.
Агонисты имидазолиновых рецепторов
Моксонидин (Физиотенз).
Рилменидин (Альбарел).
Новым классом антигипертензивных препаратов являются агонисты имидазолиновых рецепторов, место которых в терапии АГ в настоящее время уточняется. Механизм действия препаратов связан в первую очередь с активацией центральных имидазолиновых I 1 -рецепторов, что приводит к подавлению активности симпатической нервной системы и снижению АД. Помимо этого, они взаимодействуют с имидазолиновыми рецепторами в эпителии почечных канальцев, усиливая натрийурез. Также они могут активировать тормозные а 2 - адренорецепторы, но сродство препаратов к ним значительно меньше, чем к имидазолиновым рецепторам. По сравнению с клофелином препараты обладают меньшим количеством побочных эффектов, к ним несколько реже развивается толерантность и они практически не вызывают синдрома отдачи.
Показания к применению агонистов имидазолиновых рецепторов при АГ
Метаболический синдром
Абсолютные противопоказания к применению агонистов имидазолиновых рецепторов при АГ
АВ-блокада.
Тяжелая сердечная недостаточность.
Тяжелая депрессия.
Моксонидин назначают по 0,1 мг внутрь 1 раз в сутки. Через 5 - 7 дней доза может быть увеличена до 0,2 мг/сут однократно (под контролем АД), через 2-3 недели дозу повышают до 0,4 мг/сут однократно (или по 0,2 мг 2 раза в сутки). Максимальная суточная доза 0,6-0,8 мг.
Рилменидин назначают по 1 мг 1 раз в сутки. При недостаточном эффекте после одного месяца лечения доза может быть увеличена до 2 мг/сут в два приема.
Симпатолитики
Центральные симпатолитики (алкалоиды раувольфии) в настоящее время не рекомендованы для систематического лечения АГ, что обусловлено их низкой эффективностью и большим количеством побочных эффектов. Резерпин в синаптических окончаниях избирательно и стойко нарушает активный транспорт катехоламинов из цитозоля в гранулы, в результате чего нейромедиаторы разрушаются моноаминоксидазой. Это приводит к истощению запасов катехоламинов, нарушению синаптической передачи и снижению АД. Для резерпина характерны медленно развивающийся умеренный гипотензивный эффект и четко выраженное психоседативное действие.
Побочные эффекты: депрессия, усиление суицидального поведения, чувство страха, сонливость, кошмарные сновидения. Кроме того, за счет активации парасимпатического отдела вегетативной нервной системы возможны брадикардия, атриовентрикулярная блокада, повышение кислотообразующей функции желудка, бронхоспазм, заложенность носа.
а -адреноблокаторы
Празозин (Адверзутен).
Теразозин (Хайтрин).
Доксазозин (Тонокардин).
Для лечения АГ иногда используют α 1 -адреноблокаторы - празозин, доксазозин, теразозин. Эти препараты блокируют α 1 -адреноре- цепторы периферических сосудов, что приводит к расширению артериол, снижению ОПСС и АД. Кроме того, уменьшается постнагрузка и вторично снижается сердечный выброс.
Показания к применению а-адреноблокаторов при АГ
Доброкачественная гиперплазия предстательной железы.
Нарушение толерантности к глюкозе.
Дислипидемия.
Относительные противопоказания к применению α-адреноблокаторов при АГ
Ортостатическая гипотензия.
Сердечная недостаточность.
Лечение α 1 -адреноблокаторами начинают с минимальной дозы, которую больной должен принять перед сном, предварительно от-
менив диуретические препараты (во избежание феномена «первой дозы», проявляющегося ортостатической гипотензией). Основным достоинством препаратов данной группы является их благоприятное влияние на метаболические показатели (в отличие от β-адреноблокаторов и диуретиков). Однако это нивелируется их побочными эффектами: ортостатической гипотензией, отеками несердечного генеза, тахикардией, быстро развивающейся толерантностью. Кроме того, в низких дозах, относительно хорошо переносимых пациентами, гипотензивный эффект α 1 -адреноблокаторов, как правило, недостаточен, а в высоких дозах резко увеличивается количество побочных эффектов. Рекомендуемые дозы препаратов представлены в табл. 2.10.
Таблица 2.10. Рекомендуемые дозы и отдельные фармакокинетические параметры α 1 -адреноблокаторов, используемых для лечения артериальной гипертензии

2.4. ФАРМАКОТЕРАПИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Целевые значения артериального давления
Необходимо стремиться к снижению АД до уровня < 140/90 мм рт. ст. и ниже (при хорошей переносимости) у всех больных АГ. У больных сахарным диабетом и у пациентов с высоким и очень
высоким кардиоваскулярным риском (сопутствующие болезни сердечно-сосудистой системы и почек - инсульт, инфаркт миокарда, почечная дисфункция, протеинурия) целевой уровень АД должен быть <130/80 мм рт. ст. К сожалению, достичь этого уровня АД непросто, даже при комбинированной антигипертензивной терапии, особенно у пожилых пациентов, у больных сахарным диабетом и в целом у пациентов с сопутствующими повреждениями сердечнососудистой системы. Таким образом, для скорейшего и простейшего достижения целевого АД следует начинать антигипертензивную терапию еще до появления значимых кардиоваскулярных повреждений.
Антигипертензивная терапия
Ранее широко применяли поэтапную схему лечения АГ, предполагающую инициальное назначение одного антигипертензивного препарата в малых или в средних дозах с последующими наращиванием дозы и (или) комбинацией с другим(и) препаратами при недостаточной эффективности на предыдущем этапе лечения. В настоящее время постулирована необходимость инициальной комбинированной терапии у значительного числа больных АГ.
Выбор антигипертензивного препарата
Основные преимущества антигипертензивного лечения обусловлены снижением АД как таковым. В соответствии с Европейскими рекомендациями по АГ (2007), представители пяти основных классов антигипертензивных средств (тиазидные диуретики, блокаторы кальциевых каналов, ингибиторы АПФ, антагонисты ангиотензиновых рецепторов и β-адреноблокаторы) подходят как для начального, так и для поддерживающего антигипертензивного лечения в монотерапии или в комбинации друг с другом. При этом β-адреноблокаторы, особенно в сочетании с тиазидными диуретиками, не следует использовать у больных с метаболическим синдромом или с высоким риском развития сахарного диабета. Поскольку многим пациентам необходимо назначение комбинации антигипертензивных препаратов, слишком большое внимание к выбору первого препарата зачастую не оправдано. Тем не менее существует много патологических состояний, при которых доказаны приоритеты одних лекарственных средств перед другими.
Препараты выбора при назначении антигипертензивного лечения в зависимости от сопутствующих заболеваний или состояний (Рекомендации ЕОАГ-ЕОК, 2007)

Примечание: иАПФ - ингибиторы ангиотензинпревращающего фермента; БКК - блокаторы кальциевых каналов; БАР - блокаторы рецепторов ангиотензина II; БАБ - β -адреноблокаторы; АА - антагонисты альдостерона.
* - недигидропиридиновые БКК.
В конечном счете выбор специфического препарата или комбинации препаратов зависит от следующих факторов:
Предшествующего опыта применения препарата (класса препаратов) у конкретного пациента;
Преимущественной эффективности и безопасности препарата при данном профиле кардиоваскулярного риска;
Наличия и характера сопутствующей (некардиальной) патологии, которая может ограничить применение отдельных классов антигипертензивных средств (табл. 2.11);
Возможности взаимодействия с другими антигипертензивными препаратами и с препаратами, назначенными по поводу дру- гих состояний;
Возраста и расы пациента;
Особенностей гемодинамики;
Стоимости лечения.
Таблица 2.11. Основные противопоказания к назначению антигипертензивных средств в зависимости от сопутствующих заболеваний и состояний

Примечание: ПЭКС - имплантированный электрокардиостимулятор; ААБ - α-адреноблокаторы; БКК дгп - дигидропиридиновые блокаторы кальциевых каналов; БКК н/дгп - недигидропиридиновые блокаторы кальциевых каналов; АИР - агонисты имидазолиновых рецепторов.
Критерии выбора монотерапии или комбинации антигипертензивных средств
Клинический опыт свидетельствует о том, что монотерапия АГ позволяет достигнуть целевого уровня АД лишь у незначительной части пациентов, в то время как подавляющему числу больных требуется комбинация двух или более антигипертензивных препаратов.
Лечение АГ можно начать с монотерапии или с комбинации двух антигипертензивных препаратов в малых дозах. В дальнейшем при необходимости можно увеличивать дозы или количество применяемых лекарственных средств.
С монотерапии целесообразно начинать лечение больных АГ I степени с низким или средним кардиоваскулярным риском (схема 2.3). Исходно назначают один препарат в низкой дозе; если он недостаточно эффективен - дозу увеличивают до полной; если неэффективен или плохо переносится - назначают препарат другого класса в низкой, а затем в полной дозе. Критерий «положительного ответа» на лечение: снижение АД ≥20 мм рт. ст. для систолического и ≥10 мм рт. ст. для диастолического АД. Такая тактика называется последовательной монотерапией. Ее недостатки заключаются в том, что целевых значений АД на фоне монотерапии удается достигнуть только у 20-30% больных, а частая смена препаратов и доз увеличивает трудоемкость лечения, снижает степень доверия к врачу и приверженность пациентов к лечению, а также неоправданно затягивает время, необходимое для нормализации АД. При неэффективности монотерапии переходят к комбинированному лечению.
Комбинация антигипертензивных средств исходно требуется больным с АГ II-III степени или с высоким и очень высоким кар- диоваскулярным риском (см. схему 2.3). Лечение может быть начато с «низкодозовой» комбинации, которая вызывает меньше побочных эффектов и осложнений, чем полнодозовая монотерапия. При частичной эффективности низкодозовой комбинации доза одного или обоих компонентов может быть увеличена, либо назначен третий препарат в низкой дозе. Для достижения целевого АД некоторым больным может потребоваться назначение трех и более препаратов в полной дозе. Чаще всего в комбинированной терапии нуждаются пациенты с сахарным диабетом, патологией почек и тяжелыми сопутствующими заболеваниями сердечно-сосудистой системы. Недостатками тактики начальной (инициальной) комбинированной антигипертензивной терапии следует считать: риск необосно- ванного назначения «лишнего» препарата, затруднения при опре-

Схема 2.3. Тактика лечения артериальной гипертензии: выбор между монотерапией и комбинированной терапией (Рекомендации ЕОАГ-ЕОК, 2007)
делении препарата, являющегося виновником аллергии или плохой переносимости лечения. Преимущества комбинированного лечения:
Более быстрое, чем при эффективной монотерапии, достижение целевого АД;
Большая эффективность контроля АГ в целом;
Лучшая переносимость при менее выраженных побочных эффектах;
Сокращение времени и количества попыток, требующихся для подбора эффективной терапии, что способствует повышению уверенности врача и доверия к нему пациента;
Возможность назначения фиксированных комбинаций препаратов в одной таблетке, упрощающая лечение и повышающая приверженность пациентов к терапии.
Между тем не все антигипертензивные средства можно эффективно и безопасно комбинировать. Рациональная комбинация препара- тов должна обладать следующими свойствами:
Суммация или потенцирование гипотензивных эффектов составляющих комбинацию препаратов;
Компенсация контррегуляторных механизмов, запускающихся при применении каждого из составляющих комбинацию препаратов;
Отсутствие побочных эффектов, обусловленных взаимодействием комбинируемых препаратов;
Способность эффективно предотвращать субклинические поражения органов-мишеней и снижать риск сердечно-сосудистых осложнений по данным контролируемых исследований.
Эффективность различных комбинаций из большинства классов антигипертензивных средств представлена в табл. 2.12.
Таблица 2.12. Различные комбинации антигипертензивных препаратов (Чазова И. Е., Ратова Л. Г., 2006, с изменениями)

Европейскими экспертами в 2007 г. для лечения АГ рекомендованы только шесть рациональных комбинаций из пяти основных классов антигипертензивных препаратов:
1) тиазидный диуретик + ингибитор АПФ (ТД + иАПФ);
2) тиазидный диуретик + блокатор рецепторов ангиотензина II (ТД +
БАР);
3) блокатор кальциевых каналов + ингибитор АПФ (БКК + иАПФ);
4) блокатор кальциевых каналов + блокатор рецепторов ангиотензина II (БКК + БАР);
5) блокатор кальциевых каналов + тиазидный диуретик (БКК + ТД);
6) β-адреноблокатор + блокатор кальциевых каналов (дигидропи-
ридин) (БАБ + БКК).
Также признана целесообразной комбинация тиазидных диуретиков и калийсберегающих средств (триамтерен, амилорид, спиронолактон), изучается рациональность комбинации иАПФ и БАР, блокаторов ренина и тиазидных диуретиков. Безусловно эффективная комбинация тиазидных диуретиков с β-адреноблокаторами, рекомендованная и успешно использовавшаяся ранее, в настоящее время признана нежелательной из-за усиления негативных метаболических эффектов. Ее не следует применять у пациентов с риском сахарного диабета и метаболическим синдромом.
Наиболее эффективные комбинации препаратов
1. В настоящее время комбинация иАПФ и диуретика - одна из самых широко назначаемых. Ее применение позволяет достичь целевого уровня АД более чем у 80% больных. В этом случае:
Происходит потенцирование гипотензивных эффектов препаратов;
ИАПФ снижают активность РААС, повышающуюся при длительном назначении диуретиков;
Диуретик повышает эффективность иАПФ у больных с нормо- и гипорениновой формами АГ;
ИАПФ препятствуют развитию гипокалиемии на фоне диуретиков;
ИАПФ не влияют на липидный обмен и снижают гиперурикемию и гипергликемию, возникающую на фоне приема диуретиков.
Данная комбинация рекомендуется в первую очередь пациентам с сердечной недостаточностью, гипертрофией левого желудочка, диабетической нефропатией. Она также эффективна у больных с тяжелой АГ, у пожилых пациентов при неэффективности монотерапии
иАПФ.
2. По антигипертензивным эффектам к иАПФ близки БАР, поэтому их комбинация с мочегонными средствами обладает практически теми же преимуществами, что и комбинация иАПФ с диуретиками.
Совместное применение БАР и диуретика приводит к заметному снижению АД у пациентов, как с высокой, так и с низкой активностью ренина.
3. Комбинация иАПФ + БКК (а также БАР + БКК) эффективна как при высоко-, так и при низкоренинной формах АГ. Применение этих препаратов позволяет:
Потенцировать гипотензивный эффект;
Усилить натрийуретический эффект;
Повысить эффективность иАПФ у больных с нормо- и гипорениновой формами АГ;
Увеличить эффективность дигидропиридиновых БКК за счет подавления иАПФ активности САС;
Снизить выраженность отеков голеней на фоне приема БКК (наиболее характерно для дигидропиридиновых БКК);
Уменьшить сухой кашель на фоне приема иАПФ;
Достичь органопротективного действия (в том числе нефропротективного за счет расширения в почках афферентных артериол под влиянием иАПФ и афферентных и эфферентных артериол под воздействием недигидропиридиновых БКК);
Исключить возможность негативного влияния на липидный, углеводный и пуриновый обмен.
4. Комбинация β-адреноблокаторов и БКК (производных дигидропиридина) позволяет:
Достичь аддитивности в гипотензивном эффекте;
Уменьшить в помощью β-блокаторов активацию САС, развивающуюся на начальном этапе применения дигидропиридиновых
БКК;
Уменьшить выраженность отеков голеней на фоне приема
БКК.
Комбинация показана больным АГ с ИБС, а также пациентам с тяжелой формой АГ, рефрактерной к монотерапии.
5. Комбинация БКК и диуретиков не выглядит очевидной, так как допускает усиление неблагоприятных ортостатических реакций и компенсаторное повышение активности ренин-ангиотензиновой системы. В то же время:
Заметно потенцируется антигипертензивное действие обоих препаратов;
Повышается эффективность лечения изолированной систолической АГ у пожилых пациентов;
Усиливается выраженность органопротективных эффектов.
6. По-прежнему весьма часто используют сочетание β-адреноблокаторов и диуретиков. В этом случае:
Потенцируются гипотензивные эффекты препаратов;
- β-адреноблокаторы препятствуют развитию гипокалиемии на фоне диуретиков;
- β-адреноблокаторы предупреждают активацию САС и РААС на фоне назначения мочегонных средств.
Данная комбинация не только высокоэффективна, но и низкозатратна. В то же время при одновременном назначении β-адреноблокаторов и диуретиков потенцируется их негативное влияние на углеводный и липидный обмен, снижается потенция. Эту комбинацию не применяют у больных с метаболическим синдромом и высоким риском диабета, а для уменьшения неблагоприятного влияния на обмен липидов и глюкозы используют небольшие дозы мочегонных препаратов (эквивалентные не более 6,25-12,5 мг гидрохлоротиазида).
7. При совместном применении β-адреноблокатора с α 1 -адреноблокатором происходит:
Потенцирование гипотензивного эффекта;
Уменьшение β-блокаторами активации САС, развивающейся на начальном этапе применения α 1 -адреноблокаторов;
Снижение а 1 -адреноблокаторами вазоспазма, вызываемого неселективными β-адреноблокаторами;
Редукция а 1 -адреноблокаторами неблагоприятного влияния β-адреноблокаторов на липидный и углеводный обмен.
Между тем долгосрочные эффекты такой комбинации антигипертензивных средств изучены мало.
8. Современные препараты центрального действия (агонисты имидазолиновых рецепторов) хорошо комбинируются со всеми другими классами гипотензивных средств. Однако при их сочетании с β-адре- ноблокаторами необходимо соблюдать осторожность в связи с риском развития брадикардии. Влияние этой комбинации на долгосрочный прогноз не исследовано.
Существуют как низкодозовые, так и полнодозовые комбинированные препараты с фиксированным составом основных гипотензивных средств (табл. 2.13). К преимуществам фиксированных рациональных комбинаций относятся:
Простота назначения и процесса титрования дозы, повышающая приверженность пациентов к лечению;
Взаимное повышение антигипертензивного эффекта препаратов, входящих в комбинированную лекарственную форму;
Увеличение числа пациентов со стабильным снижением АД за счет разнонаправленности антигипертензивного эффекта входящих в нее компонентов;
Уменьшение частоты возникновения побочных эффектов как за счет меньших доз комбинируемых антигипертензивных средств, так и за счет взаимной нейтрализации этих эффектов;
Уменьшение стоимости лечения;
Исключение возможности использования нерациональных комбинаций;
Наиболее эффективная органопротекция и уменьшение риска и числа сердечно-сосудистых осложнений.
У фиксированных комбинаций есть два основных недостатка:
Фиксированность доз ограничивает возможность варьировать дозами препаратов. Однако это преодолевается за счет выпуска комбинаций, содержащих разные дозы одинаковых компонентов;
Определенные трудности в идентификации и соотнесении нежелательных явлений с влиянием того или иного компонента препарата.
Менее эффективные комбинации препаратов
В настоящее время убедительных данных, свидетельствующих в пользу применения комбинаций β-адреноблокатор + иАПФ и β- адреноблокатор + БАР, не существует. Считается, что оба препарата действуют однонаправленно - снижают активность РААС, следовательно, потенцирования антигипертензивного действия при их совместном назначении не происходит. Тем не менее есть некоторые особенности действия препаратов, которые могут обусловить синергизм их антигипертензивного эффекта. Так, предполагается, что гиперренинемия, возникающая вследствие ингибирования АПФ, может быть значительно снижена с помощью β-адреноблокаторов, которые подавляют секрецию ренина юкстагломерулярным аппаратом почек. В свою очередь, вазоконстрикция, возникающая при назначении БАБ, может быть заметно уменьшена при применении иАПФ, обладающих вазодилатирующими свойствами. Иногда такая комбинация может быть рекомендована в том случае, когда при низкой активности РААС сохраняется выраженная тахикардия. У пациентов с хронической сердечной недостаточностью необходимость применения иАПФ в сочетании с β-адреноблокатором не вызывает сомнения, но у больных с АГ эта комбинация не может считаться оптимальной.
Таблица 2.13. Состав некоторых комбинированных гипотензивных препаратов

Продолжение таблицы 2.13

Окончание табл. 2.13

Окончание таблицы 2.13

Примечание: * - в виде сукцината.
Комбинация иАПФ и БАР используется в клинической практике крайне редко, так как считается, что оба препарата действуют на разные уровни одной системы - РААС - и потенцирования антигипер- тензивного действия при их совместном назначении не происходит, так как БАР вызывают полное снижение активности РААС. При этом иАПФ подавляют вызываемое БАР реактивное повышение синтеза АТ-II, а значит ослабляют косвенную стимуляцию ангиотензиновых рецепторов II типа, которая считается одним из важных механизмов антигипертензивного действия БАР Однако именно данная комбинация может оказаться полезной и даже незаменимой при лечении высокорениновых форм АГ и для обеспечения нефропротекции у больных с артериальной гипертензией.
Нерациональные комбинации препаратов
К нерациональным комбинациям относятся такие сочетания лекарственных препаратов, при применении которых либо не происходит потенцирования антигипертензивного действия, либо усиливаются побочные эффекты. К ним относятся комбинации: β-блокатор + БКК фенилалкиламинового ряда, β-адреноблокатор + препарат центрального действия, БКК дигидропиридинового ряда + α 1 -адреноблокатор.
Для обеспечения максимальной эффективности лечения АГ врачу следует соблюдать несколько правил:
Целесообразно назначение фиксированной комбинации препаратов (в одной таблетке), что упрощает режим приема и улучша- ет комплайенс пациентов;
Необходимо отдавать предпочтение препаратам пролонгированного действия для обеспечения 24-часового эффекта при однократном приеме. Это позволяет добиться устойчивого гипотензивного эффекта и перманентной защиты органов-мишеней, кроме того - повысить приверженность больного к лечению;
Эффективность круглосуточного контроля АД можно оценить, измеряя АД перед приемом очередной дозы препарата или при амбулаторном мониторировании;
Следует уделять повышенное внимание побочным эффектам препаратов, поскольку они являются наиболее важной причиной отказа от лечения (отсутствие приверженности к лечению);
При неосложненной АГ и у пожилых больных объем терапии наращивается постепенно, до достижения целевого АД;
При высоком кардиоваскулярном риске целевое АД должно
быть достигнуто как можно скорее, методом комбинированной терапии с относительно быстрым увеличением дозы наряду с собственно антигипертензивным лечением корригируют устранимые факторы риска (гипергликемия, гиперхолестеринемия и пр.) по общепринятым стандартам; - забота о поддержании высокой приверженности больного к лечению - принципиально важный компонент терапии АГ, она включает: планирование регулярных визитов пациента, медицинское просвещение больного (в том числе школы АГ); разъяснение сути действия препаратов и обсуждение возможных побочных действий; регулярное поощрение по отношению к достигнутым больным изменениям образа жизни; поощрение самоконтроля АД; вовлечение родственников в процесс выполнения медицинских рекомендаций, простой и понятный режим приема препаратов, привязанный к ежедневному распорядку.
Критерии эффективности гипотензивной проводимой терапии
Результаты проводимой терапии можно разделить на краткосрочные (ближайшие), среднесрочные (промежуточные) и долгосрочные (отдаленные). Ближайшие результаты определяются через несколько недель или месяцев лечения и включают снижение АД до приемлемого уровня, отсутствие побочных эффектов, улучшение лабораторных показателей, адекватное выполнение больным назначений врача, благоприятное влияние на качество жизни. Промежуточные результаты, которые иногда называют суррогатными конечными точками лечения, являются показателем эффективности проводимой гипотензивной и органопротективной терапии. Они включают в себя влияние на состояние функции сердца и почек, гипертрофию левого желудочка, прогрессирование атеросклероза, стенокардии, влияние на состояние углеводного и липидного обмена. Отдаленные результаты представляют собой конечные точки лечения и включают в себя такие показатели, как кардиальные, цереброваскулярные и почечные осложнения, поражения аорты и периферических артерий и смертность (от кардиальных и некардиальных причин).
Краткосрочные критерии эффективности антигипертензивной терапии (1-6 месяцев от начала лечения)
Снижение АДс и/или АДд на 10% и более или достижение целевого уровня АД.
Отсутствие гипертонических кризов.
Сохранение или улучшение качества жизни.
Влияние на модифицируемые факторы риска.
Среднесрочные критерии эффективности антигипертензивной терапии (более 6 месяцев от начала лечения)
Достижение целевых значений АД.
Отсутствие поражения органов-мишеней или обратимая динамика имевшихся осложнений.
Устранение модифицируемых факторов риска.
Долгосрочные критерии эффективности антигипертензивной терапии
Стабильное поддержание АД на целевом уровне.
Отсутствие прогрессирования поражения органов-мишеней.
Компенсация имеющихся сердечно-сосудистых осложнений.
2.5. ЛЕЧЕНИЕ ГИПЕРТОНИЧЕСКИХ КРИЗОВ
Под гипертоническими кризами (ГКр) обычно понимают состояния с внезапным повышением АД, которые неоднородны по кли- ническим проявлениям и прогнозу и могут представлять угрозу для жизни или здоровья. ГКр могут осложнять все стадии гипертонической болезни, но чаще всего они возникают при II-III ст. Внезапное повышение АД может провоцироваться нервно-психической травмой, употреблением алкоголя, резкими колебаниями атмосферного давления, отменой гипотензивной терапии и др. В патогенезе ГКр выделяют:
Сосудистый механизм - повышение общего периферического сопротивления в результате увеличения вазомоторного (ней- рогуморальные влияния) и базального (при задержке натрия) тонуса артериол;
Кардиальный механизм - увеличение сердечного выброса, сократимости миокарда и фракции изгнания в ответ на повышение ЧСС, объема циркулирующей крови.
М. С. Кушаковский (2004) выделяет три типа гипертонических кризов.
Нейровегетативный. Данный тип гипертонического криза встречается чаще всего. АД повышается ночью или во время пробуждения, сопровождается возбуждением, сильными головными болями, тахикардией. АД быстро повышается: систолическое до 230-250 мм рт. ст., диастолическое до 120-125 мм рт. ст.
При отечной форме больной заторможен, тучен, вял, лицо одутловато, диурез резко снижен.
Судорожная форма встречается редко, наблюдается при самом тяжелом течении АГ и проявляется потерей сознания, тоническими и клоническими судорогами.
Среди гипертонических кризов выделяют экстренные и неотложные состояния. Под экстренными гипертоническими кризами (ГКр I типа) понимают гипертонические состояния, характеризующиеся выраженным повышением АД (>180/120 мм рт. ст.), осложненные признаками наступающей или прогрессирующей дисфункции органов-мишеней (нестабильная стенокардия, острая левожелудочковая недостаточность, расслоение аневризмы аорты, эклампсия, инсульт, отек соска зрительного нерва и др.). Однако даже в том случае, если повышение АД не превышает 180/120 мм рт. ст., но приводит к появлению или усугублению симптомов поражения органов-мишеней, такое состояние должно рассматриваться как ГКр I типа.
Для предупреждения или ограничения поражения органов-мишеней в этом случае требуется немедленное снижение АД в течение первых минут и часов (не обязательно до нормы) с помощью парентеральных препаратов.
Экстренные состояния при гипертонических кризах
Гипертензивная энцефалопатия.
АГ с признаками левожелудочковой недостаточности.
АГ при инфаркте миокарда.
АГ при нестабильной стенокардии.
АГ при расслоении аорты.
Тяжелая АГ, ассоциированная с субарахноидальным кровоизлиянием или цереброваскулярной катастрофой.
Криз при феохромоцитоме.
АГ при отравлении амфетаминами, ЛСД, кокаином или «экстази».
АГ во время операции.
Тяжелая преэклампсия или эклампсия.
Начальная цель лечения экстренных гипертонических состояний - снижение среднего АД не более чем на 25% в интервале от нескольких минут до одного часа с помощью парентерально вводимых гипотензивных препаратов. Впоследствии, если АД стабильно, его
снижают в течение следующих 2-6 часов до 160 мм рт ст. (систоличес- кое) и 100-110 мм рт. ст. (диастолическое) (возможен переход на пероральные лекарственные формы). При этом следует избегать чрезмерного снижения АД, которое может вызвать почечную, церебральную или коронарную ишемию. Если этот уровень АД хорошо переносится и состояние пациента клинически стабильно, то в течение следующих 24-48 ч можно осуществить дальнейшее постепенное снижение АД до нормального уровня.
Пациенты с ишемическим инсультом, для которых клинические исследования не показали пользы срочного антигипертен- зивного лечения;
Пациенты с расслоением аорты, у которых систолическое АД следует снижать до уровня < 100 мм рт. ст., если они это переносят.
Под неотложными гипертоническими состояниями (ГК II типа) понимают ситуации, связанные с резким повышением АД без про- грессирующей дисфункции органов-мишеней. Сюда же относят случаи бессимптомного повышения АДс ≥220 мм рт. ст. и/или АДд ≥120 мм рт. ст.
В этих ситуациях необходимо постепенное снижение АД на 15- 25% от исходного или ≤160/110 мм рт. ст. в течение 12-24 ч (с помощью применения пероральных гипотензивных лекарственных средств). Оценка эффективности и коррекция неотложной терапии проводится по истечении времени, необходимого для начала наступления гипотензивного эффекта препарата (15-30 мин).
Для купирования судорожной формы гипертонического криза дополнительно назначают диазепам (Седуксен, Релиум, Сибазон) в дозе 10-20 мг (2-4 мл 0,5% раствора). Препарат вводят внутривенно медленно до устранения судорог. Также можно назначить сульфат магния 2,5 г внутривенно струйно медленно (10 мл 25% раствора в 10 мл 0,9% раствора натрия хлорида). В этом случае основную опасность представляет остановка дыхания. Менее опасно внутривенное капельное введение магния сульфата (10 мл 25% раствора в 250 мл 0,9% раствора натрия хлорида). При угнетении дыхания необходимо внутривенное введение кальция хлорида.
Для лечения гипертонических кризов врач должен располагать сравнительно небольшим, но полноценным, а главное, хорошо ему известным набором гипотензивных средств (табл. 2.14).
Таблица 2.14. Основные препараты, используемые для купирования гипертонического криза

Продолжение табл. 2.14

Продолжение таблицы 2.14

Продолжение табл. 2.14

Продолжение таблицы 2.14

Окончание табл. 2.14

Окончание таблицы 2.14

Примечание: * - при внутривенном введении клонидина возможно кратковременное повышение АД за счет активации периферических α 1 - и α 2 -адренорецепторов сосудов; ** - введение через специальную систему; *** - можно повторить болюсное введение через 5 мин или увеличить инфузию до 300 мкг/мин.
Требования, предъявляемые к парентеральному препарату для лечения гипертонических кризов
Короткое время наступления гипотензивного эффекта и его сохранение 3-4 часа после прекращения введения.
Дозозависимый предсказуемый эффект.
Минимальное влияние на мозговой и почечный кровоток, сократимость миокарда.
Эффективность у большинства больных.
Отсутствие противопоказаний к применению у большинства пациентов.
Минимальный спектр побочных эффектов.
Требования, предъявляемые к пероральному препарату для лечения гипертонических кризов
Быстрое (20-30 мин) начало гипотензивного действия при пероральном приеме, продолжающееся 4-6 ч.
Дозозависимый предсказуемый гипотензивный эффект.
Возможность применения у большинства пациентов (отсутствие побочных эффектов).
Доступность.
После начала гипотензивной терапии желательно врачебное наблюдение в течение не менее 6 ч для своевременного выявления возможных осложнений ГКр (в первую очередь нарушения мозгового кровообращения и инфарктамиокарда) и побочныхэффектов лекарственной терапии (например, ортостатической гипотензии). При развитии ортостатической гипотензии рекомендуют постельный режим с мониторированием АД. При избыточном снижении АД возможно внутривенное капельное введение жидкостей (например, изотонического раствора натрия хлорида), при упорном сохранении гипотензии возможно добавление к терапии вазопрессоров (например, дофамина).
ЛИТЕРАТУРА
Алмазов В. А. Гипертоническая болезнь / В. А. Алмазов, Е. В. Шляхто. - М., 2000. - 118 с.
Белоусов Ю. Б. Клиническая фармакология и фармакотерапия. - 2-е изд., стереотипное / Ю. Б. Белоусов, В. С. Моисеев, В. К. Лепахин. - М.: Универсум паблишинг, 2000. - 539 с.
Бондаренко Б. Б. Телмисартан - новый блокатор рецепторов ангиотензина II / Б. Б. Бондаренко, Ю. Б. Зима // Артериальная гипертензия. - 2002. - Т 8, ? 3. - С. 82-84.
Верткин А. Л. Гипертонический криз: от традиционных представлений до современных клинических рекомендаций / А. Л. Верткин, М. И. Лукашов, О. Б. Полосьянц, Н. И. Пеньтковский // Лечащий врач. - 2007. - ? 6. - http:// old.osp.ru/doctore/2007/06/062.htm.
Гиляревский С. Р. Блокаторы а 1 -адренорецепторов после ALLHAT доказательства и сомнения / С. Р. Гиляревский // Сердце: журнал для практикующих
врачей. - 2003. - Т. 2, ? 4. - С. 202-206.
Кобалава Ж. Д. Гипертонические кризы: существуют ли реальные противо- речия в классификации и лечении? / Ж. Д. Кобалава, К. М. Гудков // Сердце: журнал для практикующих врачей. - 2003. - Т 2, ? 3. - С. 116-127.
Кобалава Ж. Д. Основные принципы лечения артериальной гипертонии: пе- ресмотренное и новое / Ж. Д. Кобалава, Ю. В. Котовская // Сердце: журнал для практикующих врачей. - 2004. - Т. 3, ? 2. - С. 75-79.
Конради А. О. Применение препаратов центрального действия в лечении артериальной гипертензии: достижения и перспективы / А. О. Конради // Артери- альная гипертензия. - 2002. - Экстра-выпуск. - С. 7-9.
Маколкин В. И. Антагонисты кальция в лечении артериальной гипертензии /
B. И. Маколкин // Русский медицинский журнал. - 2003. - Т. 11, ? 9. -
C. 511-513.
Метелица В. И. Справочник по клинической фармакологии сердечно-сосу- дистых лекарственных средств. - 3-е изд., перераб. и доп. / В. И. Метелица. - М.: МИА, 2005. - 1528 с.
Моисеев С. В. Антагонисты кальция при артериальной гипертонии: прак- тические аспекты / С. В. Моисеев // Клиническая фармакология и терапия. - 2006. - Т 15, ? 3. - С. 32-36.
Преображенский Д. В. Ингибиторы АПФ и АТ1-блокаторы в клинической практике / Д. В. Преображенский, Б. А. Сидоренко, Т. А. Батыралиев. - М.:
Альянс-ПРЕСИД, 2002. - 224 с.
Преображенский Д. В. Диагностика и лечение артериальной гипертензии. - Ч. 1. Вып. А / Д. В. Преображенский, Б. А. Сидоренко. - М.: Альянс-ПРЕСИД,
2002. - 99 с.
Преображенский Д. В. Диагностика и лечение артериальной гипертензии. - Ч. 1. Вып. Б / Д. В. Преображенский, Б. А. Сидоренко. - М.: Альянс-ПРЕСИД,
2002. - 254 с.
Профилактика, диагностика и лечение артериальной гипертензии. Российские рекомендации (второй пересмотр). - М., 2004. - 20 с.
Сидоренко Б. А. Блокаторы АТ1-ангиотензиновых рецепторов / Б. А. Сидо- ренко, Д. В. Преображенский. - М.: Информатик, 2001. - 200 с.
Терапевтический справочник Вашингтонского университета / под ред. М. Вудли, А. Уэлан. - М.: Практика, 1995. - 831 с.
Фофанова Т. В. Ингибиторы АПФ + низкие дозы тиазидных диуретиков: идеальная комбинация для лечения артериальной гипертонии / Т. В. Фофанова, Ф. Т. Агеев // Сердце: журнал для практикующих врачей. - 2004. - Т. 3, ? 2. -
С. 99-103.
Чазова И. Е. Алгоритм диагностики и лечения артериальной гипертензии / И. Е. Чазова // Consilium-Medicum. - 2003. - Т. 4, ? 3. - С. 130-133.
Чазова И. Е. Комбинированная терапия артериальной гипертонии: прос- то о сложном / И. Е. Чазова, Л. Г. Ратова // Consilium-Medicum. - 2006. - Т. 8, ? 5. - http://www.polyclinic.spb.ru/articles. php?subaction = showfull&id = 118672 9987&archive = &start_from = &ucat = 10&action = 10.
2003 European Society of Hypertension - European Society of Cardiology Guidelines for the management of arterial hypertension // J. Hypertens. - 2003. - Vol. 21. - P. 1011-1053.
Atlas S. A. The renin-angiotensin aldosterone system: pathophysiological role and pharmacologic inhibition / S. A. Atlas // О Manag. Care Pharm. - 2007. - Vol. 13, ? 8, Suppl. B. - P. 9-20.
Aulakh G. K.. Аn update on non-peptide angiotensin receptor antagonists and related RAAS modulators / Aulakh G. K., Sodhi R. K., Singh M. // Life Sci. - 2007. - Vol. 81, ? 8. - P. 615-639.
Bisognano J. D. Calcium channel blockers, angiotensin receptor blockers, and angiotensin-converting enzyme inhibitors: effectiveness in combination with diuretics or beta-blockers for treating hypertension / J. D. Bisognano, T McLaughlin, C. S. Roberts, S. S. Tang // Vasc. Health Risk Manag. - 2007. - Vol. 3, ? 5. - P. 579-585.
Cardiovascular Drugs // Drugs of the Future. - 2002. - Vol. 27, ? 1. - P. 61-103.
Cayley W. E. Jr. Are beta blockers effective first-line treatments for hypertension? / W. E. Jr. Cayley // Am. Fam. Physician. - 2007. - Vol. 76, ? 9. - P. 1306-1308.
Chalmers J. WHO-ISH Hypertension guidelines Committee. 1999 World Heath Organization - International Society of Hypertension guidelines for the Management of Hypertension / J. Chalmers // J. Hypertens. - 1999. - Vol. 17. - P. 151-185.
Chobanian A. V. Седьмой отчет Совместной национальной комиссии по пре- дупреждению, выявлению, оценке и лечению высокого артериального давления / A. V. Chobanian, G. L. Barkis, H. R. Black et al. // Сердце: журнал для практикую- щих врачей. - 2004. - Т. 3, ? 5. - С. 224-261.
Goodman & GilmanS. The pharmacological basis of therapeutics / Ed. J. G. Hardman Ninth edition. New York et al.: McGraw-Hill, 1998. - 1905p.
Gradman A. H., Kad R. Renin inhibition in hypertension // J Am Coll Cardiol. - 2008. - Vol. 51, ? 5. - P. 519-528.
Guidelines Committee. 2003 European Society of Hypertension - European Society of Cardiology guidelines for the management of arterial hypertension // J. Hypertension. - 2003. - Vol. 21. - P. 1011-1053.
Hansson L., Zanchetti Α., Carruthers S.G, et al. Westerink, for the HOT Study Group. Effects og intensive blood pressure lowering and low-bose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial / I. Hanson, A. Zanchetti, S. Carruthers et al. // Lancet. - 1998. - Vol. 351. - P
1755-1762.
Heart outcomes evaluations (HOPE) study investigators. Effects angiotensin-convertingenzyme in hibitor, ramipril, on cardiovascular events in high-risk patients //
N. Engl. J. Med. - 2000. - Vol. 342. - P. 145-153.
Katzung B. G. Basic & clinical pharmacology. - Eighth edition / B. G. Katzung. - New York et al.: McGraw-Hill, 2001. - 1217 p.
Mancia G. Guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) / G. Mancia, G. De Backer,
A. Dominiczak et al. // J. Hypertens. - 2007. - Vol. 25, ? 6. - P. 1105-1187.
Matchar D. B. Systematic review: comparative effectiveness of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers for treating essential hypertension / D. B. Matchar, D. C. McCrory, L. A. Orlando et al. // Ann Intern Med. - 2008. - Vol. 148, ? 1. - P. 16-29.
Meier P. The future of angiotensin II inhibition in cardiovascular medicine / Р. Meier, М. Maillard, М. Burnier // Curr Drug Targets Cardiovasc Haematol Disord. - 2005. - Vol. 5, ? 1. - P. 15-30.
Mustone A. L. Desirable therapeutic characteristics of an optimal antihypertensive agent / A. L. Mustone // Drugs. - 2006. - Vol. 66, ? 9. - P. 1239-1252.
Nesbitt S. D. Antihypertensive combination therapy: optimizing blood pressure control and cardiovascular risk reduction / S. D. Nesbitt // J. Clin. Hypertens. - 2007. - Vol. 9, ? 11, Suppl. 4. - P. 26-32.
Nussberger J. Tolerability, pharmacokinetics and phatmacodynamic effects of the renin inhibitor SPP 100 after repeated oral administration in healthy volunteers / J. Nussberger, H. Brunner, C. Jensen, J. Mann // Eur. Heart J. - 2001. - Vol. 22. -
Abst. P2294.
Oh B.-H. Aliskiren, an oral renin inhibitor, provides dose-dependent efficacy and sustained 24-hour blood ressure control in patients with hypertension / B.-H. Oh,
J. Mitchell, J. R. Herron et al. // J. Am. Coll Cardiol. - 2007. - Vol. 49, ? 11. - P. 1157-1163.
Remme W. J. Beta blockers or angiotensin-converting-enzyme inhibitor/angioten- sin receptor blocker: what should be first? / W. J. Remme // Cardiol Clin. - 2007. -
Vol. 25, ? 4. - P. 581-594.
Richard S. Vascular effects of calcium channel antagonists: new evidence / S. Richard // Drugs. - 2005. - Vol. 65, Suppl. 2. - P. 1-10.
Schmieder R. E. Reduced incidence of new-onset atrial fibrillation with angiotensin II receptor blockade: the VALUE trial / R. E. Schmieder, S. E. Kjeldsen, S. Julius
et al. // J. Hypertens. - 2008. - Vol. 26, ? 3. - P. 403-411.
The Sixth report of the Joint National Committee on detection, evaluation, and treatment of high blood pressure (JNC VII) // Arch Intern Med. - 1997. - Vol. 157. -
P. 2413-2446.
Triggle D. J. Calcium channel antagonists: clinical uses-past, present and future / D. J. Triggle // Biochem Pharmacol. - 2007. - Vol. 74, ? 1. - P. 1-9.