کادمیوم: حقایق و حقایق. به دلیل خواص ارزشمندی که دارد، دامنه کادمیوم هر سال در حال گسترش است. جرم کادمیوم
تعریف
کادمیومچهل و هشتمین عنصر جدول تناوبی است. نامگذاری - سی دی از لاتین "کادمیوم". واقع در دوره پنجم گروه IIB. به فلزات اشاره دارد. شارژ اصلی 48 است.
کادمیوم از نظر خواص مشابه روی است و معمولاً به صورت ناخالصی در سنگ معدن روی یافت می شود. از نظر شیوع در طبیعت، به طور قابل توجهی از روی پایین تر است: محتوای کادمیوم در پوسته زمین تنها حدود 10-5٪ (وزنی) است.
کادمیوم یک فلز سفید نقره ای (شکل 1)، نرم، چکش خوار و چکش خوار است. در یک سری از ولتاژها، از روی بیشتر است، اما جلوتر از هیدروژن است و آخرین اسید را جابجا می کند. از آنجایی که Cd (OH) 2 یک الکترولیت ضعیف است، نمک های کادمیوم هیدرولیز شده و محلول های آنها اسیدی است.
برنج. 1. کادمیوم. ظاهر.
وزن اتمی و مولکولی کادمیوم
وزن مولکولی نسبی یک ماده(M r) عددی است که نشان می دهد چند برابر جرم یک مولکول معین بزرگتر از 1/12 جرم یک اتم کربن است، و جرم اتمی نسبی یک عنصر(A r) - چند برابر جرم متوسط اتم های یک عنصر شیمیایی بیشتر از 1/12 جرم اتم کربن است.
از آنجایی که کادمیوم در حالت آزاد به شکل مولکول های کادمیوم تک اتمی وجود دارد، مقادیر جرم اتمی و مولکولی آن بر هم منطبق است. آنها برابر با 112.411 هستند.
ایزوتوپ های کادمیوم
مشخص شده است که کادمیوم را می توان در طبیعت به شکل هشت ایزوتوپ پایدار یافت که دو تای آنها رادیواکتیو هستند (113 Cd، 116 Cd): 106 Cd، 108 Cd، 110 Cd، 111 Cd، 112 Cd و 114 Cd. اعداد جرمی آنها به ترتیب 106، 108، 110، 111، 112، 113، 114 و 116 است. هسته اتم ایزوتوپ کادمیوم 106 Cd شامل چهل و هشت پروتون و پنجاه و هشت نوترون است و ایزوتوپ های باقی مانده فقط از نظر تعداد نوترون ها با آن تفاوت دارند.
یون های کادمیوم
در سطح انرژی بیرونی اتم کادمیوم، دو الکترون ظرفیتی وجود دارد:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 .
در نتیجه برهمکنش شیمیایی، کادمیوم الکترون های ظرفیت خود را رها می کند، یعنی. اهدا کننده آنها است و به یک یون با بار مثبت تبدیل می شود:
Cd 0 -2e → Cd 2+.
مولکول و اتم کادمیوم
در حالت آزاد، کادمیوم به شکل مولکول های کادمیوم تک اتمی وجود دارد. در اینجا برخی از خواصی که اتم و مولکول کادمیوم را مشخص می کنند آورده شده است:
آلیاژهای کادمیوم
کادمیوم به عنوان یک جزء در برخی از آلیاژها گنجانده شده است. به عنوان مثال، آلیاژهای مس حاوی حدود 1٪ کادمیوم (کادمیم برنز) برای ساخت سیمهای تلگراف، تلفن، ترالیبوس استفاده میشوند، زیرا این آلیاژها دارای استحکام و مقاومت در برابر سایش بیشتری نسبت به مس هستند. تعدادی از آلیاژهای سبک، مانند آنهایی که در کپسول های آتش نشانی خودکار استفاده می شوند، حاوی کادمیوم هستند.
نمونه هایی از حل مسئله
مثال 1
مثال 2
| ورزش | چه کمپلکسی در محلول حاوی 1×10-2 مولار کادمیوم (II) و 1 مولار آمونیاک غالب است؟ |
| راه حل | در محلول حاوی یون های کادمیوم و آمونیاک، تعادل های زیر برقرار می شود: Cd 2+ + NH 3 ↔Cd (NH 3) 2+; Cd (NH 3) 2+ + NH 3 ↔ Cd (NH 3) 2 2+; Cd (NH 3) 3 2+ + NH 3 ↔ Cd (NH 3) 4 2+. از جداول جستجو b 1 = 3.24×10 2، b 2 = 2.95×10 4، b 3 = 5.89×10 5، b 4 = 3.63×10 6. با توجه به اینکه c(NH 3) >> c(Cd)، فرض می کنیم که \u003d c (NH 3) \u003d 1M. 0 را محاسبه می کنیم: |
کادمیوم
کادمیوم-من؛ متر[لات. کادمیوم از یونانی kadmeia - سنگ معدن روی]
1. عنصر شیمیایی (Cd)، یک فلز نرم و چکشخوار سفید مایل به نقرهای است که در سنگ معدن روی (بخشی از بسیاری از آلیاژهای قابل ذوب، مورد استفاده در صنعت هستهای) یافت میشود.
2. رنگ زرد مصنوعی در سایه های مختلف.
◁ کادمیوم، th، th. آلیاژهای K K-امین زرد(رنگ).
کادمیوم(lat. Cadmium)، یک عنصر شیمیایی از گروه II از سیستم تناوبی. این نام از کلمه یونانی kadméia، سنگ معدن روی است. فلز نقره ای با رنگ مایل به آبی، نرم و قابل ذوب؛ چگالی 8.65 گرم بر سانتی متر 3، تی pl 321.1ºC. در طی فرآوری سنگ معدن سرب روی و مس استخراج می شود. برای آبکاری کادمیوم، در باتری های قدرتمند، انرژی هسته ای (میله های کنترل راکتورها)، برای به دست آوردن رنگدانه ها استفاده می شود. در آلیاژهای کم ذوب و سایر آلیاژها گنجانده شده است. سولفیدهای کادمیوم، سلنیدها و تلوریدها مواد نیمه رسانا هستند. بسیاری از ترکیبات کادمیوم سمی هستند.
کادمیومکادمیوم (lat. Cadmium)، کادمیوم (بخوانید "کادمیوم")، یک عنصر شیمیایی با عدد اتمی 48، جرم اتمی 112.41.
کادمیوم طبیعی از هشت ایزوتوپ پایدار تشکیل شده است: 106 کادمیوم (22/1%)، 108 کادمیوم (88/0%)، 110 کادمیوم (39/12%)، 111 کادمیوم (75/12%)، 112 کادمیوم (07/24%)، 113 کادمیوم (0.88%)، 12. 114 سی دی (28.85%) و 116 سی دی (12.75%). در دوره پنجم در گروه IIB سیستم تناوبی عناصر قرار دارد. پیکربندی دو لایه الکترونی بیرونی 4 س 2
پ 6
د 10
5س 2
. حالت اکسیداسیون 2+ (ظرفیت II) است.
شعاع اتم 0.154 نانومتر، شعاع یون Cd 2+ 0.099 نانومتر است. انرژی های یونیزاسیون متوالی - 8.99، 16.90، 37.48 eV. الکترونگاتیوی از نظر پاولینگ (سانتی متر.پاولینگ لینوس) 1,69.
تاریخچه کشف
کشف شده توسط پروفسور آلمانی F. Stromeyer (سانتی متر.استرومایر فردریش)در سال 1817. داروسازان ماگدبورگ در مطالعه اکسید روی (سانتی متر.روی (عنصر شیمیایی)) ZnO مشکوک به داشتن آرسنیک بود (سانتی متر.آرسنیک). F. استرومایر یک اکسید قهوه ای قهوه ای را از اکسید روی جدا کرد و آن را با هیدروژن کاهش داد. (سانتی متر.هیدروژن)و فلزی به رنگ سفید نقره ای دریافت کرد که به آن کادمیوم می گفتند (از یونانی kadmeia - سنگ معدن روی).
بودن در طبیعت
محتوای پوسته زمین 1.35 10-5٪ جرم، در آب دریاها و اقیانوس ها 0.00011 میلی گرم در لیتر است. چندین کانی بسیار نادر شناخته شده است، به عنوان مثال، گرینوکیت GdS، اوتاویت CdCO 3، مونتپونیت CdO. کادمیوم در سنگ معدن های چند فلزی تجمع می یابد: اسفالریت (سانتی متر.اسفالریت)(0.01-5٪)، گالن (سانتی متر.گالن)(0.02%)، کالکوپیریت (سانتی متر.کالکوپیریت)(0.12٪)، پیریت (سانتی متر.پیریت)(0.02%)، fahlore (سانتی متر.سنگ معدن شکست خورده)و تخت (سانتی متر.استنین)(تا 0.2٪).
اعلام وصول
منابع اصلی کادمیوم محصولات میانی تولید روی، گرد و غبار کارخانه های ذوب سرب و مس است. مواد خام با اسید سولفوریک غلیظ تصفیه شده و CdSO 4 در محلول به دست می آید. سی دی از محلول با استفاده از گرد و غبار روی جدا می شود:
CdSO 4 + Zn = ZnSO 4 + Cd
فلز حاصل با ذوب مجدد در زیر یک لایه قلیایی برای حذف ناخالصی های روی و سرب خالص می شود. کادمیوم با خلوص بالا با پالایش الکتروشیمیایی با خالص سازی متوسط الکترولیت یا با ذوب ناحیه ای به دست می آید. (سانتی متر.ذوب منطقه).
خواص فیزیکی و شیمیایی
کادمیوم یک فلز نرم سفید نقره ای با شبکه شش ضلعی است. آ = 0,2979, با= 0.5618 نانومتر). نقطه ذوب 321.1 درجه سانتیگراد، نقطه جوش 766.5 درجه سانتیگراد، چگالی 8.65 کیلوگرم بر dm 3. اگر چوب کادمیوم خم شده باشد، یک ترک ضعیف شنیده می شود - اینها میکروکریستال های فلزی هستند که به یکدیگر ساییده می شوند. پتانسیل استاندارد الکترود کادمیوم 0.403- ولت است، در یک سری پتانسیل استاندارد (سانتی متر.ظرفیت استاندارد)قبل از هیدروژن قرار دارد (سانتی متر.هیدروژن).
در اتمسفر خشک، کادمیوم پایدار است، در یک جو مرطوب، به تدریج با لایه ای از اکسید CdO پوشیده می شود. در بالای نقطه ذوب، کادمیوم در هوا می سوزد و اکسید قهوه ای CdO را تشکیل می دهد:
2Cd + O 2 \u003d 2CdO
بخارات کادمیوم با بخار آب واکنش می دهند و هیدروژن تشکیل می دهند:
Cd + H 2 O \u003d CdO + H 2
در مقایسه با همسایه گروه IIB، روی، کادمیوم کندتر با اسیدها واکنش نشان می دهد:
Сd + 2HCl \u003d CdCl 2 + H 2
واکنش به راحتی با اسید نیتریک انجام می شود:
3Cd + 8HNO 3 \u003d 3Cd (NO 3) 2 + 2NO - + 4H 2 O
کادمیوم با قلیاها واکنش نمی دهد.
در واکنش ها، می تواند به عنوان یک عامل کاهنده ملایم عمل کند، به عنوان مثال، در محلول های غلیظ، قادر است نیترات آمونیوم را به نیتریت NH 4 NO 2 کاهش دهد:
NH 4 NO 3 + Cd \u003d NH 4 NO 2 + CdO
کادمیوم با محلول های نمک مس (II) یا آهن (III) اکسید می شود:
Cd + CuCl 2 \u003d Cu + CdCl 2.
2FeCl 3 + Cd \u003d 2FeCl 2 + CdCl 2
در بالای نقطه ذوب خود، کادمیوم با هالوژن ها واکنش می دهد (سانتی متر.هالوژن ها)با تشکیل هالیدها:
Cd + Cl 2 \u003d CdCl 2
با گوگرد (سانتی متر.گوگرد)و سایر کالکوژن ها کالکوژنیدها را تشکیل می دهند:
Cd+S=CdS
کادمیوم با هیدروژن، نیتروژن، کربن، سیلیکون و بور واکنش نمی دهد. نیترید Cd 3 N 2 و هیدرید CdH 2 به طور غیر مستقیم به دست می آیند.
در محلول های آبی، یون های کادمیوم Cd 2+ کمپلکس های آبی 2+ و 2+ را تشکیل می دهند.
هیدروکسید کادمیوم Cd (OH) 2 با افزودن قلیایی به محلول نمک کادمیوم به دست می آید:
СdSO 4 + 2NaOH \u003d Na 2 SO 4 + Cd (OH) 2 Ї
هیدروکسید کادمیوم عملاً در قلیاها حل نمی شود، اگرچه تشکیل کمپلکس های هیدروکسید 2- در طول جوشاندن طولانی مدت در محلول های بسیار غلیظ قلیاها ثبت شد. بنابراین، آمفوتریک (سانتی متر.آمفوتریکی)خواص اکسید کادمیوم CdO و هیدروکسید Cd(OH) 2 بسیار ضعیف تر از ترکیبات روی مربوطه است.
هیدروکسید کادمیوم Cd (OH) 2 به دلیل کمپلکس شدن به راحتی در محلول های آبی آمونیاک NH 3 حل می شود:
Cd (OH) 2 + 6NH 3 \u003d (OH) 2
کاربرد
40 درصد از کادمیوم تولیدی برای پوشش های ضد خوردگی فلزات استفاده می شود. 20 درصد کادمیوم برای ساخت الکترودهای کادمیم مورد استفاده در باتریها، سلولهای وستون معمولی استفاده میشود. حدود 20 درصد کادمیوم برای تولید رنگ های معدنی، لحیم کاری های ویژه، مواد نیمه هادی و فسفر استفاده می شود. 10٪ کادمیوم - جزء جواهرات و آلیاژهای همجوشی، پلاستیک.
عمل فیزیولوژیکی
بخارات کادمیوم و ترکیبات آن سمی هستند و کادمیوم می تواند در بدن انباشته شود. MPC در آب آشامیدنی برای کادمیوم 10 میلی گرم بر متر مکعب است. علائم مسمومیت حاد با نمک های کادمیوم استفراغ و تشنج است. ترکیبات محلول کادمیوم پس از جذب در خون بر سیستم عصبی مرکزی، کبد و کلیه ها تأثیر می گذارد و متابولیسم فسفر-کلسیم را مختل می کند. مسمومیت مزمن منجر به کم خونی و تخریب استخوان می شود.
فرهنگ لغت دایره المعارفی. 2009 .
مترادف ها:ببینید کادمیوم در سایر لغت نامه ها چیست:
- (لات کادمیوم). یک فلز چکش خوار، شبیه به رنگ قلع. فرهنگ لغات کلمات خارجی موجود در زبان روسی. Chudinov A.N., 1910. Cadmium lat. کادمیوم، از kadmeia gea، زمین کادمیوم. فلزی شبیه قلع. توضیح 25000 خارجی ... ... فرهنگ لغت کلمات خارجی زبان روسی
کادمیوم- کادمیوم، کادمیوم، شیمی. عنصر، کاراکتر کادمیوم، وزن اتمی 112.41، عدد اتمی 48. در اکثر سنگهای معدنی روی به مقدار کمی وجود دارد و به عنوان یک محصول جانبی در طی استخراج روی بهدست میآید. را نیز می توان دریافت کرد ...... دایره المعارف بزرگ پزشکی
کادمیوم- کادمیم (Cd) را ببینید. این در آب های شعب بسیاری از شرکت های صنعتی، به ویژه کارخانه های سرب روی و فلزکاری با استفاده از آبکاری وجود دارد. در کودهای فسفاته وجود دارد. اسید سولفوریک در آب حل می شود، ... بیماری های ماهی: کتابچه راهنمای
کادمیوم- (Cd) فلز سفید نقره ای. این در مهندسی برق هسته ای و آبکاری استفاده می شود، بخشی از آلیاژها است، برای تهیه صفحات چاپ، لحیم کاری، الکترودهای جوشکاری، در تولید نیمه هادی ها استفاده می شود. یک جزء است ... دایره المعارف روسی حمایت از کار
- (کادمیم)، کادمیوم، عنصر شیمیایی گروه دوم سیستم تناوبی، عدد اتمی 48، جرم اتمی 112.41; فلز، mp 321.1 shC. از کادمیوم برای اعمال پوشش های ضد خوردگی بر روی فلزات، ساخت الکترود، به دست آوردن رنگدانه ها و ... استفاده می شود. دایره المعارف مدرن
- (نماد Cd)، فلز سفید نقره ای از گروه دوم جدول تناوبی. اولین بار در سال 1817 جدا شد. در گرینوکیت (به شکل سولفید) وجود دارد، اما عمدتاً به عنوان یک محصول جانبی از استخراج روی و سرب به دست می آید. به راحتی جعل… فرهنگ دانشنامه علمی و فنی
Cd (از یونانی kadmeia روی سنگ معدن * a. cadmium؛ n. Kadmium؛ f. cadmium؛ i. cadmio)، شیمی. عنصر دوم گروه دوره ای. سیستم های مندلیف، at.s. 48، در. متر 112.41. در طبیعت 8 ایزوتوپ پایدار 106Cd (1.225%) 108Cd (0.875%)، ... ... دایره المعارف زمین شناسی
شوهر. فلز (یکی از اصول شیمیایی یا عناصر غیرقابل تجزیه) موجود در سنگ معدن روی. کادمیوم، مربوط به کادمیوم. K ادمیستی، حاوی کادمیوم. فرهنگ توضیحی دال. در و. دال. 1863 1866 ... فرهنگ توضیحی دال
کادمیوم- (کادمیم)، کادمیوم، عنصر شیمیایی گروه دوم سیستم تناوبی، عدد اتمی 48، جرم اتمی 112.41; فلز، mp 321.1 درجه سانتی گراد. از کادمیوم برای اعمال پوشش های ضد خوردگی بر روی فلزات، ساخت الکترود، به دست آوردن رنگدانه ها و ... استفاده می شود. فرهنگ لغت دایره المعارف مصور
کادمیوم- شیمی عنصر، نماد Cd (lat. Cadmium)، در. n 48، در. متر 112.41; فلز نرم براق سفید نقره ای، چگالی 8650 کیلوگرم بر متر مکعب، ذوب = 320.9 درجه سانتی گراد. کادمیوم یک عنصر کمیاب و کمیاب سمی است که معمولا در سنگ معدن همراه با روی یافت می شود که ... ... دایره المعارف بزرگ پلی تکنیک
- (lat. Cadmium) کادمیوم، یک عنصر شیمیایی از گروه دوم سیستم تناوبی، عدد اتمی 48، جرم اتمی 112.41. این نام از سنگ معدن روی یونانی kadmeia گرفته شده است. فلز نقره ای با رنگ مایل به آبی، نرم و قابل ذوب؛ چگالی 8.65 g/cm³، …… فرهنگ لغت دایره المعارفی بزرگ
در پاییز 1817 هنگام بررسی برخی داروخانه ها در منطقه ماگدبورگ در آلمان، اکسید روی حاوی نوعی ناخالصی یافت شد. پزشک منطقه R. Rolov به وجود آرسنیک در آن مشکوک شد و فروش دارو را ممنوع کرد. صاحب کارخانه تولید اکسید روی، K. Hermannبا این تصمیم موافق نبود و شروع به مطالعه محصول بدبخت کرد. در نتیجه آزمایشهایش، او به این نتیجه رسید که اکسید روی تولید شده توسط کارخانهاش حاوی ترکیبی از فلز ناشناخته است. داده های به دست آمده توسط K. Hermann در آوریل 1818 در مقاله "در مورد اکسید روی سیلزی و در مورد فلزی که احتمالا هنوز ناشناخته در آن یافت شده است" منتشر شد. در همان زمان، نتیجه گیری مطلوبی توسط F. Stromeyer منتشر شد که نتیجه گیری هرمان را تأیید کرد و پیشنهاد کرد که فلز جدید کادمیوم نامیده شود.
F. Stromeyer که بازرس کل داروخانه ها در استان هانوفر بود، مقاله مفصلی در مورد فلز جدید در مجله دیگری منتشر کرد. این مقاله به تاریخ 26 آوریل 1818 در شماره ای با تاریخ 1817 بر روی جلد منتشر شد. اشتباه در تعیین تاریخ و نویسنده کشف.
مشخصات فیزیکی.
کادمیوم - سفید نقره ایآبی درخشان فلزکه در هوا به دلیل تشکیل یک لایه اکسید محافظ کدر می شود. نقطه ذوب - 321 درجه سانتیگراد، نقطه جوش - 770 درجه سانتیگراد. یک چوب کادمیوم خالص هنگام خم شدن مانند قلع خرد می شود، اما هر گونه ناخالصی در فلز این اثر را از بین می برد. کادمیوم سخت تر از قلع است، اما نرم تر از قلع است - می توان آن را با چاقو برش داد. هنگامی که در دمای بالای 80 درجه سانتیگراد گرم می شود، کادمیوم خاصیت ارتجاعی خود را از دست می دهد به حدی که می تواند به پودر تبدیل شود.
کادمیوم با بسیاری از فلزات آلیاژها و ترکیباتی تشکیل می دهد و در جیوه بسیار محلول است.
خصوصیات شیمیایی عمومی کادمیوم
هنگامی که گرم می شود، اکسیداسیون شدیدتر می شود و احتراق فلز امکان پذیر است. کادمیوم پودر شده به راحتی در هوا با شعله قرمز روشن مشتعل می شود و یک اکسید تشکیل می دهد.
اگر پودر کادمیوم به شدت با آب مخلوط شود، تکامل هیدروژن مشاهده شده و وجود پراکسید هیدروژن قابل تشخیص است.
اسیدهای کلریدریک و سولفوریک رقیق، هنگامی که گرم می شوند، به تدریج با کادمیوم واکنش داده و هیدروژن آزاد می کنند. هیدروژن کلرید خشک با کادمیوم در دمای 440 درجه سانتیگراد برهمکنش می کند. دی اکسید گوگرد خشک نیز با فلز واکنش می دهد و سولفید کادمیوم CdS و تا حدی سولفات آن CdSO 4 را تشکیل می دهد. اسید نیتریک که در شرایط عادی با کادمیوم در تعامل است، آمونیاک آزاد می کند و هنگامی که گرم می شود، اکسیدهای نیتروژن آزاد می شود.
کادمیوم بر خلاف روی نامحلول در قلیاهای سوزاننده، اما همچنین در هیدروکسید آمونیوم محلول است. هنگامی که کادمیوم با محلول نیترات آمونیوم واکنش می دهد، نیترات ها تشکیل می شوند.
آلومینیوم، روی و آهن کادمیوم را از محلول های ترکیبات آن جابجا می کنند. او خود مس و سایر عناصر الکترومثبت تر را از محلول ها رسوب می دهد. وقتی کادمیوم گرم می شود، مستقیماً با فسفر، گوگرد، سلنیوم، تلوریم و هالوژن ترکیب می شود، اما هیدرید و نیترید آن را نمی توان با برهمکنش مستقیم با هیدروژن و نیتروژن به دست آورد.
مهمترین ترکیبات کادمیوم
اکسید کادمیومCdOرا می توان با سوزاندن فلز در هوا یا اکسیژن، بو دادن سولفید آن، یا با تجزیه حرارتی ترکیبات خاص به دست آورد. این پودر با رنگ های مختلف بسته به دمایی است که در آن به دست آمده است: زرد مایل به سبز (350-370 درجه سانتیگراد)، آبی تیره ضخیم (800 درجه سانتیگراد)، قهوه ای، سیاه.
هیدروکسید کادمیومسی دی(اوه) 2 به شکل یک رسوب ژلاتینی سفید از محلول های نمک های آن تحت تأثیر قلیاها آزاد می شود.
سولفید کادمیومCDS- یکی از مهمترین ترکیبات کادمیوم. بسته به شرایط فیزیکوشیمیایی بدست آوردن، می تواند از زرد لیمویی تا قرمز باشد.
هالوژنیت هاکادمیوم به راحتی با برهمکنش مستقیم عناصر و همچنین با حل کردن کادمیوم، اکسید یا کربنات آن در اسیدهای مربوطه به دست می آید. تمام نمک های تشکیل دهنده مواد کریستالی بی رنگ هستند.
کربنات کادمیومCDCحدود 3هنگامی که کربنات های قلیایی به آنها اضافه می شود، به شکل یک رسوب سفید آمورف از محلول های کادمیوم رسوب می کند.
منابع خام کادمیوم دریافت کادمیوم
کادمیوم است پراکنده شده استعنصر، یعنی تقریباً مواد معدنی خود را تشکیل نمی دهد و ذخایر چنین مواد معدنی اصلاً شناخته شده نیست. کادمیوم در سنگ معدن سایر فلزات در غلظت های صدم و هزارم درصد وجود دارد. برخی از سنگ های معدنی حاوی 1-1.5 درصد کادمیوم از نظر این فلز بسیار غنی در نظر گرفته می شوند.
تنها کانی کادمیوم مورد علاقه سولفید طبیعی، گرینوکیت یا مخلوط کادمیوم آن است. هنگام توسعه ذخایر سنگ معدن روی، گرینوکیت همراه با فریت استخراج می شود و به گیاهان روی ختم می شود. در طی فرآوری، کادمیوم در برخی از محصولات میانی فرآیند متمرکز شده و سپس از آن استخراج می شود.
بنابراین، ماده خام واقعی برای تولید کادمیوم، کیک کارخانه های روی-الکترولیت، کارخانه های ذوب سرب و مس است.
اولین تولید در سیلزیای علیا در سال 1829 سازماندهی شد.
در حال حاضر، جهان بیش از 10000 تن کادمیوم در سال تولید می کند.
کاربرد کادمیوم
بخش عمده مصرف صنعتی کادمیوم بر روی کادمیوم است پوشش های محافظمحافظت از فلزات در برابر خوردگی این پوشش ها مزیت قابل توجهی نسبت به پوشش های نیکل، روی یا قلع دارند. در هنگام تغییر شکل از روی قطعات لایه برداری نکنید.
پوشش های کادمیوم در برخی موارد نسبت به بقیه برتری دارند: 1) برای محافظت در برابر آب دریا، 2) برای قطعاتی که در فضاهای بسته با رطوبت بالا کار می کنند، 3) برای محافظت از کنتاکت های الکتریکی.
دومین حوزه کاربرد کادمیوم است تولید آلیاژ. آلیاژهای کادمیوم به رنگ سفید مایل به نقره ای، انعطاف پذیر و قابل ماشین کاری هستند. آلیاژهای کادمیوم با افزودنیهای کوچک نیکل، مس و نقره برای ساخت یاتاقانهای موتورهای قدرتمند دریایی، هواپیما و خودرو استفاده میشوند.
سیم مسی با تنها 1% کادمیوم اضافه شده دو برابر قوی تر است، در حالی که هدایت الکتریکی آن اندکی کاهش می یابد.
آلیاژ مس-کادمیم با افزودن زیرکونیوم استحکام بیشتری دارد و برای خطوط انتقال فشار قوی استفاده می شود.
کادمیوم خالص به دلیل خاصیت قابل توجه آن - سطح مقطع جذب نوترون حرارتی بالا، برای ساخت میله های کنترل و اضطراری استفاده می شود. راکتورهای هسته ایروی نوترون های آهسته
AT تجارت جواهراتاز آلیاژهای طلا و کادمیوم استفاده می شود. با تغییر نسبت اجزاء، سایه های رنگی مختلفی به دست می آید.
نیکل کادمیوم انباشته ها، حتی کاملاً تخلیه شده نیز کاملاً غیر قابل استفاده نمی شوند.
از آمالگام کادمیوم استفاده می شود در دندانپزشکیبرای ساخت پر کردن
خواص بیولوژیکی کادمیوم
پوشش های کادمیوم زمانی که باید با مواد غذایی در تماس باشند غیرقابل قبول هستند. این فلز به خودی خود غیر سمی است، اما بسیار زیاد است سمیترکیبات محلول کادمیوم علاوه بر این، هر گونه ورود آنها به بدن و در هر حالتی (محلول، گرد و غبار، دود، مه) خطرناک است. از نظر سمیت، کادمیوم کمتر از جیوه و آرسنیک نیست. ترکیبات کادمیوم بر روی سیستم عصبی تأثیر منفی می گذارد، بر دستگاه تنفسی تأثیر می گذارد و باعث تغییراتی در اندام های داخلی می شود.
غلظت زیاد کادمیوم می تواند منجر به مسمومیت حاد شود: یک دقیقه اقامت در اتاقی حاوی 2500 میلی گرم در متر مکعب از ترکیبات آن منجر به مرگ می شود. در مسمومیت حاد، علائم ضایعه بلافاصله ایجاد نمی شود، اما پس از یک دوره نهفته مشخص که می تواند از 1-2 تا 30-40 ساعت طول بکشد.
با وجود سمیت، ثابت شده است که کادمیوم یک عنصر کمیاب حیاتی برای رشد موجودات زنده است. عملکرد آن هنوز نامشخص است. تغذیه گیاهان به طور مطلوب بر رشد آنها تأثیر می گذارد.
تعریف
کادمیومواقع در دوره پنجم از گروه II از زیر گروه ثانویه (B) جدول تناوبی.
به عناصر مربوط می شود د-خانواده ها. فلز. نام - سی دی. عدد ترتیبی - 48. جرم اتمی نسبی - 112.41 a.m.u.
ساختار الکترونیکی اتم کادمیوم
اتم کادمیوم از یک هسته با بار مثبت (+48) تشکیل شده است که در داخل آن 48 پروتون و 64 نوترون وجود دارد و 48 الکترون در پنج مدار به اطراف حرکت می کنند.
عکس. 1. ساختار شماتیک اتم کادمیوم.
توزیع الکترون ها در اوربیتال ها به شرح زیر است:
48Cd) 2) 8) 18) 18) 2 ;
1س 2 2س 2 2پ 6 3س 2 3پ 6 3د 10 4س 2 4پ 6 4د 10 5س 2 .
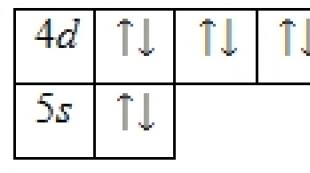
الکترون های ظرفیت اتم کادمیوم آنهایی هستند که روی 4 قرار دارند د- و 5 س-اوربیتال ها نمودار انرژی حالت پایه به شکل زیر است:

الکترون های ظرفیت یک اتم کادمیوم را می توان با مجموعه ای از چهار عدد کوانتومی مشخص کرد: n(کوانتوم اصلی)، ل(مدار) m l(مغناطیسی) و س(چرخش):
|
زیرسطح |
||||
نمونه هایی از حل مسئله
مثال 1
| ورزش | چند اوربیتال اتمی پ-سطح فرعی برای عناصر با شماره سریال 35 و 54 پر شده است؟ فرمول های الکترونیکی آنها را بنویسید. |
| پاسخ | عناصر با شماره سریال 35 و 54 برم و زنون هستند. ما فرمول های الکترونیکی آنها را در حالت پایه می نویسیم: 35 Br1 س 2 2س 2 2پ 6 3س 2 3پ 6 3د 10 4س 2 4پ 5 ; 54 Xe1 س 2 2س 2 2پ 6 3س 2 3پ 6 3د 10 4س 2 4پ 6 4د 10 5س 2 5پ 6 . 3 اوربیتال در زیرسطح p وجود دارد که هر یک نمی تواند بیش از 2 الکترون (در مجموع 6 الکترون) داشته باشد. اوربیتال های p اتم های برم و زنون پر شده اند. |
مثال 2
| ورزش | اعداد کوانتومی چه مقادیری می توانند داشته باشند؟ n, ل, m lو خانمتوصیف وضعیت الکترون ها در یک اتم چه مقادیری برای الکترون های بیرونی اتم کلسیم می گیرند؟ | |||||||||||||||
| پاسخ | عدد کوانتومی اصلی n می تواند مقادیری از 1 تا بی نهایت بگیرد، اما در واقع حد آن عدد 7 است. عدد کوانتومی مداری l می تواند مقادیری از 0 تا 3 بگیرد. عدد کوانتومی مغناطیسی m lمقادیر از -l تا 0 تا +l را می گیرد. در عدد کوانتومی اسپین خانمفقط دو مقدار می تواند وجود داشته باشد: +1/2 و -1/2. اجازه دهید پیکربندی الکترونیکی حالت پایه اتم منیزیم را بنویسیم (الکترون های ظرفیت را به صورت پررنگ برجسته می کنیم): 1س 2 2س 2 2پ 6 3س 2 3پ 6 4س 2 . الکترون های سطح انرژی بیرونی با مجموعه اعداد کوانتومی زیر مشخص می شوند:
|
کادمیوم - سمی غیر معمول و ناشناخته است
طیف وسیعی از فلزات خطرناک نقره
سنگ ها و مواد معدنی سمی و سمی
کادمیوم(لاتین کادمیوم که با علامت Cd نشان داده می شود) عنصری با عدد اتمی 48 و جرم اتمی 112.411 است. این عنصر از یک زیر گروه ثانویه از گروه دوم است، دوره پنجم سیستم تناوبی عناصر شیمیایی D.I. مندلیف. در شرایط عادی، یک ماده ساده کادمیوم یک فلز انتقالی نرم و انعطاف پذیر نرم (با چگالی 8.65 گرم در سانتی متر مکعب - سبک تر از اورانیوم) است. سفید نقره ایرنگ ها (گوشت را نمی بلعد، مانند "سنگ کربرسکی" منطقه ژیتومیر اوکراین - نه اکسید اورانیوم pitchblende، سنگ قهوه ای خطرناک). روی عکس - سولفید کادمیوم, گرینوکیت(پوسته های خاکی رنگ زردرنگ ها).
کادمیوم طبیعی از هشت ایزوتوپ تشکیل شده است که شش ایزوتوپ آن پایدار هستند: 106Cd (فراوانی ایزوتوپ 1.22%)، 108Cd (0.88%)، 110Cd (12.39%)، 111Cd (12.75%)، 112Cd (24، 07.8%). ٪. رادیواکتیویته برای دو ایزوتوپ طبیعی دیگر شناسایی شد: 113Cd (فراوانی ایزوتوپی 12.22٪، فروپاشی β با نیمه عمر 7.7∙1015 سال) و 116Cd (فراوانی ایزوتوپی 7.49٪، فروپاشی β مضاعف با نیمه عمر ∙ 3). 1019 سال).
کادمیوم سیستم تناوبی تا حدی توسط پروفسور آلمانی فردریش استرومایر در سال 1817 توصیف شد (متمایز از روی). داروسازان ماگدبورگ هنگام مطالعه داروهای حاوی اکسید روی ZnO به وجود آرسنیک (کاتالیزور اکسیداسیون از سولفید) در آنها مشکوک شدند. از آنجایی که اکسید روی در بسیاری از پمادها، پودرها و امولسیون های مورد استفاده برای بیماری های پوستی مختلف وجود دارد، بازرسان به طور قطعی فروش داروهای مشکوک را ممنوع کردند.
طبیعتاً سازنده دارو برای دفاع از منافع شخصی خود خواستار معاینه شد. استرومایر به عنوان یک متخصص عمل کرد. او اکسید قهوه ای قهوه ای را از اکسید روی جدا کرد، آن را با هیدروژن کاهش داد و فلزی به رنگ سفید نقره ای به دست آورد که آن را "کادمیم" (از یونانی kadmeia - اکسید روی، همچنین سنگ معدن روی) نامید. بدون توجه به پروفسور استرومایر، کادمیوم در سنگ معدن روی سیلسیا (ماهواره) توسط گروهی از دانشمندان - K. Hermann، K. Carsten و W. Meisner در سال 1818 کشف شد.
کادمیوم نوترون های آهسته را جذب می کند، به همین دلیل از میله های کادمیوم در راکتورهای هسته ای برای کنترل سرعت یک واکنش زنجیره ای (ChNPP) استفاده می شود. کادمیوم در باتری های قلیایی استفاده می شود و به عنوان جزئی در برخی از آلیاژها گنجانده شده است. به عنوان مثال، آلیاژهای مس حاوی حدود 1% کادمیوم (برنز کادمیوم) برای ساخت سیمهای تلگراف، تلفن، ترالیبوس و تراموا، کابلهای مترو استفاده میشوند، زیرا این آلیاژها دارای استحکام و مقاومت در برابر سایش بیشتری نسبت به مس هستند.

گرینوکیت (دوپ زرد) روی کلسیت. یوننان، چین 7*5 سانتیمتر عکس: A.A. اوسیف.
تعدادی از آلیاژهای قابل گداخت مانند آلیاژهای مورد استفاده در کپسول های آتش نشانی حاوی کادمیوم هستند. علاوه بر این، کادمیوم بخشی از آلیاژهای جواهرات نامرغوب است (لحیم کاری پس از تبخیر جزء آمالگام از آلیاژهای آمالگام که به دلیل دما ترکیده و در فروش آزاد ممنوع است - ملغمه های طلا، نقره و پلاتین با جیوه سمی).
این فلز برای آبکاری کادمیوم محصولات فولادی استفاده می شود، زیرا یک لایه اکسیدی را بر روی سطح خود حمل می کند که اثر محافظتی دارد. واقعیت این است که در آب دریا و در تعدادی از محیط های دیگر، آبکاری کادمیوم موثرتر از گالوانیزه است. کادمیوم سابقه طولانی استفاده در طب هومیوپاتی (درمان اولیه با گیاهان و میکرودوزها - به اصطلاح "مکمل های غذایی در غذا" - مکمل های غذایی و خوراک دام) دارد. ترکیبات کادمیوم نیز کاربرد گسترده ای یافته اند - سولفید کادمیوم برای ساخت رنگ زرد و شیشه های رنگی استفاده می شود و فلوروبورات کادمیوم شار مورد استفاده برای لحیم کاری آلومینیوم و سایر فلزات است.
کادمیوم در بدن مهره داران (استخوان ها، رباط ها، تاندون ها و ماهیچه ها) یافت می شود، مشخص شده است که بر متابولیسم کربن، فعالیت تعدادی از آنزیم ها و سنتز اسید هیپوریک در کبد تأثیر می گذارد. با این حال، ترکیبات کادمیوم سمی هستند و خود فلز سرطان زا است. به خصوص خطرناک استنشاق بخارات اکسید کادمیوم CdO است، موارد کشنده غیر معمول نیست. نفوذ کادمیوم به دستگاه گوارش نیز مضر است، اما هیچ موردی از مسمومیت کشنده ثبت نشده است، به احتمال زیاد این به این دلیل است که بدن به دنبال خلاص شدن از شر سم (استفراغ) است.
خواص بیولوژیکی
به نظر می رسد که کادمیوم تقریباً در همه موجودات زنده وجود دارد - در سطح زمین محتوای کادمیوم تقریباً برابر با 0.5 میلی گرم در هر کیلوگرم جرم است، در موجودات دریایی (اسفنج ها، کوئلنترات ها، خارپوستان، کرم های اقیانوس آرام) - از 0.15 تا 3 است. میلی گرم بر کیلوگرم، محتوای کادمیوم در گیاهان حدود 10-4٪ (در ماده خشک) است. علیرغم وجود کادمیوم در اکثر موجودات زنده، اهمیت فیزیولوژیکی خاص آن به طور کامل ثابت نشده است (هورمون رشد). دانشمندان موفق شدند متوجه شوند که این عنصر بر متابولیسم کربوهیدرات، سنتز اسید هیپوریک در کبد، فعالیت تعدادی از آنزیم ها و همچنین متابولیسم روی، مس، آهن و کلسیم در بدن (سنگ مورد علاقه بدنسازانی که توده عضلانی را افزایش می دهند و استخوان های خود را در ورزش تقویت می کنند - در میکرودوز).

گرینوکیت (زرد). آتشفشان فرفری، حدود. ایتوروپ، جزایر کوریل، روسیه. عکس: A.A. اوسیف.
می تواند برای تالک، گوگرد و سایر کانی های مشابه گرینوکتیت صادر شود
پیشنهادی وجود دارد که توسط تحقیقات پشتیبانی می شود مبنی بر اینکه مقادیر میکروسکوپی کادمیوم در غذا می تواند رشد بدن پستانداران را تحریک کند. به همین دلیل، دانشمندان مدتهاست که کادمیوم را به عنوان یک عنصر کمیاب ضروری، یعنی حیاتی، اما در دوزهای خاص سمی است. بدن یک فرد سالم حاوی مقدار کمی کادمیوم است. خوانده شده در حماسه یونان و روم باستان - کادمئوس(محل تجارت سمدر جنوب شرقی اروپا ("سپر بر دروازه های تزارگراد"، استانبول)، در یونان (روق ها و آمفی تئاترها) و در دریای مدیترانه در نزدیکی ترکیه - یک دارو). در زبان عامیانهمعدنچیان و معدنچیان سنگ کادمیومبه نام " سم مار" (اصطلاحات تخصصی).
کادمیوم یکی از بیشترین هاست فلزات سنگین سمی- در روسیه (مترولوژی) به کلاس خطر 2 - مواد بسیار خطرناک - که شامل آنتیموان، استرانسیوم، فنل و سایر مواد سمی (معادل ADR کالاهای خطرناک N 6 - سم، جمجمه و استخوان های متقاطع در یک لوزی). در بولتن فدراسیون روسیه در مورد ایمنی زیست محیطی و فناوری های حمل و نقل سم "مشکلات ایمنی شیمیایی" مورخ 29 آوریل 1999، کادمیوم به عنوان "خطرناک ترین سموم زیست محیطی در آغاز هزاره" ظاهر می شود!
مانند سایر فلزات سنگین، کادمیوم یک سم تجمعی است، یعنی می تواند در بدن انباشته شود - نیمه عمر آن از 10 تا 35 سال است. در سن پنجاه سالگی، بدن انسان قادر به جمع آوری 30 تا 50 میلی گرم کادمیوم است. "ذخایر" اصلی کادمیوم در بدن انسان کلیه ها هستند که از 30 تا 60٪ از کل مقدار این فلز در بدن و کبد (20-25٪) را در خود دارند. موارد زیر می توانند به میزان کمتری کادمیوم را جمع کنند: پانکراس، طحال، استخوان های لوله ای و سایر اندام ها و بافت ها. مقادیر کمی کادمیوم حتی در خون وجود دارد. با این حال، برخلاف سرب یا جیوه، کادمیوم وارد مغز نمی شود.
در بیشتر موارد، کادمیوم در بدن در یک حالت محدود است - در ترکیب با پروتئین متالوتیونین - این یک نوع مکانیسم محافظتی است، واکنش بدن به حضور یک فلز سنگین. در این شکل، کادمیوم کمتر سمی است، با این حال، حتی زمانی که متصل می شود، بی ضرر نمی شود - این فلز در طول سال ها انباشته می شود، می تواند منجر به اختلال در کلیه ها و افزایش احتمال سنگ کلیه شود. بسیار خطرناکتر کادمیوم است که به شکل یونی است، زیرا از نظر شیمیایی بسیار نزدیک به روی است و می تواند در واکنش های بیوشیمیایی جایگزین آن شود و به عنوان یک شبه فعال کننده یا برعکس، یک مهار کننده پروتئین ها و آنزیم های حاوی روی عمل می کند.
کادمیوم به مواد سیتوپلاسمی و هستهای سلولهای موجود زنده متصل میشود و به آنها آسیب میرساند، فعالیت بسیاری از هورمونها و آنزیمها را تغییر میدهد، که با توانایی آن در اتصال گروههای سولفیدریل (-SH) توضیح داده میشود. علاوه بر این، کادمیوم به دلیل مجاورت شعاع یونی کلسیم و کادمیوم، قادر است جایگزین کلسیم در بافت استخوانی شود. همین وضعیت در مورد آهن است که کادمیوم نیز قادر به جایگزینی آن است. به همین دلیل کمبود کلسیم، روی و آهن در بدن می تواند منجر به افزایش جذب کادمیوم از دستگاه گوارش تا 20-15 درصد شود. اعتقاد بر این است که دوز بی ضرر روزانه کادمیوم برای یک بزرگسال 1 میکروگرم کادمیوم به ازای هر 1 کیلوگرم وزن بدن است، مقادیر زیاد کادمیوم برای سلامتی بسیار خطرناک است.
مکانیسم های ورود کادمیوم و ترکیبات آن به بدن چیست؟ مسمومیت زمانی رخ می دهد که آب آشامیدنی (حداکثر غلظت آب آشامیدنی 0.01 میلی گرم در لیتر) آلوده به زباله های حاوی کادمیوم و همچنین هنگام خوردن سبزیجات و غلات در حال رشد در زمین های واقع در نزدیکی پالایشگاه های نفت و شرکت های متالورژی رخ می دهد. استفاده از قارچ از چنین مناطقی به ویژه خطرناک است، زیرا، طبق برخی اطلاعات، آنها قادر به جمع آوری بیش از 100 میلی گرم کادمیوم در هر کیلوگرم وزن خود هستند. سیگار یکی دیگر از منابع دریافت کادمیوم به بدن است، هم از سوی خود فرد سیگاری و هم برای افراد اطرافش، زیرا این فلز در دود تنباکو یافت می شود.
علائم مشخصه مسمومیت مزمن با کادمیوم، همانطور که قبلا ذکر شد، آسیب کلیه، درد عضلانی، تخریب بافت استخوانی و کم خونی است. مسمومیت غذایی حاد با کادمیوم زمانی اتفاق میافتد که دوزهای بزرگ با غذا (30-15 میلیگرم) یا با آب (15-13 میلیگرم) مصرف شود. در همان زمان، علائم گاستروانتریت حاد مشاهده می شود - استفراغ، درد و تشنج در ناحیه اپی گاستر، با این حال، موارد مسمومیت کشنده با ترکیبات کادمیوم که با غذا وارد بدن شده است برای علم ناشناخته است، اما بر اساس برآوردهای WHO، یک تک دوز کشنده می تواند 350-3500 میلی گرم باشد.
مسمومیت با کادمیوم با استنشاق بخارات آن (CdO) یا گرد و غبار حاوی کادمیوم بسیار خطرناک تر است (به عنوان یک قاعده، این امر در صنایع مرتبط با استفاده از کادمیوم رخ می دهد) - مشابه جیوه مایع و سینابر قرمز (از نظر سمیت). علائم این مسمومیت عبارتند از ادم ریوی، سردرد، تهوع یا استفراغ، لرز، ضعف و اسهال (اسهال). در نتیجه چنین مسمومیت هایی مرگ و میر ثبت شده است.
پادزهر مسمومیت با کادمیوم سلنیوم است که به کاهش جذب کادمیوم کمک می کند (آنها روی دستگاه های کپی و پرینتر در مراکز داده مدرن کار می کنند و کارتریج ها را برای تجهیزات اداری پر می کنند). با این حال، مصرف متعادل سلنیوم هنوز مورد نیاز است، این به این دلیل است که بیش از حد آن در بدن منجر به کاهش محتوای گوگرد می شود (سولفید گوگرد را تشکیل می دهد - آن را متصل می کند) و این قطعاً منجر به این واقعیت می شود که کادمیوم دوباره جذب بدن خواهد شد.
حقایق جالب
ثابت شده است که یک سیگار حاوی 1 تا 2 میکروگرم کادمیوم است. معلوم می شود که فردی که روزانه یک پاکت سیگار می کشد (20 عدد) حدود 20 میکروگرم کادمیم دریافت می کند! خطر در این واقعیت نهفته است که جذب کادمیوم از طریق ریه ها بیشترین- از 10 تا 20 درصد، بنابراین در بدن یک فرد سیگاری، با هر بسته سیگار از 2 تا 4 میکروگرم کادمیوم جذب می شود! اثر سرطان زایی نیکوتین موجود در دود تنباکو، به عنوان یک قاعده، با حضور کادمیوم همراه است، و حتی توسط فیلترهای کربن - سرطان ریه - حفظ نمی شود.
نمونه ای از مسمومیت مزمن با کادمیوم با پیامدهای کشنده متعدد در اواخر دهه 1950 شرح داده شد. در قلمرو ژاپن، مواردی از بیماری وجود دارد که مردم محلی آن را "ایتای-ایتای" ("بیماری ایتالیایی") می نامند، که می تواند به گویش محلی به عنوان "اوه، چقدر درد دارد!" (مسمومیت). علائم این بیماری درد شدید کمر بود که، همانطور که بعدا مشخص شد، ناشی از آسیب غیرقابل برگشت کلیه بود. درد شدید عضلانی گسترش گسترده این بیماری و سیر شدید آن ناشی از آلودگی بالای محیط زیست در ژاپن در آن زمان و رژیم غذایی خاص ژاپنی ها بود (برنج و غذاهای دریایی مقادیر زیادی کادمیوم انباشته می کنند). مشخص شد کسانی که به این بیماری مبتلا می شدند روزانه حدود 600 میکروگرم کادمیوم مصرف می کردند!
علیرغم اینکه کادمیوم به عنوان یکی از سمی ترین مواد شناخته می شود، در پزشکی نیز کاربرد پیدا کرده است! بنابراین، یک باتری نیکل-کادمیمی که در قفسه سینه بیمار مبتلا به نارسایی قلبی قرار می گیرد، انرژی را به یک محرک مکانیکی قلب می دهد. راحتی چنین باتری این است که بیمار مجبور نیست برای شارژ مجدد یا تعویض آن روی میز عمل دراز بکشد. برای ماندگاری بدون وقفه باتری کافی است هفته ای یک بار و فقط یک ساعت و نیم یک ژاکت مخصوص آهنربایی بپوشید.
کادمیوم در هومیوپاتی، پزشکی تجربی و اخیراً برای تولید داروهای ضد سرطان جدید استفاده شده است.
آلیاژ فلز چوب حاوی 50% بیسموت، 12.5% قلع، 25% سرب، 12.5% کادمیوم می تواند در آب جوش ذوب شود.این آلیاژ در سال 1860 توسط مهندس B. Wood اختراع شد. آلیاژ کم ذوب: اولاً حروف اول اجزای آلیاژ چوب مخفف "WAX" را تشکیل می دهند و ثانیاً این اختراع به همنام B. Wood - فیزیکدان آمریکایی رابرت ویلیامز وود که هشت سال بعد متولد شد نیز نسبت داده می شود. همسالان در VAK جنگیدند).
چندی پیش، کادمیوم سیستم تناوبی وارد "سلاح" پلیس و متخصصان پزشکی قانونی شد: با کمک نازک ترین لایه کادمیوم که روی سطح مورد بررسی قرار گرفته است، می توان اثر انگشت انسان را شناسایی کرد.
دانشمندان چنین واقعیت جالبی را ثابت کرده اند: قلع کادمیوم در جو مناطق روستایی مقاومت به خوردگی بسیار بیشتری نسبت به جو مناطق صنعتی دارد. اگر محتوای انیدریدهای گوگردی یا سولفوریک در هوا افزایش یابد، چنین پوششی بهویژه به سرعت از بین میرود.
در سال 1968، یکی از مقامات بهداشتی ایالات متحده (دکتر کارول) رابطه مستقیمی بین مرگ و میر ناشی از بیماری های قلبی عروقی و محتوای کادمیوم در جو کشف کرد. او با تجزیه و تحلیل داده های 28 شهر به چنین نتایجی رسید. در چهار مورد از آنها - نیویورک، شیکاگو، فیلادلفیا و ایندیاناپولیس - محتوای کادمیوم در هوا بیشتر از شهرهای دیگر بود. نسبت مرگ و میر ناشی از بیماری قلبی نیز بیشتر بود.
علاوه بر اقدامات "استاندارد" برای محدود کردن انتشار کادمیوم در جو، آب و خاک (فیلترها و پاک کنندهها در شرکتها، حذف مسکن و مزارع کشاورزی از چنین شرکتهایی)، دانشمندان همچنین در حال توسعه موارد جدید - امیدوارکننده هستند. بنابراین دانشمندان در خلیج رودخانه می سی سی پی سنبل های آبی کاشتند و معتقد بودند که با کمک آنها می توان آب را از عناصری مانند کادمیوم و جیوه پاک کرد.
داستان
تاریخ «اکتشافات» زیادی را میداند که در خلال بررسیها، بررسیها و بازبینیهای ساختگی انجام شدهاند. با این حال، چنین یافتههایی بیشتر ماهیت مجرمانه دارند تا علمی. و با این حال چنین موردی وجود داشت که تجدید نظری که آغاز شده بود در نهایت منجر به کشف یک عنصر شیمیایی جدید شد. در آغاز قرن نوزدهم در آلمان اتفاق افتاد. دکتر R. Rolov داروخانه های منطقه خود را بررسی کرد، در طول ممیزی - در تعدادی از داروخانه های نزدیک ماگدبورگ - او اکسید روی را کشف کرد که ظاهر آن شک برانگیخت و پیشنهاد کرد که حاوی آرسنیک (فارماکولیت) است. برای تأیید فرضیات، رولوف داروی ضبط شده را در اسید حل کرد و آن را از محلول سولفید هیدروژن عبور داد، که منجر به رسوب یک رسوب زرد رنگ، شبیه به سولفید آرسنیک شد. تمام داروهای مشکوک - پماد، پودر، امولسیون، پودر - بلافاصله از فروش خارج شدند.
چنین اقدامی باعث خشم صاحب کارخانه در شنبک شد که تمام داروهای رد شده توسط رولوف را تولید می کرد. این تاجر - هرمان که یک شیمیدان حرفه ای بود، معاینه خود را از کالاها انجام داد. او با آزمودن کل زرادخانه آزمایش های شناخته شده در آن زمان برای تشخیص آرسنیک، متقاعد شد که محصولاتش از این نظر خالص هستند و آهن که حسابرس را گیج می کند، رنگ زرد اکسید روی را می دهد.
هرمان پس از گزارش نتایج آزمایشات خود به رولوف و مقامات سرزمین هانوفر، خواستار بررسی مستقل و "بازسازی" کامل محصول خود شد. در نتیجه تصمیم گرفته شد نظر پروفسور استرومایر که ریاست گروه شیمی دانشگاه گوتینگن را بر عهده داشت و همزمان سمت بازرس کل همه داروخانه های هانوور را بر عهده داشت، معلوم شود. به طور طبیعی، استرومایر نه تنها اکسید روی، بلکه سایر فرآورده های روی از کارخانه Shenebek، از جمله کربنات روی، که از آن این اکسید به دست آمد، برای تأیید فرستاده شد.
فریدریش استرومایر با کلسینه کردن کربنات روی ZnCO3 اکسیدی به دست آورد، اما نه آنطور که باید سفید، بلکه مایل به زرد است. در نتیجه تحقیقات بیشتر، مشخص شد که این داروها، همانطور که رولوف پیشنهاد کرد، حاوی آرسنیک یا آهن، همانطور که آلمانی ها فکر می کردند، نیستند. دلیل رنگ غیرمعمول فلزی کاملاً متفاوت بود - قبلاً ناشناخته بود و از نظر خواص بسیار شبیه روی بود. تنها تفاوت این بود که هیدروکسید آن، بر خلاف روی (OH) 2، آمفوتریک نبود، اما دارای خواص اساسی برجسته بود.
استرومیر فلز جدید را کادمیوم نامید و به شباهت شدید عنصر جدید با روی اشاره کرد - کلمه یونانی καδμεια (kadmeia) مدتهاست که سنگ معدن روی (به عنوان مثال اسمیتسونیت ZnCO3) و اکسید روی را نشان می دهد. به نوبه خود، این کلمه از نام کادموس فنیقی می آید، که طبق افسانه، اولین کسی بود که سنگ روی را پیدا کرد و توانایی آن را در دادن رنگ طلایی به مس (هنگامی که از سنگ معدن ذوب می شود) کشف کرد. طبق اسطوره های یونان باستان ، کادموس دیگری وجود داشت - قهرمانی که اژدها را شکست داد و قلعه کادمئوس را در سرزمین های دشمن شکست خورده توسط او ساخت ، که متعاقباً شهر بزرگ هفت دروازه تبس رشد کرد. در زبانهای سامی، "کادموس" به معنای "شرق" یا "سرپانتین" است (فرغانه، قرقیزستان، آسیای مرکزی - مکانهایی وجود دارد که مارها در آنجا تجمع میکنند)، که شاید نام ماده معدنی را از مکانهای استخراج یا صادرات آن میسازد. از هر کشور یا استان شرقی
در سال 1818، فردریش استرومایر شرح مفصلی از فلز را منتشر کرد، که قبلاً خواص آن را به خوبی مطالعه کرده بود. در شکل آزاد خود، عنصر جدید یک فلز سفید، نرم و نه چندان قوی بود که با یک لایه اکسید قهوه ای در بالای آن پوشانده شده بود. خیلی زود، همانطور که اغلب اتفاق می افتد، اولویت استرومایر در کشف کادمیوم به چالش کشیده شد، اما همه ادعاها رد شدند. کمی بعد، شیمیدان دیگری به نام کرستن، عنصر جدیدی را در سنگ معدن روی سیلزی یافت و نام آن را mellin گذاشت (از لاتین mellinus، "زرد مانند به"). دلیل این نام گذاری رنگ رسوبی بود که تحت تأثیر سولفید هیدروژن ایجاد می شد.
در کمال تاسف کرستن، معلوم شد که "ملین" همان "کادمیم" استرومایر است. حتی بعداً، نامهای دیگری برای عنصر چهل و هشتم پیشنهاد شد: در سال 1821، جان پیشنهاد کرد که عنصر جدید را "کلاپروتیوم" نامیده شود - به افتخار شیمیدان مشهور مارتین کلاپروت - کاشف اورانیوم، زیرکونیوم و تیتانیوم، و گیلبرت "جونونیوم". - پس از کشف سیارک در سال 1804 جونو. اما مهم نیست که چقدر شایستگی کلاپروت برای علم زیاد است، نام او قرار نبود جای پایی در فهرست عناصر شیمیایی پیدا کند: کادمیوم کادمیوم باقی ماند. درست است، در ادبیات شیمی روسیه در نیمه اول قرن 19، کادمیوم اغلب کادمیوم نامیده می شد.
بودن در طبیعت
کادمیوم یک عنصر معمولی کمیاب و نسبتاً پراکنده است، میانگین محتوای این فلز در پوسته زمین (کلارک) حدود 1.3 * 10-5٪ یا 1.6 * 10-5٪ وزنی تخمین زده می شود، به نظر می رسد که کادمیوم در لیتوسفر تقریباً 130 میلی گرم در تن است. کادمیم در روده های سیاره ما آنقدر کم است که حتی ژرمانیوم که کمیاب به حساب می آید، ۲۵ برابر بیشتر است! تقریباً نسبت های مشابه برای کادمیوم و سایر فلزات کمیاب: بریلیم، سزیم، اسکاندیم و ایندیم. کادمیوم از نظر فراوانی نزدیک به آنتیموان (2 * 10-5٪) و دو برابر بیشتر از جیوه (8 * 10-6٪) است.
کادمیوم با مهاجرت در آب های زیرزمینی گرم همراه با روی (کادمیم به عنوان یک ناخالصی هم شکل در بسیاری از مواد معدنی و همیشه در کانی های روی یافت می شود) و سایر عناصر کالکوفیل، یعنی عناصر شیمیایی مستعد تشکیل سولفیدهای طبیعی، سلنیدها، تلوریدها، مشخص می شود. سولفوسالت ها و گاهی اوقات در حالت بومی یافت می شوند. علاوه بر این، کادمیوم در ذخایر هیدروترمال متمرکز است. سنگ های آتشفشانی کاملاً غنی از کادمیوم هستند و حاوی 0.2 میلی گرم کادمیوم در هر کیلوگرم هستند. در میان سنگ های رسوبی، خاک رس غنی ترین عنصر در چهل و هشتمین عنصر است - تا 0.3 میلی گرم در کیلوگرم (برای مقایسه، سنگ آهک حاوی 0.035 میلی گرم بر کیلوگرم کادمیوم، ماسه سنگ ها - 0.03 میلی گرم در کیلوگرم است). میانگین میزان کادمیوم در خاک 06/0 میلی گرم بر کیلوگرم است.
همچنین، این فلز کمیاب در آب - به شکل محلول (سولفات، کلرید، نیترات کادمیوم) و به صورت سوسپانسیون به عنوان بخشی از مجتمع های آلی معدنی وجود دارد. در شرایط طبیعی، کادمیوم در نتیجه شسته شدن سنگ معدن فلزات غیرآهنی و همچنین در نتیجه تجزیه گیاهان آبزی و موجوداتی که قادر به تجمع آن هستند، وارد آب های زیرزمینی می شود. از آغاز قرن بیستم آلودگی انسانی آبهای طبیعی به کادمیوم به عامل اصلی ورود کادمیوم به آب و خاک تبدیل شده است. محتوای کادمیوم در آب به طور قابل توجهی تحت تأثیر pH محیط (در یک محیط قلیایی، کادمیوم به شکل هیدروکسید رسوب می کند) و همچنین فرآیندهای جذب می باشد. به همان دلیل انسانی، کادمیوم نیز در هوا وجود دارد.
در مناطق روستایی، محتوای کادمیوم در هوا 0.1-5.0 نانوگرم در متر مکعب (1 نانوگرم یا 1 نانوگرم = 10-9 گرم)، در شهرها - 2-15 نانوگرم در متر مکعب، در مناطق صنعتی - از 15 تا 150 نانوگرم است. /m3. کادمیوم عمدتاً در هوای اتمسفر آزاد می شود زیرا بسیاری از زغال های سوزانده شده در نیروگاه های حرارتی حاوی این عنصر هستند. کادمیوم که از هوا رسوب می کند، وارد آب و خاک می شود. افزایش محتوای کادمیوم در خاک با استفاده از کودهای معدنی تسهیل می شود، زیرا تقریباً همه آنها حاوی ناخالصی های جزئی از این فلز هستند. از آب و خاک، کادمیوم وارد گیاهان و موجودات زنده می شود و بیشتر در طول زنجیره غذایی می تواند به انسان "تامین" شود.
کادمیوم دارای مواد معدنی خاص خود است: Howliite، Otavite CdCO3، montemponite CdO (حاوی 87.5٪ Cd)، Greenockite CdS (77.8٪ Cd)، گزانتوکرویت CdS(H2O)x (77.2٪ Cd) cadmoselite CdSe (47٪ Cd). با این حال، ذخایر خود را تشکیل نمی دهند، بلکه به صورت ناخالصی در سنگ معدن روی، مس، سرب و چند فلزی (بیش از 50) وجود دارند که منبع اصلی تولید صنعتی کادمیوم هستند. علاوه بر این، سنگ معدن روی نقش اصلی را ایفا می کند، جایی که غلظت کادمیوم از 0.01 تا 5٪ (در اسفالریت ZnS) است. در بیشتر موارد، محتوای کادمیوم در اسفالریت از 0.4 - 0.6٪ تجاوز نمی کند. کادمیوم در گالن (0.005 - 0.02٪)، استنیت (0.003 - 0.2٪)، پیریت (تا 0.02٪)، کالکوپیریت (0.006 - 0.12٪) تجمع می یابد، کادمیوم از این سولفیدها استخراج می شود.
کادمیوم می تواند در گیاهان (بیشتر از همه در قارچ ها) و موجودات زنده (به ویژه در آب) جمع شود، به همین دلیل، کادمیوم را می توان در سنگ های رسوبی دریایی - شیل ها (مانسفلد، آلمان) یافت.
کاربرد
مصرف کننده اصلی کادمیوم تولید منابع جریان شیمیایی است: باتری های نیکل-کادمیم و نقره-کادمیم، سلول های سرب-کادمیم و جیوه-کادمیم در باتری های پشتیبان، سلول های معمولی وستون. باتریهای نیکل کادمیوم (AKN) مورد استفاده در صنعت یکی از محبوبترین در میان سایر منابع جریان شیمیایی هستند.
صفحات منفی این گونه آکومولاتورها از شبکه های آهنی با اسفنج کادمیوم به عنوان عامل فعال ساخته شده اند و صفحات مثبت با اکسید نیکل پوشانده شده اند. الکترولیت محلولی از پتاس سوزاننده (هیدروکسید پتاسیم) است. باتری های قلیایی نیکل کادمیوم نسبت به باتری های اسید سرب قابل اعتمادتر هستند. منابع جریان شیمیایی با استفاده از کادمیوم با عمر طولانی، عملکرد پایدار و ویژگی های الکتریکی بالا متمایز می شوند. به علاوه شارژ مجدد این باتری ها کمتر از یک ساعت زمان می برد! با این حال، AKN را نمی توان بدون تخلیه اولیه کامل شارژ کرد، و در این مورد، البته، آنها نسبت به باتری های هیدرید فلزی پایین تر هستند.
یکی دیگر از زمینه های گسترده کاربرد کادمیوم، رسوب پوشش های ضد خوردگی محافظ روی فلزات (آبکاری کادمیوم) است. پوشش کادمیوم به طور قابل اعتمادی از محصولات آهن و فولاد در برابر خوردگی جوی محافظت می کند. در گذشته، آبکاری کادمیوم با غوطه ور کردن فلز در کادمیوم مذاب انجام می شد، فرآیند مدرن منحصراً توسط الکترولیز انجام می شود. آبکاری کادمیوم برای حیاتی ترین قسمت های هواپیما، کشتی ها و همچنین قطعات و مکانیسم های طراحی شده برای عملکرد در آب و هوای گرمسیری اعمال می شود.
مشخص است که برخی از خواص روی و کادمیوم مشابه هستند، اما پوشش کادمیوم مزایای خاصی نسبت به پوشش گالوانیزه دارد: اولاً در برابر خوردگی مقاومتر است و ثانیاً صاف و یکدست شدن آن آسانتر است. علاوه بر این، برخلاف روی، کادمیوم در یک محیط قلیایی پایدار است. قلع کادمیوم به طور گسترده ای استفاده می شود، با این حال، منطقه ای وجود دارد که در آن استفاده از پوشش کادمیوم به شدت ممنوع است - این صنعت غذا است. این به دلیل سمیت بالای کادمیوم است.
تا زمان معینی، گسترش پوششهای کادمیوم به دلیل دیگری نیز محدود بود - وقتی کادمیوم به صورت الکترولیتی روی یک قطعه فولادی اعمال میشود، هیدروژن موجود در الکترولیت میتواند به داخل فلز نفوذ کند و همانطور که مشخص است، این عنصر باعث شکنندگی هیدروژن میشود. فولادهای با استحکام بالا که منجر به تخریب غیرمنتظره فلز تحت بار می شود. این مشکل توسط دانشمندان شوروی از موسسه شیمی فیزیک آکادمی علوم اتحاد جماهیر شوروی حل شد. مشخص شد که افزودن ناچیز تیتانیوم (یک اتم تیتانیوم به ازای هر هزار اتم کادمیوم) از قسمت فولادی با اندود کادمیوم در برابر وقوع شکنندگی هیدروژنی محافظت می کند، زیرا تیتانیوم تمام هیدروژن فولاد را در طول فرآیند پوشش جذب می کند.
حدود یک دهم تولید جهانی کادمیوم صرف تولید آلیاژها می شود. نقطه ذوب پایین یکی از دلایل استفاده گسترده از کادمیوم در آلیاژهای کم ذوب است. به عنوان مثال، آلیاژ چوب حاوی 12.5٪ کادمیوم است. چنین آلیاژهایی به عنوان لحیم کاری، به عنوان ماده ای برای به دست آوردن ریخته گری نازک و پیچیده، در سیستم های آتش نشانی خودکار، برای لحیم کاری شیشه با فلز استفاده می شود. لحیم کاری های حاوی کادمیوم در برابر نوسانات دما کاملاً مقاوم هستند.
یکی دیگر از ویژگی های متمایز آلیاژهای کادمیوم خاصیت ضد اصطکاک بالای آنها است. بنابراین، آلیاژی حاوی 99% کادمیوم و 1% نیکل برای ساخت یاتاقانهایی که در موتورهای خودرو، هواپیما و دریایی کار میکنند استفاده میشود. از آنجایی که کادمیوم به اندازه کافی در برابر اسیدها از جمله اسیدهای آلی موجود در روان کننده ها مقاوم نیست، آلیاژهای بر پایه کادمیوم با ایندیم پوشش داده می شوند. آلیاژ مس با افزودن کمی کادمیوم (کمتر از 1٪) امکان ساخت سیم های مقاوم در برابر سایش را در خطوط حمل و نقل الکتریکی فراهم می کند. چنین افزودنی های ناچیز کادمیوم می تواند به طور قابل توجهی استحکام و سختی مس را بدون بدتر شدن خواص الکتریکی آن افزایش دهد. آمالگام کادمیوم (محلول کادمیوم در جیوه) در فناوری دندانپزشکی برای ساخت پرکردگی دندان استفاده می شود.
در دهه چهل قرن بیستم، کادمیوم نقش جدیدی به دست آورد - آنها شروع به ساخت میله های کنترل و اضطراری راکتورهای هسته ای از آن کردند. دلیل اینکه کادمیوم به سرعت تبدیل به یک ماده استراتژیک شد این بود که نوترون های حرارتی را به خوبی جذب می کند. اما اولین راکتورهای آغاز «عصر اتمی» منحصراً روی نوترون های حرارتی کار می کردند. بعداً مشخص شد که راکتورهای نوترونی سریع هم برای انرژی و هم برای به دست آوردن سوخت هسته ای - 239Pu امیدوارکننده تر هستند و کادمیوم در برابر نوترون های سریع ناتوان است و آنها را به تاخیر نمی اندازد. در دوران راکتورهای نوترونی حرارتی، کادمیوم نقش غالب خود را از دست داد و جای خود را به بور و ترکیبات آن (در واقع زغال سنگ و گرافیت) داد.
حدود 20 درصد کادمیوم (به شکل ترکیبات) برای تولید رنگ های معدنی استفاده می شود. سولفید کادمیوم CdS یک رنگ معدنی مهم است که قبلا زرد کادمیوم نامیده می شد. از قبل در آغاز قرن بیستم، مشخص بود که زرد کادمیوم را می توان در شش رنگ، از زرد لیمویی تا نارنجی به دست آورد. رنگ های به دست آمده در برابر قلیاها و اسیدهای ضعیف مقاوم بوده و به سولفید هیدروژن کاملاً غیر حساس هستند.
رنگ های مبتنی بر CdS در بسیاری از زمینه ها - نقاشی، چاپ، نقاشی چینی استفاده می شد، آنها اتومبیل های سواری را پوشش می دادند و آنها را از دود لوکوموتیو محافظت می کردند. رنگ های حاوی سولفید کادمیوم در صنایع نساجی و صابون سازی استفاده می شد. با این حال، در حال حاضر، سولفید کادمیوم نسبتاً گران قیمت اغلب با رنگهای ارزانتر جایگزین میشود - کادموپون (مخلوطی از سولفید کادمیوم و سولفات باریم) و لیتوپون روی-کادمیم (ترکیب مانند کادموپون، به علاوه سولفید روی).
ترکیب دیگر کادمیوم، سلنید کادمیوم CdSe، به عنوان رنگ قرمز استفاده می شود. با این حال، ترکیبات کادمیوم کاربرد خود را نه تنها در تولید رنگ ها پیدا کرده اند - به عنوان مثال، سولفید کادمیوم برای تولید سلول های خورشیدی فیلم نیز استفاده می شود که راندمان آن حدود 10-16٪ است. علاوه بر این، CdS یک ماده ترموالکتریک نسبتاً خوب است که به عنوان جزئی از مواد نیمه هادی و فسفر استفاده می شود. گاهی اوقات از کادمیوم در فناوری برودتی استفاده می شود که با حداکثر هدایت حرارتی آن (نسبت به سایر فلزات) نزدیک به صفر مطلق (خلاء) همراه است.
تولید
"تامین کنندگان" اصلی کادمیوم محصولات فرعی فرآوری سنگ معدن روی، مس روی و سرب روی هستند. در مورد کانیهای بومی کادمیوم، تنها مورد مورد علاقه در بدست آوردن کادمیوم، گرینوکیت CdS است که به اصطلاح «مخلوط کادمیوم» نامیده میشود. گرینوکیت همراه با فریت در طول توسعه سنگ معدن روی استخراج می شود. در طی فرآیند بازیافت، کادمیوم در محصولات فرعی فرآیند جمع میشود و سپس از آنجا بازیابی میشود.
همانطور که قبلا ذکر شد، در فرآوری سنگ معدن های چند فلزی، کادمیوم اغلب محصول جانبی تولید روی است. اینها یا کیکهای مس-کادمیم (رسوبهای فلزی بهدست آمده در نتیجه محلولهای تمیزکننده سولفات روی ZnSO4 با اثر گرد و غبار روی) هستند که حاوی 2 تا 12 درصد کادمیوم هستند، یا پوسیرها (کسریهای فرار که در طی تقطیر روی ایجاد میشوند) حاوی 0.7 تا 1.1 درصد کادمیوم است.
غنیترین عنصر چهل و هشتم، کنسانترههایی است که در خلال خالصسازی روی بهدست میآیند، آنها میتوانند تا 40 درصد کادمیوم داشته باشند. از کیک های مس-کادمیم و سایر محصولات با محتوای بالای کادمیوم، معمولاً با اسید سولفوریک H2SO4 با هوادهی همزمان هوا شسته می شود. این فرآیند در حضور یک عامل اکسید کننده - سنگ معدن منگنز یا لجن منگنز بازیافت شده از حمام های الکترولیز انجام می شود.
علاوه بر این، کادمیوم از گرد و غبار کارخانههای ذوب سرب و مس بازیافت میشود (به ترتیب میتواند حاوی 0.5 تا 5 درصد و 0.2 تا 0.5 درصد کادمیوم باشد). در چنین مواردی معمولاً گرد و غبار را با اسید سولفوریک غلیظ H2SO4 تصفیه می کنند و سپس سولفات کادمیوم حاصل را با آب شستشو می دهند. اسفنج کادمیوم از محلول سولفات کادمیوم حاصل با اثر گرد و غبار روی رسوب می کند و پس از آن در اسید سولفوریک حل می شود و محلول با اثر کربنات سدیم Na2CO3 یا اکسید روی اکسید روی از ناخالصی ها پاک می شود، همچنین می توان از آن استفاده کرد. روش های تبادل یونی
فلز کادمیوم با الکترولیز بر روی کاتدهای آلومینیوم یا احیا با روی (جابجایی اکسید کادمیوم CdO از محلولهای CdSO4 توسط روی) با استفاده از راکتورهای جداکننده گریز از مرکز جدا میشود. پالایش فلز کادمیوم معمولاً شامل ذوب فلز در زیر یک لایه قلیایی (برای حذف روی و سرب) است، در حالی که استفاده از Na2CO3 امکان پذیر است. تصفیه مذاب با آلومینیوم (برای حذف نیکل) و کلرید آمونیوم NH4Cl (برای حذف تالیم).
کادمیوم با خلوص بالاتر با پالایش الکترولیتی با خالص سازی متوسط الکترولیت، که با استفاده از تبادل یونی یا استخراج انجام می شود، به دست می آید. یکسوسازی فلز (معمولاً تحت فشار کاهش یافته)، ذوب ناحیه ای یا سایر روش های کریستالیزاسیون. با ترکیب روش های تصفیه فوق، می توان کادمیوم فلزی را با محتوای ناخالصی های اصلی (روی، مس و غیره) تنها 10-5٪ وزنی به دست آورد. علاوه بر این، از روشهای انتقال الکتریکی در کادمیوم مایع، پالایش الکتریکی در مذاب سدیم هیدروکسید NaOH و الکترولیز آمالگام میتوان برای خالصسازی کادمیوم استفاده کرد. هنگامی که ذوب ناحیه با انتقال الکتریکی ترکیب می شود، جداسازی ایزوتوپ های کادمیوم می تواند همراه با خالص سازی رخ دهد.
تولید جهانی کادمیوم تا حد زیادی با مقیاس تولید روی مرتبط است و طی دهههای گذشته افزایش چشمگیری داشته است - طبق دادههای سال 2006، حدود 21 هزار تن کادمیوم در جهان تولید شد، در حالی که این رقم در سال 1980 تنها 15 هزار تن بود. . رشد مصرف کادمیوم حتی در حال حاضر ادامه دارد. تولید کنندگان اصلی این فلز کشورهای آسیایی هستند: چین، ژاپن، کره، قزاقستان. آنها 12 هزار تن از کل تولید را تشکیل می دهند.
روسیه، کانادا و مکزیک را نیز می توان تولیدکنندگان عمده کادمیوم در نظر گرفت. تغییر تولید انبوه کادمیوم به سمت آسیا به این دلیل است که در اروپا استفاده از کادمیوم کاهش یافته است و برعکس در منطقه آسیا تقاضا برای عناصر نیکل-کادمیم رو به افزایش است که این امر باعث می شود. بسیاری برای انتقال تولید به کشورهای آسیایی.
مشخصات فیزیکی
کادمیوم فلزی به رنگ سفید مایل به نقره ای است که وقتی تازه بریده می شود آبی می درخشد، اما به دلیل تشکیل یک لایه اکسید محافظ در هوا کدر می شود. کادمیوم یک فلز نسبتاً نرم است - از قلع سخت تر است، اما از روی نرم تر است، می توان آن را با چاقو برش داد. در ترکیب با نرمی، کادمیوم دارای ویژگیهای مهمی برای صنعت مانند شکلپذیری و شکلپذیری است - کاملاً به صورت ورقهای در میآید و به سیم کشیده میشود و میتواند بدون هیچ مشکلی صیقل داده شود.
وقتی کادمیوم در دمای بالای 80 درجه سانتیگراد گرم شود خاصیت ارتجاعی خود را از دست می دهد و به قدری که به راحتی می توان آن را به پودر تبدیل کرد. سختی کادمیوم بر اساس Mohs برابر با دو است، طبق گفته برینل (برای نمونه آنیل شده) 200-275 MPa. استحکام کششی 64 MN/m2 یا 6.4 kgf/mm2، ازدیاد طول نسبی 50% (در دمای 20 درجه سانتیگراد)، استحکام تسلیم 9.8 مگاپاسکال.
کادمیوم دارای یک شبکه کریستالی نزدیک بسته شش ضلعی با دوره های: a = 0.296 نانومتر، c = 0.563 نانومتر، نسبت c/a = 1.882، z = 2، انرژی شبکه کریستالی 116 میکروژول بر کیلومتر مول. گروه فضایی С6/mmm، شعاع اتمی 0.156 نانومتر، شعاع یونی Cd2+ 0.099 نانومتر، حجم اتمی 13.01∙10-6 m3/mol.
یک میله ساخته شده از کادمیوم خالص، هنگامی که خم می شود، ترک ضعیفی مانند قلع ("جیغ قلع") منتشر می کند - این میکروکریستال های فلزی است که به یکدیگر مالش می کنند، با این حال، هر گونه ناخالصی در فلز این اثر را از بین می برد. به طور کلی کادمیوم از نظر خواص فیزیکی، شیمیایی و دارویی در گروه فلزات سنگین قرار می گیرد که بیشترین شباهت را با روی و جیوه دارد.
نقطه ذوب کادمیوم (321.1 درجه سانتیگراد) بسیار پایین است و می توان آن را با نقطه ذوب سرب (327.4 درجه سانتیگراد) یا تالیوم (303.6 درجه سانتیگراد) مقایسه کرد. با این حال، با نقاط ذوب فلزات مشابه در تعدادی از خواص متفاوت است - کمتر از روی (419.5 درجه سانتیگراد)، اما بالاتر از قلع (231.9 درجه سانتیگراد). نقطه جوش کادمیوم نیز پایین است - فقط 770 درجه سانتیگراد، که بسیار جالب است - سرب، مانند اکثر فلزات دیگر، تفاوت زیادی بین نقطه ذوب و جوش دارد.
بنابراین سرب دارای نقطه جوش (1745 درجه سانتیگراد) 5 برابر بالاتر از نقطه ذوب است و قلع که نقطه جوش آن 2620 درجه سانتیگراد است، 11 برابر بالاتر از نقطه ذوب است! در عین حال، روی، مشابه کادمیوم، دارای نقطه جوش تنها 960 درجه سانتیگراد در نقطه ذوب 419.5 درجه سانتیگراد است. ضریب انبساط حرارتی برای کادمیوم 29.8 * 10-6 (در دمای 25 درجه سانتیگراد) است. . زیر 0.519 کلوین، کادمیوم به یک ابررسانا تبدیل می شود. هدایت حرارتی کادمیوم در دمای 0 درجه سانتیگراد 97.55 W / (m * K) یا 0.233 cal / (cm * sec * o C) است.
ظرفیت گرمایی ویژه کادمیوم (در دمای 25 درجه سانتیگراد) 225.02 j/(kg * K) یا 0.055 cal/(g * o C) است. ضریب دمایی مقاومت الکتریکی کادمیوم در محدوده دمایی 0 تا 100 درجه سانتیگراد 4.3 * 10-3 است، مقاومت الکتریکی ویژه کادمیوم (در دمای 20 درجه سانتیگراد) 7.4 * 10-8 اهم * است. متر (7.4 * 10-6 اهم * سانتی متر). کادمیوم دیامغناطیس است، حساسیت مغناطیسی آن 9-0.176.10 (در دمای 20 درجه سانتیگراد) است. پتانسیل استاندارد الکترود 403/0- ولت است. الکترونگاتیوی کادمیوم 7/1 است. سطح مقطع موثر جذب نوترون های حرارتی 2450-2900-10 ~ 28 m2 است. تابع کار الکترون ها = 4.1 eV.
چگالی (در دمای اتاق) کادمیوم 8.65 گرم بر سانتی متر مکعب است که امکان طبقه بندی کادمیوم را به عنوان یک فلز سنگین فراهم می کند. طبق طبقه بندی N. Reimers، فلزات با چگالی بیش از 8 گرم بر سانتی متر مکعب باید سنگین در نظر گرفته شوند. بنابراین، فلزات سنگین شامل سرب، مس، روی، نیکل، کادمیوم، کبالت، Sb، Sn، بی، جیوه است. و اگرچه کادمیوم از سرب (چگالی 11.34 گرم در سانتی متر مکعب) یا جیوه (13.546 گرم در سانتی متر مکعب) سبک تر است، اما از قلع (7.31 گرم در سانتی متر مکعب) سنگین تر است.
خواص شیمیایی
در ترکیبات شیمیایی، کادمیوم همیشه ظرفیت 2 را نشان می دهد (پیکربندی لایه الکترونی بیرونی 5s2 است) - واقعیت این است که اتم های عناصر زیرگروه ثانویه گروه دوم (روی، کادمیوم، جیوه) مانند اتم های عناصر زیرگروه مس، دارای یک d-sublevel از دومین لایه الکترونیکی بیرونی کاملاً پر شده است. با این حال، برای عناصر زیرگروه روی، این سطح فرعی در حال حاضر کاملاً پایدار است و حذف الکترون ها از آن مستلزم صرف انرژی بسیار زیادی است. یکی دیگر از ویژگی های بارز عناصر زیرگروه روی که آنها را به عناصر زیرگروه مس نزدیک می کند، تمایل آنها به تشکیل کمپلکس است.
همانطور که قبلا ذکر شد، کادمیوم در یک گروه از سیستم تناوبی با روی و جیوه قرار دارد و یک موقعیت میانی بین آنها را اشغال می کند، به همین دلیل تعدادی از خواص شیمیایی همه این عناصر مشابه است. به عنوان مثال، اکسیدها و سولفیدهای این فلزات عملاً در آب نامحلول هستند.
در هوای خشک، کادمیوم پایدار است، اما در هوای مرطوب، یک لایه نازک از اکسید CdO به آرامی روی سطح فلز تشکیل میشود که از فلز در برابر اکسیداسیون بیشتر محافظت میکند. با تابش قوی، کادمیوم می سوزد، همچنین به اکسید کادمیوم تبدیل می شود - یک پودر کریستالی از رنگ قهوه ای روشن تا قهوه ای تیره (تفاوت در طیف رنگ تا حدی به دلیل اندازه ذرات است، اما تا حد زیادی نتیجه نقص شبکه کریستالی است. چگالی CdO 8.15 گرم بر سانتی متر مکعب. اکسید کادمیوم بالای 900 درجه سانتیگراد فرار است و در دمای 1570 درجه سانتیگراد کاملا تصعید می شود. بخارات کادمیوم با بخار آب واکنش داده و هیدروژن آزاد می کند.
اسیدها با کادمیوم واکنش داده و نمک های این فلز را تشکیل می دهند. اسید نیتریک HNO3 به راحتی کادمیوم را حل می کند، در حالی که اکسید نیتریک آزاد می شود و نیترات تشکیل می شود که به هیدرات Cd (NO3) 2 * 4H2O می دهد. از اسیدهای دیگر - هیدروکلریک و سولفوریک رقیق - کادمیوم به آرامی هیدروژن را جابجا می کند، این با این واقعیت توضیح داده می شود که در سری ولتاژها، کادمیوم بیشتر از روی است، اما جلوتر از هیدروژن است. برخلاف روی، کادمیوم با محلول های قلیایی برهمکنش نمی کند. کادمیوم نیترات آمونیوم NH4NO3 را در محلول های غلیظ به نیتریت آمونیوم NH4NO2 کاهش می دهد.
در بالای نقطه ذوب، کادمیوم به طور مستقیم با هالوژن ها ترکیب می شود و ترکیبات بی رنگ - هالیدهای کادمیوم را تشکیل می دهد. CdCl2، CdBr2 و CdI2 به راحتی در آب حل می شوند (2/53 درصد جرمی در دمای 20 درجه سانتیگراد)، حل کردن فلوراید کادمیوم CdF2 بسیار دشوارتر است (06/4 درصد جرمی در دمای 20 درجه سانتیگراد)، که کاملاً در اتانول نامحلول است. می توان آن را با اثر فلوئور روی فلز یا هیدروژن فلوراید روی کربنات کادمیوم به دست آورد. کلرید کادمیوم از واکنش کادمیوم با اسید کلریدریک غلیظ یا کلرزنی فلز در دمای 500 درجه سانتی گراد به دست می آید.
برمید کادمیوم از برماسیون فلز یا اثر هیدروژن برومید بر روی کربنات کادمیوم به دست می آید. هنگامی که گرم می شود، کادمیوم با گوگرد واکنش می دهد و سولفید CdS (زرد لیمویی تا قرمز نارنجی)، نامحلول در آب و اسیدهای رقیق تشکیل می دهد. هنگامی که کادمیوم با فسفر و آرسنیک ذوب می شود، فسفیدها و آرسنیدهای ترکیبات Cd3P2 و CdAs2 به ترتیب با آنتیموان - آنتیمونید کادمیوم تشکیل می شوند. کادمیوم با هیدروژن، نیتروژن، کربن، سیلیکون و بور واکنش نمی دهد. هیدرید CdH2 و نیترید Cd3N2، که به راحتی در حرارت تجزیه می شوند، به طور غیر مستقیم به دست آمد.
محلول های نمک های کادمیوم به دلیل هیدرولیز اسیدی هستند، قلیایی های سوزاننده هیدروکسید سفید Cd (OH) 2 را از آنها رسوب می دهند. تحت تأثیر محلول های قلیایی بسیار غلیظ، به هیدروکسوکادمات هایی مانند Na2 تبدیل می شود. هیدروکسید کادمیوم با آمونیاک واکنش می دهد و کمپلکس های محلول را تشکیل می دهد:
Cd(OH)2 + 6NH3 * H2O → (OH)2 + 6H2O
علاوه بر این، Cd(OH)2 تحت اثر سیانیدهای قلیایی وارد محلول می شود. بالای 170 درجه با آن به CdO تجزیه می شود. برهمکنش هیدروکسید کادمیوم با پراکسید هیدروژن (پراکسید) در یک محلول آبی منجر به تشکیل پراکسیدها (پراکسیدها) از ترکیبات مختلف می شود.
با استفاده از مطالب وب سایت http://i-think.ru/
ADR 6.1
مواد سمی (سم)
خطر مسمومیت در اثر استنشاق، تماس با پوست یا در صورت بلعیده شدن. خطرناک برای محیط آبی یا سیستم فاضلاب (مشابه کالاهای خطرناک ADR برای حمل و نقل جیوه، کم خطرتر)
از ماسک خروج اضطراری استفاده کنید
الماس سفید، شماره ADR، جمجمه سیاه و استخوان های متقاطع
ماهی ADR
مواد خطرناک برای محیط زیست (اکولوژی، از جمله مواد ذوب، محلول، پودری و روان)
خطرناک برای محیط آبی یا سیستم فاضلاب (مشابه کالاهای خطرناک ADR برای حمل و نقل جیوه، کم خطرتر)