يتم تحفيز بعض التفاعلات الكيميائية بواسطة تفاعلات معينة. الكيمياء الفيزيائية. تصنيف التفاعلات الكيميائية
الكيمياء العامة: كتاب مدرسي / A. V. Zholnin؛ حررت بواسطة V. A. Popkova، A. V. Zholnina. - 2012. - 400 ص: مريض.
الفصل 2. أساسيات حركية التفاعل الكيميائي
الفصل 2. أساسيات حركية التفاعل الكيميائي
الفرق بين التنفس والاحتراق هو فقط في سرعة العملية.
أ.-ل. لافوازييه
2.1. حركية الكيميائية. الموضوع والمفاهيم الأساسية للحركية الكيميائية. رد الفعل السريع
يتم الحكم على الاتجاه والعمق والاحتمال الأساسي لحدوث العملية من خلال حجم التغير في الطاقة الحرة (ΔG ≥0). ومع ذلك، فإن هذه القيمة لا تشير إلى الاحتمال الحقيقي لحدوث التفاعل في ظل هذه الظروف.
على سبيل المثال، يحدث التفاعل بين أكسيد النيتروز والأكسجين على الفور عند درجة حرارة الغرفة:
وفي الوقت نفسه، 2H 2 (ز) + O 2 (ز) = 2H 2 O (ل)، Δ درجة ز= -286.8 كيلوجول/مول - تفاعل يتميز بانخفاض أكبر بكثير في الطاقة الحرة؛ في ظل الظروف العادية لا يحدث التفاعل، ولكن عند 700 درجة مئوية أو في وجود محفز تحدث العملية على الفور. وبالتالي، فإن الديناميكا الحرارية لا تجيب على سؤال ظروف وسرعة العملية. وهذا يكشف عن القيود المفروضة على النهج الديناميكي الحراري. لوصف التفاعل الكيميائي، من الضروري أيضًا معرفة أنماط حدوثه مع مرور الوقت، والتي يتم دراستها بواسطة علم الحركة.
الحركية هي فرع من فروع الكيمياء يدرس معدل وآلية التفاعلات الكيميائية وتأثير العوامل المختلفة عليها.
اعتمادا على ما إذا كانت مكونات التفاعل في مرحلة واحدة أو أكثر، يتم تمييز حركية التفاعلات المتجانسة وغير المتجانسة. وفقا للآلية تنقسم التفاعلات إلى بسيطة ومعقدة، وبالتالي يتم تمييز حركية التفاعلات البسيطة والمعقدة.
المفهوم الأساسي لحركية التفاعل هو معدل التفاعل الكيميائي.تحديد معدل التفاعلات الكيميائية له أهمية بيولوجية واقتصادية.
يتم تحديد معدل التفاعل الكيميائي من خلال كمية المادة المتفاعلة لكل وحدة زمنية لكل وحدة حجم (في حالة التفاعلات المتجانسة، عندما تكون المواد المتفاعلة في نفس الطور) أو لكل واجهة وحدة(في حالة التفاعلات غير المتجانسة، عندما تكون المواد المتفاعلة في أطوار مختلفة).
يتميز معدل التفاعل بالتغير في تركيز أي من منتجات التفاعل الأولية أو النهائية كدالة للوقت. معادلة تصف اعتماد معدل التفاعل (v) على التركيز (مع)تسمى المواد المتفاعلة الحركية.غالبًا ما يتم التعبير عن معدل التفاعل بـ mol/l-s، في الكيمياء الحيوية بـ mg/100 ml-s، أو في الكسر الكتلي، %/100 ml-s. يتم التمييز بين متوسط معدل التفاعل خلال فترة زمنية ومعدل التفاعل الحقيقي عند نقطة زمنية معينة. إذا كان في الفاصل الزمني ر 1و ر 2تركيز إحدى المواد البادئة أو نواتج التفاعل يساوي c 1 و c 2 على التوالي، ثم متوسط معدل التفاعل (v) في الفترة الزمنية ر 1و ر 2يمكن التعبير عنه:
وبما أننا نتحدث في هذه الحالة عن انخفاض في تركيز المادة الأولية، أي. ويؤخذ التغير في تركيز المادة في هذه الحالة بعلامة الطرح (-). إذا تم تقييم معدل التفاعل من خلال التغيير (الزيادة) في تركيز أحد منتجات التفاعل، فعندئذ بعلامة الجمع (+):
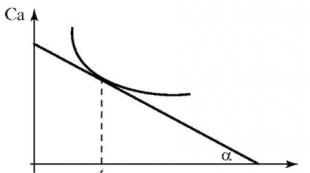
باستخدام المعادلة (2.2) نحدد متوسط السرعةتفاعل كيميائي. السرعة الحقيقية (اللحظية).يتم تحديد ردود الفعل بيانيا. أنشئ رسمًا بيانيًا لتركيز المادة البادئة أو منتج التفاعل (Ca) مقابل الزمن (t) - المنحنى الحركي للتفاعل Ca - و (ر)لعملية غير خطية (الشكل 2.1).
في كل لحظة (على سبيل المثال، ر 1)معدل التفاعل الحقيقي يساوي مماس المنحنى الحركي عند النقطة المقابلة لزمن معين. وفقًا للرسم البياني، سيتم حساب معدل التفاعل اللحظي باستخدام الصيغة:
في الكيمياء الحيوية، يتم استخدامه لوصف حركية التفاعلات الأنزيمية. معادلة ميكايليس-مينتن,مما يدل على اعتماد معدل التفاعل المحفز بواسطة الإنزيم على تركيز الركيزة والإنزيم. أبسط مخطط حركي تكون معادلة ميكايليس صالحة له: ه+ س↔إس→ه+ ف:

أرز. 2.1.المنحنى الحركي
أين جهاز افتراضي- أقصى سرعة رد الفعل؛ كم هو ثابت ميكايليس، ويساوي تركيز الركيزة الذي يكون فيه معدل التفاعل نصف الحد الأقصى؛ س- تركيز الركيزة.
تتيح لنا دراسة معدل التفاعل الكيميائي الحصول على معلومات حول آليته. بالإضافة إلى التركيز، يعتمد معدل التفاعل على طبيعة الكواشف والظروف الخارجية ووجود المحفز.
2.2. الجزيئية وترتيب التفاعل. نصف الحياة
في الحركية، تختلف التفاعلات الكيميائية من حيث الجزيئية وترتيب التفاعل. جزيئية التفاعليتم تحديده من خلال عدد الجزيئات (الذرات أو الجزيئات أو الأيونات) المشاركة في نفس الوقت في الفعل الأولي للتحول الكيميائي. يمكن لجزيء واحد أو جزيئين أو ثلاثة أن يشارك في التفاعل الأولي. احتمال تصادم المزيد من الجزيئات صغير جدًا. بناءً على هذه الميزة، يتم التمييز بين التفاعلات الأحادية الجزيئية والثنائية الجزيئية والثلاثية الجزيئية. من الناحية التجريبية، يمكن تحديد جزيئية التفاعل فقط للتفاعلات الأولية (البسيطة) التي تحدث في مرحلة واحدة وفقًا للمعادلة المتكافئة. لكي تحدث معظم هذه التفاعلات، يلزم وجود طاقة تنشيط كبيرة (150-450 كيلوجول/مول).
معظم ردود الفعل معقدة. تسمى مجموعة المراحل الأولية التي تشكل التفاعل المعقد آلية رد الفعل
شؤون.لذلك، لتوصيف حركية التفاعل، تم تقديم المفهوم ترتيب رد الفعل,والتي يتم تحديدها بواسطة المعادلة المتكافئة.
مجموع المعلمات المتكافئة لجميع المواد الأولية المدرجة في معادلة التفاعل (2.5) (أ+ ب) يحدد الترتيب العام للتفاعل. يُطلق على المؤشر الذي يدخل به كاشف معين إلى المعادلة ترتيب التفاعل للمادة (ترتيب التفاعل الجزئي)، على سبيل المثال، المؤشر أ- ترتيب التفاعل للمادة أ، ب- بالنسبة للمادة B. ترتيب التفاعل والجزيئية هما نفس التفاعلات البسيطة فقط. يتم تحديد ترتيب التفاعل من خلال تلك المواد التي تؤثر على سرعة التفاعل.
تشمل التفاعلات الأحادية الجزيئية تفاعلات التحلل والأيزومرة.
التفاعلات التي تتضمن معادلة معدلها تركيز مادة متفاعلة واحدة للقوة الأولى تسمى تفاعلات الدرجة الأولى.
تتضمن المعادلة الحركية المواد التي يتغير تركيزها أثناء التفاعل. لا تتغير تركيزات المواد التي تكون زائدة بشكل كبير أثناء التفاعل.
يكون الماء في تفاعل التحلل المائي لكربونات الصوديوم زائدًا بشكل كبير ولا يتم تضمينه في المعادلة الحركية.
في الأنظمة غير المتجانسة، تحدث تصادمات الجسيمات عند السطح البيني، وبالتالي فإن كتلة الطور الصلب لا تؤثر على معدل التفاعل وبالتالي لا تؤخذ بعين الاعتبار في التعبير عن معدل التفاعل.
تشمل التفاعلات ثنائية الجزيئات تفاعلات التقليص وتفاعلات الاستبدال التي تحدث خلال المرحلة مجمع المنشط.
التفاعلات التي يتناسب معدلها مع حاصل ضرب تراكيز مادتين للقوة الأولى أو مربع تركيز مادة واحدة تسمى تفاعلات الدرجة الثانية.
التفاعلات الثلاثية الجزيئية نادرة، والتفاعلات الرباعية الجزيئية غير معروفة.
من بين العمليات البيوكيميائية، لا تحدث تفاعلات من الدرجة الثالثة.
تسمى التفاعلات التي لا يعتمد معدلها على تركيز المواد الأولية تفاعلات الترتيب الصفري (v = k).
مثال على التفاعلات ذات الترتيب الصفري هي التفاعلات الحفزية، التي يعتمد معدلها فقط على تركيز المحفز. حالة خاصة من هذه التفاعلات هي التفاعلات الأنزيمية.
كقاعدة عامة، تشارك العديد من الكواشف (الركيزة، الإنزيم المساعد، العامل المساعد) في العمليات الكيميائية الحيوية. في بعض الأحيان لا يكون كل منهم معروفا. ولذلك، يتم الحكم على تقدم العملية على أساس مادة واحدة. في هذه الحالة، السمة الكمية لمسار ردود الفعل مع مرور الوقت هي فترة نصف العمر (الزمن)الكاشف - الوقت الذي تنخفض فيه كمية أو تركيز المادة الأولية إلى النصف (بنسبة 50٪) أو يتم تكوين نصف منتجات التفاعل. على وجه الخصوص، يتميز تحلل النويدات المشعة بهذه الطريقة، لأن نصف عمرها لا يعتمد على الكمية الأولية.
من خلال تحليل اعتماد نصف عمر التفاعل على التركيز الأولي، يمكن تحديد ترتيب التفاعل (طريقة أوستفالد-نويس). إن ثبات فترة نصف العمر (عند درجة حرارة معينة) هو سمة مميزة للعديد من تفاعلات التحلل، وبشكل عام، تفاعلات الدرجة الأولى. ومع زيادة تركيز الكاشف، تقل فترة نصف التحويل في التفاعلات من الدرجة الثانية وتزداد في التفاعلات من الدرجة الصفرية.
2.3. ثابت معدل التفاعل، تعريفه. قانون الجماهير الفاعلة
يعتمد معدل التفاعلات المتجانسة على عدد لقاءات الجسيمات المتفاعلة لكل وحدة زمنية في وحدة الحجم. يتناسب احتمال تصادم الجزيئات المتفاعلة مع ناتج تركيزات المواد المتفاعلة. وبالتالي، فإن معدل التفاعل يتناسب طرديا مع ناتج تراكيز المواد المتفاعلة، المأخوذة بقوى تساوي المعاملات المتكافئة للمواد المقابلة في معادلة التفاعل. ويسمى هذا النمط قانون العمل الجماعي(قانون معدل التفاعل الكيميائي) وهو
القانون الأساسي للحركية الكيميائية. تم وضع قانون العمل الجماعي من قبل العلماء النرويجيين K. Guldberg و P. Vahe في عام 1867.
على سبيل المثال، بالنسبة للتفاعل الذي يتم بشكل عام، وفقًا للمخطط
ستكون المعادلة الحركية صحيحة:
أين الخامس- معدل التفاعل الكيميائي. معو مع ب- تركيزات المواد أو في[مول/لتر]؛ ضد أو ضد ب- مؤشرات الطلب للكواشف أوب؛ ك- ثابت معدل التفاعل الكيميائي - معامل لا يعتمد على تركيز المواد المتفاعلة.
ثابت معدل التفاعل الكيميائي (ك) يمثل معدل التفاعل الكيميائي في الظروف التي يكون فيها ناتج تركيزات المواد المتفاعلة 1 مول / لتر. في هذه الحالة الخامس = ك.
على سبيل المثال، إذا كان في التفاعل H 2 (g) + I 2 (g) = 2HI (g) c(H 2) وc(I 2) يساوي 1 مول/لتر أو إذا كان c(H 2) يساوي إلى 2 مول/لتر، و"ج(I2) 0.5 مول/لتر"، ثم الخامس= ك.
يتم تحديد وحدات ثابت التوازن بواسطة قياس العناصر الكيميائية للتفاعل. من غير الصحيح مقارنة ثوابت معدل التفاعلات ذات الرتب المختلفة مع بعضها البعض، لأنها كميات مختلفة ذات معاني مختلفة ولها أبعاد مختلفة.
2.4. آلية التفاعلات الكيميائية. تصنيف التفاعلات المعقدة
تأخذ آلية التفاعل في الاعتبار جميع تصادمات الجزيئات الفردية التي تحدث في وقت واحد أو بالتتابع. تعطي الآلية صورة مفصلة عن العناصر المتكافئة لكل خطوة من خطوات التفاعل، أي. إن فهم الآلية يعني تحديد جزيئية كل خطوة من خطوات التفاعل. تعتبر دراسة آلية التفاعلات الكيميائية مهمة صعبة للغاية. بعد كل شيء، لا يمكننا إجراء ملاحظات مباشرة على تقدم تفاعل الجزيئات. تعتمد النتائج التي يتم الحصول عليها في بعض الأحيان على حجم وشكل الوعاء. وفي بعض الحالات، يمكن تفسير نفس النتائج باستخدام آليات مختلفة.
يعتبر تفاعل غاز الهيدروجين مع اليود H 2 (g) + I 2 (g) = 2HI (g) مثالًا كلاسيكيًا للتفاعل الجزيئي للثاني
النظام، ولكن في عام 1967 ن.ن. أظهر Semenov وG. Eyring وJ. Sullivan أنه معقد ويتكون من 3 تفاعلات أولية: I 2 = 2I؛ 2أنا = أنا 2 ; 2I + H2 = 2HI. على الرغم من أنه يمكن تصنيف التفاعل رسميًا على أنه ثلاثي الجزيئات، إلا أن معدله يوصف بمعادلة حركية تذكرنا بمعادلة التفاعل من الدرجة الثانية:

في التفاعلات المعقدة، عادة لا تتطابق الجزيئية وترتيب التفاعل. يشير الترتيب غير المعتاد - الكسري أو السلبي - للتفاعل بوضوح إلى آليته المعقدة.
المعادلة الحركية لأكسدة أول أكسيد الكربون مع الأكسجين 2CO (g) + O 2 (g) = CO 2 (g) لها ترتيب سلبي (ناقص أولًا) بالنسبة إلى CO:
كلما زاد تركيز أول أكسيد الكربون، انخفضت سرعة التفاعل.
وفقا لآلية التفاعل يمكن تقسيم التفاعلات إلى عدة أنواع.
ردود أفعال متسقةتسمى تفاعلات معقدة، يتفاعل في كل منها منتج (X 1) من المرحلة الابتدائية الأولى مع منتج المرحلة الثانية، ويدخل منتج (X 2) من المرحلة الثانية إلى الثالث، وهكذا، حتى النهاية يتم تشكيل المنتج:

أين س- الركيزة (الكاشف الأولي)؛ ك 1، ك 2، ك 3 ... - معدل ثابت 1، 2، الخ. مراحل التفاعل ص- المنتج النهائي.
تحدث مراحل التفاعلات المتعاقبة بمعدلات مختلفة. المرحلة التي يكون معدل ثابتها في حدها الأدنى تسمى الحد.ويحدد النمط الحركي للتفاعل ككل. تسمى المواد التي تتكون في المراحل المتوسطة المنتجات الوسيطةأو وسيطة،والتي تعتبر ركائز للمراحل اللاحقة. إذا كانت المادة الوسيطة تتحلل ببطء وبسرعة، فإن تركيزها لا يتغير لفترة طويلة. جميع العمليات الأيضية تقريبًا هي تفاعلات متسلسلة (على سبيل المثال، استقلاب الجلوكوز).
ردود الفعل الموازيةهي تفاعلات لها نفس كواشف البداية وتتوافق مع منتجات مختلفة. مع سرعة التفاعلات المتوازية تساوي مجموع سرعات التفاعلات الفردية.تنطبق هذه القاعدة أيضًا على التفاعلات الكيميائية المتوازية ثنائية الجزيئات.
ردود الفعل المتوازية والمتسلسلةتسمى التفاعلات التي لها نفس الكواشف الأولية، والتي يمكن أن تتفاعل عبر مسارين أو أكثر (آليات)، بما في ذلك مع عدد مختلف من المراحل الوسيطة. هذه الحالة تكمن وراء هذه الظاهرة الحفز,عندما يؤدي وجود وسيط في أحد المسارات إلى زيادة سرعة المسارات الأخرى.
ردود الفعل المتنافسةتسمى التفاعلات المعقدة التي فيها نفس المادة أيتفاعل في وقت واحد مع واحد أو أكثر من الكواشف ب1، ب2وما إلى ذلك، يشارك في ردود الفعل التي تحدث في وقت واحد: أ+ ب 1 → × 1 ; أ+ ب 2 → × 2.تتنافس هذه التفاعلات مع بعضها البعض للحصول على الكاشف أ.
ردود الفعل المترافقةهي تفاعلات معقدة لا يحدث فيها تفاعل إلا في وجود تفاعل آخر. في التفاعلات المزدوجة، تعمل المادة الوسيطة كحلقة وصل بين العمليات الأولية والثانوية وتحدد حدوث كليهما.
تحتاج الخلية الحية إلى طاقة لتتمكن من البقاء. المصدر العالمي للطاقة في الكائنات الحية هو حمض الأدينوزين ثلاثي الفوسفوريك (ATP). يعمل هذا المركب كمخزن للطاقة، لأنه عندما يتفاعل مع الماء، أي. يتم تشكيل التحلل المائي، وأحماض الأدينوزين ثنائي الفوسفوريك (ADP) والفوسفوريك (P) ويتم إطلاق الطاقة. ولهذا السبب يطلق عليه اسم ATP مركب ماكرورجيك,والرابطة P-O-P التي تنكسر أثناء التحلل المائي تكون ذات طاقة عالية. اتصال ماكرورجيكهي رابطة كيميائية، عندما تنكسر نتيجة تفاعل التحلل المائي، تطلق طاقة كبيرة:
كما تعلم، فإن قطع أي اتصال (بما في ذلك الاتصالات عالية الطاقة) يتطلب دائمًا إنفاق الطاقة. في حالة التحلل المائي ATP، بالإضافة إلى عملية تكسير الرابطة بين مجموعات الفوسفات، والتي فيها Δ ز>0، تحدث عمليات الترطيب والأيزومرة وتحييد المنتجات المتكونة أثناء التحلل المائي. ونتيجة لكل هذه العمليات، يكون التغير الكلي في طاقة جيبس سالبًا
معنى. وبالتالي، فإن كسر الرابطة ليس هو ما يسبب الطاقة الكلية، بل النتيجة النشطة لتحللها المائي.
لكي تحدث تفاعلات مولدة للطاقة (ΔG >0) في الأنظمة الحية، من الضروري أن تقترن بتفاعلات مولدة للطاقة (ΔG<0). Такое сопряжение возможно, если обе реакции имеют какое-либо общее промежуточное соединение, и на всех стадиях сопряженных реакций суммарный процесс характеризуется отрицательным значением изменения энергии Гиббса (∑ΔG сопр.р <0). Например, синтез сахарозы является эндэргонической реакцией и самопроизвольно происходить не может:
ومع ذلك، فإن اقتران هذا التفاعل مع تفاعل مولد الطاقة للتحلل المائي ATP، المصحوب بتكوين مركب وسيط مشترك جلوكوز-1-فوسفات، يؤدي إلى حقيقة أن العملية الإجمالية لها ∑ΔG<0:
ردود الفعل المتسلسلةهي تفاعلات كيميائية ونووية يؤدي فيها ظهور جسيم نشط (جذر حر أو ذرة في العمليات الكيميائية، ونيوترون في العمليات النووية) إلى حدوث عدد كبير (سلسلة) من التحولات المتعاقبة للجزيئات أو النوى غير النشطة. التفاعلات المتسلسلة شائعة في الكيمياء. تحدث العديد من التفاعلات الكيميائية الضوئية وعمليات الأكسدة (الاحتراق والانفجار) والبلمرة والتكسير عبر آلية السلسلة. تم تطوير نظرية التفاعلات المتسلسلة على يد الأكاديمي H.H. سيمينوف ، إس.إن. هينشلوود (إنجلترا) وآخرون المراحل الرئيسية للتفاعلات المتسلسلة هي: البداية (البدء)، الاستمرارية (الاستطالة)، وانتهاء السلسلة (الانتهاء). هناك نوعان من التفاعلات المتسلسلة: تفاعلات ذات سلاسل غير متفرعة ومتفرعة. تكمن خصوصية التفاعلات المتسلسلة في أن فعل التنشيط الأساسي يؤدي إلى تحويل عدد كبير من جزيئات المواد الأولية. التفاعلات الكيميائية الحيوية للأكسدة الجذرية الحرة هي تفاعلات متسلسلة.
ردود الفعل الدورية (المتأرجحة ذاتيا).هي تفاعلات تحفيزية معقدة متعددة المراحل تتضمن عدة مواد تحدث فيها تقلبات دورية في تركيزات الأشكال المؤكسدة والمخفضة. التفاعلات التذبذبية التي اكتشفها ب.ب. بيلوسوف، درس بواسطة أ.م. زابوتنسكي وآخرون يعتمد تردد وشكل الاهتزازات على تركيزات المواد الأولية والأحماض
درجة الحرارة. مثال على مثل هذه التفاعلات هو تفاعل حمض البرومومالونيك مع برومات البوتاسيوم في بيئة حمضية، حيث يكون المحفز عبارة عن ملح السيريوم (III). وللتفاعلات الدورية أهمية كبيرة بالنسبة للأشياء البيولوجية، حيث تنتشر التفاعلات من هذا النوع على نطاق واسع.
تفاعلات الاحتراق في المرحلة الصلبة(تفاعلات التوليف الذاتي لدرجات الحرارة العالية، SHS) تم اكتشافها في عام 1967 في معهد الفيزياء الكيميائية التابع لأكاديمية العلوم في اتحاد الجمهوريات الاشتراكية السوفياتية على يد أ.ج. ميرزانوف وإي جي. بوروفينسكايا. جوهر طريقة SHS هو أنه بعد البدء المحلي لتفاعل تفاعل الكواشف، ينتشر الجزء الأمامي من تفاعل الاحتراق تلقائيًا في جميع أنحاء النظام بسبب انتقال الحرارة من المنتجات الساخنة إلى المواد الأولية، مما يؤدي إلى حدوث تفاعل التفاعل في هم. وبالتالي، تحدث عملية الاحتراق، وهي سبب ونتيجة التفاعل. آلية تفاعلات SHS معقدة للغاية وتتضمن العمليات انتشار رد الفعل.يحدد مصطلح "الانتشار التفاعلي" مجموعة من الظواهر التي تحدث أثناء تفاعل مكونين مختلفين كيميائيا قادرين على تكوين مركبات كيميائية على شكل أطوار صلبة. تشكل منتجات التفاعل الكيميائي طبقة مستمرة تختلف في هيكلها عن المكونات الأصلية، ولكنها لا تتداخل مع المزيد من التفاعل.
2.5. نظرية الاصطدامات النشطة. طاقة التفعيل. اعتماد معدل التفاعل على طبيعة المواد المتفاعلة ودرجة الحرارة
لكي يحدث تفاعل كيميائي أولي، يجب أن تتصادم الجزيئات المتفاعلة مع بعضها البعض. ومع ذلك، ليس كل تصادم يؤدي إلى تفاعل كيميائي. ويحدث الأخير عندما تقترب الجسيمات من مسافات يمكن عندها إعادة توزيع كثافة الإلكترون وظهور روابط كيميائية جديدة. يجب أن تمتلك الجسيمات المتفاعلة طاقة كافية للتغلب على القوى التنافرية التي تنشأ بين أغلفة الإلكترونات الخاصة بها.
الدولة الانتقالية- حالة النظام التي يتوازن فيها تدمير وإنشاء الاتصالات. في حالة انتقالية النظام
يقع لمدة قصيرة (10 -15 ثانية). تسمى الطاقة التي يجب إنفاقها لإدخال النظام إلى حالة انتقالية طاقة التفعيل.في التفاعلات متعددة الخطوات التي تتضمن عدة حالات انتقالية، تتوافق طاقة التنشيط مع أعلى قيمة للطاقة. وبعد التغلب على الحالة الانتقالية، تتناثر الجزيئات مرة أخرى مع تدمير الروابط القديمة وتكوين روابط جديدة أو مع تحول الروابط الأصلية. كلا الخيارين ممكنان، حيث يحدثان مع إطلاق الطاقة. هناك مواد يمكنها تقليل طاقة التنشيط لتفاعل معين.
تتحد الجزيئات النشطة A 2 و B 2 عند الاصطدام في مركب نشط وسيط A 2 ... B 2 مع إضعاف ثم كسر الروابط A-A و B-B وتقوية الروابط AB.

"طاقة التنشيط" للتفاعل لتكوين HI (168 كيلوجول/مول) أقل بكثير من الطاقة اللازمة لكسر الرابطة بالكامل في الجزيئات الأولية H 2 وI 2 (571 كيلو جول/مول). لذلك، مسار رد الفعل من خلال التشكيل مجمع نشط (منشط).أكثر ملاءمة بقوة من المسار من خلال التمزق الكامل للروابط في الجزيئات الأصلية. تحدث الغالبية العظمى من التفاعلات من خلال تكوين مجمعات نشطة وسيطة. تم تطوير مبادئ نظرية المجمع النشط بواسطة G. Eyring و M. Polyani في الثلاثينيات من القرن العشرين.
طاقة التفعيليمثل الطاقة الحركية الزائدة للجزيئات نسبة إلى متوسط الطاقة اللازمة للتحول الكيميائي للجزيئات المتصادمة. تتميز التفاعلات باختلاف طاقات التنشيط (Ea). في معظم الحالات، تتراوح طاقة تنشيط التفاعلات الكيميائية بين الجزيئات المحايدة من 80 إلى 240 كيلوجول/مول. بالنسبة للعمليات البيوكيميائية، غالبًا ما تكون قيم E a أقل - حتى 20 كيلوجول/مول. ويفسر ذلك حقيقة أن الغالبية العظمى من العمليات الكيميائية الحيوية تمر عبر مرحلة مجمعات الإنزيم والركيزة. حواجز الطاقة تحد من التفاعل. ونتيجة لهذا، من حيث المبدأ، ردود الفعل المحتملة (مع ز<0) практически всегда не протекают
أو تبطئ. التفاعلات ذات طاقات التنشيط التي تزيد عن 120 كيلوجول/مول تكون بطيئة جدًا بحيث يصعب ملاحظة حدوثها.
لكي يحدث التفاعل، يجب أن تكون الجزيئات موجهة بطريقة معينة وأن تتمتع بطاقة كافية عند تصادمها. يتميز احتمال الاتجاه الصحيح للاصطدام بـ إنتروبيا التنشيطΔ س أ.يتم تفضيل إعادة توزيع كثافة الإلكترون في المركب النشط من خلال الحالة التي يتم فيها توجيه الجزيئات A 2 و B 2 عند الاصطدام، كما هو موضح في الشكل. 2.2، أ، بينما مع الاتجاه الموضح في الشكل. 2.2، ب، احتمال التفاعل أقل بكثير - في الشكل. 2.2، ج.

أرز. 2.2.التوجهات المواتية (أ) وغير المواتية (ب، ج) لجزيئات A2
و B2 في حادث تصادم
المعادلة التي تميز اعتماد المعدل والتفاعل على درجة الحرارة وطاقة التنشيط وانتروبيا التنشيط لها الشكل:
أين ك- معدل التفاعل ثابت؛ A، كتقريب أولي، هو إجمالي عدد التصادمات بين الجزيئات لكل وحدة زمنية (ثانية) لكل وحدة حجم؛ e هو أساس اللوغاريتمات الطبيعية. ر- ثابت الغاز العالمي؛ ت- درجة الحرارة المطلقة؛ ه أ- طاقة التفعيل؛ Δ س أ- التغير في إنتروبيا التنشيط.
تم اشتقاق المعادلة (2.8) من قبل أرينيوس في عام 1889. يتناسب العامل الأسي A مع إجمالي عدد التصادمات بين الجزيئات لكل وحدة زمنية. يتطابق بعده مع بعد ثابت المعدل، وبالتالي يعتمد على الترتيب الكلي للتفاعل. الأس يساوي نسبة الاصطدامات النشطة من إجمالي عددها، أي. يجب أن يكون لدى الجزيئات المتصادمة ما يكفي
طاقة التفاعل الدقيقة يتناسب احتمال اتجاهها المرغوب في لحظة التأثير مع e ΔSa/R
عند مناقشة قانون فعل الكتلة للسرعة (2.6)، ذكر على وجه التحديد أن ثابت المعدل هو قيمة ثابتة لا تعتمد على تراكيز المواد المتفاعلة. كان من المفترض أن جميع التحولات الكيميائية تحدث عند درجة حرارة ثابتة. وفي الوقت نفسه، من المعروف أن معدل التحول الكيميائي يمكن أن يتغير بشكل كبير مع انخفاض أو ارتفاع درجة الحرارة. من وجهة نظر قانون عمل الكتلة، فإن هذا التغير في السرعة يرجع إلى اعتماد ثابت المعدل على درجة الحرارة، حيث أن تركيزات المواد المتفاعلة تتغير قليلاً فقط بسبب التمدد الحراري أو ضغط السائل.
الحقيقة الأكثر شهرة هي أن معدل التفاعلات يزداد مع زيادة درجة الحرارة. يسمى هذا النوع من الاعتماد على درجة الحرارة للسرعة عاديًا (الشكل 2.3 ، أ). هذا النوع من الاعتماد هو سمة من سمات جميع ردود الفعل البسيطة.

أرز. 2.3.أنواع الاعتماد على درجة الحرارة لمعدل التفاعلات الكيميائية: أ - طبيعي؛ ب - غير طبيعي. ج - الأنزيمية
إلا أن التحولات الكيميائية أصبحت الآن معروفة جيدا، والتي يتناقص معدلها مع زيادة درجة الحرارة. ومن الأمثلة على ذلك تفاعل الطور الغازي لأكسيد النيتروجين (II) مع البروم (الشكل 2.3، ب). ويسمى هذا النوع من الاعتماد على درجة الحرارة للسرعة الشاذة.
ومما يثير اهتمام الأطباء بشكل خاص اعتماد درجة الحرارة على معدل التفاعلات الأنزيمية، أي درجة الحرارة. ردود الفعل التي تنطوي على الانزيمات. تنتمي جميع ردود الفعل التي تحدث في الجسم تقريبًا إلى هذه الفئة. على سبيل المثال، أثناء تحلل بيروكسيد الهيدروجين في وجود إنزيم الكاتلاز، يعتمد معدل التحلل على درجة الحرارة. في حدود 273-320 درجة مئوية، يكون الاعتماد على درجة الحرارة أمرًا طبيعيًا. كلما زادت درجة الحرارة زادت السرعة، وكلما انخفضت درجة الحرارة انخفضت. عندما ترتفع درجة الحرارة فوق
عند 320 درجة كلفن، لوحظ انخفاض حاد غير طبيعي في معدل تحلل البيروكسيد. تحدث صورة مماثلة للتفاعلات الأنزيمية الأخرى (الشكل 2.3، ج).
من معادلة أرهينيوس ل كومن الواضح أنه منذ ذلك الحين تالمدرجة في الأس، ومعدل التفاعل الكيميائي حساس للغاية للتغيرات في درجات الحرارة. يمكن التعبير عن اعتماد معدل التفاعل المتجانس على درجة الحرارة من خلال قاعدة فانت هوف، والتي بموجبها مع كل 10 درجات زيادة في درجة الحرارة، يزيد معدل التفاعل بمقدار 2-4 مرات؛يُسمى رقم يوضح عدد المرات التي يزداد فيها معدل تفاعل معين مع زيادة درجة الحرارة بمقدار 10 درجات معامل درجة حرارة معدل التفاعل- γ.
أين ك- معدل ثابت عند درجة الحرارة ردرجة مئوية. بمعرفة قيمة γ، من الممكن حساب التغير في معدل التفاعل عند تغير درجة الحرارة من تي 1قبل تي 2وفقا للصيغة:
كلما زادت درجة الحرارة في متوالية حسابية، زادت السرعة في متوالية هندسية.
على سبيل المثال، إذا كانت γ = 2.9، فمع زيادة درجة الحرارة بمقدار 100 درجة، يزداد معدل التفاعل بمقدار 2.9 10 مرات، أي. 40 ألف مرة. الانحرافات عن هذه القاعدة هي تفاعلات كيميائية حيوية تزيد سرعتها عشرات المرات مع زيادة طفيفة في درجة الحرارة. هذه القاعدة صالحة فقط لتقريب تقريبي. تتميز التفاعلات التي تتضمن جزيئات كبيرة (بروتينات) بمعامل درجة حرارة كبير. يزيد معدل تمسخ البروتين (ألبومين البيض) 50 مرة مع زيادة درجة الحرارة بمقدار 10 درجات مئوية. بعد الوصول إلى حد أقصى معين (50-60 درجة مئوية)، ينخفض معدل التفاعل بشكل حاد نتيجة تمسخ البروتين الحراري.
بالنسبة للعديد من التفاعلات الكيميائية، فإن قانون فعل الكتلة للسرعة غير معروف. في مثل هذه الحالات، يمكن استخدام التعبير لوصف اعتماد معدل التحويل على درجة الحرارة:
الأس المسبق ومعلا يعتمد على درجة الحرارة، بل يعتمد على التركيز. وحدة القياس هي مول/لتر ث.
يسمح الاعتماد النظري بحساب السرعة مسبقًا عند أي درجة حرارة إذا كانت طاقة التنشيط والأسي المسبق معروفة. وبالتالي، يتم التنبؤ بتأثير درجة الحرارة على معدل التحول الكيميائي.
2.6. ردود فعل عكسية ولا رجعة فيها. حالة التوازن الكيميائي. معادلة رد الفعل المتساوية
لا يصل التفاعل الكيميائي دائمًا إلى مرحلة الاكتمال؛ بمعنى آخر، لا يتم دائمًا تحويل المواد الأولية بشكل كامل إلى منتجات التفاعل. ويحدث هذا لأنه مع تراكم منتجات التفاعل، قد يتم تهيئة الظروف لبدء التفاعل في الاتجاه المعاكس. في الواقع، على سبيل المثال، إذا قمت بخلط بخار اليود مع الهيدروجين عند درجة حرارة ~ 200 درجة مئوية، فسيحدث التفاعل: H 2 + I 2 = 2HI. ومع ذلك، فمن المعروف أن يوديد الهيدروجين، حتى عند تسخينه إلى 180 درجة مئوية، يبدأ في التحلل إلى اليود والهيدروجين: 2HI = H 2 + I 2.
تسمى التفاعلات الكيميائية التي يمكن أن تحدث في اتجاهين متعاكسين تحت نفس الظروف تفريغ.عند كتابة معادلات التفاعلات العكسية، بدلاً من علامة التساوي، يتم استخدام سهمين موجهين بشكل معاكس. يسمى التفاعل الذي يحدث من اليسار إلى اليمين مستقيم(ثابت معدل التفاعل الأمامي ك 1)،من اليمين إلى اليسار - يعكس(ثابت معدل رد الفعل الخلفي ك2).
في التفاعلات العكسية، يكون لمعدل التفاعل المباشر في البداية قيمة قصوى، ثم يتناقص بسبب انخفاض تركيز المواد الأولية. وعلى العكس من ذلك، فإن التفاعل العكسي في اللحظة الأولية له سرعة دنيا، والتي تزداد مع زيادة تركيز منتجات التفاعل. وأخيرًا، تأتي لحظة تصبح فيها معدلات التفاعلات الأمامية والعكسية متساوية. تسمى الحالة التي يصبح فيها معدل التفاعل العكسي مساوياً لمعدل التفاعل الأمامي التوازن الكيميائي.
يتم تحديد حالة التوازن الكيميائي للعمليات القابلة للعكس من الناحية الكمية توازن ثابت.وفي لحظة الوصول إلى حالة التوازن الكيميائي تكون معدلات التفاعلات الأمامية والعكسية متساوية (الحالة الحركية).
حيث ك - توازن ثابت،وهي نسبة ثوابت معدل التفاعلات الأمامية والعكسية.
على الجانب الأيمن من المعادلة توجد تركيزات المواد المتفاعلة التي تم تحديدها عند التوازن - تركيزات التوازنهذه المعادلة هي تعبير رياضي لقانون فعل الكتلة في التوازن الكيميائي. تجدر الإشارة بشكل خاص إلى أنه على النقيض من قانون عمل الكتلة لمعدل التفاعل في هذه المعادلة، فإن الأسس أ، ب، د، و وإلخ. تكون دائمًا مساوية للمعاملات المتكافئة في تفاعل التوازن.
تحدد القيمة العددية لثابت التوازن لتفاعل معين ناتجه. مخرجات التفاعليسمون نسبة كمية المنتج التي تم الحصول عليها بالفعل إلى الكمية التي كان من الممكن الحصول عليها إذا استمر التفاعل حتى الاكتمال (يتم التعبير عنه عادةً كنسبة مئوية). وبالتالي، عند K >>1 يكون ناتج التفاعل مرتفعًا، وعلى العكس من ذلك، عند K<<1 выход реакции очень мал.
ويرتبط ثابت التوازن طاقة جيبس القياسيةردود الفعل مع النسبة التالية:
وباستخدام المعادلة (2.12) يمكننا إيجاد قيمة طاقة جيبس للتفاعل من خلال تراكيز التوازن:

تسمى هذه المعادلة معادلة التفاعل الكيميائي.يسمح لك بحساب التغير في طاقة جيبس أثناء العملية وتحديد اتجاه التفاعل:
عند ΔG<0 - реакция идет в прямом направлении, слева направо;
في ΔG = 0 - وصل التفاعل إلى التوازن (الحالة الديناميكية الحرارية)؛
عندما ΔG >0 - يستمر التفاعل في الاتجاه المعاكس.
من المهم أن نفهم أن ثابت التوازن لا يعتمد على تركيزات المواد. العبارة المعاكسة صحيحة: في حالة التوازن، تأخذ التركيزات نفسها قيمًا بحيث تكون نسبة منتجاتها في قوى المعاملات المتكافئة
تبين أنها قيمة ثابتة عند درجة حرارة معينة. يتوافق هذا البيان مع قانون العمل الجماعي ويمكن حتى استخدامه كأحد صيغه.
كما ذكر أعلاه، لا تستمر التفاعلات العكسية حتى الاكتمال. ومع ذلك، إذا غادر أحد منتجات التفاعل الانعكاسي مجال التفاعل، فإن العملية الانعكاسية الأساسية تستمر تقريبًا حتى الاكتمال. إذا كانت الإلكتروليتات متورطة في تفاعل عكسي وكان أحد منتجات هذا التفاعل عبارة عن إلكتروليت ضعيف أو راسب أو غاز، ففي هذه الحالة يستمر التفاعل أيضًا حتى الاكتمال تقريبًا. ردود فعل لا رجعة فيهاوهي تفاعلات لا تتفاعل منتجاتها مع بعضها البعض لتكوين المواد الأولية. ردود الفعل التي لا رجعة فيها، كقاعدة عامة، "تصل إلى النهاية"، أي. حتى يتم استهلاك مادة واحدة على الأقل من المواد الأولية بالكامل.
2.7. مبدأ لو شاتيليه
يمكن نظريًا الحفاظ على حالة التوازن الكيميائي في ظل ظروف خارجية ثابتة إلى أجل غير مسمى. في الواقع، عندما تتغير درجة الحرارة أو الضغط أو تركيز الكواشف، يمكن أن "ينحرف" التوازن إلى جانب أو آخر من العملية.
يتم تحديد التغييرات التي تحدث في النظام نتيجة للمؤثرات الخارجية من خلال مبدأ تحريك التوازن - مبدأ لو شاتيليه.
إن التأثير الخارجي على النظام الذي يكون في حالة توازن يؤدي إلى تحول هذا التوازن في اتجاه يضعف فيه تأثير التأثير.
فيما يتعلق بالأنواع الثلاثة الرئيسية للتأثير الخارجي - التغيرات في التركيز والضغط ودرجة الحرارة - يتم تفسير مبدأ لو شاتيليه على النحو التالي.
عندما يزداد تركيز أحد المواد المتفاعلة ينتقل التوازن نحو استهلاك هذه المادة، وعندما يقل التركيز يتحول التوازن نحو تكوين هذه المادة.
إن تأثير الضغط يشبه إلى حد كبير تأثير تغيير تراكيز المواد المتفاعلة، ولكنه يؤثر فقط على الأنظمة الغازية. دعونا نصيغ بيانًا عامًا حول تأثير الضغط على التوازن الكيميائي.
مع زيادة الضغط، يتحول التوازن نحو تناقص كميات المواد الغازية، أي. في اتجاه انخفاض الضغط. ومع انخفاض الضغط، يتحول التوازن نحو الزيادة
كميات المواد الغازية، أي. نحو زيادة الضغط. إذا استمر التفاعل دون تغيير عدد جزيئات المواد الغازية، فإن الضغط لا يؤثر على موضع التوازن في هذا النظام.
عند تغير درجة الحرارة تتغير التفاعلات الأمامية والعكسية ولكن بدرجات متفاوتة. ولذلك، لتوضيح تأثير درجة الحرارة على التوازن الكيميائي، لا بد من معرفة علامة التأثير الحراري للتفاعل.
مع زيادة درجة الحرارة، ينتقل التوازن نحو التفاعل الماص للحرارة، ومع انخفاض درجة الحرارة، نحو التفاعل الطارد للحرارة.
فيما يتعلق بالنظم الحيوية، ينص مبدأ لو شاتيليه على أنه في النظام الحيوي، لكل فعل، يتم تشكيل رد فعل من نفس القوة والطبيعة، والذي يوازن بين العمليات التنظيمية البيولوجية وردود الفعل ويشكل مستوى مترافق من اختلال توازنها.
في العمليات المرضية، يتم تعطيل الإغلاق الحالي للدائرة التنظيمية. اعتمادًا على مستوى عدم التوازن، تتغير جودة العلاقات بين الأنظمة وبين الأعضاء، وتصبح غير خطية بشكل متزايد. يتم تأكيد بنية وخصوصية هذه العلاقات من خلال تحليل العلاقة بين مؤشرات نظام بيروكسيد الدهون ومستوى مضادات الأكسدة، بين المؤشرات التوافقية في ظروف التكيف وعلم الأمراض. وتشارك هذه الأنظمة في الحفاظ على التوازن المضاد للأكسدة.
2.8. أسئلة ومهام للتحضير للفحص الذاتي للفصول والامتحانات
1. ما هي التفاعلات التي تسمى متجانسة وأيها غير متجانسة؟ أعط مثالا واحدا لكل نوع من ردود الفعل.
2. ما هي التفاعلات التي تسمى بسيطة وأيها معقدة؟ أعط مثالين لكل من ردود الفعل البسيطة والمعقدة.
3. في أي حالة يمكن أن تتطابق جزيئية وترتيب المعادلة الحركية عدديا؟
4. سرعة تفاعل معين لا تتغير مع مرور الوقت. هل سيتغير عمر النصف لهذا التفاعل بمرور الوقت، وإذا كان الأمر كذلك، فكيف؟ إعطاء تفسيرا.
5. في أي حالة يمكن أن تتطابق السرعة الحقيقية (اللحظية) مع متوسط سرعة التفاعل (في فترة زمنية كبيرة بما فيه الكفاية)؟
6. احسب ثابت معدل التفاعل A + B → AB، إذا كان تركيز المادتين A و B يساوي 0.5 و 0.1 مول/لتر على التوالي، فإن معدله يكون 0.005 مول/لتر دقيقة.
7. عمر النصف لتفاعل معين من الدرجة الأولى هو 30 دقيقة. ما جزء الكمية الأولية للمادة التي ستبقى بعد ساعة؟
8. إعطاء مفهوم ترتيب التفاعل العام وترتيب التفاعل حسب المادة.
9. طرق تحديد معدل التفاعل.
10. القانون الأساسي للحركية الكيميائية.
11. إعطاء مفهوم آلية التفاعلات الكيميائية.
12. ردود الفعل البسيطة والمعقدة.
13. ردود الفعل المترافقة. ما هي العوامل التي يعتمد عليها ثابت معدل التفاعلات الكيميائية؟
14. هل يتناسب معدل التفاعل حقًا مع حاصل ضرب تراكيز المواد المتفاعلة مع قوة معاملاتها المتكافئة؟
15. ما هي البيانات التجريبية المطلوبة لتحديد ترتيب التفاعلات؟
16. اكتب المعادلة الحركية للتفاعل H 2 O 2 + 2HI → I 2 + + 2H 2 O إذا تم خلط حجوم متساوية من محلول 0.02 mol/L H 2 O 2 ومحلول 0.05 mol/L HI. معدل ثابت 0.05 لتر / مول ثانية.
17. اكتب المعادلة الحركية للتفاعل H 2 O 2 + 2HI → I 2 + + 2H 2 O مع مراعاة أنه يتميز بتفاعل من الدرجة الأولى في تراكيز المادتين البادئتين.
18.اثبات أن معدل التفاعل الكيميائي يصل إلى الحد الأقصى عند نسبة العناصر المتكافئة.
19. يذكر التفسيرات المحتملة لتأثير درجة الحرارة على سرعة التفاعل.
2.9. مهام الاختبار
1. حسب قاعدة فانت هوف، عندما تزيد درجة الحرارة بمقدار 10 درجات، فإن معدل العديد من التفاعلات:
أ) ينخفض بمقدار 2-4 مرات؛
ب) ينخفض بمقدار 5-10 مرات؛
ج) يزيد 2-4 مرات؛
د) يزيد 5-10 مرات.
2. يحدد عدد أفعال التفاعل الأولية لكل وحدة زمنية:
أ) ترتيب رد الفعل؛
ب) سرعة رد الفعل.
ج) جزيئية التفاعل.
د) نصف العمر.
3. ما هي العوامل التي تؤثر على زيادة معدل التفاعل؟
أ) طبيعة المواد المتفاعلة.
ب) درجة الحرارة والتركيز والمحفز؛
ج) المحفز الوحيد؛
د) التركيز فقط؛
ه) درجة الحرارة فقط.
4. كم مرة سيزداد معدل التفاعل 2A(g) + B(g)؟→أ2 ب(ز) عندما يتضاعف تركيز المادة أ؟
أ) لن تتغير السرعة؛
ب) سيزيد 18 مرة؛
ج) سيزيد 8 مرات؛
د) سيزيد 4 مرات؛
د) سيزيد بمقدار 2 مرات.
5. التفاعل الأولي A(s) + 2B(g)→أ ب 2 (د). حدد المعادلة الحركية الصحيحة لهذا التفاعل:
أ)ك[أ] [ب] 2 ؛
ب)ك[أ] [ب]؛
ج)ك[ب]؛
د)ك[ب] 2؛
د) ك [أ].
6. كيفية تغيير الضغط في النظام لزيادة معدل التفاعل A(s) + 2B(g)→أ ب2 (د) 9 مرات؟
أ) زيادة الضغط 9 مرات؛
ب) تقليل الضغط بمقدار 9 مرات؛
ج) زيادة الضغط 3 مرات؛
د) خفض الضغط بمقدار 3 مرات.
7. ما هو معامل درجة الحرارة للتفاعل؟γ 10 , إذا تم تبريد خليط التفاعل بمقدار 30 درجة، فإن معدل التفاعل ينخفض 8 مرات؟
أ)16؛
ب)8؛
في 6؛
د) 4؛
د 2.
8. أي رد فعل هو أسرع؟
أ) الفعل ه= 40 كيلوجول/مول؛
ب) الفعل E = 80 كيلوجول/مول؛
الخامس) الفعل E = 160 كيلوجول/مول؛
ز) الفعل E = 200 كيلوجول/مول.
حركية التفاعلات الكيميائية هي دراسة العمليات الكيميائية وقوانين حدوثها في الزمن والسرعات والآليات. ترتبط أهم مجالات الكيمياء الحديثة والصناعة الكيميائية بدراسات حركية التفاعلات الكيميائية: تطوير المبادئ العقلانية للتحكم في العمليات الكيميائية؛ تحفيز التفاعلات الكيميائية المفيدة وتثبيطها وقمعها ؛ إنشاء عمليات جديدة وتحسين العمليات والأجهزة الموجودة في مجال التكنولوجيا الكيميائية؛ دراسة سلوك المنتجات الكيميائية والمواد والمنتجات المصنوعة منها في ظل ظروف الاستخدام والتشغيل المختلفة.
نظرًا لتعقيد الأنظمة الكيميائية الحقيقية والحاجة إلى مراعاة عدد كبير من العوامل وظروف العملية عند تحديد الأوضاع المثلى للحصول على المنتجات المطلوبة في الهندسة الكيميائية الحديثة. تستخدم أجهزة الكمبيوتر الإلكترونية عالية السرعة على نطاق واسع.
المفاهيم الأساسية للحركية الكيميائية
نظام-مجموعة من المواد المتفاعلة، المعزولة عقليًا (أو فعليًا) عن البيئة.
مرحلة-وهو جزء من النظام، متجانس في جميع نقاطه من حيث التركيب والخصائص، ويفصل عن الأجزاء الأخرى من النظام واجهة، ويمكن أن تكون المادة في ثلاث مراحل: السائلة والصلبة والغازية.
اعتمادا على عدد المراحل كلها الأنظمة وردود الفعل فيهامقسمة على متجانس و غير متجانسة .
متجانستحدث التفاعلات في مرحلة واحدة (عادة غازية). فمثلاً التفاعل بين الكلور والهيدروجين يؤدي إلى تكوين كلوريد الهيدروجين (نظام أحادي الطور): Cl 2 + ح 2 =2 حمض الهيدروكلوريك
غير متجانسةتحدث ردود الفعل في الواجهة. تتضمن أمثلة التفاعل غير المتجانس تفاعل الاحتراق الذي يحدث عند واجهة الفحم والأكسجين (نظام يتكون من مرحلتين): ج + س 2 =CO 2 : عند درجة حرارة 0 درجة مئوية، يشكل الجليد والماء والبخار الذي يعلوهما نظامًا غير متجانس من ثلاث مراحل: الصلبة - الجليد، والسائلة - الماء، والغازية - بخار الماء.
جزيئية التفاعليتم تحديده من خلال عدد الجزيئات المشاركة في المرحلة الأبطأ والمحددة. ردود الفعل يمكن أن تكون أحادية، ثنائية، ثلاثية، الخ. جزيئي. أحادي الجزيء هو تفاعل تكون فيه المرحلة المحددة هي تحول جزيء واحد، على سبيل المثال، تفككه إلى مكونات (تفكك جزيئات اليود أنا 2 = 2أنا) أو التحول إلى جزيء آخر نتيجة لإعادة الترتيب داخل الجزيئات:

ثنائي الجزيء التفاعل هو تفاعل جزيئين (على سبيل المثال، الهيدروجين الجزيئي مع اليود الجزيئي، ح 2 +أنا 2 = 2HI). يسمى التفاعل الذي يحدث في وقت واحد بمشاركة ثلاثة جزيئات ثلاثي الجزيئات . وبما أن احتمال تصادم ثلاثة جزيئات في وقت واحد، خاصة في الاتجاه المتبادل الصحيح، صغير جدًا، فإن مثل هذه التفاعلات نادرًا ما تحدث.
ترتيب رد الفعل.ترتيب التفاعل هو كمية تجريبية تساوي مجموع الأسس التي تدخل بها تركيزات المواد المتفاعلة في التعبير الخاص بمعدل التفاعل. نعم لرد الفعل
أ أ +ب ب=م م+ن ن
ترتيب التفاعل في هذه الحالة يساوي أ + ب .
ردود الفعل من الدرجة الأولى - وهي تفاعلات يعتمد معدلها على تركيز مادة متفاعلة واحدة فقط للقوة الأولى. تتبع العديد من التفاعلات الكيميائية معادلة من الدرجة الأولى. على سبيل المثال، مع 2 ن 5 أوه = ج 2 ن 4 + ن 2 عن
ردود الفعل من الدرجة الثانية – هو تفاعل يتناسب فيه المعدل مع مربع تركيز المادة المتفاعلة الفردية أو تركيز كل من المتفاعلين مع القوة الأولى. على سبيل المثال: 1) 2НVص= ن 2 + بص 2 أو 2) الفصل 3 ر + كوه = الفصل 3 أوه + KBr
ردود الفعل من الدرجة الثالثة هو تفاعل قد يعتمد معدله على تركيز أحد المتفاعلات أس الثالثة، أو تركيز أحد المتفاعلات أس الثاني ومتفاعل ثان أس الأول، أو تركيز كل من المواد المتفاعلة الثلاثة إلى القوة الأولى القوة الأولى.
تظهر دراسات حركية التفاعلات المختلفة أن التفاعلات الأكثر شيوعًا هي من الدرجة الأولى والثانية وأحيانًا الثالثة. ولكن هناك ردود أفعال لأوامر أخرى.
ردود فعل النظام صفر - هذا تفاعل يكون فيه المعدل مستقلاً عن تركيزات المواد المتفاعلة ويتم تحديده بواسطة عوامل محددة أخرى، مثل مساحة سطح المحفز (في تفاعلات الحفز غير المتجانسة) أو امتصاص الضوء (في التفاعلات الكيميائية الضوئية).
كقاعدة عامة، بالنسبة لمعظم التفاعلات البسيطة، يكون ترتيب التفاعل وجزيئيته متماثلين ويتم تحديدهما بالطرق الموضحة أعلاه. لكن بالنسبة للتفاعلات التي تحدث على عدة مراحل، يتم تحديد ترتيب التفاعل تجريبيا أو بناء على حسابات رياضية معقدة.
المفهوم الرئيسي في الحركية الكيميائية هو مفهوم سرعة رد الفعل.
تحدث بعض التفاعلات على الفور تقريبًا (على سبيل المثال، تحييد حمض مع قاعدة)، بينما تتم تفاعلات أخرى ببطء شديد في الظروف العادية بحيث لا يتم ملاحظة تغيرات ملحوظة في تركيزات الكواشف إلا بعد عدة سنوات (على سبيل المثال، تفاعل الهيدروجين مع الأكسجين) لتكوين الماء في غياب المحفز). علاوة على ذلك، هناك العديد من التفاعلات التي تحدث بمعدلات قابلة للقياس تمامًا في ظل الظروف العادية. تهتم الحركية الكيميائية بتحديد معدلات التفاعلات الكيميائية ودراسة آليتها.
معدل التفاعل الكيميائي
معدل التفاعل الكيميائي يتم تحديده من خلال كمية المادة التي تفاعلت لكل وحدة زمنية (دخلت في التفاعل أو تشكلت نتيجة للتفاعل) لكل وحدة حجم النظام (للحل المتجانس) أو لكل وحدة مساحة لواجهة الطور (لل رد فعل غير متجانس).
ج(التركيز)
أين 1 - التغير في تركيز المادة الأولية. 2 - التغير في تركيز منتج التفاعل
يترتب على هذا الرسم البياني أنه أثناء التفاعل الكيميائي، يتناقص تركيز كل مادة من المواد الأولية بمرور الوقت (C 2  ج > 0).
ج > 0).
في الحركية الكيميائية هناك متوسطو حقيقي(سرعة لحظية.
متوسط السرعة.
إذا انخفض تركيز أحد المواد المتفاعلة، عند حجم ودرجة حرارة ثابتين، من C 1 إلى C 2 خلال فترة زمنية من t 1 إلى t 2، فوفقًا للتعريف، فإن متوسط معدل التفاعل المباشر لـ فترة زمنية معينة تساوي:
=
- 
تظهر علامة "-" على الجانب الأيمن من المعادلة لأنه مع تقدم التفاعل (t 2 -t 1 > 0)، يقل تركيز الكواشف، وبالتالي C 2 -C 1 < وبما أن معدل التفاعل دائمًا إيجابي، فيجب عليك وضع علامة "-" أمام الكسر.
إذا كنا نتحدث عن سرعة ردود الفعل الأمامية والخلفية، فإن هذه الصيغة تبدو كما يلي:
= 

السرعة الحقيقية.
يتم تحديد المعدل الحقيقي للتفاعل من خلال الحد الذي تميل إليه النسبة  مع/
مع/  ر في
ر في
 ر
0
، أي مشتق التركيز بالنسبة للوقت:
ر
0
، أي مشتق التركيز بالنسبة للوقت:
= 
عادةً، بالنسبة للتفاعلات التي تحدث في الغازات أو المحاليل، يتم التعبير عن تركيزات المواد المتفاعلة بالمول/لتر، و معدل التفاعل - بالمول/(لتر*ث).
تحدث التفاعلات عندما تصطدم جزيئات المواد المتفاعلة. يتم تحديد سرعتها من خلال عدد الاصطدامات واحتمالية أن تؤدي إلى التحول. يتم تحديد عدد التصادمات من خلال تركيزات المواد المتفاعلة، ويتم تحديد احتمال التفاعل من خلال طاقة الجزيئات المتصادمة.
حركية الكيميائية -هذا فرع من فروع الكيمياء يدرس معدلات التفاعلات وتأثير العوامل المختلفة عليها.
في عملية متجانسة (أحادية الطور)، يحدث التفاعل في كامل حجم النظام ويتميز معدله بالتغير في تركيز أي كاشف أو أي منتج لكل وحدة زمنية. التمييز بين السرعة المتوسطة الخامسсп = ±ΔС/Δt، حيث ΔC هو التغير في التركيز المولي خلال فترة زمنية Δt، والسرعة الحقيقية عند الزمن t، وهي مشتقة التركيز مع مرور الوقت: الخامس= ±dС/dt.
يعتمد معدل كل تفاعل محدد في غياب المحفز على تركيزات الكواشف وعلى درجة الحرارة . ويعتمد معدل التفاعلات غير المتجانسة التي تحدث في الواجهة أيضًا على حجم هذا السطح.
يتم تحديد تأثير تركيزات الكاشف على معدل التفاعل من خلال قانون الكتل الفعالة: عند درجة حرارة ثابتة، يتناسب معدل التفاعل مع حاصل ضرب تراكيز المواد المتفاعلة في قوى تساوي المعاملات المتكافئة.
بالنسبة للتفاعل aA + bB = cC + dD، يسمى التعبير الرياضي لقانون عمل الكتلة المعادلة الحركية للتفاعل، هو مكتوب: الخامس= kС A a С B b ، أين ك - معامل التناسب، ويسمى ثابت السرعة،ج أ و ج بهي التركيزات المولية للكواشف، a و b هي معاملاتها المتكافئة. يسمى مجموع الأسس في المعادلة الحركية بترتيب التفاعل. في التفاعلات متعددة المراحل، يمكن أن يكون ترتيب التفاعل كسريًا، ولكن ليس أكثر من 3.
في معادلات التفاعل الحركي تركيزات المواد في حالة مكثفةبسبب ثباتها، لم تتم الإشارة إليها. يتم تضمين هذه التركيزات الثابتة كمكونات في المعدل الثابت.
آلية رد الفعلتسمى مجموعة مراحل التفاعل الكيميائي، ونتيجة لذلك يتم تحويل المواد الأولية إلى مواد نهائية. يمكن أن تكون ردود الفعل على مرحلة واحدة أو متعددة المراحل. يتم تحديد معدل التفاعل بمعدل أبطأ مراحله (المرحلة المحددة).
يميز متجانسو غير متجانسةالتفاعلات الكيميائية. التفاعلات التي تحدث في نظام أحادي الطور (متجانس)، على سبيل المثال، السائل أو الغازي، تسمى متجانس. تحدث مثل هذه التفاعلات في كامل حجم النظام. تسمى التفاعلات التي تحدث في الأنظمة متعددة الأطوار (التي تتكون من مرحلتين أو أكثر، مثل الطور الغازي والطور الصلب) غير متجانسة. تحدث مثل هذه التفاعلات فقط في الواجهة. يتم تحديد معدل التفاعل غير المتجانس من خلال التغير في تركيز المواد المتفاعلة لكل وحدة سطح لكل وحدة زمنية.
جزيئية التفاعلهو عدد الجزيئات المشاركة في التفاعل الكيميائي الأولي. في التفاعلات الحقيقية، يمكن أن تكون الجزيئية مساوية لـ 1، 2، 3. وفي التفاعلات البسيطة التي تحدث في مرحلة واحدة، يتطابق الترتيب مع الجزيئية. قانون العمل الجماعي صالح لردود الفعل البسيطة. في حالة التفاعلات المعقدة التي تحدث في عدة مراحل، ينطبق القانون على أي تفاعل فردي، ولكن ليس على مجموعها.
يتم تفسير اعتماد معدل التفاعل على درجة الحرارة من خلال حقيقة أن معدل التفاعل، كما ذكرنا سابقًا، يعتمد على عدد تصادمات الجزيئات (الذرات والجزيئات والأيونات) المشاركة في التفاعل. ولكن ليس كل الاصطدامات تؤدي إلى تفاعلات كيميائية. لكي يحدث التفاعل، يجب أن تمتلك الجسيمات كمية زائدة معينة من الطاقة (مقارنة بالقيمة المتوسطة)، تسمى طاقة التفعيل(ه أ). كلما ارتفعت درجة الحرارة، زاد عدد الجسيمات التي لها طاقة أكبر من أو تساوي E A. وبالتالي، فإن معدل التفاعل يزداد مع زيادة درجة الحرارة. يتم تحديد ثابت معدل التفاعل الكيميائي من خلال عدد الاصطدامات الفعالة، أي. عدد الجزيئات النشطة القادرة على الدخول في التفاعل الكيميائي. يتم التعبير عن اعتماد ثابت معدل التفاعل على درجة الحرارة وطاقة التنشيط معادلة ارهينيوس :
أين ك- ثابت معدل التفاعل، Z - ثابت، ويسمى العامل الساكن ويعتمد على عدد الاصطدامات المؤدية إلى التفاعل؛ ه - قاعدة اللوغاريتم الطبيعي (ه = 2.7183...)؛ - طاقة التنشيط، J/mol؛ R - ثابت الغاز (R = 8.314 J/K mol)، ت- درجة الحرارة، ك.
يتم تحقيق التوازن الكيميائي في التفاعلات العكسية -في التفاعلات التي يمكن أن تحدث في الاتجاهين الأمامي والخلفي. إذا كان التفاعل aA + bB ↔ cC + dD) قابلاً للعكس، فهذا يعني أن المتفاعلات A وB قادرتان على التحول إلى المنتجات C وD (تفاعل مباشر)، ويمكن للمنتجات C وD بدورها، من خلال التفاعل مع كل منهما أخرى، تشكل مرة أخرى المادتين الأصليتين A وB (تفاعل عكسي).
الشرط الديناميكي الحراري للتوازن الكيميائي هو ثبات طاقة جيبس للتفاعل، أي. ص G = 0، وشرط التوازن الحركي هو تساوي معدلات التفاعلات الأمامية (v 1) والعكسية (v 2): v 1 = v 2.
نظرًا لأنه في حالة التوازن الكيميائي، تتم التفاعلات الأمامية والعكسية بنفس المعدلات، فإن تركيزات المواد المتفاعلة والمنتجات لا تتغير بمرور الوقت. هؤلاء تسمى التركيزات التي لا تتغير بمرور الوقت بالتوازن. عادة ما يتم تحديد تركيزات التوازن، على عكس التركيزات غير المتوازنة التي تتغير أثناء التفاعل، بطريقة خاصة، أي من خلال صيغة المادة الموضوعة بين قوسين مربعين. على سبيل المثال، الإدخالات [H 2 ] تعني أننا نتحدث عن التركيزات المتوازنة للهيدروجين والأمونيا.
عند درجة حرارة معينة، تكون نسبة تركيزات التوازن للمواد المتفاعلة والمنتجات قيمة ثابتة ومميزة لكل تفاعل. تتميز هذه العلاقة كميًا بقيمة ثابت التوازن الكيميائي Kc، الذي يساوي نسبة منتج تراكيز التوازن من المنتجات إلى منتج تراكيز التوازن للمواد المتفاعلة مرفوعة إلى قوى تساوي معاملاتها المتكافئة.
بالنسبة للتفاعل العكسي aA + bB ↔ cC + dD، فإن التعبير عن Kc له الصيغة:
كانساس = . كما هو الحال في معادلات التفاعلات الحركية، في تعبيرات ثوابت التوازن، لا يتم تسجيل تركيزات المواد في الحالة المكثفة، بسبب ثباتها.
بالنسبة للتفاعلات التي تتضمن غازات، يمكن التعبير عن ثابت التوازن الكيميائي ليس فقط من حيث تركيزات التوازن، ولكن أيضًا من حيث الضغوط الجزئية للغازات. في هذه الحالة، يتم فهرسة رمز ثابت التوازن "K" ليس برمز التركيز "c"، ولكن برمز الضغط "p".
يمكن للنظام أن يبقى في حالة توازن، تتميز بتساوي معدلات التفاعلات الأمامية والعكسية، لفترة طويلة بشكل اعتباطي إذا لم تتغير الظروف. عندما تتغير الظروف، تساوي السرعات ضد 1= ضد 2إذا تعطلت، يبدأ أحد التفاعلين في الحدوث بمعدل أسرع. يتم التعبير عن ذلك بالقول أن التحول في التوازن الكيميائي يحدث في النظام.
إذا، نتيجة لتغير الظروف في النظام، بدأ التفاعل المباشر يحدث بمعدل أسرع، أي. ضد 1> ضد 2 ينحرف التوازن نحو التفاعل الأمامي - إلى اليمين، والعكس صحيح، إذا أصبح معدل التفاعل العكسي أكبر من معدل التفاعل الأمامي، أي. تم استيفاء الشرطالخامس 2 > الخامس 1 , هناك تحول في التوازن نحو رد الفعل العكسي - إلى اليسار.
يمكن تحقيق التحول في التوازن الكيميائي عن طريق تغيير تركيزات المواد المتفاعلة أو المنتجات وتغيير درجة الحرارة، وبالنسبة للتفاعلات التي تنطوي على الغازات، يمكن أيضًا تغيير الضغط. يتم تحديد اتجاه تحول التوازن في ظل هذه التغيرات في الظروف من خلال مبدأ لوشاتيلييه (مبدأ الرد المضاد): إذا تغيرت الظروف في نظام التوازن، فإن التوازن سوف يتحول في اتجاه رد الفعل الذي يتعارض مع التغيير الذي حدث.
مهمة 1.في تفاعل كيميائي معين، اكتب معادلة حركية وحدد الترتيب النظري للتفاعل. احسب كيف سيتغير معدل التفاعل مع التغيرات المشار إليها في ظروف التفاعل: Fe 2 O 3 (s) + 3CO(g) → 2Fe(s) + 3CO 2 (g)
كم مرة سيتغير معدل التفاعل (بالزيادة أو النقصان) إذا:
أ) زيادة الضغط مرتين؛
ب) زيادة حجم خليط التفاعل بمقدار مرتين
ج) زيادة درجة الحرارة بمقدار 40 درجة مئوية (γ = 2)
د) خفض درجة الحرارة بمقدار 20 درجة مئوية (γ = 2)
Fe 2 O 3 (s) + 3CO (g) → 2Fe (s) + 3CO 2 (g) - تفاعل غير متجانس (تشارك المواد في حالات الطور المختلفة).
المعادلة الحركية: υ 1 = ك ث 3 (CO)،
ك هو المعدل الثابت. وتشمل المعادلة الحركية للتفاعلات غير المتجانسة فقط تركيزات الغازات أو المواد الذائبة في المذيب.
الترتيب النظري للتفاعل: 3 (يسمى مجموع أسس قوى التركيز في المعادلة الحركية بالترتيب النظري للتفاعل).
حساب التغير في معدل التفاعل:
أ) عندما يتضاعف الضغط:يتم وصف معدل التفاعل قبل زيادة الضغط بالمعادلة الحركية:
υ 1 = k · с 3 (CO)، حيث с 3 (CO) هو التركيز الأولي (الأولي) لأول أكسيد الكربون (II).
ومع زيادة الضغط، يزداد التركيز أيضًا، أي. إذا زاد الضغط مرتين فإن التركيز سيزيد مرتين، وبالتالي فإن المعادلة الحركية للتفاعل بعد تغيير الضغط تكون بالشكل التالي:
υ 2 = k · (2с) 3 (CO)، حيث (2с) 3 (CO) هو تركيز أول أكسيد الكربون (II) بعد زيادة الضغط في النظام بمقدار مرتين.
= = = 2 3 = 8 - سيزيد معدل التفاعل 8 مرات.
ب) مع زيادة حجم خليط التفاعل مرتين:
ستؤدي الزيادة في حجم خليط التفاعل بمقدار مرتين إلى انخفاض تركيز الغاز بمقدار مرتين: υ 1 = k · s 3 (CO)، حيث s 3 (CO) هو التركيز الأولي (الأولي) للكربون أول أكسيد (II).
υ 2 = k (CO)، حيث (CO) هو تركيز أول أكسيد الكربون (II) بعد زيادة حجم خليط التفاعل بمقدار مرتين.
تغيير سرعة رد الفعل ():
= = = - سينخفض معدل التفاعل بمقدار 8 مرات.
الخامس) زيادة درجة الحرارة بمقدار 40 درجة مئوية (γ = 2):
عندما تتغير درجة الحرارة يتغير معدل التفاعل وفقا لقاعدة فانت هوف:
وفقا لظروف المشكلة ارتفعت درجة الحرارة بمقدار 40 درجة مئوية، لذلك
ΔT = T 2 - T 1 = 40،
= 2 40/10 = 2 4 = 16 - سيزيد معدل التفاعل 16 مرة.
ز) انخفاض درجة الحرارة بمقدار 20 درجة مئوية (γ = 2):
عندما تتغير درجة الحرارة يتغير معدل التفاعل وفقا لقاعدة فانت هوف:
= γ ΔT/10، حيث γ هو معامل درجة حرارة التفاعل، ΔТ هو التغير في درجة الحرارة (T 2 - T 1)، υ 1 هو معدل التفاعل عند درجة الحرارة T 1، υ 2 هو معدل التفاعل عند درجة الحرارة T 2.
وفقا لظروف المشكلة انخفضت درجة الحرارة بمقدار 20 درجة مئوية,
ولذلك ΔT = T 1 - T 2 = -20،
= 2 -20/10 = 2 -2 = - سينخفض معدل التفاعل بمقدار 4 مرات.
المهمة 2. 1) للتفاعلات العكسية
CuO(s) + CO(g) ↔ Cu(s) + CO 2 (g) + QN 2 (g) + O 2 (g) ↔ 2NO (g) - Q، حدد الاتجاه الذي سيتحول فيه توازن التفاعل إذا :
أ) زيادة درجة الحرارة. ب) خفض درجة الحرارة
2) للتفاعلات العكسية:
ج 2 ح 2 (جم) + 2 ح 2 (جم) ↔ ج 2 ح 6 (جم)
3S(s) + H 2 O(g) ↔ 2H 2 S(g) + SO 2 (g)
C(tv) + O 2 (g) ↔ CO 2 (g)، حدد الاتجاه الذي سيتحول فيه توازن التفاعل إذا:
أ) زيادة الضغط. ب) خفض الضغط
3) لرد فعل عكسي:
Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g)، حدد الاتجاه الذي سيتحول فيه توازن التفاعل إذا:
أ) زيادة تركيز H 2؛
ب) تقليل تركيز H 2؛
ج) زيادة تركيز H 2 O
د) تقليل تركيز H 2 O
يتم تحديد الاتجاه الذي يتغير فيه التوازن الكيميائي من خلال مبدأ لوشاتيليه: إذا حدث تأثير خارجي على نظام التوازن، فإن التوازن ينتقل إلى الجانب الذي يقاوم هذا التأثير.
1) تؤدي الزيادة في درجة الحرارة إلى إزاحة التوازن نحو تفاعل ماص للحرارة (-Q)، وانخفاض درجة الحرارة يؤدي إلى إزاحة التوازن نحو تفاعل طارد للحرارة (+ Q).
CuO(s) + CO(g) ↔ Cu(s) + CO 2 (g) + Q
في هذه الحالة:
- التفاعل المباشر CuO(s) + CO(g) → Cu(s) + CO 2 (g) + Q - طارد للحرارة ,
- رد فعل عكسي Cu(tv) + CO 2 (g) → CuO(tv) + CO(g) - Q - ماص للحرارة ,
لذلك:
أ) مع زيادة درجة الحرارةسوف يتحول التوازن نحو رد الفعل العكسي (نحو تكوين الكواشف، إلى اليسار (←))،
ب) مع انخفاض درجة الحرارةسوف يتحول التوازن نحو التفاعل المباشر (نحو تكوين المنتجات، إلى اليمين (←)).
N 2 (ز) + O 2 (ز) ↔ 2NO (ز) - س
في هذه الحالة:
التفاعل المباشر N 2 (g) + O 2 (g) → 2NO (g) - Q - ماص للحرارة,
رد فعل عكسي 2NO (ز) → N 2 (ز) + O 2 (ز) + س - طارد للحرارة,
لذلك:
أ) مع زيادة درجة الحرارةسوف يتحول التوازن نحو التفاعل المباشر (نحو تكوين المنتجات، إلى اليمين (→))
ب) مع انخفاض درجة الحرارةسوف يتحول التوازن نحو رد الفعل العكسي (نحو تكوين الكواشف، إلى اليسار (←)).
2)تؤدي زيادة الضغط إلى إزاحة التوازن نحو التفاعل الذي يحدث فيه يتناقص عدد جزيئات الغاز. يؤدي انخفاض الضغط إلى إزاحة التوازن نحو التفاعل الذي يحدث فيه يزداد عدد جزيئات الغاز.
في النظام C 2 H 2 (g) + 2H 2 (g) ↔ C 2 H 6 (g)يحدث التفاعل المباشر (C 2 H 2 (g) + 2H 2 (g) → C 2 H 6 (g)) مع انخفاض في عدد جزيئات الغاز (يتكون جزيء واحد من المنتج النهائي من ثلاثة جزيئات أولية الغازات) والتفاعل العكسي
(C 2 H 6 (g) → C 2 H 2 (g) + 2H 2 (g)) - يحدث بزيادة في عدد الجزيئات (من جزيء واحد من C 2 H 6 يتم تشكيل ثلاثة جزيئات جديدة (جزيء واحد من C 2 H 2 وجزيئين H 2).
لذلك:
أ) زيادة في الضغطيحول التوازن نحو التفاعل المباشر (نحو تكوين المنتجات، إلى اليمين (→))؛
ب) انخفاض في الضغطيزيح التوازن نحو التفاعل العكسي (نحو تكوين الكواشف، إلى اليسار (←)).
في النظام 3S(s) + H 2 O(g) ↔ 2H 2 S(g) + SO 2 (g)التفاعل المباشر (3S(s) + H2O(g) → 2H2S(g) + SO 2 (g)) يحدث مع زيادة في عدد جزيئات الغاز، والتفاعل العكسي (2H2S(g) ) + SO 2 (g) → 3S(s) + H 2 O(g)) - يحدث مع انخفاض في جزيئات الغاز (S(الكبريت) مادة صلبة، ولا يؤخذ عدد جزيئات المواد الصلبة في الاعتبار).
لذلك:
أ) زيادة في الضغطيزيح التوازن نحو التفاعل العكسي (نحو تكوين الكواشف، إلى اليسار (←))؛
ب) انخفاض في الضغطيحول التوازن نحو التفاعل المباشر (نحو تكوين المنتجات، إلى اليمين (←)).
في النظام C(تلفزيون) + O 2 (ز) ↔ CO 2 (ز) عدد جزيئات الغاز بين المواد المتفاعلة وبين المنتجات متساوي (جزيء واحد من O 2 وجزيء واحد من ثاني أكسيد الكربون (ز)) ومن هنا يتغير الضغط (زيادة أو نقصان) لن يؤثرلتغيير التوازن الكيميائي في نظام معين.
أ) زيادة في الضغطلا يغير التوازن.
ب) انخفاض في الضغطلا يغير التوازن.
3) أ) تؤدي الزيادة في تركيز المواد المتفاعلة إلى تحويل التوازن نحو تكوين المنتجات، وبالتالي:
بالنسبة لتفاعل معين Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g)، فإن الزيادة في تركيز الكاشف H 2 ستؤدي إلى تحول في التوازن نحو رد الفعل المباشر (باتجاه تكوين المنتجات، إلى اليمين (← )).
ب) يؤدي انخفاض تركيز الكواشف إلى تحويل التوازن نحو تكوين الكواشف، وبالتالي:
بالنسبة لتفاعل معين Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g)، فإن الزيادة في تركيز الكاشف H 2 ستؤدي إلى تحول في التوازن نحو رد فعل عكسي (باتجاه تكوين الكواشف، إلى اليسار (← )) ؛
الخامس) تؤدي الزيادة في تركيز المنتجات إلى تحويل التوازن نحو تكوين الكواشف، وبالتالي:
بالنسبة لتفاعل معين Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g)، فإن الزيادة في تركيز المنتج H 2 O ستؤدي إلى تحول في التوازن نحو رد الفعل العكسي (باتجاه تكوين الكواشف، إلى اليسار ( ←))؛
ز) يؤدي انخفاض تركيز المنتجات إلى تحويل التوازن نحو تكوين المنتجات، وبالتالي:
بالنسبة لتفاعل معين Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g)، فإن انخفاض تركيز المنتج H 2 O سيؤدي إلى تحول التوازن نحو رد فعل مباشر (نحو تكوين المنتجات، إلى اليمين ( →)).
المهمة 3. 1) بالنسبة للتفاعل العكسي Fe 2 O 3 (s) + 3CO (g) ↔ 2Fe (s) + 3CO 2 (g)، احسب ثابت التوازن، إذا كان التركيز الأولي لـ CO هو 3 مول/لتر، بحلول الوقت يحدث التوازن، ويتفاعل 75% من ثاني أكسيد الكربون.
2) بالنسبة للتفاعل العكسي S(s) + H 2 (g) ↔ H 2 S(g)، احسب تركيزات توازن المواد إذا كان التركيز الأولي لـ H 2 هو 3 مول/لتر وثابت التوازن Kp = 15.
ج) بالنسبة للتفاعل العكسي 2NH 3 (g) ↔ 3H 2 (g) + N 2 (g)، احسب التركيز الأولي لـ NH 3 وثابت التوازن لهذا التفاعل إذا كانت تركيزات التوازن للمواد = 0.4 مول/ ل، = 1.2 مول/لتر، [H 2 ] = 3.6 مول/لتر.
لحل هذه المشاكل، من المناسب استخدام الجدول التالي::
1) يعتمد ثابت التوازن في التفاعلات غير المتجانسة فقط على تركيز الغازات، وبالتالي لا تؤخذ في الاعتبار كميات المواد الصلبة (Fe 2 O 3 (s) و Fe (s)) .
في خط التركيزات الأولية ندخل التركيز الأولي لثاني أكسيد الكربون - 3 مول/لتر. التركيز الأولي لثاني أكسيد الكربون هو صفر (هذا منتج تفاعل لم يتشكل بعد في بداية التفاعل).
وفقًا للشرط، بحلول وقت التوازن، يكون 75% من ثاني أكسيد الكربون قد تفاعل،أولئك. 3 مول 0.75 = 2.25 مول.
نتيجة للتفاعل، تم تشكيل 2.25 مول CO 2، لأن وفقا لمعادلة التفاعلكمية ثاني أكسيد الكربون تساوي كمية ثاني أكسيد الكربون.
بعد التفاعل، ستبقى الكميات التالية من ثاني أكسيد الكربون:
من البداية - من التفاعل = 3 مول - 2.25 مول = 0.75 مول.
وبالتالي فإن تركيزات التوازن ستكون مساوية لـ: = 0.75 مول/لتر = 2.25 مول/لتر
نحسب ثابت التوازن الكيميائي (وفقًا لقانون العمل الجماعي: في حالة التوازن الكيميائي عند درجة حرارة معينة، يتم حساب حاصل ضرب تراكيز منتجات التفاعل في القوى التي تكون أسسها مساوية للمعاملات المقابلة في معادلة التفاعل المتكافئة ، مقسومًا على منتج مماثل لتركيزات المواد المتفاعلة في القوى المقابلة، هي قيمة ثابتة )
كر = = =27
2)
في التفاعلات غير المتجانسة، يتم أخذ تركيزات الغاز فقط في الاعتبار.
التركيز الأولي لـ H 2 يساوي 3 مول/لتر. التركيز الأولي لـ H 2 S هو صفر (هذا منتج تفاعل لم يتشكل بعد في بداية التفاعل).
دع القفزات H 2 تتشكل. في هذه الحالة، سيكون تركيز H 2 S مساويًا أيضًا لـ hmol (نظرًا لأن نسبتها وفقًا لمعادلة التفاعل هي 1: 1). يتم حساب تركيز التوازن لـ H2:
C يساوي = C الأولي - C proreact = (3 - x) مول، وتركيز التوازن H 2 S: C يساوي =
= من البداية + من التفاعل = 0 + x = x mol.
التعبير عن ثابت التوازن لهذا التفاعل هو كما يلي:
Кн = بالتعويض عن البيانات المعروفة نحصل على المعادلة:
15 = , وبالتالي x = 45-15x;
16س = 45؛ س = 2.8
وبالتالي فإن تركيز التوازن H 2 S:
= س = 2.8 مول/لتر
تركيز التوازن من H2:
= 3 = 3 - 2.8 = 0.2 مول/لتر
3) نصنع جدولاً باستخدام معادلة التفاعل:
في خط تركيزات التوازن نكتب البيانات في مسألة تركيز المواد. يمكن حساب كمية NH 3 المتفاعلة من كمية أي من المواد التي تم الحصول عليها: على سبيل المثال، نسبة NH 3 و N 2 وفقا لمعادلة التفاعلهي 2:1، مما يعني أنه إذا تم تكوين 1.2 مول N 2 بعد التفاعل، فإن NH 3 يتفاعل مرتين أكثر: n(NH 3) = 2 1.2 = 2.4 مول.
يتم حساب التركيز الأولي لـ NH 3:
C الأولي = C التفاعل + C يساوي = 2.4 + 0.4 = 2.8 مول/لتر.
تعتبر الحركية الكيميائية أحد أهم فروع الكيمياء، حيث تتمثل مهمتها في تفسير التغيرات النوعية والكمية في العملية الكيميائية التي تحدث مع مرور الوقت. عادةً ما يتم تقسيم هذه المهمة العامة إلى مهمتين أكثر تحديدًا:
1) تحديد آلية التفاعل - تحديد المراحل الأولية للعملية وتسلسل حدوثها (التغيرات النوعية)؛
2) الوصف الكمي للتفاعل الكيميائي - إنشاء علاقات صارمة يمكنها التنبؤ بشكل مرض بالتغيرات في كميات الكواشف الأولية والمنتجات مع استمرار التفاعل.
كقاعدة عامة، يحدث التفاعل الكيميائي في عدة مراحل متوسطة، والتي عند إضافتها معًا تعطي تفاعلًا كليًا.
لا يمكن الحصول على المعادلة الحركية للتفاعل الكيميائي (مع الأخذ في الاعتبار آلية التفاعل) إلا نتيجة لدراسة تجريبية للتفاعل ولا يمكن استخلاصها من المعادلة المتكافئة للتفاعل الكلي. عند مناقشة آليات التفاعل، من المعتاد التمييز بين التفاعلات حسب جزيئيتها، أي. من خلال عدد الجزيئات المشاركة في كل فعل تفاعل أولي. وعلى هذا الأساس، يتم التمييز بين التفاعلات أحادية الجزيئية، وثنائية الجزيئية، وثلاثية الجزيئات.
التفاعلات الأحادية الجزيئية هي تلك التي يكون فيها الفعل الأولي عبارة عن تحول كيميائي لجزيء واحد، والذي يمكن وصفه بشكل عام بالمعادلة
التفاعلات ثنائية الجزيئات هي تفاعلات يحدث فيها الفعل الأولي عندما يصطدم جزيئين
![]()
في التفاعلات ثلاثية الجزيئات، يحدث فعل أولي أثناء التصادم المتزامن لثلاثة جزيئات
![]()
يكاد يكون من المستحيل اصطدام أكثر من ثلاثة جزيئات في نفس الوقت، لذلك لم يتم العثور على تفاعلات ذات وزن جزيئي أعلى في الممارسة العملية.
المفهوم الرئيسي في الحركية الكيميائية هو مفهوم معدل التفاعل:
يتم تحديد معدل التفاعل الكيميائي من خلال كمية المادة المتفاعلة لكل وحدة زمنية في وحدة الحجم.
إذا انخفض تركيز إحدى المواد المتفاعلة، عند حجم ودرجة حرارة ثابتين، من إلى خلال فترة زمنية من إلى، فإن معدل التفاعل لفترة زمنية معينة، وفقًا للتعريف، يساوي:
تظهر العلامة الموجودة على الجانب الأيمن من المعادلة للسبب التالي. مع تقدم التفاعل، يقل تركيز المواد المتفاعلة، وبما أن معدل التفاعل موجب دائمًا، يجب وضع العلامة أمام الكسر
عادة، بالنسبة للتفاعلات التي تحدث في الغازات أو المحاليل، يتم التعبير عن تركيزات المواد المتفاعلة بالمول/لتر، ومعدل التفاعل بالمول/(لتر/ث).
يعتمد معدل كل تفاعل كيميائي على طبيعة المواد المتفاعلة وعلى الظروف التي يحدث فيها التفاعل. وأهم هذه الشروط هي: التركيز، ودرجة الحرارة، ووجود العامل المحفز (تناقش ظاهرة الحفز أدناه). إن طبيعة المواد المتفاعلة لها تأثير حاسم على معدل التفاعل الكيميائي. على سبيل المثال، يتفاعل الهيدروجين بقوة مع الفلور حتى في درجة حرارة الغرفة، بينما يتفاعل مع البروم بشكل أبطأ بكثير حتى عند تسخينه.
يمكن تفسير تأثير تركيز المواد المتفاعلة من خلال مفهوم أن التفاعل الكيميائي هو نتيجة تصادم الجزيئات. تؤدي الزيادة في عدد الجسيمات في حجم معين إلى حدوث تصادمات أكثر تكرارًا، أي: لزيادة معدل التفاعل.
يتم وصف العلاقة الكمية بين معدل التفاعل والتركيزات المولية للمواد المتفاعلة من خلال القانون الأساسي للحركية الكيميائية - قانون العمل الجماعي.
يتناسب معدل التفاعل الكيميائي عند درجة حرارة ثابتة بشكل مباشر مع ناتج تركيزات المواد المتفاعلة.
بالنسبة للتفاعل أحادي الجزيئي من النوع (5.3)، يتم تحديد معدل التفاعل v من خلال تركيز جزيئات المادة A:
![]()
حيث k هو معامل التناسب، والذي يسمى ثابت معدل التفاعل؛ - التركيز المولي للمادة أ.
في حالة التفاعل ثنائي الجزيئي من النوع (5.4)، يتم تحديد معدله من خلال تركيز الجزيئات ليس فقط من المادة أ، ولكن أيضًا من المادة ب:
![]()
في حالة التفاعل الثلاثي الجزيئي من النوع (6.5) يتم التعبير عن معدل التفاعل بالمعادلة:
![]()
في الحالة العامة، عندما تدخل جزيئات المادة، جزيئات المادة B، في تفاعل في وقت واحد، أي.
![]()
معادلة معدل التفاعل لها الشكل
![]()
هذه المعادلة هي تعبير رياضي لقانون فعل الكتلة بشكل عام.
لفهم المعنى الفيزيائي لثابت معدل التفاعل يجب أن نقبل في المعادلات المكتوبة أعلاه (أو نساوي ناتجها بالوحدة) ومن ثم يتضح أن ثابت المعدل k يساوي عددياً معدل التفاعل عندما تكون تراكيز المواد المتفاعلة (أو منتجاتها في معادلات المعدل) هي وحدة متساوية.
يجب التأكيد بشكل خاص على أنه تم الحصول على التعبير (5.7) عند درجة حرارة ثابتة معينة. في الحالة العامة، بما أن معدل التفاعل يعتمد على درجة الحرارة، فإن قانون فعل الكتلة يجب أن يعتمد على ذلك
حيث v و k دالتان لدرجة الحرارة.
إن اعتماد معدل التفاعل الكيميائي على تركيز المواد المتفاعلة من النوع (5.7) صالح للغازات والتفاعلات التي تحدث في المحاليل.
ولا ينطبق على التفاعلات التي تنطوي على مواد صلبة، لأنه في هذه الحالات لا يحدث تفاعل الجزيئات في كامل حجم المواد المتفاعلة، ولكن فقط على السطح، الذي يحدد حجمه أيضًا معدل التفاعل. ولذلك، فإن ردود الفعل في الأنظمة غير المتجانسة أكثر تعقيدا بكثير.
النظام غير المتجانس هو نظام يتكون من جزيئات فردية تقع في حالات تجميع مختلفة ويتم فصلها عن بعضها البعض بواسطة واجهات معينة. تسمى الأجزاء المتجانسة الفردية من النظام غير المتجانس مراحله. على سبيل المثال، عند درجة حرارة 0 درجة مئوية، يشكل الجليد والماء والبخار الذي يعلوهما نظامًا غير متجانس من ثلاث مراحل: الصلبة - الجليد، والسائل - الماء، والغازي - بخار الماء؛ ويشكل تفاعل الحمض وقطع المعدن معه نظامًا من ثلاث مراحل، وما إلى ذلك.
في النظام غير المتجانس، يحدث التفاعل دائمًا عند السطح البيني بين مرحلتين، حيث أنه هنا فقط يمكن أن تتصادم جزيئات المراحل المختلفة مع بعضها البعض. لذلك، فإن معدل التفاعل غير المتجانس لا يعتمد فقط على العوامل التي تمت مناقشتها سابقًا، ولكن أيضًا على حجم سطح التلامس بين مراحل التفاعل. وأي زيادة في مساحة السطح تؤدي أيضًا إلى زيادة في معدل التفاعل. على سبيل المثال، يتم ذوبان المعادن في الأحماض بشكل أسرع بكثير إذا تم أخذ المعادن في شكل مساحيق.
تأثير درجة الحرارة.
تظهر العديد من التجارب أنه مع زيادة درجة الحرارة، يزيد معدل معظم التفاعلات الكيميائية بشكل كبير، وبالنسبة للتفاعلات في الأنظمة المتجانسة، عند تسخينها لكل عشر درجات، يزيد معدل التفاعل بمقدار 2-4 مرات (قاعدة فانت هوف).
ترتبط هذه القاعدة بمفهوم معامل درجة الحرارة لمعدل التفاعل y ويتم تحديدها بالعلاقة
![]()
تم الحصول عليها من العلاقة (5.8).
عند درجات حرارة لا تختلف كثيراً، للعديد من التفاعلات طبقاً لقاعدة فانت هوف
تتيح قيمة معامل درجة الحرارة y حساب التغير في معدل التفاعل عند زيادة درجة الحرارة بعدد معين من الدرجات من إلى استخدام الصيغة
بمعنى آخر، من (5.10) يتضح أنه مع زيادة درجة الحرارة في متوالية حسابية، يزداد معدل التفاعل في متوالية هندسية. كيف يمكن تفسير هذا الاعتماد على درجة الحرارة العالية لمعدل التفاعل؟
يبدو أن مثل هذا الاعتماد يرتبط بزيادة في عدد الاصطدامات الجزيئية. وتبين أن هذا لم يكن الحال. وقد ثبت أن العدد الإجمالي للتصادمات الجزيئية لا يزيد إلا بنسبة قليلة عند ارتفاع درجة الحرارة بمقدار عشر درجات، بينما يزيد عدد الجزيئات المتفاعلة بنسبة 200-400%.
لشرح التناقضات الملحوظة، كان S. Arrhenius أول من أظهر أن تأثير درجة الحرارة ينخفض إلى زيادة في عدد الجزيئات النشطة، أي. هي الجزيئات التي تمتلك في لحظة التصادم طاقة لا تقل عن القيمة المحددة لتفاعل معين، وتسمى طاقة التنشيط للتفاعل الكيميائي.
طاقة التنشيط هي كمية زائدة معينة من الطاقة (مقارنة بالمتوسط) اللازمة لدخول الجزيئات في التفاعل.
وبحسب أرهينيوس، فإن ثابت معدل التفاعل الكيميائي البالغ (5.8) يعتمد بشكل كبير على درجة الحرارة
![]()
هنا E هي طاقة التنشيط - ثابت الغاز العالمي، T هي درجة الحرارة في K، A ثابت.
الفرق بين طاقة التنشيط وحرارة التفاعل
ويتضح ذلك بوضوح من خلال الرسم البياني في الشكل. 5.1.

أرز. 5.1. العلاقة بين طاقة التنشيط والتغير في المحتوى الحراري (التأثير الحراري) للتفاعل
يتم تحديد طاقة التنشيط نفسها بواسطة حاجز الطاقة الذي يجب أن تتغلب عليه الجزيئات المتصادمة في الاتجاهين الأمامي () أو العكسي قبل حدوث إعادة توزيع الرابطة.
مفهوم الحفز.
من أقوى وسائل التأثير على معدل التفاعلات الكيميائية هو استخدام المحفزات.
المحفز هو مادة تغير معدل التفاعل الكيميائي ولكنها تبقى دون تغيير بعد اكتمال التفاعل الكيميائي.
يسمى تأثير المحفزات على معدل التفاعل بالتحفيز. عندما تكون المواد المتفاعلة والمحفز في نفس حالة التجميع، فإنها تتحدث عن الحفز المتجانس. في الحفز غير المتجانس، تكون المواد المتفاعلة والمحفز في حالات مختلفة من التجميع: عادة ما يكون المحفز صلبًا، وتكون المواد المتفاعلة سائلة أو غازية (على سبيل المثال، في حالة الأكسدة في وجود أكسيد البلاتين أو الفاناديوم (V)، يحدث الحفز غير المتجانس).
يمكن أن تكون آلية عمل المحفزات متنوعة للغاية، وعادة ما تكون معقدة للغاية. الفرضية الرئيسية التي تشرح تأثير المحفز على معدل التفاعل هي افتراض تكوين منتجات وسيطة أثناء تفاعل المحفز والمادة المتفاعلة. إذا حدث تفاعل كيميائي ببطء بدون محفز، ولكن بسرعة في وجود المحفز K، فسيتم تفسير عمله من خلال حقيقة أن المحفز يتفاعل مع إحدى المواد الأولية، ويشكل مركبًا وسيطًا هشًا (عادةً شديد التفاعل) AA ( أو في سي):
يتفاعل المركب الوسيط الناتج (على سبيل المثال، AA) مع مادة بدء أخرى B، مكونًا منتج التفاعل النهائي AB ويطلق المحفز K في شكله الأصلي:
يوضح أبسط مخطط للحفز (5.12)، (5.13) بوضوح سبب مشاركة كل جسيم محفز في التفاعل مرات لا تحصى. (صحيح أن كلمة "لا تعد ولا تحصى" هي كلمة نظرية فقط، لأنه في الممارسة العملية، يمكن لبعض المواد، حتى بكميات صغيرة جدًا، أن تقلل بشكل حاد من معدل التفاعل التحفيزي، مما يقلل من نشاط المحفز أو يدمره تمامًا. وتسمى هذه المواد بالسموم الحفزية، و إن ظاهرة تقليل نشاط المحفز هي التسمم.) ومن هنا يتضح سبب بقاء المحفز دون تغيير كميًا وكيميائيًا بعد نهاية التفاعل.
معدل التفاعل الكيميائي
معدل التفاعل الكيميائييتم تعريفه على أنه التغير في التركيز المولي لأحد المواد المتفاعلة لكل وحدة زمنية. يكون معدل التفاعل الكيميائي دائمًا قيمة موجبة، فإذا تم تحديده بواسطة المادة البادئة (التي ينخفض تركيزها أثناء التفاعل)، يتم ضرب القيمة الناتجة في -1.
على سبيل المثال، بالنسبة لرد الفعل، يمكن التعبير عن السرعة على النحو التالي:
في عام 1865 ن.ن. بيكيتوف وفي عام 1867 ك. صاغ غولدبرغ وبي.واجي قانون الفعل الجماعي، والذي بموجبه يتناسب معدل التفاعل الكيميائي في كل لحظة من الزمن مع تركيزات الكواشف المرفوعة إلى قوى معينة. بالإضافة إلى التركيز، يتأثر معدل التفاعل الكيميائي بالعوامل التالية: طبيعة المواد المتفاعلة، ووجود محفز، ودرجة الحرارة (قاعدة فانت هوف) ومساحة سطح المواد المتفاعلة.
ترتيب التفاعل الكيميائي
ترتيب التفاعل لمادة معينة هو الأس عند تركيز هذه المادة في المعادلة الحركية للتفاعل.
الدولة الانتقالية
الحفز
التحفيز هو عملية تتضمن تغيير معدل التفاعلات الكيميائية في وجود مواد تسمى المحفزات.
المحفزات هي مواد تغير معدل التفاعل الكيميائي، ويمكن أن تشارك في التفاعل، وتكون جزءًا من المنتجات الوسيطة، ولكنها ليست جزءًا من منتجات التفاعل النهائية وتبقى دون تغيير بعد نهاية التفاعل.
التفاعلات التحفيزية هي تفاعلات تحدث في وجود المحفزات.
يسمى التحفيز موجبًا عندما يزيد معدل التفاعل، وسالبًا (تثبيطًا) عندما ينخفض. مثال على التحفيز الإيجابي هو أكسدة الأمونيا على البلاتين لإنتاج حمض النيتريك. مثال على السلبية هو انخفاض معدل التآكل عند إدخال نتريت الصوديوم وكرومات البوتاسيوم وثنائي كرومات في السائل الذي يستخدم فيه المعدن.
تسمى المحفزات التي تبطئ التفاعل الكيميائي بالمثبطات.
اعتمادا على ما إذا كان المحفز في نفس المرحلة مثل المواد المتفاعلة أو يشكل مرحلة مستقلة، فإننا نتحدث عن الحفز المتجانس أو غير المتجانس.
مثال على الحفز المتجانس هو تحلل بيروكسيد الهيدروجين في وجود أيونات اليود. يحدث التفاعل على مرحلتين:
H O + I = H O + IO
H O + IO = H O + O + I
في الحفز المتجانس، يرجع عمل المحفز إلى حقيقة أنه يتفاعل مع المواد المتفاعلة لتكوين مركبات وسيطة، وهذا يؤدي إلى انخفاض في طاقة التنشيط.
في الحفز غير المتجانس، يحدث تسارع العملية عادة على سطح جسم صلب - المحفز، وبالتالي فإن نشاط المحفز يعتمد على حجم وخصائص سطحه. ومن الناحية العملية، عادة ما يتم دعم المحفز على دعامة صلبة مسامية. تعد آلية الحفز غير المتجانس أكثر تعقيدًا من آلية الحفز المتجانس.
تشتمل آلية التحفيز غير المتجانس على خمس مراحل، وكلها قابلة للعكس.
1. انتشار المواد المتفاعلة على سطح المادة الصلبة.
2. الامتزاز الفيزيائي على المراكز النشطة لسطح المادة الصلبة من الجزيئات المتفاعلة ثم امتزازها الكيميائي.
3. التفاعل الكيميائي بين الجزيئات المتفاعلة.
4. امتزاز المنتجات من سطح المحفز.
5. انتشار المنتج من سطح المحفز إلى التدفق العام.
مثال على الحفز غير المتجانس هو أكسدة ثاني أكسيد الكبريت إلى ثاني أكسيد الكبريت عبر محفز VO في إنتاج حمض الكبريتيك (طريقة الاتصال).
المروجين (أو المنشطات) هي مواد تزيد من نشاط المحفز. في هذه الحالة، قد لا يكون لدى المروجين أنفسهم خصائص تحفيزية.
السموم التحفيزية هي شوائب غريبة موجودة في خليط التفاعل، مما يؤدي إلى فقدان جزئي أو كامل لنشاط المحفز. وبالتالي، فإن آثار الزرنيخ والفوسفور تسبب فقدانًا سريعًا لنشاط VO2 بواسطة المحفز (طريقة الاتصال لإنتاج H2SO4).
يتم تنفيذ العديد من الإنتاجات الكيميائية المهمة، مثل إنتاج حامض الكبريتيك والأمونيا وحامض النيتريك والمطاط الصناعي وعدد من البوليمرات وغيرها، في وجود المحفزات.
يتم تسريع التفاعلات الكيميائية الحيوية في الكائنات النباتية والحيوانية بواسطة المحفزات الكيميائية الحيوية - الإنزيمات.
تعد سرعة العملية عاملاً مهمًا للغاية في تحديد إنتاجية معدات إنتاج المواد الكيميائية. ولذلك فإن إحدى المهام الرئيسية التي ألقيتها الثورة العلمية والتكنولوجية على الكيمياء هي البحث عن طرق لزيادة معدل التفاعلات. هناك مهمة أخرى مهمة للكيمياء الحديثة، بسبب الزيادة الحادة في حجم إنتاج المنتجات الكيميائية، وهي زيادة انتقائية التحولات الكيميائية إلى منتجات مفيدة، مما يقلل من كمية الانبعاثات والنفايات. ويرتبط هذا أيضًا بحماية البيئة والاستخدام الأكثر عقلانية للموارد الطبيعية المستنزفة للأسف.
لتحقيق كل هذه الأهداف، هناك حاجة إلى الوسائل الصحيحة، وهذه الوسائل هي في المقام الأول محفزات. ومع ذلك، العثور عليهم ليس بالأمر السهل. في عملية فهم البنية الداخلية للأشياء من حولنا، أنشأ العلماء تدرجًا معينًا، وهو تسلسل هرمي لمستويات العالم الصغير. العالم الموصوف في كتابنا هو عالم الجزيئات التي تشكل تحولاتها المتبادلة موضوع الكيمياء. لن نهتم بالكيمياء بأكملها، ولكن بجزء منها فقط، المخصص لدراسة ديناميكيات التغيرات في التركيب الكيميائي للجزيئات. والظاهر أنه لا داعي للقول بأن الجزيئات مبنية من الذرات، وهذه الأخيرة تتكون من نواة وغلاف الإلكترون المحيط بها؛ أن خواص الجزيئات تعتمد على طبيعة الذرات المكونة لها وتسلسل ارتباطها ببعضها البعض، وأن الخواص الكيميائية والفيزيائية للمواد تعتمد على خواص الجزيئات وطبيعة ترابطها. سنفترض أن كل هذا معروف بشكل عام للقارئ، وبالتالي سيكون التركيز الرئيسي على القضايا المتعلقة بفكرة معدل التفاعلات الكيميائية.
تحدث التحولات المتبادلة للجزيئات بمعدلات مختلفة جدًا. يمكن تغيير المعدل عن طريق تسخين أو تبريد خليط الجزيئات المتفاعلة. عند التسخين، يزداد معدل التفاعل عادة، لكن هذه ليست الوسيلة الوحيدة لتسريع التحولات الكيميائية. هناك طريقة أخرى أكثر فعالية - تحفيزية، تستخدم على نطاق واسع في عصرنا في إنتاج مجموعة واسعة من المنتجات.
نشأت الأفكار العلمية الأولى حول الحفز بالتزامن مع تطور النظرية الذرية لبنية المادة. في عام 1806، بعد عام من قيام دالتون، أحد مؤسسي النظرية الذرية الحديثة، بصياغة قانون النسب المتعددة في وقائع جمعية مانشستر الأدبية والفلسفية، نشر كليمان وديسورميس بيانات مفصلة عن تسارع أكسدة ثاني أكسيد الكبريت في وجود أكاسيد النيتروجين في درجة حرارة الغرفة إنتاج حامض الكبريتيك. بعد ست سنوات، في مجلة التكنولوجيا، قدم كيرشوف نتائج ملاحظاته حول التأثير المتسارع للأحماض المعدنية المخففة على التحلل المائي للنشا إلى الجلوكوز. فتحت هاتان الملاحظتان عصر الدراسة التجريبية للظواهر الكيميائية غير العادية في ذلك الوقت، والتي أطلق عليها الكيميائي السويدي بيرزيليوس الاسم العام "الحفز" في عام 1835 من الكلمة اليونانية "كاتالو" - للتدمير. هذا، باختصار، هو تاريخ اكتشاف الحفز الكيميائي، والذي ينبغي، لسبب وجيه، تصنيفه كواحدة من الظواهر الأساسية في الطبيعة.
الآن يجب أن نقدم التعريف الحديث والأكثر قبولًا للحفز الكيميائي، ثم بعض التصنيف العام للعمليات التحفيزية، حيث أن هذا هو المكان الذي يبدأ فيه أي علم دقيق. كما تعلم، "الفيزياء هي ما يفعله الفيزيائيون (ويمكن قول الشيء نفسه عن الكيمياء)." باتباع هذه التعليمات من بيرجمان، يمكن للمرء أن يقتصر على العبارة التي مفادها أن "التحفيز هو شيء يفعله كل من الكيميائيين والفيزيائيين". ولكن من الطبيعي أن مثل هذا التفسير الفكاهي لا يكفي، ومنذ زمن بيرزيليوس، تم تقديم العديد من التعريفات العلمية لمفهوم "الحفز". في رأينا، أفضل تعريف صاغه G. K. Vereskov: "من الناحية الظاهرية، يمكن تعريف التحفيز بأنه إثارة التفاعلات الكيميائية أو تغيير في سرعتها تحت تأثير المواد - المحفزات التي تدخل بشكل متكرر في تفاعلات كيميائية وسيطة مع المشاركين في التفاعل و استعادة تركيبها الكيميائي بعد كل دورة من التفاعلات الوسيطة "
وأغرب ما في هذا التعريف هو جزئه الأخير وهو عدم استهلاك المادة التي تسرع العملية الكيميائية. إذا كان من الضروري تسريع حركة جسم ثقيل، فسيتم دفعه، وبالتالي يتم إنفاق الطاقة على ذلك. كلما زادت الطاقة المستهلكة، زادت السرعة التي يكتسبها الجسم. من الناحية المثالية، فإن كمية الطاقة المستهلكة ستكون مساوية تماما للطاقة الحركية التي يكتسبها الجسم. وهذا يكشف عن القانون الأساسي للطبيعة - الحفاظ على الطاقة.
شخصيات بارزة في الكيمياء في مجال الحفز الكيميائي
I. Berzelius (1837): "المواد المعروفة، عند ملامستها لمواد أخرى، لها تأثير كبير على الأخيرة بحيث يحدث تأثير كيميائي - يتم تدمير بعض المواد، وتتشكل مواد أخرى مرة أخرى بدون الجسم الذي يسبب وجوده هذه التحولات، القيام بأي مشاركة. نحن نطلق على السبب الذي ينتج هذه الظواهر القوة التحفيزية.
م. فاراداي (1840). "يمكن تفسير الظواهر التحفيزية بالخصائص المعروفة للمادة، دون تزويدها بأي قوة جديدة."
P. Raschig (1906): "الحفز هو تغيير في بنية الجزيء بسبب عوامل خارجية، مما يؤدي إلى تغيير في الخواص الكيميائية."
إي. أبيل (1913): "لقد توصلت إلى نتيجة مفادها أن التحفيز يتأثر برد فعل وليس بمجرد وجود مادة ما."
L. Gurvich (1916): "الأجسام ذات التأثير التحفيزي، تجذب الجزيئات المتحركة إلى نفسها بشكل أقوى بكثير من الأجسام التي تفتقر إلى الفعل التحفيزي، وبالتالي تزيد من قوة تأثير الجزيئات التي تصطدم بسطحها."
G. K. بوريسكوف (1968): "ذات مرة، كان التحفيز يعتبر ظاهرة خاصة وغامضة بعض الشيء، مع قوانين محددة، وكان من المفترض أن يؤدي الكشف عنها إلى حل مشكلة الاختيار على الفور في شكل عام. الآن نحن نعلم أن الأمر ليس كذلك. التحفيز في جوهره هو ظاهرة كيميائية. إن التغير في معدل التفاعل أثناء العمل التحفيزي يرجع إلى التفاعل الكيميائي الوسيط للمواد المتفاعلة مع المحفز.
إذا لم نأخذ في الاعتبار محاولة بيرسيليوس الفاشلة لربط الظواهر المرصودة بفعل "القوة التحفيزية" المخفية، فكما يتبين من الخطب المذكورة أعلاه، كانت المناقشة تدور بشكل أساسي حول الجوانب الفيزيائية والكيميائية للتحفيز. لفترة طويلة، كانت نظرية الطاقة الخاصة بالحفز الكيميائي شائعة بشكل خاص، حيث ربطت عملية إثارة الجزيئات بالهجرة الرنانة للطاقة. يتفاعل المحفز مع الجزيئات المتفاعلة، مكونًا مركبات وسيطة غير مستقرة تتحلل لتحرر منتج التفاعل والمحفز غير المتغير كيميائيًا. تنعكس معرفتنا الحديثة بشكل أفضل في بيان بوريسكوف. ومع ذلك، فإن السؤال الذي يطرح نفسه هنا هو: هل يمكن للمحفز، بما أنه يشارك كيميائيا في التفاعل، أن يخلق حالة توازن جديدة؟ إذا كان الأمر كذلك، فإن فكرة المشاركة الكيميائية للمحفز سوف تتعارض على الفور مع قانون الحفاظ على الطاقة. ولتجنب ذلك، اضطر العلماء إلى القبول ثم إثبات أن المحفز يعمل على تسريع التفاعل ليس فقط في الأمام ولكن أيضًا في الاتجاه المعاكس. تلك المركبات التي تغير معدل وتوازن التفاعل ليست محفزات بالمعنى الدقيق للكلمة. يبقى لنا أن نضيف أنه عادة في وجود المحفز يحدث تسارع في التفاعلات الكيميائية، وتسمى هذه الظاهرة بالتحفيز "الإيجابي" على عكس "السلبية" التي يسبب فيها إدخال المحفز في نظام التفاعل انخفاض في المعدل. بالمعنى الدقيق للكلمة، يعمل التحفيز دائمًا على زيادة معدل التفاعل، ولكن في بعض الأحيان يؤدي تسارع إحدى المراحل (على سبيل المثال، ظهور مسار جديد لإنهاء السلسلة) إلى تثبيط ملحوظ للتفاعل الكيميائي.
سننظر فقط في الحفز الإيجابي، والذي ينقسم عادة إلى الأنواع التالية:
أ) متجانس، عندما يكون خليط التفاعل والمحفز إما في حالة سائلة أو غازية؛ ب) غير متجانس - يكون المحفز على شكل مادة صلبة، والمركبات المتفاعلة على شكل محلول أو خليط غازي؛ (هذا هو النوع الأكثر شيوعًا من التحفيز، وبالتالي يتم إجراؤه عند السطح البيني بين مرحلتين.) ج) الأنزيمية - تعمل تكوينات البروتين المعقدة كمحفزات، مما يؤدي إلى تسريع مسار التفاعلات المهمة بيولوجيًا في الكائنات الحية في عالم النبات والحيوان. (يمكن أن يكون التحفيز الإنزيمي إما متجانسًا أو غير متجانس، ولكن نظرًا للخصائص المحددة لعمل الإنزيمات، فمن المستحسن فصل هذا النوع من الحفز إلى منطقة مستقلة.) الحفز المتجانس
من بين التفاعلات التحفيزية العديدة، يحتل الحفز مكانًا خاصًا في التفاعلات المتسلسلة. "التفاعلات المتسلسلة كما هو معروف هي تلك العمليات الكيميائية والفيزيائية التي يؤدي فيها تكوين بعض الجزيئات النشطة (المراكز النشطة) في مادة ما أو في خليط من المواد إلى أن كل جزيء من الجزيئات النشطة يسبب سلسلة كاملة ( سلسلة) من التحولات المتسلسلة للمادة" (ايمانويل، 1957).
هذه الآلية لتطوير العملية ممكنة نظرًا لحقيقة أن الجسيم النشط يتفاعل مع المادة، مكونًا ليس فقط منتجات التفاعل، ولكن أيضًا جسيم نشط جديد (واحد أو اثنين أو أكثر)، قادر على تفاعل جديد للتحويل المادة، وما إلى ذلك. تستمر التحولات المتسلسلة الناتجة للمادة حتى يختفي الجسيم النشط من النظام (يحدث "موت" الجسيم النشط وانقطاع السلسلة). أصعب مرحلة في هذه الحالة هي نواة الجزيئات النشطة (على سبيل المثال، الجذور الحرة)، ولكن بعد التنوي تحدث سلسلة التحولات بسهولة. ردود الفعل المتسلسلة منتشرة على نطاق واسع في الطبيعة. تتبع البلمرة والكلورة والأكسدة والعديد من العمليات الكيميائية الأخرى آلية سلسلة، أو بالأحرى، آلية سلسلة جذرية (بمشاركة الجذور). لقد تم الآن تحديد آلية أكسدة المركبات العضوية (في المراحل المبكرة) بشكل كامل. إذا أشرنا إلى المادة المؤكسدة R-H (حيث H هي ذرة الهيدروجين التي لديها أقل قوة رابطة مع بقية جزيء R)، فيمكن كتابة هذه الآلية بالشكل التالي:
يمكن أن تؤثر المحفزات، مثل مركبات معادن التكافؤ المتغيرة، على أي من المراحل المدروسة من العملية. دعونا الآن نتناول دور المحفزات في عمليات تفرع السلسلة المتدهورة. يمكن أن يؤدي تفاعل الهيدروبيروكسيد مع المعدن إلى تسريع وتثبيط تفاعل أكسدة المواد العضوية بواسطة مركبات معدنية ذات تكافؤ متغير، اعتمادًا على طبيعة المنتجات المتكونة أثناء تحلل الهيدروبيروكسيد. تشكل المركبات المعدنية مركبًا يحتوي على هيدرو بيروكسيدات، والذي يتحلل في "قفص" وسط المذيب، وإذا تمكنت الجذور المتكونة أثناء تحلل المركب من مغادرة الخلية، فإنها تبدأ العملية (التحفيز الإيجابي). إذا لم يكن لدى هذه الجذور الوقت الكافي للمغادرة وإعادة الاتحاد في الخلية إلى منتجات غير نشطة جزيئيًا، فسيؤدي ذلك إلى تباطؤ عملية السلسلة الجذرية (التحفيز السلبي)، لأنه في هذه الحالة يكون الهيدروبيروكسيد، وهو المورد المحتمل للجذور الجديدة، هو يضيع.
لقد تناولنا حتى الآن المراحل الضحلة فقط من عمليات الأكسدة؛ في مراحل أعمق، على سبيل المثال في حالة أكسدة الهيدروكربونات، تتشكل الأحماض والكحوليات والكيتونات والألدهيدات، والتي يمكن أن تتفاعل أيضًا مع المحفز وتكون بمثابة مصدر إضافي للجذور الحرة في التفاعل، أي في هذه الحالة هناك سيكون هناك تفرع إضافي للسلسلة.
الحفز غير المتجانس
لسوء الحظ، حتى الآن، على الرغم من عدد كبير إلى حد ما من النظريات والفرضيات في مجال الحفز الكيميائي، تم إجراء العديد من الاكتشافات الأساسية عن طريق الصدفة أو نتيجة لنهج تجريبي بسيط. كما تعلمون، تم اكتشاف محفز الزئبق لكبريتة الهيدروكربونات العطرية عن طريق الخطأ بواسطة M. A. Ilyinsky، الذي كسر بطريق الخطأ مقياس حرارة الزئبق: دخل الزئبق إلى المفاعل، وبدأ التفاعل. وبطريقة مماثلة، تم اكتشاف محفزات زيغلر المعروفة الآن، والتي فتحت في وقت ما حقبة جديدة في عملية البلمرة. وبطبيعة الحال، فإن مسار تطور عقيدة التحفيز لا يتوافق مع المستوى الحديث للعلم، وهذا ما يفسر الاهتمام المتزايد بدراسة المراحل الأولية للعمليات في التفاعلات الحفزية غير المتجانسة. تعد هذه الدراسات مقدمة لإنشاء أساس علمي صارم لاختيار المحفزات عالية الكفاءة. في كثير من الحالات، يتم تقليل دور المحفزات غير المتجانسة في عملية الأكسدة إلى امتزاز مركب عضوي والأكسجين مع تكوين مركب ممتز من هذه المواد على سطح المحفز. يعمل هذا المركب على فك روابط المكونات ويجعلها أكثر تفاعلاً. في بعض الحالات، يمتص المحفز مكونًا واحدًا فقط، والذي ينفصل إلى جذور. على سبيل المثال، ينفصل البروبيلين الموجود على أكسيد النحاسوز ليشكل جذر أليلي، والذي يتفاعل بعد ذلك بسهولة مع الأكسجين. اتضح أن النشاط التحفيزي للمعادن ذات التكافؤ المتغير يعتمد إلى حد كبير على ملء المدارات d في كاتيونات أكاسيد المعادن.
وفقا للنشاط التحفيزي في تفاعل التحلل للعديد من الهيدروبيروكسيدات، يتم ترتيب المركبات المعدنية بالترتيب التالي:
لقد نظرنا في إحدى الطرق الممكنة لبدء العملية - تفاعل الهيدروبيروكسيد مع المحفز. ومع ذلك، في حالة الأكسدة، يمكن أن يحدث تفاعل بدء السلسلة غير المتجانسة من خلال التحلل إلى جذور الهيدروبيروكسيد ومن خلال تفاعل الهيدروكربون مع الأكسجين المنشط بواسطة سطح المحفز. قد يكون بدء السلاسل بسبب مشاركة الشكل المشحون للمركب العضوي RH+، الذي يتكون أثناء تفاعل RH مع المحفز. هذا هو الحال مع التحفيز في تفاعلات بدء السلسلة (التنوي والتفرع). يتم التأكيد بشكل خاص على دور المحفزات غير المتجانسة في تفاعلات استمرار السلسلة من خلال التغيرات في معدل واتجاه الأيزومرة لجذور البيروكسيد.
الحفز في الكيمياء الحيوية
يرتبط التحفيز الأنزيمي ارتباطًا وثيقًا بالنشاط الحيوي للكائنات الحية النباتية والحيوانية. يتم التحكم في العديد من التفاعلات الكيميائية الحيوية التي تحدث في الخلية (حوالي عشرة آلاف) بواسطة محفزات عضوية خاصة تسمى الإنزيمات أو الإنزيمات. لا ينبغي إيلاء اهتمام وثيق لمصطلح "خاص"، لأنه معروف بالفعل مما تتكون هذه الإنزيمات. اختارت الطبيعة لهذا الغرض مادة بناء واحدة - الأحماض الأمينية وربطتها في سلاسل متعددة الببتيد بأطوال مختلفة وبتسلسلات مختلفة
هذا هو ما يسمى بالبنية الأولية للإنزيم، حيث R عبارة عن بقايا جانبية، أو أهم المجموعات الوظيفية للبروتينات، والتي من المحتمل أن تعمل كمراكز نشطة للإنزيمات. تتحمل هذه المجموعات الجانبية العبء الرئيسي أثناء عمل الإنزيم، بينما تلعب سلسلة الببتيد دور الهيكل العظمي الداعم. وفقًا لنموذج بولينج-كوري الهيكلي، فهو مطوي على شكل حلزون، والذي في الحالة الطبيعية يتم تثبيته بواسطة روابط هيدروجينية بين المراكز الحمضية والقاعدية:
بالنسبة لبعض الإنزيمات، تم تحديد التركيب الكامل للأحماض الأمينية وتسلسل مواقعها في السلسلة، بالإضافة إلى البنية المكانية المعقدة. لكن هذا لا يزال في كثير من الأحيان لا يساعدنا في الإجابة على سؤالين رئيسيين: 1) لماذا تكون الإنزيمات انتقائية للغاية وتسرع التحولات الكيميائية للجزيئات ذات البنية المحددة جيدًا فقط (والتي نعرفها أيضًا)؛ 2) كيف يقلل الإنزيم حاجز الطاقة، أي يختار مسارًا أكثر ملاءمة للطاقة، بحيث يمكن أن تستمر التفاعلات في درجات الحرارة العادية.
الانتقائية الصارمة والسرعة العالية هما السمتان الرئيسيتان للتحفيز الأنزيمي الذي يميزه عن الحفز المختبري والصناعي. لا يمكن لأي من المحفزات التي يصنعها الإنسان (باستثناء محتمل لـ 2-هيدروكسي بيريدين) أن تقارن مع الإنزيمات في قوة وانتقائية عملها على الجزيئات العضوية. يعتمد نشاط الإنزيم، مثل أي محفز آخر، أيضًا على درجة الحرارة: مع زيادة درجة الحرارة، يزداد أيضًا معدل التفاعل الأنزيمي. وفي الوقت نفسه، يتم لفت الانتباه إلى الانخفاض الحاد في طاقة التنشيط E مقارنة بالتفاعل غير التحفيزي. صحيح أن هذا لا يحدث دائمًا. هناك العديد من الحالات التي تزداد فيها السرعة بسبب زيادة العامل الأسي المستقل عن درجة الحرارة في معادلة أرينيوس.
حالة توازن
ثابت التوازن الكيميائي
طاقة حرة
روابط
محاضرات الحركية الكيميائية والحفز الكيميائي للدكتور أ. أ. كوباسوف، دكتوراه في الكيمياء. ن، أستاذ مشارك في قسم الكيمياء الفيزيائية، كلية الكيمياء، جامعة موسكو الحكومية.
أنظر أيضا
- نظرية الاصطدام
- نظرية الدولة الانتقالية
مؤسسة ويكيميديا. 2010.
انظر ما هي "الحركية الكيميائية" في القواميس الأخرى:
فرع من فروع الكيمياء الفيزيائية، يدرس معدلات وآليات التفاعلات الكيميائية. الحركية الكيميائية هي الأساس العلمي لإنشاء عمليات جديدة وتحسينها في التكنولوجيا الكيميائية. تستخدم طرق الحركية الكيميائية في علم الأحياء و... ... القاموس الموسوعي الكبير
المجال المادي الكيمياء، حيث يدرسون آليات وسرعات الكيمياء. تفاعلات. ك.س. يتضمن ثلاثة رئيسية المهام: دراسة أنماط التدفق الكيميائي. التفاعلات مع مرور الوقت واعتماد معدلاتها على تراكيز الكواشف ودرجة الحرارة وعوامل أخرى؛... ... الموسوعة الفيزيائية
حركية الكيميائية- (من الحركة الحركية اليونانية) قسم الكيمياء النظرية مخصص لدراسة قوانين الكيمياء. تفاعلات. يمكن التعرف على عدة أنواع من المواد الكيميائية. التفاعلات، وقبل كل شيء، تمييز التفاعلات التي تحدث في وسط متجانس (متجانس) عن التفاعلات... ... الموسوعة الطبية الكبرى
حركية الكيميائية- - فرع من فروع الكيمياء الفيزيائية يدرس معدل وآليات التفاعلات الكيميائية وأنماط التغيرات مع مرور الوقت في تراكيز المكونات الأولية والوسيطة والمنتجات النهائية للتفاعلات الموصوفة بالمنحنيات الحركية. [أوشيروف... ... موسوعة مصطلحات وتعاريف وشروحات مواد البناء
قسم الكيمياء الفيزيائية. دراسة معدلات وآليات التفاعلات الكيميائية. الحركية الكيميائية هي الأساس العلمي لإنشاء عمليات جديدة وتحسينها في التكنولوجيا الكيميائية. تُستخدم طرق الحركية الكيميائية في علم الأحياء و... القاموس الموسوعي
حركية التفاعلات الكيميائية، دراسة العمليات الكيميائية وقوانين حدوثها في الزمن والسرعات والآليات. ترتبط أهم مجالات الكيمياء الحديثة والعلوم الكيميائية بدراسات حركية التفاعلات الكيميائية... ... الموسوعة السوفيتية الكبرى
- (من الكلمة اليونانية kinetikos المتحركة)، القسم البدني. الكيمياء، دراسة الكيمياء. التموين كعملية تحدث مع مرور الوقت، وآلية هذه العملية، واعتمادها على شروط التنفيذ. ك.س. يحدد أنماط مؤقتة من التدفق الكيميائي. ص،… ... الموسوعة الكيميائية
عقيدة السرعات والآليات (مجموع وتسلسل المراحل) في الكيمياء. تفاعلات؛ قسم الكيمياء الفيزيائية. Chem.speed يتم تحديد التفاعلات في الأنظمة المغلقة من خلال التغيرات في تركيز الجزيئات الأولية أو المتوسطة أو النهائية (الجزيئات ... قاموس البوليتكنيك الموسوعي الكبير