炭水化物の一般式の主な機能。 化学の授業「炭水化物」。 IV. 定性的反応
>> 化学: 炭水化物、その分類と意義
炭水化物の一般式は C n (H 2 O) m です。つまり、それらは炭素と水で構成されているように見えるため、歴史的なルーツを持つクラスの名前です。 それは、最初に知られている炭水化物の分析に基づいて登場しました。 後に、デオキシリボース - C5H10O4など、指定された比率(2:1)が観察されない分子内に炭水化物があることがわかりました。 有機化合物も知られており、その組成は所与の一般式に対応するが、炭水化物のクラスには属さない。 これらには、たとえば、すでに知られているホルムアルデヒド CH2O や酢酸 CH3COOH が含まれます。
しかし、「炭水化物」という名前が定着し、現在ではこれらの物質に一般的に受け入れられています.
炭水化物は、加水分解する能力に応じて、単糖、二糖、多糖の 3 つの主なグループに分けることができます。
単糖類は、加水分解されない (水によって分解されない) 炭水化物です。 次に、炭素原子の数に応じて、単糖類はトリオース (分子に 3 つの炭素原子が含まれる)、テトロース (4 つの炭素原子)、ペントース (5)、ヘキソース (6) などに分けられます。 d.
自然界では、単糖は主にペントースとヘキソースによって表されます。
ペントースには、例えば、リボース - C5H10O5 およびデオキシリボース (酸素原子が「取り除かれた」リボース) - C5H10O4 が含まれます。 それらは RNA と DNA の一部であり、核酸の名前の最初の部分を決定します。
一般分子式C6H12O6を有するヘキソースには、例えば、グルコース、フルクトース、ガラクトースが含まれる。
二糖類は、ヘキソースなどの 2 つの単糖類分子を形成するために加水分解される炭水化物です。 大多数の二糖類の一般式を導き出すのは難しくありません。ヘキソースの 2 つの式を「足し」、得られた式から水分子 - С12Н22О11 - を「引く」必要があります。 したがって、一般的な加水分解式は次のように記述できます。
С12Н22O11 + Н2O -> 2С6Н12O6
ヘキソース二糖
二糖類には以下が含まれます:
加水分解されると、1 分子のグルコースと 1 分子のフルクトースを生成するスクロース (一般的な食用糖)。 それは、サトウダイコン、サトウキビ(したがって、ビートまたはサトウキビの名前)、カエデ(カナダの開拓者がカエデ糖を抽出した)、サトウヤシ、トウモロコシなどに大量に含まれています。
加水分解して2分子のグルコースを形成するマルトース(麦芽糖)。 マルトースは、麦芽に含まれる酵素の作用下でデンプンを加水分解することによって得ることができます。
ラクトース(乳糖)。加水分解されてグルコースとガラクトースの分子を形成します。 哺乳動物の乳に含まれ(最大 4 ~ 6%)、甘味が少なく、錠剤や医薬品錠剤の充填剤として使用されます。
異なる単糖類と二糖類の甘味は異なります。 したがって、最も甘い単糖であるフルクトースは、標準とされるグルコースよりも1.5倍甘い. 一方、スクロース(二糖類)は、グルコースの 2 倍、ラクトースの 4 ~ 5 倍の甘さで、ほとんど無味です。
多糖類 - デンプン、グリコーゲン、デキストリン、セルロース ... - 加水分解されて多くの単糖分子、ほとんどの場合グルコースを形成する炭水化物。
多糖類の式を導き出すには、グルコース分子から水分子を「取り去り」、インデックス n: (C6H10O5) n で式を書く必要があります。そして多糖類は自然界で形成されます。
自然界における炭水化物の役割と人間の生活にとっての重要性は非常に大きいです。 光合成の結果として植物細胞で形成され、動物細胞のエネルギー源として機能します。 まず第一に、これはグルコースに適用されます。
多くの炭水化物(でんぷん、グリコーゲン、スクロース)は、貯蔵機能、つまり栄養素の蓄えの役割を果たします。
いくつかの炭水化物(ペントース - リボースおよびデオキシリボース)を含むRNAおよびDNA酸は、遺伝情報を伝達する機能を果たします。
植物細胞の構成材料であるセルロースは、これらの細胞の膜のフレームワークの役割を果たします。 別の多糖類であるキチンは、一部の動物の細胞で同様の役割を果たし、節足動物 (甲殻類)、昆虫、およびクモ類の外骨格を形成します。
でんぷん質の穀物を食べても、でんぷんをタンパク質や脂肪に変換する動物に食べさせても、炭水化物は究極の栄養源です。 私たちの最も衛生的な衣類は、セルロースまたはそれをベースにした製品で作られています: コットンとリネン、ビスコース繊維、アセテートシルク。 木造住宅や家具は、木材を構成するのと同じパルプから作られています。 写真とフィルムの製造の中心にあるのは、今でも同じセルロースです。 本、新聞、手紙、紙幣 - これらはすべて紙パルプ産業の製品です。 これは、炭水化物が私たちの生活に必要なすべてのものを提供することを意味します: 食べ物、衣類、住居.
さらに、炭水化物は複雑なタンパク質、酵素、ホルモンの構築に関与しています。 炭水化物は、ヘパリン(重要な役割を果たします-血液凝固を防ぎます)、寒天(海藻から得られ、微生物学および製菓業界で使用されます-有名な鳥のミルクケーキを思い出してください)などの重要な物質でもあります.
地球上の唯一のエネルギー源(もちろん核以外)は太陽のエネルギーであり、すべての生物の生命活動を確実にするためにそれを蓄積する唯一の方法は光合成のプロセスであることを強調する必要があります。生きた植物の細胞内に存在し、水と二酸化炭素から炭水化物を合成します。 ちなみに、酸素が形成されるのはこの変化の最中であり、それなしでは地球上の生命は不可能です。
光合成
6С02 + 6Н20 ------> С6Н1206 + 602
炭水化物
炭水化物の種類.
炭水化物は次のとおりです。
1) 単糖類
2) オリゴ糖
3) 複合炭水化物
でんぷん12.jpg
主な機能。
エネルギー。
プラスチック。
栄養素の補給。
明確な。
保護。
規制。
化学的特性
単糖類は、アルコールやカルボニル化合物の性質を示します。
酸化。
a) すべてのアルデヒドと同様に、単糖の酸化により、対応する酸が生成されます。 そのため、グルコースが水酸化銀のアンモニア溶液で酸化されると、グルコン酸が形成されます (「銀の鏡」反応)。
b) 単糖類と水酸化銅との加熱による反応も、アルドン酸につながります。
c) より強力な酸化剤は、アルデヒド基だけでなく、第一級アルコール基もカルボキシル基に酸化し、二塩基性糖 (アルダル) 酸をもたらします。 通常、この酸化には濃硝酸が使用されます。
回復。
糖の還元は多価アルコールにつながります。 還元剤としては、ニッケル存在下の水素、水素化アルミニウムリチウムなどが用いられます。
III. 特定の反応
上記に加えて、グルコースはいくつかの特定の特性、つまり発酵プロセスによっても特徴付けられます。 発酵とは、酵素(酵素)の影響下で糖分子を分解することです。 3 の倍数の炭素原子を持つ糖が発酵されます。 発酵には多くの種類がありますが、その中で最も有名なものは次のとおりです。
a) アルコール発酵
b) 乳酸発酵
c) 酪酸発酵
微生物によって引き起こされる言及されたタイプの発酵は、広く実用的に重要です。 たとえば、アルコール - ワイン製造、醸造などにおけるエチルアルコールの製造用、乳酸および発酵乳製品の製造用の乳酸。
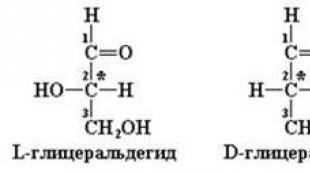
3. 単糖 D および L シリーズの立体異性。 開式と循環式。 ピラノーゼとフラノーゼ。 α-およびβ-アノマー。 シクロチェーン互変異性。 ムローテーション現象。
偏光の偏光面を右または左に回転させる多くの有機化合物の能力は、光学活性と呼ばれます。 以上のことから、有機物質は右旋性異性体と左旋性異性体の形で存在し得るということになる。 そのような異性体は立体異性体と呼ばれ、立体異性の現象そのものです。
立体異性体の分類と指定のより厳密なシステムは、光の偏光面の回転ではなく、立体異性体分子の絶対配置に基づいています。 不斉炭素原子またはキラル中心と呼ばれる、中心に局在する炭素原子の周りの四面体の頂点に位置する 4 つの必然的に異なる置換基の相互配置。 キラルまたは光学活性炭素原子とも呼ばれ、構造式ではアスタリスクで示されます。 

したがって、立体異性という用語は、同じ構造式を有し、同じ化学的性質を有する化合物における置換基の異なる空間配置として理解されるべきである。 このタイプの異性はミラー異性とも呼ばれます。 ミラー異性の良い例は、左右の手のひらです。 以下は、グリセルアルデヒドとグルコースの立体異性体の構造式です。
グリセルアルデヒドの射影式の不斉炭素原子の右側にOH基がある場合、この異性体はD-立体異性体と呼ばれ、OH基が左側にある場合、L-立体異性体と呼ばれます。
テトロース、ペントース、ヘキソース、および 2 つ以上の不斉炭素原子を持つ他のモノースの場合、立体異性体が D または L シリーズに属するかどうかは、最後から 2 番目の炭素原子の OH 基の位置によって決まります。 chain - 最後の不斉原子でもあります。 たとえば、グルコースの場合、5 番目の炭素原子の OH 基の方向が評価されます。 絶対ミラー立体異性体は呼ばれます エナンチオマーまたは対蹠地。
立体異性体は、化学的性質は異なりませんが、生物学的作用 (生物活性) が異なります。 哺乳動物の体内の単糖類のほとんどは D シリーズに属します。代謝に関与する酵素が特異的であるのは、この構成です。 特に、D-グルコースは、舌の味蕾と相互作用する能力があるため、甘い物質として知覚されますが、L-グルコースは、その構成が味蕾によって知覚されないため、無味です.
一般に、アルドースとケトーシスの構造は次のように表すことができます。

立体異性。単糖分子にはいくつかのキラリティー中心が含まれています。これが、同じ構造式に対応する多くの立体異性体が存在する理由です。 たとえば、アルドヘキソースは 4 つの不斉炭素原子を持ち、16 の立体異性体 (24)、つまり 8 対のエナンチオマーに対応します。 対応するアルドースと比較して、ケトヘキソースはキラル炭素原子が 1 つ少ないため、立体異性体 (23) の数は 8 (4 対のエナンチオマー) に減少します。
オープン (非循環)単糖の形態は、フィッシャー射影式の形で表されます。 それらの炭素鎖は縦に書かれています。 アルドースでは、アルデヒド基が一番上に配置され、ケトースでは第一級アルコール基がカルボニル基に隣接しています。 これらのグループからチェーンの番号付けが始まります。
D,L システムは、立体化学を表すために使用されます。 DシリーズまたはLシリーズへの単糖の割り当ては、他の中心の配置に関係なく、オキソ基から最も離れたキラル中心の配置に従って実行されます! ペントースの場合、そのような「定義」中心は C-4 原子であり、ヘキソースの場合は C-5 です。 右側のキラリティーの最後の中心にある OH 基の位置は、単糖が D シリーズ、左側の L シリーズに属していることを示しています。つまり、立体化学標準との類推により、グリセルアルデヒド
循環フォーム。単糖のオープン フォームは、立体異性単糖間の空間的関係を考慮するのに便利です。 実際、単糖は構造的に環状ヘミアセタールです。 単糖の環状形態の形成は、単糖分子に含まれるカルボニル基とヒドロキシル基の分子内相互作用の結果として表すことができます。

初めて、グルコースの環状ヘミアセタール式が A. A. Colli (1870) によって提案されました。 彼は、3 員環のエチレンオキシド (α-オキシド) サイクルの存在により、グルコースにいくつかのアルデヒド反応が存在しないことを説明しました。

後に Tollens (1883) は、グルコースに対して同様のヘミアセタール式を提案しましたが、5 員 (γ-オキシド) ブチレンオキシド環を使用しています。

Colley-Tollens 式は扱いにくく不便であり、環状グルコースの構造を反映していないため、Haworth 式が提案されました。
環化の結果、熱力学的により安定な化合物が形成されます。 フラノセ(五員環)と ピラノース(六員環)です。サイクルの名前は、関連する複素環式化合物の名前であるフランとピランに由来します。

これらのサイクルの形成は、単糖類の炭素鎖がかなり好ましい爪のような立体配座をとる能力に関連しています。 その結果、アルデヒド(またはケトン)とC-4(またはC-5)基のヒドロキシルは、分子内環化が起こる相互作用の結果として、空間的に近い、つまりこれらの官能基になります。
環状形態では、キラリティーの追加の中心が作成されます - 以前はカルボニル基の一部であった炭素原子です (アルドースの場合、これは C-1 です)。 この原子はアノマーと呼ばれ、対応する 2 つの立体異性体は α-およびβ-アノマー(図 11.1)。 アノマーはエピマーの特殊なケースです。
α-アノマーでは、アノマー中心の立体配置は「末端」キラル中心の立体配置と同じであり、これにより d 系列または l 系列に属することが決定されますが、β アノマーでは反対です。 投影中 フィッシャー式α-アノマーの d シリーズの単糖類では、グリコシド基 OH は炭素鎖の右側にあり、β-アノマーでは左側にあります。

米。 11.1. d-グルコースの例におけるα-およびβ-アノマーの形成
ハワース式。単糖類の環状形態はハワースの遠近法の式として描かれており、その中で環状は図面の平面に垂直に横たわる平らな多角形として示されている。 酸素原子は、環面の後ろにあるフラノース環の右端隅にあるピラノース環にあります。 サイクル内の炭素原子の記号は示していません。

ハワースの式に移ると、フィッシャーの環状式は、サイクルの酸素原子がサイクルに含まれる炭素原子と同じ直線上に位置するように変換されます。 これは、C-5 原子での 2 つの順列による a-d-グルコピラノースについて以下に示されていますが、これはこの非対称中心の配置を変更しません (7.1.2 を参照)。 変換されたフィッシャーの式を水平方向に配置すると、ハワースの式を記述する規則に従って、炭素鎖の垂直線の右側にある置換基はサイクルの面の下になり、左側の置換基は上になります。この飛行機。

ピラノース型の d-アルドヘキソース (およびフラノース型の d-アルドペントース) では、CH2OH 基は常に環平面の上に位置し、これが d シリーズの正式な特徴として機能します。 d-アルドースのα-アノマーのグリコシドヒドロキシル基は、サイクルの面の下にあり、β-アノマーでは面の上にあります。
D-グルコピラノース
同様の規則に従って、変換はケトースに対して実行されます。これは、d-フルクトースのフラノース型のアノマーの 1 つの例を使用して以下に示されます。

シクロチェーン互変異性単糖類の開放型から環状型への遷移、およびその逆の遷移によるものです。
炭水化物の溶液による光の偏光面の回転角の時間変化は、 ミュータローテーション。
ミュータローテーションの化学的本質は、単糖類が互変異性体の平衡混合物 - 開いた形と環状の形 - として存在する能力です。 このタイプの互変異性は、シクロオキソ互変異性と呼ばれます。
溶液では、単糖の 4 つの環状互変異性体間の平衡は、開いた形 (オキソ形) によって確立されます。 α-アノマーとβ-アノマーが中間オキソ型を介して相互変換されることを、 アノマー化。
したがって、d-グルコースは互変異性体の形で溶液中に存在します: オキソ形と、ピラノースおよびフラノース環状形のα-およびβ-アノマー。

ラクチム-ラクタム互変異性
このタイプの互変異性は、N=C-OH 部分を持つ窒素含有複素環の特徴です。
互変異性体の相互変換は、フェノール性 OH 基に似たヒドロキシル基から主中心であるピリジン窒素原子へのプロトンの移動、およびその逆に関連しています。 通常、平衡状態ではラクタム型が優勢です。

モノアミノモノカルボン酸。
ラジカルの極性によると:
非極性ラジカル: (アラニン、バリン、ロイシン、フェニルアラニン) モノアミノ、モノカルボン酸
極性の無電荷ラジカル (グリシン、セリン、アスパラギン、グルタミン)
負に帯電したラジカル (アスパラギン酸、グルタミン酸) を持つモノアミノ、ジカルボン酸
正に荷電したラジカル (リジン、ヒスチジン) ジアミノ、モノカルボン酸
立体異性
グリシン (NH 2 -CH 2 -COOH) を除くすべての天然の α-アミノ酸は、不斉炭素原子 (α-炭素原子) を持ち、それらのいくつかは、たとえばスレオニンのように 2 つのキラル中心を持っています。 したがって、すべてのアミノ酸は、不適合なミラー対蹠 (エナンチオマー) のペアとして存在できます。
α-アミノ酸の構造を比較するのが通例である最初の化合物については、D-およびL-乳酸が条件付きで取られ、その配置はD-およびL-グリセロールアルデヒドによって確立されます。
グリセルアルデヒドからα-アミノ酸への移行中にこれらの一連の変換が行われるすべての変換は、主な要件に従って実行されます-それらは非対称中心で新しい結合を作成せず、古い結合を切断しません.
α-アミノ酸の立体配置を決定するために、セリン(アラニンの場合もある)がリファレンスとしてよく使用されます。
タンパク質を構成する天然アミノ酸はLシリーズに属します。 アミノ酸の D 型は比較的まれで、微生物によってのみ合成され、「非天然」アミノ酸と呼ばれます。 D-アミノ酸は動物に吸収されません。 味覚受容体に対する D- および L- アミノ酸の影響に注目するのは興味深いことです。ほとんどの L シリーズ アミノ酸は甘味がありますが、D シリーズ アミノ酸は苦味または無味です。
酵素の関与がなければ、等モル混合物 (ラセミ混合物) の形成を伴う L 異性体から D 異性体への自発的な転移が十分に長い時間にわたって起こります。
特定の温度での各 L 酸のラセミ化は、特定の速度で進行します。 この状況は、人や動物の年齢を判断するために使用できます。 したがって、たとえば、歯の硬いエナメル質には象牙質タンパク質があり、L-アスパラギン酸は人体の温度で年間0.01%の割合でD-異性体に移行します. 歯が形成される期間中、象牙質には L 異性体のみが含まれているため、D-アスパラギン酸の含有量から人や動物の年齢を計算できます。
I. 一般特性
1.分子内中和→ バイポーラ双性イオンが形成されます。
水溶液は導電性です。 これらの特性は、アミノ酸分子が内部塩の形で存在するという事実によって説明されます。内部塩は、カルボキシル基からアミノ基へのプロトンの移動によって形成されます。
両性イオン
アミノ酸の水溶液は、官能基の数に応じて、中性、酸性、またはアルカリ性の環境になります。
2.重縮合→ ポリペプチド (タンパク質) が形成されます。

2つのα-アミノ酸の相互作用により、 ジペプチド.
3.分解→ アミン + 二酸化炭素:
NH 2 -CH 2 -COOH → NH 2 -CH 3 + CO 2
IV. 定性的反応
1. すべてのアミノ酸はニンヒドリンによって酸化され、青紫色の生成物を形成します!
2. 重金属イオン入りα-アミノ酸は錯体内塩を形成します。 α-アミノ酸の検出には、濃い青色の銅(II)錯体が使用されます。

生理活性ペプチド。 例。
高い生理活性を持つペプチドは、さまざまな生物学的プロセスを調節します。 生体調節作用によると、ペプチドは通常いくつかのグループに分けられます。
ホルモン活性のある化合物(グルカゴン、オキシトシン、バソプレシンなど);
消化プロセスを調節する物質(ガストリン、胃抑制ペプチドなど);
食欲を調節するペプチド(エンドルフィン、ニューロペプチド-Y、レプチンなど);
鎮痛効果のある化合物(オピオイドペプチド);
高次神経活動、記憶のメカニズムに関連する生化学的プロセス、学習、恐怖感の出現、怒りなどを調節する有機物質。
血圧や血管緊張を調節するペプチド(アンギオテンシンII、ブラジキニンなど)。
抗腫瘍および抗炎症特性を持つペプチド(ルナシン)
ニューロペプチド - シグナル伝達特性を持つニューロンで合成される化合物
タンパク質の分類
-分子の形に合わせて(球状または繊維状);
-分子量による(低分子量、高分子量など);
-化学構造による (非タンパク質部分の有無);
-セル内の位置によって(核、細胞質、リソソームなど);
-体内の局在化によって(血液タンパク質、肝臓、心臓など);
-可能であれば、これらのタンパク質の量を適応的に調節する: 一定の速度で合成されるタンパク質 (構成的) と、環境要因によって合成が促進されるタンパク質 (誘導性)。
-細胞の寿命(T 1/2 が 1 時間未満の非常に速く再生するタンパク質から、T 1/2 が数週間または数か月で計算される非常にゆっくりと再生するタンパク質まで);
-一次構造と関連機能の類似領域による(タンパク質ファミリー)。
化学構造によるタンパク質の分類
単純なタンパク質タンパク質の中には、アミノ酸残基からなるポリペプチド鎖のみを含むものがあります。 それらは「単純タンパク質」と呼ばれます。 単純なタンパク質の例 - ヒストン; それらは多くのアミノ酸残基を含んでいます リジンとアルギニン、そのラジカルは正電荷を持っています.
2. 複合タンパク質 . 多くのタンパク質は、ポリペプチド鎖に加えて、弱い結合または共有結合によってタンパク質に結合している非タンパク質部分を含んでいます。 非タンパク質部分は、金属イオン、低分子量または高分子量の有機分子で表すことができます。 そのようなタンパク質は「複合タンパク質」と呼ばれます。 タンパク質にしっかりと結合している非タンパク質部分は、補欠分子族と呼ばれます。
高分子が極性基と非極性基で構成される生体高分子では、溶媒が極性の場合、極性基が溶媒和されます。 非極性溶媒では、対応して高分子の非極性領域が溶媒和される。
通常、化学構造が近い液体ではよく膨潤します。 そのため、ゴムなどの炭化水素ポリマーは、非極性液体 (ヘキサン、ベンゼン) で膨潤します。 分子が多数の極性官能基 (タンパク質、多糖類など) を含むバイオポリマーは、極性溶媒 (水、アルコールなど) でよく膨潤します。
ポリマー分子の溶媒和シェルの形成には、エネルギーの放出が伴います。 腫れの熱.
腫れの熱物質の性質によります。 多量の極性基を含む極性溶媒HMCで膨潤すると最大になり、炭化水素ポリマーの非極性溶媒で膨潤すると最小になります。
正電荷と負電荷が等しくなり、タンパク質が活性化する環境の酸性度。 等電点 (IEP) と呼ばれる電気的に中性の. IETが酸性環境にあるタンパク質は、酸性と呼ばれます。 IEP 値がアルカリ性環境にあるタンパク質は、塩基性と呼ばれます。 ほとんどの植物タンパク質は、わずかに酸性の環境で IEP を持っています。
. IUD の膨張と溶解は、以下に依存します。
1. 溶媒とポリマーの性質、
2.高分子高分子の構造、
3.温度、
4. 電解質の存在
5.
媒体の pH について (高分子電解質の場合)。
2,3-ジホスホグリセレートの役割
2,3-ジホスホグリセリン酸は、解糖系の中間代謝産物である 1,3-ジホスホグリセリン酸から赤血球内で、と呼ばれる反応で形成されます。 ラポポートシャント。

ラポポートシャント反応
2,3-ジホスホグリセレートは、デオキシヘモグロビン四量体の中央の空洞に位置し、β鎖に結合して、2,3-ジホスホグリセレートの酸素原子と両方のβ鎖の末端バリンのアミノ基の間に横断塩橋を形成します、およびラジカルのアミノ基 リジンとヒスチジン。

ヘモグロビン中の 2,3-ジホスホグリセレートの位置
2,3-ジホスホグリセレートの機能は、 親和性の低下ヘモグロビンを酸素に。 これは、吸入空気中の酸素が不足している高さに登るときに特に重要です。 これらの条件下では、酸素の濃度が比較的高いため、肺のヘモグロビンへの酸素の結合は妨げられません。 ただし、2,3-ジホスホグリセレートによる組織では、酸素放出が増加します 2回。
炭水化物。 分類。 機能
炭水化物- 炭素 (C)、水素 (H)、酸素 (O2) からなる有機化合物を呼びます。 このような炭水化物の一般式は Cn(H2O)m です。 例はグルコース (C6H12O6) です。
化学的な観点から、炭水化物は、いくつかの炭素原子の直鎖、カルボニル基 (C=O)、およびいくつかのヒドロキシル基 (OH) を含む有機物質です。
人体では、炭水化物は少量しか生成されないため、ほとんどが食物とともに体内に入ります。
炭水化物の種類.
炭水化物は次のとおりです。
1) 単糖類(炭水化物の最も単純な形態)
グルコース C6H12O6 (私たちの体の主な燃料)
フルクトース C6H12O6 (最も甘い炭水化物)
リボース C5H10O5 (核酸の一部)
赤血球症 C4H8O4 (炭水化物の分解における中間体)
2) オリゴ糖(2 ~ 10 個の単糖残基を含む)
スクロース С12Н22О11 (グルコース + フルクトース、または単に - 砂糖)
ラクトース C12H22O11(乳糖)
マルトース C12H24O12 (麦芽糖、結合した 2 つのグルコース残基からなる)
110516_1305537009_シュガーキューブ.jpg
3) 複合炭水化物(多数のグルコース単位からなる)
でんぷん (C6H10O5) n (食事の最も重要な炭水化物成分で、人は炭水化物からでんぷんの約 80% を消費します。)
グリコーゲン(体のエネルギー貯蔵、過剰なブドウ糖が血液に入ると、グリコーゲンの形で体内に蓄えられます)
でんぷん12.jpg
4) 食物繊維として定義される、繊維質または難消化性の炭水化物。
セルロース(地球上で最も一般的な有機物質であり、繊維の一種)
簡単な分類によると、炭水化物は単純なものと複雑なものに分けることができます。 単純なものには、単糖類とオリゴ糖、複合多糖類と繊維が含まれます。
主な機能。
エネルギー。
炭水化物は主要なエネルギー物質です。 炭水化物が分解されると、放出されたエネルギーは熱の形で放散されるか、ATP 分子に蓄えられます。 炭水化物は、身体の 1 日のエネルギー消費量の約 50 ~ 60% を提供し、筋持久力活動中は最大 70% を提供します。 炭水化物1gを酸化すると、17kJ(4.1kcal)のエネルギーが放出されます。 体内の主なエネルギー源として、遊離ブドウ糖またはグリコーゲンの形で貯蔵された炭水化物が使用されます。 それは脳の主要なエネルギー基質です。
プラスチック。
炭水化物 (リボース、デオキシリボース) は、ATP、ADP、その他のヌクレオチド、および核酸を構築するために使用されます。 それらはいくつかの酵素の一部です。 個々の炭水化物は、細胞膜の構成成分です。 グルコース変換の生成物 (グルクロン酸、グルコサミンなど) は、軟骨および他の組織の多糖類および複合タンパク質の一部です。
栄養素の補給。
炭水化物は、グリコーゲンの形で骨格筋、肝臓、およびその他の組織に保存 (保存) されます。 体系的な筋肉活動は、体のエネルギー容量を増加させるグリコーゲン貯蔵の増加につながります.
明確な。
個々の炭水化物は、血液型の特異性を確保することに関与し、抗凝固剤の役割を果たし(凝固を引き起こします)、一連のホルモンまたは薬理学的物質の受容体となり、抗腫瘍効果を発揮します。
保護。
複合炭水化物は免疫系の構成要素の一部です。 ムコ多糖類は、鼻、気管支、消化管、尿路の血管の表面を覆い、細菌やウイルスの侵入や機械的損傷から保護する粘液物質に含まれています。
規制。
食物繊維は腸内で分解するプロセスには役立ちませんが、消化管で使用される酵素である腸管の蠕動運動を活性化し、栄養素の消化と吸収を改善します。
意味
炭水化物 C$_n$(H$_2$O)$_m$ の組成を持つ天然化合物です。 例外はデオキシリボース C$_5$H$_(10)$O$_4$ です。
分子式 C$_n$(H$_2$O)$_m$ は、他のクラスの化合物も表すことができることに注意してください。
炭水化物はすべての生物の一部であり、植物の乾燥質量の約 80% を占め、多糖セルロースは地球上で最も一般的な有機物質です。
植物や動物では、炭水化物はさまざまな機能を果たします。炭水化物はエネルギー源として機能し、植物細胞壁の「建築材料」であり、哺乳動物の保護特性を決定します (タンパク質とともに)。 炭水化物は、紙、人工繊維、爆発物などの製造の出発原料として機能します。多くの炭水化物は医薬品に使用されます。
最も有名な炭水化物の中で、次のものを区別することができます (図は、炭水化物の構造式とそのソース (「a」、「b」、「c」) またはその用途 (「d」) を示しています)。
a) グルコース - 単糖、ブドウ糖。

b) スクロース- 二糖類、きび砂糖。


の) デンプン - 植物細胞の主要な栄養素である光合成中の光の影響下で、葉緑体のさまざまな植物によって合成される多糖類。


G) セルロース - すべての高等植物の細胞膜の主成分である多糖類。


炭水化物の分類。
歴史的に、炭水化物には非常に多様な構造の物質が含まれます - わずか数個の炭素原子 (ほとんどの場合 5 または 6) から構成される低分子量から、分子量が数百万のポリマーまでです。
後者は、 多糖類、完全な加水分解の結果として、それらはより単純な化合物を形成します - 単糖類. 中間グループは オリゴ糖、比較的少数のモノマー単位を含みます。
定義 1
単糖類 - モノマー、その残基はより複雑な構造の炭水化物です。 単糖類は加水分解を受けません。
定義 2
オリゴ糖 – 2 ~ 10 個の単糖残基を含むオリゴマー。
定義 3
多糖類 - 最大数千の単糖単位を含むポリマー
単糖類 (例えば、グルコース、フルクトース、ガラクトースなど) は、構造の問題が他のクラスの化合物よりも重要な物質のグループに属しています。 したがって、単糖類は次のように分類できます。
I. 鎖中の炭素原子の数による
トリオース - 3 つの炭素
テトロース - 鎖内の 4 つの炭素原子
ペントース - 鎖内の 5 つの炭素原子
ヘキソース - 鎖の 6 つの炭素
Ⅱ. カルボニル基の種類による
アルドース - アルデヒド基 ($-C(O)H$) を含む
ケトース - ケト基 ($-C(O)-$) を含む
III. 最後のキラル炭素原子の配置によると
Dシリーズ炭水化物
L系炭水化物
単糖の多様性は、主に立体化学の違いによるものです。 たとえば、ペントースまたはヘキソース分子には 2 ~ 4 個のキラル (不斉) 炭素原子が含まれているため、いくつかの異性体は同じ構造式に対応します。
意味
キラル (また 非対称 ) 炭素原子 - $sp^3$-ハイブリダイゼーションの炭素原子。 4人の異なる議員. キラルな炭素原子 (キラル中心) を持つ化合物は、光学活性を持っています。 溶液中の物質が偏光面を回転させる能力。
単糖の空間構造を指定するために、D、L-システムが歴史的に使用されてきました。
右側のキラリティーの最後の中心にあるヒドロキシル基の位置は、単糖が D シリーズ、左側の L シリーズに属していることを示しています。
レッスンのトピック: 「炭水化物」 人道的方向の11年生のために目標:
教育的:
炭水化物、その組成と分類に関する生徒の知識を形成する。 炭水化物の化学的性質が分子の構造に依存していることを考えてみましょう。 グルコースとデンプンの定性的反応。 炭水化物の生物学的役割、人間の生活におけるそれらの重要性についての考えを与えること。
現像:
既存の知識を新たに獲得した知識と結びつける能力、研究された資料の主なものを強調する能力、研究された資料を一般化して結論を引き出す能力。
教育的:
学習に対する責任ある態度の教育、創造的で認知的な活動への欲求。
タイプ: 新しい教材を学ぶ
意見: 講義
方法 : コンピュータのサポートによる説明と実例
レッスンプラン
1.組織の瞬間
2. 授業の動機
炭水化物は重要な栄養源です。私たちは穀物を食べたり、動物に食べさせたりします。動物の体内でデンプンがタンパク質や脂肪に変換されます。 最も衛生的な衣類は、セルロースまたはそれをベースにした製品で作られています。綿とリネン、ビスコース繊維、アセテートシルクです。 木造住宅や家具は、木材を構成するのと同じパルプから作られています。 写真とフィルムの製造の中心にあるのは、今でも同じセルロースです。 本、新聞、紙幣はすべて紙パルプ産業の製品です。 つまり、炭水化物は私たちに必要なものすべてを提供してくれます。
さらに、炭水化物は複雑なタンパク質、酵素、ホルモンの構築に関与しています。 炭水化物は、ヘパリン(重要な役割を果たします-血液凝固を防ぎます)、寒天(海藻から得られ、微生物学および製菓産業で使用されます)などの重要な物質でもあります.
地球上の唯一のエネルギー源(核以外)は太陽のエネルギーであり、すべての生物の生命活動を確保するためにそれを蓄積する唯一の方法は、植物細胞で行われ、光合成につながる光合成のプロセスです。水と二酸化炭素から炭水化物を合成。 ちなみに、酸素が形成されるのはこの変化の最中であり、それなしでは地球上の生命は不可能です。
講義計画
1.炭水化物の概念。 炭水化物の分類。
2. 単糖類
3. 二糖類
4. 多糖類
1. 炭水化物の概念。 炭水化物の分類。
炭水化物- 人間、動物、植物の生活に重要な役割を果たす天然化合物の広範なクラス .
これらの化合物は、それらの多くの組成が一般式 Cn (H 2 O ) m で表されるため、「炭水化物」という名前が付けられました。 正式には、それらは炭素と水の化合物です。 炭水化物化学の発展に伴い、組成が上記の式に対応しないが、そのクラスの物質の特性を持つ化合物が発見されました(たとえば、デオキシリボースC 5 H 10 O 4)。 同時に、炭水化物の一般式に対応するが、その特性を示さない物質があります(たとえば、イノシトールC 6 H 12 O 6アルコール)。
炭水化物の分類
すべての炭水化物は、次の 2 つのグループに分けることができます。 単純炭水化物(単糖類)と複合炭水化物です。
単純炭水化物(単糖類)より単純な炭水化物を形成するために加水分解されない最も単純な炭水化物です。
複合炭水化物- これらは炭水化物であり、その分子は 2 つ以上の単糖残基で構成され、加水分解中にこれらの単糖に分解されます。
2. 単糖類
単糖類は複合機能を持つ化合物です。 それらには、アルデヒドまたはケト基といくつかのヒドロキシル基が含まれています。 それは アルデヒドアルコールまたはケトアルコール.
アルデヒド基を持つ単糖は呼ばれます アルドース、そしてケトグループと - ケトーシス。
分子内の炭素原子の数に応じて、単糖は次のように分類されます。 テトロース、ペントース、ヘキソース等
ヘキソースとペントースは最も重要な単糖です。
単糖の構造
射影射影は、単糖の構造を表すために使用されます。 フィッシャーの公式。フィッシャーの式では、炭素原子の鎖は 1 つの鎖の中にあります。 鎖の番号付けは、アルデヒド基の原子 (アルドースの場合) またはケト基がより近くに位置する極端な炭素原子 (ケトースの場合) から始まります。
ペントースでは 4 番目の炭素原子、ヘキソースでは 5 番目の炭素原子の H 原子と OH 基の空間配置に応じて、単糖は D - または L - シリーズに割り当てられます。
これらの原子の OH 基が鎖の右側にある場合、単糖は D シリーズとして分類されます。
天然に存在するほとんどすべての単糖は D シリーズに属します。
ただし、単糖類は環状の形で存在することもあります。 ヘキソースおよびペントースの環状形態は、それぞれピラノースおよびフラノースと呼ばれます。
単糖類の溶液では、非環式と環式の間で可動平衡が確立されます - 互変異性。
周期的なフォームは通常描かれています 有望なハワース式。
単糖の環状形態では、不斉炭素原子が現れます (アルドースでは C-1、ケトースでは C-2)。 この炭素原子は アノマー。アノマー原子のOH基が平面の下にある場合、α-アノマーが形成され、反対の配置ではβ-アノマーが形成されます。
物理的特性
無色の結晶性物質で、味が甘く、水によく溶け、アルコールに溶けにくい。 単糖の甘さはさまざま。 例えば、果糖はブドウ糖の3倍の甘さです。
(スライド 8 ~ 12)
化学的特性
単糖類の化学的性質は、その構造の特異性によるものです。
例としてグルコースの化学的性質を考えてみましょう。
1. グルコースのアルデヒド基が関与する反応
a) 回収(水素化)多価アルコールソルビトールの形成を伴う
CH=O CH 2 OH
│ kat , t 0 │
(CHOH) 4 + H 2 → (CHOH) 4
CH 2 OH CH 2 OH
b) 酸化
「銀鏡」反応(酸化銀のアンモニア溶液と、t 0 ),
水酸化銅との反応(Ⅱ ) 銅 (おー ) 2 アルカリ性の環境でt 0 )
CH=OCOOH
│ NH 4 OH、t 0 │
(CHOH) 4 + Ag 2 O → (CHOH) 4
CH 2 OH CH 2 OH
酸化生成物はグルコン酸です(この酸の塩はグルコン酸カルシウムであり、よく知られた薬です).
CH=OCOOH
│ t0 │
(CHOH) 4 + 2Cu(OH) 2 → (CHOH) 4 + Cu 2 O↓ + 2H 2 O
│ ブルー │ ブリックレッド
CH 2 OH CH 2 OH
これらの反応は、アルデヒドとしてのグルコースの定性的なものです。
強力な酸化剤(例えば、硝酸)の作用下で、二塩基性グルカル酸が形成されます。
CH=OCOOH
│ t0 │
(CHOH) 4 + HNO 3 → (CHOH) 4
CH2OHCOOH
2. 水酸基が関与するグルコースの反応(すなわち、多価アルコールとしてのグルコースの性質)
a) 交流 銅 (おー ) 2 寒い中グルコン酸銅(II)の形成 - 多価アルコールとしてのグルコースの定性的反応。
3. 単糖類の発酵(醗酵)
a) アルコール発酵
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2
b) 酪酸発酵
C 6 H 12 O 6 → CH 3 ─CH 2 ─CH 2 ─COOH + 2H 2 + 2CO 2
の) 乳酸発酵
C 6 H 12 O 6 → 2CH 3 ─ CH ─ COOH
彼
グルコースの生物学的役割
D-グルコース (ブドウ糖) は自然界に広く分布しており、ブドウやその他の果物、蜂蜜に含まれています。 動物の血液や組織の必須成分であり、細胞反応の直接的なエネルギー源です。 人間の血液中のブドウ糖のレベルは一定で、0.08 ~ 0.11% の範囲にあります。 成人の全血液量には 5 ~ 6 g のブドウ糖が含まれています。 この量は、15 分間の体のエネルギー コストをカバーするのに十分です。 彼の人生活動。 たとえば、真性糖尿病などの一部の病状では、血糖値が上昇し、その過剰分が尿中に排泄されます。 同時に、尿中のブドウ糖の量は、通常の 0.1% に対して最大 12% 増加する可能性があります。
3. 二糖類
(スライド 13.)
二糖類 - 2 つの単糖の縮合生成物。
最も重要な天然の代表:スクロース(サトウキビまたはてんさい糖)、マルトース(麦芽糖)、ラクトース(乳糖)、セロビオース。 それらはすべて同じ実験式 C 12 H 22 O 11 を持っています。 異性体です。
二糖類は典型的な砂糖のような炭水化物です。 これらは、甘味のある固体の結晶性物質です。
(スライド 14-15)
構造
1. 二糖分子は、1 つの単糖の 2 つの残基または異なる単糖の 2 つの残基を含む場合があります。
2. 単糖残基間で形成される結合には、次の 2 つのタイプがあります。
a) 両方の単糖分子のヘミアセタールヒドロキシルが結合形成に関与します。 たとえば、スクロース分子の形成。
b) 1 つの単糖のヘミアセタール ヒドロキシルと別の単糖のアルコール ヒドロキシルが結合の形成に関与します。 たとえば、マルトース、ラクトース、セロビオースの分子の形成。
(スライド 16-17)
二糖類の化学的性質
1. 分子内にヘミアセタールヒドロキシル (マルトース、ラクトース、セロビオース) が保存されている二糖類は、溶液中で部分的に開アルデヒド形態に変換され、アルデヒドに特徴的な反応、特に「シルバーミラー」反応に入り、水酸化銅(II)。 これらの二糖類は 復元中。
分子内にヘミアセタール ヒドロキシル (スクロース) がない二糖類は、開いたカルボニル基に入ることができません。 これらの二糖類は 非還元(Cu (OH) 2 および Ag 2 O を復元しないでください)。
2.すべての二糖類は多価アルコールであり、多価アルコールの特性によって特徴付けられ、多価アルコールへの定性的反応、つまり低温でのCu(OH)2との反応をもたらします。
3. すべての二糖類は加水分解されて単糖類を形成します。
H+、 t0
C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 + C 6 H 12 O 6
スクロース グルコース フルクトース
生物では、加水分解は酵素の作用で起こります。
4. 多糖類
(スライド 18 ~ 20)
多糖類- グリコシド結合によって連結された 10 から数十万の単糖残基 (通常はヘキソース) を含む、高分子の非糖様炭水化物。
最も重要な自然の代表者:デンプン、グリコーゲン、セルロース。 これらは天然高分子 (VMC) であり、その単量体はグルコースです。 それらの一般的な実験式は (C 6 H 10 O 5) n です。
スターチ- 無味無臭の白色の無定形粉末で、水に溶けにくく、熱湯でコロイド溶液を形成します。 デンプン高分子は、α-1,4-グリコシド結合によって結合された多数のα-グルコース残基から構築されます。
でんぷんは、アミロース (20 ~ 30%) とアミロペクチン (70 ~ 80%) の 2 つの部分で構成されています。
アミロース分子は、α-グルコース残基からなる非常に長い非分岐鎖です。 アミロースとは異なり、アミロペクチン分子は高度に分岐しています。
デンプンの化学的性質:
(スライド 21)
1. 加水分解
H 2 O、酵素
(C 6 H 10 O 5) n → (C 6 H 10 O 5) m → C 12 H 22 O 11 → n C 6 H 12 O 6
デンプン デキストリン マルトース グルコース
硫酸の触媒作用によるデンプンからグルコースへの変換反応は、1811 年にロシアの科学者 K. Kirchhoff によって発見されました。
2. デンプンへの定性的反応
(C 6 H 10 O 5) n + I 2 → 青紫色複合化合物。
加熱すると発色が消え(複合体が破壊され)、冷やすと再び発色します。
でんぷんは、植物の主要な予備栄養素である光合成の産物の 1 つです。 デンプン分子中のグルコース残基は非常にしっかりと結合していると同時に、酵素の作用で簡単に分離することができます. エネルギー源が必要になるとすぐに。
グリコーゲン動物の体内で合成されるでんぷんに相当する、つまり それは予備の多糖でもあり、その分子は多数のα-グルコース残基から構築されています。 グリコーゲンは主に肝臓と筋肉に存在します。
セルロースまたは繊維
植物細胞の主成分は植物で合成されます (木材では最大 60% のセルロース)。 純粋なセルロースは、無味無臭の白い繊維状物質で、水に不溶です。
セルロース分子は、β-1,4-グリコシド結合の形成によって接続されたβ-グルコース残基からなる長鎖です。
デンプン分子とは異なり、セルロースはフィラメントの形をした分岐していない分子のみで構成されています。 β-グルコース残基の形状により、コイル化が妨げられます。
セルロースは、人間やほとんどの動物の食品ではありません。 彼らの生物には、より強力なβ-1,4-グリコシド結合を分解する酵素はありません。
(スライド 22-23)
セルロースの化学的性質:
1. 加水分解
鉱酸または酵素の作用下で長時間加熱すると(反芻動物およびウサギの場合)、段階的な加水分解が発生します。
H 2 O
(C 6 H 10 O 5) n → y (C 6 H 10 O 5) x → n / 2 C 12 H 22 O 11 → n C 6 H 12 O 6
セロビオース セルロース β-グルコース
2. エステル形成
a) 無機酸との相互作用
b) 有機酸との相互作用
3.燃焼
(C 6 H 10 O 5) n + 6nO 2 → 6nCO 2 + 5nH 2 O
4. 空気が入らないセルロースの熱分解:
t0
(C 6 H 10 O 5) n → 木炭 + H 2 O + 揮発性有機物質
木材の不可欠な部分であるセルロースは、建設や大工仕事に使用されます。 燃料として; 紙、段ボール、エチルアルコールは木材から得られます。 繊維素材(綿、麻)の形で、セルロースは布地や糸の製造に使用されます。 セルロースエーテルは、ニトロワニス、プラスチック、医療用コロジオン、および人工繊維の製造に使用されます。
アルコール基によるグルコースの反応
グルコースは、カルボン酸またはその無水物と反応してエステルを形成します。 たとえば、無水酢酸の場合:
多価アルコールとして、グルコースは水酸化銅 (II) と反応して、銅 (II) グリコシドの明るい青色の溶液を形成します。
アルデヒド基に対するグルコースの反応
シルバーミラー反応:
アルカリ性媒体中で加熱した場合の水酸化銅(II)によるグルコースの酸化:
臭素水にさらされると、グルコースもグルコン酸に酸化されます。
硝酸によるグルコースの酸化は、二塩基性糖酸につながります。

グルコースの六価アルコールソルビトールへの還元:
ソルビトールは多くの果実や果物に含まれています。
3種類のブドウ糖発酵
さまざまな酵素によって
アルコール発酵:

乳酸発酵:

酪酸発酵:

二糖反応
鉱酸(H 2 SO 4、Hcl、H 2 CO 3)の存在下でのスクロースの加水分解:
「銀鏡」反応などのマルトースの酸化 (二糖類の還元):
多糖類の反応
酸または酵素の存在下でのデンプンの加水分解は、段階的に進行します。 さまざまな条件下で、デキストリン、マルトース、ブドウ糖など、さまざまな製品を区別できます。
でんぷんはヨウ素水溶液で青色に発色します。 加熱すると色が消え、冷やすと再び現れます。 デンプンヨウ素反応は、デンプンの定性的反応です。 デンプンヨウ化物は、デンプン分子の内部細管へのヨウ素の包接取り込みの化合物であると考えられています。
酸の存在下でのセルロースの加水分解:

濃硫酸の存在下での濃硝酸によるセルロースのニトロ化。 セルロースの 3 つの可能なニトロエステル (モノ、ジ、およびトリニトロエステル) のうち、硝酸の量と反応温度に応じて、そのうちの 1 つが優先的に形成されます。 たとえば、トリニトロセルロースの形成:
トリニトロセルロースと呼ばれる ピロキシリン無煙粉末の製造に使用されます。
酢酸および硫酸の存在下での無水酢酸との反応によるセルロースのアセチル化:
トリアセチルセルロースから人工繊維を得る - アセテート。
セルロースは、銅アンモニア試薬 (濃アンモニア中の (OH) 2 の溶液) に溶解します。 このような溶液を特殊な条件下で酸性化すると、セルロースがフィラメントの形で得られます。
これ - 銅繊維。
セルロースに対するアルカリと二硫化炭素の作用により、セルロースザンテートが形成されます。
このようなザンテートのアルカリ溶液から、セルロース繊維が得られます - ビスコース。
 |