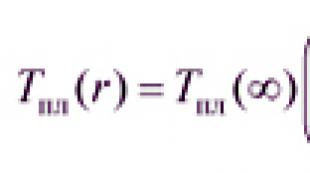راههای تنظیم فعالیت متابولیک در سلول. گهواره-آنزیم ها-هورمون ها. مفاهیم و اصطلاحات اساسی
بیوشیمی دینامیک
فصلIV.8.
متابولیسم و انرژی
متابولیسم یا متابولیسم - مجموعه ای از واکنش های شیمیایی در بدن که مواد و انرژی لازم برای زندگی را تامین می کند. در متابولیسم، دو مرحله اصلی قابل تشخیص است: آماده سازی - زمانی که ماده دریافت شده از طریق غذا دچار دگرگونی های شیمیایی می شود که در نتیجه می تواند وارد جریان خون شود و سپس به داخل سلول ها نفوذ کند و متابولیسم واقعی یعنی. تبدیل شیمیایی ترکیباتی که به سلول ها نفوذ کرده اند.
مسیر سوخت و ساز - این ماهیت و توالی دگرگونی های شیمیایی یک ماده خاص در بدن است. محصولات واسطه ای که در طی متابولیسم ایجاد می شوند، متابولیت نامیده می شوند و آخرین ترکیب مسیر متابولیک، محصول نهایی است.
فرآیند تجزیه مواد پیچیده به مواد ساده تر نامیده می شود کاتابولیسم بنابراین پروتئین ها، چربی ها، کربوهیدرات هایی که وارد غذا می شوند، تحت تأثیر آنزیم های دستگاه گوارش به اجزای ساده تری (اسیدهای آمینه، اسیدهای چرب و مونوساکاریدها) تجزیه می شوند. این باعث آزاد شدن انرژی می شود. فرآیند معکوس، یعنی سنتز ترکیبات پیچیده از ترکیبات ساده تر نامیده می شود آنابولیسم . با انرژی همراه است. از اسیدهای آمینه، اسیدهای چرب و مونوساکاریدهای تشکیل شده در نتیجه هضم، پروتئین های سلولی جدید، فسفولیپیدهای غشایی و پلی ساکاریدها در سلول ها سنتز می شوند.
یک مفهوم وجود دارد آمفیبولیسم هنگامی که یک ترکیب از بین می رود، اما دیگری سنتز می شود.
چرخه متابولیک یک مسیر متابولیک است که یکی از محصولات نهایی آن با یکی از ترکیبات دخیل در این فرآیند یکسان است.
مسیر متابولیک خصوصی مجموعه ای از دگرگونی های یک ترکیب خاص (کربوهیدرات ها یا پروتئین ها) است. مسیر متابولیک رایج زمانی است که دو یا چند نوع ترکیب درگیر می شوند (کربوهیدرات ها، لیپیدها و تا حدی پروتئین ها در متابولیسم انرژی نقش دارند).
بسترهای متابولیسم - ترکیبات ناشی از غذا در میان آنها مواد مغذی اصلی (پروتئین ها، کربوهیدرات ها، لیپیدها) و جزئی هستند که در مقادیر کم (ویتامین ها، مواد معدنی) وجود دارند.
شدت متابولیسم بر اساس نیاز سلول به مواد یا انرژی خاص تعیین می شود، تنظیم به چهار روش انجام می شود:
1) سرعت کل واکنش های یک مسیر متابولیک مشخص با غلظت هر یک از آنزیم های این مسیر، مقدار pH محیط، غلظت درون سلولی هر یک از محصولات میانی، غلظت کوفاکتورها و کوآنزیم ها تعیین می شود.
2) فعالیت آنزیم های تنظیم کننده (آلوستریک) که معمولاً مراحل اولیه مسیرهای متابولیک را کاتالیز می کنند. اکثر آنها توسط محصول نهایی این مسیر مهار می شوند و به این نوع بازداری "بازخورد" می گویند.
3) کنترل ژنتیکی که سرعت سنتز یک آنزیم خاص را تعیین می کند. یک مثال واضح، ظهور آنزیم های القایی در سلول در پاسخ به دریافت سوبسترای مربوطه است.
4) تنظیم هورمونی تعدادی از هورمون ها قادرند بسیاری از آنزیم های مسیرهای متابولیک را فعال یا مهار کنند.
موجودات زنده سیستم های ترمودینامیکی ناپایدار هستند. برای شکل گیری و عملکرد آنها، تامین مداوم انرژی به شکلی مناسب برای استفاده چند وجهی ضروری است. برای به دست آوردن انرژی، تقریباً تمام موجودات زنده روی این سیاره برای هیدرولیز یکی از پیوندهای پیروفسفات ATP سازگار شده اند. در این راستا، یکی از وظایف اصلی بیوانرژیک موجودات زنده، پر کردن ATP استفاده شده از ADP و AMP است.
منبع اصلی انرژی در سلول، اکسیداسیون بسترها با اکسیژن اتمسفر است. این فرآیند به سه روش انجام می شود: افزودن اکسیژن به اتم کربن، حذف هیدروژن یا از دست دادن یک الکترون. در سلول ها، اکسیداسیون به شکل انتقال متوالی هیدروژن و الکترون ها از بستر به اکسیژن انجام می شود. در این حالت، اکسیژن نقش یک ترکیب کاهنده (عامل اکسید کننده) را ایفا می کند. واکنشهای اکسیداتیو با آزاد شدن انرژی ادامه مییابند.تغییرات نسبتاً کوچک در انرژی از ویژگیهای واکنشهای بیولوژیکی است. این امر با تقسیم فرآیند اکسیداسیون به تعدادی از مراحل میانی به دست میآید که امکان ذخیره آن را در بخشهای کوچک به شکل ترکیبات ماکروارژیک (ATP) فراهم میکند. کاهش یک اتم اکسیژن در اثر برهمکنش با یک جفت پروتون و الکترون منجر به تشکیل یک مولکول آب می شود.
تنفس بافتی
این فرآیند مصرف اکسیژن توسط سلول های بافت های بدن است که در اکسیداسیون بیولوژیکی نقش دارد. این نوع اکسیداسیون نامیده می شود اکسیداسیون هوازی . اگر پذیرنده نهایی در زنجیره انتقال هیدروژن اکسیژن نباشد، بلکه مواد دیگر (مثلاً اسید پیروویک) باشد، این نوع اکسیداسیون نامیده می شود. بی هوازی.
که اکسیداسیون بیولوژیکی هیدروژن زدایی یک بستر با کمک حامل های هیدروژن میانی و پذیرنده نهایی آن است.
زنجیره تنفسی (آنزیم های تنفس بافتی) حامل پروتون ها و الکترون ها از بستر اکسید شده به اکسیژن هستند. یک عامل اکسید کننده ترکیبی است که قادر به پذیرش الکترون است. این توانایی کمی است پتانسیل ردوکس در رابطه با الکترود هیدروژن استاندارد که pH آن برابر با 7.0 است. هر چه پتانسیل این ترکیب کمتر باشد، خاصیت کاهشی آن قوی تر است و بالعکس.
که هر ترکیبی فقط می تواند به ترکیبی با پتانسیل ردوکس بالاتر الکترون بدهد. در زنجیره تنفسی، هر حلقه بعدی پتانسیل بالاتری نسبت به حلقه قبلی دارد.
زنجیره تنفسی از موارد زیر تشکیل شده است:
1. NAD - دهیدروژناز وابسته؛
2. دهیدروژناز وابسته به FAD؛
3. Ubiquinone (Ko Q);
4. سیتوکروم b , c , a + a 3 .
دهیدروژنازهای وابسته به NAD . حاوی کوآنزیم است در بالاو NADP. حلقه پیریدین نیکوتین آمید قادر به اتصال الکترون ها و پروتون های هیدروژن است.
دهیدروژنازهای وابسته به FAD و FMN حاوی به عنوان یک کوآنزیم استر فسفریک ویتامین B2 ( مد زودگذر).
یوبی کینون (شرکت س ) هیدروژن را از فلاووپروتئین ها می گیرد و تبدیل می شود هیدروکینون.
سیتوکروم ها - پروتئین های کروموپروتئینی به دلیل وجود پورفیرین های آهن به عنوان گروه های مصنوعی در ترکیب آنها قادر به اتصال الکترون ها هستند. آنها یک الکترون را از یک عامل کاهنده کمی قویتر میپذیرند و آن را به یک عامل اکسید کننده قویتر اهدا میکنند. اتم آهن به اتم نیتروژن حلقه ایمیدازول اسید آمینه هیستیدین در یک طرف صفحه حلقه پورفیرین و از طرف دیگر به اتم گوگرد متیونین متصل است. بنابراین، توانایی بالقوه اتم آهن در سیتوکروم ها برای اتصال به اکسیژن سرکوب می شود.
V سیتوکروم c صفحه پورفیرین به طور کووالانسی از طریق دو باقیمانده سیستئین به پروتئین متصل می شود و در سیتوکرومسب و ، پیوند کووالانسی ندارد با پروتئین
V سیتوکروم a+a 3 (سیتوکروم اکسیداز) به جای پروتوپورفیرین حاوی پورفیرین A است که در تعدادی از ویژگی های ساختاری متفاوت است. پنجمین موقعیت هماهنگی آهن توسط یک گروه آمینه متعلق به باقیمانده آمینو قند که بخشی از خود پروتئین است، اشغال می شود.
برخلاف هِم همولگوبین، اتم آهن در سیتوکروم ها می تواند به طور برگشت پذیر از حالت دو به حالت سه ظرفیتی تغییر کند؛ این امر انتقال الکترون ها را تضمین می کند (برای جزئیات بیشتر به پیوست 1 «ساختار اتمی و الکترونیکی هموپروتئین ها» مراجعه کنید).
مکانیسم عملکرد زنجیره انتقال الکترون
غشای خارجی میتوکندری (شکل 4.8.1) برای اکثر مولکولها و یونهای کوچک نفوذپذیر است، در حالی که غشای داخلی تقریباً به همه یونها (به جز پروتونهای H) و برای اکثر مولکولهای بدون بار نفوذپذیر است.
تمام اجزای فوق از زنجیره تنفسی در غشای داخلی ساخته شده است. انتقال پروتون ها و الکترون ها در طول زنجیره تنفسی توسط اختلاف پتانسیل بین اجزای آن انجام می شود. علاوه بر این، هر افزایش پتانسیل با 0.16 ولت انرژی کافی برای سنتز یک مولکول ATP از ADP و H 3 RO 4 آزاد می کند. وقتی یک مولکول O 2 مصرف می شود، 3 ATP.
فرآیندهای اکسیداسیون و تشکیل ATP از ADP و اسید فسفریک یعنی. فسفوریلاسیون در میتوکندری انجام می شود. غشای داخلی چین های زیادی را تشکیل می دهد - cristae. فضا توسط غشای داخلی - ماتریس - محدود می شود. فضای بین غشاهای داخلی و خارجی را بین غشاء می گویند.
چنین مولکولی حاوی سه پیوند ماکروارژیک است. ماکرو ارژیک یا غنی از انرژی یک پیوند شیمیایی است که با شکستن آن بیش از 4 کیلو کالری در مول آزاد می شود. در طی تجزیه هیدرولیتیک ATP به ADP و اسید فسفریک، 7.3 کیلو کالری در مول آزاد می شود. دقیقاً همین مقدار برای تشکیل ATP از ADP و بقیه اسید فسفریک خرج می شود و این یکی از راه های اصلی ذخیره انرژی در بدن است.
در فرآیند انتقال الکترون در طول زنجیره تنفسی، انرژی آزاد می شود که برای افزودن یک باقیمانده اسید فسفریک به ADP صرف می شود تا یک مولکول ATP و یک مولکول آب تشکیل شود. در فرآیند انتقال یک جفت الکترون در طول زنجیره تنفسی، 21.3 کیلوکالری در مول آزاد شده و در قالب سه مولکول ATP ذخیره می شود. این حدود 40 درصد انرژی آزاد شده در حمل و نقل الکترونیکی است.
به این روش ذخیره انرژی در سلول گفته می شود فسفوریلاسیون اکسیداتیو یا فسفوریلاسیون جفت شده
مکانیسمهای مولکولی این فرآیند بهطور کامل توسط نظریه شیمیایی اسمزی میچل که در سال 1961 ارائه شد توضیح داده شده است.
مکانیسم فسفوریلاسیون اکسیداتیو (شکل 4.8.2.):
1) دهیدروژناز وابسته به NAD در سطح ماتریکس غشای داخلی میتوکندری قرار دارد و یک جفت الکترون هیدروژن را به دهیدروژناز وابسته به FMN اهدا می کند. در این حالت یک جفت پروتون نیز از ماتریس به FMN می رود و در نتیجه FMN H2 تشکیل می شود. در این زمان، یک جفت پروتون متعلق به NAD به فضای بین غشایی رانده می شود.
2) دهیدروژناز وابسته به FAD یک جفت الکترون به شرکت اهدا می کندس و چند پروتون را به فضای بین غشایی هل می دهد. دریافت الکترونس چند پروتون از ماتریس می پذیرد و به شرکت تبدیل می شود Q H 2 .
3) شرکت Q H 2 یک جفت پروتون را به فضای بین غشایی هل می دهد و یک جفت الکترون به سیتوکروم ها و سپس به اکسیژن منتقل می شود تا یک مولکول آب تشکیل شود.
در نتیجه هنگامی که یک جفت الکترون در طول زنجیره از ماتریس به فضای بین غشایی منتقل می شود، 6 پروتون (3 جفت) پمپ می شود که منجر به ایجاد اختلاف پتانسیل و اختلاف pH بین سطوح داخلی می شود. غشاء.
4) اختلاف پتانسیل و اختلاف pH حرکت پروتون ها را از طریق کانال پروتون به ماتریس تضمین می کند.
5) این حرکت معکوس پروتون ها منجر به فعال شدن ATP سنتاز و سنتز ATP از ADP و اسید فسفریک می شود. با انتقال یک جفت الکترون (یعنی سه جفت پروتون)، 3 مولکول ATP سنتز می شود (شکل 4.7.3.).

جداسازی فرآیندهای تنفس و فسفوریلاسیون اکسیداتیو زمانی اتفاق می افتد که پروتون ها شروع به نفوذ به غشای داخلی میتوکندری می کنند. در این حالت، گرادیان pH کاهش می یابد و نیروی محرکه فسفوریلاسیون ناپدید می شود. مواد شیمیایی - uncouplerها پروتونوفور نامیده می شوند، آنها قادر به حمل پروتون از طریق غشاء هستند. این شامل 2،4-دی نیتروفنول، هورمون های تیروئید و غیره (شکل 4.8.3.).
ATP حاصل از ماتریکس به سیتوپلاسم توسط آنزیم های ترانس لوکاز منتقل می شود، در حالی که یک مولکول ADP و یک مولکول اسید فسفریک در جهت مخالف به ماتریکس منتقل می شوند. واضح است که نقض حمل و نقل ADP و فسفات باعث مهار سنتز ATP می شود.
سرعت فسفوریلاسیون اکسیداتیو در درجه اول به محتوای ATP بستگی دارد، هر چه سریعتر مصرف شود، ADP بیشتر انباشته شود، نیاز به انرژی بیشتر است و بنابراین، فرآیند فسفوریلاسیون اکسیداتیو فعال تر است. تنظیم میزان فسفوریلاسیون اکسیداتیو توسط غلظت ADP در سلول را کنترل تنفسی می نامند.

ادبیات به فصل IV.8.
1. Byshevsky A. Sh., Tersenov O. A. بیوشیمی برای یک پزشک // اکاترینبورگ: کارگر اورال، 1994، 384 ص.
2. Knorre D. G.، Myzina S. D. شیمی بیولوژیکی. - م .: بالاتر. مدرسه 1998، 479 ص.
3. Lehninger A. بیوشیمی. پایه های مولکولی ساختار و عملکرد سلول // M.: Mir, 1974, 956 p.;
4. Pustovalova L.M. کارگاه بیوشیمی // Rostov-on-Don: Phoenix, 1999, 540 p.;
5. Stepanov V. M. زیست شناسی مولکولی. ساختار و عملکرد پروتئین ها // M.: Vysshaya shkola, 1996, 335 p.;
کل انواع موجودات زنده روی زمین را می توان به دو گروه اصلی تقسیم کرد که در استفاده از منابع مختلف انرژی - موجودات اتوتروف و هتروتروف متفاوت هستند. اولین (اتوتروف ها) در درجه اول گیاهان سبز هستند که قادر به استفاده مستقیم از انرژی تابشی خورشید در فرآیند فتوسنتز هستند و ترکیبات آلی (کربوهیدرات ها، اسیدهای آمینه، اسیدهای چرب و غیره) را از غیر آلی ایجاد می کنند. موجودات زنده باقیمانده مواد آلی آماده را جذب می کنند و از آنها به عنوان منبع انرژی یا مواد پلاستیکی برای ساختن بدن خود استفاده می کنند. لازم به ذکر است که اکثر میکروارگانیسم ها هتروتروف نیز هستند. با این حال، آنها قادر به جذب ذرات کامل غذا نیستند. آنها در محیط خود آنزیم های گوارشی خاصی ترشح می کنند که مواد غذایی را تجزیه می کند و آنها را به مولکول های کوچک و محلول تبدیل می کند و این مولکول ها به داخل سلول ها نفوذ می کنند. در نتیجه متابولیسم، مواد مصرف شده با غذا به مواد و ساختارهای سلولی خود تبدیل میشوند و علاوه بر این، انرژی برای کارهای خارجی برای بدن تأمین میشود. خود تولید مثل، یعنی تجدید مداوم ساختارهای بدن و تولید مثل، بارزترین ویژگی متابولیسم در موجودات زنده است که آن را از متابولیسم در طبیعت بی جان متمایز می کند. |
متابولیسم، به طور جدایی ناپذیر با تبادل انرژی، یک نظم طبیعی از تبدیل ماده و انرژی در سیستم های زنده است که با هدف حفظ و بازتولید خود آنها انجام می شود. F. Engels متابولیسم را مهمترین خاصیت زندگی می داند که با پایان یافتن آن زندگی خود متوقف می شود. وی بر دیالکتیکی بودن این فرآیند تاکید کرد و خاطرنشان کرد
I. M. Sechenov، بنیانگذار فیزیولوژی روسی، نقش متابولیسم را در زندگی موجودات از یک موقعیت مادی ثابت در نظر گرفت. K. A. Timiryazev پیوسته این ایده را دنبال می کرد که ویژگی اصلی موجودات زنده تبادل فعال دائمی بین ماده تشکیل دهنده بدن و ماده محیط است که بدن دائماً آن را درک می کند ، جذب می کند ، دوباره آن را به یک مشابه تبدیل می کند. تغییرات و برجستگیها در فرآیند تجزیه. IP Pavlov متابولیسم را به عنوان پایه ای برای تجلی فعالیت حیاتی، به عنوان پایه ای برای عملکردهای فیزیولوژیکی بدن در نظر گرفت. کمک قابل توجهی به دانش شیمی فرآیندهای زندگی توسط AI Oparin انجام شد که الگوهای اساسی تکامل متابولیسم را در جریان پیدایش و توسعه حیات بر روی زمین مطالعه کرد.
مفاهیم و اصطلاحات اساسی
یا متابولیسم مجموعه ای از واکنش های شیمیایی در بدن است که مواد و انرژی لازم برای زندگی را تامین می کند: حفظ خود و تولید مثل. خود تولید مثل تبدیل ماده ای است که از خارج به مواد و ساختارهای خود ارگانیسم می آید و در نتیجه تجدید مداوم بافت ها، رشد و تولیدمثل وجود دارد.
در متابولیسم ترشح می شود:
- تبادل خارجی- شامل تبدیل خارج سلولی مواد در مسیر ورود آنها به بدن و دفع محصولات متابولیک از آن است. [نمایش]
.
دریافت مواد به بدن و آزاد شدن محصولات متابولیک با هم تبادل مواد بین محیط و بدن را تشکیل می دهد و به عنوان تبادل خارجی تعریف می شود.
تبادل خارجی مواد (و انرژی) به طور مداوم انجام می شود.
اکسیژن، آب، املاح معدنی، مواد مغذی، ویتامینها که برای ساختن و بهروزرسانی عناصر ساختاری سلولها و بافتها و تولید انرژی ضروری هستند، از محیط بیرونی وارد بدن انسان میشوند. همه این مواد را می توان محصولات غذایی نامید که برخی از آنها منشأ بیولوژیکی (گیاهی و حیوانی) و قسمت کوچکتری غیر بیولوژیکی (آب و نمک های معدنی محلول در آن) دارند.
مواد مغذی تامین شده با غذا با تشکیل اسیدهای آمینه، مونوساکاریدها، اسیدهای چرب، نوکلئوتیدها و سایر مواد تجزیه میشوند که با مخلوط شدن با همان موادی که در فرآیند پوسیدگی مداوم اجزای ساختاری و عملکردی سلول ایجاد میشوند، ترکیب کلی را تشکیل میدهند. صندوق متابولیت های بدن این سرمایه در دو جهت هزینه می شود: بخشی برای تجدید اجزای ساختاری و عملکردی پوسیده سلول استفاده می شود. قسمت دیگر به محصولات نهایی متابولیسم تبدیل می شود که از بدن دفع می شود.
در طی تجزیه مواد به محصولات نهایی متابولیسم، انرژی در یک فرد بالغ 8000-12000 کیلوژول (2000-3000 کیلو کالری) در روز آزاد می شود. این انرژی توسط سلول های بدن برای انجام انواع مختلف کار و همچنین حفظ دمای بدن در یک سطح ثابت استفاده می شود.
- تبادل واسطه- شامل تبدیل مواد در داخل سلول های بیولوژیکی از لحظه ورود تا تشکیل محصولات نهایی (به عنوان مثال متابولیسم اسید آمینه، متابولیسم کربوهیدرات و غیره)
مراحل متابولیسم. سه مرحله متوالی وجود دارد.
بیشتر در مورد
- مصرف (تغذیه بخشی جدایی ناپذیر از متابولیسم (دریافت مواد از محیط به بدن است))
- هضم (بیوشیمی هضم (هضم مواد مغذی))
- جذب (بیوشیمی هضم (جذب مواد مغذی))
II. حرکت و تبدیل مواد در بدن (متابولیسم متوسط) |
متابولیسم میانی (یا متابولیسم) - تبدیل مواد در بدن از لحظه ورود به سلول ها تا تشکیل محصولات نهایی متابولیسم، یعنی کل واکنش های شیمیایی که در سلول های زنده رخ می دهد و مواد و انرژی را برای بدن فراهم می کند. فعالیت حیاتی آن، رشد، تولید مثل. این سخت ترین بخش متابولیسم است.
هنگامی که در داخل سلول قرار می گیرد، ماده مغذی متابولیزه می شود - تحت یک سری تغییرات شیمیایی که توسط آنزیم ها کاتالیز می شود. توالی خاصی از چنین تغییرات شیمیایی را مسیر متابولیک و محصولات میانی حاصل را متابولیت می نامند. مسیرهای متابولیک را می توان در قالب یک نقشه متابولیک نشان داد.
| متابولیسم مواد مغذی | ||
| کربوهیدرات ها | لیپیدها | بلکوف |
مسیرهای کاتابولیک کربوهیدرات ها
مسیرهای کربوهیدرات آنابولیک
|
مسیر کاتابولیک لیپید
مسیر لیپیدی آنابولیک
|
مسیر کاتابولیک پروتئین
مسیر اسید آمینه آنابولیک
|
به دلیل رقابت بین مسیرهای سنتز فسفولیپیدها و تری اسیل گلیسرول ها برای سوبستراهای رایج، همه موادی که سنتز فسفولیپیدها را تقویت می کنند از رسوب تری گلیسرول ها در بافت ها جلوگیری می کنند. این مواد را عوامل لیپوتروپیک می نامند. اینها شامل اجزای ساختاری فسفولیپیدها است: کولین، اینوزیتول، سرین. ماده ای که دکربوکسیلاسیون سرین فسفاتید - پیریدوکسال فسفات را تسهیل می کند. دهنده گروه متیل - متیونین؛ اسید فولیک و سیانوکوبالامین در تشکیل کوآنزیم های انتقال گروه متیل (THFK و متیل کوبالامین) نقش دارند. آنها را می توان به عنوان داروهایی استفاده کرد که از رسوب بیش از حد تری اسیل گلیسرول در بافت ها (نفوذ چربی) جلوگیری می کند.
|
||
| جدول 24. متابولیسم روزانه یک فرد (مقادیر گرد؛ یک بزرگسال با وزن بدن حدود 70 کیلوگرم) | |||
| مواد | محتوا در بدن، g | مصرف روزانه، g | تخصیص روزانه |
| O2 | - | 850 | - |
| CO2 | - | - | 1000 |
| اب | 42 000 | 2200 | 2600 |
| مواد آلی: | |||
| سنجاب ها | 15 000 | 80 | - |
| لیپیدها | 10 000 | 100 | - |
| کربوهیدرات ها | 700 | 400 | - |
| اسیدهای نوکلئیک | 700 | - | - |
| اوره | - | - | 30 |
| نمک های معدنی | 3 500 | 20 | 20 |
| جمع | 71 900 | 3650 | 3650 |
در نتیجه فعالیت متابولیک در تمام قسمت های بدن، مواد مضری تشکیل می شود که وارد جریان خون شده و باید حذف شوند. این عملکرد توسط کلیه ها انجام می شود که مواد مضر را جدا کرده و به سمت مثانه هدایت می کند و از آنجا از بدن دفع می شود. سایر اندام ها نیز در فرآیند متابولیسم شرکت می کنند: کبد، پانکراس، کیسه صفرا، روده ها، غدد عرق.
فرد با ادرار، مدفوع، عرق، هوای بازدم محصولات نهایی اصلی متابولیسم - CO 2، H 2 O، اوره H 2 N - CO - NH 2 را دفع می کند. به شکل H 2 O، هیدروژن مواد آلی دفع می شود و بدن بیش از آنچه که مصرف می کند، آب آزاد می کند (جدول 24 را ببینید): تقریباً 400 گرم آب در روز در بدن از هیدروژن مواد آلی و اکسیژن هوای استنشاقی (آب متابولیک). کربن و اکسیژن مواد آلی به شکل CO 2 و نیتروژن به شکل اوره حذف می شود.
علاوه بر این، فرد بسیاری از مواد دیگر را آزاد می کند، اما در مقادیر کم، به طوری که سهم آنها در تعادل کلی متابولیسم بین بدن و محیط کم است. با این حال، باید توجه داشت که اهمیت فیزیولوژیکی انتشار چنین موادی می تواند قابل توجه باشد. به عنوان مثال، نقض انتشار محصولات پوسیدگی هم یا محصولات متابولیک ترکیبات خارجی، از جمله داروها، می تواند باعث اختلالات متابولیک شدید و عملکردهای بدن شود.
بسترهای متابولیسم- ترکیبات شیمیایی که با غذا می آید. در میان آنها دو گروه قابل تشخیص است: مواد مغذی اصلی (کربوهیدرات ها، پروتئین ها، لیپیدها) و مواد جزئی که در مقادیر کم (ویتامین ها، ترکیبات معدنی) وجود دارند.
مرسوم است که بین مواد مغذی قابل تعویض و غیر قابل جایگزینی تشخیص داده شود. ضروری آن دسته از مواد مغذی هستند که نمی توانند در بدن سنتز شوند و بنابراین باید با غذا تامین شوند.
مسیر سوخت و ساز- این ماهیت و توالی دگرگونی های شیمیایی یک ماده خاص در بدن است. محصولات میانی تشکیل شده در طی فرآیند تبدیل، متابولیت نامیده می شوند و آخرین ترکیب مسیر متابولیک، محصول نهایی است.
دگرگونی های شیمیایی به طور مداوم در بدن اتفاق می افتد. در نتیجه تغذیه بدن، مواد اولیه دچار تحولات متابولیکی می شوند. محصولات نهایی متابولیسم به طور مداوم از بدن دفع می شوند. بنابراین، یک موجود زنده یک سیستم شیمیایی باز ترمودینامیکی است. ساده ترین مثال از یک سیستم متابولیک یک زنجیره متابولیک منفرد بدون شاخه است:




--> a --> b --> c --> d -->
با جریان ثابت مواد در چنین سیستمی، تعادل دینامیکی برقرار می شود، زمانی که سرعت تشکیل هر متابولیت برابر با میزان مصرف آن باشد. این بدان معنی است که غلظت هر متابولیت ثابت نگه داشته می شود. چنین حالتی از سیستم را ساکن و غلظت مواد در این حالت را غلظت ساکن می نامند.
یک موجود زنده در هر لحظه با تعریف ارائه شده از حالت ساکن مطابقت ندارد. با این حال، با توجه به مقدار متوسط پارامترهای آن در یک دوره زمانی نسبتاً طولانی، می توان به ثبات نسبی آنها اشاره کرد و از این طریق کاربرد مفهوم سیستم ثابت را برای موجودات زنده توجیه کرد. [نمایش] .

روی انجیر 64 یک مدل هیدرودینامیکی از یک زنجیره متابولیکی بدون انشعاب را نشان می دهد. در این دستگاه ارتفاع ستون مایع در سیلندرها به ترتیب غلظت متابولیت های a-d را شبیه سازی می کند و خروجی لوله های اتصال بین سیلندرها سرعت واکنش های آنزیمی مربوطه را شبیه سازی می کند.
با سرعت ثابت سیال ورودی به سیستم، ارتفاع ستون سیال در تمام سیلندرها ثابت می ماند: این یک حالت ساکن است.
اگر سرعت جریان سیال افزایش یابد، هم ارتفاع ستون سیال در همه سیلندرها و هم سرعت جریان سیال در کل سیستم افزایش مییابد: سیستم به حالت ثابت جدیدی رفته است. تغییرات مشابهی در فرآیندهای متابولیک در یک سلول زنده رخ می دهد.
تنظیم غلظت متابولیت
معمولاً واکنشی در زنجیره متابولیک وجود دارد که بسیار کندتر از سایر واکنش ها پیش می رود - این مرحله محدود کننده سرعت مسیر است. در شکل، چنین مرحله ای با یک لوله اتصال باریک بین سیلندر اول و دوم مدل سازی شده است. مرحله محدود کننده سرعت، سرعت کلی تبدیل ماده اولیه به محصول نهایی زنجیره متابولیک را تعیین می کند. اغلب آنزیمی که واکنش محدود کننده را کاتالیز می کند یک آنزیم تنظیم کننده است: فعالیت آن می تواند تحت تأثیر مهارکننده ها و فعال کننده های سلولی تغییر کند. به این ترتیب تنظیم مسیر متابولیک تضمین می شود. روی انجیر 64 یک لوله انتقال با یک دمپر بین سیلندر اول و دوم، یک آنزیم تنظیم کننده را شبیه سازی می کند: با بالا بردن یا پایین آوردن دمپر، می توان سیستم را به یک حالت ثابت جدید انتقال داد، با نرخ جریان کلی سیال متفاوت و سطوح مختلف سیال در سیلندرها
در سیستم های متابولیک شاخه دار، آنزیم های تنظیم کننده معمولاً اولین واکنش ها را در محل انشعاب کاتالیز می کنند، مانند واکنش های b --> c و b --> i در شکل. 65. این امر امکان تنظیم مستقل هر شاخه از سیستم متابولیک را تضمین می کند.

بسیاری از واکنش های متابولیک برگشت پذیر هستند. جهت جریان آنها در یک سلول زنده با مصرف محصول در واکنش بعدی یا حذف محصول از کره واکنش، به عنوان مثال، با دفع تعیین می شود (شکل 65).
با تغییر در وضعیت بدن (غذا خوردن، انتقال از استراحت به فعالیت حرکتی و غیره)، غلظت متابولیت ها در بدن تغییر می کند، یعنی یک حالت ثابت جدید ایجاد می شود. اما در شرایط یکسان، مثلاً بعد از یک خواب شبانه (قبل از صبحانه)، تقریباً در همه افراد سالم یکسان است. به دلیل عملکرد مکانیسم های تنظیمی، غلظت هر متابولیت در سطح مشخصه خود حفظ می شود. مقادیر متوسط این غلظت ها (با نشان دادن محدودیت های نوسانات) به عنوان یکی از ویژگی های هنجار عمل می کند. در بیماری ها، غلظت ثابت متابولیت ها تغییر می کند و این تغییرات اغلب مختص یک بیماری خاص است. بسیاری از روش های بیوشیمیایی تشخیص آزمایشگاهی بیماری ها بر این اساس است.
دو جهت در مسیر متابولیک وجود دارد - آنابولیسم و کاتابولیسم (شکل 1).
- واکنش های آنابولیک با هدف تبدیل مواد ساده تر به مواد پیچیده تر، تشکیل اجزای ساختاری و عملکردی سلول، مانند کوآنزیم ها، هورمون ها، پروتئین ها، اسیدهای نوکلئیک و غیره انجام می شود. واکنش های اندرگونیک). منبع انرژی برای آنها فرآیند کاتابولیسم است. علاوه بر این، انرژی کاتابولیسم برای اطمینان از فعالیت عملکردی سلول (موتور و دیگران) استفاده می شود.
- دگرگونی های کاتابولیک فرآیندهای تقسیم مولکول های پیچیده، هم مولکول هایی که همراه غذا هستند و هم بخشی از سلول هستند، به اجزای ساده (دی اکسید کربن و آب) هستند. این واکنش ها معمولا اکسیداتیو هستند و با آزاد شدن انرژی آزاد همراه هستند (واکنش های اگزرگونیک).
راه آمفیبولیک(دوگانه) - مسیری که در آن تبدیلات کاتابولیک و آنابولیک با هم ترکیب می شوند، یعنی. همراه با تخریب یک ترکیب، ترکیب دیگری نیز سنتز می شود.
مسیرهای آمفیبولیک با سیستم اکسیداسیون نهایی یا نهایی مواد مرتبط هستند، جایی که با تشکیل مقدار زیادی انرژی به محصولات نهایی (CO 2 و H 2 O ) می سوزند. علاوه بر آنها، فرآورده های نهایی متابولیسم اوره و اسید اوریک هستند که در واکنش های ویژه مبادله اسیدهای آمینه و نوکلئوتیدها تشکیل می شوند. به طور شماتیک، رابطه متابولیسم از طریق سیستم ATP-ADP و چرخه آمفیبولیک متابولیت ها در شکل 1 نشان داده شده است. 2.
سیستم ATP-ADP(چرخه ATP-ADP) - چرخه ای است که در آن تشکیل مداوم مولکول های ATP رخ می دهد که انرژی هیدرولیز آن توسط بدن در انواع مختلف کار استفاده می شود.
این یک مسیر متابولیکی است که یکی از محصولات نهایی آن با یکی از ترکیبات درگیر در این فرآیند یکسان است (شکل 3).
مسیر آناپلروتیک- متابولیک که محصول نهایی آن با یکی از محصولات میانی هر مسیر حلقوی یکسان است. مسیر آناپلروتیک در مثال شکل. 3 چرخه را با محصول X (آناپلروز - دوباره پر کردن) پر می کند.
بیایید از این مثال استفاده کنیم. اتوبوس های برندهای X، Y، Z در شهر تردد می کنند که مسیر آنها در نمودار نشان داده شده است (شکل 4).
بر اساس این مثال موارد زیر را تعریف می کنیم.
- یک مسیر متابولیک خصوصی مجموعه ای از دگرگونی ها است که فقط برای یک ترکیب خاص (مثلا کربوهیدرات ها، لیپیدها یا اسیدهای آمینه) مشخص می شود.
- یک مسیر متابولیک متداول مجموعه ای از دگرگونی ها است که شامل دو یا چند نوع ترکیب می شود (به عنوان مثال کربوهیدرات ها و لیپیدها یا کربوهیدرات ها، لیپیدها و اسیدهای آمینه).
محلی سازی مسیرهای متابولیک
مسیرهای کاتابولیک و آنابولیک در افراد یوکاریوتی از نظر محلی سازی در سلول متفاوت است (جدول 22).
این تقسیم به دلیل محصور شدن سیستم های آنزیمی در مناطق خاصی از سلول است (بخش بندی) که هم جداسازی و یکپارچگی عملکردهای درون سلولی و هم کنترل مناسب را فراهم می کند.
در حال حاضر، به لطف مطالعات میکروسکوپی الکترونی و هیستوشیمیایی و همچنین روش سانتریفیوژ افتراقی، پیشرفت قابل توجهی در تعیین محلی سازی درون سلولی آنزیم ها حاصل شده است. همانطور که در شکل دیده میشود. 74، در یک سلول، می توان یک غشای سلولی یا پلاسمایی، یک هسته، میتوکندری، لیزوزوم، ریبوزوم، سیستم لوله ها و وزیکول ها - شبکه آندوپلاسمی، یک کمپلکس لایه ای، واکوئل های مختلف، ادخال های داخل سلولی و غیره را پیدا کرد. از قسمت تمایز نیافته سیتوپلاسم سلول هیالوپلاسم (یا سیتوزول) است.
مشخص شده است که RNA پلیمرازها، به عنوان مثال، آنزیم هایی که تشکیل mRNA را کاتالیز می کنند، در هسته (به طور دقیق تر، در هسته) قرار دارند. هسته حاوی آنزیم هایی است که در فرآیند همانندسازی DNA و برخی دیگر نقش دارند (جدول 23).

| جدول 23. محلی سازی برخی از آنزیم ها در داخل سلول | |
| سیتوزول | آنزیم های گلیکولیز آنزیم های مسیر پنتوز آنزیم های فعال کننده اسید آمینه آنزیم برای سنتز اسیدهای چرب فسفوریلاز گلیکوژن سنتاز |
| میتوکندری | کمپلکس پیروات دهیدروژناز آنزیم های چرخه کربس آنزیم های چرخه اکسیداسیون اسیدهای چرب آنزیم های اکسیداسیون بیولوژیکی و فسفوریلاسیون اکسیداتیو |
| لیزوزوم ها | هیدرولازهای اسیدی |
| کسر میکروزومی | آنزیم های ریبوزومی سنتز پروتئین آنزیم هایی برای سنتز فسفولیپیدها، تری گلیسیریدها و همچنین تعدادی از آنزیم های دخیل در سنتز کلسترول هیدروکسیلازها |
| غشای پلاسمایی | آدنیلات سیکلاز، ATPase وابسته به Na+-K+ |
| هسته | آنزیم های دخیل در تکثیر DNA RNA پلیمراز NAD سنتتاز |
ارتباط آنزیم ها با ساختار سلولی:
- میتوکندری. میتوکندری ها با آنزیم های زنجیره اکسیداسیون بیولوژیکی (تنفس بافت) و فسفوریلاسیون اکسیداتیو و همچنین آنزیم های کمپلکس پیروات دهیدروژناز، چرخه اسید تری کربوکسیلیک، سنتز اوره، اکسیداسیون اسیدهای چرب و غیره مرتبط هستند.
- لیزوزوم ها لیزوزوم ها عمدتاً حاوی آنزیم های هیدرولیتیک با pH بهینه در ناحیه 5 هستند. به دلیل وابستگی هیدرولیتیکی آنزیم ها است که این ذرات را لیزوزوم می نامند.
- ریبوزوم ها آنزیم های سنتز پروتئین در ریبوزوم ها موضعی می شوند، در این ذرات mRNA ترجمه می شود و اسیدهای آمینه با تشکیل مولکول های پروتئین به زنجیره های پلی پپتیدی متصل می شوند.
- شبکه آندوپلاسمی شبکه آندوپلاسمی حاوی آنزیم های سنتز لیپید و همچنین آنزیم هایی است که در واکنش های هیدروکسیلاسیون دخیل هستند.
- غشای پلاسمایی ATP-ase انتقال Na + و K +، آدنیلات سیکلاز و تعدادی از آنزیم های دیگر در درجه اول با غشای پلاسمایی مرتبط هستند.
- سیتوزول. آنزیم های گلیکولیز، چرخه پنتوز، سنتز اسیدهای چرب و مونونوکلئوتیدها، فعال شدن اسیدهای آمینه، و همچنین بسیاری از آنزیم های گلوکونئوژنز در سیتوزول (هیالوپلاسم) قرار دارند.
روی میز. 23 داده های مربوط به محلی سازی مهم ترین آنزیم ها و مراحل متابولیک فردی را در ساختارهای مختلف درون سلولی خلاصه می کند.
سیستم های چند آنزیمی در ساختار اندامک ها به گونه ای محلی شده اند که هر آنزیم در یک توالی مشخص از واکنش ها در مجاورت آنزیم بعدی قرار دارد. به همین دلیل، زمان مورد نیاز برای انتشار محصولات واکنش میانی کاهش مییابد و کل توالی واکنشها به شدت در زمان و مکان هماهنگ میشوند. این امر، به عنوان مثال، در مورد آنزیم های دخیل در اکسیداسیون اسید پیروویک و اسیدهای چرب، در سنتز پروتئین، و همچنین برای انتقال الکترون و آنزیم های فسفوریلاسیون اکسیداتیو صادق است.
بخشسازی همچنین تضمین میکند که واکنشهای شیمیایی ناسازگار در همان زمان رخ میدهند، یعنی. استقلال مسیرهای کاتابولیسم و آنابولیسم بنابراین، در سلول، اکسیداسیون اسیدهای چرب با زنجیره بلند به مرحله استیل-CoA و فرآیند خلاف جهت - سنتز اسیدهای چرب از استیل-CoA می تواند به طور همزمان رخ دهد. این فرآیندهای شیمیایی ناسازگار در بخشهای مختلف سلول اتفاق میافتد: اکسیداسیون اسیدهای چرب در میتوکندری و سنتز آنها در خارج از میتوکندری در هیالوپلاسم اتفاق میافتد. اگر این مسیرها تنها در جهت فرآیند منطبق و متفاوت بودند، در آن صورت چرخه های به اصطلاح بی فایده یا بیهوده در مبادله به وجود می آمد. چنین چرخه هایی در آسیب شناسی زمانی اتفاق می افتد که گردش بی فایده متابولیت ها امکان پذیر باشد.
توضیح پیوندهای فردی متابولیسم در طبقات مختلف گیاهان، جانوران و میکروارگانیسم ها، اشتراک اساسی مسیرهای دگرگونی های بیوشیمیایی در طبیعت زنده را آشکار می کند.
مقررات اساسی مقررات متابولیسم
تنظیم متابولیسم در سطوح سلولی و درون سلولی انجام می شود
- با تنظیم سنتز و فعالیت کاتالیزوری آنزیم ها.
این مکانیسم های نظارتی هستند
- سرکوب سنتز آنزیم ها توسط محصولات نهایی مسیر متابولیک،
- القای سنتز یک یا چند آنزیم توسط سوبستراها،
- تعدیل فعالیت مولکول های آنزیمی موجود،
- تنظیم سرعت ورود متابولیت ها به سلول در اینجا نقش اصلی متعلق به غشاهای بیولوژیکی احاطه کننده پروتوپلاسم و هسته، میتوکندری، لیزوزوم ها و سایر اندامک های درون سلولی واقع در آن است.
- با تنظیم سنتز و فعالیت هورمون ها. بنابراین، متابولیسم پروتئین تحت تأثیر هورمون تیروئید - تیروکسین، متابولیسم چربی - توسط هورمون های پانکراس و غدد تیروئید، غدد فوق کلیوی و غده هیپوفیز، متابولیسم کربوهیدرات ها - توسط هورمون های پانکراس (انسولین) و غدد فوق کلیوی (آدرنالین) قرار می گیرد. . نقش ویژه ای در مکانیسم عمل هورمون ها متعلق به نوکلئوتیدهای حلقوی (cAMP و cGMP) است.
در حیوانات و انسان ها، تنظیم هورمونی متابولیسم ارتباط نزدیکی با فعالیت هماهنگ کننده سیستم عصبی دارد. نمونه ای از تأثیر سیستم عصبی بر متابولیسم کربوهیدرات، تزریق قند به اصطلاح توسط کلود برنارد است که منجر به هیپرگلیسمی و گلوکوزوری می شود.
- مهمترین نقش در فرآیندهای ادغام متابولیسم متعلق به قشر مغز است. همانطور که IP Pavlov خاطرنشان کرد: "هر چه سیستم عصبی یک موجود جانوری کامل تر باشد، متمرکزتر باشد، بخش آن بیشتر و بیشتر مدیر و توزیع کننده همه فعالیت های ارگانیسم است... این بخش بالاتر شامل در صلاحیت آن همه پدیده هایی که در بدن رخ می دهد».
بنابراین، یک ترکیب خاص، سازگاری دقیق و سرعت واکنش های متابولیک در کل سیستمی را تشکیل می دهد که ویژگی های مکانیسم بازخورد (مثبت یا منفی) را نشان می دهد.

روش های مطالعه متابولیسم متوسط
دو رویکرد برای مطالعه متابولیسم استفاده می شود:
- مطالعات کل بدن (آزمایشات درون تنی) [نمایش]
یک نمونه کلاسیک از تحقیقات بر روی کل ارگانیسم، که در آغاز قرن ما انجام شد، آزمایشات Knoop است. او نحوه تجزیه اسیدهای چرب در بدن را مطالعه کرد. برای انجام این کار، Knoop به سگها اسیدهای چرب مختلف با تعداد زوج (I) و فرد (II) اتمهای کربن داد که در آن یک اتم هیدروژن در گروه متیل با رادیکال فنیل C 6 H 5 جایگزین شد:
در حالت اول، اسید فنیل استیک C 6 H 5 - CH 2 -COOH همیشه از طریق ادرار سگ ها دفع می شود و در مورد دوم، اسید بنزوئیک C 6 H 5 -COOH. بر اساس این نتایج، Knoop به این نتیجه رسید که تجزیه اسیدهای چرب در بدن از طریق حذف متوالی قطعات دو کربنه، از انتهای کربوکسیل شروع می شود:
CH 3 -CH 2 -|-CH2 -CH2 -|-CH2 -CH2 -|-CH2 -CH2 -|-CH2 -COOH
این نتیجه گیری بعداً با روش های دیگر تأیید شد.
در اصل، در این مطالعات، نوپ از روش برچسبگذاری مولکولها استفاده کرد: او از یک رادیکال فنیل به عنوان برچسب استفاده کرد که در بدن تغییری نمیکند. از حدود دهه 40 قرن بیستم شروع شد. استفاده از موادی که مولکولهای آنها حاوی ایزوتوپهای رادیواکتیو یا سنگین عناصر هستند، رواج یافته است. به عنوان مثال، با تغذیه ترکیبات مختلف حاوی کربن رادیواکتیو (14 درجه سانتیگراد) به حیوانات آزمایشی، مشخص شد که تمام اتم های کربن موجود در مولکول کلسترول از اتم های کربن استات می آیند:

معمولاً یا از ایزوتوپ های پایدار عناصری که از نظر جرم با عناصر پراکنده در بدن متفاوت هستند (معمولا ایزوتوپ های سنگین) یا ایزوتوپ های رادیواکتیو استفاده می شود. از ایزوتوپ های پایدار، ایزوتوپ های هیدروژن با جرم 2 (دوتریوم، 2 نیوتن)، نیتروژن با جرم 15 (15 نیوتن)، کربن با جرم 13 (13 درجه سانتیگراد) و اکسیژن با جرم 18 (18 درجه سانتیگراد). ) بیشتر مورد استفاده قرار می گیرند. از ایزوتوپ های رادیواکتیو، ایزوتوپ های هیدروژن (تریتیوم، 3H)، فسفر (32 P و 33 P)، کربن (14 C)، گوگرد (35 S)، ید (131 I)، آهن (59 Fe)، سدیم (54) Na ) و غیره
با علامت گذاری به کمک ایزوتوپ پایدار یا رادیواکتیو یک مولکول از ترکیب مورد مطالعه و وارد کردن آن به بدن، سپس اتم های نشاندار شده یا گروه های شیمیایی حاوی آنها مشخص شده و با کشف آنها در ترکیبات خاص، نتیجه گیری در مورد راه های تبدیل ماده برچسب گذاری شده در بدن با کمک یک برچسب ایزوتوپی، می توان زمان ماندن یک ماده در بدن را نیز تعیین کرد، که با تقریبی مشخص، نیمه عمر بیولوژیکی را مشخص می کند، یعنی زمانی که در طی آن مقدار یک ایزوتوپ یا ترکیب برچسب گذاری شده مشخص می شود. نصف می شود یا برای به دست آوردن اطلاعات دقیق در مورد نفوذپذیری غشای سلول های منفرد. ایزوتوپ ها همچنین برای تعیین اینکه آیا یک ماده خاص پیش ساز یا محصول فروپاشی یک ترکیب دیگر است و همچنین برای تعیین سرعت تجدید بافت استفاده می شود. در نهایت، اگر چندین مسیر متابولیک وجود داشته باشد، می توان تعیین کرد که کدام یک از آنها غالب است.
در مطالعات انجام شده بر روی کل موجودات، نیاز بدن به مواد مغذی نیز مورد مطالعه قرار می گیرد: اگر حذف یک ماده از رژیم غذایی منجر به اختلال در رشد و نمو یا عملکردهای فیزیولوژیکی بدن شود، این ماده یک عامل تغذیه ای ضروری است. مقادیر مورد نیاز مواد مغذی نیز به روشی مشابه تعیین می شود.
- و مطالعات بر روی قسمت های جدا شده بدن - روش های تجزیه و تحلیل - تجزیه (آزمایش های آزمایشگاهی، یعنی خارج از بدن، در یک لوله آزمایش یا سایر رگ های آزمایشگاهی). اصل این روشها سادهسازی تدریجی یا بهتر بگوییم از هم پاشیدگی یک سیستم پیچیده بیولوژیکی به منظور جداسازی فرآیندهای فردی است. اگر این روش ها را به ترتیب نزولی، یعنی از سیستم های پیچیده تر به ساده تر در نظر بگیریم، می توان آنها را به ترتیب زیر مرتب کرد:
- برداشتن اندام های فردی [نمایش]
هنگامی که اندامها برداشته میشوند، دو موضوع مورد مطالعه وجود دارد: یک ارگانیسم بدون عضو برداشته شده و یک عضو جدا شده.
اندام های جدا شده اگر محلولی از یک ماده به شریان یک اندام جدا شده تزریق شود و مواد در مایعی که از ورید جریان دارد تجزیه و تحلیل شود، می توان تعیین کرد که این ماده در اندام تحت چه تغییراتی قرار می گیرد. به عنوان مثال، در این روش مشخص شده است که کبد محل اصلی تشکیل اجسام کتون و اوره است.
آزمایشهای مشابهی را میتوان بر روی اندامها بدون جداسازی آنها از بدن انجام داد (روش تفاوت شریانی-وریدی): در این موارد، خون برای تجزیه و تحلیل با استفاده از کانولهایی که در شریان و ورید اندام قرار داده میشوند یا با سرنگ گرفته میشود. به این ترتیب، به عنوان مثال، می توان ثابت کرد که در خونی که از ماهیچه های در حال کار جریان دارد، غلظت اسید لاکتیک افزایش می یابد و با جریان یافتن در کبد، خون از اسید لاکتیک آزاد می شود.
- روش برش بافت [نمایش]
برش ها قطعات نازکی از بافت هستند که با استفاده از میکروتوم یا فقط یک تیغ ساخته می شوند. بخش ها در محلولی حاوی مواد مغذی (گلوکز یا سایر مواد) و ماده ای که تغییر شکل آن در سلول های این نوع تعیین می شود، انکوبه می شوند. پس از انکوباسیون، محصولات متابولیکی ماده مورد آزمایش را در مایع جوجه کشی تجزیه و تحلیل کنید.
روش برش بافت اولین بار توسط واربورگ در اوایل دهه 1920 پیشنهاد شد. با استفاده از این تکنیک می توان تنفس بافتی (مصرف اکسیژن و انتشار دی اکسید کربن توسط بافت ها) را مطالعه کرد. محدودیت قابل توجهی در مطالعه متابولیسم در مورد استفاده از بخش های بافتی غشای سلولی است که - اغلب به عنوان مانعی بین محتویات سلول و محلول "مغذی" عمل می کند.
- همگن و بخش های درون سلولی [نمایش]

هموژنات ها آماده سازی های بدون سلول هستند. آنها با از بین بردن غشای سلولی با مالش بافت با ماسه یا در دستگاه های مخصوص - هموژنایزرها به دست می آیند (شکل 66). در هموژن ها، هیچ مانع نفوذ ناپذیری بین سوبستراهای اضافه شده و آنزیم ها وجود ندارد.
تخریب غشای سلولی امکان تماس مستقیم بین محتویات سلول و ترکیبات اضافه شده را فراهم می کند. این امر امکان تعیین آنزیم ها، کوآنزیم ها و سوبستراها را برای فرآیند مورد مطالعه ممکن می سازد.
تفکیک مواد هموژن.ذرات درون سلولی را می توان از هموژن جدا کرد، هم ترکیبات فوق مولکولی (ارگانل های سلولی) و هم از ترکیبات فردی (آنزیم ها و سایر پروتئین ها، اسیدهای نوکلئیک، متابولیت ها). به عنوان مثال، با استفاده از سانتریفیوژ افتراقی، می توان بخش هایی از هسته، میتوکندری و میکروزوم را به دست آورد (میکروزوم ها قطعاتی از شبکه آندوپلاسمی هستند). این اندامک ها در اندازه و چگالی متفاوت هستند و بنابراین در سرعت های سانتریفیوژ متفاوت رسوب می کنند. استفاده از اندامک های جدا شده امکان مطالعه فرآیندهای متابولیک مرتبط با آنها را فراهم می کند. به عنوان مثال، ریبوزوم های جدا شده برای مطالعه مسیرها و مکانیسم های سنتز پروتئین و میتوکندری ها برای مطالعه واکنش های اکسیداتیو چرخه کربس یا زنجیره ای از آنزیم های تنفسی استفاده می شوند.
پس از ته نشینی میکروزوم ها، اجزای محلول سلول در مایع رویی باقی می مانند - پروتئین های محلول، متابولیت ها. هر یک از این فراکسیون ها را می توان با روش های مختلف تقسیم بندی کرد و اجزای تشکیل دهنده آنها را جدا کرد. از اجزای جدا شده می توان سیستم های بیوشیمیایی را بازسازی کرد، به عنوان مثال، یک سیستم ساده "آنزیم + بستر" و موارد پیچیده مانند سیستم های سنتز پروتئین ها و اسیدهای نوکلئیک.
- بازسازی جزئی یا کامل سیستم آنزیمی در شرایط آزمایشگاهی با استفاده از آنزیم ها، کوآنزیم ها و سایر اجزای واکنش [نمایش]
برای ادغام آنزیم ها و کوآنزیم های بسیار خالص شده استفاده کنید. به عنوان مثال، با کمک این روش، امکان بازتولید کامل یک سیستم تخمیر که تمام ویژگی های ضروری تخمیر مخمر را دارد، فراهم شد.
- برداشتن اندام های فردی [نمایش]
البته، این روش ها تنها به عنوان یک گام ضروری برای دستیابی به هدف نهایی - درک عملکرد کل ارگانیسم، ارزش دارند.
ویژگی های مطالعه بیوشیمی انسان
شباهت های گسترده ای در فرآیندهای مولکولی موجودات مختلف ساکن زمین وجود دارد. فرآیندهای اساسی مانند بیوسنتز ماتریکس، مکانیسم های تبدیل انرژی، راه های اصلی تبدیل متابولیک مواد تقریباً در موجودات از باکتری ها به حیوانات بالاتر یکسان است. بنابراین، بسیاری از نتایج مطالعات انجام شده با E. coli برای انسان قابل اجرا است. هر چه رابطه فیلوژنتیکی گونه ها بیشتر باشد، در فرآیندهای مولکولی آنها بیشتر است.
اکثریت قریب به اتفاق دانش در مورد بیوشیمی انسان از این طریق به دست می آید: بر اساس فرآیندهای بیوشیمیایی شناخته شده در حیوانات دیگر، فرضیه ای در مورد محتمل ترین نوع این فرآیند در بدن انسان ساخته می شود و سپس این فرضیه با مطالعات مستقیم آزمایش می شود. سلول ها و بافت های انسانی این رویکرد امکان انجام تحقیقات بر روی مقدار کمی از مواد بیولوژیکی به دست آمده از انسان را فراهم می کند. اغلب، بافتهایی که در طی عملیات جراحی برداشته میشوند، سلولهای خونی (گلبولهای قرمز و لکوسیتها)، و همچنین سلولهای بافت انسانی رشد یافته در شرایط آزمایشگاهی استفاده میشوند.
مطالعه بیماری های ارثی انسان که برای توسعه روش های موثر برای درمان آنها ضروری است، به طور همزمان اطلاعات زیادی در مورد فرآیندهای بیوشیمیایی در بدن انسان ارائه می دهد. به طور خاص، نقص مادرزادی آنزیم منجر به تجمع بستر آن در بدن می شود. در مطالعه چنین اختلالات متابولیکی، گاهی اوقات آنزیم ها و واکنش های جدیدی کشف می شود، از نظر کمی ناچیز (به همین دلیل است که هنگام مطالعه هنجار مورد توجه قرار نگرفتند)، که با این حال، از اهمیت حیاتی برخوردار هستند.
تعداد زیادی از واکنش های شیمیایی مختلف به طور مداوم در سلول رخ می دهد که مسیرهای متابولیکی را تشکیل می دهند - تبدیل متوالی یک ترکیب به ترکیب دیگر. متابولیسم- مجموع تمام مسیرهای متابولیکی که در سلول های بدن رخ می دهد.
در بین تمام مسیرهای متابولیکی که در بدن اتفاق می افتد، فرآیندهای خلاف جهت متمایز می شوند: کاتابولیسم و آنابولیسم. کاتابولیسم- تجزیه مواد پیچیده به مواد ساده با آزاد شدن انرژی.
آنابولیسم- سنتز از مواد ساده تر پیچیده تر. مسیرهای متابولیک در مکان، زمان و شدت جریان با یکدیگر هماهنگ هستند. این سازگاری در مسیر همه فرآیندها با مکانیسم های پیچیده و متنوع نظارتی تضمین می شود.
سازماندهی واکنش های شیمیایی در مسیرهای متابولیک
فعالیت بهینه آنزیم هایی که واکنش های یک مسیر متابولیک را کاتالیز می کنند به دلیل سازماندهی فضایی خاصی در سلول به دست می آید.
- محلی سازی فضایی آنزیم ها
بیشتر آنزیم ها در داخل سلولی موضعی هستند و به طور نابرابر در بدن توزیع می شوند. همه آنزیم های یک مسیر متابولیک، به عنوان یک قاعده، در یک قسمت از سلول قرار دارند. به ویژه جداسازی مسیرهای متابولیک برای فرآیندهای کاتابولیک و آنابولیک با جهت مخالف مهم است. به عنوان مثال، سنتز اسیدهای چرب در سیتوپلاسم و تجزیه آنها در میتوکندری اتفاق می افتد. اگر چنین جدایی وجود نداشت، مسیرهایی شکل می گرفت که از نظر عملکردی و پرانرژی بی فایده بود.
در مسیرهای متابولیک، محصول اولین واکنش آنزیمی به عنوان بستری برای واکنش دوم عمل می کند و به همین ترتیب تا زمانی که محصول نهایی تشکیل شود. واسطه های مسیر متابولیک را می توان از توالی واکنش آزاد کرد و در سایر مسیرهای متابولیک استفاده کرد، یعنی. مسیرهای متابولیک توسط محصولات میانی به هم مرتبط هستند.
در تعدادی از موارد، سازماندهی فضایی آنزیم ها به قدری برجسته است که محصول واکنش تحت هیچ شرایطی نمی تواند از مسیر متابولیک جدا شود و لزوماً به عنوان بستری برای واکنش بعدی عمل می کند. این سازماندهی مسیر متابولیک نامیده می شود کمپلکس چند آنزیمیو در نتیجه سازماندهی ساختاری و عملکردی آنزیم ها به وجود می آید. به طور معمول، چنین مجتمع هایی با غشاها همراه هستند. نمونههایی از کمپلکسهای چند آنزیمی عبارتند از کمپلکس پیروات دهیدروژناز، که تحت تأثیر آن، دکربوکسیلاسیون اکسیداتیو پیروویک اسید (پیرووات) رخ میدهد (به بخش 6 مراجعه کنید)، اسید چرب سنتاز، که سنتز اسید پالمتیک را کاتالیز میکند (به بخش 8 مراجعه کنید).
- ساختار مسیرهای متابولیک
ساختار مسیرهای متابولیک در سلول بسیار متنوع است.
در صورتی که بستر در نتیجه یک سری فرآیندهای آنزیمی به یک محصول تبدیل شود، این مسیر نامیده می شود. مسیر متابولیک خطی. اغلب مسیرهای متابولیکی شاخه ای وجود دارد که بسته به نیاز سلول منجر به سنتز محصولات نهایی مختلف می شود.
ترکیب آنزیمی سلول های مختلف یکسان نیست. آنزیم هایی که عملکرد حمایت از حیات سلولی را انجام می دهند در تمام سلول های بدن یافت می شوند. در فرآیند تمایز سلولی، تغییر در ترکیب آنزیمی سلول ها رخ می دهد. بنابراین، آنزیم آرژیناز که در سنتز اوره نقش دارد، فقط در سلول های کبد و اسید فسفاتاز که در هیدرولیز مونواسترهای اسید اورتوفسفریک نقش دارد، در سلول های پروستات یافت می شود. اینها به اصطلاح هستند آنزیم های خاص اندام.
یک سلول یک سیستم عملکردی پیچیده است که پشتیبانی از زندگی خود را تنظیم می کند. تنوع عملکردهای سلولی با تنظیم مکانی و زمانی (در درجه اول، بسته به ریتم تغذیه) مسیرهای متابولیکی خاص فراهم می شود. تنظیم فضایی با محلی سازی دقیق آنزیم های خاص در اندامک های مختلف همراه است. بنابراین، در هسته آنزیم های مرتبط با سنتز مولکول های DNA و RNA، در سیتوپلاسم - آنزیم های گلیکولیز، در لیزوزوم ها - آنزیم های هیدرولیتیک، در ماتریکس میتوکندری - آنزیم های TCA، در غشای داخلی میتوکندری ها - آنزیم های الکترون وجود دارد. زنجیره حمل و نقل و غیره
اصول تنظیم مسیرهای متابولیک
تمام واکنش های شیمیایی در سلول با مشارکت آنزیم ها انجام می شود. بنابراین، برای تأثیرگذاری بر سرعت مسیر متابولیک، تنظیم میزان یا فعالیت آنزیم ها کافی است. معمولا آنزیم های کلیدی در مسیرهای متابولیک وجود دارند که سرعت کل مسیر را تنظیم می کنند. این آنزیم ها (یک یا چند در مسیر متابولیک) نامیده می شوند آنزیم های تنظیمی؛آنها معمولاً واکنشهای اولیه مسیر متابولیک، واکنشهای برگشتناپذیر، واکنشهای محدودکننده سرعت (کندترینها) یا واکنشهایی را در نقطه تغییر مسیر متابولیک (نقاط شاخه) کاتالیز میکنند.
تنظیم سرعت واکنش های آنزیمی در 3 سطح مستقل انجام می شود:
- تغییر در تعداد مولکول های آنزیم؛
- در دسترس بودن سوبسترا و مولکول های کوآنزیم؛
- تغییر در فعالیت کاتالیزوری مولکول آنزیم.
- تنظیم تعداد مولکول های آنزیم
در یک قفس
مشخص است که پروتئین های موجود در سلول به طور مداوم به روز می شوند. تعداد مولکول های آنزیم در یک سلول با نسبت 2 فرآیند تعیین می شود - سنتز و پوسیدگی مولکول پروتئین آنزیم:

سنتز و تا کردن پروتئین یک فرآیند چند مرحله ای است. تنظیم سنتز پروتئین می تواند در هر مرحله از تشکیل یک مولکول پروتئین رخ دهد. مکانیسم تنظیم سنتز یک مولکول پروتئین در سطح رونویسی، که توسط متابولیت های خاص، هورمون ها و تعدادی از مولکول های فعال بیولوژیکی انجام می شود، بیشتر مورد مطالعه قرار گرفته است.
در مورد تجزیه آنزیم ها، تنظیم این فرآیند کمتر مورد مطالعه قرار گرفته است. فقط می توان فرض کرد که این فقط یک فرآیند پروتئولیز (تخریب یک مولکول پروتئین) نیست، بلکه یک مکانیسم پیچیده است که احتمالاً در سطح ژنتیکی تعیین می شود.
- تنظیم نرخ آنزیمی
واکنش های در دسترس بودن مولکول های سوبسترا
و کوآنزیم ها
یک پارامتر مهم که جریان مسیر متابولیک را کنترل می کند، وجود بسترها و عمدتاً وجود اولین بستر است. هر چه غلظت سوبسترای اولیه بیشتر باشد، سرعت مسیر متابولیک بیشتر است.
پارامتر دیگری که مسیر متابولیک را محدود می کند، وجود کوآنزیم های بازسازی شده است. به عنوان مثال، در واکنش های هیدروژن زدایی، کوآنزیم دهیدروژنازها، اشکال اکسید شده NAD+، FAD، FMN هستند که در طی واکنش کاهش می یابند. برای اینکه کوآنزیم ها دوباره در واکنش شرکت کنند، بازسازی آنها ضروری است، یعنی. تبدیل به فرم اکسید شده
- تنظیم فعالیت کاتالیزوری
آنزیم ها
تنظیم فعالیت کاتالیزوری یک یا چند آنزیم کلیدی یک مسیر متابولیک معین نقش مهمی در تغییر سرعت مسیرهای متابولیک دارد. این یک راه بسیار موثر و سریع برای تنظیم متابولیسم است.
راه های اصلی تنظیم فعالیت آنزیم ها:
- تنظیم آلوستریک؛
- تنظیم توسط فعل و انفعالات پروتئین پروتئین.
- تنظیم توسط فسفوریلاسیون/دفسفوریلاسیون مولکول آنزیم.
- تنظیم با پروتئولیز جزئی (محدود).
تنظیم آلوستریک. آنزیم های آلوستریک آنزیم هایی هستند که فعالیت آنها نه تنها توسط تعداد مولکول های سوبسترا، بلکه توسط مواد دیگری به نام تنظیم می شود. عواملعوامل موثر در تنظیم آلوستریک اغلب متابولیت های سلولی همان مسیری هستند که تنظیم می کنند.
سه نوع مکانیسم در تنظیم مسیرهای متابولیک نقش دارند. اولین مورد از آنها، که سریعترین واکنش را به هر تغییری در وضعیت نشان می دهد، با عمل آنزیم های آلوستریک همراه است (شکل 13-15)، که فعالیت کاتالیزوری آنها می تواند تحت تأثیر مواد خاصی که تحریک کننده یا تحریک کننده هستند تغییر کند. اثر بازدارنده (اثرها یا تعدیل کننده نامیده می شوند؛ بخش 9.18).
به عنوان یک قاعده، آنزیم های آلوستریک مکانی را در ابتدا یا نزدیک آغاز یک توالی چند آنزیمی معین اشغال می کنند و آن مرحله از آن را کاتالیز می کنند، که سرعت کل فرآیند را محدود می کند. معمولاً نقش چنین مرحله ای با یک واکنش تقریباً برگشت ناپذیر ایفا می شود.
برنج. 13-15. تنظیم مسیر کاتابولیک توسط نوع بازخورد، یعنی به دلیل مهار آنزیم آلوستریک توسط محصول نهایی این فرآیند. حروف J، K، L و غیره نشان دهنده محصولات میانی این مسیر متابولیک و حروف E1، E2، E3 و غیره، آنزیم هایی هستند که تک تک مراحل را کاتالیز می کنند. مرحله اول توسط یک آنزیم آلوستریک (ED) کاتالیز می شود که توسط محصول نهایی این توالی واکنش مهار می شود. مهار آلوستریک با یک فلش قرمز چین نشان داده می شود که متابولیت بازدارنده را به واکنش کاتالیز شده توسط آنزیم آلوستریک متصل می کند.
در فرآیندهای کاتابولیک همراه با سنتز ATP از ADP، این محصول نهایی، ATP، اغلب به عنوان یک بازدارنده آلوستریک یکی از مراحل اولیه کاتابولیسم عمل می کند. یک مهارکننده آلوستریک یکی از مراحل اولیه آنابولیسم اغلب محصول نهایی بیوسنتز است، برای مثال، مقداری اسید آمینه (بخش 9.18). فعالیت برخی از آنزیم های آلوستریک توسط تعدیل کننده های مثبت خاص تحریک می شود. برای مثال، یک آنزیم آلوستریک که یکی از توالیهای واکنش کاتابولیک را تنظیم میکند، ممکن است در معرض اثر تحریکی تعدیلکنندههای مثبت-ADP یا AMP و اثر بازدارندگی یک تعدیلکننده منفی-ATP باشد. مواردی نیز شناخته می شوند که یک آنزیم آلوستریک یک مسیر متابولیک به روشی خاص به مواد واسطه یا محصولات نهایی سایر مسیرهای متابولیک واکنش نشان دهد. این امکان هماهنگی سرعت عمل سیستم های آنزیمی مختلف را فراهم می کند.
دومین نوع مکانیسمی که متابولیسم را در ارگانیسم های بالاتر تنظیم می کند، تنظیم هورمونی است (شکل 13-16). هورمونها مواد شیمیایی ویژه (واسطههای شیمیایی) نامیده میشوند که توسط غدد درونریز مختلف تولید میشوند و مستقیماً در خون آزاد میشوند. آنها توسط خون به بافت ها یا اندام های دیگر منتقل می شوند و در اینجا انواع خاصی از فعالیت متابولیک را تحریک یا مهار می کنند. به عنوان مثال، هورمون آدرنالین توسط مدولای آدرنال ترشح می شود و توسط خون به کبد منتقل می شود و در آنجا تجزیه گلیکوژن به گلوکز را تحریک می کند که باعث افزایش سطح قند خون می شود. علاوه بر این، آدرنالین تجزیه گلیکوژن در عضلات اسکلتی را تحریک می کند. این فرآیند منجر به تشکیل لاکتات و ذخیره انرژی در قالب ATP می شود. آدرنالین با چسبیدن به مکان های گیرنده خاصی در سطح سلول های ماهیچه ای یا کبدی این اثرات را ایجاد می کند.
اتصال آدرنالین به عنوان یک سیگنال عمل می کند. این سیگنال به بخشهای داخلی سلول منتقل میشود و در اینجا باعث تغییر کووالانسی میشود، که تحت تأثیر آن گلیکوژن فسفوریلاز (اولین آنزیم در سیستم که تبدیل گلیکوژن به گلوکز و سایر محصولات را کاتالیز میکند؛ بخش 9.22) از شکل کمتر فعال به شکل فعال تر (شکل 13-16).
نوع سوم مکانیسم هایی که متابولیسم را تنظیم می کنند با تغییر غلظت این آنزیم در سلول همراه است. غلظت هر آنزیم در هر لحظه با نسبت سرعت سنتز و فروپاشی آن تعیین می شود. سرعت سنتز برخی از آنزیم ها در شرایط خاص به طور چشمگیری افزایش می یابد. غلظت این آنزیم در سلول نیز بر همین اساس افزایش می یابد. به عنوان مثال، اگر حیوانی رژیم غذایی غنی از کربوهیدرات ها اما از نظر پروتئین فقیر دریافت کند، در کبد دارای محتوای بسیار کم آنزیم هایی است که در شرایط عادی تجزیه اسیدهای آمینه را به استیل کوآ کاتالیز می کند. از آنجایی که این آنزیم ها با چنین رژیمی عملاً مورد نیاز نیستند، در مقادیر زیاد تولید نمی شوند. با این حال، ارزش آن را دارد که حیوان را به یک رژیم غذایی غنی از پروتئین منتقل کنید و ظرف یک روز در کبد آن محتوای آنزیم ها به میزان قابل توجهی افزایش می یابد که اکنون برای تجزیه اسیدهای آمینه قابل هضم مورد نیاز است.

برنج. 13-16. تنظیم هورمونی واکنش آنزیمی. در نتیجه اتصال هورمون آدرنالین به گیرنده های خاص واقع در سطح سلول های کبدی، آدنیلات حلقوی با مشارکت یک آنزیم مرتبط با غشاء (آدنیلات سیکلاز) تشکیل می شود. دومی به عنوان یک فعال کننده آلوستریک یا واسطه درون سلولی عمل می کند که تحت تأثیر آن گلیکوژن فسفوریلاز از شکل غیرفعال به شکل فعال تغییر می کند که منجر به تسریع در تبدیل گلیکوژن کبد به گلوکز خون می شود. این مسیر متابولیک به تفصیل در فصل توضیح داده شده است. 25.

برنج. 13-17. القای آنزیم غلظت بالای سوبسترای A درون سلولی می تواند بیوسنتز آنزیم های E1، E2 و E3 را تحریک کند. محتوای این آنزیم ها در سلول افزایش می یابد و بنابراین می توان آن واکنش ها را تسریع کرد و در نتیجه مازاد سوبسترا A حذف می شود. بنابراین، مازاد سوبسترا A به عنوان یک سیگنال برای هسته سلول عمل می کند و آن را مجبور می کند تا ژن های کنترل کننده تشکیل آنزیم های El، E2 و E3 را "روشن" کند. گنجاندن ژن ها به معنای سنتز RNA پیام رسان مربوطه است. وارد ریبوزوم ها می شود و در نتیجه سنتز آنزیم های E1، E2 و E3 در آنها انجام می شود.
بنابراین سلول های کبدی بسته به ماهیت مواد مغذی ورودی به آنها، توانایی فعال یا خاموش کردن بیوسنتز آنزیم های خاص را دارند. این پدیده القای آنزیمی نامیده می شود (شکل 13-17).
بخش 2 1. مدولاسیون آلوستریک
در مدولاسیون آلوستریک، آنزیم تنظیمی دارای یک یا چند مرکز آلوستریک در ساختار خود است که می تواند به طور انتخابی با ترکیبات با وزن مولکولی کم به عنوان تعدیل کننده آلوستریک برهمکنش داشته باشد. در نتیجه این فعل و انفعال، ترکیب پروتئین-آنزیم تغییر می کند، از جمله تغییراتی در ساختار مرکز فعال که با تغییر در کارایی کاتالیز همراه است. اگر فعالیت کاتالیزوری آنزیم در این مورد افزایش یابد، ما با فعال سازی آلوستریک سروکار داریم. اگر فعالیت آنزیم کاهش یابد، پس ما در مورد مهار آلوستریک صحبت می کنیم. اتصال تعدیل کننده آلوستریک به مرکز آلوستریک آنزیم به دلیل فعل و انفعالات ضعیف رخ می دهد؛ بنابراین، به راحتی قابل برگشت است: با کاهش غلظت تعدیل کننده در محیط، مجموعه آنزیم- تعدیل کننده جدا می شود و آنزیم خود را بازیابی می کند. ترکیب اصلی و در نتیجه فعالیت کاتالیزوری آن.
به عنوان تعدیل کننده های آلوستریک در سلول، متابولیت های میانی یا محصولات نهایی یک یا آن مسیر متابولیک معمولاً عمل می کنند. رایج ترین نوع تنظیم آلوستریک به عنوان بازداری مجدد یا مهار بازخورد منفی شناخته می شود. در این حالت، محصول نهایی مسیر متابولیک، با یک مکانیسم آلوستریک، فعالیت آنزیم تنظیمی را که یکی از واکنشهای اولیه همان مسیر متابولیک را کاتالیز میکند، مهار میکند: مسیرهای متابولیک مسئول سنتز پورین یا پورین نوکلئوتیدهای پیریمیدین در سلول ها تنظیم می شوند.
به عنوان دومین نوع تنظیم آلوستریک، مکانیسم فعال سازی پیش ساز را می توان ذکر کرد. در این مورد، یکی از متابولیت های میانی تشکیل شده در ابتدای مسیر متابولیک به عنوان یک فعال کننده آلوستریک یک یا آنزیم دیگر عمل می کند و یکی از واکنش های نهایی همان مسیر متابولیک را کاتالیز می کند: .... به عنوان مثال، فعال شدن پیروات کیناز توسط فروکتوز-1،6-بیس فسفات در مسیر متابولیک تجزیه اکسیداتیو گلوکز است.
البته اصلاً لازم نیست که یک متابولیت میانی یا نهایی از همان مسیر متابولیک به عنوان تعدیل کننده آلوستریک یک آنزیم تنظیمی عمل کند. نمونه های زیادی از مدولاسیون آلوستریک جفت شده وجود دارد، زمانی که تعدیل کننده آلوستریک ترکیبی است که در مسیر متابولیکی دیگری تشکیل شده است. بنابراین، تجمع ATP در سلول، که مقدار اصلی آن در طول فسفوریلاسیون اکسیداتیو در زنجیره آنزیم های تنفسی تشکیل می شود، فعالیت آنزیم گلیکولیز فسفروکتوکیناز را با مکانیسم آلوستریک مهار می کند، فعالیت آنزیم گلوتامات دهیدروژناز ترانس دهیدروژناز را مهار می کند. سیستم، و فعالیت ایزوسیترات دهیدروژناز آنزیم چرخه کربس را مهار می کند. فقط باید توجه داشت که یک یا سطح دیگری از رابطه عملکردی را می توان بین چنین مسیرهای متابولیکی ردیابی کرد. در مثالی که قبلا داده شد، هر سه فرآیند متابولیک با این واقعیت به هم مرتبط هستند که عملکرد آنها مستقیماً با تولید ATP در سلول مرتبط است. برای تامین انرژی سلولی
2. اصلاح کووالانسی
اصلاح کووالانسی مکانیزمی برای تنظیم فعالیت آنزیم ها با اتصال یک گروه اتمی با کمک پیوند کووالانسی در مرکز تنظیمی آنزیم یا جدا کردن این گروه است. پیوستن یک گروه اضافی به آنزیم توسط پیوند کووالانسی منجر به تغییر در ترکیب پروتئین - آنزیم می شود که با تغییر در ساختار مرکز فعال و تغییر در کارایی کاتالیز همراه است. برش این گروه، بازیابی ترکیب اولیه آنزیم و در نتیجه بازگشت به سطح اولیه فعالیت کاتالیزوری آن را تضمین می کند. چنین گروههای اصلاحکنندهای میتوانند باقیماندههای اسید آدنیلیک، باقیماندههای گلیکوزیل باشند، اما اغلب فسفوریلاسیون با افزودن بقایای اسید فسفریک است. از آنجایی که تشکیل یا جدا شدن یک پیوند کووالانسی بین آنزیم و گروه تعدیل کننده در طی اصلاح کووالانسی رخ می دهد، دو آنزیم اضافی برای عملکرد مؤثر این مکانیسم مورد نیاز است: یک آنزیم اتصال گروه تعدیل کننده به آنزیم تنظیم کننده را تضمین می کند. آنزیم دوم حذف این گروه را تضمین می کند. ظاهراً، این آنزیمهای اضافی اتصال گروه تعدیلکننده را به یک باقیمانده اسید آمینه کاملاً تعریفشده از زنجیره پلیپپتیدی آنزیم تنظیمکننده و همچنین برش انتخابی آن تضمین میکنند. نمونه هایی از کار چنین مکانیسم های تنظیمی عبارتند از: فعال شدن گلیکوژن فسفوریلاز توسط فسفوریلاسیون آن، فعال شدن گلوتامات دهیدروژناز با آدنیلاسیون آن، کاهش فعالیت کمپلکس پیروات دهیدروژناز در نتیجه فسفوریلاسیون آن و کاهش فعالیت سنتت گلیکوژن. با فسفوریلاسیون آن چرخه کامل تنظیم فعالیت آنزیم با اصلاح کووالانسی آن را می توان با مثال گلیکوژن فسفوریلاز هپاتوسیت نشان داد.
3. برهمکنش پروتئین-پروتئین
بر اساس مفاهیم مدرن، آنزیم های مسیرهای متابولیک فردی در سلول ها، در اکثر موارد، به مجتمع های چند آنزیمی متابولون ها ترکیب می شوند. در ترکیب چنین متابولون هایی، هر آنزیم با یک یا چند آنزیم این مسیر متابولیک در تماس است. بنابراین، ترکیب و در نتیجه فعالیت کاتالیزوری هر آنزیم جداگانه به وضعیت آنزیم های دیگر در تماس با آن بستگی دارد. از این رو، تغییر در فعالیت کاتالیزوری آنزیم تنظیم کننده که بخشی از متابولون است، به عنوان مثال، با افزودن یک تعدیل کننده آلوستریک به آن، با تغییر در فعالیت آنزیم های متابولون دیگر همراه خواهد بود، زیرا آنها ترکیب در ترکیب کمپلکس پروتئین فوق مولکولی نیز دستخوش تغییرات خاصی خواهد شد. سلول ها و مایع خارج سلولی حاوی پروتئین هایی هستند که می توانند با پروتئین های آنزیمی تعامل داشته باشند و فعالیت آنها را تنظیم کنند. این پروتئین ها پروتئین های تعدیل کننده نامیده می شوند.
بنابراین، لیپوپروتئینهای پلاسمای خون شامل آپوپروتئینهای apo-C-II و apo-C-I هستند که به ترتیب در تعامل با آنزیمهای لیپوپروتئین لیپاز و لسیتین کلسترول آسیل ترانسفراز، فعالیت آنها را افزایش میدهند. در پلاسمای خون، یک آنتی ترومبین-III تعدیل کننده پروتئین نیز وجود دارد که در تعامل با آنزیم ترومبین سیستم انعقاد خون، دومی را غیرفعال می کند.
نمونه ای از پروتئین تعدیل کننده درون سلولی کالمودولین است. در یک حالت غیر فعال آزاد در سیتوزول سلول های اندام ها و بافت های مختلف وجود دارد. با افزایش غلظت یون های Ca2 + در سیتوزول، یک کمپلکس Ca-calmodulin تشکیل می شود، ترکیب کالمودولین تغییر می کند و مجموعه Ca-calmodulin توانایی تعامل با آنزیم های مختلف درون سلولی را به دست می آورد. در طی این برهمکنش، ترکیب پروتئین-آنزیم تغییر می کند و در نتیجه فعالیت کاتالیزوری آن تغییر می کند. با کاهش غلظت Ca2+ در سیتوزول، کمپلکس Ca-calmodulin تجزیه می شود، کالمودولین آزاد به دلیل تغییر در ساختار مولکول، تمایل خود را به آنزیم از دست می دهد. در نتیجه آنزیم از کمپلکس آزاد می شود و فعالیت کاتالیزوری آن به سطح اولیه خود باز می گردد. این روش فعالیت کاتالیزوری آنزیم هایی مانند گوانیلات سیکلاز، فسفودی استراز نوکلئوتیدهای حلقوی، پیرووات کربوکسیلاز، NAD-کیناز و غیره را تنظیم می کند (نمودار صفحه بعد را ببینید).
4. نقش مهار رقابتی و غیر رقابتی در تنظیم فعالیت آنزیم در سلول
این گونه از مکانیسم های تنظیم فعالیت آنزیم در سلول ها بسیار نادر استفاده می شود. نمونه ای از مهار رقابتی که در یک سلول برای تنظیم متابولیسم خود استفاده می شود، مهار فعالیت آنزیم سوکسینات دهیدروژناز چرخه اسید تری کربوکسیلیک توسط غلظت های بالای اگزالواستیک اسید یا مالات است که محصولات واسطه ای از همان متابولیک هستند. مسیر کاهش غلظت آنها در ماتریکس میتوکندری، جایی که این مسیر متابولیک عمل می کند، مهار را از بین می برد، یعنی. اثر تنظیمی برگشت پذیر است.
باید در نظر داشت که داروها اغلب مهارکننده های رقابتی یا غیر رقابتی آنزیم های مختلف هستند. بنابراین، داروی آلوپورینول که در درمان نقرس استفاده می شود، یک مهارکننده رقابتی معمولی آنزیم گزانتین اکسیداز است که در سلول در مرحله نهایی مسیر متابولیک برای سنتز اسید اوریک کار می کند. کاهش فعالیت این آنزیم منجر به کاهش غلظت اسید اوریک در خون و بافت ها می شود و از رسوب مجدد کریستال های اسید اوریک در بافت ها، مشخصه نقرس، جلوگیری می کند.
داروی استروفانتین G که در درمان نارسایی حاد قلبی استفاده می شود، یک مهارکننده غیررقابتی K,Na-ATPase غشای سلولی بیرونی میوکاردیوسیت ها است. عقیده ای وجود دارد که اثر درمانی این دارو به دلیل عادی سازی ترکیب یونی محیط داخلی میوکاردیوسیت ها در نتیجه اصلاح فعالیت این آنزیم غشایی است.
در میان بسیاری از آنزیم های موجود در سلول، همه آنها تنظیم کننده نیستند. با این حال، تقریباً هر مسیر متابولیک شامل یک یا چند آنزیم (2، گاهی اوقات حتی 3) است که شدت جریان متابولیت ها را در امتداد یک یا آن مسیر متابولیک کنترل می کند. این آنزیم ها معمولا واکنش های ترمودینامیکی برگشت ناپذیر را کاتالیز می کنند. آنها اغلب آنزیمهایی هستند که کمترین فعالیت کاتالیزوری را در بین تمام آنزیمها در یک مسیر متابولیک مشخص دارند و بنابراین سرعت جریان یک ماده را در طول مسیر متابولیک به عنوان یک کل کنترل میکنند. آنها معمولاً یکی از اولین واکنش های یک مسیر متابولیک معین را کاتالیز می کنند، که از تجمع واسطه های مسیر متابولیک در سلول در صورت کاهش فعالیت آنزیم جلوگیری می کند. آنزیمهایی از این نوع که جریان متابولیتها را در مسیر متابولیک کنترل میکنند و قادرند با تغییرات فعالیت به تأثیرات تنظیمی پاسخ دهند، «آنزیمهای کلیدی» نامیده میشوند. گاهی اوقات آنها را "آنزیم های ضربان ساز" نیز می نامند. نمونه هایی از این آنزیم ها آسپارتات کاربامویل ترانسفراز (یک مسیر متابولیک برای سنتز نوکلئوتیدهای پیریمیدین)، فسفوفروکتوکیناز (گلیکولیز)، یا ایزوسیترات دهیدروژناز (چرخه کربس تری کربوکسیلیک اسید) هستند.
5. انتقال مواد از طریق غشای سلولی
یک سلول می تواند از تغییرات در نفوذپذیری غشاء برای تنظیم متابولیسم خود استفاده کند، از جمله نفوذپذیری غشای خارجی و غشاهایی که بخش های جداگانه آن را جدا می کنند. بنابراین، هم غلظت سوبستراها برای یک یا آن مسیر متابولیک (به عنوان مثال، غلظت استیل کوآ در سیتوزول برای سنتز اسیدهای چرب بالاتر که از ماتریکس میتوکندری می آیند) و هم غلظت کوفاکتورهایی که از یک بخش سلولی به دیگری (به عنوان مثال، ADP از سیتوزول به ماتریکس میتوکندری).
انتقال مواد از طریق غشای سلولی می تواند از طریق سه نوع فرآیند اصلی انجام شود:
الف) انتشار ساده،
ب) انتشار تسهیل شده،
ج) حمل و نقل فعال
شدت انتشار ساده، یعنی. انتقال مواد در سراسر غشاء در امتداد گرادیان غلظت از طریق دولایه لیپیدی یا از طریق کانال های موجود در لایه لیپیدی تنظیم می شود، اولاً با تغییر حالت ساختاری غشا یا میکرو ویسکوزیته آن و ثانیاً با تغییر غلظت متابولیت منتقل شده. در طرف مقابل غشا. وضعیت غشاء را می توان با تغییر ترکیب آن تغییر داد، به عنوان مثال، با تغییر محتوای کلسترول در غشاها، و تغییر گرادیان غلظت متابولیت نسبت به غشا را می توان با تولید یا استفاده از آن در یکی از سلول ها تغییر داد. محفظه ها
تنظیم انتشار وقفی، یعنی. انتقال مواد در سراسر غشا در امتداد گرادیان غلظت با مشارکت حامل هم به دلیل عملکرد عوامل ذکر شده قبلی و هم به دلیل دو مکانیسم جدید انجام می شود: تغییر در محتوای حامل در غشاء یا به دلیل تغییر در وضعیت عملکردی وضعیت حامل های موجود. بنابراین، وقتی انسولین روی سلولهایی که گیرندههای این هورمون را دارند، اثر میکند، تعداد پروتئینهای حامل گلوکز در غشای خارجی آنها افزایش مییابد. تغییر در شدت حمل و نقل فعال، به عنوان مثال. انتقال مواد از طریق غشاها با مشارکت یک حامل در برابر گرادیان غلظتی که با هزینه های انرژی همراه است، اولاً به دلیل عملکرد مکانیسم هایی است که فرآیندهای انتشار تسهیل شده را تنظیم می کند و ثانیاً به دلیل تغییر در مقدار. از انرژی موجود به نوبه خود، انرژی یا با ارائه مکانیسمهای انتقال انرژی ATP یا با گرادیانهای الکتروشیمیایی گذرنده که توسط سلول ایجاد میشوند، برای مثال، گرادیانهای H+ یا گرادیانهای یون Na+ تامین میشود.
بنابراین، در طول تکامل، طبیعت مکانیسم های مختلفی ایجاد کرد که به سلول ها اجازه می دهد هم شدت فرآیندهای متابولیک را به طور کلی و هم مکانیسم های تنظیم انتخابی کار یک یا آن مسیر متابولیک را تنظیم کنند. تمام مکانیسم های تنظیمی که در بدن عمل می کنند را می توان به دو سطح تقسیم کرد: 1. مکانیسم هایی که تنظیم را در سطح سلول های منفرد یا مکانیسم های تنظیمی درون سلولی فراهم می کنند.
2. مکانیسم هایی که تنظیم فرآیندهای متابولیک را در سطح کل ارگانیسم تضمین می کند - مکانیسم های تنظیمی فوق سلولی.
هر یک از این سطوح را می توان به سطوح فرعی تقسیم کرد. بنابراین، در چارچوب سطح تنظیم درون سلولی، سطوح فرعی را می توان تشخیص داد:
سطح فرعی واکنش های شیمیایی فردی،
زیرسطح مسیرهای متابولیک،
سطح زیرین اندامک های سلولی،
زیرسطح شبکه مسیر متابولیک و سطح تنظیم فوق سلولی را می توان به سطوح فرعی تقسیم کرد:
زیرسطح یک بافت خاص
زیرسطح یک اندام
زیرسطح سیستم اندام
زیرسطح کل ارگانیسم
بخش 3 1.
نسخه دوم طبقه بندی بر اساس ماهیت شیمیایی هورمون ها است. هورمون ها با توجه به ماهیت شیمیایی خود به 4 دسته تقسیم می شوند:
1. هورمونهایی که ماهیتی پروتئینی دارند و در این کلاس دو زیردسته قابل تشخیص هستند:
الف) هورمون ها پروتئین های ساده ای هستند (انسولین، سوماتوتروپین).
ب) هورمون ها پروتئین های پیچیده ای هستند (هورمون محرک تیروئید، هورمون های گنادوتروپیک)، از نظر ماهیت شیمیایی آنها گلیکوپروتئین هستند.
2. پلی پپتیدهای هورمونی (لیبرین ها و استاتین های هیپوتالاموس، وازوپرسین و اکسی توسین، گلوکاگون، کورتیکوتروپین).
3. مشتقات هورمونی اسیدهای آمینه (ملاتونین، آدرنالین، تیرونین های یددار).
4. هورمون های استروئیدی (کورتیزول، آلدوسترون، پروژسترون، استرادیول، تستوسترون).
2. سلول های هدف و گیرنده های هورمونی
سلول هایی که قادرند به یک طریق به عملکرد یک هورمون پاسخ دهند، سلول های هدف این هورمون نامیده می شوند. به نوبه خود، اندام ها یا بافت هایی که اثر یک هورمون در آنها باعث واکنش بیوشیمیایی یا فیزیولوژیکی خاص می شود، اندام های هدف یا بافت های هدف برای این هورمون نامیده می شوند. فقط باید در نظر داشت که این یا آن بافت معمولاً حاوی چندین نوع سلول متمایز است و همه آنها به عملکرد یک هورمون خاص پاسخ نمی دهند.
برای اینکه یک سلول به ظاهر یک هورمون یا مولکول سیگنال دهنده دیگر در محیط خود واکنش نشان دهد، باید دارای ساختارهای تخصصی باشد که قادر به تشخیص این مولکول های سیگنالینگ باشد. گیرنده های سلولی چنین ساختارهای تخصصی هستند. از نظر ماهیت شیمیایی، گیرنده های سلولی پروتئین های گلیکوپروتئینی پیچیده ای هستند که دارای مراکز عملکردی تخصصی در ساختار خود هستند که قادر به تعامل انتخابی با یک یا آن مولکول سیگنال هستند.
همه گیرنده ها پروتئین های چند دامنه ای هستند. در یکی از حوزه ها مرکز اتصال مولکول سیگنال قرار دارد، این به اصطلاح حوزه تشخیص است. علاوه بر حوزه تشخیص، گیرندهها همیشه دارای دامنهای هستند که مسئول ایجاد مکانیسمهای درون سلولی هستند که پاسخ سلول به سیگنال تنظیمکننده خارجی را تضمین میکنند، این به اصطلاح دامنه کونژوگاسیون است. برهمکنش محل اتصال گیرنده با مولکول سیگنال آن، به عنوان مثال، با یک هورمون، ترکیب حوزه تشخیص را تغییر می دهد، موج تغییرات ساختاری، حوزه صرف را نیز می گیرد، که منجر به "فعال شدن" گیرنده و گنجاندن آن می شود. مکانیسم های درون سلولی برای اجرای سیگنال تنظیمی خارجی
3. هورمون های آزاد کننده (لیبرین ها)
1. تیرولیبرین (TRH) ترشح هورمون محرک تیروئید (TSH) را از غده هیپوفیز تحریک می کند.
2. کورتیکولیبرین (CRH) ترشح هورمون آدرنوکورتیکوتروپیک (ACTH) را از غده هیپوفیز تحریک می کند.
3. گونادولیبرین (GnRH) ترشح هورمون های لوتئینه کننده (LH) و محرک فولیکول (FSH) را از غده هیپوفیز تحریک می کند.
4. سوماتولیبرین (STH-RG) ترشح هورمون سوماتوتروپیک (STH) را از غده هیپوفیز تحریک می کند.
وجود پرولاکتولیبرین (PRL-RG) و هورمون محرک ملانوسیت لیبرین (MSH-RG) در هیپوتالاموس نیز فرض می شود، اما تاکنون امکان دستیابی به آنها به شکل بسیار خالص وجود نداشته است. ب). استاتین ها 1. سوماتواستاتین (SS)، که آزاد شدن هورمون رشد از غده هیپوفیز را مهار می کند. علاوه بر این، آزاد شدن TSH را مهار می کند.
2. پپتید مرتبط با گونادولیبرین (GAP)، که از آزاد شدن پرولاکتین (PRL) از غده هیپوفیز جلوگیری می کند. علاوه بر این، انتشار PRL به شدت توسط دوپامین مهار می شود. HAP و دوپامین گاهی اوقات تحت نام هورمون های مهارکننده پرولاکتین (PIH) ترکیب می شوند. وجود ملانوستاتین (MSH-S) نیز مشکوک است، اما وجود آن تایید نشده است.
گروه سوم هورمون های هیپوتالاموس از دو هورمون اکسی توسین و وازوپرسین تشکیل شده است که با سنتز شدن در هیپوتالاموس وارد غده هیپوفیز خلفی شده و به طور موقت در آنجا تجمع یافته و سپس وارد جریان خون می شوند. هورمون های هیپوفیز را نیز می توان به سه گروه تقسیم کرد. گروه اول شامل هورمون های غده هیپوفیز قدامی است که فعالیت غدد درون ریز محیطی را تحریک می کند. این شامل:
1. TSH که سنتز تترایدوتیرونین (T4) و تری یدوتیرونین (T3) را در غده تیروئید تحریک می کند.
2. ACTH که باعث تحریک سنتز گلوکوکورتیکوئیدها توسط قشر آدرنال می شود.
3. LH و FSH که باعث تحریک سنتز هورمون های جنسی در بیضه ها و تخمدان ها می شوند.
4. در کار مکانیسم های تنظیمی که از cAMP، cGMP یا محصولات هیدرولیز فسفاتیدهای اینوزیتول به عنوان پیام رسان دوم استفاده می کنند، یک نقطه مشترک در سیستم ها وجود دارد، مکانیسم های تقویت سیگنال گنجانده شده است. یک هورمون یا مولکول سیگنال دهنده دیگر، هنگامی که با یک گیرنده ترکیب می شود، آنزیمی را فعال می کند که باعث تشکیل مولکول های زیادی در سلول می شود که به عنوان پیام رسان دوم عمل می کنند. به نوبه خود، پیام رسان دوم همچنین آنزیمی را فعال می کند که قادر است به سرعت فعالیت عملکردی تعداد زیادی از مولکول های مختلف پروتئین را تغییر دهد که مستقیماً مسئول تشکیل پاسخ متابولیک سلول ها هستند. مکانیسم اثر هورمون ها تا حد زیادی به خواص فیزیکی و شیمیایی مولکول های هورمون بستگی دارد. هورمونهای پروتئینی، هورمونهای پپتیدی، هورمونهای مشتق از اسید آمینه، به استثنای تیرونینهای یددار، و همچنین سایر مولکولهای سیگنال مرتبط با ماهیت شیمیایی که دارای خواص آب دوست هستند، قادر به نفوذ به غشای سلولی خارجی نیستند. گیرنده های این تنظیم کننده های زیستی در سمت بیرونی غشای سلولی خارجی قرار دارند؛ بنابراین مکانیسم خاصی برای اطمینان از تبدیل سیگنال تنظیمی خارج سلولی به سیگنال درون سلولی مورد نیاز است. به عنوان یک قاعده، این با سنتز در سلول ترکیباتی همراه است که به عنوان پیام رسان درون سلولی یا "پیام رسان دوم" عمل می کنند که از تشکیل پاسخ متابولیک سلول ها به یک سیگنال تنظیمی خارجی اطمینان می دهد.
5. هورمونهای استروئیدی و تیرونینهای یددار که دارای خواص آبگریز هستند، میتوانند از غشای خارجی به داخل سلولها نفوذ کرده و با اتصال به گیرندههای خود در سیتوزول یا هسته، خود در تشکیل پاسخ متابولیک سلولها به سیگنالهای تنظیمی خارجی نقش داشته باشند. بنابراین این تنظیم کننده های زیستی به واسطه هایی مانند "پیام رسان دوم" نیاز ندارند.اثر تنظیمی هورمون های گروه اول اساساً بر اساس تغییر در فعالیت عملکردی پروتئین های موجود در سلول است، در حالی که اساس اثرات تنظیمی استروئید است. هورمون ها و تیرونین های ید دار در درجه اول تغییر در کارایی بیان ژن و بر این اساس تغییر در میزان پروتئین ها در سلول است. البته تحت تأثیر هورمونها-پروتئینها، هورمونها-پپتیدها و هورمونها-مشتقات اسید آمینه، تغییر در کارایی بیان ژن نیز میتواند رخ دهد، اما این نتیجه تأثیر روی ژنوم سلولی پروتئینهای تنظیمکننده اصلاحشده است. که ساختار آن معمولا با مشارکت غیرمستقیم پیام رسان های درون سلولی تغییر می کند. این ترکیبات به عنوان پیام رسان های درون سلولی یا پیام رسان های دوم شناخته می شوند که شناخته شده ترین نمایندگان آنها cAMP، cGMP، یون های Ca+، محصولات برش فسفاتید اینوزیتول، اینوزیتول تری فسفات و دی آسیل گلیسرول هستند.
بخش 4. 1. انسولین
انسولین یک هورمون پروتئینی است. این توسط سلول های b پانکراس سنتز می شود. انسولین یکی از مهم ترین هورمون های آنابولیک است. اتصال انسولین به سلول های هدف منجر به فرآیندهایی می شود که باعث افزایش سرعت سنتز پروتئین و همچنین تجمع گلیکوژن و لیپیدها در سلول ها می شود که ذخیره ای از مواد پلاستیکی و انرژی هستند. انسولین، احتمالاً به دلیل اثر آنابولیک، رشد و تولید مثل سلول ها را تحریک می کند.
مولکول انسولین از دو زنجیره پلی پپتیدی، زنجیره A و زنجیره B تشکیل شده است. زنجیره A از 21 باقیمانده اسید آمینه تشکیل شده است، زنجیره B شامل 30 است. این زنجیره ها توسط دو پل دی سولفیدی به هم مرتبط هستند: یکی بین A7 و B7 (اعداد اسید آمینه، شمارش از انتهای N زنجیره های پلی پپتیدی)، دوم بین A20 و B19. پل سوم دی سولفید در زنجیره A است که A6 و A11 را به هم متصل می کند.
محرک فیزیولوژیکی اصلی برای آزادسازی انسولین از سلول های b به داخل خون، افزایش گلوکز خون است.
اثر انسولین بر متابولیسم کربوهیدرات را می توان با اثرات زیر مشخص کرد:
1. انسولین نفوذپذیری غشای سلولی برای گلوکز را در بافت های به اصطلاح وابسته به انسولین افزایش می دهد.
2. انسولین تجزیه اکسیداتیو گلوکز در سلول ها را فعال می کند.
3. انسولین از تجزیه گلیکوژن جلوگیری می کند و سنتز آن را در سلول های کبدی فعال می کند.
4. انسولین تبدیل گلوکز به تری گلیسیرید ذخیره را تحریک می کند.
5. انسولین با کاهش فعالیت برخی از آنزیم های گلوکونئوژنز، گلوکونئوژنز را مهار می کند.
اثر انسولین بر متابولیسم لیپید شامل مهار لیپولیز در لیپوسیت ها به دلیل دفسفوریلاسیون لیپاز تری اسیل گلیسرول و تحریک لیپوژنز است.
انسولین اثر آنابولیک بر متابولیسم پروتئین دارد: ورود اسیدهای آمینه به سلول ها را تحریک می کند، رونویسی بسیاری از ژن ها را تحریک می کند و بر این اساس، سنتز بسیاری از پروتئین ها را، اعم از درون سلولی و خارج سلولی، تحریک می کند.
2. تیرونین ها
غده تیروئید دو هورمون 3،5،3-تری یدوتیرونین (T3) و 3،5،3،5-تترایودوتیرونین (تیروکسین، T4) تولید می کند که نقش مهمی در تنظیم متابولیسم عمومی، توسعه و تمایز بافت ها ایفا می کند. تشکیل این هورمون ها در طول پردازش پس از رونویسی پروتئین خاص تیروگلوبولین، که در طی آن سازماندهی ید در سلول های غده تیروئید تجمع می یابد، رخ می دهد. پروتئولیز درون سلولی بعدی تیروگلوبولین ید دار منجر به ترشح هورمون می شود.
سنتز تیرونین های ید دار در تیروسیت های غده تیروئید به عنوان بخشی از پروتئین یدوتیروگلوبولین اتفاق می افتد.
سنتز تیروگلوبولین روی ریبوزوم های تیروسیت در قسمت پایه سلول، سپس در مخازن شبکه آندوپلاسمی خشن و سپس در دستگاه گلژی، گلیکوزیلاسیون زنجیره های پلی پپتیدی مولکول با افزودن حدود دو اتفاق می افتد. دوجین بلوک الیگوساکارید
هورمونهای تیروئید به روشهای مختلفی غیرفعال میشوند: آنها میتوانند تحت ید زدایی، دآمیناسیون و دکربوکسیلاسیون قرار گیرند. در تمام این موارد، هورمون ها فعالیت بیولوژیکی خود را از دست می دهند. در کبد، محصولات تخریب هورمون های تیروئید می توانند کونژوگه شده و سپس در صفرا دفع شوند.
گیرنده های هورمون های تیروئید در سلول های اندام ها و بافت های مختلف یافت می شوند. گیرنده های میل ترکیبی پایین در سیتوزول سلول ها قرار دارند، در حالی که گیرنده های میل ترکیبی بالا در هسته همان سلول ها قرار دارند. معرفی تیروکسین به حیوانات آزمایشی با ایجاد تعادل مثبت نیتروژن همراه است، تولید گرما را افزایش می دهد و منجر به افزایش فعالیت بسیاری از سیستم های آنزیمی می شود. تا به امروز، نشان داده شده است که معرفی این هورمون منجر به افزایش فعالیت بیش از 100 آنزیم می شود. این افزایش در فعالیت تعداد زیادی از آنزیم ها به احتمال زیاد نشان دهنده اثر تحریکی برجسته هورمون بر سنتز پروتئین در بسیاری از اندام ها و بافت ها است.
معرفی هورمون های تیروئید در واقع منجر به افزایش تولید گرما می شود، اما این افزایش در تولید گرما به دلیل جدا نشدن اکسیداسیون و فسفوریلاسیون در میتوکندری نیست، بلکه به دلیل افزایش مصرف ATP در سلول ها در فرآیندهای وابسته به انرژی است.
3. آدرنالین
سلول های کرومافین مدولای فوق کلیوی گروهی از مواد فعال بیولوژیکی کاتکول آمین ها را تولید می کنند که شامل آدرنالین، نوراپی نفرین و دوپامین است که نقش مهمی در سازگاری بدن با استرس حاد و مزمن به ویژه در شکل گیری واکنش بدن ایفا می کند. جنگ یا گریز" نوع. در طول توسعه این واکنش در بدن، بسیج اضطراری منابع انرژی رخ می دهد: لیپولیز در بافت چربی تسریع می شود، گلیکوژنز در کبد فعال می شود و گلیکوژنولیز در عضلات تحریک می شود.
تمام کاتکول آمین ها از اسید آمینه تیروزین سنتز می شوند و آدرنالین تقریباً 80٪ از کاتکول آمین های تولید شده در بصل الکلیوی آدرنال را تشکیل می دهد. سنتز با تبدیل تیروزین به دی هیدروکسی فنیل آلانین (DOPA) آغاز می شود، واکنش توسط آنزیم تیروزین هیدروکسیلاز کاتالیز می شود. گروه پروتزی آنزیم تتراهیدروبیوپترین است. طی واکنش بعدی، DOPA با مشارکت آنزیم DOPA-decarboxylase دچار دکربوکسیلاسیون می شود، گروه پروتزی این آنزیم پیریدوکسال فسفات است.
دوپامین تولید می شود. در طی اکسیداسیون، اسید اسکوربیک به عنوان یک دهنده الکترون (هم بستر واکنش) استفاده می شود. در واکنش نهایی، نوراپی نفرین در گروه آمینه با تبدیل آن به آدرنالین متیله می شود؛ S-آدنوزیل متیونین به عنوان دهنده گروه متیل استفاده می شود.
تحت تأثیر تکانه های عصبی که از طریق عصب سلیاک وارد بصل الکلیوی آدرنال می شوند، گرانول های کرومافین با انتشار کاتکول آمین ها در جریان خون با غشای پلاسمایی ادغام می شوند. آدرنالین وارد جریان خون به شکل کمپلکسی که با آلبومین ارتباط ضعیفی دارد همراه با جریان خون به سایر اندام ها و بافت ها منتقل می شود.
مدت زمان وجود آدرنالین در جریان خون با زمان 10 30 ثانیه اندازه گیری می شود. غلظت آن در پلاسمای خون به طور معمول از 0.1 میکروگرم در لیتر (کمتر از 0.55 نانومولار در لیتر) تجاوز نمی کند. غیرفعال شدن آدرنالین، مانند سایر کاتکول آمین ها، می تواند از طریق دآمیناسیون اکسیداتیو یا با متیلاسیون O رخ دهد. محصولات نهایی اصلی غیرفعال سازی آدرنالین که از طریق ادرار دفع می شوند متانفرین و وانیلین ماندلیک اسید هستند.
هنگامی که هورمون به گیرنده های b1 و b2 متصل می شود، آدنیلات سیکلاز با واسطه برهمکنش گیرنده های فعال شده با پروتئین های Gs فعال می شود که با افزایش غلظت cAMP در سلول همراه است. هنگامی که هورمون با گیرنده a2 با مشارکت پروتئین Gi تعامل می کند، آدنیلات سیکلاز مهار می شود و غلظت cAMP در سلول کاهش می یابد.
در مورد عمل آدرنالین از طریق گیرنده های b2، تجزیه گلیکوژن در کبد با آزاد شدن گلوکز در جریان خون تحریک می شود، در حالی که تحریک جزئی گلوکونئوژنز در سلول های کبدی وجود دارد. در ماهیچه ها، آدرنالین گلیکوژنولیز را از طریق گیرنده های b2 تحریک می کند. اپی نفرین از طریق این نوع گیرنده باعث افزایش ترشح انسولین و گلوکاگون در پانکراس یا ترشح رنین در کلیه ها می شود.
4. گلوکاگون
گلوکاگون یک هورمون پلی پپتیدی است که توسط سلول های a پانکراس ترشح می شود. عملکرد اصلی این هورمون حفظ هموستاز انرژی بدن با بسیج منابع انرژی درون زا است که اثر کلی کاتابولیک آن را توضیح می دهد.
ترکیب زنجیره پلی پپتیدی گلوکاگون شامل 29 باقی مانده اسید آمینه است، وزن مولکولی آن 4200 است، حاوی سیستئین نیست. گلوکاگون به صورت شیمیایی سنتز شد که در نهایت ساختار شیمیایی آن را تایید کرد.
محل اصلی سنتز گلوکاگون سلول های α پانکراس است، اما مقادیر بسیار زیادی از این هورمون در سایر اندام های دستگاه گوارش نیز تشکیل می شود. گلوکاگون بر روی ریبوزوم های سلول های a به شکل یک پیش ساز طولانی تر با وزن مولکولی حدود 9000 سنتز می شود. در طول پردازش، کوتاه شدن قابل توجهی از زنجیره پلی پپتیدی رخ می دهد، پس از آن گلوکاگون به خون ترشح می شود. در خون به صورت آزاد است، غلظت آن در سرم خون 100-20 نانوگرم در لیتر است. نیمه عمر آن تقریباً 5 دقیقه است. بخش اصلی گلوکاگون در کبد با برش هیدرولیتیک 2 باقی مانده اسید آمینه از انتهای N مولکول غیرفعال می شود.
ترشح گلوکاگون توسط سلولهای a پانکراس به دلیل سطوح بالای گلوکز خون و همچنین سوماتوستاتین ترشح شده توسط سلولهای D پانکراس مهار میشود. این امکان وجود دارد که ترشح گلوکاگون نیز توسط انسولین یا IGF-1 مهار شود. ترشح با کاهش غلظت گلوکز در خون تحریک می شود، اما مکانیسم این اثر نامشخص است. علاوه بر این، ترشح گلوکاگون توسط هورمون رشد غده هیپوفیز، آرژنین و Ca2+ تحریک می شود.
مکانیسم اثر گلوکاگون به خوبی شناخته شده است. گیرنده های هورمون در غشای سلولی خارجی قرار دارند. تشکیل مجتمع های گیرنده هورمونی با فعال شدن آدنیلات سیکلاز و افزایش غلظت cAMP در سلول ها همراه با فعال شدن پروتئین کیناز و فسفوریلاسیون پروتئین ها با تغییر در فعالیت عملکردی دومی همراه است.
تحت تأثیر گلوکاگون در سلول های کبدی، حرکت گلیکوژن با آزاد شدن گلوکز در خون تسریع می شود. این اثر هورمون به دلیل فعال شدن گلیکوژن فسفوریلاز و مهار گلیکوژن سنتتاز در نتیجه فسفوریلاسیون آنهاست. لازم به ذکر است که گلوکاگون بر خلاف آدرنالین بر میزان گلیکوژنولیز در عضلات تأثیری ندارد.
گلوکاگون فرآیند گلوکونئوژنز را در سلولهای کبدی فعال میکند: اولاً، تجزیه پروتئینها را در کبد تسریع میکند و اسیدهای آمینه حاصل به عنوان سوبسترا برای گلوکونئوژنز استفاده میشوند. ثانیاً، فعالیت تعدادی از آنزیم ها افزایش می یابد، مانند فروکتوز-1،6-بیس فسفاتاز، فسفونول پیروات کربوکسی کیناز، گلوکز-6-فسفاتاز، که هم به دلیل فعال شدن آنزیم های موجود و هم به دلیل القای سنتز آنها در گلوکونئوژنز نقش دارند. به دلیل فعال شدن گلوکونئوژنز، جریان گلوکز در خون نیز افزایش می یابد. تسریع در استفاده از اسیدهای آمینه برای گلوکونئوژنز با افزایش حجم سنتز اوره و افزایش مقدار اوره دفع شده در ادرار همراه است.
گلوکاگون لیپولیز را در لیپوسیت ها تحریک می کند و در نتیجه جریان گلیسرول و اسیدهای چرب بالاتر را در خون افزایش می دهد. در کبد، این هورمون سنتز اسیدهای چرب و کلسترول از استیل کوآ را مهار می کند و استیل کوآ انباشته شده برای سنتز اجسام استونی استفاده می شود. بنابراین، گلوکاگون کتوژنز را تحریک می کند.
در کلیه ها، گلوکاگون فیلتراسیون گلومرولی را افزایش می دهد، که ظاهراً افزایش دفع سدیم، کلرید، پتاسیم، فسفر و یون های اسید اوریک مشاهده شده پس از تجویز گلوکاگون را توضیح می دهد.
5. کورتیزول
گلوکوکورتیکوئید اصلی انسان کورتیزول است: 10-30 میلی گرم کورتیزول و 2-4 میلی گرم گلوکوکورتیکوئید دیگر، کورتیکوسترون، در روز در غدد فوق کلیوی سنتز می شوند. هورمون های قشر آدرنال، به ویژه گلوکوکورتیکوئیدها، نقش مهمی در سازگاری با استرس شدید دارند.
ساختار تمام هورمون های استروئیدی بر اساس هسته سیکلوپنتان پرهیدروفنانترن است که دارای 17 اتم کربن و شامل چهار چرخه یا حلقه است که با حروف A، B، C و D نشان داده می شود.
سنتز کورتیزول در سلول های ناحیه فاسیکولار و شبکه ای قشر آدرنال انجام می شود. ترکیب اولیه برای سنتز کورتیزول کلسترول است، از خون وارد سلول های قشر آدرنال می شود، تنها قسمت کوچکی از آن در سلول ها با سنتز استیل-CoA تشکیل می شود.
ترشح کورتیزول تا حد زیادی تحت تاثیر استرس فیزیکی و عاطفی، اضطراب، ترس و غیره است، اما تمام این اثرات توسط سیستم عصبی از طریق پیوند هیپوتالاموس تنظیم می شود.
معرفی کورتیزول منجر به افزایش محتوای اسیدهای چرب بالاتر در پلاسمای خون می شود. تا حدی، این ممکن است نتیجه تحریک لیپولیز در سلول های بافت چربی باشد. جالب اینجاست که مقادیر بیش از حد کورتیزول باعث تحریک لیپولیز در بافت چربی اندام ها می شود، اما در عین حال لیپوژنز در بافت چربی تنه و صورت تحریک می شود. مهار ورود گلوکز به سلولهای بافتهای محیطی کمک خاصی به افزایش سطح اسیدهای چرب بالاتر میکند: اولاً، کمبود گلوکز در سلولهای بافتهای محیطی منجر به افزایش تحرک تری گلیسیرید ذخیره میشود. ثانیاً، کمبود گلوکز در لیپوسیت ها منجر به کمبود فسفودی هیدروکسی استون در آنها می شود که برای سنتز تری گلیسیرید ضروری است، اسیدهای چرب بالاتر استفاده نشده نیز از لیپوسیت ها وارد خون می شوند.