واکنش های شیمیایی خاصی توسط واکنش های خاصی کاتالیز می شوند. شیمی فیزیک. طبقه بندی واکنش های شیمیایی
شیمی عمومی: کتاب درسی / A. V. Zholnin; ویرایش شده توسط V. A. Popkova، A. V. Zholnina. - 2012. - 400 ص: بیمار.
فصل 2. مبانی سینتیک واکنش های شیمیایی
فصل 2. مبانی سینتیک واکنش های شیمیایی
تفاوت بین تنفس و احتراق فقط در سرعت فرآیند است.
A.-L. لاووازیه
2.1. سینتیک شیمیایی. موضوع و مفاهیم اساسی سینتیک شیمیایی. واکنش سریع
جهت، عمق و امکان اساسی وقوع فرآیند با بزرگی تغییر در انرژی آزاد قضاوت می شود. (ΔG ≤0). با این حال، این مقدار نشان دهنده امکان واقعی واکنش در این شرایط نیست.
به عنوان مثال، واکنش بین اکسید نیتروژن و اکسیژن بلافاصله در دمای اتاق رخ می دهد:
در همان زمان، 2H 2 (g) + O 2 (g) = 2H 2 O (l)، Δ °G= -286.8 کیلوژول / مول - واکنشی که با کاهش قابل توجهی بیشتر در انرژی آزاد مشخص می شود؛ در شرایط عادی این برهمکنش رخ نمی دهد، اما در دمای 700 درجه سانتیگراد یا در حضور یک کاتالیزور، فرآیند فورا رخ می دهد. در نتیجه، ترمودینامیک به سؤال شرایط و سرعت فرآیند پاسخ نمی دهد. این محدودیت های رویکرد ترمودینامیکی را نشان می دهد. برای توصیف یک واکنش شیمیایی، شناخت الگوهای وقوع آن در طول زمان نیز ضروری است که توسط سینتیک مطالعه می شود.
سینتیک شاخه ای از شیمی است که به مطالعه سرعت، مکانیسم واکنش های شیمیایی و تأثیر عوامل مختلف بر آنها می پردازد.
بسته به اینکه اجزای واکنش در یک یا چند فاز هستند، سینتیک واکنش های همگن و ناهمگن را تشخیص می دهند. با توجه به مکانیسم، واکنش ها به ساده و پیچیده تقسیم می شوند، بنابراین سینتیک واکنش های ساده و پیچیده متمایز می شوند.
مفهوم اصلی سینتیک واکنش است سرعت واکنش شیمیاییتعیین سرعت واکنش های شیمیایی از اهمیت بیولوژیکی و اقتصادی برخوردار است.
سرعت یک واکنش شیمیایی با مقدار ماده واکنش داده شده در واحد زمان در واحد حجم تعیین می شود (در مورد واکنش های همگن، زمانی که واکنش دهنده ها در یک فاز هستند) یا رابط هر واحد(در مورد واکنش های ناهمگن، زمانی که واکنش دهنده ها در فازهای مختلف هستند).
سرعت واکنش با تغییر در غلظت هر یک از محصولات اولیه یا نهایی واکنش به عنوان تابعی از زمان مشخص می شود. معادله ای که وابستگی سرعت واکنش (v) به غلظت را توصیف می کند (با)واکنش دهنده ها نامیده می شوند جنبشیسرعت واکنش اغلب بر حسب mol/l-s، در بیوشیمی در mg/100 ml-s یا در کسر جرمی در %/100 ml-s بیان میشود. بین سرعت متوسط واکنش در یک بازه زمانی و سرعت واکنش واقعی در یک نقطه خاص از زمان تمایز قائل میشود. اگر در بازه زمانی t 1و t 2غلظت یکی از مواد اولیه یا محصولات واکنش به ترتیب برابر با c 1 و c 2 است، سپس میانگین سرعت واکنش (v) در بازه زمانی t 1و t 2می توان بیان کرد:
از آنجایی که در این مورد ما در مورد کاهش غلظت ماده اولیه صحبت می کنیم، یعنی. تغییر در غلظت ماده در این مورد با علامت منفی (-) گرفته می شود. اگر سرعت واکنش با تغییر (افزایش) در غلظت یکی از محصولات واکنش ارزیابی شود، با علامت مثبت (+):
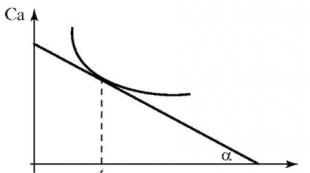
با استفاده از رابطه (2.2) تعیین می کنیم سرعت متوسطواکنش شیمیایی. سرعت واقعی (آنی).واکنش ها به صورت گرافیکی تعیین می شوند. نموداری از غلظت ماده اولیه یا محصول واکنش (Ca) در مقابل زمان (t) بسازید - منحنی جنبشی واکنش Ca - f(t)برای یک فرآیند غیر خطی (شکل 2.1).
در هر نقطه از زمان (مثلا t 1)سرعت واکنش واقعی برابر است با مماس مماس بر منحنی جنبشی در نقطه مربوط به زمان معین. با توجه به نمودار، سرعت واکنش لحظه ای با استفاده از فرمول محاسبه می شود:
در بیوشیمی، برای توصیف سینتیک واکنش های آنزیمی استفاده می شود. معادله مایکلیس-منتن،که وابستگی سرعت واکنش کاتالیز شده توسط آنزیم را به غلظت سوبسترا و آنزیم نشان می دهد. ساده ترین طرح جنبشی که معادله مایکلیس برای آن معتبر است: E+ اس↔ES→E+ پ:

برنج. 2.1.منحنی جنبشی
جایی که Vm- حداکثر سرعت واکنش؛ Km ثابت Michaelis است، برابر با غلظت بستر که در آن سرعت واکنش نصف حداکثر است. اس- غلظت بستر
مطالعه سرعت یک واکنش شیمیایی به ما امکان می دهد اطلاعاتی در مورد مکانیسم آن به دست آوریم. سرعت واکنش علاوه بر غلظت، به ماهیت معرفها، شرایط خارجی و وجود کاتالیزور بستگی دارد.
2.2. مولکولی و ترتیب واکنش. نیمه عمر
در سینتیک، واکنش های شیمیایی از نظر مولکولی و ترتیب واکنش متفاوت است. مولکولی بودن واکنشبا تعداد ذرات (اتم ها، مولکول ها یا یون ها) که به طور همزمان در عمل اولیه تبدیل شیمیایی شرکت می کنند تعیین می شود. یک، دو یا سه مولکول می توانند در یک واکنش اولیه شرکت کنند. احتمال برخورد ذرات بیشتر بسیار کم است. بر اساس این ویژگی، واکنش های تک مولکولی، دو مولکولی و سه مولکولی متمایز می شوند. به طور تجربی، مولکولی بودن یک واکنش را می توان تنها برای واکنش های ابتدایی (ساده) که در یک مرحله مطابق با معادله استوکیومتری رخ می دهند، تعیین کرد. برای رخ دادن بیشتر این واکنش ها، انرژی فعال سازی زیادی مورد نیاز است (150-450 کیلوژول بر مول).
بیشتر واکنش ها پیچیده هستند. مجموعه مراحل ابتدایی که یک واکنش پیچیده را تشکیل می دهند نامیده می شود مکانیسم واکنش
یون هابنابراین، برای توصیف سینتیک واکنش، این مفهوم معرفی شده است ترتیب واکنش،که با معادله استوکیومتری مشخص می شود.
مجموع پارامترهای استوکیومتری همه مواد اولیه موجود در معادله واکنش (2.5) (آ+ ب) ترتیب کلی واکنش را تعیین می کند. شاخصی که با آن یک معرف معین وارد معادله می شود، ترتیب واکنش ماده (ترتیب واکنش جزئی) نامیده می شود، به عنوان مثال، نشانگر آ- ترتیب واکنش برای ماده A، ب- برای ماده B. ترتیب واکنش و مولکولی فقط برای واکنش های ساده یکسان است. ترتیب یک واکنش توسط موادی تعیین می شود که بر سرعت واکنش تأثیر می گذارند.
واکنش های تک مولکولی شامل واکنش های تجزیه و ایزومریزاسیون است.
واکنش هایی که معادله سرعت آنها شامل غلظت یک واکنش دهنده به توان اول باشد، واکنش های مرتبه اول نامیده می شوند.
معادله جنبشی شامل موادی است که غلظت آنها در طول واکنش تغییر می کند. غلظت موادی که بیش از حد قابل توجهی هستند در طول واکنش تغییر نمی کند.
آب در واکنش هیدرولیز کربنات سدیم بیش از حد قابل توجهی است و در معادله جنبشی لحاظ نمی شود.
در سیستم های ناهمگن، برخورد ذرات در سطح مشترک رخ می دهد، بنابراین جرم فاز جامد بر سرعت واکنش تاثیر نمی گذارد و بنابراین در بیان سرعت واکنش در نظر گرفته نمی شود.
واکنشهای دو مولکولی شامل واکنشهای دیمریزاسیون و واکنشهای جایگزینی است که در مرحله رخ میدهند مجتمع فعال شده
واکنش هایی که سرعت آنها متناسب با حاصل ضرب غلظت دو ماده به توان اول یا مجذور غلظت یک ماده باشد، واکنش های مرتبه دوم نامیده می شوند.
واکنش های سه مولکولی نادر هستند و واکنش های چهار مولکولی ناشناخته هستند.
در بین فرآیندهای بیوشیمیایی، واکنش های مرتبه سوم رخ نمی دهد.
واکنش هایی که سرعت آنها به غلظت مواد اولیه بستگی ندارد، واکنش های مرتبه صفر (v = k) نامیده می شوند.
نمونه ای از واکنش های مرتبه صفر، واکنش های کاتالیزوری است که سرعت آن ها تنها به غلظت کاتالیزور بستگی دارد. یک مورد خاص از این گونه واکنش ها، واکنش های آنزیمی است.
به عنوان یک قاعده، چندین معرف (سوبسترا، کوآنزیم، کوفاکتور) در فرآیندهای بیوشیمیایی دخیل هستند. گاهی اوقات همه آنها شناخته شده نیستند. بنابراین، پیشرفت فرآیند بر اساس یک ماده مورد قضاوت قرار می گیرد. در این مورد، یک ویژگی کمی از سیر واکنش ها در طول زمان است دوره نیمه عمر (زمان)معرف - زمانی که در طی آن مقدار یا غلظت ماده شروع به نصف می رسد (50٪) یا نیمی از محصولات واکنش تشکیل می شود. به ویژه، تجزیه رادیونوکلئیدها به این ترتیب مشخص می شود، زیرا نیمه عمر آنها به مقدار اولیه بستگی ندارد.
با تجزیه و تحلیل وابستگی نیمه عمر واکنش به غلظت اولیه می توان ترتیب واکنش را تعیین کرد (روش استوالد- نویز). ثبات دوره نیمه عمر (در یک دمای معین) مشخصه بسیاری از واکنش های تجزیه و به طور کلی واکنش های مرتبه اول است. با افزایش غلظت معرف، دوره نیمه تبدیل برای واکنش های مرتبه دوم کاهش و برای واکنش های مرتبه صفر افزایش می یابد.
2.3. نرخ واکنش ثابت، تعریف آن. قانون توده های بازیگر
سرعت واکنش های همگن به تعداد برخورد ذرات واکنش دهنده در واحد زمان در واحد حجم بستگی دارد. احتمال برخورد ذرات برهم کنش با حاصلضرب غلظت مواد واکنش دهنده متناسب است. بنابراین، سرعت واکنش مستقیماً با حاصلضرب غلظت مواد واکنشدهنده، در توانهایی برابر با ضرایب استوکیومتری مواد مربوطه در معادله واکنش، متناسب است. این الگو نامیده می شود قانون عمل توده ای(قانون سرعت واکنش شیمیایی) که می باشد
قانون اساسی سینتیک شیمیایی قانون عمل جمعی توسط دانشمندان نروژی K. Guldberg و P. Vahe در سال 1867 ایجاد شد.
به عنوان مثال، برای واکنشی که طبق طرح به شکل کلی پیش میرود
معادله جنبشی معتبر خواهد بود:
جایی که v- سرعت واکنش شیمیایی؛ با یکو با B- غلظت مواد آو که در[mol/l]؛ v aو v b- نشانگرهای سفارش برای معرف ها آو B; ک- ثابت سرعت یک واکنش شیمیایی - ضریبی که به غلظت واکنش دهنده ها بستگی ندارد.
ثابت سرعت واکنش شیمیایی (ک) نشان دهنده سرعت یک واکنش شیمیایی در شرایطی است که محصول غلظت واکنش دهنده ها 1 مول در لیتر است. در این مورد v = k.
به عنوان مثال، اگر در واکنش H 2 (g) + I 2 (g) = 2HI (g) c(H 2) و c(I 2) برابر با 1 mol/l باشند یا اگر c(H 2) برابر باشد. سپس به 2 mol/l و c(I 2) 0.5 mol/l می رسد v= k
واحدهای ثابت تعادل با استوکیومتری واکنش تعیین می شوند. مقایسه ثابتهای سرعت واکنشهای مرتبههای مختلف با یکدیگر نادرست است، زیرا آنها کمیتهای مختلف با معانی متفاوت هستند و ابعاد متفاوتی دارند.
2.4. مکانیسم واکنش های شیمیایی. طبقه بندی واکنش های پیچیده
مکانیسم واکنش تمام برخوردهای ذرات منفرد را که به طور همزمان یا متوالی رخ می دهند در نظر می گیرد. مکانیسم یک تصویر استوکیومتری دقیق از هر مرحله واکنش نشان می دهد، به عنوان مثال. درک مکانیسم به معنای تعیین مولکولی بودن هر مرحله واکنش است. مطالعه مکانیسم واکنش های شیمیایی کار بسیار دشواری است. از این گذشته ، ما نمی توانیم مشاهدات مستقیمی از پیشرفت برهمکنش مولکول ها انجام دهیم. نتایج به دست آمده گاهی به اندازه و شکل رگ بستگی دارد. در برخی موارد، نتایج یکسان را می توان با استفاده از مکانیسم های مختلف توضیح داد.
واکنش گاز هیدروژن با ید H 2 (g) + I 2 (g) = 2HI (g) یک مثال کلاسیک از واکنش دو مولکولی دوم در نظر گرفته شد.
سفارش داد، اما در سال 1967 N.N. Semenov، G. Ayring و J. Sullivan نشان دادند که پیچیده است و از 3 واکنش اولیه تشکیل شده است: I 2 = 2I; 2I = I 2 ; 2I + H2 = 2HI. اگرچه واکنش را می توان به طور رسمی به عنوان سه مولکولی طبقه بندی کرد، اما سرعت آن با یک معادله جنبشی توصیف می شود که یادآور معادله واکنش مرتبه دوم است:

در واکنشهای پیچیده، مولکولی و ترتیب واکنش معمولاً با هم منطبق نیستند. ترتیب غیرمعمول - کسری یا منفی - یک واکنش به وضوح مکانیسم پیچیده آن را نشان می دهد.
معادله جنبشی برای اکسیداسیون مونوکسید کربن با اکسیژن 2CO (g) + O 2 (g) = CO 2 (g) نسبت به CO یک مرتبه منفی (منهای اول) دارد:
با افزایش غلظت مونوکسید کربن، سرعت واکنش کاهش می یابد.
با توجه به مکانیسم واکنش، واکنش ها را می توان به چند نوع تقسیم کرد.
واکنش های مداومواکنش های پیچیده ای نامیده می شوند که در هر یک از آنها محصول (X 1) مرحله اول ابتدایی با حاصلضرب مرحله دوم واکنش می دهد، محصول (X 2) مرحله دوم تا مرحله نهایی وارد مرحله سوم و غیره می شود. محصول تشکیل می شود:

جایی که اس- بستر (معرف اولیه)؛ k 1، k 2، k 3 ... - ثابت نرخ 1، 2، و غیره. مراحل واکنش؛ پ- محصول نهایی.
مراحل واکنش های متوالی با سرعت های مختلف رخ می دهد. مرحله ای که ثابت سرعت آن حداقل است، محدود کننده نامیده می شود.الگوی جنبشی واکنش را به عنوان یک کل تعیین می کند. مواد تشکیل شده در مراحل میانی نامیده می شوند محصولات میانییا واسطه ها،که بستری برای مراحل بعدی هستند. اگر یک واسطه به آرامی و به سرعت تجزیه شود، غلظت آن برای مدت طولانی تغییر نمی کند. تقریباً تمام فرآیندهای متابولیک واکنش های متوالی هستند (به عنوان مثال، متابولیسم گلوکز).
واکنش های موازیواکنشهایی هستند که معرفهای شروع یکسانی دارند و با محصولات مختلف مطابقت دارند. با سرعت واکنش های موازی برابر است با مجموع سرعت هر واکنش.این قانون در مورد واکنش های شیمیایی موازی دو مولکولی نیز صدق می کند.
واکنش های سری-موازیبه واکنشهایی گفته میشود که دارای معرفهای اولیه یکسانی هستند، که میتوانند در طول دو یا چند مسیر (مکانیسم)، از جمله با تعداد متفاوتی از مراحل میانی واکنش نشان دهند. این مورد زمینه ساز این پدیده است کاتالیزور،زمانی که یک واسطه در یکی از مسیرها سرعت مسیرهای دیگر را افزایش می دهد.
واکنش های رقابتیواکنش های پیچیده ای نامیده می شود که در آنها یک ماده وجود دارد آبه طور همزمان با یک یا چند معرف تعامل دارد ب 1، ب 2و غیره، در واکنش های همزمان شرکت می کند: آ+ B 1 → X 1 ; آ+ B 2 → X 2.این واکنش ها بر سر معرف با یکدیگر رقابت می کنند آ.
واکنش های مزدوجواکنش های پیچیده ای هستند که در آنها یک واکنش تنها در حضور واکنش دیگری رخ می دهد. در واکنش های جفت شده، ماده میانی به عنوان رابط بین فرآیندهای اولیه و ثانویه عمل می کند و وقوع هر دو را تعیین می کند.
یک سلول زنده برای وجود نیاز به انرژی دارد. یک منبع جهانی انرژی در موجودات زنده، اسید آدنوزین تری فسفریک (ATP) است. این ترکیب به عنوان یک انباشته کننده انرژی عمل می کند، زیرا زمانی که با آب تعامل می کند، یعنی. هیدرولیز، اسیدهای آدنوزین دی فسفریک (ADP) و فسفریک (P) تشکیل شده و انرژی آزاد می شود. به همین دلیل به آن ATP می گویند ترکیب ماکرو ارژیک،و پیوند P-O-P که در طول هیدرولیز آن می شکند پرانرژی است. اتصال ماکروارژیکیک پیوند شیمیایی است که وقتی در نتیجه یک واکنش هیدرولیز شکسته شود، انرژی قابل توجهی آزاد می کند:
همانطور که می دانید، قطع هر گونه اتصال (از جمله اتصالات پر انرژی) همیشه مستلزم صرف انرژی است. در مورد هیدرولیز ATP، علاوه بر فرآیند شکستن پیوند بین گروه های فسفات، که برای آن Δ جی> 0، فرآیندهای هیدراتاسیون، ایزومریزاسیون و خنثی سازی محصولات تشکیل شده در طول هیدرولیز رخ می دهد. در نتیجه همه این فرآیندها، کل تغییر در انرژی گیبس منفی است
معنی در نتیجه، شکستن یک پیوند نیست که ماکروارژیک است، بلکه نتیجه پر انرژی هیدرولیز آن است.
برای اینکه واکنش های اندرگونیک (ΔG > 0) در سیستم های زنده رخ دهد، لازم است که آنها با واکنش های اگزرگونیک (ΔG) همراه شوند.<0). Такое сопряжение возможно, если обе реакции имеют какое-либо общее промежуточное соединение, и на всех стадиях сопряженных реакций суммарный процесс характеризуется отрицательным значением изменения энергии Гиббса (∑ΔG сопр.р <0). Например, синтез сахарозы является эндэргонической реакцией и самопроизвольно происходить не может:
با این حال، جفت شدن این واکنش با واکنش اگزرگونیک هیدرولیز ATP، همراه با تشکیل یک ترکیب متوسط معمولی گلوکز-1-فسفات، منجر به این واقعیت می شود که فرآیند کلی دارای ∑ΔG است.<0:
واکنش های زنجیره ایواکنشهای شیمیایی و هستهای هستند که در آن ظهور یک ذره فعال (یک رادیکال یا اتم آزاد در فرآیندهای شیمیایی، یک نوترون در فرآیندهای هستهای) باعث تعداد زیادی (زنجیره) تبدیلهای متوالی مولکولها یا هستههای غیرفعال میشود. واکنش های زنجیره ای در شیمی رایج است. بسیاری از واکنشهای فتوشیمیایی، فرآیندهای اکسیداسیون (احتراق، انفجار)، پلیمریزاسیون و ترکخوردگی از طریق یک مکانیسم زنجیرهای رخ میدهند. تئوری واکنش های زنجیره ای توسط آکادمیک H.H. سمنوف، S.N. Hinshelwood (انگلیس) و دیگران مراحل اصلی واکنش های زنجیره ای عبارتند از: منشاء (شروع)، ادامه (طول) و خاتمه زنجیره (پایان). دو نوع واکنش زنجیره ای وجود دارد: واکنش هایی با زنجیره های بدون شاخه و منشعب. ویژگی واکنش های زنجیره ای این است که یک عمل اولیه فعال سازی منجر به تبدیل تعداد زیادی از مولکول های مواد اولیه می شود. واکنش های بیوشیمیایی اکسیداسیون رادیکال های آزاد، واکنش های زنجیره ای هستند.
واکنش های دوره ای (خود نوسانی).واکنشهای اتوکاتالیستی چند مرحلهای پیچیده شامل چندین ماده هستند که در آنها نوسانات دورهای در غلظت اشکال اکسید شده و کاهشیافته رخ میدهد. واکنش های نوسانی کشف شده توسط B.P. بلوسوف، مورد مطالعه A.M. ژابوتینسکی و دیگران فرکانس و شکل ارتعاشات به غلظت مواد اولیه، اسیدها بستگی دارد.
درجه حرارت نمونه ای از این واکنش ها برهمکنش اسید برومومالونیک با برومات پتاسیم در یک محیط اسیدی است که کاتالیزور آن نمک سریم (III) است. واکنشهای دورهای برای اجسام بیولوژیکی از اهمیت بالایی برخوردار هستند، جایی که واکنشهایی از این نوع گسترده است.
واکنش های احتراق فاز جامد(واکنشهای سنتز در دمای بالا خود تکثیر شونده، SHS) در سال 1967 در موسسه فیزیک شیمی آکادمی علوم اتحاد جماهیر شوروی توسط A.G. مرژانوف و I.G. بورووینسکایا ماهیت روش SHS این است که پس از شروع موضعی واکنش متقابل معرف ها، قسمت جلویی واکنش احتراق به دلیل انتقال حرارت از محصولات داغ به مواد اولیه، به طور خود به خود در سراسر سیستم پخش می شود و باعث شروع واکنش متقابل در سیستم می شود. آنها را بنابراین، فرآیند احتراق رخ می دهد که هم علت و هم پیامد واکنش است. مکانیسم واکنش های SHS کاملاً پیچیده است و شامل فرآیندها می شود انتشار واکنشاصطلاح انتشار واکنشی مجموعهای از پدیدهها را تعریف میکند که در طی برهمکنش دو جزء شیمیایی متفاوت که قادر به تشکیل ترکیبات شیمیایی به شکل فازهای جامد هستند رخ میدهد. محصولات حاصل از فعل و انفعالات شیمیایی یک لایه پیوسته را تشکیل می دهند که از نظر ساختار با اجزای اصلی متفاوت است، اما در برهمکنش بیشتر تداخلی ایجاد نمی کند.
2.5. تئوری برخوردهای فعال. انرژی فعال سازی. وابستگی سرعت واکنش به ماهیت مواد واکنش دهنده و دما
برای اینکه یک عمل اولیه برهمکنش شیمیایی انجام شود، ذرات واکنش دهنده باید با یکدیگر برخورد کنند. با این حال، هر برخوردی منجر به یک واکنش شیمیایی نمی شود. مورد دوم زمانی اتفاق می افتد که ذرات به فاصله هایی نزدیک می شوند که در آن توزیع مجدد چگالی الکترون و ظهور پیوندهای شیمیایی جدید امکان پذیر است. ذرات برهم کنش باید انرژی کافی برای غلبه بر نیروهای دافعه ای که بین لایه های الکترونی آنها ایجاد می شود داشته باشند.
وضعیت گذار- حالتی از سیستم که در آن تخریب و ایجاد ارتباطات متعادل است. در حالت گذار سیستم
برای مدت کوتاهی (10 -15 ثانیه) قرار دارد. انرژی ای که باید برای رساندن سیستم به حالت گذار صرف شود نامیده می شود انرژی فعال سازی.در واکنش های چند مرحله ای که شامل چندین حالت گذار است، انرژی فعال سازی با بالاترین مقدار انرژی مطابقت دارد. پس از غلبه بر حالت گذار، مولکول ها دوباره با از بین رفتن پیوندهای قدیمی و تشکیل پیوندهای جدید یا با تبدیل پیوندهای اولیه پراکنده می شوند. هر دو گزینه ممکن است، زیرا با آزاد شدن انرژی رخ می دهند. موادی وجود دارند که می توانند انرژی فعال سازی را برای یک واکنش معین کاهش دهند.
مولکول های فعال A 2 و B 2 در هنگام برخورد با ضعیف شدن و سپس شکستن پیوندهای A-A و B-B و تقویت پیوندهای A-B به یک کمپلکس فعال میانی A 2 ... B 2 ترکیب می شوند.

"انرژی فعال سازی" واکنش برای تشکیل HI (168 کیلوژول بر مول) به طور قابل توجهی کمتر از انرژی لازم برای شکستن کامل پیوند در مولکول های اولیه H2 و I2 (571 کیلوژول بر مول) است. بنابراین، مسیر واکنش از طریق تشکیل مجتمع فعال (فعال شده).از نظر انرژی مطلوب تر از مسیر گسیختگی کامل پیوندها در مولکول های اصلی است. اکثریت قریب به اتفاق واکنش ها از طریق تشکیل کمپلکس های فعال میانی رخ می دهد. اصول تئوری مجموعه فعال توسط G. Eyring و M. Polyani در دهه 30 قرن بیستم توسعه یافت.
انرژی فعال سازیانرژی جنبشی اضافی ذرات را نسبت به میانگین انرژی مورد نیاز برای تبدیل شیمیایی ذرات در حال برخورد نشان می دهد. واکنش ها با انرژی های فعال سازی مختلف (Ea) مشخص می شوند. در بیشتر موارد، انرژی فعال سازی واکنش های شیمیایی بین مولکول های خنثی از 80 تا 240 کیلوژول بر مول متغیر است. برای فرآیندهای بیوشیمیایی، مقادیر Ea اغلب کمتر است - تا 20 کیلوژول در مول. این با این واقعیت توضیح داده می شود که اکثریت قریب به اتفاق فرآیندهای بیوشیمیایی از طریق مرحله مجتمع های آنزیم-سوبسترا پیش می روند. موانع انرژی واکنش را محدود می کند. با توجه به این، در اصل، واکنش های احتمالی (با جی<0) практически всегда не протекают
یا کم کردن سرعت واکنش هایی با انرژی فعال سازی بالای 120 کیلوژول بر مول به قدری آهسته است که به سختی متوجه وقوع آنها می شود.
برای اینکه یک واکنش اتفاق بیفتد، مولکول ها باید در جهت خاصی قرار گیرند و در هنگام برخورد، انرژی کافی داشته باشند. احتمال جهت گیری مناسب برخورد با مشخصه می شود آنتروپی فعال سازیΔ S a.توزیع مجدد چگالی الکترون در کمپلکس فعال با شرایط زمانی که مولکولهای A2 و B2 در هنگام برخورد جهتگیری میکنند، مورد علاقه است، همانطور که در شکل نشان داده شده است. 2.2، a، در حالی که با جهت نشان داده شده در شکل. 2.2، b، احتمال واکنش حتی بسیار کمتر است - در شکل. 2.2، ج.

برنج. 2.2.جهت گیری های مطلوب (a) و نامطلوب (b، c) مولکول های A 2
و B 2 در یک برخورد
معادله ای که وابستگی سرعت و واکنش به دما، انرژی فعال سازی و آنتروپی فعال سازی را مشخص می کند به شکل زیر است:
جایی که ک- ثابت سرعت واکنش؛ A در تقریب اول، تعداد کل برخوردهای بین مولکول ها در واحد زمان (ثانیه) در واحد حجم است. e پایه لگاریتم های طبیعی است. آر- ثابت گاز جهانی؛ تی- دمای مطلق؛ E a- انرژی فعال سازی؛ Δ S a- تغییر در آنتروپی فعال سازی
معادله (2.8) توسط آرنیوس در سال 1889 به دست آمد. عامل پیش نمایی A متناسب با تعداد کل برخوردهای بین مولکول ها در واحد زمان است. بعد آن با بعد ثابت سرعت منطبق است و بنابراین به ترتیب کل واکنش بستگی دارد. توان برابر است با نسبت برخوردهای فعال از تعداد کل آنها، یعنی. مولکولهای در حال برخورد باید کافی باشند
انرژی تعامل دقیق احتمال جهت گیری مورد نظر آنها در لحظه برخورد با e ΔSa/R متناسب است
هنگام بحث از قانون عمل جرم برای سرعت (2.6)، به طور خاص بیان شد که ثابت سرعت یک مقدار ثابت است که به غلظت واکنش دهنده ها بستگی ندارد. فرض بر این بود که تمام تحولات شیمیایی در دمای ثابت رخ می دهد. در عین حال، به خوبی شناخته شده است که سرعت تبدیل شیمیایی می تواند به طور قابل توجهی با کاهش یا افزایش دما تغییر کند. از نقطه نظر قانون عمل جرم، این تغییر در سرعت به دلیل وابستگی به دمای ثابت سرعت است، زیرا غلظت مواد واکنش دهنده به دلیل انبساط حرارتی یا فشرده سازی مایع فقط اندکی تغییر می کند.
شناخته شده ترین واقعیت این است که سرعت واکنش ها با افزایش دما افزایش می یابد. این نوع وابستگی سرعت به دما، نرمال نامیده می شود (شکل 2.3، a). این نوع وابستگی مشخصه همه واکنش های ساده است.

برنج. 2.3.انواع وابستگی دمایی سرعت واکنش های شیمیایی: الف - نرمال. ب - غیر طبیعی؛ ج - آنزیمی
با این حال، تحولات شیمیایی در حال حاضر به خوبی شناخته شده است، که سرعت آن با افزایش دما کاهش می یابد. یک مثال واکنش فاز گاز اکسید نیتروژن (II) با برم است (شکل 2.3، b). به این نوع وابستگی سرعت به دما، غیرعادی می گویند.
وابستگی دمایی سرعت واکنشهای آنزیمی، مورد توجه خاص پزشکان است. واکنش های شامل آنزیم ها تقریباً تمام واکنش هایی که در بدن اتفاق می افتد متعلق به این کلاس هستند. به عنوان مثال، در هنگام تجزیه پراکسید هیدروژن در حضور آنزیم کاتالاز، سرعت تجزیه به دما بستگی دارد. در محدوده 273-320 درجه کلوین، وابستگی به دما طبیعی است. با افزایش دما سرعت افزایش می یابد و با کاهش دما کاهش می یابد. وقتی دما بالاتر می رود
در دمای 320 درجه کلوین، یک افت غیرعادی شدید در سرعت تجزیه پراکسید مشاهده می شود. تصویر مشابهی برای سایر واکنش های آنزیمی رخ می دهد (شکل 2.3، ج).
از معادله آرنیوس برای کواضح است که، از آنجا که تیسرعت یک واکنش شیمیایی به تغییرات دما بسیار حساس است. وابستگی سرعت یک واکنش همگن به دما را می توان با قانون van’t Hoff بیان کرد که بر اساس آن با هر 10 درجه افزایش دما، سرعت واکنش 2-4 برابر افزایش می یابد.عددی که نشان می دهد با افزایش دما به میزان 10 درجه چند برابر سرعت یک واکنش معین افزایش می یابد، نامیده می شود ضریب دمایی سرعت واکنش- γ.
جایی که ک- نرخ ثابت در دما تیدرجه سانتی گراد با دانستن مقدار γ، می توان تغییر سرعت واکنش را در هنگام تغییر دما محاسبه کرد T 1قبل از T 2طبق فرمول:
با افزایش دما در یک پیشرفت حسابی، سرعت در یک پیشرفت هندسی افزایش می یابد.
به عنوان مثال، اگر γ = 2.9، سپس با افزایش دما به میزان 100 درجه، سرعت واکنش 2.9 10 برابر افزایش می یابد، یعنی. 40 هزار بار انحراف از این قانون واکنش های بیوشیمیایی است که سرعت آن با افزایش جزئی دما ده ها برابر افزایش می یابد. این قانون فقط برای یک تقریب تقریبی معتبر است. واکنشهایی که شامل مولکولهای بزرگ (پروتئینها) هستند با ضریب دمایی بزرگ مشخص میشوند. سرعت دناتوره شدن پروتئین (آلبومین تخم مرغ) با افزایش دما به میزان 10 درجه سانتی گراد 50 برابر افزایش می یابد. پس از رسیدن به حداکثر معین (50-60 درجه سانتیگراد)، سرعت واکنش در نتیجه دناتوره شدن حرارتی پروتئین به شدت کاهش می یابد.
برای بسیاری از واکنش های شیمیایی قانون عمل جرم برای سرعت ناشناخته است. در چنین مواردی، عبارت را می توان برای توصیف وابستگی دمایی نرخ تبدیل استفاده کرد:
پیشنمایه و بابه دما بستگی ندارد، بلکه به غلظت بستگی دارد. واحد اندازه گیری mol/l s است.
وابستگی نظری اجازه می دهد تا در هر دمایی که انرژی فعال سازی و پیش نمایی مشخص باشد، سرعت از قبل محاسبه شود. بنابراین، تأثیر دما بر سرعت تبدیل شیمیایی پیشبینی میشود.
2.6. واکنش های برگشت پذیر و برگشت ناپذیر. وضعیت تعادل شیمیایی. معادله ایزوترمی واکنش
یک واکنش شیمیایی همیشه "به پایان نمی رسد"؛ به عبارت دیگر، مواد اولیه همیشه به طور کامل به محصولات واکنش تبدیل نمی شوند. این به این دلیل اتفاق می افتد که با تجمع محصولات واکنش، ممکن است شرایطی برای انجام واکنش در جهت مخالف ایجاد شود. در واقع، اگر، برای مثال، بخار ید را با هیدروژن در دمای ~ 200 درجه سانتیگراد مخلوط کنید، واکنش رخ می دهد: H 2 + I 2 = 2HI. با این حال، مشخص است که یدید هیدروژن، حتی زمانی که تا 180 درجه سانتیگراد گرم می شود، شروع به تجزیه به ید و هیدروژن می کند: 2HI = H 2 + I 2.
واکنش های شیمیایی که در شرایط یکسان می توانند در جهت مخالف پیش بروند نامیده می شوند برگشت پذیرهنگام نوشتن معادلات برای واکنش های برگشت پذیر، به جای علامت مساوی، از دو فلش مخالف استفاده می شود. واکنشی که از چپ به راست رخ می دهد نامیده می شود سر راست(ثابت سرعت واکنش رو به جلو k 1)از راست به چپ - معکوس(سرعت واکنش برگشتی ثابت است k 2).
در واکنشهای برگشتپذیر، سرعت واکنش مستقیم در ابتدا دارای حداکثر مقدار است و سپس به دلیل کاهش غلظت مواد اولیه کاهش مییابد. برعکس، واکنش معکوس در لحظه اولیه دارای حداقل سرعت است که با افزایش غلظت محصولات واکنش افزایش می یابد. سرانجام لحظه ای فرا می رسد که نرخ واکنش های رو به جلو و معکوس برابر می شود. حالتی که در آن سرعت واکنش معکوس برابر با سرعت واکنش رو به جلو می شود نامیده می شود تعادل شیمیایی.
وضعیت تعادل شیمیایی فرآیندهای برگشت پذیر از نظر کمی مشخص می شود ثابت تعادلدر لحظه رسیدن به حالت تعادل شیمیایی، سرعت واکنش های رو به جلو و معکوس برابر است. (شرایط جنبشی).
جایی که K - ثابت تعادل،که نسبت ثابت های سرعت واکنش های رو به جلو و معکوس است.
در سمت راست معادله آن دسته از غلظتهایی از مواد متقابل هستند که در حالت تعادل برقرار میشوند - غلظت های تعادلیاین معادله بیانی ریاضی از قانون عمل جرم در تعادل شیمیایی است. به ویژه باید توجه داشت که بر خلاف قانون عمل جرم برای سرعت واکنش در این معادله، توان الف، ب، د، ف وو غیره. همیشه با ضرایب استوکیومتری در واکنش تعادل برابر است.
مقدار عددی ثابت تعادل یک واکنش معین، بازده آن را تعیین می کند. خروجی واکنشآنها نسبت مقدار محصول واقعی به دست آمده را به مقداری می گویند که در صورت تکمیل واکنش (معمولاً به صورت درصد بیان می شود) به دست می آمد. بنابراین، در K >>1 بازده واکنش بالا است و برعکس، در K<<1 выход реакции очень мал.
ثابت تعادل مربوط به انرژی استاندارد گیبسواکنش هایی با نسبت زیر:
با استفاده از رابطه (2.12)، میتوانیم مقدار انرژی گیبس واکنش را از طریق غلظتهای تعادلی پیدا کنیم:

این معادله نامیده می شود معادله ایزوترم واکنش شیمیاییاین به شما امکان می دهد تغییر انرژی گیبس را در طول فرآیند محاسبه کنید و جهت واکنش را تعیین کنید:
در ΔG<0 - реакция идет в прямом направлении, слева направо;
در ΔG = 0 - واکنش به تعادل رسیده است (شرایط ترمودینامیکی)؛
وقتی ΔG > 0، واکنش در جهت مخالف پیش می رود.
درک این نکته مهم است که ثابت تعادل به غلظت مواد بستگی ندارد. گزاره مخالف درست است: در حالت تعادل، خود غلظت ها چنان مقادیری می گیرند که نسبت محصولات آنها به توان ضرایب استوکیومتری
معلوم می شود که در یک دمای معین یک مقدار ثابت است. این بیانیه با قانون عمل توده مطابقت دارد و حتی می تواند به عنوان یکی از فرمول بندی های آن استفاده شود.
همانطور که در بالا ذکر شد، واکنش های برگشت پذیر به پایان نمی رسد. با این حال، اگر یکی از محصولات یک واکنش برگشت پذیر از کره واکنش خارج شود، آنگاه فرآیند اساساً برگشت پذیر تقریباً به پایان می رسد. اگر الکترولیت ها در یک واکنش برگشت پذیر دخیل باشند و یکی از محصولات این واکنش یک الکترولیت ضعیف، رسوب یا گاز باشد، در این صورت واکنش نیز تقریباً تا پایان ادامه می یابد. واکنش های برگشت ناپذیراینها واکنش هایی هستند که محصولات آنها برای تشکیل مواد اولیه با یکدیگر برهمکنش نمی کنند. واکنش های برگشت ناپذیر، به عنوان یک قاعده، "به پایان می رسد"، یعنی. تا زمانی که حداقل یکی از مواد اولیه به طور کامل مصرف شود.
2.7. اصل LE CHATELIER
حالت تعادل شیمیایی در شرایط خارجی ثابت از نظر تئوری می تواند به طور نامحدود حفظ شود. در حقیقت، زمانی که دما، فشار یا غلظت معرفها تغییر میکند، تعادل میتواند به یک طرف فرآیند تغییر کند.
تغییراتی که در سیستم در نتیجه تأثیرات خارجی رخ می دهد با اصل تعادل متحرک تعیین می شود - اصل لو شاتلیه
تأثیر خارجی بر سیستمی که در حالت تعادل است، منجر به تغییر در این تعادل در جهتی می شود که در آن اثر تأثیر ضعیف می شود.
در رابطه با سه نوع اصلی تأثیر خارجی - تغییرات غلظت، فشار و دما - اصل Le Chatelier به شرح زیر تفسیر می شود.
هنگامی که غلظت یکی از واکنش دهنده ها افزایش می یابد، تعادل به سمت مصرف این ماده تغییر می کند و با کاهش غلظت، تعادل به سمت تشکیل این ماده تغییر می کند.
اثر فشار بسیار شبیه به اثر تغییر غلظت مواد واکنش دهنده است، اما فقط سیستم های گاز را تحت تأثیر قرار می دهد. اجازه دهید یک بیانیه کلی در مورد تأثیر فشار بر تعادل شیمیایی فرموله کنیم.
با افزایش فشار، تعادل به سمت کاهش مقادیر مواد گازی تغییر می کند، به عنوان مثال. در جهت کاهش فشار؛ با کاهش فشار، تعادل به سمت افزایش تغییر می کند
مقادیری از مواد گازی، به عنوان مثال. به سمت افزایش فشار اگر واکنش بدون تغییر تعداد مولکول های مواد گازی ادامه یابد، فشار بر وضعیت تعادل در این سیستم تأثیر نمی گذارد.
هنگامی که دما تغییر می کند، هر دو واکنش رو به جلو و معکوس تغییر می کنند، اما به درجات مختلف. بنابراین برای روشن شدن اثر دما بر تعادل شیمیایی، لازم است نشانه اثر حرارتی واکنش را بدانیم.
با افزایش دما، تعادل به سمت واکنش گرماگیر و با کاهش دما به سمت واکنش گرمازا تغییر می کند.
در رابطه با بیوسیستم ها، اصل Le Chatelier بیان می کند که در یک بیوسیستم، برای هر عمل، واکنشی با قدرت و ماهیت یکسان شکل می گیرد که فرآیندها و واکنش های تنظیمی بیولوژیکی را متعادل می کند و سطح مزدوج عدم تعادل آنها را تشکیل می دهد.
در فرآیندهای پاتولوژیک، بسته بودن موجود مدار تنظیمی مختل می شود. بسته به سطح عدم تعادل، کیفیت روابط بین سیستمی و بین ارگانی تغییر می کند، آنها به طور فزاینده ای غیرخطی می شوند. ساختار و ویژگی این روابط با تجزیه و تحلیل رابطه بین شاخص های سیستم پراکسیداسیون لیپیدی و سطح آنتی اکسیدان ها، بین شاخص های هارمونیک در شرایط سازگاری و آسیب شناسی تأیید می شود. این سیستم ها در حفظ هموستاز آنتی اکسیدانی نقش دارند.
2.8. سوالات و وظایف برای آمادگی خودآزمایی برای کلاس ها و امتحانات
1-کدام واکنش ها را همگن و کدام را ناهمگن می نامند؟ از هر نوع واکنش یک مثال بزنید.
2-کدام واکنش ها را ساده و کدام را پیچیده می نامند؟ دو مثال از واکنش های ساده و پیچیده را ذکر کنید.
3. در چه صورت مولکولی و ترتیب معادله جنبشی می تواند از نظر عددی منطبق باشد؟
4. سرعت یک واکنش خاص در طول زمان تغییر نمی کند. آیا نیمه عمر این واکنش در طول زمان تغییر می کند و اگر چنین است، چگونه؟ توضیح بدید
5. در چه موردی سرعت واقعی (لحظه ای) و سرعت متوسط واکنش (در یک بازه زمانی به اندازه کافی زیاد) می توانند مطابقت داشته باشند؟
6. ثابت سرعت واکنش A + B → AB را محاسبه کنید، در صورتی که در غلظت های مواد A و B به ترتیب برابر با 0.5 و 0.1 mol/l، سرعت آن 0.005 mol/l min باشد.
7. نیمه عمر یک واکنش مرتبه اول مشخص 30 دقیقه است. چه کسری از مقدار اولیه ماده بعد از یک ساعت باقی می ماند؟
8. مفهوم ترتیب کلی واکنش و ترتیب واکنش را بر اساس ماده بیان کنید.
9. روشهای تعیین سرعت واکنش.
10. قانون اساسی سینتیک شیمیایی.
11. مفهوم مکانیسم واکنش های شیمیایی را بیان کنید.
12. واکنش های ساده و پیچیده.
13. واکنش های مزدوج. ثابت سرعت واکنش های شیمیایی به چه عواملی بستگی دارد؟
14. آیا سرعت واکنش واقعاً با حاصلضرب غلظت مواد واکنش دهنده به توان ضرایب استوکیومتری آنها متناسب است؟
15. چه داده های تجربی برای تعیین ترتیب واکنش ها مورد نیاز است؟
16. معادله جنبشی واکنش H 2 O 2 + 2HI → I 2 + + 2H 2 O را بنویسید اگر حجم های مساوی 0.02 mol/L محلول H 2 O 2 و 0.05 mol/L محلول HI مخلوط شوند. نرخ ثابت 0.05 l/mol s.
17. معادله جنبشی واکنش H 2 O 2 + 2HI → I 2 + + 2H 2 O را بنویسید، با در نظر گرفتن این که با یک واکنش مرتبه اول در غلظت هر دو ماده شروع مشخص می شود.
18. ثابت کنید که سرعت یک واکنش شیمیایی در نسبت استوکیومتری اجزا حداکثر است.
19. توضیحات احتمالی را برای تأثیر دما بر سرعت واکنش فهرست کنید.
2.9. وظایف تست
1. طبق قانون وانت هاف، وقتی دما 10 درجه افزایش می یابد، سرعت بسیاری از واکنش ها:
الف) 2-4 برابر کاهش می یابد.
ب) 5-10 برابر کاهش می یابد.
ج) 2-4 برابر افزایش می یابد.
د) 5-10 برابر افزایش می یابد.
2. تعداد اعمال اولیه تعامل در واحد زمان تعیین می کند:
الف) ترتیب واکنش؛
ب) سرعت واکنش؛
ج) مولکولی بودن واکنش.
د) نیمه عمر
3. چه عواملی بر افزایش سرعت واکنش تأثیر می گذارد؟
الف) ماهیت مواد واکنش دهنده؛
ب) دما، غلظت، کاتالیزور.
ج) فقط کاتالیزور؛
د) فقط غلظت.
ه) فقط دما
4. سرعت واکنش 2A(g) + B(g) چند برابر افزایش می یابد؟→A 2 B(g) وقتی غلظت ماده A دو برابر شود؟
الف) سرعت تغییر نخواهد کرد.
ب) 18 برابر افزایش می یابد.
ج) 8 برابر افزایش می یابد.
د) 4 برابر افزایش می یابد.
د) 2 برابر افزایش می یابد.
5. واکنش اولیه A(s) + 2B(g)→AB 2 (د). معادله جنبشی صحیح را برای این واکنش مشخص کنید:
a)k[A][B] 2 ;
ب) k[A][B];
ج) k[B];
د) k[B] 2;
د) k[A].
6. نحوه تغییر فشار در سیستم برای افزایش سرعت واکنش A(s) + 2B(g)→AB 2 (د) 9 بار؟
الف) فشار را 9 برابر افزایش دهید.
ب) فشار را 9 برابر کاهش دهید.
ج) فشار را 3 برابر افزایش دهید.
د) فشار را 3 برابر کاهش دهید.
7. ضریب دمایی واکنش چقدر است؟γ 10 , اگر وقتی مخلوط واکنش تا 30 درجه سرد شود، سرعت واکنش 8 برابر کاهش می یابد؟
الف) 16؛
ب) 8؛
ساعت 6؛
د) 4؛
د 2.
8. کدام واکنش سریعتر است؟
آ) E عمل کنید= 40 کیلوژول بر مول؛
ب) E act = 80 kJ/mol;
V) E act = 160 kJ/mol;
ز) E act = 200 kJ/mol.
سینتیک واکنشهای شیمیایی مطالعه فرآیندهای شیمیایی، قوانین وقوع آنها در زمان، سرعت و مکانیسم است. مهم ترین زمینه های شیمی مدرن و صنایع شیمیایی با مطالعات سینتیک واکنش های شیمیایی مرتبط است: توسعه اصول منطقی برای کنترل فرآیندهای شیمیایی. تحریک سودمند، مهار و سرکوب واکنش های شیمیایی ناخواسته؛ ایجاد فرآیندهای جدید و بهبود فرآیندها و دستگاه های موجود در فناوری شیمیایی؛ مطالعه رفتار محصولات شیمیایی، مواد و محصولات ساخته شده از آنها در شرایط مختلف استفاده و عملیات.
با توجه به پیچیدگی سیستم های شیمیایی واقعی و نیاز به در نظر گرفتن تعداد زیادی از عوامل و شرایط فرآیند، هنگام تعیین حالت های بهینه برای دستیابی به محصولات مورد نظر در مهندسی شیمی مدرن. کامپیوترهای الکترونیکی پرسرعت به طور گسترده مورد استفاده قرار می گیرند.
مفاهیم اولیه سینتیک شیمیایی
سیستم-مجموعه ای از مواد متقابل، جداسازی ذهنی (یا بالفعل) از محیط.
فاز-این قسمتی از سیستم است که در تمام نقاط از نظر ترکیب و خواص همگن است و توسط یک رابط از سایر قسمت های سیستم جدا می شود.یک ماده می تواند در سه فاز مایع، جامد و گاز باشد.
بسته به تعداد فازها همه سیستم ها و واکنش های موجود در آنهاتقسیم بر همگن و ناهمگون .
همگنواکنش ها در یک فاز (معمولاً گاز) رخ می دهد. به عنوان مثال، واکنش بین کلر و هیدروژن، منجر به تشکیل کلرید هیدروژن (سیستم تک فاز): Cl 2 + اچ 2 =2 HCl
ناهمگونواکنش ها در رابط رخ می دهد. نمونه هایی از یک واکنش ناهمگن شامل یک واکنش احتراق است که در فصل مشترک زغال سنگ و اکسیژن (سیستمی متشکل از دو فاز) رخ می دهد: C + O 2 = CO 2 : در دمای صفر درجه سانتی گراد، یخ، آب و بخار بالای آنها یک سیستم ناهمگن از سه فاز را تشکیل می دهند: جامد - یخ، مایع - آب و گاز - بخار آب.
مولکولی بودن واکنشتوسط تعداد مولکول های شرکت کننده در کندترین مرحله محدود کننده تعیین می شود. واکنش ها می توانند تک، دو، سه و غیره باشند. مولکولی تک مولکولی واکنشی است که در آن مرحله محدود کننده تبدیل یک مولکول است، به عنوان مثال، تجزیه آن به اجزا (تجزیه مولکول های ید) من 2 = 2I) یا تبدیل شدن به مولکول دیگر در نتیجه بازآرایی درون مولکولی:

دو مولکولی یک واکنش برهمکنش دو مولکول است (به عنوان مثال، هیدروژن مولکولی با ید مولکولی، اچ 2 +من 2 = 2HI). واکنشی که به طور همزمان با سه مولکول اتفاق می افتد نامیده می شود سه مولکولی . از آنجایی که احتمال برخورد سه مولکول به طور همزمان، به خصوص در جهت گیری صحیح متقابل، بسیار کم است، چنین واکنش هایی به ندرت رخ می دهد.
ترتیب واکنشترتیب واکنش یک کمیت تجربی برابر با مجموع توانهایی است که با آن غلظت واکنش دهنده ها در بیان سرعت واکنش وارد می شود. بله، برای واکنش
آ A+ب B=متر M+n ن
ترتیب واکنش در این مورد برابر است با آ + ب .
واکنش های مرتبه اول - اینها واکنش هایی هستند که سرعت آنها به غلظت تنها یک واکنش دهنده به توان اول بستگی دارد. بسیاری از واکنش های شیمیایی از یک معادله مرتبه اول پیروی می کنند. مثلا، با 2 ن 5 OH = C 2 ن 4 + ن 2 در باره
واکنش های مرتبه دوم – واکنشی است که در آن سرعت با مجذور غلظت هر واکنش دهنده یا غلظت هر یک از دو واکنش دهنده به توان اول متناسب است. به عنوان مثال: 1) 2NVr= ن 2 + بr 2 یا 2) CH 3 برادر + KOH = CH 3 اوه + KBr
واکنش های مرتبه سوم واکنشی است که در آن سرعت ممکن است به غلظت یک واکنش دهنده به توان سوم، یا غلظت یک واکنش دهنده به توان دوم و واکنش دهنده دوم به توان اول، یا غلظت هر یک از سه واکنش دهنده به توان اول بستگی داشته باشد. قدرت اول
بررسی سینتیک برهمکنش های مختلف نشان می دهد که رایج ترین واکنش ها مرتبه 1، 2 و گاهی اوقات سوم هستند. اما واکنش هایی از دستورات دیگر وجود دارد.
واکنش های مرتبه صفر - این واکنشی است که در آن سرعت مستقل از غلظت واکنش دهنده ها است و توسط سایر عوامل محدود کننده مانند سطح کاتالیزور (در واکنش های کاتالیز ناهمگن) یا جذب نور (در واکنش های فتوشیمیایی) تعیین می شود.
به عنوان یک قاعده، برای اکثر واکنش های ساده، ترتیب واکنش و مولکولی بودن آن یکسان است و با روش هایی که در بالا توضیح داده شد تعیین می شود. اما برای واکنش هایی که در چند مرحله رخ می دهند، ترتیب واکنش به صورت تجربی یا بر اساس محاسبات پیچیده ریاضی تعیین می شود.
مفهوم اصلی در سینتیک شیمیایی مفهوم است سرعت واکنش
برخی از واکنش ها تقریباً فوراً رخ می دهند (به عنوان مثال، خنثی سازی یک اسید با یک باز)، در حالی که برخی دیگر در شرایط عادی چنان آهسته پیش می روند که تغییرات قابل توجهی در غلظت معرف ها تنها پس از چندین سال مشاهده می شود (به عنوان مثال، برهمکنش هیدروژن با اکسیژن). برای تشکیل آب در غیاب کاتالیزور). علاوه بر این، واکنش های زیادی وجود دارد که در شرایط عادی با سرعت های کاملاً قابل اندازه گیری رخ می دهد. سینتیک شیمیایی با تعیین سرعت واکنش های شیمیایی و مطالعه مکانیسم آنها سر و کار دارد.
سرعت واکنش شیمیایی
سرعت واکنش شیمیایی با مقدار ماده ای که در واحد زمان واکنش نشان داده است (وارد یک واکنش یا تشکیل شده در نتیجه یک واکنش) در واحد حجم سیستم (برای یک محلول همگن) یا در واحد سطح سطح مشترک فاز (برای یک واکنش ناهمگن).
C (غلظت)
جایی که 1 - تغییر در غلظت ماده اولیه؛ 2 - تغییر در غلظت محصول واکنش
از این نمودار چنین استنباط می شود که در طول فعل و انفعالات شیمیایی غلظت هر یک از مواد اولیه در طول زمان کاهش می یابد (C2  C> 0).
C> 0).
در سینتیک شیمیایی وجود دارد میانگینو درست است، واقعیسرعت (آنی)
سرعت متوسط.
اگر در حجم و دمای ثابت، غلظت یکی از واکنشدهندهها از C 1 به C 2 در طی یک دوره زمانی از t 1 به t 2 کاهش یابد، مطابق با تعریف، سرعت متوسط واکنش مستقیم برای یک بازه زمانی معین برابر است با:
=
- 
علامت "-" در سمت راست معادله ظاهر می شود زیرا با پیشرفت واکنش (t 2 -t 1 > 0)، غلظت معرف ها کاهش می یابد، بنابراین، C 2 - C 1 < اوه، و از آنجایی که سرعت واکنش همیشه مثبت است، باید علامت "-" را جلوی کسری قرار دهید.
اگر ما در مورد سرعت هر دو واکنش رو به جلو و معکوس صحبت می کنیم، این فرمول به نظر می رسد:
= 

سرعت واقعی
سرعت واقعی واکنش توسط حدی که نسبت به آن تمایل دارد تعیین می شود  با/
با/  تی در
تی در
 تی
0
، یعنی مشتق غلظت با توجه به زمان:
تی
0
، یعنی مشتق غلظت با توجه به زمان:
= 
به طور معمول، برای واکنشهایی که در گازها یا محلولها رخ میدهند، غلظت واکنشدهندهها بر حسب mol/l بیان میشود. سرعت واکنش - بر حسب mol/(l*s).
واکنش ها زمانی رخ می دهد که مولکول های مواد واکنش دهنده با هم برخورد می کنند. سرعت آن با تعداد برخوردها و احتمال اینکه منجر به دگرگونی شوند تعیین می شود. تعداد برخوردها با غلظت مواد واکنش دهنده و احتمال واکنش با انرژی مولکول های برخورد کننده تعیین می شود.
سینتیک شیمیایی -این شاخه ای از شیمی است که سرعت واکنش ها و تأثیر عوامل مختلف بر آنها را مطالعه می کند.
در یک فرآیند همگن (تک فاز)، واکنش در کل حجم سیستم رخ می دهد و سرعت آن با تغییر در غلظت هر معرف یا هر محصول در واحد زمان مشخص می شود. بین سرعت متوسط تمایز قائل شوید vср = ±ΔΣ/Δt، که ΔC تغییر در غلظت مولی در یک دوره زمانی Δt و سرعت واقعی در زمان t است که مشتق غلظت در طول زمان است: v= ±dС/dt.
سرعت هر واکنش خاص در غیاب کاتالیزور به غلظت معرف ها و دما بستگی دارد. . سرعت واکنش های ناهمگنی که در سطح مشترک رخ می دهد نیز به اندازه این سطح بستگی دارد.
تأثیر غلظت معرف بر سرعت واکنش با قانون جرم های مؤثر تعیین می شود: در دمای ثابت، سرعت واکنش متناسب با حاصلضرب غلظت واکنش دهنده ها در توان برابر با ضرایب استوکیومتری است.
برای واکنش aA + bB = cC + dD، عبارت ریاضی قانون عمل جرم، به نام معادله جنبشی واکنش، نوشته شده است: v= kС A a С B b، که در آن ک - ضریب تناسب که ثابت سرعت نامیده می شود، C A و C Bغلظت های مولی معرف ها هستند، a و b ضرایب استوکیومتری آنها هستند. مجموع توان های معادله جنبشی را ترتیب واکنش می گویند. در واکنش های چند مرحله ای، ترتیب واکنش می تواند کسری باشد، اما نه بیشتر از 3.
در معادلات واکنش جنبشی غلظت مواد در حالت متراکمبه دلیل تغییر ناپذیری آنها نشان داده نمی شوند. این غلظت های ثابت به عنوان اجزاء در ثابت سرعت گنجانده می شوند.
مکانیسم واکنشبه مجموعه ای از مراحل یک واکنش شیمیایی گفته می شود که در نتیجه مواد اولیه به مراحل نهایی تبدیل می شوند. واکنش ها می توانند تک مرحله ای یا چند مرحله ای باشند. سرعت یک واکنش با سرعت کندترین مرحله آن (مرحله محدود) تعیین می شود.
تمیز دادن همگنو ناهمگونواکنش های شیمیایی واکنش هایی که در یک سیستم تک فاز (همگن) رخ می دهند، به عنوان مثال، مایع یا گاز، نامیده می شوند. همگن. چنین واکنش هایی در کل حجم سیستم رخ می دهد. واکنشهایی که در سیستمهای چند فازی (شامل دو یا چند فاز مانند فاز گازی و جامد) رخ میدهند. ناهمگون. چنین واکنش هایی فقط در سطح مشترک رخ می دهد. سرعت یک واکنش ناهمگن با تغییر غلظت واکنش دهنده ها در واحد سطح در واحد زمان تعیین می شود.
مولکولی بودن واکنشتعداد ذرات شرکت کننده در یک عمل اولیه برهمکنش شیمیایی است. در واکنش های واقعی، مولکولی می تواند برابر با 1، 2، 3 باشد. در واکنش های ساده ای که در یک مرحله اتفاق می افتد، ترتیب با مولکولی مطابقت دارد. قانون عمل جرم برای واکنش های ساده معتبر است. در مورد واکنش های پیچیده ای که در چند مرحله رخ می دهد، قانون برای هر واکنش فردی اعمال می شود، اما در مورد مجموع آنها نیست.
وابستگی سرعت واکنش به دما با این واقعیت توضیح داده می شود که همانطور که قبلا ذکر شد، سرعت واکنش به تعداد برخورد ذرات (اتم ها، مولکول ها، یون ها) شرکت کننده در واکنش بستگی دارد. اما همه برخوردها منجر به فعل و انفعالات شیمیایی نمی شود. برای اینکه یک واکنش اتفاق بیفتد، ذرات باید مقدار معینی انرژی اضافی (در مقایسه با مقدار متوسط) داشته باشند که به نام انرژی فعال سازی(E A). هر چه دما بالاتر باشد، انرژی ذرات بیشتر یا مساوی E A است. بنابراین، سرعت واکنش با افزایش دما افزایش مییابد. ثابت سرعت یک واکنش شیمیایی با تعداد برخوردهای مؤثر تعیین می شود، یعنی. تعداد مولکول های فعالی که می توانند وارد یک واکنش شیمیایی شوند. وابستگی ثابت سرعت واکنش به دما و انرژی فعال سازی به صورت بیان می شود معادله آرنیوس :
جایی که ک- ثابت سرعت واکنش، Z - ثابت، به نام عامل فضایی و بسته به تعداد برخوردهای منجر به واکنش. e - پایه لگاریتم طبیعی (e = 2.7183...)؛ - انرژی فعال سازی، J/mol. R - ثابت گاز (R = 8.314 J/K mol)، تی- دما، K.
تعادل شیمیایی در واکنش های برگشت پذیر برقرار می شود -در واکنش هایی که می توانند در هر دو جهت رو به جلو و معکوس رخ دهند. اگر واکنش aA + bB ↔ cC + dD) برگشت پذیر باشد، به این معنی است که واکنش دهنده های A و B می توانند به محصولات C و D (واکنش مستقیم) تبدیل شوند و محصولات C و D نیز به نوبه خود با واکنش با هر یک می توانند دیگر، دوباره مواد اولیه A و B را تشکیل می دهند (واکنش معکوس).
شرط ترمودینامیکی برای تعادل شیمیایی پایداری انرژی گیبس واکنش است، یعنی. r G = 0، و شرط تعادل جنبشی برابری نرخ واکنش های رو به جلو (v 1) و معکوس (v 2) است: v 1 = v 2.
از آنجایی که در حالت تعادل شیمیایی، هر دو واکنش رو به جلو و معکوس با سرعت یکسانی پیش می روند، غلظت واکنش دهنده ها و محصولات در طول زمان تغییر نمی کند. اینها غلظت هایی که در طول زمان تغییر نمی کنند، تعادل نامیده می شوند. غلظتهای تعادلی، برخلاف غلظتهای غیرتعادلی که در طی واکنش تغییر میکنند، معمولاً به روش خاصی تعیین میشوند، یعنی با فرمول ماده محصور در براکتهای مربع. به عنوان مثال، ورودی های [H2] به این معنی است که ما در مورد غلظت های تعادلی هیدروژن و آمونیاک صحبت می کنیم.
در یک دمای معین، نسبت غلظت های تعادلی واکنش دهنده ها و محصولات یک مقدار ثابت و مشخصه هر واکنش است. این رابطه از نظر کمی با مقدار ثابت تعادل شیمیایی Kc، برابر با نسبت حاصلضرب غلظتهای تعادلی محصولات به حاصلضرب غلظتهای تعادل واکنشدهندهها به توانهایی برابر با ضرایب استوکیومتری آنها مشخص میشود.
برای واکنش برگشت پذیر aA + bB ↔ cC + dD، عبارت Kc به شکل زیر است:
KS = . همانطور که در معادلات جنبشی واکنش ها، در عبارت های ثابت تعادل، غلظت مواد در حالت متراکم، به دلیل ثبات آنها، یادداشت نمی شود.
برای واکنشهای شامل گازها، ثابت تعادل شیمیایی را میتوان نه تنها بر حسب غلظتهای تعادل، بلکه بر حسب فشار جزئی تعادلی گازها نیز بیان کرد. در این حالت، نماد ثابت تعادل "K" نه با نماد غلظت "c"، بلکه با نماد فشار "p" نمایه می شود.
اگر شرایط تغییر نکند، سیستم میتواند در حالت تعادل باقی بماند، که مشخصه آن برابری نرخ واکنشهای رو به جلو و معکوس است. وقتی شرایط تغییر می کند، برابری سرعت ها v 1= v 2مختل می شود، یکی از دو واکنش با سرعت بیشتری شروع می شود. این با گفتن اینکه یک تغییر در تعادل شیمیایی در سیستم رخ می دهد بیان می شود.
اگر در نتیجه تغییر شرایط در سیستم، یک واکنش مستقیم با سرعت بیشتری شروع به رخ دادن کند، به عنوان مثال. v 1> v 2 ، تعادل به سمت واکنش رو به جلو تغییر می کند - به سمت راست و بالعکس، اگر سرعت واکنش معکوس از سرعت واکنش رو به جلو بیشتر شود، یعنی. شرط برقرار استv 2 > v 1 , یک تغییر در تعادل به سمت واکنش معکوس - به سمت چپ وجود دارد.
تغییر در تعادل شیمیایی را می توان با تغییر غلظت واکنش دهنده ها یا محصولات و تغییر دما و برای واکنش های شامل گازها، تغییر فشار نیز انجام داد. جهت تغییر تعادل تحت چنین تغییراتی در شرایط توسط اصل لو شاتلیه (اصل کنش متقابل) تعیین می شود: اگر شرایط در یک سیستم تعادلی تغییر کند، تعادل در جهت واکنشی تغییر می کند که با تغییر ایجاد شده مقابله می کند.
وظیفه 1.برای یک واکنش شیمیایی معین، یک معادله جنبشی بنویسید و ترتیب نظری واکنش را تعیین کنید. نحوه تغییر سرعت واکنش با تغییرات مشخص شده در شرایط واکنش را محاسبه کنید: Fe 2 O 3 (s) + 3CO(g) → 2Fe(s) + 3CO 2 (g)
سرعت واکنش چند بار تغییر می کند (افزایش یا کاهش می یابد) اگر:
الف) فشار را 2 برابر افزایش دهید.
ب) حجم مخلوط واکنش را 2 برابر افزایش دهید
ج) دما را 40 درجه سانتیگراد افزایش دهید (γ = 2)
د) دما را 20 درجه سانتیگراد کاهش دهید (γ = 2)
Fe 2 O 3 (s) + 3CO (g) → 2Fe (s) + 3CO 2 (g) - یک واکنش ناهمگن (مواد در حالت های فاز مختلف شرکت می کنند).
معادله جنبشی: υ 1 = k s 3 (CO)،
k ثابت سرعت است. معادله جنبشی واکنش های ناهمگن شامل فقط غلظت گازها یا مواد محلول در حلال.
ترتیب نظری واکنش: 3 (به مجموع توان های تمرکز در معادله جنبشی، ترتیب نظری واکنش می گویند).
محاسبه تغییر سرعت واکنش:
آ) وقتی فشار دو برابر می شود:سرعت واکنش قبل از افزایش فشار با معادله جنبشی توصیف می شود:
υ 1 = k · с 3 (CO)، که در آن с 3 (CO) غلظت اولیه (اولیه) مونوکسید کربن (II) است.
با افزایش فشار، غلظت نیز افزایش می یابد، یعنی. اگر فشار 2 برابر افزایش یابد، غلظت 2 برابر افزایش می یابد، بنابراین معادله جنبشی واکنش پس از تغییر فشار به شکل زیر است:
υ 2 = k · (2с) 3 (CO)، که در آن (2с) 3 (CO) غلظت مونوکسید کربن (II) پس از افزایش فشار در سیستم به میزان 2 برابر است.
= = = 2 3 = 8 - سرعت واکنش 8 برابر افزایش می یابد.
ب) با افزایش حجم مخلوط واکنش تا 2 برابر:
افزایش حجم مخلوط واکنش به میزان 2 برابر منجر به کاهش غلظت گاز به میزان 2 برابر می شود: υ 1 = k · s 3 (CO)، که در آن s3 (CO) غلظت اولیه (اولیه) کربن است. مونوکسید (II).
υ 2 = k (CO)، که در آن (CO) غلظت مونوکسید کربن (II) پس از افزایش 2 برابری حجم مخلوط واکنش است.
تغییر سرعت واکنش () :
= = = - سرعت واکنش 8 برابر کاهش می یابد.
V) افزایش دما تا 40 درجه سانتیگراد (γ = 2):
هنگامی که دما تغییر می کند، سرعت واکنش طبق قانون وانت هاف تغییر می کند:
با توجه به شرایط مشکل دما 40 درجه سانتیگراد افزایش یافت، از این رو
ΔT = T 2 - T 1 = 40،
= 2 40/10 = 2 4 = 16 - سرعت واکنش 16 برابر افزایش می یابد.
ز) کاهش دما 20 درجه سانتیگراد (γ = 2):
هنگامی که دما تغییر می کند، سرعت واکنش طبق قانون وانت هاف تغییر می کند:
= γ ΔΤ/10، که γ ضریب دمایی واکنش است، ΔΤ تغییر دما (T 2 - T 1)، υ 1 سرعت واکنش در دمای T 1، υ 2 سرعت واکنش در دمای T است. 2.
با توجه به شرایط مشکل دما 20 درجه کاهش یافت,
بنابراین ΔT = T 1 - T 2 = -20،
= 2 -20/10 = 2 -2 = - سرعت واکنش 4 برابر کاهش می یابد.
وظیفه 2. 1) برای واکنش های برگشت پذیر
CuO(s) + CO(g) ↔ Cu(s) + CO 2 (g) + QN 2 (g) + O 2 (g) ↔ 2NO (g) - Q، تعیین کنید که تعادل واکنش در کدام جهت تغییر کند اگر :
الف) افزایش دما؛ ب) کاهش دما
2) برای واکنش های برگشت پذیر:
C 2 H 2 (g) + 2H 2 (g) ↔ C 2 H 6 (g)
3S(s) + H 2 O (g) ↔ 2H 2 S (g) + SO 2 (g)
C(tv) + O 2 (g) ↔ CO 2 (g)، تعیین کنید که تعادل واکنش در کدام جهت تغییر می کند اگر:
الف) افزایش فشار؛ ب) کاهش فشار
3) برای یک واکنش برگشت پذیر:
Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H2 O (g)، تعیین کنید که تعادل واکنش در کدام جهت تغییر می کند اگر:
الف) غلظت H 2 را افزایش دهید.
ب) غلظت H 2 را کاهش دهید.
ج) غلظت H 2 O را افزایش دهید
د) غلظت H 2 O را کاهش دهید
جهتی که تعادل شیمیایی در آن جابهجا میشود با اصل لو شاتلیه تعیین میشود: اگر تأثیر خارجی بر یک سیستم تعادلی اعمال شود، آنگاه تعادل به سمتی تغییر میکند که با این تأثیر مقابله میکند.
1) افزایش دما تعادل را به سمت واکنش گرماگیر (-Q) تغییر می دهد، کاهش دما تعادل را به سمت واکنش گرمازا (+Q) تغییر می دهد.
CuO(s) + CO(g) ↔ Cu(s) + CO 2 (g) + Q
در این مورد:
- واکنش مستقیم CuO(s) + CO(g) → Cu(s) + CO 2 (g) + Q - گرمازا ,
- واکنش معکوس Cu(tv) + CO 2 (g) → CuO(tv) + CO(g) - Q - گرماگیر ,
از این رو:
آ) با افزایش دماتعادل به سمت واکنش معکوس (به سمت تشکیل معرف، به سمت چپ (←)) تغییر خواهد کرد.
ب) با کاهش دماتعادل به سمت واکنش مستقیم (به سمت تشکیل محصولات، به سمت راست (→) تغییر خواهد کرد.
N 2 (g) + O 2 (g) ↔ 2NO (g) - Q
در این مورد:
واکنش مستقیم N 2 (g) + O 2 (g) → 2NO (g) - Q - گرماگیر,
واکنش معکوس 2NO (g) → N 2 (g) + O 2 (g) + Q - گرمازا,
از این رو:
آ) با افزایش دماتعادل به سمت واکنش مستقیم (به سمت تشکیل محصولات، به سمت راست (→) تغییر خواهد کرد.
ب) با کاهش دماتعادل به سمت واکنش معکوس (به سمت تشکیل معرف، به سمت چپ (←)) تغییر خواهد کرد.
2)افزایش فشار باعث تغییر تعادل به سمت واکنشی می شود که در آن تعداد مولکول های گاز کاهش می یابد. کاهش فشار باعث تغییر تعادل به سمت واکنشی می شود که در آن تعداد مولکول های گاز افزایش می یابد.
در سیستم C 2 H 2 (g) + 2H 2 (g) ↔ C 2 H 6 (g)واکنش مستقیم (C 2 H 2 (g) + 2H 2 (g) → C 2 H 6 (g)) با کاهش تعداد مولکول های گاز رخ می دهد (یک مولکول محصول نهایی از سه مولکول اولیه تشکیل می شود. گازها) و واکنش معکوس
(C 2 H 6 (g) → C 2 H 2 (g) + 2H 2 (g)) - با افزایش تعداد مولکول ها (از یک مولکول C 2 H 6 سه مولکول جدید تشکیل می شود (یک مولکول) از C 2 H 2 و دو مولکول H 2).
از این رو:
آ) افزایش فشارتعادل را به سمت واکنش مستقیم (به سمت تشکیل محصولات به سمت راست (→) تغییر می دهد.
ب) کاهش فشارتعادل را به سمت واکنش معکوس تغییر می دهد (به سمت تشکیل معرف، به سمت چپ (←)).
در سیستم 3S(s) + H 2 O (g) ↔ 2H 2 S (g) + SO 2 (g)واکنش مستقیم (3S(s) + H2O(g) → 2H2S(g) + SO2 (g)) با افزایش تعداد مولکول های گاز رخ می دهد و واکنش معکوس (2H2S(g) ) + SO 2 (g) → 3S(s) + H 2 O(g)) - با کاهش مولکول های گاز رخ می دهد (S(گوگرد) جامد است، تعداد مولکول های جامد در نظر گرفته نمی شود).
از این رو:
آ) افزایش فشارتعادل را به سمت واکنش معکوس تغییر می دهد (به سمت تشکیل معرف ها، به سمت چپ (←)).
ب) کاهش فشارتعادل را به سمت واکنش مستقیم (به سمت تشکیل محصولات، به سمت راست (→) تغییر می دهد.
در سیستم C(tv) + O 2 (g) ↔ CO 2 (g) تعداد مولکول های گاز در میان واکنش دهنده ها و بین محصولات برابر است (یک مولکول O 2 و یک مولکول CO 2 (g))، بنابراین تغییر فشار (افزایش یا کاهش) تاثیر نخواهد گذاشتبرای تغییر تعادل شیمیایی در یک سیستم معین.
آ) افزایش فشارتعادل را تغییر نمی دهد؛
ب) کاهش فشارتعادل را تغییر نمی دهد.
3) آ) افزایش غلظت واکنش دهنده ها تعادل را به سمت تشکیل محصولات تغییر می دهد، بنابراین:
برای یک واکنش معین Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g)، افزایش غلظت معرف H2 منجر به تغییر تعادل به سمت واکنش مستقیم (به سمت تشکیل محصولات، به سمت راست (→ )).
ب) کاهش غلظت معرف ها تعادل را به سمت تشکیل معرف تغییر می دهد، بنابراین:
برای یک واکنش معین Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g)، افزایش غلظت معرف H2 منجر به تغییر تعادل به سمت واکنش معکوس (به سمت تشکیل معرف، به سمت چپ (← ))؛
V) افزایش غلظت محصولات تعادل را به سمت تشکیل معرف تغییر می دهد، بنابراین:
برای یک واکنش معین Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g) ، افزایش غلظت محصول H 2 O منجر به تغییر در تعادل به سمت می شود. واکنش معکوس (به سمت تشکیل معرف، به سمت چپ (←))؛
ز) کاهش غلظت محصولات، تعادل را به سمت تشکیل محصولات تغییر می دهد، بنابراین:
برای یک واکنش معین Fe 2 O 3 (s) + 3H 2 (g) ↔ 2Fe (s) + 3H 2 O (g)، کاهش غلظت محصول H2O منجر به تغییر تعادل به سمت واکنش مستقیم (به سمت تشکیل محصولات، به سمت راست ( →)).
وظیفه 3. 1) برای واکنش برگشت پذیر Fe 2 O 3 (s) + 3CO (g) ↔ 2Fe (s) + 3CO 2 (g)، ثابت تعادل را محاسبه کنید، اگر غلظت اولیه CO 3 مول در لیتر باشد، تا زمان تعادل رخ می دهد، 75٪ CO واکنش نشان داده است.
2) برای واکنش برگشت پذیر S(s) + H 2 (g) ↔ H 2 S(g)، اگر غلظت اولیه H 2 3 mol/l و ثابت تعادل Kp = 15 باشد، غلظت تعادلی مواد را محاسبه کنید.
ج) برای واکنش برگشت پذیر 2NH 3 (g) ↔ 3H 2 (g) + N 2 (g)، غلظت اولیه NH 3 و ثابت تعادل این واکنش را در صورتی که غلظت تعادلی مواد برابر 0.4 mol/ باشد محاسبه کنید. l، = 1.2 mol/l، [H2] = 3.6 mol/l.
برای حل این مشکلات، استفاده از جدول زیر راحت است::
1) ثابت تعادل در واکنش های ناهمگن فقط به غلظت گازها بستگی دارد، بنابراین مقادیر جامدات (Fe 2 O 3 (s) و Fe (s)) در نظر گرفته نمی شود. .
در ردیف غلظت های اولیه، غلظت اولیه CO - 3 mol/l را وارد می کنیم. غلظت اولیه CO 2 صفر است (این محصول واکنشی است که هنوز در شروع واکنش تشکیل نشده است).
با توجه به شرایط، زمانی که تعادل رخ می دهد، 75٪ CO واکنش نشان می دهد،آن ها 3 مول 0.75 = 2.25 مول.
در نتیجه واکنش، 2.25 مول CO 2 تشکیل شد، زیرا با توجه به معادله واکنشمقدار CO 2 برابر با مقدار CO است.
پس از واکنش، مقادیر زیر CO باقی می ماند:
از ابتدا - از واکنش = 3 مول - 2.25 مول = 0.75 مول.
بنابراین، غلظت تعادل برابر خواهد بود با: = 0.75 mol/l = 2.25 mol/l
ما ثابت تعادل شیمیایی را محاسبه می کنیم (مطابق با قانون عمل جرم: در حالت تعادل شیمیایی در دمای معین، حاصل ضرب غلظت محصولات واکنش در توان هایی که توان آنها برابر با ضرایب مربوطه در معادله واکنش استوکیومتری است. ، تقسیم بر یک حاصلضرب مشابه از غلظت واکنش دهنده ها در توان های مربوطه، یک مقدار ثابت است)
Kr = = = 27
2)
در واکنش های ناهمگن، فقط غلظت گاز در نظر گرفته می شود.
غلظت اولیه H 2 برابر با 3 mol/l است. غلظت اولیه H 2 S صفر است (این محصول واکنشی است که هنوز در شروع واکنش تشکیل نشده است).
اجازه دهید رازک H 2 تشکیل شود. در این حالت، غلظت H 2 S نیز برابر با hmol خواهد بود (زیرا طبق معادله واکنش، نسبت آنها 1: 1 است). غلظت تعادل H2 محاسبه می شود:
C برابر = C اولیه - C proreact = (3 - x) مول، و غلظت تعادل H 2 S: C برابر =
= از شروع + از واکنش = 0 + x = x مول.
بیان ثابت تعادل این واکنش به صورت زیر است:
Kr = با جایگزینی داده های شناخته شده، معادله را به دست می آوریم:
15 =، بنابراین x = 45-15x;
16x = 45; x = 2.8
بنابراین، غلظت تعادل H2S:
= x = 2.8 mol/l
غلظت تعادل H2:
= 3 = 3 - 2.8 = 0.2 مول در لیتر
3) با استفاده از معادله واکنش جدولی درست می کنیم:
در خط غلظت های تعادلی، داده های مسئله غلظت مواد را یادداشت می کنیم. مقدار NH 3 واکنش داده شده را می توان از مقدار هر یک از مواد به دست آمده محاسبه کرد: به عنوان مثال، نسبت NH 3 و N 2 با توجه به معادله واکنش 2:1 است، به این معنی که اگر پس از واکنش 1.2 مول N 2 تشکیل شد، NH 3 2 برابر بیشتر واکنش نشان داد: n(NH 3) = 2 1.2 = 2.4 مول.
غلظت اولیه NH 3 محاسبه می شود:
C اولیه = واکنش C + C برابر = 2.4 + 0.4 = 2.8 mol/l.
سینتیک شیمیایی یکی از شاخه های مهم شیمی است که وظیفه آن تفسیر تغییرات کمی و کیفی در فرآیند شیمیایی است که در طول زمان رخ می دهد. به طور معمول این کار کلی به دو مورد خاص دیگر تقسیم می شود:
1) شناسایی مکانیسم واکنش - تعیین مراحل اولیه فرآیند و توالی وقوع آنها (تغییرات کیفی).
2) توصیف کمی از یک واکنش شیمیایی - ایجاد روابط دقیقی که می تواند به طور رضایت بخشی تغییرات در مقادیر معرف ها و محصولات اولیه را در طول واکنش پیش بینی کند.
به عنوان یک قاعده، یک واکنش شیمیایی در چندین مرحله میانی رخ می دهد، که وقتی با هم جمع شوند، یک واکنش کلی ایجاد می کنند.
معادله جنبشی یک واکنش شیمیایی (با در نظر گرفتن مکانیسم واکنش) تنها در نتیجه مطالعه تجربی واکنش به دست می آید و نمی توان آن را از معادله استوکیومتری واکنش کل استخراج کرد. هنگام بحث در مورد مکانیسم های واکنش، مرسوم است که واکنش ها را بر اساس مولکولی بودنشان تشخیص دهیم، به عنوان مثال. با تعداد مولکول های درگیر در هر عمل اولیه برهمکنش. بر این اساس، واکنش ها بین تک مولکولی، دو مولکولی و سه مولکولی تشخیص داده می شوند.
واکنشهای تک مولکولی آنهایی هستند که در آنها عمل اولیه تبدیل شیمیایی یک مولکول است که به طور کلی می توان آن را با این معادله توصیف کرد.
واکنشهای دو مولکولی واکنشهایی هستند که در آنها عمل ابتدایی هنگام برخورد دو مولکول اتفاق میافتد
![]()
در واکنش های سه مولکولی، یک عمل ابتدایی در هنگام برخورد همزمان سه مولکول رخ می دهد.
![]()
برخورد بیش از سه مولکول به طور همزمان تقریبا غیرممکن است، بنابراین واکنش هایی با وزن مولکولی بالاتر در عمل یافت نمی شوند.
مفهوم اصلی در سینتیک شیمیایی مفهوم سرعت واکنش است:
سرعت یک واکنش شیمیایی با مقدار ماده واکنش داده شده در واحد زمان در واحد حجم تعیین می شود.
اگر در حجم و دمای ثابت، غلظت یکی از مواد واکنش دهنده در طی یک دوره زمانی از به کاهش یابد، در این صورت، مطابق با تعریف، سرعت واکنش برای یک دوره زمانی معین برابر است با:
علامت سمت راست معادله به دلیل زیر ظاهر می شود. با پیشرفت واکنش، غلظت واکنش دهنده ها کاهش می یابد، بنابراین، و از آنجایی که سرعت واکنش همیشه مثبت است، علامت باید در جلوی کسر قرار گیرد.
به طور معمول، برای واکنشهایی که در گازها یا محلولها رخ میدهند، غلظت واکنشدهندهها بر حسب mol/l و سرعت واکنش بر حسب mol/(ls) بیان میشود.
سرعت هر واکنش شیمیایی هم به ماهیت واکنش دهنده ها و هم به شرایطی که در آن واکنش رخ می دهد بستگی دارد. مهمترین این شرایط عبارتند از: غلظت، دما و وجود کاتالیزور (پدیده کاتالیز در زیر مورد بحث قرار می گیرد). ماهیت واکنش دهنده ها تأثیر تعیین کننده ای بر سرعت یک واکنش شیمیایی دارد. به عنوان مثال، هیدروژن حتی در دمای اتاق با فلوئور بسیار شدید واکنش می دهد، در حالی که با برم حتی زمانی که گرم می شود بسیار کندتر واکنش می دهد.
اثر غلظت مواد واکنش دهنده را می توان از این مفهوم توضیح داد که فعل و انفعالات شیمیایی نتیجه برخورد ذرات است. افزایش تعداد ذرات در یک حجم معین منجر به برخوردهای مکرر می شود، به عنوان مثال. برای افزایش سرعت واکنش
رابطه کمی بین سرعت واکنش و غلظت مولی واکنش دهنده ها با قانون اساسی سینتیک شیمیایی - قانون عمل جرم توصیف می شود.
سرعت یک واکنش شیمیایی در دمای ثابت با حاصلضرب غلظت مواد واکنش دهنده نسبت مستقیم دارد.
برای یک واکنش تک مولکولی از نوع (5.3)، سرعت واکنش v با غلظت مولکول های ماده A تعیین می شود:
![]()
که در آن k ضریب تناسب است که ثابت سرعت واکنش نامیده می شود. - غلظت مولی ماده A.
در مورد یک واکنش دو مولکولی از نوع (5.4)، سرعت آن با غلظت مولکول ها نه تنها از ماده A، بلکه در ماده B نیز تعیین می شود:
![]()
در مورد یک واکنش سه مولکولی از نوع (6.5)، سرعت واکنش با معادله بیان می شود:
![]()
در حالت کلی، وقتی m مولکول های یک ماده، مولکول های ماده B به طور همزمان وارد واکنش می شوند، یعنی.
![]()
معادله سرعت واکنش شکل دارد
![]()
این معادله بیانی ریاضی از قانون عمل جرم به صورت کلی است.
برای درک معنای فیزیکی ثابت سرعت واکنش، باید در معادلات نوشته شده در بالا بپذیریم که (یا حاصل ضرب آنها را برابر با واحد قرار دهیم) و سپس مشخص می شود که ثابت سرعت k از نظر عددی برابر با سرعت واکنش است زمانی که غلظت واکنش دهنده ها (یا محصول آنها در معادلات سرعت) واحد مساوی هستند.
به ویژه باید تأکید شود که عبارت (5.7) برای یک دمای معین و ثابت به دست آمده است. در حالت کلی، از آنجایی که سرعت واکنش به دما بستگی دارد، قانون عمل جرم باید به این صورت باشد
که در آن v و k تابع دما هستند.
وابستگی سرعت یک واکنش شیمیایی به غلظت واکنش دهنده های نوع (5.7) برای گازها و واکنش های رخ داده در محلول ها معتبر است.
این برای واکنش هایی که شامل مواد جامد است اعمال نمی شود، زیرا در این موارد برهمکنش مولکول ها در کل حجم مواد واکنش دهنده رخ نمی دهد، بلکه فقط روی سطحی که اندازه آن نیز سرعت واکنش را تعیین می کند، رخ می دهد. بنابراین، واکنش ها در سیستم های ناهمگن بسیار پیچیده تر است.
سیستم ناهمگن سیستمی است متشکل از ذرات مجزا که در حالتهای مختلف تجمع قرار دارند و توسط رابطهای خاصی از یکدیگر جدا شدهاند. تک تک اجزای همگن یک سیستم ناهمگن فازهای آن نامیده می شود. به عنوان مثال، در دمای 0 درجه سانتیگراد، یخ، آب و بخار بالای آنها یک سیستم ناهمگن از سه فاز را تشکیل می دهند: جامد - یخ، مایع - آب و گاز - بخار آب. اسید و قطعات فلزی که با آن واکنش می دهند، یک سیستم سه فازی و غیره را تشکیل می دهند.
در یک سیستم ناهمگن، یک واکنش همیشه در سطح مشترک بین دو فاز رخ می دهد، زیرا فقط در اینجا مولکول های فازهای مختلف می توانند با یکدیگر برخورد کنند. بنابراین، سرعت یک واکنش ناهمگن نه تنها به عوامل مورد بحث قبلی، بلکه به اندازه سطح تماس بین فازهای واکنش بستگی دارد. هر گونه افزایش سطح نیز منجر به افزایش سرعت واکنش می شود. به عنوان مثال، اگر فلزات به صورت پودر گرفته شوند، انحلال فلزات در اسیدها بسیار سریعتر انجام می شود.
اثر دما.
آزمایش های متعدد نشان می دهد که با افزایش دما، سرعت اکثر واکنش های شیمیایی به طور قابل توجهی افزایش می یابد و برای واکنش ها در سیستم های همگن، هنگامی که به ازای هر ده درجه حرارت داده می شود، سرعت واکنش 2-4 برابر افزایش می یابد (قانون van't Hoff).
این قانون با مفهوم ضریب دمایی سرعت واکنش y همراه است و توسط رابطه تعیین می شود
![]()
به دست آمده از رابطه (5.8).
در دماهایی که خیلی تغییر نمی کنند، برای بسیاری از واکنش ها مطابق با قانون وانت هاف
مقدار ضریب دما y این امکان را فراهم می کند که با استفاده از فرمول، تغییر در سرعت واکنش را زمانی که دما به میزان معینی از درجه افزایش می یابد، محاسبه کنید.
به عبارت دیگر، از (5.10) واضح است که با افزایش دما در یک پیشرفت حسابی، سرعت واکنش در یک پیشرفت هندسی افزایش مییابد. چگونه می توان چنین وابستگی دمایی بالایی را در سرعت واکنش توضیح داد؟
به نظر می رسد که چنین وابستگی با افزایش تعداد برخوردهای مولکولی همراه است. معلوم شد که اینطور نیست. ثابت شده است که تعداد کل برخوردهای مولکولی تنها چند درصد با افزایش دما به میزان ده درجه افزایش می یابد، در حالی که تعداد مولکول های واکنش داده شده 200-400٪ افزایش می یابد.
برای توضیح اختلافات مشاهده شده، S. Arrhenius اولین کسی بود که نشان داد که اثر دما به افزایش تعداد مولکولهای فعال کاهش مییابد. چنین مولکولی که در لحظه برخورد دارای انرژی کمتر از مقدار تعیین شده برای یک واکنش معین نیست، انرژی فعال شدن یک واکنش شیمیایی نامیده می شود.
انرژی فعال سازی مقدار معینی از انرژی اضافی (در مقایسه با میانگین) مورد نیاز برای ورود مولکول ها به یک واکنش است.
به گفته آرنیوس، ثابت سرعت یک واکنش شیمیایی در (5.8) به طور نمایی به دما بستگی دارد.
![]()
در اینجا E انرژی فعال سازی است - ثابت گاز جهانی، T دما در K است، A یک ثابت است.
تفاوت بین انرژی فعال سازی و گرمای واکنش
با نمودار در شکل 1 به وضوح نشان داده شده است. 5.1.

برنج. 5.1. رابطه بین انرژی فعال سازی و تغییر در آنتالپی (اثر حرارتی) واکنش
خود انرژی فعالسازی توسط سد انرژی تعیین میشود که مولکولهای در حال برخورد باید در جهتهای رو به جلو () یا معکوس قبل از توزیع مجدد پیوند بر آن غلبه کنند.
مفهوم کاتالیزور
یکی از قوی ترین ابزارها برای تأثیرگذاری بر سرعت واکنش های شیمیایی استفاده از کاتالیزورها است.
کاتالیزور ماده ای است که سرعت یک واکنش شیمیایی را تغییر می دهد اما پس از اتمام واکنش شیمیایی بدون تغییر باقی می ماند.
اثر کاتالیزورها بر سرعت واکنش را کاتالیز می گویند. هنگامی که مواد برهم کنش و کاتالیزور در یک حالت تجمع هستند، از کاتالیز همگن صحبت می کنند. در کاتالیز ناهمگن، واکنش دهنده ها و کاتالیزور در حالت های مختلف تجمع هستند: معمولا کاتالیزور جامد است و واکنش دهنده ها مایع یا گاز هستند (به عنوان مثال، در مورد اکسیداسیون در حضور اکسید پلاتین یا وانادیم (V) کاتالیز ناهمگن رخ می دهد).
مکانیسم عمل کاتالیزورها می تواند بسیار متنوع و به عنوان یک قاعده بسیار پیچیده باشد. فرضیه اصلی توضیح دهنده تأثیر یک کاتالیزور بر سرعت واکنش، فرض تشکیل محصولات میانی در طول برهمکنش کاتالیزور و واکنش دهنده است. اگر یک واکنش شیمیایی به آرامی بدون کاتالیزور، اما به سرعت در حضور کاتالیزور K رخ دهد، عمل آن با این واقعیت توضیح داده می شود که کاتالیزور با یکی از مواد اولیه واکنش می دهد و یک ترکیب شکننده (معمولاً بسیار واکنش پذیر) میانی AA را تشکیل می دهد. یا VC):
ترکیب میانی به دست آمده (به عنوان مثال، AA) با ماده اولیه دیگری B واکنش می دهد و محصول واکنش نهایی AB را تشکیل می دهد و کاتالیزور K را به شکل اصلی خود آزاد می کند:
ساده ترین طرح کاتالیز (5.12)، (5.13) به وضوح نشان می دهد که چرا هر ذره کاتالیزور می تواند بارها در واکنش شرکت کند. (درست است، "بی شمار" فقط تئوری است، زیرا در عمل برخی از مواد، حتی در مقادیر بسیار کم، می توانند سرعت واکنش کاتالیزوری را به شدت کاهش دهند و فعالیت کاتالیزور را کاهش دهند یا کاملاً از بین ببرند. چنین موادی سم کاتالیزوری نامیده می شوند. خود پدیده کاهش فعالیت کاتالیزور مسمومیت است.) از اینجا مشخص می شود که چرا کاتالیزور پس از پایان واکنش از نظر کمی و شیمیایی بدون تغییر باقی می ماند.
سرعت واکنش شیمیایی
سرعت واکنش شیمیاییبه عنوان تغییر در غلظت مولی یکی از واکنش دهنده ها در واحد زمان تعریف می شود. سرعت یک واکنش شیمیایی همیشه یک مقدار مثبت است، بنابراین اگر توسط ماده شروع (که غلظت آن در طول واکنش کاهش می یابد) تعیین شود، مقدار حاصل در -1 ضرب می شود.
به عنوان مثال، برای یک واکنش، سرعت را می توان به صورت زیر بیان کرد:
در سال 1865 N.N. بکتوف و در سال 1867 ک.م. گولدبرگ و پی واگ قانون عمل جرمی را فرموله کردند که بر اساس آن سرعت یک واکنش شیمیایی در هر لحظه از زمان متناسب با غلظت معرف های افزایش یافته به توان های معین است. علاوه بر غلظت، سرعت یک واکنش شیمیایی تحت تأثیر عوامل زیر است: ماهیت مواد واکنش دهنده، وجود کاتالیزور، دما (قاعده وانت هاف) و سطح مواد واکنش دهنده.
ترتیب واکنش شیمیایی
ترتیب واکنش برای یک ماده معین، توان غلظت این ماده در معادله جنبشی واکنش است.
وضعیت گذار
کاتالیزور
کاتالیز فرآیندی است که شامل تغییر سرعت واکنش های شیمیایی در حضور موادی به نام کاتالیزور است.
کاتالیزورها موادی هستند که سرعت یک واکنش شیمیایی را تغییر می دهند، که می توانند در یک واکنش شرکت کنند، بخشی از محصولات میانی باشند، اما جزء محصولات نهایی واکنش نیستند و پس از پایان واکنش بدون تغییر باقی می مانند.
واکنش های کاتالیزوری واکنش هایی هستند که در حضور کاتالیزورها رخ می دهند.
هنگامی که سرعت واکنش افزایش می یابد، کاتالیز مثبت و هنگامی که سرعت واکنش کاهش می یابد منفی (بازداری) نامیده می شود. نمونه ای از کاتالیز مثبت اکسیداسیون آمونیاک روی پلاتین برای تولید اسید نیتریک است. یک مثال از منفی کاهش نرخ خوردگی زمانی است که نیتریت سدیم، کرومات پتاسیم و دی کرومات وارد مایعی می شوند که در آن فلز استفاده می شود.
کاتالیزورهایی که سرعت یک واکنش شیمیایی را کاهش می دهند، بازدارنده نامیده می شوند.
بسته به اینکه کاتالیزور در همان فاز با واکنش دهنده ها باشد یا یک فاز مستقل تشکیل دهد، ما از کاتالیز همگن یا ناهمگن صحبت می کنیم.
نمونه ای از کاتالیز همگن، تجزیه پراکسید هیدروژن در حضور یون های ید است. واکنش در دو مرحله رخ می دهد:
H O + I = H O + IO
H O + IO = H O + O + I
در کاتالیز همگن، عمل کاتالیزور به این دلیل است که با مواد واکنش دهنده برهمکنش می کند و ترکیبات میانی تشکیل می دهد که منجر به کاهش انرژی فعال سازی می شود.
در کاتالیز ناهمگن، شتاب فرآیند معمولاً روی سطح یک جسم جامد - کاتالیزور اتفاق می افتد، بنابراین فعالیت کاتالیزور به اندازه و خواص سطح آن بستگی دارد. در عمل، کاتالیزور معمولاً روی یک تکیه گاه متخلخل جامد پشتیبانی می شود. مکانیسم کاتالیز ناهمگن پیچیده تر از کاتالیز همگن است.
مکانیسم کاتالیز ناهمگن شامل پنج مرحله است که همه آنها برگشت پذیر هستند.
1. انتشار مواد واکنش دهنده به سطح یک جامد.
2. جذب فیزیکی در مراکز فعال سطح یک ماده جامد از مولکول های واکنش دهنده و سپس جذب شیمیایی آنها.
3. واکنش شیمیایی بین مولکول های واکنش دهنده.
4. دفع محصولات از سطح کاتالیزور.
5. انتشار محصول از سطح کاتالیزور به جریان عمومی.
یک مثال از کاتالیز ناهمگن، اکسیداسیون SO به SO بر روی یک کاتالیزور VO در تولید اسید سولفوریک (روش تماس) است.
پروموترها (یا فعال کننده ها) موادی هستند که فعالیت کاتالیزور را افزایش می دهند. در این حالت ممکن است خود پروموترها خاصیت کاتالیزوری نداشته باشند.
سموم کاتالیزوری ناخالصی های خارجی در مخلوط واکنش هستند که منجر به از دست دادن جزئی یا کامل فعالیت کاتالیزور می شود. بنابراین، آثار آرسنیک و فسفر باعث از دست دادن سریع فعالیت VO توسط کاتالیزور می شود (روش تماس برای تولید HSO).
بسیاری از تولیدات شیمیایی مهم مانند تولید اسید سولفوریک، آمونیاک، اسید نیتریک، لاستیک مصنوعی، تعدادی پلیمر و غیره در حضور کاتالیزورها انجام می شود.
واکنش های بیوشیمیایی در موجودات گیاهی و جانوری توسط کاتالیزورهای بیوشیمیایی - آنزیم ها تسریع می شود.
سرعت فرآیند عامل بسیار مهمی است که بهره وری تجهیزات تولید مواد شیمیایی را تعیین می کند. بنابراین یکی از اصلی ترین وظایفی که انقلاب علمی و فناوری برای شیمی تعیین کرده است، جستجوی راه هایی برای افزایش سرعت واکنش هاست. یکی دیگر از وظایف مهم شیمی مدرن، به دلیل افزایش شدید مقیاس تولید محصولات شیمیایی، افزایش گزینش پذیری تبدیل های شیمیایی به محصولات مفید، کاهش میزان انتشار و ضایعات است. این نیز به حفاظت از محیط زیست و استفاده منطقی تر از منابع طبیعی متأسفانه در حال نابودی مربوط می شود.
برای دستیابی به همه این اهداف، ابزارهای مناسب مورد نیاز است و این ابزارها در درجه اول کاتالیزور هستند. با این حال، پیدا کردن آنها چندان آسان نیست. در فرآیند درک ساختار درونی چیزهای اطراف ما، دانشمندان درجه بندی خاصی را ایجاد کرده اند، سلسله مراتبی از سطوح جهان خرد. دنیایی که در کتاب ما توضیح داده شده است، دنیای مولکول ها است که دگرگونی های متقابل آنها موضوع شیمی را تشکیل می دهد. ما به تمام شیمی علاقه مند نخواهیم بود، بلکه فقط به بخشی از آن که به مطالعه دینامیک تغییرات در ساختار شیمیایی مولکول ها اختصاص دارد، علاقه مند خواهیم بود. ظاهراً نیازی به گفتن نیست که مولکول ها از اتم ها ساخته شده اند و اتم ها از یک هسته و لایه الکترونی اطراف آن ساخته شده اند. اینکه خواص مولکول ها به ماهیت اتم های تشکیل دهنده آنها و توالی ارتباط آنها با یکدیگر بستگی دارد؛ اینکه خواص شیمیایی و فیزیکی مواد به خواص مولکول ها و ماهیت پیوند آنها بستگی دارد. ما فرض می کنیم که همه اینها به طور کلی برای خواننده شناخته شده است، و بنابراین تاکید اصلی بر مسائل مربوط به ایده سرعت واکنش های شیمیایی خواهد بود.
دگرگونی های متقابل مولکول ها با سرعت های بسیار متفاوتی اتفاق می افتد. سرعت را می توان با گرم کردن یا سرد کردن مخلوط مولکول های واکنش دهنده تغییر داد. هنگامی که حرارت داده می شود، سرعت واکنش معمولا افزایش می یابد، اما این تنها وسیله برای تسریع دگرگونی های شیمیایی نیست. روش مؤثرتر دیگری وجود دارد - کاتالیزوری که در زمان ما به طور گسترده در تولید طیف گسترده ای از محصولات استفاده می شود.
اولین ایده های علمی در مورد کاتالیزور همزمان با توسعه نظریه اتمی ساختار ماده بوجود آمد. در سال 1806، یک سال پس از اینکه دالتون، یکی از بنیانگذاران نظریه اتمی مدرن، قانون نسبت های چندگانه را در مجموعه مقالات انجمن ادبی و فلسفی منچستر فرموله کرد، کلمنت و دسورمز اطلاعات دقیقی را در مورد شتاب اکسیداسیون دی اکسید گوگرد در وجود اکسیدهای نیتروژن در دمای اتاق تولید اسید سولفوریک. شش سال بعد در مجله فناوری، کیرشهوف نتایج مشاهدات خود را در مورد اثر تسریع کننده اسیدهای معدنی رقیق بر هیدرولیز نشاسته به گلوکز ارائه کرد. این دو مشاهدات عصر مطالعه تجربی پدیده های شیمیایی غیرمعمول برای آن زمان را باز کرد، که شیمیدان سوئدی برزلیوس در سال 1835 نام کلی "کاتالیز" را از کلمه یونانی "کاتالو" - برای از بین بردن، گذاشت. این، به طور خلاصه، تاریخچه کشف کاتالیزور است که با دلیل موجه باید آن را به عنوان یکی از پدیده های اساسی طبیعت طبقه بندی کرد.
حال باید مدرنترین و پذیرفتهشدهترین تعریف کاتالیزور و سپس طبقهبندی کلی فرآیندهای کاتالیزوری را ارائه دهیم، زیرا هر علم دقیقی از اینجا شروع میشود. همانطور که می دانید، "فیزیک کاری است که فیزیکدانان انجام می دهند (همین را می توان در مورد شیمی نیز گفت). با پیروی از این دستور برگمن، می توان خود را به این جمله اکتفا کرد که "کاتالیز کاری است که هم شیمیدانان و هم فیزیکدانان انجام می دهند." اما طبیعتاً چنین توضیحی طنزآمیز کافی نیست و از زمان برزلیوس، تعاریف علمی بسیاری از مفهوم «کاتالیزور» ارائه شده است. به نظر ما، بهترین تعریف توسط G.K. Vereskov فرموله شده است: "از نظر پدیدارشناسی، کاتالیز را می توان به عنوان تحریک واکنش های شیمیایی یا تغییر در سرعت آنها تحت تأثیر مواد - کاتالیزورهایی که مکرراً وارد برهمکنش های شیمیایی میانی با شرکت کنندگان در واکنش می شوند و ... تعریف کرد. ترکیب شیمیایی خود را پس از هر چرخه فعل و انفعالات میانی بازیابی کنید.
عجیب ترین چیز در مورد این تعریف قسمت پایانی آن است - ماده ای که فرآیند شیمیایی را تسریع می کند مصرف نمی شود. اگر لازم باشد حرکت جسم سنگین را تسریع کنیم، آن را هل می دهند و بنابراین انرژی صرف آن می شود. هرچه انرژی بیشتری صرف شود، سرعت بدن بیشتر می شود. در حالت ایده آل، مقدار انرژی مصرف شده دقیقاً برابر با انرژی جنبشی به دست آمده توسط بدن خواهد بود. این قانون اساسی طبیعت - حفاظت از انرژی را نشان می دهد.
چهره های برجسته در شیمی در کاتالیزور
I. Berzelius (1837): "مواد شناخته شده، هنگام تماس با مواد دیگر، چنان تأثیری بر مواد دوم می گذارند که یک اثر شیمیایی رخ می دهد - برخی از مواد از بین می روند، برخی دیگر دوباره بدون بدن تشکیل می شوند که حضور آنها باعث این دگرگونی ها می شود. بر عهده گرفتن هر گونه مشارکت. ما علت تولید این پدیده ها را نیروی کاتالیزوری می نامیم.
M. Faraday (1840). پدیدههای کاتالیزوری را میتوان با ویژگیهای شناختهشده ماده توضیح داد، بدون اینکه نیروی جدیدی به آن وارد شود.»
P. Raschig (1906): "کاتالیز، تغییر در ساختار یک مولکول است که توسط عوامل خارجی ایجاد می شود، که منجر به تغییر در خواص شیمیایی می شود."
E. Abel (1913): "من به این نتیجه رسیده ام که کاتالیز توسط یک واکنش انجام می شود و نه با حضور صرف یک ماده."
L. Gurvich (1916): "اجزام کاتالیزوری، مولکول های متحرک را به سمت خود جذب می کنند، بسیار قوی تر از اجسامی که فاقد عمل کاتالیزوری هستند، در نتیجه نیروی ضربه مولکول هایی که به سطح آنها برخورد می کنند افزایش می دهد."
G.K. Boreskov (1968): "روزی روزگاری، کاتالیز به عنوان یک پدیده خاص، کمی مرموز، با قوانین خاصی در نظر گرفته می شد، که قرار بود افشای آنها بلافاصله مشکل انتخاب را به شکل کلی حل کند. اکنون می دانیم که اینطور نیست. کاتالیز در ذات خود یک پدیده شیمیایی است. تغییر در سرعت واکنش در طول عمل کاتالیزوری به دلیل برهمکنش شیمیایی میانی واکنش دهنده ها با کاتالیزور است.
اگر تلاش ناموفق برزلیوس برای پیوند دادن پدیده های مشاهده شده با عمل یک «نیروی کاتالیزوری» پنهان را در نظر نگیریم، همانطور که از سخنرانی های بالا مشخص است، بحث عمدتاً حول جنبه های فیزیکی و شیمیایی کاتالیزور بود. برای مدت طولانی، نظریه انرژی کاتالیز محبوبیت خاصی داشت و فرآیند تحریک مولکول ها را با مهاجرت رزونانسی انرژی مرتبط می کرد. کاتالیزور با مولکول های در حال واکنش تعامل می کند و ترکیبات میانی ناپایداری را تشکیل می دهد که تجزیه می شوند تا محصول واکنش و کاتالیزور شیمیایی بدون تغییر را آزاد کنند. دانش مدرن ما به بهترین وجه در بیانیه بورسکوف منعکس شده است. اما در اینجا این سوال مطرح می شود: آیا کاتالیزور از آنجایی که خود از نظر شیمیایی در واکنش شرکت می کند، می تواند حالت تعادل جدیدی ایجاد کند؟ اگر چنین بود، ایده مشارکت شیمیایی کاتالیزور بلافاصله با قانون بقای انرژی در تضاد بود. برای جلوگیری از این امر، دانشمندان مجبور شدند بپذیرند و سپس به طور تجربی ثابت کنند که کاتالیزور واکنش را نه تنها در جهت جلو، بلکه در جهت معکوس نیز تسریع می کند. آن دسته از ترکیباتی که هم سرعت و هم تعادل یک واکنش را تغییر می دهند، کاتالیزور به معنای دقیق کلمه نیستند. باید اضافه کنیم که معمولاً در حضور کاتالیزور واکنش های شیمیایی شتاب می گیرد و این پدیده را کاتالیز مثبت می نامند بر خلاف منفی که در آن وارد شدن کاتالیزور به سیستم واکنش باعث می شود. کاهش نرخ به بیان دقیق، کاتالیز همیشه سرعت یک واکنش را افزایش می دهد، اما گاهی اوقات شتاب یکی از مراحل (به عنوان مثال، ظهور یک مسیر پایان زنجیره جدید) منجر به مهار مشاهده شده یک واکنش شیمیایی می شود.
ما فقط کاتالیزور مثبت را در نظر خواهیم گرفت که معمولاً به انواع زیر تقسیم می شود:
الف) همگن، زمانی که مخلوط واکنش و کاتالیزور در حالت مایع یا گاز هستند. ب) ناهمگن - کاتالیزور به شکل یک ماده جامد است و ترکیبات واکنش دهنده به شکل محلول یا مخلوط گازی هستند. (این رایج ترین نوع کاتالیز است که بنابراین در حد فاصل بین دو فاز انجام می شود.) ج) تشکیلات پروتئینی آنزیمی - پیچیده به عنوان کاتالیزور عمل می کنند و روند واکنش های مهم بیولوژیکی را در موجودات دنیای گیاهی و حیوانی تسریع می کنند. (کاتالیز آنزیمی میتواند همگن یا ناهمگن باشد، اما به دلیل ویژگیهای خاص عمل آنزیمها، توصیه میشود این نوع کاتالیز را به یک ناحیه مستقل جدا کنیم.) کاتالیز همگن
در میان واکنشهای کاتالیزوری متعدد، کاتالیز جایگاه ویژهای در واکنشهای زنجیرهای دارد. همانطور که مشخص است، واکنش های زنجیره ای آن دسته از فرآیندهای شیمیایی و فیزیکی هستند که در آنها تشکیل برخی ذرات فعال (مراکز فعال) در یک ماده یا در مخلوطی از مواد منجر به این واقعیت می شود که هر یک از ذرات فعال باعث ایجاد یک سری کامل می شود. زنجیره ای از تبدیلات متوالی ماده» (امانوئل، 1957).
این مکانیسم برای توسعه فرآیند به این دلیل امکان پذیر است که ذره فعال با ماده تعامل می کند و نه تنها محصولات واکنش را تشکیل می دهد، بلکه یک ذره فعال جدید (یک، دو یا بیشتر) را نیز تشکیل می دهد که قادر به واکنش جدید تبدیل است. ماده، و غیره. دگرگونی های زنجیره ای حاصل از ماده تا زمانی که ذره فعال از سیستم ناپدید شود ادامه می یابد ("مرگ" ذره فعال و شکست زنجیره رخ می دهد). سخت ترین مرحله در این مورد، هسته زایی ذرات فعال (مثلا رادیکال های آزاد) است، اما پس از هسته زایی زنجیره تبدیل ها به راحتی رخ می دهد. واکنش های زنجیره ای در طبیعت گسترده هستند. پلیمریزاسیون، کلرزنی، اکسیداسیون و بسیاری از فرآیندهای شیمیایی دیگر از یک زنجیره یا بهتر بگوییم یک مکانیسم رادیکال زنجیره ای (با مشارکت رادیکال ها) پیروی می کنند. مکانیسم اکسیداسیون ترکیبات آلی (در مراحل اولیه) اکنون کاملاً مشخص شده است. اگر ماده اکسید کننده R-H را نشان دهیم (که در آن H اتم هیدروژنی است که کمترین استحکام پیوند را با بقیه مولکول R دارد)، این مکانیسم را می توان به شکل زیر نوشت:
کاتالیزورها، مانند ترکیبات فلزات با ظرفیت متغیر، می توانند بر هر یک از مراحل در نظر گرفته شده فرآیند تأثیر بگذارند. اجازه دهید اکنون به نقش کاتالیزورها در فرآیندهای انشعاب زنجیره ای منحط بپردازیم. برهم کنش هیدروپراکسید با یک فلز می تواند منجر به تسریع و مهار واکنش اکسیداسیون مواد آلی توسط ترکیبات فلزی با ظرفیت متغیر شود که این بستگی به ماهیت محصولات تشکیل شده در طی تجزیه هیدروپراکسید دارد. ترکیبات فلزی با هیدروپراکسیدها کمپلکسی را تشکیل می دهند که در "قفس" محیط حلال متلاشی می شود؛ اگر رادیکال های تشکیل شده در طی تجزیه کمپلکس موفق به ترک سلول شوند، آنگاه فرآیند را آغاز می کنند (کاتالیز مثبت). اگر این رادیکالها زمان خروج و ترکیب مجدد در سلول به محصولات غیرفعال مولکولی را نداشته باشند، این امر منجر به کندی فرآیند زنجیره رادیکال (کاتالیز منفی) میشود، زیرا در این مورد هیدروپراکسید، تامینکننده بالقوه رادیکالهای جدید، است. هدر رفت
تا کنون ما فقط مراحل کم عمق فرآیندهای اکسیداسیون را در نظر گرفته ایم. در مراحل عمیق تر، به عنوان مثال در مورد اکسیداسیون هیدروکربن ها، اسیدها، الکل ها، کتون ها و آلدئیدها تشکیل می شوند که همچنین می توانند با کاتالیزور واکنش دهند و به عنوان منبع اضافی رادیکال های آزاد در واکنش عمل کنند، یعنی در این مورد. انشعاب زنجیره ای منحط اضافی وجود خواهد داشت.
کاتالیز ناهمگن
متأسفانه تاکنون، علیرغم تعداد نسبتاً زیادی از نظریه ها و فرضیه ها در زمینه کاتالیزور، بسیاری از اکتشافات اساسی به طور تصادفی یا در نتیجه یک رویکرد ساده تجربی انجام شده است. همانطور که می دانید، یک کاتالیزور جیوه برای سولفوناسیون هیدروکربن های معطر به طور تصادفی توسط M.A. Ilyinsky کشف شد که به طور تصادفی دماسنج جیوه ای را شکست: جیوه وارد راکتور شد و واکنش شروع شد. به روشی مشابه، کاتالیزورهای شناخته شده زیگلر که در یک زمان عصر جدیدی را در فرآیند پلیمریزاسیون باز کردند، کشف شدند. طبیعتاً این مسیر توسعه دکترین کاتالیز با سطح علم مدرن مطابقت ندارد و این افزایش علاقه به مطالعه مراحل اولیه فرآیندها در واکنش های کاتالیزوری ناهمگن را توضیح می دهد. این مطالعات مقدمه ای برای ایجاد یک مبنای کاملاً علمی برای انتخاب کاتالیزورهای بسیار کارآمد است. در بسیاری از موارد، نقش کاتالیزورهای ناهمگن در فرآیند اکسیداسیون به جذب یک ترکیب آلی و اکسیژن با تشکیل مجتمع جذب شده از این مواد در سطح کاتالیزور کاهش می یابد. این کمپلکس پیوندهای اجزا را سست می کند و آنها را واکنش پذیرتر می کند. در برخی موارد، کاتالیزور تنها یک جزء را جذب می کند که به رادیکال ها تجزیه می شود. به عنوان مثال، پروپیلن روی اکسید مس تجزیه می شود و یک رادیکال آلییک تشکیل می دهد که سپس به راحتی با اکسیژن واکنش می دهد. مشخص شد که فعالیت کاتالیزوری فلزات با ظرفیت متغیر تا حد زیادی به پر شدن اوربیتالهای d در کاتیونهای اکسیدهای فلزی بستگی دارد.
با توجه به فعالیت کاتالیزوری در واکنش تجزیه بسیاری از هیدروپراکسیدها، ترکیبات فلزی به ترتیب زیر مرتب می شوند:
ما یکی از راه های ممکن برای شروع فرآیند را در نظر گرفتیم - برهمکنش هیدروپراکسید با کاتالیزور. با این حال، در مورد اکسیداسیون، واکنش شروع زنجیره ناهمگن می تواند هم از طریق تجزیه به رادیکال های هیدروپراکسید و هم از طریق تعامل هیدروکربن با اکسیژن فعال شده توسط سطح کاتالیزور رخ دهد. شروع زنجیره ها ممکن است به دلیل مشارکت فرم باردار ترکیب آلی RH+ باشد که در طی برهمکنش RH با کاتالیزور ایجاد می شود. این مورد در مورد کاتالیز در واکنش های شروع زنجیره ای (هسته و انشعاب) است. نقش کاتالیزورهای ناهمگن در واکنشهای ادامه زنجیره بهویژه با تغییر در سرعت و جهت ایزومریزاسیون رادیکالهای پراکسید به وضوح تاکید میشود.
کاتالیز در بیوشیمی
کاتالیز آنزیمی به طور جدایی ناپذیری با فعالیت حیات موجودات گیاهی و جانوری مرتبط است. بسیاری از واکنشهای شیمیایی حیاتی که در یک سلول رخ میدهند (حدود ده هزار) توسط کاتالیزورهای آلی خاصی به نام آنزیمها یا آنزیمها کنترل میشوند. اصطلاح "ویژه" نباید به دقت مورد توجه قرار گیرد، زیرا از قبل مشخص شده است که این آنزیم ها از چه چیزی ساخته شده اند. طبیعت برای این منظور یک ماده ساختمانی واحد - اسیدهای آمینه را انتخاب کرد و آنها را به زنجیره های پلی پپتیدی با طول های مختلف و در توالی های مختلف متصل کرد.
این به اصطلاح ساختار اولیه آنزیم است که در آن R باقیمانده های جانبی یا مهم ترین گروه های عملکردی پروتئین ها هستند که احتمالاً به عنوان مراکز فعال آنزیم ها عمل می کنند. این گروه های جانبی بار اصلی را در حین کار آنزیم تحمل می کنند، در حالی که زنجیره پپتیدی نقش یک اسکلت پشتیبان را بازی می کند. طبق مدل ساختاری پاولینگ-کوری، به شکل یک مارپیچ تا می شود که در حالت عادی توسط پیوندهای هیدروژنی بین مراکز اسیدی و بازی تثبیت می شود:
برای برخی از آنزیم ها، ترکیب اسید آمینه کامل و توالی محل آنها در زنجیره، و همچنین ساختار فضایی پیچیده، ایجاد شده است. اما این هنوز خیلی اوقات نمی تواند به ما کمک کند به دو سؤال اصلی پاسخ دهیم: 1) چرا آنزیم ها اینقدر انتخابی هستند و تبدیل شیمیایی مولکول ها را فقط با یک ساختار کاملاً مشخص تسریع می کنند (که برای ما نیز شناخته شده است). 2) چگونه آنزیم سد انرژی را کاهش می دهد، به عنوان مثال، مسیری از نظر انرژی مطلوب تر را انتخاب می کند، به طوری که واکنش ها می توانند در دمای معمولی انجام شوند.
گزینش پذیری دقیق و سرعت بالا دو ویژگی اصلی کاتالیز آنزیمی است که آن را از کاتالیز آزمایشگاهی و صنعتی متمایز می کند. هیچ یک از کاتالیزورهای ساخته شده توسط انسان (به استثنای 2-هیدروکسی پیریدین) نمی توانند با آنزیم ها از نظر قدرت و گزینش پذیری عملکردشان بر روی مولکول های آلی مقایسه شوند. فعالیت آنزیم، مانند هر کاتالیزور دیگری، به دما نیز بستگی دارد: با افزایش دما، سرعت واکنش آنزیمی نیز افزایش می یابد. در همان زمان، توجه به کاهش شدید انرژی فعال سازی E در مقایسه با واکنش غیر کاتالیزوری جلب می شود. درست است، این همیشه اتفاق نمی افتد. موارد زیادی وجود دارد که سرعت به دلیل افزایش ضریب پیش نمایی مستقل از دما در معادله آرنیوس افزایش می یابد.
تعادل
ثابت تعادل شیمیایی
انرژی آزاد
پیوندها
سینتیک شیمیایی و کاتالیز سخنرانی توسط A. A. Kubasov، دکترای شیمی. n، دانشیار گروه شیمی فیزیک، دانشکده شیمی، دانشگاه دولتی مسکو.
همچنین ببینید
- تئوری برخورد
- نظریه حالت گذار
بنیاد ویکی مدیا 2010.
ببینید «سینتیک شیمیایی» در فرهنگهای دیگر چیست:
شاخه ای از شیمی فیزیک، مطالعه سرعت و مکانیسم واکنش های شیمیایی. سینتیک شیمیایی مبنای علمی برای ایجاد و بهبود فرآیندهای موجود در فناوری شیمیایی است. روش های سینتیک شیمیایی در زیست شناسی و... ... فرهنگ لغت دایره المعارفی بزرگ
زمینه فیزیکی شیمی، که در آن مکانیسم ها و سرعت های شیمی را مطالعه می کنند. واکنش ها K. x. شامل سه اصلی وظایف: مطالعه الگوهای جریان شیمیایی. واکنش ها در طول زمان و وابستگی سرعت آنها به غلظت معرف ها، دما و سایر عوامل؛... ... دایره المعارف فیزیکی
سینتیک شیمیایی- (از جنبش یونانی کینزیس)، بخش شیمی نظری که به مطالعه قوانین شیمی اختصاص دارد. واکنش ها انواع مختلفی از مواد شیمیایی را می توان شناسایی کرد. فعل و انفعالات و اول از همه برای تشخیص واکنش های رخ داده در یک محیط همگن (همگن) از واکنش ها... ... دایره المعارف بزرگ پزشکی
سینتیک شیمیایی- - شاخه ای از شیمی فیزیک که به مطالعه سرعت و مکانیسم واکنش های شیمیایی، الگوهای تغییرات در طول زمان در غلظت اجزای اولیه، میانی و محصولات نهایی واکنش ها که با منحنی های جنبشی توصیف شده اند می پردازد. [اشروف... ... دایره المعارف اصطلاحات، تعاریف و توضیحات مصالح ساختمانی
بخش شیمی فیزیک؛ مطالعه سرعت و مکانیسم واکنش های شیمیایی. سینتیک شیمیایی مبنای علمی برای ایجاد و بهبود فرآیندهای موجود در فناوری شیمیایی است. روش های سینتیک شیمیایی در زیست شناسی و... فرهنگ لغت دایره المعارفی
سینتیک واکنش های شیمیایی، مطالعه فرآیندهای شیمیایی، قوانین وقوع آنها در زمان، سرعت ها و مکانیسم ها. مهم ترین حوزه های شیمی مدرن و علوم شیمی با مطالعات سینتیک واکنش های شیمیایی مرتبط است... ... دایره المعارف بزرگ شوروی
- (از یونانی kinetikos متحرک)، بخش فیزیکی. شیمی، مطالعه شیمی. سهمیه به عنوان فرآیندی که در طول زمان رخ می دهد، مکانیسم این فرآیند، وابستگی آن به شرایط اجرا است. K. x. الگوهای موقت جریان شیمیایی را ایجاد می کند. اقدامات، …… دایره المعارف شیمی
دکترین سرعت ها و مکانیسم ها (کل و توالی مراحل) شیمی. واکنش ها؛ بخش شیمی فیزیک سرعت شیمی واکنش ها در سیستم های بسته با تغییر در غلظت مولکول های اولیه، میانی یا نهایی (مولکول های ... فرهنگ لغت بزرگ دایره المعارفی پلی تکنیک