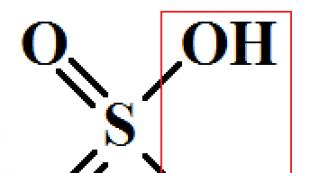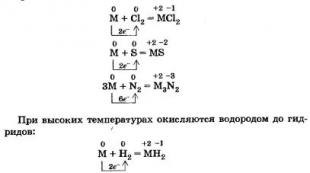Beriliy, magniy, ishqoriy tuproq metallari. Berilliy, magniy va ishqoriy tuproq metallari mos ravishda magniy va kaltsiyning berilliy oksidlari
Darsning maqsadi: Kimyoviy elementlarning mavjudligining umumiy, maxsus va yagona shakllari: atomlar, oddiy moddalar va murakkab moddalar nuqtai nazaridan ishqoriy tuproq metallariga umumiy tavsif berish.
Dars maqsadlari:
Ushbu guruh elementlarining kimyosida vertikal (guruh) bo'ylab PSCEdagi elementlarning xususiyatlarining o'zgarishining asosiy naqshlarini takrorlang.
Asosiy kichik guruhning 2-guruhi elementlari tomonidan hosil qilingan oddiy moddalar va birikmalarning xarakterli xususiyatlarini ko'rib chiqing.
Bu metallar birikmalarining amaliy ahamiyati nimada.
Rivojlantiruvchi o`quv topshiriqlarini qo`llashda o`quvchilarning kimyoviy qobiliyatlarini rivojlantirish.
Umumlashtirish, xulosalar chiqarish qobiliyatini yanada shakllantirish.
Uskunalar va reaktivlar:
kaltsiy, suv, fenolftalein, pinset, pichoq, probirkalar.
Dars rejasi:
1. Tashkiliy moment.
2. Yangi mavzu ustida ishlash.
slayd 3: Beriliy va magniy nima uchun ishqoriy tuproq metallari qatoriga kirmaydi, garchi ular bu metallar bilan bir guruhga kiradi?
Ushbu elementlarning atomlari tashqi energiya darajasida ikkita elektronni o'z ichiga oladi, ular kimyoviy o'zaro ta'sirlar paytida beradilar va shuning uchun eng kuchli qaytaruvchi moddalardir. Barcha birikmalarda ular +2 oksidlanish darajasini ko'rsatadi.
4-slayd: Bu elementlarning atomlari o'lchamiga ko'ra mos keladigan ishqoriy metallar atomlaridan bir muncha kichikroqdir va shu munosabat bilan 2-guruhning asosiy kichik guruhidagi metallar kimyoviy faollik va boshqa xususiyatlar bo'yicha ularga o'xshash bo'lishi kerak.
5-slayd: Talabalar 1-topshiriqni bajaradilar.
6-slayd:Beriliy, magniy va ishqoriy tuproq metallari - oddiy moddalar sifatida.
Beriliy.
7-slayd: Magniy
8-slayd: Kaltsiy
9-slayd: Stronsiy
10-slayd: Bariy
11-slayd: Radiy
12-slayd: Ularning zichligi berilliydan bariygacha ortadi, erish nuqtasi esa, aksincha, pasayadi. Ishqoriy tuproqli metall tuzlarining olov rangi.
13-slayd: Kimyoviy xossalari.
14-slayd: Atmosfera kislorodi bilan metallarning o‘zaro ta’siri.
Ishqoriy tuproq metallari atmosfera kislorodi bilan o'zaro ta'sir qiladi, oksid plyonkasi bilan qoplanadi (bariy, oksid va peroksid aralashmasi bundan mustasno), shuning uchun ular kerosin qatlami ostida yoki muhrlangan ampulalarda saqlanadi.
Slayd 15: Metall bo'lmaganlar bilan o'zaro ta'siri.
Reaksiya odatda qizdirilganda sodir bo'ladi.
Metalllarning suv bilan o'zaro ta'siri.
2-guruhning asosiy kichik guruhidagi barcha metallardan faqat berilliy suv bilan o'zaro ta'sir qilmaydi (uning sirtidagi himoya plyonka bunga to'sqinlik qiladi), magniy u bilan sekin, qolgan metallar esa shiddatli reaksiyaga kirishadi.
Tajribani ko'rsatish: Kaltsiyning suv bilan o'zaro ta'siri.
Reaksiya tenglamasini yozamiz:
Ca + 2 HOH \u003d Ca (OH) 2 + H 2
Söndürülmüş ohak
Ishqoriy metallarning suv bilan o'zaro ta'siri reaktsiyasini eslang.
Ishqoriy tuproq metallari nomining kelib chiqishi ularning gidroksidlari ishqorlar ekanligi va oksidlari refrakterligi bo'yicha ilgari "er" umumiy nomini olgan alyuminiy va temir oksidlariga o'xshashligi bilan bog'liq.
16-slayd: Talabalar 2-sonli vazifani bajaradilar
17-slayd: Beriliy, magniy va ishqoriy yer metallarining birikmalari
Ushbu metallarning oksidlari yuqori haroratga chidamli qattiq, oq, o'tga chidamli moddalardir. Ular amfoter xususiyatga ega berilliydan tashqari asosiy xususiyatlarni namoyon qiladi
Slayd 18: Oksidlarning suv bilan o‘zaro ta’siri.
Magniy oksidi suv bilan reaksiyada faol emas, boshqa barcha oksidlar u bilan juda kuchli o'zaro ta'sir qiladi. Bu sezilarli miqdorda energiya chiqaradi. Shuning uchun kaltsiy oksidining suv bilan reaksiyasi ohak so'ndirilishi, hosil bo'lgan kaltsiy gidroksid esa o'chirilgan ohak deb ataladi. Oksidlar karbonatlarni qovurish orqali olinadi:
CaCO 3 \u003d CaO + CO 2
Tez ohak
MgCO 3 \u003d MgO + CO 2
Magnesiya
19-slayd: gidroksidlarning kislotalar bilan o‘zaro ta’siri.
Ko'pgina gidroksidi tuproqli metallar tuzlari erimaydigan bo'lganligi sababli, neytrallanish reaktsiyasi yog'ingarchilik bilan birga bo'lishi mumkin.
Slayd 20: Tuz.
21-slayd: Talabalar No3, No4, No5 topshiriqlarni bajaradilar.
Kaltsiy, magniy va bariy birikmalarining amaliy ahamiyati.
22-slayd: Kaltsiy karbonat. Yerdagi eng keng tarqalgan birikmalardan biri. Uning tarkibidagi minerallar bo'r, marmar, ohaktosh kabi yaxshi ma'lum.
Bu minerallarning eng muhimi ohaktoshdir. Busiz hech qanday bino tugamaydi. Ohaktosh - sement, so'ndirilgan va so'nmagan ohak, shisha va boshqalar ishlab chiqarish uchun xom ashyo. Tabiiy bo'r - qadimgi hayvonlarning qobiqlari qoldiqlari. Uni ishlatish misollaridan biri siz yaxshi bilasiz maktab bo'ri, tish pastalari. Bo'r qog'oz, kauchuk ishlab chiqarishda, shuningdek, oqlash uchun ishlatiladi. Marmar haykaltaroshlar, me'morlar va kafelchilarning mineralidir.
Slayd 23: "Turgoyakskoye kon boshqarmasi" OAJ
Flyus ohaktosh ishlab chiqaradi. Viloyatdagi eng yirik marmar konlari: Koelginskoye (Yetkulskiy tumani), Balandinskiy (Sosnovskiy tumani), Ufaleyskoye (V. Ufaley tumani).
Slayd 24: Magniy karbonatning amaliy qo'llanilishi.
Slayd 25: Magniy sulfatning amaliy qo'llanilishi.
Slayd 26: Kaltsiy fosfatning amaliy qo‘llanilishi.
Slayd 27: Bariy sulfatning amaliy qo‘llanilishi.
28-slayd: Darsni yakunlash.
Talabalar o'z ishlarini ko'rib chiqish uchun o'qituvchiga topshiradilar. Keyingi darsda natijalarni baholash.
Slayd 29: Uyga vazifa.
Uyga vazifa: 12-band, №3,5,7.
Mavzu bo'yicha topshiriqlar: "Berilliy, magniy va ishqoriy yer metallari"
*****
F.I. talabalar _____________________ sinf _______________
1. * oʻrniga yoki = belgilarini qoʻyib, elementlarning atomlarini solishtiring.
a) yadro zaryadi: Ca * Mg, Be * Ba, Mg * Al, K * Ca
b) elektron qatlamlar soni: Ca * Mg, Be * Ba, Mg * Al
c) tashqi darajadagi elektronlar soni: Ca * Mg, Be * Ba, Mg * Al
d) qaytaruvchi xossalari: Ca * Mg, Be * Ba
2. Reaksiya tenglamalarini qo‘shing, tenglashtiring:
a) Mg + S = ………
b) Be + N 2 = ………..
c) Ca + O 2 = …………
d) Ca + S = ………….
Reaktsiya mahsulotlarini nomlang.
3. Belgilangan ob'ektlarni birlashtiruvchi belgini qo'ying:
a) MgO, CaO, SrO, BaO belgisi ______________________
b) Be 0 Be 2+, Mg 0 Mg 2+, Ca 0 Ca 2+ xususiyati __________________________
c) Ca, Sr, Ba, Ra belgisi ____________________________
a) ha mumkin
b) muammosiz o'tadi
d) umumiy zaharlanish
“Berilliy, magniy va ishqoriy yer metallari” mavzusidagi topshiriqlar.
***
F. Va talabalar ____________________ sinf _______
1. Gaplarning qaysi birinoto'g'ri:
a) gidroksidi tuproqli metallarga berilliy va magniy kirmaydi
b) qaytaruvchi xossalar berilliyda ko'proq namoyon bo'ladi, chunki atom yadrosining zaryadi asosiy kichik guruhning 2-guruhining boshqa elementlariga qaraganda eng kichikdir.
v) ishqoriy tuproq metallari kalsiy, stronsiy, bariy, radiy
2. Reaksiya tenglamalariga moddalarning etishmayotgan formulalarini kiriting. Reaktsiya mahsulotlarini nomlang:
a) Ca + .... = CaS
b) ….+ C l 2 = Mg C l 2
c) + ... .. \u003d 3 N 2 bo'ling
Hisobni tenglashtirishni unutmang!
Moddaning nomi raqamini formulaning tegishli harfi bilan moslang:
Söndürülmüş ohak
bariy xlorid
Tez ohak
Magnesiya
kaltsiy sulfid
4. Tajriba uchun ishqoriy tuproq bo'laklarini qo'l bilan olish mumkinmi?
a) ha mumkin
b) yo'q, bu metallar qo'l terisiga suv bilan ta'sir qiladi, bu kuyishga olib kelishi mumkin
c) yo'q, chunki bu gigienik emas, metall ifloslanishi mumkin
d) yo'q, chunki gidroksidi tuproq metallari past erish nuqtasiga ega va qo'lda erishi mumkin
5. Kaltsiy oksidining suvda erishi quyidagilar bilan birga kechishi mumkin:
a) aralashmaning qaynashi va chayqalishi
b) muammosiz o'tadi
c) yuqori nafas yo'llarining tirnash xususiyati
d) umumiy zaharlanish
Vazifa ***** - "kuchli talabalar" uchun
*** - "zaif" talabalar uchun
Ish 2 kishidan iborat guruhlarda kutilmoqda.
Darsning texnologik xaritasi
"Berilliy, magniy va ishqoriy tuproq metallari".
| Mavzu, sinf | Kimyo, 9-sinf |
| Dars mavzusi | Beriliy, magniy va ishqoriy tuproq metallari. |
| AKT vositalaridan foydalanishning dolzarbligi | Taqdimotdan foydalanish imkonini beradi Materialning ko'rinishi, ochiqligi va tizimli taqdimoti tamoyillarini amalga oshirish. Axborot-tafakkur faoliyati ko`nikma va malakalari shakllanadi. |
| Darsning maqsadi | Kimyoviy elementlarning mavjudligining umumiy, maxsus va yagona shakllari: atomlar, oddiy moddalar va murakkab moddalar nuqtai nazaridan ishqoriy tuproq metallariga umumiy tavsif berish. |
| Dars maqsadlari | Darslar: 1. Ushbu guruh elementlarining kimyosi bo'yicha, vertikal (guruh) bo'ylab PSCEda elementlarning xossalari o'zgarishining asosiy qonuniyatlarini takrorlang. 2. Asosiy kichik guruhning 2-guruh elementlari tomonidan hosil qilingan oddiy moddalar va birikmalarning xarakterli xususiyatlarini ko'rib chiqing. Tarbiyaviy : Rivojlantiruvchi o`quv topshiriqlarini qo`llashda o`quvchilarning kimyoviy qobiliyatlarini rivojlantirish. Tarbiyaviy:
Ishqoriy tuproq metallari, magniy birikmalarining amaliy ahamiyati haqida tuyg'ularni tarbiyalash. |
| Kerakli apparat ta'minoti | Kimyo o'qituvchisining ish joyi, multimedia proyektori, ekrani.MS PowerPoint. |
| O`qitish usullari - olingan bilim manbasiga ko`ra - og`zaki, ko`rgazmali, amaliy, muammoli-izlanish; didaktik maqsadlarda - yangilash, yangi materialni o'rganish. Fanlararo aloqalar - biologiya, o`lkashunoslik. Darsning tashkiliy tuzilishi
|
|
| 1-bosqich | Tashkiliy vaqt |
| Bosqich davomiyligi | 2 daqiqa |
| Maqsad | Talabalarni sinfda ishlashga undash. |
| Talabalar faoliyatini tashkil etish shakli | Darsga tayyorgarlikni tekshirish, o'qituvchi bilan salomlashish. |
| | Talabalar bilan salomlashish, dars mavzusi va maqsadlarini etkazish. |
| 2-bosqich | Yangi bilimlarni shakllantirish |
| Bosqich davomiyligi | 3 daqiqa |
| Maqsad | Nima uchun berilliy, magniy gidroksidi tuproq metallari bilan bir kichik guruhga kiradi, garchi ular ularga tegishli bo'lmasa-da; ular atomlar tuzilishining qanday xususiyatlariga ega; |
| | Frontal |
| | xabardor qilish |
| O'qituvchining asosiy faoliyati | |
| Talabalar faoliyati | |
| 3-bosqich | |
| Bosqich davomiyligi | 5 daqiqa |
| Maqsad | Yangi bilimlarni mustahkamlash. |
| Talabalarning o'quv faoliyatini tashkil etish shakli | Guruh. |
| Ushbu bosqichda o'qituvchining vazifasi | Nazorat qilish. |
| O'qituvchining asosiy faoliyati | |
| Talabalar faoliyati | Karta ishi. |
| 4-bosqich | Yangi bilimlarni shakllantirish. |
| Bosqich davomiyligi | 5 daqiqa. |
| Maqsad | Oddiy moddalar nima ekanligini aniqlang - berilliy, magniy, kaltsiy, stronsiy, bariy, radiy. Zichlik va erish temperaturalarining o'zgarishi qonuniyatlarini aniqlang va unga ushbu elementlarning tuzlari qo'shilganda olov rangining xususiyatlarini aniqlang. Ushbu oddiy moddalarning kimyoviy xossalarini bilib oling. |
| Talabalarning o'quv faoliyatini tashkil etish shakli | Frontal |
| Ushbu bosqichda o'qituvchining vazifasi | Hikoya, suhbat, taqdimot namoyishi. |
| O'qituvchining asosiy faoliyati | Ma'lumot beruvchi. |
| Talabalar faoliyati | Daftarda ishlash, asosiy tushunchalarni yozib olish. |
| 5-bosqich | Guruhlarda differensial ishlash. |
| Bosqich davomiyligi | 5 daqiqa |
| Maqsad | Yangi bilimlarni mustahkamlash. |
| Talabalarning o'quv faoliyatini tashkil etish shakli | Guruh. |
| Ushbu bosqichda o'qituvchining vazifasi | Nazorat qilish. |
| O'qituvchining asosiy faoliyati | Shaxsiy nazoratni ta'minlaydi. |
| Talabalar faoliyati | Karta ishi. |
| 6-bosqich | Yangi bilimlarni shakllantirish. |
| Bosqich davomiyligi | 10 daqiqa |
| Maqsad | Bu metallarning qanday birikmalar ekanligini aniqlang: oksidlar, asoslar, tuzlar; ularning kimyoviy xossalarining xususiyatlari. |
| Talabalarning o'quv faoliyatini tashkil etish shakli | Frontal. |
| Ushbu bosqichda o'qituvchining vazifasi | Ma'lumot beruvchi. |
| O'qituvchining asosiy faoliyati | Hikoya, suhbat, taqdimot namoyishi. |
| Talabalar faoliyati | Daftarda ishlash, asosiy tushunchalarni yozib olish. |
| 7-bosqich | Guruhlarda differensial ishlash. |
| Bosqich davomiyligi | 5 daqiqa. |
| Maqsad | Yangi bilimlarni mustahkamlash. |
| Talabalarning o'quv faoliyatini tashkil etish shakli | Guruh. |
| Ushbu bosqichda o'qituvchining vazifasi | Nazorat qilish. |
| O'qituvchining asosiy faoliyati | Shaxsiy nazoratni ta'minlaydi. |
| Talabalar faoliyati | Karta ishi. |
| 8-bosqich | Yangi bilimlarni shakllantirish |
| Bosqich davomiyligi | 5 daqiqa |
| Maqsad | Magniy tuzlari va gidroksidi tuproq metallarining amaliy qo'llanilishi bilan tanishish uchun Miass shahri misolida kaltsiy birikmasidan (Berezovskiy kareri) foydalanishni ko'rib chiqing. |
| Talabalarning o'quv faoliyatini tashkil etish shakli | Frontal. |
| Ushbu bosqichda o'qituvchining vazifasi | Hikoya, suhbat, taqdimot namoyishi. |
| O'qituvchining asosiy faoliyati | Ma'lumot beruvchi. |
| Talabalar faoliyati | Daftarda ishlash, asosiy tushunchalarni yozib olish. |
| 9-bosqich | Yakuniy qism |
| Bosqich davomiyligi | 5 daqiqa |
| Maqsad | Xulosa: darsning maqsad va vazifalariga erishish muvaffaqiyatini tahlil qilish va baholash. |
| Talabalarning o'quv faoliyatini tashkil etish shakli | Frontal. |
| Ushbu bosqichda o'qituvchining vazifasi | Axborot berish: keyingi darsda differensiyalangan topshiriqlar ishi natijalari haqida hisobot berish. |
| O'qituvchining asosiy faoliyati | Maqsadlarga erishish to'g'risida hisobot, dars samaradorligini tahlil qilish, uy vazifasi bo'yicha ko'rsatmalar. |
| Talabalar faoliyati | Uy vazifasini yozib olish. |
Adabiyotlar ro'yxati
Gabrielyan O. S. “Kimyo. 9-sinf "M .: Bustard 2009 yil.
Dendeber S.V., Klyuchnikova O.V. "Kimyoni o'qitish jarayonida zamonaviy texnologiyalar" M .: Bilimlar uchun OOO 5, 2008 yil.
Denisova V.G. “Magistr bu kimyo oʻqituvchisining sinfidir. 8-11 sinflar "M.: Globus, 2010
Ishqoriy yer metallariga D.I davriy sistemasining IIA guruhi metallari kiradi. Mendeleyev - kaltsiy (Ca), stronsiy (Sr), bariy (Ba) va radiy (Ra). Ulardan tashqari II guruhning asosiy kichik guruhiga berilliy (Be) va magniy (Mg) kiradi. Ishqoriy tuproq metallarining tashqi energiya darajasi ikkita valent elektronga ega. Ishqoriy tuproq metallarining tashqi energiya darajasining elektron konfiguratsiyasi ns 2 ga teng. Ularning birikmalarida ular +2 ga teng bo'lgan yagona oksidlanish darajasini ko'rsatadilar. OVRda ular kamaytirish agentlari, ya'ni. elektronni bering.
Ishqoriy tuproq metallar guruhiga kiruvchi elementlar atomlari yadrosi zaryadining ortishi bilan atomlarning ionlanish energiyasi kamayadi, atom va ionlarning radiuslari ortib boradi, kimyoviy elementlarning metall xususiyatlari ortadi.
Ishqoriy tuproq metallarining fizik xossalari
Erkin holatda Be - zich olti burchakli kristall panjarali po'lat-kulrang metall, ancha qattiq va mo'rt. Havoda Be oksidli plyonka bilan qoplangan, bu unga mat rang beradi va kimyoviy faolligini pasaytiradi.
Oddiy modda ko'rinishidagi magniy oq metall bo'lib, u Be kabi, oksidli plyonka hosil bo'lishi tufayli havo ta'sirida mat rangga ega bo'ladi. Mg berilliyga qaraganda yumshoqroq va egiluvchanroqdir. Mg ning kristall panjarasi olti burchakli.
Erkin Ca, Ba va Sr kumush-oq metallardir. Havoga ta'sir qilganda, ular bir zumda sarg'ish plyonka bilan qoplanadi, bu ularning havoning tarkibiy qismlari bilan o'zaro ta'siridan hosil bo'ladi. Kaltsiy ancha qattiq metall, Ba va Sr yumshoqroq.
Ca va Sr kubik yuz markazli kristall panjaraga ega, bariy kubik tana markazli kristall panjaraga ega.
Barcha gidroksidi tuproq metallari yuqori issiqlik va elektr o'tkazuvchanligini keltirib chiqaradigan kimyoviy bog'lanishning metall turi mavjudligi bilan tavsiflanadi. Ishqoriy tuproq metallarining qaynash va erish nuqtalari ishqoriy metallarga qaraganda yuqori.
Ishqoriy tuproq metallarini olish
Getting Be uning ftoridini kamaytirish reaksiyasi orqali amalga oshiriladi. Reaksiya qizdirilganda davom etadi:
BeF 2 + Mg = Be + MgF 2
Magniy, kaltsiy va stronsiy eritilgan tuzlarni, ko'pincha xloridlarni elektroliz qilish orqali olinadi:
CaCl 2 \u003d Ca + Cl 2
Bundan tashqari, Mg dixlorid eritmasini elektroliz qilish orqali olinganda, erish haroratini pasaytirish uchun reaktsiya aralashmasiga NaCl qo'shiladi.
Sanoatda Mg olish uchun metall va uglerod-termik usullar qo'llaniladi:
2(CaO×MgO) (dolomit) + Si = Ca 2 SiO 4 + Mg
Ba ni olishning asosiy usuli - oksidni kamaytirish:
3BaO + 2Al = 3Ba + Al 2 O 3
Ishqoriy tuproq metallarining kimyoviy xossalari
n.a.dan beri. Be va Mg yuzasi oksidli plyonka bilan qoplangan - bu metallar suvga nisbatan inertdir. Ca, Sr va Ba suvda eriydi va kuchli asosiy xususiyatga ega gidroksidlarni hosil qiladi:
Ba + H 2 O \u003d Ba (OH) 2 + H 2
Ishqoriy tuproq metallari kislorod bilan reaksiyaga kirisha oladi va ularning barchasi, bariydan tashqari, bu o'zaro ta'sir natijasida oksidlar hosil qiladi, bariy - peroksid:
2Ca + O 2 \u003d 2CaO
Ba + O 2 \u003d BaO 2
Ishqoriy tuproq metallarining oksidlari, berilliydan tashqari, asosiy xossalarini, Be - amfoter xususiyatlarini namoyon qiladi.
Ishqoriy tuproq metallari qizdirilganda metall bo'lmaganlar (galogenlar, oltingugurt, azot va boshqalar) bilan ta'sir o'tkazishga qodir:
Mg + Br 2 \u003d 2MgBr
3Sr + N 2 \u003d Sr 3 N 2
2Mg + 2C \u003d Mg 2 C 2
2Ba + 2P = Ba 3 P 2
Ba + H 2 = BaH 2
Ishqoriy tuproq metallari kislotalar bilan reaksiyaga kirishadi - ularda eriydi:
Ca + 2HCl \u003d CaCl 2 + H 2
Mg + H 2 SO 4 \u003d MgSO 4 + H 2
Beriliy ishqorlarning suvli eritmalari bilan reaksiyaga kirishadi - ularda eriydi:
Be + 2NaOH + 2H 2 O \u003d Na 2 + H 2
Sifatli reaksiyalar
Ishqoriy tuproq metallariga sifatli reaktsiya olovni ularning kationlari bilan bo'yashdir: Ca 2+ olovni quyuq to'q sariq rangga, Sr 2+ to'q qizil, Ba 2+ och yashil rangga bo'yadi.
Bariy kationi Ba 2+ ga sifatli reaksiya SO 4 2- anionlar bo'lib, noorganik kislotalarda erimaydigan bariy sulfatning oq cho'kmasi (BaSO 4) hosil bo'ladi.
Ba 2+ + SO 4 2- \u003d BaSO 4 ↓
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Bir qator o'zgarishlarni amalga oshiring: Ca → CaO → Ca (OH) 2 → Ca (NO 3) 2 |
| Yechim | 2Ca + O 2 → 2CaO CaO + H 2 O→Ca(OH) 2 Ca(OH) 2 + 2HNO 3 → Ca(NO 3) 2 + 2H 2 O |
Ushbu elementlarning atomlari tashqi energiya darajasida ikkita elektronni o'z ichiga oladi, ular kimyoviy o'zaro ta'sirlar paytida beradilar va shuning uchun eng kuchli qaytaruvchi moddalardir. Barcha birikmalarda ular +2 oksidlanish darajasiga ega. Kichkina guruhda seriya raqamining yuqoridan pastgacha o'sishi bilan elementlarning kamaytiruvchi xususiyatlari kuchayadi, bu ularning atomlari radiuslarining oshishi bilan bog'liq.
Radiy- radioaktiv element, uning tabiatdagi tarkibi kichik.
Beriliy, magniy va ishqoriy tuproq metallari oddiy moddalardir. Yengil kumush-oq metallar, stronsiy oltin rangga ega. Bu gidroksidi metallarga qaraganda ancha qattiqroq, bariy esa yumshoqligi bo'yicha qo'rg'oshinga o'xshaydi.
Oddiy haroratda havoda berilliy va magniy yuzasi himoya oksidi plyonkasi bilan qoplangan. Ishqoriy tuproq metallari atmosfera kislorodi bilan faolroq o'zaro ta'sir qiladi, shuning uchun ular kerosin qatlami ostida yoki gidroksidi metallar kabi muhrlangan idishlarda saqlanadi.
Havoda qizdirilganda, ko'rib chiqilayotgan barcha metallar oksidlarni hosil qilish uchun kuchli yonadi. Reaksiya tenglamalarini yozish uchun M metallarning umumiy belgilaridan ham foydalanamiz:
Magniyning yonish reaktsiyasi ko'r-ko'rona chaqnash bilan birga keladi, u ilgari qorong'i xonalarda ob'ektlarni suratga olishda ishlatilgan. Hozirda elektr chirog'idan foydalanilmoqda.
Beriliy, magniy va barcha gidroksidi tuproq metallari metall bo'lmaganlar - xlor, oltingugurt, azot va boshqalar bilan qizdirilganda o'zaro ta'sir qiladi va mos ravishda xloridlar, sulfidlar, nitridlar hosil qiladi:

II guruhning asosiy kichik guruhidagi barcha metallardan faqat berilliy amalda suv bilan o'zaro ta'sir qilmaydi (uning sirtidagi himoya plyonka bunga to'sqinlik qiladi), magniy u bilan sekin reaksiyaga kirishadi, qolgan metallar normal sharoitda suv bilan kuchli o'zaro ta'sir qiladi: 
Alyuminiy kabi magniy va kaltsiy noyob metallarni - niobiy, tantal, molibden, volfram, titan va boshqalarni oksidlaridan kamaytirishga qodir.
Metalllarni olishning bunday usullari, aluminotermiyaga o'xshab, magniytermiya va kaltsiytermiya deb ataladi.
Magniy va kaltsiy nodir metallar va engil qotishmalar ishlab chiqarish uchun ishlatiladi. Masalan, magniy duraluminning bir qismidir, kaltsiy esa podshipniklar va simi qoplamalarini ishlab chiqarish uchun zarur bo'lgan qo'rg'oshin qotishmalarining tarkibiy qismlaridan biridir.
Beriliy, magniy va ishqoriy yer metallarining birikmalari. Tabiatda gidroksidi metallar kabi ishqoriy tuproq metallari yuqori kimyoviy faolligi tufayli faqat birikmalar holida uchraydi.
MO oksidlari yuqori haroratga chidamli qattiq oq o'tga chidamli moddalardir.
Ular amfoter xususiyatga ega bo'lgan berilliy oksidi bundan mustasno, asosiy xususiyatlarni namoyon qiladi.
Magniy oksidi suv bilan reaksiyada faol emas, boshqa barcha oksidlar u bilan juda kuchli o'zaro ta'sir qiladi:
MO + H20 \u003d M (OH) 2
Oksidlar karbonatlarni qovurish orqali olinadi: MC03 \u003d MO + CO2
Muhandislikda kaltsiy oksidi CaO sönmemiş ohak, MgO esa kuygan magneziya deb ataladi. Bu oksidlarning ikkalasi ham qurilish materiallari ishlab chiqarishda ishlatiladi.
Ishqoriy tuproq metallarining gidroksidlari ishqorlardir. Ularning suvda eruvchanligi Ca(OH)2 dan Ba(OH)2 gacha ortadi. Bu gidroksidlar mos keladigan oksidni suv bilan reaksiyaga kiritish orqali olinadi.
Dars mazmuni dars xulosasi qo'llab-quvvatlash ramka dars taqdimoti tezlashtirish usullari interaktiv texnologiyalar Amaliyot topshiriq va mashqlar o'z-o'zini tekshirish seminarlar, treninglar, keyslar, kvestlar uy vazifalarini muhokama qilish savollari talabalar tomonidan ritorik savollar Tasvirlar audio, videokliplar va multimedia fotosuratlar, rasmlar grafikasi, jadvallar, sxemalar hazil, latifalar, hazillar, komikslar, maqollar, krossvordlar, iqtiboslar Qo'shimchalar tezislar maqolalar, qiziquvchan varaqlar uchun chiplar darsliklar, asosiy va qo'shimcha atamalarning lug'ati Darslik va darslarni takomillashtirishdarslikdagi xatolarni tuzatish darslikdagi parchani yangilash darsdagi innovatsiya elementlari eskirgan bilimlarni yangilari bilan almashtirish Faqat o'qituvchilar uchun mukammal darslar yil uchun kalendar rejasi muhokama dasturining uslubiy tavsiyalari Integratsiyalashgan darslarOilaga ishqoriy tuproq elementlari kaltsiy, stronsiy, bariy va radiyni o'z ichiga oladi. D. I. Mendeleyev bu oilaga magniyni kiritgan. Ishqoriy tuproq elementlari gidroksidlari ishqoriy metallar gidroksidlari kabi suvda yaxshi eriydi, ya'ni ishqorlar bo'lganligi sababli shunday nomlangan. Mendeleyev “Kimyo asoslari” asarida “... Ular tuproqli deb ataladi, chunki tabiatda ular yerning erimaydigan massasini hosil qiluvchi birikmalar holatida bo‘ladi va o‘zlari RO oksidi holida tuproqsimon ko‘rinishga ega bo‘ladi”, deb tushuntiradi. .
IIa guruh elementlarining umumiy tavsifi

II guruhning asosiy kichik guruhidagi metallar ns² tashqi energiya darajasining elektron konfiguratsiyasiga ega va s-elementlardir.
Ikki valentlik elektronni osongina bering va barcha birikmalarda ular +2 oksidlanish darajasiga ega
Kuchli kamaytiruvchi vositalar
Metalllarning faolligi va ularning qaytarilish qobiliyati qatorda ortadi: Be–Mg–Ca–Sr–Ba
Ishqoriy tuproq metallari tarkibiga faqat kaltsiy, stronsiy, bariy va radiy, kamroq magniy kiradi.
Beriliy ko'pchilik xususiyatlarida alyuminiyga yaqinroq.
Oddiy moddalarning fizik xossalari
Ishqoriy tuproq metallari (ishqoriy metallarga nisbatan) yuqori t°pl ga ega. va t ° qaynash., ionlanish potentsiallari, zichlik va qattiqlik.
Ishqoriy tuproq metallarining kimyoviy xossalari + Be
1. Suv bilan reaksiyasi.
Oddiy sharoitlarda Be va Mg ning yuzasi inert oksidli plyonka bilan qoplangan, shuning uchun ular suvga chidamli. Bundan farqli o'laroq, Ca, Sr va Ba gidroksidi hosil bo'lishi bilan suvda eriydi:
Mg + 2H 2 O - t ° → Mg (OH) 2 + H 2
Ca + 2H 2 O → Ca (OH) 2 + H 2
2. Kislorod bilan reaksiyasi.
Barcha metallar oksidi RO, bariy peroksid - BaO 2 hosil qiladi:
2Mg + O 2 → 2MgO
Ba + O 2 → BaO 2
3. Boshqa nometalllar bilan ikkilik birikmalar hosil qiling:
Be + Cl 2 → BeCl 2 (galogenidlar)
Ba + S → BaS (sulfidlar)
3Mg + N 2 → Mg 3 N 2 (nitridlar)
Ca + H 2 → CaH 2 (gidridlar)
Ca + 2C → CaC 2 (karbidlar)
3Ba + 2P → Ba 3 P 2 (fosfidlar)
Beriliy va magniy nometallar bilan nisbatan sekin reaksiyaga kirishadi.
4. Hamma ishqoriy tuproq metallari kislotalarda eriydi:
Ca + 2HCl → CaCl 2 + H 2
Mg + H 2 SO 4 (dec.) → MgSO 4 + H 2
5. Beriliy ishqorlarning suvli eritmalarida eriydi:
Be + 2NaOH + 2H 2 O → Na 2 + H 2
6. Ishqoriy tuproq metallarining uchuvchi birikmalari alangaga xos rang beradi:
kaltsiy birikmalari - g'isht qizil, stronsiy - karmin qizil va bor - sarg'ish yashil.

 Beriliy, litiy kabi, s-elementdir. Be atomida paydo bo'lgan to'rtinchi elektron 2s orbitaliga joylashtirilgan. Beriliyning ionlanish energiyasi yadro zaryadining kattaligi tufayli litiynikidan yuqori. Kuchli asoslarda u BeO 2-2 berillat ionini hosil qiladi. Shuning uchun berilliy metalldir, lekin uning birikmalari amfoterdir. Berilliy, garchi metall bo'lsa-da, litiyga qaraganda kamroq elektropozitivdir.
Beriliy, litiy kabi, s-elementdir. Be atomida paydo bo'lgan to'rtinchi elektron 2s orbitaliga joylashtirilgan. Beriliyning ionlanish energiyasi yadro zaryadining kattaligi tufayli litiynikidan yuqori. Kuchli asoslarda u BeO 2-2 berillat ionini hosil qiladi. Shuning uchun berilliy metalldir, lekin uning birikmalari amfoterdir. Berilliy, garchi metall bo'lsa-da, litiyga qaraganda kamroq elektropozitivdir.
Beriliy atomining yuqori ionlanish energiyasi PA kichik guruhining boshqa elementlaridan (magniy va ishqoriy tuproq metallari) sezilarli darajada farq qiladi. Uning kimyosi asosan alyuminiyga o'xshaydi (diagonal o'xshashlik). Shunday qilib, bu uning birikmalarida amfoter fazilatlarga ega bo'lgan element bo'lib, ular orasida asosiylari hali ham ustunlik qiladi.
Mg ning elektron konfiguratsiyasi: 1s 2 2s 2 2p 6 3s 2 natriyga nisbatan bitta muhim xususiyatga ega: o'n ikkinchi elektron 2s orbitaliga joylashtirilgan, bu erda allaqachon 1e - .
Magniy va kaltsiy ionlari har qanday hujayraning hayotiy faoliyatining ajralmas elementlari hisoblanadi. Ularning tanadagi nisbati qat'iy belgilanishi kerak. Magniy ionlari fermentlar faoliyatida (masalan, karboksilaza), kaltsiy - skeletning qurilishida va metabolizmda ishtirok etadi. Kaltsiy miqdorini oshirish oziq-ovqatning so'rilishini yaxshilaydi. Kaltsiy yurak faoliyatini qo'zg'atadi va tartibga soladi. Uning ortiqcha bo'lishi yurak faoliyatini keskin oshiradi. Magniy kaltsiy antagonisti rolining bir qismini o'ynaydi. Mg 2+ ionlarining teri ostiga kiritilishi hayajonlanish davrisiz behushlik, mushaklar, nervlar va yurakning falajlanishiga olib keladi. Yaraga metall shaklida kirib, uzoq muddatli shifo bermaydigan yiringli jarayonlarni keltirib chiqaradi. O'pkadagi magniy oksidi quyma isitmasi deb ataladigan holatga olib keladi. Teri yuzasining birikmalari bilan tez-tez aloqa qilish dermatitga olib keladi. Tibbiyotda eng ko'p ishlatiladigan kaltsiy tuzlari CaSO 4 sulfat va CaCL 2 xloriddir. Birinchisi gips uchun ishlatiladi, ikkinchisi esa tomir ichiga infuziyalar uchun va ichki vosita sifatida ishlatiladi. Bu shish, yallig'lanish, allergiya bilan kurashishga yordam beradi, yurak-qon tomir tizimining spazmlarini yo'qotadi va qon ivishini yaxshilaydi.
BaSO 4 dan tashqari barcha bariy birikmalari zaharli hisoblanadi. Serebellumning shikastlanishi, silliq yurak mushaklarining shikastlanishi, falaj va katta dozalarda - jigarda degenerativ o'zgarishlar bilan mengoensefalitga sabab bo'ladi. Kichik dozalarda bariy birikmalari suyak iligi faoliyatini rag'batlantiradi.
Stronsiy birikmalari oshqozonga kiritilganda uning buzilishi, falaj va qusish paydo bo'ladi; lezyonlar belgilari bo'yicha bariy tuzlari shikastlanishiga o'xshaydi, ammo stronsiy tuzlari kamroq zaharli. Stronsiy 90 Sr radioaktiv izotopining tanasida paydo bo'lishi alohida tashvish uyg'otadi. U tanadan juda sekin chiqariladi va uning uzoq yarimparchalanish davri va shuning uchun ta'sir qilish muddati nurlanish kasalligini keltirib chiqarishi mumkin.
Radiy o'zining nurlanishi va ulkan yarimparchalanish davri (T 1/2 = 1617 yil) bilan organizm uchun xavflidir. Dastlab, radiy tuzlari ko'p yoki kamroq sof shaklda topilgan va ishlab chiqarilgandan so'ng, u floroskopiya, o'smalarni davolash va ba'zi jiddiy kasalliklar uchun juda keng qo'llanila boshlandi. Endi, boshqa qulayroq va arzonroq materiallar paydo bo'lishi bilan, radiyni tibbiyotda qo'llash deyarli to'xtatildi. Ba'zi hollarda u radon ishlab chiqarish uchun va mineral o'g'itlarga qo'shimcha sifatida ishlatiladi.
4s orbitalni to'ldirish kaltsiy atomida tugaydi. Kaliy bilan birgalikda to'rtinchi davrning bir juft s-elementini hosil qiladi. Kaltsiy gidroksidi juda kuchli asosdir. Kaltsiyda - barcha gidroksidi tuproq metallarining eng kam faolligi - birikmalardagi bog'lanishning tabiati iondir.
O'zining xususiyatlariga ko'ra, stronsiy kaltsiy va bariy o'rtasida oraliq pozitsiyani egallaydi.
Bariyning xossalari ishqoriy metallarnikiga eng yaqin.
Beriliy va magniy qotishmalarda keng qo'llaniladi. Beriliy bronzalari - 0,5-3% berilliy bo'lgan elastik mis qotishmalari; aviatsiya qotishmalari (zichligi 1,8) 85-90% magniyni ("elektron") o'z ichiga oladi. Berilliy IIA guruhidagi boshqa metallardan farq qiladi - u vodorod va suv bilan reaksiyaga kirishmaydi, lekin ishqorlarda eriydi, chunki u amfoter gidroksid hosil qiladi:
Be + H 2 O + 2NaOH \u003d Na 2 + H 2.
Magniy azot bilan faol reaksiyaga kirishadi:
3 Mg + N 2 \u003d Mg 3 N 2.
Jadvalda II guruh elementlari gidroksidlarining eruvchanligi ko'rsatilgan.
An'anaviy texnik muammo - suvning qattiqligi tarkibida Mg 2+ va Ca 2+ ionlarining mavjudligi bilan bog'liq. Magniy va kaltsiy karbonatlari va kaltsiy sulfatlari bikarbonatlar va sulfatlardan issiq suv bilan isitish qozonlari va quvurlarning devorlariga yotqiziladi. Ular, ayniqsa, laboratoriya distillyatorlarining ishiga xalaqit beradi.
Tirik organizmdagi S-elementlar muhim biologik funktsiyani bajaradi. Jadvalda ularning mazmuni ko'rsatilgan.
Hujayradan tashqari suyuqlikda hujayra ichidagiga qaraganda 5 barobar ko'proq natriy ionlari mavjud. Izotonik eritma ("fiziologik suyuqlik") 0,9% natriy xloridni o'z ichiga oladi, u in'ektsiya, yaralarni va ko'zlarni yuvish uchun ishlatiladi va hokazo. Gipertonik eritmalar (3-10% natriy xlorid) yiringli yaralarni davolashda losonlar sifatida ishlatiladi ("cho'zish"). » yiring). Tanadagi kaliy ionlarining 98% hujayralar ichida va faqat 2% hujayradan tashqari suyuqlikda. Bir kishi kuniga 2,5-5 g kaliyga muhtoj. 100 g quritilgan o'rikda 2 g gacha kaliy mavjud. 100 g qovurilgan kartoshkada - 0,5 g gacha kaliy. Hujayra ichidagi fermentativ reaksiyalarda ATP va ADP magniy komplekslari shaklida ishtirok etadi.
Har kuni odamga 300-400 mg magniy kerak. U tanaga non (100 g nonga 90 mg magniy), don (100 g jo'xori unida 115 mg magniygacha), yong'oq (100 g yong'oq uchun 230 mg magniygacha) bilan kiradi. Gidroksilapatit Ca 10 (PO 4) 6 (OH) 2 asosida suyak va tishlarni qurishdan tashqari, kaltsiy kationlari qon ivishida, nerv impulslarini uzatishda va mushaklarning qisqarishida faol ishtirok etadi. Kattalar kuniga taxminan 1 g kaltsiy iste'mol qilishlari kerak. 100 g qattiq pishloqlar 750 mg kaltsiyni o'z ichiga oladi; 100 g sutda - 120 mg kaltsiy; 100 g karamda - 50 mg gacha.

II GURUH METALLARI İŞQORLI YER METALLARI, MAGNIY VA BERILLIY IIA guruhning hamma elementlari ham tuproq ishqoriy emas, balki faqat kaltsiydan boshlanib, guruhdan pastda joylashgan. Ushbu elementlarning oksidlari ("yerlar" - eski terminologiyada) bilan o'zaro ta'sir qiladi
 ATOMLARNING PSCEDAGI O'RNI VA R atomining Tuzilishi Metall Qaytarilish xossalarini oshiradi Ishqoriy tuproq metallar Asosiy xarakter (Be - amfoterdan tashqari) Yuqori gidroksidning yuqori oksidi formulasi …ns 2 s. O. +2 RO R(OH)
ATOMLARNING PSCEDAGI O'RNI VA R atomining Tuzilishi Metall Qaytarilish xossalarini oshiradi Ishqoriy tuproq metallar Asosiy xarakter (Be - amfoterdan tashqari) Yuqori gidroksidning yuqori oksidi formulasi …ns 2 s. O. +2 RO R(OH)
 UMUMIY XUSUSIYATLAR Be Mg Ca Sr Ba Ra Atomning radiusi va yadro zaryadining ortishi Maksimal daraja Metallik va oksidlanishning qaytarilishi +2 Ishqoriy tuproq metallari Asosiy sv-va Oksidlar va gidroksidlar uv-Xia. Tabiatda faqat birikmalar holida uchraydigan reaktiv metallar 2 Ular suv bilan o'zaro ta'sirlashib, ishqorlar hosil qiladi. nS
UMUMIY XUSUSIYATLAR Be Mg Ca Sr Ba Ra Atomning radiusi va yadro zaryadining ortishi Maksimal daraja Metallik va oksidlanishning qaytarilishi +2 Ishqoriy tuproq metallari Asosiy sv-va Oksidlar va gidroksidlar uv-Xia. Tabiatda faqat birikmalar holida uchraydigan reaktiv metallar 2 Ular suv bilan o'zaro ta'sirlashib, ishqorlar hosil qiladi. nS

 MAGNIY, BERILLIY VA İŞQORLI YER METALLARINING Jismoniy xossalari kumush-oq moddalar. egiluvchan va plastik, ancha yumshoq, garchi ishqoriylarga qaraganda qattiqroq. Beriliy o'zining sezilarli qattiqligi bilan ajralib turadi va asosan pichoq bilan kesilmaydi (istisno - stronsiy). va mo'rtlik, o'tkir zarba bilan bariy yoriqlari. Metall kristall panjara ularning yuqori issiqlik va elektr o'tkazuvchanligiga sabab bo'ladi. Metalllarning erish va qaynash nuqtalari ishqoriy metallarga qaraganda yuqori. Beriliy va magniy kuchli oksidli plyonka bilan qoplangan va havoda o'zgarmaydi. Ishqoriy tuproq metallari juda faol, ular muhrlangan ampulalarda, vazelin moyi qatlami ostida yoki
MAGNIY, BERILLIY VA İŞQORLI YER METALLARINING Jismoniy xossalari kumush-oq moddalar. egiluvchan va plastik, ancha yumshoq, garchi ishqoriylarga qaraganda qattiqroq. Beriliy o'zining sezilarli qattiqligi bilan ajralib turadi va asosan pichoq bilan kesilmaydi (istisno - stronsiy). va mo'rtlik, o'tkir zarba bilan bariy yoriqlari. Metall kristall panjara ularning yuqori issiqlik va elektr o'tkazuvchanligiga sabab bo'ladi. Metalllarning erish va qaynash nuqtalari ishqoriy metallarga qaraganda yuqori. Beriliy va magniy kuchli oksidli plyonka bilan qoplangan va havoda o'zgarmaydi. Ishqoriy tuproq metallari juda faol, ular muhrlangan ampulalarda, vazelin moyi qatlami ostida yoki
 Metalllarning fizik xossalari II A guruh zichligi Terish 1285 850 651 1. 85 770 710 960 3. 76 2. 63 1. 74 Be 6 1. 54 Mg Ca Sr Ba Ra
Metalllarning fizik xossalari II A guruh zichligi Terish 1285 850 651 1. 85 770 710 960 3. 76 2. 63 1. 74 Be 6 1. 54 Mg Ca Sr Ba Ra
 th va Mg ning Yumshoq birlamchi qatlami Xona haroratida u eng nozik oksidli plyonka bilan qoplangan.
th va Mg ning Yumshoq birlamchi qatlami Xona haroratida u eng nozik oksidli plyonka bilan qoplangan.
 Jismoniy xossalari Shaffof plastik, ammo ozgina aralashmalar uni mo'rt qiladi.
Jismoniy xossalari Shaffof plastik, ammo ozgina aralashmalar uni mo'rt qiladi.
 Yengil, oq-kulrang, egiluvchan metall Ca Erish nuqtasi C Etarli qattiqlik tufayli ishqoriy metallar kabi pichoq bilan kesish mumkin emas.
Yengil, oq-kulrang, egiluvchan metall Ca Erish nuqtasi C Etarli qattiqlik tufayli ishqoriy metallar kabi pichoq bilan kesish mumkin emas.
 OLISH 1. Bariy oksidni qaytarganda olinadi: 3 Ba. O + 2 Al \u003d 3 Ba + Al 2 O 3 2. Qolgan metallar xlorid eritmalarini elektroliz qilish orqali olinadi: Ca. Cl 2 \u003d Ca + Cl 2 (elektron oqim)
OLISH 1. Bariy oksidni qaytarganda olinadi: 3 Ba. O + 2 Al \u003d 3 Ba + Al 2 O 3 2. Qolgan metallar xlorid eritmalarini elektroliz qilish orqali olinadi: Ca. Cl 2 \u003d Ca + Cl 2 (elektron oqim)
 KIMYOVIY XUSUSIYATLARI - REDUKTORLAR 1. Nometallar bilan ikkilik birikmalar hosil qiling Kislorod bilan reaksiya. Barcha metallar oksidlar RO, bariy konserva-peroksid - Ba hosil qiladi. O 2: Ba + O 2 \u003d Ba. O 2 peroksid Ca + O 2 \u003d Ca. O Ba + S = Ba. S sulfid Ca + H 2 \u003d Ca. H 2 gidrid Ca + 2 C \u003d Ca. C 2 karbid 3 Ba + 2 P \u003d Ba 3 P 2 fosfid Ca + N 2 \u003d Ca 3 N 2 nitridi Ca + Cl 2 \u003d Ca. Cl 2 xlorid
KIMYOVIY XUSUSIYATLARI - REDUKTORLAR 1. Nometallar bilan ikkilik birikmalar hosil qiling Kislorod bilan reaksiya. Barcha metallar oksidlar RO, bariy konserva-peroksid - Ba hosil qiladi. O 2: Ba + O 2 \u003d Ba. O 2 peroksid Ca + O 2 \u003d Ca. O Ba + S = Ba. S sulfid Ca + H 2 \u003d Ca. H 2 gidrid Ca + 2 C \u003d Ca. C 2 karbid 3 Ba + 2 P \u003d Ba 3 P 2 fosfid Ca + N 2 \u003d Ca 3 N 2 nitridi Ca + Cl 2 \u003d Ca. Cl 2 xlorid
 2. Suv bilan reaksiyasi. Ular gidroksidi hosil qiladi. Oddiy sharoitlarda Be va Mg ning yuzasi inert oksidli plyonka bilan qoplangan, shuning uchun ular suvga chidamli. Ca + 2 H 2 O \u003d Ca (OH) 2 + H 2 (o.s.da) Mg + H 2 O \u003d Mg (OH) 2 + H 2 (t da)
2. Suv bilan reaksiyasi. Ular gidroksidi hosil qiladi. Oddiy sharoitlarda Be va Mg ning yuzasi inert oksidli plyonka bilan qoplangan, shuning uchun ular suvga chidamli. Ca + 2 H 2 O \u003d Ca (OH) 2 + H 2 (o.s.da) Mg + H 2 O \u003d Mg (OH) 2 + H 2 (t da)
 3. Barcha metallar kislotalarda eriydi: Ca + 2 HCl = Ca. Cl 2 + H 2 4. Maxsus kislotalar bilan (Be Al ga o'xshash) Ca + HNO 3 (c) \u003d N 2 O + Ca (NO 3) 2 + H 2 O Ca + HNO 3 (p) \u003d NH 4 NO 3 + Ca (NO 3) 2 + H 2 O (N 2 O, NH 3) Ca + H 2 SO 4 (c) = H 2 S + Ca. SO 4 + H 2 O azot kislotasi bilan passivlanadi, kislota konsentratsiyasidan qatʼiy nazar reaksiya sovuqda davom etmaydi.
3. Barcha metallar kislotalarda eriydi: Ca + 2 HCl = Ca. Cl 2 + H 2 4. Maxsus kislotalar bilan (Be Al ga o'xshash) Ca + HNO 3 (c) \u003d N 2 O + Ca (NO 3) 2 + H 2 O Ca + HNO 3 (p) \u003d NH 4 NO 3 + Ca (NO 3) 2 + H 2 O (N 2 O, NH 3) Ca + H 2 SO 4 (c) = H 2 S + Ca. SO 4 + H 2 O azot kislotasi bilan passivlanadi, kislota konsentratsiyasidan qatʼiy nazar reaksiya sovuqda davom etmaydi.
 5. Ca, Mg og'ir metallar oksidlari bilan Metalllarni ularning oksidlaridan tiklash - pirometallurgiya (kalsetermiya, magnittermiya) Ca + Cu. O = Cu + Ca. O(t) 2 Mg + Ti. O 2 → 2 Mg. O + Ti 5 Ca + V 2 O 5 → 5 Ca. O + 2 V 2 Mg + CO 2 → 2 Mg. Mg ning karbonat angidriddagi O + C yonishi
5. Ca, Mg og'ir metallar oksidlari bilan Metalllarni ularning oksidlaridan tiklash - pirometallurgiya (kalsetermiya, magnittermiya) Ca + Cu. O = Cu + Ca. O(t) 2 Mg + Ti. O 2 → 2 Mg. O + Ti 5 Ca + V 2 O 5 → 5 Ca. O + 2 V 2 Mg + CO 2 → 2 Mg. Mg ning karbonat angidriddagi O + C yonishi
 6. Ishqoriy tuproq metal kationlariga sifatli reaksiya - olovni quyidagi ranglarda bo'yash: Ca 2+ - to'q to'q sariq Sr 2+ - to'q qizil Ba 2+ - och yashil
6. Ishqoriy tuproq metal kationlariga sifatli reaksiya - olovni quyidagi ranglarda bo'yash: Ca 2+ - to'q to'q sariq Sr 2+ - to'q qizil Ba 2+ - och yashil
 İŞQOLI METALLARNING KIMYOVIY XUSUSIYATLARI UMUMIYLASH M E + Cl 2 Xlorid fosfid T + P + H 2 + N 2 nitrid A + S Sulfid L + O 2 Oksid + C karbid L Ca, Sr, Ba + H 2 O S + kislotalar H gidrid Ishqor. 2 tuz va vodorod
İŞQOLI METALLARNING KIMYOVIY XUSUSIYATLARI UMUMIYLASH M E + Cl 2 Xlorid fosfid T + P + H 2 + N 2 nitrid A + S Sulfid L + O 2 Oksid + C karbid L Ca, Sr, Ba + H 2 O S + kislotalar H gidrid Ishqor. 2 tuz va vodorod
 SUV BILAN O'ARO TA'SIRI Reaksiya tenglamalarini to'ldiring, reaksiya mahsulotlarini nomlang va reaksiyadagi orolni tashkil qiling. Ca + H 2 O Sr + H 2 O Ba + H 2 O
SUV BILAN O'ARO TA'SIRI Reaksiya tenglamalarini to'ldiring, reaksiya mahsulotlarini nomlang va reaksiyadagi orolni tashkil qiling. Ca + H 2 O Sr + H 2 O Ba + H 2 O
 II GURUH METAL OKSIDLARI Oksidlarning umumiy formulasi Me. O va peroksidlar - Men. O 2 guruh IIA metall oksidlari asosli oksidlar, Be. O amfoter xossalarini namoyon qiladi.
II GURUH METAL OKSIDLARI Oksidlarning umumiy formulasi Me. O va peroksidlar - Men. O 2 guruh IIA metall oksidlari asosli oksidlar, Be. O amfoter xossalarini namoyon qiladi.
 Ishqoriy er metallarining birikmalari Ishqoriy yer metallarining oksidlari Umumiy MO formulasi Turi va sinfi Moddalarning asosiy oksidi fizik Oq moddaning qattiq kristalli xossalari Kimyoviy MO + H 2 O \u003d xossalari MO + kislota oksidi \u003d MO + kislota \u003d
Ishqoriy er metallarining birikmalari Ishqoriy yer metallarining oksidlari Umumiy MO formulasi Turi va sinfi Moddalarning asosiy oksidi fizik Oq moddaning qattiq kristalli xossalari Kimyoviy MO + H 2 O \u003d xossalari MO + kislota oksidi \u003d MO + kislota \u003d
 TAYYORLASH Metalllarning oksidlanishi (peroksid hosil qiluvchi Badan tashqari) Ca + O 2 = Ca. O magniy nitrat yoki erimaydigan Ca karbonatlarining termal parchalanishi. CO 3 → Ca. O + CO 2 t˚C 2 Mg(NO 3)2 → 2 Mg. O + 4 NO 2 + O 2 t˚C
TAYYORLASH Metalllarning oksidlanishi (peroksid hosil qiluvchi Badan tashqari) Ca + O 2 = Ca. O magniy nitrat yoki erimaydigan Ca karbonatlarining termal parchalanishi. CO 3 → Ca. O + CO 2 t˚C 2 Mg(NO 3)2 → 2 Mg. O + 4 NO 2 + O 2 t˚C
 KIMYOVIY XUSUSIYATLARI 1. Kislota oksidi 3 Ca bilan. O + P 2 O 5 \u003d Ca 3 (PO 4) 2 2. Suv bilan Ca. O + H 2 O \u003d Ca (OH) 2 (Be. O dan tashqari) 3. Ca kislotasi bilan. O + HCl = Ca. Cl 2 + H 2 O 4. Amfoter oksidi Ca bilan. O + Zn. O = Ca. Zn. O2
KIMYOVIY XUSUSIYATLARI 1. Kislota oksidi 3 Ca bilan. O + P 2 O 5 \u003d Ca 3 (PO 4) 2 2. Suv bilan Ca. O + H 2 O \u003d Ca (OH) 2 (Be. O dan tashqari) 3. Ca kislotasi bilan. O + HCl = Ca. Cl 2 + H 2 O 4. Amfoter oksidi Ca bilan. O + Zn. O = Ca. Zn. O2
 OKSIDLARNING MAXSUS XUSUSIYATLARI 2 Ba. O + O 2 \u003d 2 Ba. O 2 peroksid, faqat bariy Be uchun. O amfoter xossalarini namoyon qiladi, ishqorlar bilan ta'sir qiladi: Be. O+2Na. OH = Na 2 Be. O 2 + H 2 O qotishmasi Be. O+2Na. OH + H 2 O \u003d Na 2 Eritma bo'lsin. O + Na 2 CO 3 \u003d Na 2 Be. O 2 + CO 2 qotishmasi
OKSIDLARNING MAXSUS XUSUSIYATLARI 2 Ba. O + O 2 \u003d 2 Ba. O 2 peroksid, faqat bariy Be uchun. O amfoter xossalarini namoyon qiladi, ishqorlar bilan ta'sir qiladi: Be. O+2Na. OH = Na 2 Be. O 2 + H 2 O qotishmasi Be. O+2Na. OH + H 2 O \u003d Na 2 Eritma bo'lsin. O + Na 2 CO 3 \u003d Na 2 Be. O 2 + CO 2 qotishmasi
 Ishqoriy tuproq metal birikmalari İŞQORLI YER METAL GIDROKSIDLARI Umumiy formula M(OH)2 moddalarning turi va sinfi Ishqorlar Fizik xossalari Kimyoviy xossalari Ion kristalli panjarali oq kristall qattiq moddalar M(OH)2 + tuz = M(OH)2 + kislota oksidi =
Ishqoriy tuproq metal birikmalari İŞQORLI YER METAL GIDROKSIDLARI Umumiy formula M(OH)2 moddalarning turi va sinfi Ishqorlar Fizik xossalari Kimyoviy xossalari Ion kristalli panjarali oq kristall qattiq moddalar M(OH)2 + tuz = M(OH)2 + kislota oksidi =
 İŞQORLI ER METALLARINING GIDROKSIDLARI - İŞQALALI. R (OH) 2 gidroksidlari oq kristall moddalar bo'lib, gidroksidlar gidroksidlariga qaraganda suvda kamroq eriydi (gidroksidlarning eruvchanligi seriya raqamining kamayishi bilan kamayadi; Be (OH) 2 suvda erimaydi, ishqorlarda eriydi). R (OH) 2 ning asosligi atom sonining ortishi bilan ortadi: Be (OH) 2 - amfoter gidroksid Mg (OH) 2 - kuchsiz asos Ca (OH) 2 - ishqor, qolgan gidroksidlar kuchli asoslar (ishqorlar).
İŞQORLI ER METALLARINING GIDROKSIDLARI - İŞQALALI. R (OH) 2 gidroksidlari oq kristall moddalar bo'lib, gidroksidlar gidroksidlariga qaraganda suvda kamroq eriydi (gidroksidlarning eruvchanligi seriya raqamining kamayishi bilan kamayadi; Be (OH) 2 suvda erimaydi, ishqorlarda eriydi). R (OH) 2 ning asosligi atom sonining ortishi bilan ortadi: Be (OH) 2 - amfoter gidroksid Mg (OH) 2 - kuchsiz asos Ca (OH) 2 - ishqor, qolgan gidroksidlar kuchli asoslar (ishqorlar).
 GIDROKSIDLAR OLISH 1. Ishqoriy tuproq metallar yoki ularning oksidlarining suv bilan reaksiyalari: Ba + 2 H 2 O Ba(OH) 2 + H 2 Ca. O + H 2 O Ca(OH)2 2. Ca tuzi eritmalarining elektrolizi. Cl 2 + H 2 O Ca (OH) 2 + Cl 2 + H 2 el. tok 3. Be(OH)2 va Mg(OH)2 Be almashish reaksiyalari natijasida hosil bo'ladi. Cl 2 + 2 Na. OH = 2Na. Cl + Be(OH)2
GIDROKSIDLAR OLISH 1. Ishqoriy tuproq metallar yoki ularning oksidlarining suv bilan reaksiyalari: Ba + 2 H 2 O Ba(OH) 2 + H 2 Ca. O + H 2 O Ca(OH)2 2. Ca tuzi eritmalarining elektrolizi. Cl 2 + H 2 O Ca (OH) 2 + Cl 2 + H 2 el. tok 3. Be(OH)2 va Mg(OH)2 Be almashish reaksiyalari natijasida hosil bo'ladi. Cl 2 + 2 Na. OH = 2Na. Cl + Be(OH)2
 KIMYOVIY XUSUSIYATLARI 1. indikator rangini o'zgartirish Litmus - ko'k Metil apelsin - sariq Fenolftalein - malina Suvdagi gidroksidi tuproqli metallarning gidroksidlari ajraladi.
KIMYOVIY XUSUSIYATLARI 1. indikator rangini o'zgartirish Litmus - ko'k Metil apelsin - sariq Fenolftalein - malina Suvdagi gidroksidi tuproqli metallarning gidroksidlari ajraladi.
 KIMYOVIY XUSUSIYATLARI 2. Kislotali oksidlar bilan reaksiyalar: Ca(OH)2 + SO 2 Ca. SO 3 + H 2 O Ba (OH) 2 + CO 2 Ba. CO 3 + H 2 O Ca (OH) 2 + 2 CO 2 CA (HCO 3) 2 Ca (OH) 2 + CO 2 \u003d Ca. CO 3 + H 2 O karbonat angidridga sifatli reaksiya 3. Kislotalar bilan reaksiyalar (neytrallanish) Ba (OH) 2 + 2 HNO 3 Ba (NO 3) 2 + 2 H 2 O 4. Tuzlar bilan almashinish reaksiyalari: Ba (OH) 2 + K 2 SO 4 Ba. SO 4+ 2 KOH
KIMYOVIY XUSUSIYATLARI 2. Kislotali oksidlar bilan reaksiyalar: Ca(OH)2 + SO 2 Ca. SO 3 + H 2 O Ba (OH) 2 + CO 2 Ba. CO 3 + H 2 O Ca (OH) 2 + 2 CO 2 CA (HCO 3) 2 Ca (OH) 2 + CO 2 \u003d Ca. CO 3 + H 2 O karbonat angidridga sifatli reaksiya 3. Kislotalar bilan reaksiyalar (neytrallanish) Ba (OH) 2 + 2 HNO 3 Ba (NO 3) 2 + 2 H 2 O 4. Tuzlar bilan almashinish reaksiyalari: Ba (OH) 2 + K 2 SO 4 Ba. SO 4+ 2 KOH
 KIMYOVIY XUSUSIYATLARI 5. Amfoter metallar, oksidlar, gidroksidlar bilan Ca(OH)2 + Be(OH)2 Ca (eritma) Ca(OH)2 + Be(OH)2 Ca. bo'l. O 2 + H 2 O (qotishma) Ca (OH) 2 + Be. O + H 2 O Ca (eritma) Ca (OH) 2 + Be. Ca haqida. bo'l. O 2 + H 2 O (qotishma) Ca (OH) 2 + Be Ca + H 2 kaltsiy tetragidroksoberillat
KIMYOVIY XUSUSIYATLARI 5. Amfoter metallar, oksidlar, gidroksidlar bilan Ca(OH)2 + Be(OH)2 Ca (eritma) Ca(OH)2 + Be(OH)2 Ca. bo'l. O 2 + H 2 O (qotishma) Ca (OH) 2 + Be. O + H 2 O Ca (eritma) Ca (OH) 2 + Be. Ca haqida. bo'l. O 2 + H 2 O (qotishma) Ca (OH) 2 + Be Ca + H 2 kaltsiy tetragidroksoberillat
 MADDALARNING TRIVIAL NOMLARI Ca. O - so'nmagan ohak Ca(OH)2 -o'chirilgan ohak (ohak suvi, sut) Ca. CO 3 - bo'r, marmar, ohaktosh Ca. SO 4 * 2 H 2 O - gips Ca (Cl. O) Cl - oqartiruvchi
MADDALARNING TRIVIAL NOMLARI Ca. O - so'nmagan ohak Ca(OH)2 -o'chirilgan ohak (ohak suvi, sut) Ca. CO 3 - bo'r, marmar, ohaktosh Ca. SO 4 * 2 H 2 O - gips Ca (Cl. O) Cl - oqartiruvchi
 İŞQORLI YER METALLARI TUZI Be va Ba ning eruvchan tuzlari zaharli, zaharli! Ba 2+ kationi odatda sulfat kislota yoki uning tuzlari bilan almashinuv reaksiyasi natijasida ochiladi: Bariy sulfat oq cho‘kma bo‘lib, mineral kislotalarda erimaydi.
İŞQORLI YER METALLARI TUZI Be va Ba ning eruvchan tuzlari zaharli, zaharli! Ba 2+ kationi odatda sulfat kislota yoki uning tuzlari bilan almashinuv reaksiyasi natijasida ochiladi: Bariy sulfat oq cho‘kma bo‘lib, mineral kislotalarda erimaydi.
 TABIATDAGI KALTSIY Kaltsiy jinslari - ohaktosh, marmar, bo'r. Ushbu jinslarning formulasini eslang. Ularning farqi nimada?
TABIATDAGI KALTSIY Kaltsiy jinslari - ohaktosh, marmar, bo'r. Ushbu jinslarning formulasini eslang. Ularning farqi nimada?
 BOR, OHAKTOSH, MARMARLAR TOZA SUVDA ERIMAYDI, BIRAKKSIL ERITMALARDA ERIRADI, HATTO TABIY SUVDAGI CHUNCHALIK zaif. Ohaktosh konlari orqali yer yuzasidan suv sizib chiqqanda quyidagi jarayonlar sodir bo'ladi: 1. tog 'jinslari tuproqning yupqa qatlami ostida yotsa, chuqurchalar hosil bo'ladi.
BOR, OHAKTOSH, MARMARLAR TOZA SUVDA ERIMAYDI, BIRAKKSIL ERITMALARDA ERIRADI, HATTO TABIY SUVDAGI CHUNCHALIK zaif. Ohaktosh konlari orqali yer yuzasidan suv sizib chiqqanda quyidagi jarayonlar sodir bo'ladi: 1. tog 'jinslari tuproqning yupqa qatlami ostida yotsa, chuqurchalar hosil bo'ladi.
 2. Agar toshlar katta chuqurlikda yotsa, er osti karst g'orlari paydo bo'ladi. G'or tomidan ulkan muzlar shaklida osilgan konlar qanday nomlanadi? Va g'orning tubidan ularga qarab o'sayotgan ustunlar? Qanday kimyoviy reaktsiyalar sodir bo'ladi?
2. Agar toshlar katta chuqurlikda yotsa, er osti karst g'orlari paydo bo'ladi. G'or tomidan ulkan muzlar shaklida osilgan konlar qanday nomlanadi? Va g'orning tubidan ularga qarab o'sayotgan ustunlar? Qanday kimyoviy reaktsiyalar sodir bo'ladi?
 ARXITEKTURA VA HAYKALTURASHDA ohaktosh VA MARMAR ISHLATILADI Kislota yomg'irlari ta'sirida binolar vayron bo'ladi. Qanday reaktsiyalar sodir bo'ladi?
ARXITEKTURA VA HAYKALTURASHDA ohaktosh VA MARMAR ISHLATILADI Kislota yomg'irlari ta'sirida binolar vayron bo'ladi. Qanday reaktsiyalar sodir bo'ladi?
 INSON ORGANASIDAGI KALTSIY Tarkibida kaltsiy fosfat bo'lgan mineral inson organizmida muhim rol o'ynaydi. Bu inson suyaklarining qurilish materiali, emalning bir qismidir. Boshqa minerallar bilan birgalikda u yurak-qon tomir tizimining faoliyatini qo'llab-quvvatlaydi, yo'g'on ichak saratoni paydo bo'lishining oldini oladi, asab faoliyatini tartibga soladi va xolesterinni kamaytirishga yordam beradi. Voyaga etgan odamning tanasida Ca 3 (PO 4) 2 shaklida 1 kg dan ortiq kaltsiy mavjud.
INSON ORGANASIDAGI KALTSIY Tarkibida kaltsiy fosfat bo'lgan mineral inson organizmida muhim rol o'ynaydi. Bu inson suyaklarining qurilish materiali, emalning bir qismidir. Boshqa minerallar bilan birgalikda u yurak-qon tomir tizimining faoliyatini qo'llab-quvvatlaydi, yo'g'on ichak saratoni paydo bo'lishining oldini oladi, asab faoliyatini tartibga soladi va xolesterinni kamaytirishga yordam beradi. Voyaga etgan odamning tanasida Ca 3 (PO 4) 2 shaklida 1 kg dan ortiq kaltsiy mavjud.
 Ca. SO 4 - kaltsiy sulfat, tabiatda gips Ca minerali shaklida uchraydi. SO 4 * 2 H 2 O, bu kristalli gidrat. U qurilishda, tibbiyotda qattiq gipsli bintlarni qo'llash, gips tayyorlash uchun ishlatiladi. Buning uchun yarim suvli gips 2 Ca ishlatiladi. SO 4 - alebastr.
Ca. SO 4 - kaltsiy sulfat, tabiatda gips Ca minerali shaklida uchraydi. SO 4 * 2 H 2 O, bu kristalli gidrat. U qurilishda, tibbiyotda qattiq gipsli bintlarni qo'llash, gips tayyorlash uchun ishlatiladi. Buning uchun yarim suvli gips 2 Ca ishlatiladi. SO 4 - alebastr.
 BERILLIY Berilliy alyuminiy va magniyga o'xshaydi... Beril mineralida bo'lgani uchun uning nomini oldi. Metall yunoncha "shirin" so'zidan glitsiy deb ham ataladi, chunki uning tuzlari shirin ta'mga ega. D.I.Mendeleyev
BERILLIY Berilliy alyuminiy va magniyga o'xshaydi... Beril mineralida bo'lgani uchun uning nomini oldi. Metall yunoncha "shirin" so'zidan glitsiy deb ham ataladi, chunki uning tuzlari shirin ta'mga ega. D.I.Mendeleyev
 TABIATDAGI BERILLIY BIRIKMALARI Xrizoberil Be. Al 2 O 4 Zumrad akvamarin Aleksandrit
TABIATDAGI BERILLIY BIRIKMALARI Xrizoberil Be. Al 2 O 4 Zumrad akvamarin Aleksandrit
 "Zumrad injiq, ayolga o'xshab, uni qidirgan joyda topilmaydi." Boy yashil rangi va qattiqligi tufayli zargarlar orasida juda mashhur, ajoyib rang xrom yoki vanadiy ionlari mavjudligidan kelib chiqadi. . "Akvamaringa qarasangiz, yulduzlar rangidagi suvli sokin dengizni ko'rasiz." K. G. Paustovskiy Bu rang unga temir temirning kichik aralashmasi bilan berilgan.
"Zumrad injiq, ayolga o'xshab, uni qidirgan joyda topilmaydi." Boy yashil rangi va qattiqligi tufayli zargarlar orasida juda mashhur, ajoyib rang xrom yoki vanadiy ionlari mavjudligidan kelib chiqadi. . "Akvamaringa qarasangiz, yulduzlar rangidagi suvli sokin dengizni ko'rasiz." K. G. Paustovskiy Bu rang unga temir temirning kichik aralashmasi bilan berilgan.
 MAGNIY TABIATDA Magniy o'simliklar yashil pigmentining faol markazi - xlorofillning bir qismidir Avtomobil, aviatsiya va raketa sanoati Magnalium alyuminiy bilan qattiq va bardoshli qotishma - rux qo'shimchalari bilan 30% Mg,
MAGNIY TABIATDA Magniy o'simliklar yashil pigmentining faol markazi - xlorofillning bir qismidir Avtomobil, aviatsiya va raketa sanoati Magnalium alyuminiy bilan qattiq va bardoshli qotishma - rux qo'shimchalari bilan 30% Mg,
 TIBBIYOTDA MAGNESIY Tibbiyotda magniy karbonat va magniy oksidi oshqozonning xlorid kislotasini zararsizlantirish vositasi va engil laksatiflar (Gastal, Rennie, Almagel) sifatida ishlatiladi. Magniy sulfat ("epsom tuzi") o't pufagining spazmlari uchun laksatif, xoleretik va og'riq qoldiruvchi vosita sifatida ishlatiladi. Magniy sulfat eritmasi epilepsiya uchun antikonvulsant sifatida va siydikni ushlab turish, bronxial astma va gipertenziya uchun antispastik dori sifatida qo'llaniladi. organik magniy tuzlari turli xil terapevtik va profilaktik ta'sirga ega bo'lgan parhez qo'shimchalari va dori vositalarini ishlab chiqarishda qo'llaniladi.
TIBBIYOTDA MAGNESIY Tibbiyotda magniy karbonat va magniy oksidi oshqozonning xlorid kislotasini zararsizlantirish vositasi va engil laksatiflar (Gastal, Rennie, Almagel) sifatida ishlatiladi. Magniy sulfat ("epsom tuzi") o't pufagining spazmlari uchun laksatif, xoleretik va og'riq qoldiruvchi vosita sifatida ishlatiladi. Magniy sulfat eritmasi epilepsiya uchun antikonvulsant sifatida va siydikni ushlab turish, bronxial astma va gipertenziya uchun antispastik dori sifatida qo'llaniladi. organik magniy tuzlari turli xil terapevtik va profilaktik ta'sirga ega bo'lgan parhez qo'shimchalari va dori vositalarini ishlab chiqarishda qo'llaniladi.
 SUV QATTIQLIGI Suvning qattiqligi suvning kimyoviy va fizik xususiyatlarining to'plami bo'lib, undagi gidroksidi tuproq metallarining, asosan kaltsiy va magniyning ("qattiqlik tuzlari" deb ataladigan) erigan tuzlari tarkibiga bog'liq. Qattiq yoki yumshoq suvni iste'mol qilish odatda sog'liq uchun zararli emas, yuqori qattiqlik siydik toshlarining shakllanishiga hissa qo'shishi haqida dalillar mavjud va past qattiqlik yurak-qon tomir kasalliklari xavfini biroz oshiradi. Tabiiy ta'mi
SUV QATTIQLIGI Suvning qattiqligi suvning kimyoviy va fizik xususiyatlarining to'plami bo'lib, undagi gidroksidi tuproq metallarining, asosan kaltsiy va magniyning ("qattiqlik tuzlari" deb ataladigan) erigan tuzlari tarkibiga bog'liq. Qattiq yoki yumshoq suvni iste'mol qilish odatda sog'liq uchun zararli emas, yuqori qattiqlik siydik toshlarining shakllanishiga hissa qo'shishi haqida dalillar mavjud va past qattiqlik yurak-qon tomir kasalliklari xavfini biroz oshiradi. Tabiiy ta'mi
 SUVNING QATTILIGI Qattiq suv yuvganda terini quritadi, sovun ishlatganda yaxshi ko'piklanmaydi. Qattiq suvdan foydalanish qozonlarning devorlarida, quvurlarda va hokazolarda cho'kindi (shkala) paydo bo'lishiga olib keladi. Shu bilan birga, juda yumshoq suvdan foydalanish quvurlarning korroziyasiga olib kelishi mumkin. Tabiiy suvlarning qattiqligi juda keng chegaralarda o'zgarishi mumkin va yil davomida doimiy emas. Suvning bug'lanishi tufayli qattiqlik ortadi, yomg'irli mavsumda, shuningdek, qor va muz erishi paytida kamayadi.
SUVNING QATTILIGI Qattiq suv yuvganda terini quritadi, sovun ishlatganda yaxshi ko'piklanmaydi. Qattiq suvdan foydalanish qozonlarning devorlarida, quvurlarda va hokazolarda cho'kindi (shkala) paydo bo'lishiga olib keladi. Shu bilan birga, juda yumshoq suvdan foydalanish quvurlarning korroziyasiga olib kelishi mumkin. Tabiiy suvlarning qattiqligi juda keng chegaralarda o'zgarishi mumkin va yil davomida doimiy emas. Suvning bug'lanishi tufayli qattiqlik ortadi, yomg'irli mavsumda, shuningdek, qor va muz erishi paytida kamayadi.
 SUV QATTIQLIGI Suvning qattiqligining turlari mavjud ionlar Suvning qattiqligini yo'qotish yo'llari Vaqtinchalik (karbonat) Ca(2+), Mg(2+) HCO 3(-) 1. Qaynatish 2. Soda yoki Ca(OH)2 Doimiy Ca(2) qo'shilishi. +) , Mg(2+) SO 4(2 -) 1. Soda qo'shilishi. 2. Kation almashtirgichlardan foydalanish Jami Ca(2+), Mg(2+), HCO 3(-), Cl(-) SO 4(2 -) Yuqoridagi barcha usullarning kombinatsiyasi.
SUV QATTIQLIGI Suvning qattiqligining turlari mavjud ionlar Suvning qattiqligini yo'qotish yo'llari Vaqtinchalik (karbonat) Ca(2+), Mg(2+) HCO 3(-) 1. Qaynatish 2. Soda yoki Ca(OH)2 Doimiy Ca(2) qo'shilishi. +) , Mg(2+) SO 4(2 -) 1. Soda qo'shilishi. 2. Kation almashtirgichlardan foydalanish Jami Ca(2+), Mg(2+), HCO 3(-), Cl(-) SO 4(2 -) Yuqoridagi barcha usullarning kombinatsiyasi.
 TABIATDA STRONTIUM Sarcodidae sinfi - radiolaryanlar, tubdan joylashgan psevdopodiyaga ega. Kremniy yoki stronsiy sulfatdan tashkil topgan mineral skelet alohida ignalardan tashkil topgan muntazam geometrik shakllar (to'plar, polihedralar, halqalar) shaklini oladi.
TABIATDA STRONTIUM Sarcodidae sinfi - radiolaryanlar, tubdan joylashgan psevdopodiyaga ega. Kremniy yoki stronsiy sulfatdan tashkil topgan mineral skelet alohida ignalardan tashkil topgan muntazam geometrik shakllar (to'plar, polihedralar, halqalar) shaklini oladi.
 STRONTIY TUZLARINING QO'LLANISHI Kolleksion mineral sifatida selestit juda qadrlanadi, lekin past qattiqligi va yuqori mo'rtligi tufayli zargarlik buyumlarida deyarli qo'llanilmaydi. Selestinning xarakterli namunalari ko'k, och ko'k, kulrang-ko'k va biroz mavimsi; selestin rangsiz, shuningdek, oq, sarg'ish, zangori-yashil, qizg'ish, jigarrang, ba'zan zo'rg'a shaffof, ba'zan zonal rangga ega bo'lishi mumkin.
STRONTIY TUZLARINING QO'LLANISHI Kolleksion mineral sifatida selestit juda qadrlanadi, lekin past qattiqligi va yuqori mo'rtligi tufayli zargarlik buyumlarida deyarli qo'llanilmaydi. Selestinning xarakterli namunalari ko'k, och ko'k, kulrang-ko'k va biroz mavimsi; selestin rangsiz, shuningdek, oq, sarg'ish, zangori-yashil, qizg'ish, jigarrang, ba'zan zo'rg'a shaffof, ba'zan zonal rangga ega bo'lishi mumkin.
 STRONTIY TUZLARIDAN FOYDALANISh Stronsiy birikmalari pirotexnika vositalarida ishlatilgan; olovga bir chimdim stronsiy tuzini tashlashga arziydi - va u qizil rangga aylanadi. Qizil otashinlar va olov chiroqlari hammasi stronsiy tufaylidir. Stronsiy birikmalari shisha va keramika sanoatida sirlangan yuzalarni olish uchun ishlatiladi,
STRONTIY TUZLARIDAN FOYDALANISh Stronsiy birikmalari pirotexnika vositalarida ishlatilgan; olovga bir chimdim stronsiy tuzini tashlashga arziydi - va u qizil rangga aylanadi. Qizil otashinlar va olov chiroqlari hammasi stronsiy tufaylidir. Stronsiy birikmalari shisha va keramika sanoatida sirlangan yuzalarni olish uchun ishlatiladi,
 CELESTINE SIRLARI Gerr Heinemann o'z hayotidan mamnun edi. Qo'shma Shtatlarga ko'chib kelgan boshqa ko'plab emigrantlar bilan solishtirganda, u juda yaxshi ish qilardi. Uning go'zal ko'l orolidagi vinochilik zavodi gullab-yashnadi va endi ishlab chiqarish ehtiyojlari uchun kichik quduq qilish kerak edi. Kechadan beri uning yordamchilari toshni o'yib, shunday qilishdi. Va bugun ulardan biri yugurib keldi, deyishadi, u o'zini izlagani ma'qul. Eh, hamma narsani o'zingiz qilishingiz kerak. Gerr Heinemann ish ketayotgan yerto‘laga tushdi. - Xo'sh, bu erda nima bor? - Mana, qarang, janob, ular toshni o'yib, bo'shliqqa qoqilib ketishdi ... - Menga chiroq bering. Gerr Heinemann qoyaning teshigiga tushdi - bu bir kunlik mehnat natijasidir. Haqiqatan ham uning pastki qismida teshik bor edi. U egilib, chirog'ini ichkariga qaratdi. Va u o'z ko'zlariga ishona olmadi: fonarning nuri ulkan zangori-oq kristallar bilan qoplangan keng g'orning devorlarini tortib oldi. Gerr Heinemann allaqachon bu o'z vatanining ertaklaridan trollarning er osti xazinasi ekanligiga qaror qilgan edi, ammo AQShda nemis trollari yo'q. Gerr Heinemann o'z mantig'iga kulib yubordi.
CELESTINE SIRLARI Gerr Heinemann o'z hayotidan mamnun edi. Qo'shma Shtatlarga ko'chib kelgan boshqa ko'plab emigrantlar bilan solishtirganda, u juda yaxshi ish qilardi. Uning go'zal ko'l orolidagi vinochilik zavodi gullab-yashnadi va endi ishlab chiqarish ehtiyojlari uchun kichik quduq qilish kerak edi. Kechadan beri uning yordamchilari toshni o'yib, shunday qilishdi. Va bugun ulardan biri yugurib keldi, deyishadi, u o'zini izlagani ma'qul. Eh, hamma narsani o'zingiz qilishingiz kerak. Gerr Heinemann ish ketayotgan yerto‘laga tushdi. - Xo'sh, bu erda nima bor? - Mana, qarang, janob, ular toshni o'yib, bo'shliqqa qoqilib ketishdi ... - Menga chiroq bering. Gerr Heinemann qoyaning teshigiga tushdi - bu bir kunlik mehnat natijasidir. Haqiqatan ham uning pastki qismida teshik bor edi. U egilib, chirog'ini ichkariga qaratdi. Va u o'z ko'zlariga ishona olmadi: fonarning nuri ulkan zangori-oq kristallar bilan qoplangan keng g'orning devorlarini tortib oldi. Gerr Heinemann allaqachon bu o'z vatanining ertaklaridan trollarning er osti xazinasi ekanligiga qaror qilgan edi, ammo AQShda nemis trollari yo'q. Gerr Heinemann o'z mantig'iga kulib yubordi.
 KALTSIYNING GENETIK SERISI Ca. Taxminan Ca (OH) 2 Ca. CO 3 Ca (HCO 3) 2 Moddalarning o'zgarishini amalga oshirish mumkin bo'lgan reaksiya tenglamalarini yozing.
KALTSIYNING GENETIK SERISI Ca. Taxminan Ca (OH) 2 Ca. CO 3 Ca (HCO 3) 2 Moddalarning o'zgarishini amalga oshirish mumkin bo'lgan reaksiya tenglamalarini yozing.
 TRANSFORMATSIYALAR ZANJIRI Ca → Ca. O → Ca. Cl 2 → Ca (OH) 2 → Ca. CO 3 → Ca. O reaktsiyalar uchun ion tenglamalari va ho'kiz-qaytarilish balanslarini tuzing.
TRANSFORMATSIYALAR ZANJIRI Ca → Ca. O → Ca. Cl 2 → Ca (OH) 2 → Ca. CO 3 → Ca. O reaktsiyalar uchun ion tenglamalari va ho'kiz-qaytarilish balanslarini tuzing.