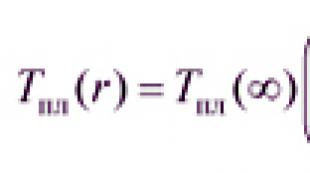細胞内の代謝活性を調節する方法。 ベビーベッド-酵素-ホルモン。 基本的な概念と用語
動的生化学
章IV.8.
代謝とエネルギー
代謝 または代謝-生命に必要な物質とエネルギーを体に提供する体内の一連の化学反応。 代謝では、2つの主要な段階を区別することができます:準備-消化管によって受け取られた物質が化学変換を受け、その結果、血流に入り、細胞に浸透することができるとき、そして実際の代謝、すなわち 細胞に浸透した化合物の化学的変換。
代謝経路 -これは、体内の特定の物質の化学的変換の性質と順序です。 代謝中に形成される中間生成物は代謝物と呼ばれ、代謝経路の最後の化合物が最終生成物です。
複雑な物質をより単純な物質に分解するプロセスは、 異化。 したがって、消化管酵素の作用下で食品に入るタンパク質、脂肪、炭水化物は、より単純な成分(アミノ酸、脂肪酸、単糖)に分解されます。 これはエネルギーを放出します。 逆のプロセス、すなわち、より単純なものからの複雑な化合物の合成は、 同化作用 。 それはエネルギーが付属しています。 消化の結果として形成されるアミノ酸、脂肪酸、単糖類から、新しい細胞タンパク質、膜リン脂質、多糖類が細胞内で合成されます。
コンセプトがあります 両親媒性 1つの化合物が破壊されたが、別の化合物が合成された場合。
代謝サイクル は代謝経路であり、その最終生成物の1つは、このプロセスに関与する化合物の1つと同一です。
プライベート代謝経路は、1つの特定の化合物(炭水化物またはタンパク質)の一連の変換です。 一般的な代謝経路は、2種類以上の化合物が関与している場合です(炭水化物、脂質、および部分的にタンパク質がエネルギー代謝に関与しています)。
代謝の基質 -食品に由来する化合物。 それらの中には、主要な栄養素(タンパク質、炭水化物、脂質)と少量(ビタミン、ミネラル)が含まれています。
代謝の強さは、特定の物質またはエネルギーに対する細胞の必要性によって決定され、調節は4つの方法で実行されます。
1) 特定の代謝経路の総反応速度は、この経路の各酵素の濃度、培地のpH値、各中間生成物の細胞内濃度、補因子および補酵素の濃度によって決定されます。
2) 通常、代謝経路の初期段階を触媒する調節(アロステリック)酵素の活性。 それらのほとんどは、この経路の最終産物によって阻害され、このタイプの阻害は「フィードバック」と呼ばれます。
3) 特定の酵素の合成速度を決定する遺伝子制御。 鮮やかな例は、対応する基質の摂取に応じた細胞内の誘導酵素の出現です。
4) ホルモン調節。 多くのホルモンは、代謝経路の多くの酵素を活性化または阻害することができます。
生物は熱力学的に不安定なシステムです。 それらの形成と機能のためには、多面的な使用に適した形でのエネルギーの継続的な供給が必要です。 エネルギーを得るために、地球上のほとんどすべての生き物は、ATPのピロリン酸結合の1つを加水分解するように適応しています。 この点で、生物の生体エネルギー学の主なタスクの1つは、ADPおよびAMPからの使用済みATPの補充です。
セル内の主なエネルギー源は、大気中の酸素による基質の酸化です。 このプロセスは、炭素原子への酸素の追加、水素の除去、または電子の損失の3つの方法で実行されます。 セルでは、酸化は、水素と電子が基板から酸素に順次移動するという形で進行します。 この場合、酸素は還元性化合物(酸化剤)の役割を果たします。 酸化反応はエネルギーの放出とともに進行します。エネルギーの比較的小さな変化は生物学的反応の特徴です。 これは、酸化プロセスをいくつかの中間段階に分割することによって達成されます。これにより、酸化プロセスをマクロ作動性化合物(ATP)の形で少量に保存することが可能になります。 陽子と電子のペアとの相互作用による酸素原子の還元は、水分子の形成につながります。
組織呼吸
これは、生物学的酸化に関与する体の組織の細胞による酸素の消費のプロセスです。 このタイプの酸化はと呼ばれます 好気性酸化 。 水素移動鎖の最終受容体が酸素ではなく、他の物質(ピルビン酸など)である場合、このタイプの酸化はと呼ばれます 嫌気性。
それか。 生物学的酸化は、中間水素担体とその最終受容体の助けを借りて基質を脱水素化することです。
呼吸鎖 (組織呼吸の酵素)は、酸化された基質から酸素への陽子と電子のキャリアです。 酸化剤は、電子を受け入れることができる化合物です。 この能力は定量化されます 酸化還元電位 pHが7.0に等しい標準水素電極に関連して。 化合物の可能性が低いほど、その還元特性は強くなり、逆もまた同様です。
それか。 どの化合物も、酸化還元電位が高い化合物にのみ電子を供与できます。 呼吸鎖では、後続の各リンクは前のリンクよりも高い可能性があります。
呼吸鎖は次のもので構成されています。
1. NAD依存性デヒドロゲナーゼ;
2. FAD依存性デヒドロゲナーゼ;
3.ユビキノン(コちゃんQ);
4.シトクロムb、c、a + a3。
NAD依存性デヒドロゲナーゼ 。 補酵素として含まれています その上と NADP。 ニコチンアミドのピリジン環は、電子と水素プロトンを結合することができます。
FADおよびFMN依存性デヒドロゲナーゼ 補酵素としてビタミンB2のリン酸エステルを含む( 流行).
ユビキノン (共同 Q ) フラボタンパク質から水素を取り、 ハイドロキノン.
シトクロム -組成に補欠分子族として鉄ポルフィリンが存在するため、電子を結合できる色素タンパク質タンパク質。 彼らはわずかに強い還元剤から電子を受け取り、それをより強い酸化剤に寄付します。 鉄原子は、ポルフィリン環の平面の片側でヒスチジンアミノ酸のイミダゾール環の窒素原子に結合し、反対側でメチオニンの硫黄原子に結合します。 したがって、シトクロムの鉄原子が酸素に結合する潜在的な能力は抑制されます。
V シトクロムc ポルフィリン平面は、2つのシステイン残基を介してタンパク質に共有結合しています。 チトクロームb と 、共有結合されていません たんぱく質で。
V シトクロムa + a 3 (チトクロームオキシダーゼ)プロトポルフィリンの代わりにポルフィリンAが含まれていますが、これは多くの構造的特徴が異なります。 鉄の5番目の配位位置は、タンパク質自体の一部であるアミノ糖残基に属するアミノ基によって占められています。
ヘムゴビンのヘムとは対照的に、シトクロムの鉄原子は2価から3価の状態に可逆的に変化する可能性があります。これにより、電子の輸送が保証されます(詳細については付録1「ヘムタンパク質の原子および電子構造」を参照)。
電子伝達系の動作メカニズム
ミトコンドリアの外膜(図4.8.1)は、ほとんどの小分子とイオンを透過しますが、内膜は、ほとんどすべてのイオン(Hプロトンを除く)とほとんどの非荷電分子を透過します。
呼吸鎖の上記のすべてのコンポーネントは、内膜に組み込まれています。 呼吸鎖に沿った陽子と電子の輸送は、その成分間の電位差によって提供されます。 この場合、電位が0.16 V上昇するたびに、ADPとH 3 RO4から1つのATP分子を合成するのに十分なエネルギーが放出されます。 O 2の1分子が消費されると、3 ATP.
ADPとリン酸からのATPの酸化と形成のプロセス、すなわち リン酸化はミトコンドリアで起こります。 内膜は多くのひだを形成します-クリステ。 スペースは内膜、つまりマトリックスによって制限されます。 内膜と外膜の間の空間は膜間腔と呼ばれます。
このような分子には、3つのマクロ作動性結合が含まれています。 マクロ作動性 またはエネルギーが豊富なのは化学結合であり、それが切断されると4 kcal / mol以上が放出されます。 ATPのADPとリン酸への加水分解の間に、7.3 kcal / molが放出されます。 正確に同じ量がADPからのATPの形成とリン酸の残留物に費やされ、これは体内にエネルギーを蓄える主な方法の1つです。
呼吸鎖に沿った電子伝達の過程で、エネルギーが放出され、ADPへのリン酸残基の付加に費やされて1つのATP分子と1つの水分子を形成します。 呼吸鎖に沿って1対の電子を伝達する過程で、21.3 kcal / molが放出され、3つのATP分子の形で保存されます。 これは、電子輸送中に放出されるエネルギーの約40%です。
細胞にエネルギーを蓄えるこの方法は、 酸化的リン酸化 または結合リン酸化。
このプロセスの分子メカニズムは、1961年に提唱されたミッチェルの化学浸透圧理論によって最も完全に説明されています。
酸化的リン酸化のメカニズム (図4.8.2):
1) NAD依存性デヒドロゲナーゼはミトコンドリアの内膜のマトリックス表面に位置し、FMN依存性デヒドロゲナーゼに水素電子のペアを提供します。 この場合、陽子のペアもマトリックスからFMNに移動し、その結果、FMNH2が形成されます。 このとき、NADに属する一対のプロトンが膜間腔に押し込まれます。
2) FAD依存性デヒドロゲナーゼはCoに電子対を提供します Q いくつかのプロトンを膜間腔に押し込みます。 電子を受け取ったこと Q マトリックスから2、3の陽子を受け取り、Coに変わります Q H2。
3)Co Q H 2は、一対のプロトンを膜間腔に押し込み、一対の電子がシトクロムに移動し、次に酸素に移動して水分子を形成します。
その結果、電子対が鎖に沿ってマトリックスから膜間腔に移動すると、6つのプロトン(3対)がポンピングされ、内部の表面間に電位差とpH差が生じます。膜。
4) 電位差とpH差により、プロトンチャネルを介してマトリックスに戻るプロトンの移動が保証されます。
5) プロトンのこの逆の動きは、ATPシンターゼの活性化とADPとリン酸からのATPの合成につながります。 1対の電子(つまり3対の陽子)の移動により、3つのATP分子が合成されます(図4.7.3)。

呼吸と酸化的リン酸化のプロセスの脱共役 プロトンがミトコンドリアの内膜に浸透し始めるときに発生します。 この場合、pH勾配は横ばいになり、リン酸化の推進力はなくなります。 化学物質-脱共役剤はプロトノフォアと呼ばれ、膜を通してプロトンを運ぶことができます。 これらには以下が含まれます 2,4-ジニトロフェノール、甲状腺ホルモンなど(図4.8.3)。
得られたATPはトランスロカーゼ酵素によってマトリックスから細胞質に移動しますが、1つのADP分子と1つのリン酸分子は反対方向にマトリックスに移動します。 ADPとリン酸の輸送の違反がATPの合成を阻害することは明らかです。
酸化的リン酸化の速度は、主にATPの含有量に依存します。ATPの消費が速いほど、ADPの蓄積が多くなり、エネルギーの必要性が高まります。したがって、酸化的リン酸化のプロセスが活発になります。 細胞内のADP濃度による酸化的リン酸化の速度の調節は呼吸制御と呼ばれます。

章への文学 IV.8。
1. Byshevsky A. Sh。、Tersenov O. A.医師のための生化学//エカテリンブルク:ウラリスキー労働者、1994年、384ページ。
2. Knorre D. G.、Myzina S.D.生化学。 --M 。:高い。 学校 1998、479 pp。;
3.レーニンガーA.生化学。 細胞の構造と機能の分子基盤// M。:Mir、1974、956 p。;
4.プストバロワL.M. 生化学に関するワークショップ// Rostov-on-Don:Phoenix、1999、540 p。;
5. Stepanov V.M.分子生物学。 タンパク質の構造と機能// M。:Vysshaya shkola、1996、335 p。;
地球上に生息するさまざまな生物は、独立栄養生物と従属栄養生物というさまざまなエネルギー源の使用方法が異なる2つの主要なグループに分けることができます。 最初の(オートトロフ)は主に、光合成の過程で太陽の放射エネルギーを直接使用して、無機化合物から有機化合物(炭水化物、アミノ酸、脂肪酸など)を生成することができる緑の植物です。 残りの生物は、既製の有機物質を吸収し、それらをエネルギー源または体を構築するためのプラスチック材料として使用します。 ほとんどの微生物は従属栄養生物でもあることに注意する必要があります。 しかし、彼らは食物粒子全体を吸収することはできません。 それらは、食物物質を分解してそれらを小さくて可溶性の分子に変える特別な消化酵素を環境に分泌し、これらの分子は細胞に浸透します。 代謝の結果、食物と一緒に消費される物質は、細胞の独自の物質と構造に変換され、さらに、体は外部の仕事のためのエネルギーを供給されます。 自己複製、すなわち体の構造と生殖の絶え間ない更新は、生物の代謝の最も特徴的な特徴であり、無生物の代謝とは区別されます。 |
エネルギーの交換と密接に関連している代謝は、生命システムにおける物質とエネルギーの変換の自然な秩序であり、それらの保存と自己複製を目的としています。 F.エンゲルスは、代謝が生命の最も重要な特性であり、生命自体が終了することを指摘しました。 彼はこのプロセスの弁証法的性質を強調し、それを指摘した
ロシアの生理学の創設者であるI.M.セチェノフは、一貫して唯物論的な立場から、生物の生命における代謝の役割を検討しました。 K. A. Timiryazevは一貫して、生物を特徴付ける主な特性は、身体を構成する物質と環境の物質との間の絶え間ない活発な交換であるという考えを追求しました。異化の過程での変化とハイライト。 IPパブロフは、代謝を生命活動の発現の基礎として、身体の生理学的機能の基礎として考えました。 生命過程の化学の知識への重要な貢献は、地球上の生命の出現と発達の過程での代謝の進化の基本的なパターンを研究したAIオパリンによってなされました。
基本的な概念と用語
または、代謝は、生命に必要な物質とエネルギーを体に提供する体内の一連の化学反応です。つまり、自己保存と自己複製です。 自己生殖は、外部から来る物質が生物自体の物質や構造に変化することとして理解され、その結果、組織の継続的な更新、成長、および生殖が行われます。
新陳代謝の分泌物:
- 外部交換-体内に入る途中の物質の細胞外変換と、そこからの代謝産物の排泄が含まれます [見せる]
.
体内への物質の摂取と代謝産物の放出が一緒になって、環境と体の間の物質の交換を構成し、外部交換として定義されます。
物質(およびエネルギー)の外部交換は常に行われています。
細胞や組織の構造要素を構築および更新し、エネルギーを生成するために必要な酸素、水、ミネラル塩、栄養素、ビタミンは、外部環境から人体に入ります。 これらの物質はすべて食品と呼ぶことができ、そのうちのいくつかは生物学的起源(野菜および動物製品)であり、非生物学的(水およびミネラル塩がそれに溶解している)のごく一部です。
食物とともに供給される栄養素は、アミノ酸、単糖、脂肪酸、ヌクレオチド、およびその他の物質の形成によって分解されます。これらの物質は、細胞の構造的および機能的成分の継続的な崩壊の過程で形成される同じ物質と混合して、一般的なものを構成します。体の代謝物の基金。 この資金は2つの方向に使われます。一部は細胞の腐敗した構造的および機能的構成要素を更新するために使用されます。 他の部分は代謝の最終産物に変換され、体から排泄されます。
物質が代謝の最終生成物に崩壊する間に、エネルギーが放出され、成人では1日あたり8,000〜12,000 kJ(2000〜3000 kcal)になります。 このエネルギーは、体の細胞がさまざまな種類の作業を実行したり、体温を一定のレベルに維持したりするために使用されます。
- 中間交換-生体細胞に入った瞬間から最終生成物の形成までの生体細胞内の物質の変換を含みます(たとえば、アミノ酸代謝、炭水化物代謝など)
代謝の段階。 3つの連続した段階があります。
詳細について
- 摂取量(栄養は代謝(環境から体内への物質の摂取)の不可欠な部分です)
- 消化(消化の生化学(栄養素の消化))
- 吸収(消化の生化学(栄養素の吸収))
II。 体内の物質の動きと変換(中間代謝) |
中間代謝(または代謝)-細胞に入った瞬間から代謝の最終生成物の形成への体内の物質の変換、すなわち生細胞で発生し、体に物質とエネルギーを提供する化学反応の全体その重要な活動、成長、再生。 これは新陳代謝の最も難しい部分です。
細胞内に入ると、栄養素は代謝されます-酵素によって触媒される一連の化学変化を受けます。 このような化学変化の特定のシーケンスは代謝経路と呼ばれ、結果として生じる中間生成物は代謝物と呼ばれます。 代謝経路は、代謝マップの形で表すことができます。
| 栄養代謝 | ||
| 炭水化物 | 脂質 | ベルコフ |
炭水化物の異化経路
同化炭水化物経路
|
脂質異化経路
同化脂質経路
|
タンパク質異化経路
同化アミノ酸経路
|
リン脂質の合成経路と一般的な基質のトリアシルグリセロールとの競合により、リン脂質の合成を促進するすべての物質は、組織へのトリアシルグリセロールの沈着を防ぎます。 これらの物質は脂肪親和性因子と呼ばれます。 これらには、リン脂質の構造成分が含まれます:コリン、イノシトール、セリン。 セリンホスファチドの脱炭酸を促進する物質-ピリドキサールリン酸; メチル基供与体-メチオニン; メチル基転移補酵素(THFKおよびメチルコバラミン)の形成に関与する葉酸およびシアノコバラミン。 それらは、組織へのトリアシルグリセロールの過剰な沈着(脂肪浸潤)を防ぐ薬として使用することができます。
|
||
| 表24.人の毎日の代謝(四捨五入された値;体重が約70 kgの成人) | |||
| 物質 | 体内の内容、g | 毎日の消費量、g | 毎日の割り当て |
| O2 | - | 850 | - |
| CO2 | - | - | 1000 |
| 水 | 42 000 | 2200 | 2600 |
| 有機物: | |||
| リス | 15 000 | 80 | - |
| 脂質 | 10 000 | 100 | - |
| 炭水化物 | 700 | 400 | - |
| 核酸 | 700 | - | - |
| 尿素 | - | - | 30 |
| ミネラル塩 | 3 500 | 20 | 20 |
| 合計 | 71 900 | 3650 | 3650 |
体のすべての部分での代謝活動の結果として、血流に入る有害物質が形成され、除去する必要があります。 この機能は腎臓によって実行されます。腎臓は有害物質を分離して膀胱に送り、そこから体から排泄されます。 肝臓、膵臓、胆嚢、腸、汗腺などの他の臓器も代謝の過程に関与しています。
人は尿、糞便、汗、呼気で代謝の主な最終産物であるCO 2、H 2 O、尿素H 2 N-CO-NH2を排出します。 H 2 Oの形で、有機物質の水素が排出され、体は消費するよりも多くの水を放出します(表24を参照)。有機物質の水素と体内で1日あたり約400gの水が生成されます。吸入された空気(代謝水)の酸素。 有機物の炭素と酸素はCO2の形で除去され、窒素は尿素の形で除去されます。
さらに、人は他の多くの物質を放出しますが、少量であるため、体と環境の間の代謝の全体的なバランスへのそれらの寄与はわずかです。 ただし、そのような物質の放出の生理学的重要性は重要である可能性があることに注意する必要があります。 たとえば、薬物を含む外来化合物のヘム分解産物または代謝産物の放出の違反は、重度の代謝障害および身体機能を引き起こす可能性があります。
代謝の基質-食品に含まれる化合物。 それらの中で、2つのグループを区別することができます:主な栄養素(炭水化物、タンパク質、脂質)と少量で来るマイナーな栄養素(ビタミン、ミネラル化合物)。
交換可能な栄養素とかけがえのない栄養素を区別するのが通例です。 体内で合成できない栄養素が不可欠であるため、食物と一緒に供給しなければなりません。
代謝経路-これは、体内の特定の物質の化学的変換の性質と順序です。 変換プロセス中に形成される中間生成物は代謝物と呼ばれ、代謝経路の最後の化合物が最終生成物です。
化学変換は体内で継続的に起こります。 体の栄養の結果として、最初の物質は代謝変換を受けます。 代謝の最終産物は絶えず体から排泄されます。 したがって、生物は熱力学的に開いた化学システムです。 代謝システムの最も単純な例は、単一の分岐していない代謝チェーンです。




-> a-> b-> c-> d->
このようなシステム内の物質の一定の流れにより、各代謝物の形成速度がその消費速度に等しいときに、動的平衡が確立されます。 これは、各代謝物の濃度が一定に保たれることを意味します。 このようなシステムの状態は定常と呼ばれ、この状態の物質の濃度は定常濃度と呼ばれます。
ある瞬間の生物は、定常状態の与えられた定義を満たしていません。 しかし、比較的長期間にわたるそのパラメータの平均値を考慮すると、それらの相対的な不変性に注意することができ、それによって、静止システムの概念を生物に適用することを正当化することができます。 [見せる] .

イチジクに 図64は、分岐していない代謝連鎖の流体力学的モデルを示している。 このデバイスでは、シリンダー内の液柱の高さがそれぞれ代謝物a〜dの濃度をシミュレートし、シリンダー間の接続チューブのスループットが対応する酵素反応の速度をシミュレートします。
システムに入る液体の速度が一定の場合、すべてのシリンダーの液柱の高さは一定のままです。これは定常状態です。
流体の流入速度が増加すると、すべてのシリンダーの流体カラムの高さとシステム全体の流体の流れの速度の両方が増加します。システムは新しい定常状態になります。 同様の移行は、生細胞の代謝過程でも起こります。
代謝物濃度の調節
通常、代謝連鎖には他のすべての反応よりもはるかにゆっくりと進行する反応があります-これは経路の律速段階です。 この図では、このようなステージは、第1シリンダーと第2シリンダーの間の細い接続チューブによってモデル化されています。 律速段階は、出発物質の代謝連鎖の最終生成物への全体的な変換速度を決定します。 多くの場合、制限反応を触媒する酵素は調節酵素です。その活性は、細胞の阻害剤や活性剤の作用下で変化する可能性があります。 このようにして、代謝経路の調節が保証されます。 イチジクに 64第1シリンダーと第2シリンダーの間にダンパーを備えたトランジションチューブは、調節酵素をシミュレートします。ダンパーを上下させることにより、システムを新しい定常状態に移行できます。シリンダー。
分岐代謝システムでは、調節酵素は通常、分岐部位での最初の反応、たとえば図のb-> cおよびb-> iの反応を触媒します。 65.これにより、代謝システムの各分岐の独立した調節の可能性が保証されます。

多くの代謝反応は可逆的です。 生細胞内でのそれらの流れの方向は、その後の反応での生成物の消費、または反応の領域からの生成物の除去、例えば排泄によって決定されます(図65)。
体の状態の変化(食事、休息から運動活動への移行など)に伴い、体内の代謝物の濃度が変化します。つまり、新しい定常状態が確立されます。 ただし、同じ条件下では、たとえば、夜の睡眠後(朝食前)は、すべての健康な人でほぼ同じです。 調節メカニズムの作用により、各代謝物の濃度はその特徴的なレベルに維持されます。 これらの濃度の平均値(変動の限界を示す)は、基準の特性の1つとして機能します。 疾患では、代謝物の定常濃度が変化し、これらの変化は特定の疾患に固有であることがよくあります。 病気の実験室診断の多くの生化学的方法はこれに基づいています。
代謝経路には、同化作用と異化作用の2つの方向があります(図1)。
- 同化反応は、より単純な物質をより複雑な物質に変換し、補酵素、ホルモン、タンパク質、核酸などの細胞の構造的および機能的構成要素を形成することを目的としています。これらの反応は主に還元的であり、遊離化学エネルギーの消費を伴います(エンダーゴニック反応)。 彼らのエネルギー源は異化作用のプロセスです。 さらに、異化作用のエネルギーは、細胞の機能的活動(運動など)を確保するために使用されます。
- 異化変換は、食物に含まれるものと細胞の一部であるものの両方の複雑な分子を単純な成分(二酸化炭素と水)に分割するプロセスです。 これらの反応は通常酸化的であり、自由エネルギーの放出を伴います(発エルゴン反応)。
両生類の方法(デュアル)-異化変換と同化変換が組み合わされたパス、つまり ある化合物の破壊とともに、別の化合物が合成されます。
両性経路は、物質の最終的な酸化システム、つまり最終的な酸化システムに関連しており、大量のエネルギーを形成して最終生成物(CO2およびH2 O)に燃焼します。 それらに加えて、代謝の最終産物は尿素と尿酸であり、これらはアミノ酸とヌクレオチドの交換の特別な反応で形成されます。 概略的には、ATP-ADPシステムを介した代謝と代謝物の両親媒性サイクルの関係を図に示します。 2.2。
ATP-ADPシステム(ATP-ADPサイクル)-ATP分子の継続的な形成が発生するサイクルであり、その加水分解エネルギーはさまざまな種類の仕事で身体によって使用されます。
これはそのような代謝経路であり、その最終生成物の1つは、このプロセスに関与する化合物の1つと同一です(図3)。
アナプレロティックパス-代謝、その最終生成物は、任意の環状経路の中間生成物の1つと同一です。 図の例のアナプレロティックパス。 3は、サイクルに製品Xを補充します(アナプレロティック-補充)。
この例を使用してみましょう。 市内をX、Y、Zブランドのバスが運行しており、その路線を図に示します(図4)。
この例に基づいて、次のように定義します。
- プライベート代謝経路は、特定の化合物(たとえば、炭水化物、脂質、アミノ酸)にのみ特徴的な一連の変換です。
- 一般的な代謝経路は、2つ以上のタイプの化合物(たとえば、炭水化物と脂質、または炭水化物、脂質とアミノ酸)が関与する一連の変換です。
代謝経路の局在
真核生物の異化経路と同化経路は、細胞内での局在が異なります(表22)。
この分裂は、細胞の特定の領域への酵素システムの閉じ込め(区画化)によるものであり、細胞内機能の分離と統合、および適切な制御の両方を提供します。
現在、電子顕微鏡および組織化学的研究、ならびに分画遠心分離の方法のおかげで、酵素の細胞内局在を決定する上で大きな進歩が見られました。 図からわかるように。 74、細胞内では、細胞膜または原形質膜、核、ミトコンドリア、リソソーム、リボソーム、小胞体および小胞のシステム-小胞体、層状複合体、さまざまな液胞、細胞内封入体などを見つけることができます。細胞の細胞質の未分化部分は、硝子体(またはサイトゾル)です。
RNAポリメラーゼ、すなわち、mRNAの形成を触媒する酵素は、核(より正確には核小体)に局在することが確立されている。 核には、DNA複製のプロセスに関与する酵素やその他の酵素が含まれています(表23)。

| 表23.細胞内のいくつかの酵素の局在 | |
| サイトゾル | 解糖系の酵素 ペントース経路の酵素 アミノ酸活性化酵素 脂肪酸合成のための酵素 ホスホリラーゼ グリコーゲンシンターゼ |
| ミトコンドリア | ピルビン酸デヒドロゲナーゼ複合体 クレブス回路酵素 脂肪酸酸化サイクルの酵素 生物学的酸化および酸化的リン酸化の酵素 |
| リソソーム | 酸性加水分解酵素 |
| ミクロソーム画分 | タンパク質合成のリボソーム酵素 リン脂質、トリグリセリドの合成のための酵素、およびコレステロールの合成に関与する多くの酵素 ヒドロキシラーゼ |
| 原形質膜 | アデニル酸シクラーゼ、Na + -K +依存性ATPアーゼ |
| 芯 | DNA複製に関与する酵素RNAポリメラーゼNADシンテターゼ |
酵素と細胞構造の関係:
- ミトコンドリア。 ミトコンドリアは、生物学的酸化鎖(組織呼吸)および酸化的リン酸化の酵素、ならびにピルビン酸デヒドロゲナーゼ複合体、トリカルボン酸サイクル、尿素合成、脂肪酸酸化などの酵素に関連しています。
- リソソーム。 リソソームは主に5の領域で最適なpHを持つ加水分解酵素を含んでいます。これらの粒子がリソソームと呼ばれるのは酵素の加水分解的所属のためです。
- リボソーム。 タンパク質合成の酵素はリボソームに局在し、mRNAの翻訳とアミノ酸のポリペプチド鎖への結合がこれらの粒子で起こり、タンパク質分子が形成されます。
- 小胞体。 小胞体には、脂質合成酵素と、ヒドロキシル化反応に関与する酵素が含まれています。
- 原形質膜。 Na +およびK +を輸送するATP-ase、アデニル酸シクラーゼ、および他の多くの酵素は、主に原形質膜に関連しています。
- サイトゾル。 解糖系の酵素、ペントースサイクル、脂肪酸とモノヌクレオチドの合成、アミノ酸の活性化、および糖新生の多くの酵素が細胞質ゾル(硝子体質)に局在しています。
テーブルの中。 23は、さまざまな細胞内構造における最も重要な酵素の局在と個々の代謝ステップに関するデータをまとめたものです。
多酵素システムは、各酵素が特定の一連の反応で次の酵素に近接して配置されるように、オルガネラの構造に局在しています。 これにより、中間反応生成物の拡散に必要な時間が短縮され、反応のシーケンス全体が時間と空間で厳密に調整されます。 これは、例えば、ピルビン酸および脂肪酸の酸化、タンパク質合成、ならびに電子伝達および酸化的リン酸化酵素に関与する酵素に当てはまります。
コンパートメント化により、化学的に不適合な反応が同時に発生することも保証されます。 異化作用と同化作用の経路の独立。 したがって、細胞内では、長鎖脂肪酸のアセチルCoAの段階への酸化と、反対方向のプロセス、つまりアセチルCoAからの脂肪酸の合成が同時に発生する可能性があります。 これらの化学的に不適合なプロセスは、細胞のさまざまな部分で発生します。脂肪酸の酸化はミトコンドリアで発生し、ミトコンドリア外での合成は硝子体で発生します。 これらの経路が一致し、プロセスの方向のみが異なる場合、交換でいわゆる無益または無益回路が発生します。 このようなサイクルは、代謝物の無用な循環が可能である病理学で起こります。
さまざまなクラスの植物、動物、微生物における代謝の個々の関連性を解明することで、生きている自然における生化学的変換の経路の基本的な共通性が明らかになります。
代謝の規制の基本的な規定
細胞レベルおよび細胞内レベルでの代謝の調節が行われる
- 酵素の合成と触媒活性を調節することによって。
これらの規制メカニズムは
- 代謝経路の最終産物による酵素合成の抑制、
- 基質による1つまたは複数の酵素の合成の誘導、
- すでに存在する酵素分子の活性の調節、
- 細胞への代謝物の侵入速度の調節。 ここでの主な役割は、原形質と核を取り巻く生体膜、ミトコンドリア、リソソーム、およびそこにある他の細胞内小器官に属しています。
- ホルモンの合成と活性を調節することによって。 したがって、タンパク質代謝は甲状腺ホルモン(チロキシン、脂肪代謝)、膵臓と甲状腺のホルモン、副腎腺と下垂体腺、炭水化物代謝、膵臓(インスリン)と副腎腺(アドレナリン)のホルモンの影響を受けます。 ホルモンの作用機序における特別な役割は、サイクリックヌクレオチド(cAMPおよびcGMP)に属します。
動物と人間では、代謝のホルモン調節は神経系の協調活動と密接に関連しています。 炭水化物代謝に対する神経系の影響の例は、高血糖と糖尿につながるクロード・ベルナールによるいわゆる砂糖注射です。
- 代謝の統合のプロセスで最も重要な役割は大脳皮質に属しています。 IP Pavlovが指摘したように、「動物の神経系が完全であるほど、それはより集中化され、その部門はますますその生物のすべての活動の管理者および配布者になります...このより高い部門にはその管轄区域では、身体で発生するすべての現象」。
したがって、特別な組み合わせ、厳密な一貫性、および集合体の代謝反応の速度は、フィードバックメカニズムの特性(正または負)を明らかにするシステムを形成します。

中間代謝を研究するための方法
代謝を研究するために2つのアプローチが使用されます:
- 全身研究(invivo実験) [見せる]
私たちの世紀の初めに行われた生物全体の研究の典型的な例は、Knoopの実験です。 彼は脂肪酸が体内で分解する方法を研究しました。 これを行うために、Knoopは、メチル基の1つの水素原子がフェニルラジカルC 6 H 5に置き換えられた、偶数(I)および奇数(II)の炭素原子を持つさまざまな脂肪酸を犬に与えました。
最初のケースでは、フェニル酢酸C 6 H 5 -CH 2 -COOHが常に犬の尿中に排泄され、2番目のケースでは安息香酸C 6 H 5-COOHが排泄されました。 これらの結果に基づいて、Knoopは、体内の脂肪酸の分解は、カルボキシル末端から始まる2つの炭素フラグメントの連続的な除去によって発生すると結論付けました。
CH 3 -CH 2- | -CH 2 -CH 2- | -CH 2 -CH 2- | -CH 2 -CH 2- | -CH 2 -COOH
この結論は、後で他の方法で確認されました。
本質的に、これらの研究では、Knoopは分子を標識する方法を適用しました。彼は、体内で変化を受けないフェニルラジカルを標識として使用しました。 XX世紀の40年代頃から始まります。 分子に元素の放射性または重い同位体が含まれている物質の使用が広まっています。 たとえば、放射性炭素(14 C)を含むさまざまな化合物を実験動物に与えると、コレステロール分子のすべての炭素原子が酢酸塩の炭素原子に由来することがわかりました。

通常、体内に広く分布している元素(通常は重い同位体)とは質量が異なる元素の安定同位体または放射性同位体のいずれかが使用されます。 安定同位体のうち、質量2の水素同位体(重水素、2 N)、質量15の窒素(15 N)、質量13の炭素(13 C)、質量18の酸素(18 C) )が最も頻繁に使用されます。 放射性同位元素のうち、水素同位体(トリチウム、3 H)、リン(32Pおよび33P)、炭素(14 C)、硫黄(35 S)、ヨウ素(131 I)、鉄(59 Fe)、ナトリウム(54 Na)など。
研究中の化合物の分子を安定同位体または放射性同位体でマークし、それを体内に導入すると、それらを含む標識原子または化学基が決定され、特定の化合物でそれらを発見した後、変換の経路について結論が出されます体内の標識物質の。 同位体ラベルの助けを借りて、体内の物質の滞留時間を確立することもできます。これは、既知の近似で、生物学的半減期、つまり、同位体または標識された化合物の量を特徴付ける時間です。半減期、または個々の細胞の膜の透過性に関する正確な情報を取得するために。 同位体は、特定の物質が別の化合物の前駆体または崩壊生成物であるかどうかを判断するため、および組織の再生速度を判断するためにも使用されます。 最後に、いくつかの代謝経路がある場合、それらのどれが優勢であるかを決定することが可能です。
生物全体の研究では、体の栄養素の必要性も研究されています。食事から物質を排除することが体の成長と発達または生理学的機能の侵害につながる場合、この物質は不可欠な栄養素です。 必要な栄養素の量も同様の方法で決定されます。
- 体の孤立した部分に関する研究-分析分解法(invitro実験、つまり体外、試験管または他の実験容器内)。 これらの方法の原理は、個々のプロセスを分離するために、複雑な生物学的システムを徐々に単純化すること、またはむしろ崩壊させることです。 これらの方法を降順、つまり、より複雑なシステムからより単純なシステムへと考えると、次の順序で配置できます。
- 個々の臓器の除去 [見せる]
臓器が除去されると、2つの研究対象があります。臓器が除去されていない生物と孤立した臓器です。
孤立した臓器。 物質の溶液が隔離された臓器の動脈に注入され、物質が静脈から流れる流体で分析される場合、この物質が臓器でどのような変化を起こすかを確認することができます。 たとえば、このようにして、肝臓がケトン体と尿素の形成の主な部位であることがわかっています。
同様の実験は、体から隔離されることなく臓器で実行できます(動静脈差法)。これらの場合、臓器の動脈と静脈に挿入されたカニューレを使用するか、注射器を使用して分析のために血液を採取します。 このようにして、例えば、骨格筋から流れる血液では乳酸濃度が上昇し、肝臓を流れる血液では乳酸が遊離することが確認できます。
- 組織切片法 [見せる]
切片は、ミクロトームまたはかみそりの刃だけを使用して作られた薄い組織片です。 切片は、栄養素(グルコースまたはその他)と物質を含む溶液中で培養され、このタイプの細胞での変換が決定されます。 インキュベーション後、インキュベーション液中の試験物質の代謝産物を分析します。
組織切片法は、1920年代初頭にWarburgによって最初に提案されました。 この技術を使用して、組織の呼吸(組織による酸素消費と二酸化炭素放出)を研究することが可能です。 組織切片を使用する場合の代謝の研究における重要な制限は細胞膜であり、これは細胞の内容物と「栄養素」溶液との間の障壁として機能することが多い。
- ホモジネートおよび細胞内画分 [見せる]

ホモジネートは無細胞製剤です。 それらは、砂で組織をこすることによって細胞膜を破壊することによって、または特別な装置-ホモジナイザーで得られます(図66)。 ホモジネートでは、添加された基質と酵素の間に不浸透性の障壁はありません。
細胞膜の破壊は、細胞の内容物と添加された化合物の間の直接接触を可能にします。 これにより、研究中のプロセスにとってどの酵素、補酵素、基質が重要であるかを確認することができます。
ホモジネートの分画。細胞内粒子は、超分子(細胞小器官)と個々の化合物(酵素および他のタンパク質、核酸、代謝物)の両方のホモジネートから単離することができます。 たとえば、核、ミトコンドリア、およびミクロソームの画分は、分画遠心分離を使用して取得できます(ミクロソームは小胞体の断片です)。 これらのオルガネラはサイズと密度が異なるため、異なる遠心分離速度で沈殿します。 単離された細胞小器官の使用は、それらに関連する代謝過程を研究することを可能にします。 たとえば、単離されたリボソームはタンパク質合成の経路とメカニズムを研究するために使用され、ミトコンドリアはクレブス回路または呼吸酵素の連鎖の酸化反応を研究するために使用されます。
ミクロソームの沈降後、細胞の可溶性成分は上澄み液に残ります-可溶性タンパク質、代謝物。 これらの各画分は、それらの構成成分を分離して、さまざまな方法でさらに分画することができます。 単離された成分から、例えば、単純な「酵素+基質」システムおよびタンパク質および核酸の合成のためのシステムなどの複雑なシステムなどの生化学的システムを再構築することが可能である。
- 酵素、補酵素、その他の反応成分を使用した、invitroでの酵素システムの部分的または完全な再構築 [見せる]
高度に精製された酵素と補酵素を統合するために使用。 例えば、この方法の助けを借りて、酵母発酵のすべての本質的な特徴を備えた発酵システムを完全に再現することが可能になりました。
- 個々の臓器の除去 [見せる]
もちろん、これらの方法は、生物全体の機能を理解するという究極の目標を解決するために必要なステップとしてのみ価値があります。
人間の生化学を研究することの特徴
地球に生息するさまざまな生物の分子過程には、広範囲にわたる類似点があります。 マトリックス生合成、エネルギー変換のメカニズム、物質の代謝変換の主な方法などの基本的なプロセスは、細菌から高等動物までの生物でほぼ同じです。 したがって、大腸菌を用いて実施された研究の結果の多くは、ヒトに適用可能です。 種の系統発生関係が大きいほど、それらの分子プロセスでより一般的です。
人間の生化学に関する知識の大部分は、このようにして得られます。他の動物の既知の生化学的プロセスに基づいて、人体におけるこのプロセスの最も可能性の高いバリアントについて仮説が立てられ、その後、仮説は次の直接研究によってテストされます。人間の細胞と組織。 このアプローチにより、人間から得られた少量の生物学的物質の研究を行うことが可能になります。 ほとんどの場合、外科手術中に除去された組織、血液細胞(赤血球および白血球)、ならびにインビトロ培養で増殖したヒト組織細胞が使用されます。
効果的な治療法の開発に必要なヒトの遺伝性疾患の研究は、同時に人体の生化学的プロセスに関する多くの情報を提供します。 特に、酵素の先天性欠損は、体内でのその基質の蓄積につながります。 このような代謝障害の研究では、新しい酵素や反応が発見されることがありますが、量的には重要ではありません(そのため、標準を研究するときに気づかれませんでした)が、これは非常に重要です。
細胞内ではさまざまな化学反応が絶えず発生し、代謝経路を形成します。つまり、ある化合物から別の化合物への連続的な変換です。 代謝-体の細胞で発生するすべての代謝経路の全体。
体内で発生するすべての代謝経路の中で、反対方向のプロセスが区別されます:異化作用と同化作用。 異化-エネルギーの放出により、複雑な物質を単純な物質に分解します。
同化作用-より単純でより複雑な物質からの合成。 代謝経路は、流れの場所、時間、強度において互いに調整されています。 すべてのプロセスにおけるこの一貫性は、複雑で多様な規制メカニズムによって保証されています。
代謝経路への化学反応の組織化
ある代謝経路の反応を触媒する酵素の最適な活性は、細胞内の特定の空間的組織化によって達成されます。
- 酵素の空間的局在
ほとんどの酵素は細胞内に局在しており、体内に不均一に分布しています。 原則として、同じ代謝経路のすべての酵素は、細胞の一部に位置しています。 特に代謝経路の分離は、反対方向の異化および同化プロセスにとって重要です。 たとえば、脂肪酸の合成は細胞質で起こり、脂肪酸の分解はミトコンドリアで起こります。 そのような分離が存在しなかった場合、機能的かつエネルギー的な観点からは役に立たない経路が形成されます。
代謝経路では、最初の酵素反応の生成物が2番目の基質として機能し、最終生成物が形成されるまで続きます。 代謝経路中間体は、反応シーケンスから放出され、他の代謝経路で使用されます。 代謝経路は中間生成物によって相互接続されています。
多くの場合、酵素の空間的構成は非常に顕著であるため、いかなる状況でも反応生成物を代謝経路から分離することはできず、必然的に次の反応の基質として機能します。 代謝経路のこの組織はと呼ばれます 多酵素複合体酵素の構造的および機能的組織化の結果として生じます。 通常、このような複合体は膜に関連しています。 多酵素複合体の例には、ピルビン酸(ピルビン酸)の酸化的脱炭酸が起こるピルビン酸デヒドロゲナーゼ複合体(セクション6を参照)、パルミチン酸の合成を触媒する脂肪酸シンターゼ(セクション8を参照)が含まれます。
- 代謝経路の構造
細胞内の代謝経路の構造は非常に多様です。
一連の酵素プロセスの結果として基質が1つの生成物に変換される場合、この経路はと呼ばれます 線形代謝経路。 多くの場合、細胞のニーズに応じてさまざまな最終産物の合成につながる分岐代謝経路があります。
異なる細胞の酵素組成は同じではありません。 細胞の生命維持の機能を実行する酵素は、体のすべての細胞に見られます。 細胞分化の過程で、細胞の酵素組成に変化が起こります。 このように、尿素の合成に関与する酵素アルギナーゼは肝細胞にのみ見られ、オルトリン酸モノエステルの加水分解に関与する酸性ホスファターゼは前立腺細胞に見られます。 これらはいわゆる 臓器特異的酵素.
細胞は、その生命維持を調節する複雑な機能システムです。 細胞機能の多様性は、特定の代謝経路の空間的および時間的(主に栄養のリズムに応じて)調節によって提供されます。 空間的調節は、さまざまな細胞小器官における特定の酵素の厳密な局在化に関連しています。 したがって、核には、DNAおよびRNA分子の合成に関連する酵素があり、細胞質には解糖酵素、リゾソームには加水分解酵素、ミトコンドリアマトリックスにはTCA酵素、ミトコンドリアの内膜には電子の酵素があります輸送チェーンなど
代謝経路の調節の原理
細胞内のすべての化学反応は、酵素の関与によって進行します。 したがって、代謝経路の速度に影響を与えるには、酵素の量または活性を調節するだけで十分です。 通常、代謝経路には、経路全体の速度を調節する重要な酵素があります。 これらの酵素(代謝経路の1つ以上)はと呼ばれます 調節酵素;それらは、原則として、代謝経路の初期反応、不可逆反応、律速反応(最も遅い反応)、または代謝経路の切り替え点(分岐点)での反応を触媒します。
酵素反応の速度の調節は、3つの独立したレベルで実行されます。
- 酵素分子の数の変化;
- 基質および補酵素分子の利用可能性;
- 酵素分子の触媒活性の変化。
- 酵素分子数の調節
檻の中。
細胞内のタンパク質は絶えず更新されていることが知られています。 細胞内の酵素分子の数は、2つのプロセスの比率によって決定されます-酵素タンパク質分子の合成と崩壊:

タンパク質の合成と折り畳みは多段階のプロセスです。 タンパク質合成の調節は、タンパク質分子の形成のどの段階でも起こり得る。 特定の代謝物、ホルモン、および多くの生物学的に活性な分子によって実行される、転写レベルでのタンパク質分子の合成の調節のメカニズムが最も研究されています。
酵素の分解に関しては、このプロセスの調節はあまり研究されていません。 これは単なるタンパク質分解(タンパク質分子の破壊)のプロセスではなく、おそらく遺伝子レベルで決定される複雑なメカニズムであると推測することしかできません。
- 酵素の速度調節
基質分子の利用可能性による反応
と補酵素。
代謝経路の流れを制御する重要なパラメーターは、基質の存在であり、主に最初の基質の存在です。 初期基質の濃度が高いほど、代謝経路の速度が高くなります。
代謝経路の経路を制限する別のパラメーターは、再生された補酵素の存在です。 たとえば、脱水素反応では、デヒドロゲナーゼの補酵素は酸化型のNAD +、FAD、FMNであり、反応中に還元されます。 補酵素が再び反応に関与するためには、それらの再生が必要です。 酸化型への変換。
- 触媒活性の調節
酵素
所与の代謝経路の1つまたは複数の重要な酵素の触媒活性の調節は、代謝経路の速度を変化させる上で重要な役割を果たします。 これは、代謝を調節するための非常に効果的で迅速な方法です。
酵素の活性を調節する主な方法:
- アロステリック調節;
- タンパク質間相互作用による調節;
- 酵素分子のリン酸化/脱リン酸化による調節;
- 部分的な(限定された)タンパク質分解による調節。
アロステリック調節。 アロステリック酵素は、基質分子の数だけでなく、他の物質によっても活性が調節されている酵素です。 エフェクター。アロステリック調節に関与するエフェクターは、多くの場合、それらが調節する経路そのものの細胞代謝物です。
代謝経路の調節には3種類のメカニズムが関与しています。 状況の変化に最も迅速に反応する最初のものは、アロステリック酵素の作用に関連しており(図13-15)、その触媒活性は、刺激性または刺激性を有する特殊な物質の影響下で変化する可能性があります抑制効果(それらはエフェクターまたはモジュレーターと呼ばれます;セクション9.18)。
原則として、アロステリック酵素は、特定の多酵素シーケンスの最初または最初の近くの場所を占め、その段階を触媒します。これにより、プロセス全体の速度が制限されます。 通常、そのような段階の役割は、ほとんど不可逆的な反応によって果たされます。
米。 13-15。 フィードバックのタイプによる、すなわちこのプロセスの最終生成物によるアロステリック酵素の阻害による異化経路の調節。 文字J、K、Lなどは、この代謝経路の中間生成物を示し、文字E1、E2、E3などは、個々のステップを触媒する酵素を示します。 最初のステップは、この反応シーケンスの最終生成物によって阻害されるアロステリック酵素(ED)によって触媒されます。アロステリック阻害は、阻害代謝物をアロステリック酵素によって触媒される反応に接続する赤い破線の矢印で示されます。
ADPからのATPの合成を伴う異化プロセスでは、この最終生成物であるATPは、異化作用の初期段階の1つのアロステリック阻害剤として機能することがよくあります。 同化作用の初期段階の1つのアロステリック阻害剤は、多くの場合、生合成の最終産物であり、たとえば、いくつかのアミノ酸です(セクション9.18)。 一部のアロステリック酵素の活性は、特定の正のモジュレーターによって刺激されます。 異化反応配列の1つを調節するアロステリック酵素は、例えば、正のモジュレーター-ADPまたはAMPの刺激効果および負のモジュレーター-ATPの阻害効果の影響を受ける可能性があります。 ある代謝経路のアロステリック酵素が特定の方法で他の代謝経路の中間生成物または最終生成物に反応する場合も知られています。 これにより、さまざまな酵素システムの作用速度を調整することが可能になります。
高等生物の代謝を調節する2番目のタイプのメカニズムはホルモン調節です(図13-16)。 ホルモンは、さまざまな内分泌腺によって生成され、血液中に直接放出される特殊な化学物質(化学的な「中間体」)と呼ばれます。 それらは血液によって他の組織や器官に運ばれ、ここで特定の種類の代謝活動を刺激または阻害します。 たとえば、ホルモンのアドレナリンは副腎髄質から分泌され、血液によって肝臓に運ばれ、そこでグリコーゲンのブドウ糖への分解を刺激し、血糖値を上昇させます。 さらに、アドレナリンは骨格筋のグリコーゲンの分解を刺激します。 このプロセスは、乳酸の形成とATPの形でのエネルギーの貯蔵につながります。 アドレナリンは、筋肉や肝臓の細胞の表面にある特定の受容体部位に付着することで、これらの効果を引き起こします。
アドレナリンの結合はシグナルとして機能します。 この信号は細胞の内部に伝達され、ここで共有結合修飾を引き起こします。その影響下で、グリコーゲンホスホリラーゼ(グリコーゲンのグルコースおよび他の生成物への変換を触媒するシステムの最初の酵素;セクション9.22)が活性の低い形態から活性の高い形態へ(図13-16)。
代謝を調節する3番目のタイプのメカニズムは、細胞内のこの酵素の濃度の変化に関連しています。 任意の時点での酵素の濃度は、その合成と崩壊の速度の比率によって決定されます。 特定の条件下でのいくつかの酵素の合成速度は劇的に増加します。 細胞内のこの酵素の濃度もそれに応じて増加します。 たとえば、動物が炭水化物が豊富でタンパク質が少ない食事をとった場合、肝臓では、通常の条件下でアミノ酸のアセチルCoAへの分解を触媒する酵素の含有量が非常に低くなります。 これらの酵素は、このような食事では実際には必要ないため、大量に生産されることはありません。 しかし、動物をたんぱく質が豊富な食事に移すことは価値があり、肝臓で1日以内に酵素の含有量が著しく増加し、消化可能なアミノ酸の分解に必要になります。

米。 13-16。 酵素反応のホルモン調節。 肝臓細胞の表面にある特定の受容体にホルモンアドレナリンが付着した結果、膜に結合した酵素(アデニル酸シクラーゼ)が関与して環状アデニル酸が形成されます。 後者はアロステリックアクチベーターまたは細胞内メディエーターとして機能し、その作用下でグリコーゲンホスホリラーゼが不活性型から活性型に変化し、肝臓グリコーゲンの血糖への変換を促進します。 この代謝経路については、Chapで詳しく説明されています。 25。

米。 13-17。 酵素誘導。 基質Aの細胞内濃度が高いと、酵素E1、E2、およびE3の生合成を刺激する可能性があります。 細胞内のこれらの酵素の含有量が増加するため、これらの反応を加速することが可能であり、その結果、過剰な基質Aが除去されます。 したがって、過剰な基質Aは細胞核のシグナルとして機能し、酵素El、E2、およびE3の形成を制御する遺伝子を「オン」にするように強制します。 遺伝子を含めることは、対応するメッセンジャーRNAの合成を意味します。 それはリボソームに入り、その結果、酵素E1、E2、E3の合成がリボソームで行われます。
したがって、肝細胞は、それらに入る栄養素の性質に応じて、特定の酵素の生合成をオンまたはオフにする機能を持っています。 この現象は酵素誘導と呼ばれます(図13-17)。
セクション21.アロステリック変調
アロステリック調節では、調節酵素はその構造内に1つまたは複数のアロステリック中心を持ち、アロステリックモジュレーターとして低分子量化合物と高度に選択的に相互作用することができます。 この相互作用の結果として、タンパク質-酵素のコンフォメーションが変化します。これには、触媒作用の効率の変化を伴う、活性中心の構造の変化が含まれます。 この場合、酵素の触媒活性が高まると、アロステリック活性化を処理します。 酵素の活性が低下した場合、アロステリック阻害について話します。 酵素のアロステリック中心へのアロステリックモジュレーターの結合は、弱い相互作用が原因で発生します。したがって、簡単に元に戻すことができます。環境内のモジュレーターの濃度が低下すると、酵素-モジュレーター複合体が解離し、酵素がその元のコンフォメーションと、その結果としてのその触媒活性。
細胞内のアロステリックモジュレーターとして、通常、1つまたは別の代謝経路の中間代謝物または最終生成物が作用します。 アロステリック調節の最も一般的な変種は、逆抑制または負のフィードバック抑制として知られています。 この場合、代謝経路の最終産物は、アロステリックメカニズムによって、同じ代謝経路の初期反応の1つを触媒する調節酵素の活性を阻害します。これは、プリンまたはピリミジンヌクレオチドは細胞内で調節されています。
アロステリック調節の2番目の変形として、前駆体活性化のメカニズムを引用することができます。 この場合、代謝経路の開始時に形成される中間代謝物の1つは、1つまたは別の酵素のアロステリック活性化因子として機能し、同じ代謝経路の最終反応の1つを触媒します。 一例は、グルコースの酸化的分解の代謝経路におけるフルクトース-1,6-ビスリン酸によるピルビン酸キナーゼの活性化です。
もちろん、同じ代謝経路の中間または最終代謝物が調節酵素のアロステリックモジュレーターとして作用する必要はまったくありません。 アロステリックモジュレーターが別の代謝経路で形成される化合物である場合、結合されたアロステリックモジュレーションの多くの例があります。 したがって、細胞内のATPの蓄積は、呼吸酵素の鎖の酸化的リン酸化の間に形成され、アロステリックメカニズムによって解糖系酵素ホスホラクトキナーゼの活性を阻害し、トランス脱アミノ化からの酵素グルタミン酸デヒドロゲナーゼの活性を阻害しますシステム、およびクレブス回路酵素のイソクエン酸デヒドロゲナーゼの活性を阻害します。 このような代謝経路の間で、1つまたは別のレベルの機能的関係を追跡できることに注意する必要があります。 前に示した例では、3つの代謝プロセスすべてが、それらの機能が細胞内でのATPの生成に直接関連しているという事実によって相互に関連しています。 セルに利用可能なエネルギーを提供します。
2.共有結合による修飾
共有結合修飾は、酵素の調節中心にある共有結合の助けを借りて原子基を結合するか、この基を分割することによって、酵素の活性を調節するためのメカニズムです。 共有結合による酵素への追加の基の結合は、タンパク質-酵素のコンフォメーションの変化をもたらし、これは、活性中心の構造の変化および触媒作用の効率の変化を伴う。 この基の開裂は、酵素の初期コンフォメーションの回復を確実にし、その結果、その触媒活性の初期レベルに戻ることを保証します。 そのような修飾基は、アデニル酸残基、グリコシル残基であり得るが、ほとんどの場合、リン酸化は、リン酸残基の付加である。 酵素とモジュレーター基の間の共有結合の形成または切断は共有結合修飾中に起こるため、このメカニズムの効果的な操作には2つの追加の酵素が必要です。1つの酵素がモジュレーター基の調節酵素への結合を保証します。 2番目の酵素はこのグループの除去を確実にします。 明らかに、これらの追加の酵素は、調節酵素のポリペプチド鎖の厳密に定義されたアミノ酸残基へのモジュレーター基の結合、ならびにその選択的切断を確実にする。 そのような調節メカニズムの働きの例は、そのリン酸化によるグリコーゲンホスホリラーゼの活性化、そのアデニル化によるグルタミン酸デヒドロゲナーゼの活性化、そのリン酸化の結果としてのピルビン酸デヒドロゲナーゼ複合体の活性の低下、およびグリコーゲンシンテターゼの活性の低下である。そのリン酸化によって。 その共有結合修飾による酵素活性の調節の完全なサイクルは、肝細胞グリコーゲンホスホリラーゼの例によって説明することができます。
3.タンパク質間相互作用
現代の概念によれば、個々の代謝経路の酵素は、ほとんどの場合、細胞内で結合されて、代謝物の多酵素複合体になります。 そのような代謝物の組成において、各酵素は、この代謝経路の1つまたは複数の酵素と接触している。 したがって、コンフォメーション、したがって個々の酵素の触媒活性は、それに接触している他の酵素の状態に依存します。 したがって、例えばアロステリックモジュレーターの添加によって引き起こされる、メタボロンの一部である調節酵素の触媒活性の変化は、他のメタボロン酵素の活性の変化を伴うであろう。超分子タンパク質複合体の組成のコンフォメーションも特定の変化を受けます。 細胞と細胞外液には、酵素タンパク質と相互作用してそれらの活性を調節できるタンパク質が含まれています。 これらのタンパク質はモジュレータータンパク質と呼ばれます。
したがって、血漿リポタンパク質には、アポ-C-IIおよびアポ-C-Iアポタンパク質が含まれ、これらは、酵素リポタンパク質リパーゼおよびレシチンコレステロールアシルトランスフェラーゼとそれぞれ相互作用して、それらの活性を増加させる。 血漿中には、血液凝固系トロンビンの酵素と相互作用して後者を不活性化するタンパク質調節剤アンチトロンビン-IIIもあります。
細胞内モジュレータータンパク質の例はカルモジュリンです。 さまざまな臓器や組織の細胞の細胞質ゾルに遊離の不活性状態で存在します。 細胞質ゾル中のCa2 +イオンの濃度が増加すると、Ca-カルモジュリン複合体が形成され、カルモジュリンのコンフォメーションが変化し、Ca-カルモジュリン複合体はさまざまな細胞内酵素と相互作用する能力を獲得します。 この相互作用の間に、タンパク質-酵素のコンフォメーションが変化し、その結果、その触媒活性が変化します。 細胞質ゾル中のCa2 +濃度が低下すると、Ca-カルモジュリン複合体が分解し、分子のコンフォメーションの変化により、遊離カルモジュリンが酵素に対する親和性を失います。 その結果、酵素が複合体から放出され、その触媒活性が元のレベルに戻ります。 この方法は、グアニル酸シクラーゼ、環状ヌクレオチドのホスホジエステラーゼ、ピルビン酸カルボキシラーゼ、NADキナーゼなどの酵素の触媒活性を調節します(次のページの図を参照)。
4.細胞内の酵素活性の調節における競合的および非競合的阻害の役割
細胞内の酵素活性の調節メカニズムのこれらの変異体は、非常にまれにしか使用されません。 細胞内で自身の代謝を調節するために使用される競合阻害の例は、同じ代謝の中間生成物である高濃度のオキサロ酢酸またはリンゴ酸によるトリカルボン酸回路のコハク酸デヒドロゲナーゼ酵素の活性の阻害であると考えられています。小道。 この代謝経路が機能するミトコンドリアマトリックス中のそれらの濃度の減少は、阻害を取り除きます。 規制効果は可逆的です。
薬物は多くの場合、さまざまな酵素の競合的または非競合的阻害剤であることに留意する必要があります。 したがって、痛風の治療に使用される薬物アロプリノールは、尿酸合成の代謝経路の最終段階で細胞内で作用する酵素キサンチンオキシダーゼの典型的な競合阻害剤です。 この酵素の活性が低下すると、血液や組織の尿酸濃度が低下し、痛風の特徴である組織内の尿酸結晶の再沈着が防止されます。
急性心不全の治療に使用される薬剤ストロファンチンGは、心筋細胞の外細胞膜のK、Na-ATPaseの非競合的阻害剤です。 この薬の治療効果は、この膜酵素の活性の補正の結果として、心筋細胞の内部環境のイオン組成の正常化によるものであるという意見があります。
細胞内に存在する多くの酵素の中で、すべてが調節しているわけではありません。 ただし、ほとんどすべての代謝経路には、1つまたは別の代謝経路に沿った代謝物の流れの強度を制御する1つ以上(2つ、場合によっては3つ)の酵素が含まれています。 これらの酵素は通常、熱力学的に不可逆的な反応を触媒します。 それらは多くの場合、特定の代謝経路内のすべての酵素の中で最も低い触媒活性を持ち、したがってその代謝経路全体に沿った物質の流量を制御する酵素です。 それらは通常、特定の代謝経路の最初の反応の1つを触媒し、酵素活性が低下したときに細胞内の代謝経路中間体の蓄積を防ぎます。 この種の酵素は、代謝経路に沿った代謝物の流れを制御し、規制の影響に対する活性の変化に応答することができ、「キー酵素」と呼ばれます。 「ペースメーカー酵素」と呼ばれることもあります。 そのような酵素の例は、アスパラギン酸カルバモイルトランスフェラーゼ(ピリミジンヌクレオチドの合成のための代謝経路)、ホスホフルクトキナーゼ(解糖)、またはイソクエン酸デヒドロゲナーゼ(クレブストリカルボン酸回路)である。
5.細胞膜を通過する物質の移動
細胞は、膜透過性の変化を利用して、外膜とその個々の区画を分離する膜の両方の透過性を含む、その代謝を調節することができます。 したがって、1つまたは別の代謝経路の基質の濃度(たとえば、ミトコンドリアマトリックスから来る高級脂肪酸の合成のためのサイトゾル中のアセチルCoAの濃度)と1つの細胞区画から来る補因子の濃度の両方もう1つ(たとえば、細胞質ゾルからミトコンドリアマトリックスへのADP)。
細胞膜を通過する物質の移動は、3つの主要なタイプのプロセスを通じて実行できます。
a)単純拡散、
b)促進拡散、
c)能動輸送。
単純拡散の強度、すなわち 脂質二重層または脂質二重層のチャネルを介した濃度勾配に沿った膜を横切る物質の移動は、第一に、膜のコンフォメーション状態またはその微小粘度を変化させることによって、そして第二に、伝達された代謝物の濃度を変化させることによって調節される。膜の反対側に。 膜の状態は、その組成を変えることによって、例えば、膜中のコレステロール含有量を変えることによって変えることができ、膜に対する代謝産物の濃度勾配を変えることは、その産生または細胞の1つでの使用によって変えることができる。コンパートメント。
付与された拡散の規制、すなわち キャリアの関与による濃度勾配に沿った膜を横切る物質の移動は、前述の要因の作用と、膜内のキャリアの含有量の変化または2つの新しいメカニズムの両方によって実行されます。既存のキャリアの状態の機能状態の変化。 したがって、インスリンがこのホルモンの受容体を持つ細胞に作用すると、外膜のグルコース担体タンパク質の数が増加します。 能動輸送の強度の変化、すなわち エネルギーコストに伴う濃度勾配に逆らって担体が関与する膜を介した物質の移動は、第一に、促進拡散のプロセスを調節するメカニズムの動作により、第二に、量の変化により発生します。利用可能なエネルギーの。 次に、エネルギーは、ATPエネルギー輸送のメカニズムを提供することによって、またはセルによって作成された膜貫通電気化学勾配、たとえばH +勾配またはNa +イオン勾配によって供給されます。
したがって、進化の過程で、自然は、細胞が一般的な代謝プロセスの強度と、1つまたは別の代謝経路の働きを選択的に調節するメカニズムの両方を調節できるようにするさまざまなメカニズムを生み出しました。 体内で機能するすべての調節メカニズムは、2つのレベルに分けることができます。1。個々の細胞のレベルで調節を提供するメカニズムまたは細胞内調節メカニズム。
2.生物全体のレベルで代謝プロセスの調節を確実にするメカニズム-細胞上調節メカニズム。
これらの各レベルは、サブレベルに分割できます。 したがって、細胞内レベルの規制の枠組みの中で、サブレベルを区別することができます。
個々の化学反応のサブレベル、
代謝経路のサブレベル、
細胞小器官のサブレベル、
代謝経路ネットワークのサブレベル。 そして、細胞上レベルの調節は、サブレベルに分けることができます:
特定の組織のサブレベル
臓器のサブレベル
臓器系のサブレベル
生物全体のサブレベル。
セクション31。
分類の2番目のバージョンは、ホルモンの化学的性質に基づいています。 それらの化学的性質に従って、ホルモンは4つのクラスに分けられます:
1.タンパク質性のホルモンであり、このクラスでは2つのサブクラスを区別できます。
a)ホルモンは単純なタンパク質(インスリン、ソマトトロピン)です。
b)ホルモンは複雑なタンパク質(甲状腺刺激ホルモン、性腺刺激ホルモン)であり、化学的性質により糖タンパク質です)
2.ホルモンポリペプチド(視床下部のリベリンとスタチン、バソプレッシンとオキシトシン、グルカゴン、コルチコトロピン)。
3.アミノ酸のホルモン誘導体(メラトニン、アドレナリン、ヨウ素化チロニン)。
4.ステロイドホルモン(コルチゾール、アルドステロン、プロゲステロン、エストラジオール、テストステロン)。
2.標的細胞とホルモン受容体
ホルモンの作用に何らかの形で反応することができる細胞は、このホルモンの標的細胞と呼ばれます。 同様に、ホルモンの効果が特定の生化学的または生理学的反応を引き起こす器官または組織は、このホルモンの標的器官または標的組織と呼ばれます。 特定の組織には通常、いくつかの種類の分化した細胞が含まれており、それらのすべてが特定のホルモンの効果に反応するわけではないことに注意してください。
細胞がその環境におけるホルモンまたは他のシグナル伝達分子の出現に応答するためには、これらのシグナル伝達分子を認識できる特殊な構造が含まれている必要があります。 細胞受容体はそのような特殊な構造です。 化学的性質により、細胞受容体は複雑な糖タンパク質タンパク質であり、構造内に特殊な機能中心を持ち、1つまたは別のシグナル分子と選択的に相互作用することができます。
すべての受容体はポリドメインタンパク質です。 ドメインの1つはシグナル分子の結合中心であり、これはいわゆる認識ドメインです。 認識ドメインに加えて、受容体は常に、外部調節シグナルに対する細胞の応答を確実にする細胞内メカニズムの誘発に関与するドメインを含みます。これは、いわゆる共役ドメインです。 受容体結合部位とそのシグナル分子、例えばホルモンとの相互作用は、認識ドメインのコンフォメーションを変化させ、コンフォメーション変化の波はまた、結合ドメインを捕捉し、それが受容体の「活性化」および封入につながる外部調節シグナルの実装のための細胞内メカニズムの開発。
3.ホルモン(リベリン)の放出
1.チロリベリン(TRH)は、下垂体からの甲状腺刺激ホルモン(TSH)の放出を刺激します。
2.コルチコリベリン(CRH)は、下垂体からの副腎皮質刺激ホルモン(ACTH)の放出を刺激します。
3.ゴナドリベリン(GnRH)は、下垂体からの黄体形成(LH)および卵胞刺激(FSH)ホルモンの放出を刺激します。
4.ソマトリベリン(STH-RG)は、下垂体からの成長ホルモン(STH)の放出を刺激します。
視床下部にプロラクチンリベリン(PRL-RG)とリベリンメラノサイト刺激ホルモン(MSH-RG)が存在すると考えられていますが、これまでのところ、高度に精製された形で入手することはできませんでした。 b)。 スタチン1.下垂体からの成長ホルモンの放出を阻害するソマトスタチン(SS)。 さらに、それはTSHの放出を抑制します。
2.下垂体からのプロラクチン(PRL)の放出を阻害するゴナドリベリン関連ペプチド(GAP)。 さらに、PRLの放出はドーパミンによって強く阻害されます。 HAPとドーパミンは、プロラクチン阻害ホルモン(PIH)という名前で組み合わされることがあります。 メラノスタチン(MSH-S)の存在も疑われますが、その存在は確認されていません。
視床下部ホルモンの3番目のグループは、2つのホルモンであるオキシトシンとバソプレッシンで構成されています。これらは視床下部で合成され、下垂体後葉に入り、一時的に蓄積してから血流に入ります。 下垂体ホルモンも3つのグループに分けることができます。 最初のグループは、末梢内分泌腺の活動を刺激する下垂体前葉のホルモンで構成されています。 これらには以下が含まれます:
1.甲状腺でのテトラヨードチロニン(T4)とトリヨードチロニン(T3)の合成を刺激するTSH。
2.副腎皮質による糖質コルチコイドの合成を刺激するACTH。
3.精巣および卵巣の性ホルモンの合成を刺激するLHおよびFSH。
4. セカンドメッセンジャーとしてイノシトールホスファチドのcAMP、cGMP、または加水分解生成物を使用する調節メカニズムの作業には、システムに1つの共通点があり、信号増幅メカニズムが含まれています。 ホルモンまたは他のシグナル伝達分子は、受容体と組み合わされると、セカンドメッセンジャーとして機能する細胞内の多くの分子の形成を生成する酵素を活性化します。 次に、セカンドメッセンジャーは、細胞の代謝応答の形成に直接関与する多数の異なるタンパク質分子の機能的活性を迅速に変化させることができる酵素も活性化します。 ホルモンの作用機序は、ホルモン分子の物理化学的性質に大きく依存します。 タンパク質ホルモン、ペプチドホルモン、アミノ酸誘導体ホルモンは、ヨウ素化チロニンを除いて、親水性を有する化学的性質に関連する他のシグナル分子は、細胞外膜に浸透することができません。 これらの生体調節因子の受容体は細胞外膜の外側に局在しているため、細胞外調節シグナルから細胞内シグナルへの変換を確実にするために特別なメカニズムが必要です。 原則として、これは、細胞内メッセンジャーまたは「セカンドメッセンジャー」として機能する化合物の細胞内での合成に関連しており、外部の調節シグナルに対する細胞の代謝応答の形成を確実にします。
5. 疎水性を有するステロイドホルモンおよびヨウ素化チロニンは、外膜を細胞に浸透させることができ、サイトゾルまたは核内のそれらの受容体に結合することにより、それ自体が外部調節シグナルに対する細胞の代謝応答の形成に関与し、したがって、これらのバイオレギュレーターは「セカンドメッセンジャー」などのメディエーターを必要としません。最初のグループのホルモンの調節効果は、主に細胞内にすでに存在するタンパク質の機能的活性の変化に基づいていますが、ステロイドの調節効果に基づいていますホルモンとヨウ素化チロニンは、主に遺伝子発現の効率の変化であり、これに基づいて細胞内のタンパク質の量が変化します。 もちろん、ホルモン-タンパク質、ホルモン-ペプチド、ホルモン-アミノ酸誘導体の影響下で、遺伝子発現の効率の変化も起こる可能性がありますが、これは修飾された調節タンパク質の細胞ゲノムへの影響の結果です、その構造は通常、細胞内メッセンジャーの間接的な参加によって変化します。 これらの化合物は、細胞内メッセンジャーまたはセカンドメッセンジャーとして知られており、その最もよく知られている代表的なものは、cAMP、cGMP、Ca +イオン、イノシトールホスファチドの切断産物、イノシトール三リン酸、およびジアシルグリセロールです。
セクション4.1。 インスリン
インスリンはタンパク質ホルモンです。 膵臓のB細胞によって合成されます。 インスリンは最も重要な同化ホルモンの1つです。 インスリンが標的細胞に結合すると、タンパク質合成の速度が上がるプロセスが発生するだけでなく、プラスチックやエネルギー物質の蓄えであるグリコーゲンや脂質が細胞内に蓄積します。 インスリンは、おそらくその同化作用のために、細胞の成長と再生を刺激します。
インスリン分子は、A鎖とB鎖の2つのポリペプチド鎖で構成されています。 A鎖には21個のアミノ酸残基が含まれ、B鎖には30個のアミノ酸残基が含まれます。これらの鎖は2つのジスルフィド架橋によって相互接続されています。 A20とB19の間。 3番目のジスルフィド架橋は鎖Aにあり、A6とA11をつないでいます。
B細胞から血中へのインスリン放出の主な生理学的刺激は、血糖値の上昇です。
炭水化物代謝に対するインスリンの効果は、以下の効果によって特徴付けることができます。
1.インスリンは、いわゆるインスリン依存性組織のグルコースに対する細胞膜の透過性を高めます。
2.インスリンは、細胞内のブドウ糖の酸化的分解を活性化します。
3.インスリンはグリコーゲンの分解を阻害し、肝細胞でのその合成を活性化します。
4.インスリンは、ブドウ糖の予備トリグリセリドへの変換を刺激します。
5.インスリンは、いくつかの糖新生酵素の活性を低下させることにより、糖新生を阻害します。
脂質代謝に対するインスリンの効果は、トリアシルグリセロールリパーゼの脱リン酸化と脂質生成の刺激による脂肪細胞の脂肪分解の阻害で構成されています。
インスリンはタンパク質代謝に同化作用を及ぼします。それは細胞へのアミノ酸の侵入を刺激し、多くの遺伝子の転写を刺激し、したがって、細胞内および細胞外の両方で多くのタンパク質の合成を刺激します。
2.サイロニン
甲状腺は、2つのホルモンである3,5,3-トリヨードチロニン(T3)と3,5,3,5-テトラヨードチロニン(チロキシン、T4)を生成します。これらは、組織の一般的な代謝、発達、分化の調節に重要な役割を果たします。 これらのホルモンの形成は、特定のタンパク質であるチログロブリンの転写後プロセシング中に起こり、その間に甲状腺の細胞に蓄積するヨウ素の組織化が起こります。 その後のヨウ素化チログロブリンの細胞内タンパク質分解は、ホルモンの放出につながります。
ヨウ素化サイロニンの合成は、ヨードサイログロブリンタンパク質の一部として甲状腺の甲状腺細胞で起こります。
チログロブリンの合成は、細胞の基底部の甲状腺細胞のリボソームで起こり、次に粗面小胞体の槽で起こり、次にゴルジ装置で、分子のポリペプチド鎖のグリコシル化が約2つの付加で起こります。十数個のオリゴ糖ブロック。
甲状腺ホルモンはさまざまな方法で不活化されます:それらは脱ヨウ素化、脱アミノ化、および脱炭酸を受ける可能性があります。 これらすべての場合において、ホルモンは生物学的活性を失います。 肝臓では、甲状腺ホルモンの分解産物が抱合され、胆汁中に排泄される可能性があります。
甲状腺ホルモンの受容体は、さまざまな臓器や組織の細胞に見られます。 低親和性受容体は細胞の細胞質ゾルに位置し、高親和性受容体は同じ細胞の核に位置します。 実験動物へのチロキシンの導入は、正の窒素バランスの発達を伴い、熱産生を増加させ、多くの酵素システムの活性の増加につながります。 今日まで、ホルモンの導入は100以上の酵素の活性の増加につながることが示されています。 多数の酵素の活性のこの増加は、多くの臓器や組織でのタンパク質合成に対するホルモンの顕著な刺激効果を反映している可能性が最も高いです。
甲状腺ホルモンの導入は確かに熱産生の増加につながりますが、この熱産生の増加はミトコンドリアの酸化とリン酸化の脱共役によるものではなく、エネルギー依存プロセスにおける細胞のATP消費の増加によるものです。
3.アドレナリン
副腎髄質のクロム親和性細胞は、アドレナリン、ノルエピネフリン、ドーパミンなどの生物学的に活性な物質であるカテコールアミンのグループを生成します。これらは、急性および慢性ストレスへの身体の適応、特に身体の反応の形成に重要な役割を果たします。戦うか逃げるか」タイプ。 体内でこの反応が起こると、エネルギー資源の緊急動員が起こります。脂肪組織での脂肪分解が促進され、肝臓でのグリコーゲン合成が活性化され、筋肉でのグリコーゲン分解が刺激されます。
すべてのカテコールアミンはアミノ酸のチロシンから合成され、アドレナリンは副腎髄質で生成されるカテコールアミンの約80%を占めています。 合成は、チロシンのジヒドロキシフェニルアラニン(DOPA)への変換から始まり、反応は酵素チロシンヒドロキシラーゼによって触媒されます。 酵素の補欠分子族はテトラヒドロビオプテリンです。 次の反応では、DOPAは酵素DOPA-デカルボキシラーゼの関与により脱炭酸を受けます。この酵素の補欠分子族はピリドキサールリン酸です。
ドーパミンが生成されます。 酸化中、アスコルビン酸は電子供与体(反応共基質)として使用されます。 最終反応では、ノルエピネフリンがアミノ基でメチル化され、アドレナリンに変換されます。S-アデノシルメチオニンがメチル基供与体として使用されます。
腹腔神経を通って副腎髄質に入る神経インパルスの影響下で、クロム親和性顆粒は原形質膜と融合し、カテコールアミンが血流に放出されます。 アルブミンとの関連性が低い複合体の形で血流に入るアドレナリンは、血流とともに他の臓器や組織に運ばれます。
血流中のアドレナリンの存在の持続時間は、10〜30秒のオーダーの時間で測定されます。 血漿中のその濃度は通常0.1µg / l(0.55 nM / l未満)を超えません。 アドレナリンの不活性化は、他のカテコールアミンと同様に、それらの酸化的脱アミノ化またはO-メチル化のいずれかによって発生する可能性があります。 尿中に排泄されるアドレナリン不活化の主な最終産物は、メタネフリンとバニリルマンデル酸です。
ホルモンがb1およびb2受容体に結合すると、アデニル酸シクラーゼが活性化され、活性化された受容体とGsタンパク質との相互作用によって媒介されます。これは、細胞内のcAMP濃度の増加を伴います。 ホルモンがGiタンパク質の関与によりa2受容体と相互作用すると、アデニル酸シクラーゼが阻害され、細胞内のcAMPの濃度が低下します。
b2受容体を介したアドレナリンの作用の場合、肝臓でのグリコーゲン分解は、血流へのグルコースの放出によって刺激されますが、肝細胞では糖新生がわずかに刺激されます。 筋肉では、アドレナリンはb2受容体を介してグリコーゲン分解を刺激します。 このタイプの受容体を介して、エピネフリンは膵臓でのインスリンとグルカゴンの分泌、または腎臓でのレニンの分泌を増加させます。
4.グルカゴン
グルカゴンは、膵臓のa細胞から分泌されるポリペプチドホルモンです。 このホルモンの主な機能は、内因性のエネルギー資源を動員することによって体のエネルギー恒常性を維持することです。これは、その全体的な異化作用を説明しています。
グルカゴンのポリペプチド鎖の組成は29アミノ酸残基を含み、その分子量は4200であり、システインを含まない。 グルカゴンは化学的に合成され、最終的にその化学構造が確認されました。
グルカゴン合成の主な部位は膵臓のα細胞ですが、このホルモンは消化管の他の臓器でも大量に生成されます。 グルカゴンは、分子量約9000のより長い前駆体の形でa細胞のリボソーム上で合成されます。処理中に、ポリペプチド鎖の大幅な短縮が起こり、その後、グルカゴンが血中に分泌されます。 血液中は遊離型であり、血清中の濃度は20〜100 ng / lです。 その半減期は約5分です。 グルカゴンの主要部分は、分子のN末端からの2つのアミノ酸残基の加水分解による切断によって肝臓で不活化されます。
膵臓のa細胞によるグルカゴンの分泌は、高血糖値、および膵臓のD細胞によって分泌されるソマトスタチンによって阻害されます。 グルカゴン分泌もインスリンまたはIGF-1によって阻害される可能性があります。 血中のブドウ糖濃度の低下により分泌が促進されますが、そのメカニズムは不明です。 さらに、グルカゴンの分泌は下垂体の成長ホルモン、アルギニンおよびCa2 +によって刺激されます。
グルカゴンの作用機序はよく理解されています。 ホルモンの受容体は細胞外膜に局在しています。 ホルモン受容体複合体の形成は、アデニル酸シクラーゼの活性化と細胞内のcAMP濃度の増加を伴い、プロテインキナーゼの活性化とタンパク質のリン酸化を伴い、後者の機能的活性が変化します。
肝細胞におけるグルカゴンの作用下で、グリコーゲンの動員は、血中へのブドウ糖の放出によって加速されます。 ホルモンのこの効果は、グリコーゲンホスホリラーゼの活性化と、それらのリン酸化の結果としてのグリコーゲンシンテターゼの阻害によるものです。 アドレナリンとは異なり、グルカゴンは筋肉のグリコーゲン分解の速度に影響を与えないことに注意する必要があります。
グルカゴンは肝細胞の糖新生のプロセスを活性化します。まず、肝臓でのタンパク質の分解を促進し、得られたアミノ酸は糖新生の基質として使用されます。 第二に、フルクトース-1,6-ビスホスファターゼ、ホスホエノールピルビン酸カルボキシキナーゼ、グルコース-6-ホスファターゼなどの多くの酵素の活性が増加します。これらは、既存の酵素の活性化とそれらの合成の誘導の両方により、糖新生に関与します。 糖新生の活性化により、血中へのブドウ糖の流れも増加します。 糖新生のためのアミノ酸の使用の加速は、尿素合成の量の増加と尿中に排泄される尿素の量の増加を伴います。
グルカゴンは脂肪細胞の脂肪分解を刺激し、それによって血中へのグリセロールと高級脂肪酸の流れを増加させます。 肝臓では、ホルモンがアセチルCoAからの脂肪酸とコレステロールの合成を阻害し、蓄積されたアセチルCoAがアセトン体の合成に使用されます。 したがって、グルカゴンはケトン生成を刺激します。
腎臓では、グルカゴンは糸球体濾過を増加させます。これは、グルカゴンの投与後に観察されたナトリウム、塩化物、カリウム、リン、および尿酸イオンの排泄の増加を明らかに説明しています。
5. コルチゾール
主なヒト糖質コルチコイドはコルチゾールです。副腎では、1日あたり10〜30 mgのコルチゾールと2〜4mgの別の糖質コルチコイドであるコルチコステロンが合成されます。 副腎皮質のホルモン、特に糖質コルチコイドは、重度のストレスへの適応において重要な役割を果たします。
すべてのステロイドホルモンの構造は、17個の炭素原子を持ち、文字A、B、C、およびDで示される4つのサイクルまたはリングを含むシクロペンタンペルヒドロフェナントレンコアに基づいています。
コルチゾールの合成は、副腎皮質の束状および網状帯の細胞で起こります。 コルチゾール合成の最初の化合物はコレステロールであり、血液から副腎皮質の細胞に入り、アセチルCoAからの合成によって細胞内で形成されるのはごく一部です。
コルチゾール分泌は、身体的および感情的なストレス、不安、恐怖などの影響を大きく受けますが、これらの影響はすべて、視床下部の調節リンクを介して神経系によって媒介されます。
コルチゾールの導入は、血漿中の高級脂肪酸の含有量の増加につながります。 一部には、これは脂肪組織細胞の脂肪分解の刺激の結果である可能性があります。 興味深いことに、過剰な量のコルチゾールは、四肢の脂肪組織で脂肪分解を刺激しますが、脂質生成は、体幹と顔の脂肪組織で同時に刺激されます。 末梢組織の細胞へのブドウ糖の侵入の阻害は、高級脂肪酸のレベルの増加に一定の貢献をします:第一に、末梢組織の細胞におけるブドウ糖の欠如は、予備のトリグリセリドの動員の増加につながります、そして第二に、脂肪細胞にブドウ糖が不足すると、トリグリセリドの合成に必要なホスホジヒドロキシアセトンが不足します。未使用の高級脂肪酸も脂肪細胞から血中に流れ込みます。