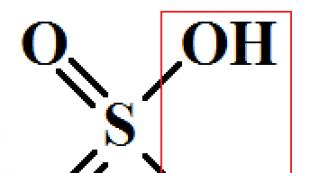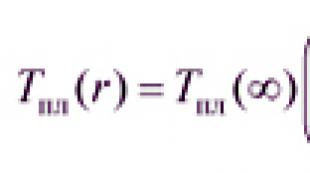両性酸化物。 化学的性質、取得方法。 両性化合物
両性酸化物(二重の特性を持つ)は、ほとんどの場合、電気陰性度が小さい金属酸化物です。 外部条件に応じて、それらは酸性または酸化物の特性を示します。 これらの酸化物が形成され、通常、次の酸化状態を示します:II、III、LV。
両性酸化物の例:酸化亜鉛(ZnO)、酸化物クロムIII(Cr2O3)、酸化物アルミニウム(Al2O3)、酸化物スズII(SnO)、酸化物スズlV(SnO2)、酸化物鉛II(PbO)、酸化物鉛lV(PbO2 )、酸化チタンlV(TiO2)、酸化物マンガンlV(MnO2)、酸化鉄III(Fe2O3)、酸化ベリリウム(BeO)。
両性酸化物に特徴的な反応:
1.これらの酸化物は強酸と反応する可能性があります。 この場合、同じ酸の塩が形成されます。 このタイプの反応は、メインタイプの特性の現れです。 例:ZnO(酸化亜鉛)+ H2SO4(塩酸)→ZnSO4 + H2O(水)。
2.強アルカリと相互作用すると、両性の酸化物と水酸化物が現れます。同時に、特性の二重性(つまり、両性)が2つの塩の形成に現れます。
溶融物では、アルカリと反応すると、平均的な塩が形成されます。たとえば、次のようになります。
ZnO(酸化亜鉛)+ 2NaOH(水酸化ナトリウム)→Na2ZnO2(一般的な平均塩)+ H2O(水)。
Al2O3(酸化アルミニウム)+ 2NaOH(水酸化ナトリウム)= 2NaAlO2 + H2O(水)。
2Al(OH)3(水酸化アルミニウム)+ 3SO3(硫黄酸化物)= Al2(SO4)3(硫酸アルミニウム)+ 3H2O(水)。
溶液中で、両性酸化物はアルカリと反応して複合塩を形成します。たとえば、Al2O3(酸化アルミニウム)+ 2NaOH(水酸化ナトリウム)+ 3H2O(水)+ 2Na(Al(OH)4)(テトラヒドロキソアルミン酸ナトリウム複合塩)。
3.両性酸化物の各金属には、独自の配位数があります。 例:亜鉛(Zn)-4の場合、アルミニウム(Al)-4または6の場合、クロム(Cr)-4(まれに)または6の場合。
4.両性酸化物は水と反応せず、水に溶解しません。
金属の両性の性質を証明する反応は何ですか?
相対的に言えば、両性元素は金属と非金属の両方の特性を示すことができます。 同様の特徴がAグループの元素に存在します:Be(ベリリウム)、Ga(ガリウム)、Ge(ゲルマニウム)、Sn(スズ)、Pb、Sb(アンチモン)、Bi(ビスマス)、その他多くの元素のB基は、Cr(クロム)、Mn(マンガン)、Fe(鉄)、Zn(亜鉛)、Cd(カドミウム)などです。
次の化学反応によって、化学元素亜鉛(Zn)の両性を証明しましょう。
1. Zn(OH)2 + N2O5(五酸化二窒素)= Zn(NO3)2(硝酸亜鉛)+ H2O(水)。
ZnO(酸化亜鉛)+ 2HNO3 = Zn(NO3)2(硝酸亜鉛)+ H2O(水)。
b)Zn(OH)2(水酸化亜鉛)+ Na2O(酸化ナトリウム)= Na2ZnO2(ジオキソジン酸ナトリウム)+ H2O(水)。
ZnO(酸化亜鉛)+ 2NaOH(水酸化ナトリウム)= Na2ZnO2(ジオキソジン酸ナトリウム)+ H2O(水)。
化合物に二重の性質を持つ元素が次の酸化状態を持っている場合、その二重の(両性)性質は酸化の中間段階で最も顕著になります。
例はクロム(Cr)です。 この元素の酸化状態は3 +、2 +、6 +です。 +3の場合、塩基性と酸性の特性はほぼ同じ程度に表されますが、Cr +2の場合は塩基性の特性が優勢であり、Cr + 6の場合は酸性の特性が優勢です。 この声明を証明する反応は次のとおりです。
Cr + 2→CrO(酸化クロム+2)、Cr(OH)2→CrSO4;
Cr + 3→Cr2O3(酸化クロム+3)、Cr(OH)3(水酸化クロム)→KCrO2または硫酸クロムCr2(SO4)3;
Cr + 6→CrO3(酸化クロム+6)、H2CrO4→K2CrO4。
ほとんどの場合、酸化状態が+3の化学元素の両性酸化物がメタ型で存在します。 例として、次の例を挙げられます。メタ水酸化アルミニウム(化学式AlO(OH)およびメタ水酸化鉄(化学式FeO(OH))。
両性酸化物はどのようにして得られますか?
1.それらを得る最も便利な方法は、アンモニア水和物、すなわち弱塩基を使用して水溶液から沈殿させることです。 例えば:
Al(NO3)3(硝酸アルミニウム)+ 3(H2OxNH3)(水性水和物)\ u003d Al(OH)3(両性酸化物)+ 3NH4NO3(反応は20度の熱で行われます)。
Al(NO3)3(硝酸アルミニウム)+ 3(H2OxNH3)(アンモニア水和物水溶液)= AlO(OH)(両性酸化物)+ 3NH4NO3 + H2O(反応は80°Cで実行)
この場合、このタイプの交換反応では、アルカリが過剰の場合、沈殿しません。 これは、アルミニウムがその二重の特性のために陰イオンになるという事実によるものです:Al(OH)3(水酸化アルミニウム)+ OH-(過剰なアルカリ)=-(水酸化アルミニウム陰イオン)。
このタイプの反応の例:
Al(NO3)3(硝酸アルミニウム)+ 4NaOH(過剰な水酸化ナトリウム)= 3NaNO3 + Na(Al(OH)4)。
ZnSO4(硫酸亜鉛)+ 4NaOH(過剰な水酸化ナトリウム)= Na2SO4 + Na2(Zn(OH)4)。
この場合に形成される塩は、次の複合アニオンに属します:(Al(OH)4)-および(Zn(OH)4)2-。 これらの塩は次のように呼ばれます:Na(Al(OH)4)-テトラヒドロキソアルミン酸ナトリウム、Na2(Zn(OH)4)-テトラヒドロキソジン酸ナトリウム。 アルミニウムまたは亜鉛酸化物と固体アルカリとの相互作用の生成物は、異なる方法で呼ばれます:NaAlO2-ジオキソアルミン酸ナトリウムおよびNa2ZnO2-ジオキソジン酸ナトリウム。
両性化合物
化学は常に反対の団結です。
周期表を見てください。
一部の元素(ほとんどすべての金属が酸化状態+1および+2を示す)が形成されます 主要酸化物と水酸化物。 たとえば、カリウムは酸化物K 2 Oを形成し、水酸化物KOHを形成します。 それらは、酸との相互作用などの基本的な特性を示します。
K2O + HCl→KCl + H2O
一部の元素(ほとんどの非金属および酸化状態が+ 5、+ 6、+ 7の金属)が形成されます 酸性酸化物と水酸化物。 酸水酸化物は酸素含有酸であり、構造内にヒドロキシル基があるため、水酸化物と呼ばれます。たとえば、硫黄は酸酸化物SO3と酸水酸化物H2 SO 4(硫酸)を形成します。

このような化合物は酸性の特性を示します。たとえば、塩基と反応します。
H2SO4 + 2KOH→K2SO4 + 2H2O
そして、酸性と塩基性の両方の特性を示すそのような酸化物と水酸化物を形成する元素があります。 この現象は 両性 。 この記事では、このような酸化物と水酸化物に注目します。 すべての両性酸化物および水酸化物は固体であり、水に不溶性です。
まず、酸化物または水酸化物が両性であるかどうかをどのように判断しますか? 少し条件付きのルールがありますが、それでも使用できます。
両性の水酸化物と酸化物は、酸化状態+3と+4の金属によって形成されます、 例えば (アル 2 O 3 , アル(おー) 3 , Fe 2 O 3 , Fe(おー) 3)
そして4つの例外:金属亜鉛 , なれ , Pb , sn 次の酸化物と水酸化物を形成します。ZnO , 亜鉛 ( おー ) 2 , BeO , なれ ( おー ) 2 , PbO , Pb ( おー ) 2 , SNO , sn ( おー ) 2 、それらは+2の酸化状態を示しますが、それにもかかわらず、これらの化合物は 両性特性 .
最も一般的な両性酸化物(およびそれらに対応する水酸化物):ZnO、Zn(OH)2、BeO、Be(OH)2、PbO、Pb(OH)2、SnO、Sn(OH)2、Al 2 O 3、Al (OH)3、Fe 2 O 3、Fe(OH)3、Cr 2 O 3、Cr(OH)3。
両性化合物の特性を覚えるのは難しくありません:それらは相互作用します 酸とアルカリ.
- 酸との相互作用により、すべてが単純になります。これらの反応では、両性化合物は基本的な化合物のように動作します。
Al 2 O 3 + 6HCl→2AlCl3 + 3H 2 O
ZnO + H 2 SO4→ZnSO4 + H 2 O
BeO + HNO 3→Be(NO 3)2 + H 2 O
水酸化物は同じように反応します:
Fe(OH)3 + 3HCl→FeCl3 + 3H 2 O
Pb(OH)2 + 2HCl→PbCl2 + 2H 2 O
- アルカリとの相互作用では、それはもう少し難しいです。 これらの反応では、両性化合物は酸のように振る舞い、反応生成物は異なる可能性があり、それはすべて条件によって異なります。
反応は溶液中で行われるか、反応物は固体として溶解されます。
融合中の塩基性化合物と両性化合物の相互作用。
例として水酸化亜鉛を取り上げましょう。 前述のように、塩基性化合物と相互作用する両性化合物は酸のように振る舞います。 したがって、水酸化亜鉛Zn(OH)2を酸と表記します。 酸の前に水素があります。取り出しましょう:H 2 ZnO2。 そして、アルカリと水酸化物の反応は、まるで酸であるかのように進行します。 「酸残留物」ZnO22価:
2K おー(テレビ)+ H 2 ZnO 2(固体)(t、融合)→K 2 ZnO 2 + 2 H 2 O
得られた物質K2 ZnO 2は、メタジン酸カリウム(または単に亜鉛酸カリウム)と呼ばれます。 この物質はカリウムの塩であり、仮想の「亜鉛酸」H 2 ZnO 2です(このような化合物を塩と呼ぶのは完全に正しいわけではありませんが、私たち自身の便宜のために忘れます)。 水酸化亜鉛だけがこのように書かれています:H 2 ZnO2は良くありません。 私たちはいつものようにZn(OH)2と書きますが、これは(私たち自身の便宜のために)これが「酸」であることを意味します。
2KOH(固体)+ Zn(OH)2(固体)(t、融合)→K 2 ZnO 2 + 2H 2 O
2つのOH基がある水酸化物の場合、すべてが亜鉛の場合と同じになります。
Be(OH)2(固体)+ 2NaOH(固体)(t、融合)→2H 2 O + Na 2 BeO 2(メタベリル酸ナトリウムまたはベリレート)
Pb(OH)2(固体)+ 2NaOH(固体)(t、融合)→2H 2 O + Na 2 PbO 2(メタ鉛酸ナトリウムまたは鉛酸塩)
3つのOH基(Al(OH)3、Cr(OH)3、Fe(OH)3)を持つ両性水酸化物では少し異なります。
例として水酸化アルミニウムを取り上げましょう:Al(OH)3、それを酸の形で書きます:H 3 AlO 3、しかし私たちはそれをこの形のままにしませんが、そこから水を取り出します:
H 3 AlO 3-H 2O→HAlO2 + H2O。
ここでは、この「酸」(HAlO 2)を使用しています。
HAlO 2 + KOH→H2 O + KAlO 2(メタアルミン酸カリウム、または単にアルミン酸塩)
しかし、水酸化アルミニウムはこのHAlO 2のように書くことはできません。いつものように書き留めますが、そこでは「酸」を意味します。
Al(OH)3(固体)+ KOH(固体)(t、融合)→2H 2 O + KAlO 2(メタアルミン酸カリウム)
同じことが水酸化クロムにも当てはまります。
Cr(OH)3→H 3 CrO3→HCrO2
Cr(OH)3(固体)+ KOH(固体)(t、融合)→2H 2 O + KCrO 2(メタクロメートカリウム、
しかし、クロム酸塩ではありません。クロム酸塩はクロム酸の塩です)。
4つのOH基を含む水酸化物の場合、それはまったく同じです。水素を前方に運び、水を除去します。
Sn(OH)4→H 4 SnO4→H2 SnO 3
Pb(OH)4→H 4 PbO4→H2 PbO 3
鉛とスズはそれぞれ2つの両性水酸化物を形成することを覚えておく必要があります。酸化状態は+2(Sn(OH)2、Pb(OH)2)、および+4(Sn(OH)4、Pb(OH)4)です。 )。
そして、これらの水酸化物は異なる「塩」を形成します:
|
酸化状態 |
||||
|
水酸化物フォーミュラ |
|
|
|
|
|
酸としての水酸化物の式 |
H2SnO2 |
H2PbO2 |
H2SnO3 |
H2PbO3 |
|
塩(カリウム) |
K2SnO2 |
K 2 PbO 2 |
K2SnO3 |
K2PbO3 |
|
塩名 |
metastannat |
metablumbAT |
||
通常の「塩」の名前と同じ原理、最高度の酸化の要素-中間の接尾辞AT-IT。
そのような「塩」(メタクロメート、メタアルミネート、メタベリレート、メタジンケートなど)は、アルカリと水酸化両性の相互作用の結果としてだけでなく得られる。 これらの化合物は、非常に基本的な「世界」と両性の「世界」(融合による)が接触したときに常に形成されます。 つまり、アルカリを含む両性水酸化水素塩と同様に、両性酸化物と両性酸化物を形成する金属塩(弱酸の塩)の両方が反応します。 そして、アルカリの代わりに、強塩基性酸化物と、アルカリを形成する金属の塩(弱酸の塩)を摂取することができます。

相互作用:
以下の反応は融合中に起こることを忘れないでください。
強塩基性酸化物を含む両性酸化物:
ZnO(固体)+ K 2 O(固体)(t、融合)→K 2 ZnO 2(メタジン酸カリウム、または単に亜鉛酸カリウム)
アルカリを含む両性酸化物:
ZnO(固体)+ 2KOH(固体)(t、融合)→K 2 ZnO 2 + H 2 O
弱酸とアルカリ形成金属の塩を含む両性酸化物:
ZnO(固体)+ K 2 CO 3(固体)(t、融合)→K 2 ZnO 2 + CO 2
強塩基性酸化物を含む両性水酸化物:
Zn(OH)2(固体)+ K 2 O(固体)(t、融合)→K 2 ZnO 2 + H 2 O
アルカリを含む両性水酸化物:
Zn(OH)2(固体)+ 2KOH(固体)(t、融合)→K 2 ZnO 2 + 2H 2 O
弱酸とアルカリ形成金属の塩を含む両性水酸化物:
Zn(OH)2(固体)+ K 2 CO 3(固体)(t、融合)→K 2 ZnO 2 + CO 2 + H 2 O
弱酸と強塩基性酸化物と両性化合物を形成する金属の塩:
ZnCO 3(固体)+ K 2 O(固体)(t、融合)→K 2 ZnO 2 + CO 2
弱酸とアルカリと両性化合物を形成する金属の塩:
ZnCO 3(固体)+ 2KOH(固体)(t、融合)→K 2 ZnO 2 + CO 2 + H 2 O
弱酸とアルカリを形成する金属の塩と両性化合物を形成する弱酸と金属の塩:
ZnCO 3(固体)+ K 2 CO 3(固体)(t、融合)→K 2 ZnO 2 + 2CO 2
以下は、水酸化両性塩の塩に関する情報です。試験で最も一般的なものは赤でマークされています。
|
水酸化物 |
酸性水酸化物 |
酸残留物 |
塩名 |
||
|
BeO |
Be(OH) 2 |
H 2 BeO 2 |
BeO 2 2- |
K 2 BeO 2 |
メタベリレート(ベリレート) |
|
ZnO |
Zn(OH) 2 |
H 2 ZnO 2 |
ZnO 2 2- |
K 2 ZnO 2 |
メタジンケート(zincate) |
|
アル 2 O 3 |
Al(OH) 3 |
HAlO 2 |
AlO 2 — |
カロ 2 |
メタアルミネート(アルミネート) |
|
Fe2O3 |
Fe(OH)3 |
HFeO 2 |
FeO2- |
KFeO 2 |
メタ鉄酸塩(しかし鉄酸塩ではない) |
|
Sn(OH)2 |
H2SnO2 |
SnO 22- |
K2SnO2 |
||
|
Pb(OH)2 |
H2PbO2 |
PbO 22- |
K 2 PbO 2 |
||
|
SnO 2 |
Sn(OH)4 |
H2SnO3 |
SnO 32- |
K2SnO3 |
MetastannAT(スズ酸塩) |
|
PbO2 |
Pb(OH)4 |
H2PbO3 |
PbO 32- |
K2PbO3 |
MetablumbAT(鉛酸塩) |
|
Cr2O3 |
Cr(OH)3 |
HCrO 2 |
CrO2- |
KCrO 2 |
メタクロマット(ただし、クロム酸塩ではありません) |
両性化合物とアルカリ溶液(ここではアルカリのみ)との相互作用。
統一国家試験では、これは「水酸化アルミニウム(亜鉛、ベリリウムなど)アルカリの溶解」と呼ばれています。 これは、(アルカリ性媒体中の)過剰の水酸化物イオンの存在下で両性水酸化物の組成中の金属がこれらのイオンをそれら自体に付着させる能力によるものです。 粒子は、水酸化物イオンに囲まれた中央の金属(アルミニウム、ベリリウムなど)で形成されます。 この粒子は水酸化物イオンによって負に帯電し(陰イオン)、このイオンはヒドロキソアルミネート、ヒドロキソジン酸塩、ヒドロキソベリル酸塩などと呼ばれます。さらに、プロセスはさまざまな方法で進行でき、金属はさまざまな数の水酸化物イオンに囲まれます。
金属が囲まれている場合の2つのケースを検討します。 4つの水酸化物イオン、そしてそれが囲まれているとき 6つの水酸化物イオン.
これらのプロセスの簡略化されたイオン方程式を書き留めましょう。
Al(OH)3 + OH-→Al(OH)4-
得られたイオンは、テトラヒドロキソアルミネートイオンと呼ばれます。 水酸化物イオンが4つあるため、接頭辞「テトラ」が追加されます。 アルミニウムは3+の電荷を帯びているため、テトラヒドロキソアルミネートイオンは-電荷を持ち、4つの水酸化物イオンは4-、合計で-になります。
Al(OH)3 + 3OH-→Al(OH)63-
この反応で生成されるイオンは、ヘキサヒドロキソアルミネートイオンと呼ばれます。 水酸化物イオンが6つあるため、接頭辞「hexo-」が追加されます。
水酸化物イオンの量を示す接頭辞を追加する必要があります。 「ヒドロキソアルミネート」と書くだけでは、Al(OH)4-またはAl(OH)63-のどちらのイオンを意味するのかが明確ではないためです。
アルカリが両性水酸化物と反応すると、溶液中で塩が形成されます。 その陽イオンはアルカリ陽イオンであり、陰イオンは錯イオンであり、その形成については先に検討しました。 陰イオンは 角括弧.
Al(OH)3 + KOH→K(テトラヒドロキソアルミン酸カリウム)
Al(OH)3 + 3KOH→K3(ヘキサヒドロキソアルミン酸カリウム)
製品として正確に(ヘキサまたはテトラ)塩を書くことは重要ではありません。 USEの回答にも、「... K 3(Kの形成は許容されます」)と書かれています。主なことは、すべてのインデックスが正しく添付されていることを確認することを忘れないでください。それらの合計はゼロに等しくなければならないことに注意してください。
両性水酸化物に加えて、両性酸化物はアルカリと反応します。 商品は同じになります。 このような反応を書く場合のみ:
Al 2 O 3 + NaOH→Na
Al 2 O 3 + NaOH→Na3
しかし、これらの反応は等しくなりません。 相互作用は溶液中で起こり、そこには十分な水があり、すべてが等しくなるため、左側に水を追加する必要があります。
Al 2 O 3 + 2NaOH + 3H 2O→2Na
Al 2 O 3 + 6NaOH + 3H 2O→2Na3
両性の酸化物と水酸化物に加えて、いくつかの特に活性な金属は、両性の化合物を形成するアルカリ溶液と相互作用します。 つまり、アルミニウム、亜鉛、ベリリウムです。 均等にするために、左側にも水が必要です。 さらに、これらのプロセスの主な違いは、水素の放出です。
2Al + 2NaOH + 6H 2O→2Na + 3H 2
2Al + 6NaOH + 6H 2O→2Na3 + 3H 2
次の表は、試験における両性化合物の特性の最も一般的な例を示しています。
|
両性物質 |
塩名 |
||
|
Al2O3 Al(OH)3 |
テトラヒドロキソアルミン酸ナトリウム |
Al(OH) 3 + NaOH→Na アル 2 O 3 + 2NaOH + 3H 2 O→2Na 2Al + 2NaOH + 6H 2 O→2Na + 3H 2 |
|
|
Na 3 |
ヘキサヒドロキソアルミン酸ナトリウム |
Al(OH) 3 + 3NaOH→Na 3 アル 2 O 3 + 6NaOH + 3H 2 O→2Na 3 2Al + 6NaOH + 6H 2 O→2Na 3 + 3H 2 |
|
|
Zn(OH)2 |
K2 |
テトラヒドロキソジン酸ナトリウム |
Zn(OH) 2 + 2NaOH→Na 2 ZnO + 2NaOH + H 2 O→Na 2 Zn + 2NaOH + 2H 2 O→Na 2 + H 2 |
|
K4 |
ヘキサヒドロキソジン酸ナトリウム |
Zn(OH) 2 + 4NaOH→Na 4 ZnO + 4NaOH + H 2 O→Na 4 Zn + 4NaOH + 2H 2 O→Na 4 + H 2 |
|
|
Be(OH)2 |
Li 2 |
リチウムテトラヒドロキソベリルレート |
Be(OH) 2 + 2LiOH→Li 2 BeO + 2LiOH + H 2 O→Li 2 Be + 2LiOH + 2H 2 O→Li 2 + H 2 |
|
Li 4 |
リチウムヘキサヒドロキソベリルレート |
Be(OH) 2 + 4LiOH→Li 4 BeO + 4LiOH + H 2 O→Li 4 Be + 4LiOH + 2H 2 O→Li 4 + H 2 |
|
|
Cr2O3 Cr(OH)3 |
テトラヒドロキソクロム酸ナトリウム |
Cr(OH) 3 + NaOH→Na Cr 2 O 3 + 2NaOH + 3H 2 O→2Na |
|
|
Na 3 |
ヘキサヒドロキソクロム酸ナトリウム |
Cr(OH) 3 + 3NaOH→Na 3 Cr 2 O 3 + 6NaOH + 3H 2 O→2Na 3 |
|
|
Fe2O3 Fe(OH)3 |
テトラヒドロキソ鉄酸ナトリウム |
Fe(OH) 3 + NaOH→Na Fe 2 O 3 + 2NaOH + 3H 2 O→2Na |
|
|
ナ 3 |
ヘキサヒドロキソ鉄酸ナトリウム |
Fe(OH) 3 + 3NaOH→Na 3 Fe 2 O 3 + 6NaOH + 3H 2 O→2Na 3 |
これらの相互作用で得られた塩は酸と反応し、他の2つの塩(特定の酸と2つの金属の塩)を形成します。
2Na 3 + 6H 2 それで 4 →3Na 2 それで 4 +アル 2 (それで 4 ) 3 + 12H 2 O
それで全部です! 複雑なことは何もありません。 主なことは、混乱しないことです。融合中に何が形成され、何が解決されるかを覚えておいてください。 非常に頻繁に、この問題に関するタスクはで出くわします B部品。
亜鉛は、原子番号30のD. I. Mendeleevの化学元素の周期系の第4周期である、第2グループのサイドサブグループの要素です。これは、記号Zn(lat。Zincum)で表されます。 通常の状態での単体亜鉛は、青みがかった白色の脆い遷移金属です(空気中で変色し、酸化亜鉛の薄層で覆われるようになります)。
第4周期では、亜鉛が最後のd元素であり、その価電子が 3d 10 4s2。 d 10配置は非常に安定しているため、外部エネルギーレベルの電子のみが化学結合の形成に関与します。 化合物では、亜鉛の酸化状態は+2です。
亜鉛は反応性金属であり、顕著な還元特性を持ち、アルカリ土類金属よりも活性が劣ります。 両性のプロパティを表示します。
亜鉛と非金属の相互作用
空気中で強く加熱すると、明るい青みがかった炎で燃焼して酸化亜鉛を形成します。
2Zn + O2→2ZnO。
発火すると、硫黄と激しく反応します。
Zn + S→ZnS。
それは、触媒としての水蒸気の存在下で通常の条件下でハロゲンと反応します:
Zn + Cl2→ZnCl2。
亜鉛にリン蒸気が作用すると、リン化物が形成されます。
Zn + 2P→ZnP2または3Zn + 2P→Zn3 P2。
亜鉛は水素、窒素、ホウ素、シリコン、炭素と相互作用しません。
亜鉛と水との相互作用
赤熱で水蒸気と反応して、酸化亜鉛と水素を形成します。
Zn + H 2O→ZnO + H2。
亜鉛と酸の相互作用
金属の電気化学的一連の電圧では、亜鉛は水素の前にあり、非酸化性の酸からそれを置き換えます。
Zn + 2HCl→ZnCl2 + H 2;
Zn + H 2 SO4→ZnSO4 + H2。
希硝酸と反応して、硝酸亜鉛と硝酸アンモニウムを形成します。
4Zn + 10HNO 3→4Zn(NO 3)2 + NH 4 NO 3 + 3H2O。
濃硫酸および硝酸と反応して、亜鉛塩および酸還元生成物を形成します。
Zn + 2H 2 SO4→ZnSO4 + SO 2 + 2H 2 O;
Zn + 4HNO 3→Zn(NO 3)2 + 2NO 2 + 2H 2 O
亜鉛とアルカリの相互作用
アルカリ溶液と反応してヒドロキソ錯体を形成します。
Zn + 2NaOH + 2H 2O→Na2 + H 2
融合すると、亜鉛酸塩を形成します。
Zn + 2KOH→K2 ZnO 2 + H2。
アンモニアとの相互作用
550〜600°Cのガス状アンモニアでは、窒化亜鉛を形成します。
3Zn + 2NH3→Zn3 N 2 + 3H 2;
アンモニアの水溶液に溶解し、テトラアンミン亜鉛水酸化物を形成します。
Zn + 4NH 3 + 2H 2 O→(OH)2 + H2。
亜鉛と酸化物および塩との相互作用
亜鉛は、その右側の応力列にある金属を塩と酸化物の溶液から置き換えます。
Zn + CuSO4→Cu + ZnSO 4;
Zn + CuO→Cu + ZnO。
酸化亜鉛(II)ZnO
-白い結晶は、加熱すると黄色になります。 密度5.7g / cm 3、昇華温度1800°C。 1000°Cを超える温度では、炭素、一酸化炭素、水素を含む金属亜鉛に還元されます。
ZnO + C→Zn + CO;
ZnO + CO→Zn + CO 2;
ZnO + H2→Zn + H2O。
水と相互作用しません。 両性の特性を示し、酸およびアルカリの溶液と反応します。
ZnO + 2HCl→ZnCl2 + H 2 O;
ZnO + 2NaOH + H 2O→Na2。
金属酸化物と融合すると、亜鉛酸塩を形成します。
ZnO + CoO→CoZnO2。
非金属酸化物と相互作用するとき、それは塩を形成します、そこでそれは陽イオンです:
2ZnO + SiO2→Zn2 SiO 4、
ZnO + B 2 O 3→Zn(BO 2)2。
水酸化亜鉛(II)Zn(OH)2
-無色の結晶性または無定形の物質。 密度3.05g / cm 3、125°Cを超える温度で分解:
Zn(OH)2→ZnO + H2O。
水酸化亜鉛は両性の特性を示し、酸やアルカリに溶けやすい:
Zn(OH)2 + H 2 SO4→ZnSO4 + 2H 2 O;
Zn(OH)2 + 2NaOH→Na2;
また、アンモニア水に容易に溶解して、テトラアンミン亜鉛水酸化物を形成します。
Zn(OH)2 + 4NH 3→(OH)2。
亜鉛塩がアルカリと反応すると、白い沈殿物の形で得られます。
ZnCl 2 + 2NaOH→Zn(OH)2 + 2NaCl。