الصيغة العامة للكربوهيدرات وظائف رئيسية. درس كيمياء "كربوهيدرات". رابعا. رد فعل نوعي
>> الكيمياء: الكربوهيدرات وتصنيفها وأهميتها
الصيغة العامة للكربوهيدرات هي C n (H 2 O) m ، أي يبدو أنها تتكون من الكربون والماء ، ومن هنا جاء اسم الفئة التي لها جذور تاريخية. ظهر على أساس تحليل أول الكربوهيدرات المعروفة. في وقت لاحق وجد أن هناك كربوهيدرات ، في الجزيئات التي لم يتم ملاحظة النسبة المشار إليها (2: 1) ، على سبيل المثال ، deoxyribose - C5H10O4. المركبات العضوية معروفة أيضًا ، والتي يتوافق تركيبها مع الصيغة العامة المحددة ، ولكنها لا تنتمي إلى فئة الكربوهيدرات. وتشمل هذه ، على سبيل المثال ، الفورمالديهايد CH20 وحمض الخليك CH3COOH المعروف لك بالفعل.
ومع ذلك ، فإن اسم "الكربوهيدرات" قد ترسخت جذوره وأصبح الآن مقبولًا بشكل عام لهذه المواد.
يمكن تقسيم الكربوهيدرات وفقًا لقدرتها على التحلل المائي إلى ثلاث مجموعات رئيسية: السكريات الأحادية والثنائية والسكريات المتعددة.
السكريات الأحادية هي كربوهيدرات لا تتحلل بالماء (لا تتحلل بالماء). في المقابل ، بناءً على عدد ذرات الكربون ، يتم تقسيم السكريات الأحادية إلى ثلاثيات (تحتوي جزيئاتها على ثلاث ذرات كربون) ، تتروس (أربع ذرات كربون) ، خماسيات (خمسة) ، سداسي (ستة) ، إلخ. د.
في الطبيعة ، يتم تمثيل السكريات الأحادية بشكل أساسي بواسطة البنتوز والسداسي.
تشمل البنتوز ، على سبيل المثال ، ريبوز - C5H10O5 و deoxyribose (ريبوز ، تم "أخذ ذرة الأكسجين" منه) - C5H10O4. إنها جزء من RNA و DNA وتحدد الجزء الأول من أسماء الأحماض النووية.
تتضمن الهكسوات التي لها الصيغة الجزيئية العامة C6H1206 ، على سبيل المثال ، الجلوكوز والفركتوز والجالاكتوز.
السكريات الثنائية عبارة عن كربوهيدرات يتم تحللها لتشكيل جزيئين أحادي السكاريد ، مثل السداسي. ليس من الصعب اشتقاق الصيغة العامة للغالبية العظمى من السكاريد: تحتاج إلى "إضافة" صيغتي السداسيات و "طرح" جزيء الماء - С12Н22О11 - من الصيغة الناتجة. وفقًا لذلك ، يمكن كتابة معادلة التحلل المائي العامة:
С12Н22O11 + 2O -> 2С6Н12O6
سداسي السكاريد
تشمل السكريات الثنائية:
السكروز (سكر غذائي شائع) والذي عند تحلله ينتج جزيء واحد من الجلوكوز وجزيء واحد من الفركتوز. يوجد بكميات كبيرة في بنجر السكر وقصب السكر (ومن هنا جاء الاسم - البنجر أو قصب السكر) والقيقب (استخرج الرواد الكنديون سكر القيقب) ونخيل السكر والذرة وما إلى ذلك ؛
المالتوز (سكر الشعير) ، والذي يتحلل ليشكل جزيئين من الجلوكوز. يمكن الحصول على المالتوز عن طريق التحلل المائي للنشا تحت تأثير الإنزيمات الموجودة في حبوب الشعير النابتة والمجففة والمطحونة ؛
اللاكتوز (سكر الحليب) ، والذي يتحلل بالماء لتشكيل جزيء من الجلوكوز والجالاكتوز. يوجد في حليب الثدييات (تصل إلى 4-6٪) ، وله حلاوة منخفضة ويستخدم كحشو في الحبوب والأقراص الصيدلانية.
يختلف المذاق الحلو لمختلف السكريات الأحادية والثنائية. لذا فإن أحلى السكاريد أحلى - الفركتوز - أحلى مرة ونصف من الجلوكوز ، الذي يؤخذ كمعيار. السكروز (ثنائي السكاريد) ، بدوره ، أحلى مرتين من الجلوكوز و4-5 مرات أكثر حلاوة من اللاكتوز ، الذي يكاد يكون عديم الطعم.
السكريات المتعددة - النشا ، الجليكوجين ، الدكسترين ، السليلوز ... - الكربوهيدرات التي يتم تحللها لتشكيل العديد من جزيئات السكريات الأحادية ، وغالبًا ما تكون الجلوكوز.
لاشتقاق صيغة السكريات ، تحتاج إلى "إزالة" جزيء الماء من جزيء الجلوكوز وكتابة تعبير بالمؤشر n: (C6H10O5) n - بعد كل شيء ، يرجع ذلك إلى التخلص من جزيئات الماء التي والسكريات في الطبيعة.
دور الكربوهيدرات في الطبيعة وأهميتها في حياة الإنسان عظيم للغاية. تشكلت في الخلايا النباتية نتيجة لعملية التمثيل الضوئي ، وهي تعمل كمصدر للطاقة للخلايا الحيوانية. بادئ ذي بدء ، هذا ينطبق على الجلوكوز.
تؤدي العديد من الكربوهيدرات (النشا والجليكوجين والسكروز) وظيفة التخزين ، وهي دور احتياطي العناصر الغذائية.
تؤدي أحماض الحمض النووي الريبي والحمض النووي ، والتي تحتوي على بعض الكربوهيدرات (البنتوز - الريبوز و الديوكسيريبوز) ، وظيفة نقل المعلومات الوراثية.
يلعب السليلوز - مادة بناء الخلايا النباتية - دور إطار عمل أغشية هذه الخلايا. يؤدي عديد السكاريد الآخر - الكيتين - دورًا مشابهًا في خلايا بعض الحيوانات - فهو يشكل الهيكل العظمي الخارجي لمفصليات الأرجل (القشريات) والحشرات والعناكب.
الكربوهيدرات هي المصدر النهائي لتغذيتنا ، سواء كنا نأكل الحبوب النشوية أو نطعمها للحيوانات التي تحول النشا إلى بروتينات ودهون. ملابسنا الأكثر صحية مصنوعة من السليلوز أو المنتجات التي تعتمد عليها: القطن والكتان وألياف الفسكوز وحرير الأسيتات. يتم بناء المنازل والأثاث الخشبي من نفس اللب الذي يتكون منه الخشب. في قلب إنتاج التصوير الفوتوغرافي والأفلام لا يزال السليلوز نفسه. الكتب والصحف والخطابات والأوراق النقدية - كل هذه منتجات من صناعة اللب والورق. وهذا يعني أن الكربوهيدرات تزودنا بكل ما هو ضروري للحياة: الطعام ، والملابس ، والمأوى.
بالإضافة إلى ذلك ، تشارك الكربوهيدرات في بناء البروتينات المعقدة والإنزيمات والهرمونات. الكربوهيدرات هي أيضًا مواد حيوية مثل الهيبارين (يلعب دورًا مهمًا - يمنع تخثر الدم) ، أجار أجار (يتم الحصول عليه من الأعشاب البحرية ويستخدم في الصناعات الميكروبيولوجية والحلويات - تذكر كعكة حليب الطيور الشهيرة).
يجب التأكيد على أن المصدر الوحيد للطاقة على الأرض (إلى جانب الطاقة النووية بالطبع) هو طاقة الشمس ، والطريقة الوحيدة لتجميعها لضمان النشاط الحيوي لجميع الكائنات الحية هي عملية التمثيل الضوئي ، والتي تتطلب مكان في خلايا النباتات الحية ويؤدي إلى تخليق الكربوهيدرات من الماء وثاني أكسيد الكربون. بالمناسبة ، خلال هذا التحول يتكون الأكسجين ، والذي بدونه ستكون الحياة على كوكبنا مستحيلة.
البناء الضوئي
6С02 + 6Н20 ------> С6Н1206 + 602
الكربوهيدرات
أنواع الكربوهيدرات.
الكربوهيدرات هي:
1) السكريات الأحادية
2) قلة السكريات
3) الكربوهيدرات المعقدة
starch12.jpg
وظائف رئيسيه.
طاقة.
بلاستيك.
توريد المغذيات.
محدد.
محمي.
تنظيمية.
الخواص الكيميائية
تعرض السكريات الأحادية خصائص الكحوليات ومركبات الكربونيل.
أكسدة.
أ) كما هو الحال مع جميع الألدهيدات ، تؤدي أكسدة السكريات الأحادية إلى الأحماض المقابلة. لذلك ، عندما يتأكسد الجلوكوز بمحلول أمونيا من هيدروكسيد الفضة ، يتشكل حمض الغلوكونيك (تفاعل "المرآة الفضية").
ب) يؤدي تفاعل السكريات الأحادية مع هيدروكسيد النحاس عند التسخين أيضًا إلى تكوين أحماض الألدونيك.
ج) عوامل مؤكسدة أقوى لا تؤكسد فقط مجموعة الألدهيد ، ولكن أيضًا مجموعة الكحول الأولية في مجموعة الكربوكسيل ، مما يؤدي إلى أحماض سكر ثنائي القاعدة (الداريك). عادة ، يتم استخدام حمض النيتريك المركز لهذه الأكسدة.
استعادة.
يؤدي تقليل السكريات إلى الكحوليات المتعددة الهيدروجين. يستخدم الهيدروجين في وجود النيكل وهيدريد الألومنيوم والليثيوم وما إلى ذلك كعامل اختزال.
ثالثا. ردود فعل محددة
بالإضافة إلى ما سبق ، يتميز الجلوكوز أيضًا ببعض الخصائص المحددة - عمليات التخمير. التخمر هو تكسير جزيئات السكر تحت تأثير الإنزيمات (الإنزيمات). يتم تخمير السكريات مع مضاعفات ثلاث ذرات كربون. تتعدد أنواع التخمير ومن أشهرها ما يلي:
أ) التخمير الكحولي
ب) تخمير حمض اللاكتيك
ج) التخمير الزبداني
أنواع التخمير المذكورة التي تسببها الكائنات الحية الدقيقة لها أهمية عملية واسعة. على سبيل المثال ، الكحول - لإنتاج الكحول الإيثيلي ، وصناعة النبيذ ، والتخمير ، وما إلى ذلك ، وحمض اللاكتيك - لإنتاج حمض اللاكتيك ومنتجات الألبان المخمرة.
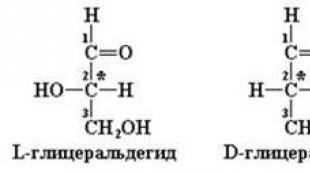
3. الأيزومرية الفراغية للسكريات الأحادية D- وسلسلة L-. الصيغ المفتوحة والدائرية. بيرانوز والفيورانوز. α- و- anomers. توتومير سيكلوتشين. ظاهرة القتل.
تسمى قدرة عدد من المركبات العضوية على تدوير مستوى استقطاب الضوء المستقطب إلى اليمين أو اليسار النشاط البصري. بناءً على ما سبق ، يترتب على ذلك أن المواد العضوية يمكن أن توجد في شكل أيزومرات تكسيرية وأيزومرات طينية. وتسمى هذه الأيزومرات الفراغية ، وتسمى ظاهرة الأيزوميرات الفراغية نفسها.
لا يعتمد النظام الأكثر صرامة لتصنيف وتعيين الأيزومرات الفراغية على دوران مستوى استقطاب الضوء ، ولكن على التكوين المطلق لجزيء الأيزومرات الفراغية ، أي. الترتيب المتبادل لأربع مجموعات بديلة مختلفة بالضرورة تقع عند رؤوس رباعي السطوح حول ذرة كربون موضعية في المركز ، والتي تسمى ذرة كربون غير متماثلة أو مركز مراوان. يتم الإشارة إلى ذرات الكربون النشطة بصريًا ، أو كما يطلق عليها أيضًا ، في صيغ هيكلية بواسطة العلامات النجمية 

وبالتالي ، يجب فهم مصطلح الأيزومرية الفراغية على أنه تكوين مكاني مختلف للبدائل في المركبات التي لها نفس الصيغة الهيكلية وامتلاك نفس الخصائص الكيميائية. يسمى هذا النوع من التماكب أيضًا تماثل المرآة. من الأمثلة الجيدة على تماثل المرآة راحتي اليد اليمنى واليسرى. فيما يلي الصيغ الهيكلية للإيزومرات الفراغية للجليسرالديهيد والجلوكوز.
إذا كانت ذرة الكربون غير المتماثلة في صيغة الإسقاط للجليسيرالدهيد تحتوي على مجموعة OH على اليمين ، فإن هذا الأيزومر يسمى D-stereoisomer ، وإذا كانت مجموعة OH على اليسار ، فإنها تسمى L-stereoisomer.
في حالة الرباعي ، البنتوز ، السداسيات ، وغيرها من الأحاديات التي تحتوي على ذرتين أو أكثر من ذرات الكربون غير المتماثلة ، يتم تحديد انتماء الأيزومر الفراغي إلى السلسلة D- أو L- من خلال موقع مجموعة OH في ذرة الكربون قبل الأخيرة في السلسلة - إنها أيضًا آخر ذرة غير متماثلة. على سبيل المثال ، بالنسبة للجلوكوز ، يتم تقييم اتجاه مجموعة OH عند ذرة الكربون الخامسة. تسمى الأيزومرات الفراغية المرآة تمامًا enantiomers أو antipodes.
لا تختلف الأيزومرات المجسمة في خصائصها الكيميائية ، ولكنها تختلف في عملها البيولوجي (النشاط البيولوجي). تنتمي معظم السكريات الأحادية في جسم الثدييات إلى السلسلة D - وهذا التكوين هو أن الإنزيمات المسؤولة عن استقلابها محددة. على وجه الخصوص ، يُنظر إلى D-glucose على أنه مادة حلوة ، نظرًا لقدرته على التفاعل مع براعم التذوق في اللسان ، في حين أن L-glucose لا طعم له ، نظرًا لأن تكوينه لا يدركه براعم التذوق.
بشكل عام ، يمكن تمثيل هيكل الألدوز والكيتوزية على النحو التالي.

الأيزومرية المجسمة.تحتوي جزيئات السكاريد الأحادي على العديد من مراكز chirality ، وهذا هو سبب وجود العديد من الأيزومرات الفراغية التي تتوافق مع نفس الصيغة البنائية. على سبيل المثال ، يحتوي الألدوهكسوز على أربع ذرات كربون غير متناظرة ويتوافق مع 16 من الأيزومرات الفراغية (24) ، أي 8 أزواج من المتضادات. بالمقارنة مع الجرعات المقابلة ، يحتوي الكيتو هكسوز على ذرة كربون مراوان أقل ، لذلك يتم تقليل عدد الأيزومرات الفراغية (23) إلى 8 (4 أزواج من المتشاكلات).
مفتوح (غير دوري)يتم تصوير أشكال السكريات الأحادية في شكل صيغ الإسقاط فيشر. سلسلة الكربون فيها مكتوبة رأسياً. في الجرعات ، توضع مجموعة الألدهيد في الجزء العلوي ، في الكيتوز ، مجموعة الكحول الأولية المجاورة لمجموعة الكاربونيل. من هذه المجموعات يبدأ ترقيم السلسلة.
يستخدم نظام D ، L للدلالة على الكيمياء الفراغية. يتم تعيين السكاريد الأحادي إلى السلسلة D أو L وفقًا لتكوين المركز اللولبي ، الأبعد عن مجموعة oxo ، بغض النظر عن تكوين المراكز الأخرى! بالنسبة إلى البنتوز ، فإن المركز "المحدد" هو ذرة C-4 ، وبالنسبة للسداسيات - C-5. يشير موضع مجموعة OH في المركز الأخير من chirality على اليمين إلى أن السكاريد الأحادي ينتمي إلى السلسلة D ، على اليسار - إلى السلسلة L ، أي عن طريق القياس مع المعيار الكيميائي الفراغي - glyceraldehyde
أشكال دورية.تعتبر الأشكال المفتوحة من السكريات الأحادية ملائمة للنظر في العلاقات المكانية بين السكريات الأحادية الفراغية. في الواقع ، السكريات الأحادية عبارة عن مركبات نصف دائرية من الناحية الهيكلية. يمكن تمثيل تكوين الأشكال الحلقية للسكريات الأحادية نتيجة للتفاعل داخل الجزيء لمجموعات الكربونيل والهيدروكسيل الموجودة في جزيء السكاريد الأحادي.

لأول مرة ، تم اقتراح الصيغة الحلقية لنص الدم للجلوكوز بواسطة A. A. Colli (1870). وأوضح عدم وجود بعض تفاعلات الألدهيد في الجلوكوز من خلال وجود دورة أكسيد الإيثيلين ثلاثي الأعضاء (أكسيد ألفا):

في وقت لاحق ، اقترح Tollens (1883) صيغة نصية مماثلة للجلوكوز ، ولكن مع حلقة من خمسة أعضاء (γ-oxide) من أكسيد البوتيلين:

تعتبر صيغ Colley-Tollens مرهقة وغير مريحة ، ولا تعكس بنية الجلوكوز الدوري ، لذلك تم اقتراح صيغ Haworth.
نتيجة للدورة ، تتشكل مركبات أكثر ثباتًا من الناحية الديناميكية الحرارية. فورانوز (خمسة أعضاء)و حلقات بيرانوز (ستة أعضاء).تأتي أسماء الدورات من أسماء المركبات الحلقية غير المتجانسة ذات الصلة - فوران وبيران.

يرتبط تكوين هذه الدورات بقدرة سلاسل الكربون للسكريات الأحادية على تبني شكل يشبه المخلب. نتيجة لذلك ، تبين أن مجموعات الألدهيد (أو الكيتون) والهيدروكسيل في مجموعات C-4 (أو في C-5) قريبة في الفضاء ، أي تلك المجموعات الوظيفية ، نتيجة للتفاعل الذي يحدث التدهور داخل الجزيء.
في الشكل الدوري ، يتم إنشاء مركز إضافي من chirality - ذرة كربون كانت في السابق جزءًا من مجموعة carbonyl (بالنسبة للجرعات ، هذا هو C-1). هذه الذرة تسمى شاذة ، واثنين من الأيزومرات المقابلة لها α- و- anomers(الشكل 11.1). Anomers هي حالة خاصة من epimers.
في α-anomer ، يكون تكوين المركز الشاذي هو نفسه تكوين المركز اللولبي "الطرفي" ، والذي يحدد الانتماء إلى سلسلة d- أو l ، بينما يكون عكسه في β-anomer. في الإسقاط صيغ فيشرفي السكريات الأحادية من السلسلة d في α-anomer ، تقع مجموعة الجليكوسيد OH على اليمين ، وفي β-anomer ، على يسار سلسلة الكربون.

أرز. 11.1. تشكيل أنومرات ألفا وبيتا على مثال الجلوكوز د
صيغ هاورث.يتم تصوير الأشكال الدورية للسكريات الأحادية على أنها صيغ منظور هاوورث ، حيث تظهر الدورات كمضلعات مسطحة متعامدة مع مستوى الرسم. تقع ذرة الأكسجين في حلقة البيرانوز في الزاوية اليمنى القصوى ، في حلقة الفورانوز - خلف المستوى الدائري. لا تشير رموز ذرات الكربون في الدورات.

للتمرير إلى صيغ هاوورث ، يتم تحويل صيغة فيشر الدورية بحيث تقع ذرة الأكسجين في الدورة على نفس الخط المستقيم مثل ذرات الكربون المدرجة في الدورة. هذا موضح أدناه لـ a-d-glucopyranose بواسطة تبدلين في ذرة C-5 ، والتي لا تغير تكوين هذا المركز غير المتماثل (انظر 7.1.2). إذا تم وضع صيغة Fisher المحولة أفقيًا ، كما هو مطلوب بموجب قواعد كتابة صيغ Haworth ، فإن البدائل الموجودة على يمين الخط العمودي لسلسلة الكربون ستكون أسفل مستوى الدورة ، وستكون البدائل الموجودة على اليسار أعلى هذه الطائرة.

في d-aldohexoses في شكل pyranose (وفي d-aldopentoses في شكل furanose) ، تقع مجموعة CH2OH دائمًا فوق المستوى الدائري ، والتي تعمل كميزة رسمية للسلسلة d. تقع مجموعة هيدروكسيل الجليكوسيد في a-anomers لـ d-aldoses تحت مستوى الدورة ، في-anomers - فوق المستوى.
D- الجلوكوبيرانوز
وفقًا لقواعد مماثلة ، يتم إجراء الانتقال في حالة الكيتوز ، والذي يظهر أدناه باستخدام مثال أحد شذوذات شكل فورانوز من د-فركتوز.

توتومير سيكلوتشينبسبب انتقال الأشكال المفتوحة من السكريات الأحادية إلى أشكال دورية والعكس صحيح.
يسمى التغيير في وقت زاوية دوران مستوى استقطاب الضوء بواسطة محاليل الكربوهيدرات الجفر.
الجوهر الكيميائي للتحوير هو قدرة السكريات الأحادية على الوجود كمزيج متوازن من التوتومرات - الأشكال المفتوحة والدائرية. يُطلق على هذا النوع من التكافل cyclo-oxo-tautomerism.
في الحلول ، يتم إنشاء التوازن بين المواد الدقيقة الحلقية الأربعة للسكريات الأحادية من خلال الشكل المفتوح - شكل أوكسو. يسمى التحويل البيني بين anomers a و في بعضها البعض من خلال شكل oxo وسيط شذوذ.
وهكذا ، يوجد د-جلوكوز في محلول على شكل توتومرات: أشكال أوكسو وأ- و- أنومرات من أشكال بيرانوز وفورانوز دوري.

توتومير لاكتيم لاكتام
هذا النوع من الحشو هو سمة من سمات الدورات غير المتجانسة المحتوية على النيتروجين مع جزء N = C-OH.
يرتبط التحويل البيني للأشكال المعدنية بنقل البروتون من مجموعة الهيدروكسيل ، والتي تشبه مجموعة OH الفينولية ، إلى المركز الرئيسي ، ذرة نيتروجين البيريدين ، والعكس صحيح. عادة ما يسود شكل اللاكتام في حالة التوازن.

أحادي أمينومونوكربوكسيل.
حسب قطبية الراديكالية:
مع جذر غير قطبي: (ألانين ، فالين ، ليسين ، فينيل ألانين) أحادي أمين ، أحادي الكربوكسيل
مع جذري قطبي غير مشحون (جليكاين ، سيرين ، أسباراجين ، جلوتامين)
مع جذر سالب الشحنة (حمض الأسبارتيك ، حمض الجلوتاميك) أحادي أمين ، ثنائي الكربوكسيل
مع شحنة موجبة الشحنة (ليسين ، هيستيدين) ديامينو ، أحادي الكربوكسيل
الأيزومرية الفراغية
تحتوي جميع الأحماض الأمينية α الطبيعية ، باستثناء الجلايسين (NH 2 -CH 2 -COOH) ، على ذرة كربون غير متماثلة (ذرة كربون ألفا) ، وبعضها يحتوي على مركزين مراوان ، على سبيل المثال ، ثريونين. وبالتالي ، يمكن أن توجد جميع الأحماض الأمينية كزوج من مضادات المرآة غير المتوافقة (متشابهة).
بالنسبة للمركب الأولي ، الذي من المعتاد مقارنة بنية الأحماض الأمينية α ، يتم أخذ أحماض D- و L-lactic بشروط ، والتي يتم تحديد تكويناتها بدورها بواسطة D- و L-glycerol aldehydes.
يتم إجراء جميع التحولات التي تحدث في هذه السلسلة أثناء الانتقال من الجلسيرالدهيد إلى الأحماض الأمينية ألفا وفقًا للمتطلبات الرئيسية - فهي لا تخلق روابط جديدة ولا تكسر الروابط القديمة في المركز غير المتماثل.
لتحديد تكوين حمض أميني ألفا ، غالبًا ما يستخدم السيرين (أحيانًا ألانين) كمرجع.
تنتمي الأحماض الأمينية الطبيعية التي تتكون منها البروتينات إلى سلسلة L. تعد أشكال D من الأحماض الأمينية نادرة نسبيًا ، حيث يتم تصنيعها فقط بواسطة الكائنات الحية الدقيقة وتسمى الأحماض الأمينية "غير الطبيعية". لا تمتص الأحماض الأمينية د من قبل الكائنات الحية. من المثير للاهتمام ملاحظة تأثير الأحماض الأمينية D و L على مستقبلات التذوق: معظم الأحماض الأمينية من السلسلة L لها طعم حلو ، في حين أن الأحماض الأمينية من السلسلة D مريرة أو لا طعم لها.
بدون مشاركة الإنزيمات ، يحدث الانتقال التلقائي لأيزومرات L إلى أيزومرات D مع تكوين خليط متساوي المولي (خليط راسيمي) على مدى فترة زمنية طويلة بما فيه الكفاية.
يستمر ترقيم كل حمض L عند درجة حرارة معينة بمعدل معين. يمكن استخدام هذا الظرف لتحديد عمر الأشخاص والحيوانات. لذلك ، على سبيل المثال ، يوجد في المينا الصلبة للأسنان بروتين عاج ، حيث يمر L-aspartate إلى D-isomer عند درجة حرارة جسم الإنسان بمعدل 0.01٪ سنويًا. خلال فترة تكوين الأسنان ، يحتوي العاج فقط على L-isomer ، لذلك يمكن حساب عمر الشخص أو الحيوان من محتوى D-aspartate.
I. الخصائص العامة
1. تحييد الجزيئات→ يتم تشكيل zwitterion ثنائي القطب:
المحاليل المائية موصلة للكهرباء. يتم تفسير هذه الخصائص من خلال حقيقة أن جزيئات الأحماض الأمينية موجودة في شكل أملاح داخلية ، والتي تتشكل بسبب انتقال البروتون من الكربوكسيل إلى المجموعة الأمينية:
زويتيريون
تحتوي المحاليل المائية للأحماض الأمينية على بيئة محايدة أو حمضية أو قلوية ، اعتمادًا على عدد المجموعات الوظيفية.
2. كثرة التكثيف→ البولي ببتيدات (بروتينات) تتشكل:

ينتج تفاعل اثنين من الأحماض الأمينية ألفا ثنائي الببتيد.
3. التحلل→ أمين + ثاني أكسيد الكربون:
NH 2 -CH 2 -COOH → NH 2 -CH 3 + CO 2
رابعا. رد فعل نوعي
1. تتأكسد جميع الأحماض الأمينية بواسطة نينهيدرين لتشكيل منتجات زرقاء بنفسجية!
2. مع أيونات المعادن الثقيلةتشكل الأحماض الأمينية ألفا أملاحًا داخل المركب. تستخدم مركبات النحاس (II) ذات اللون الأزرق الغامق للكشف عن الأحماض الأمينية ألفا.

الببتيدات النشطة الفسيولوجية. أمثلة.
الببتيدات ، ذات النشاط الفسيولوجي العالي ، تنظم العمليات البيولوجية المختلفة. وفقًا لإجراء التنظيم الحيوي ، تنقسم الببتيدات عادةً إلى عدة مجموعات:
المركبات ذات النشاط الهرموني (الجلوكاجون ، الأوكسيتوسين ، الفازوبريسين ، إلخ) ؛
المواد التي تنظم العمليات الهضمية (الجاسترين ، الببتيد المثبط للمعدة ، إلخ) ؛
الببتيدات التي تنظم الشهية (الإندورفين ، الببتيد العصبي Y ، اللبتين ، إلخ) ؛
المركبات ذات التأثير المسكن (الببتيدات الأفيونية) ؛
المواد العضوية التي تنظم النشاط العصبي العالي ، والعمليات الكيميائية الحيوية المرتبطة بآليات الذاكرة ، والتعلم ، وظهور مشاعر الخوف ، والغضب ، وما إلى ذلك ؛
الببتيدات التي تنظم ضغط الدم ونغمة الأوعية الدموية (أنجيوتنسين 2 ، براديكينين ، إلخ).
الببتيدات التي لها خصائص مضادة للأورام ومضادة للالتهابات (Lunasin)
نيوروببتيدات - مركبات يتم تصنيعها في الخلايا العصبية ذات خصائص الإشارة
تصنيف البروتين
-حسب شكل الجزيئات(كروي أو ليفي) ؛
-بالوزن الجزيئي(وزن جزيئي منخفض ، وزن جزيئي مرتفع ، إلخ) ؛
-عن طريق التركيب الكيميائي (وجود أو عدم وجود جزء غير بروتيني) ؛
-حسب الموقع في الخلية(النووية ، السيتوبلازمية ، الليزوزومية ، إلخ) ؛
-عن طريق التوطين في الجسم(بروتينات الدم ، الكبد ، القلب ، إلخ) ؛
-إذا أمكن تنظيم كمية هذه البروتينات بشكل تكيفي: البروتينات التي يتم تصنيعها بمعدل ثابت (المكونة) والبروتينات التي يمكن تعزيز تركيبها بواسطة العوامل البيئية (المحفزة) ؛
-عمر في الخلية(من البروتينات سريعة التجديد للغاية ، مع T 1/2 أقل من ساعة واحدة ، إلى البروتينات التي تتجدد ببطء شديد ، والتي يتم حساب T 1/2 في الأسابيع والأشهر) ؛
-من خلال مجالات مماثلة من الهيكل الأساسي والوظائف ذات الصلة(عائلات البروتين).
تصنيف البروتينات حسب التركيب الكيميائي
بروتينات بسيطةتحتوي بعض البروتينات فقط على سلاسل متعددة الببتيد تتكون من بقايا الأحماض الأمينية. يطلق عليهم اسم "البروتينات البسيطة". مثال على البروتينات البسيطة - الهستونات؛ أنها تحتوي على العديد من بقايا الأحماض الأمينية ليسين وأرجينين ، ولجذورهما شحنة موجبة.
2. بروتينات معقدة . تحتوي العديد من البروتينات ، بالإضافة إلى سلاسل البولي ببتيد ، على جزء غير بروتيني مرتبط بالبروتين بواسطة روابط ضعيفة أو تساهمية. يمكن تمثيل الجزء غير البروتين بأيونات معدنية ، أي جزيئات عضوية ذات وزن جزيئي منخفض أو مرتفع. تسمى هذه البروتينات "بروتينات معقدة". الجزء غير البروتيني المرتبط بإحكام بالبروتين يسمى المجموعة الاصطناعية.
في البوليمرات الحيوية التي تتكون جزيئاتها الكبيرة من مجموعات قطبية وغير قطبية ، يتم إذابة المجموعات القطبية إذا كان المذيب قطبيًا. في مذيب غير قطبي ، بالمقابل ، يتم إذابة المناطق غير القطبية من الجزيئات الكبيرة.
عادة ما يتضخم جيدًا في سائل قريب منه في التركيب الكيميائي. لذلك ، تنتفخ البوليمرات الهيدروكربونية مثل المطاط في السوائل غير القطبية: الهكسان والبنزين. البوليمرات الحيوية ، التي تحتوي جزيئاتها على عدد كبير من المجموعات الوظيفية القطبية ، على سبيل المثال ، البروتينات ، السكريات ، تتضخم بشكل أفضل في المذيبات القطبية: الماء ، الكحوليات ، إلخ.
يكون تكوين غلاف مذيب لجزيء بوليمر مصحوبًا بإطلاق الطاقة ، وهو ما يسمى حرارة التورم.
حرارة الانتفاخيعتمد على طبيعة المواد. يكون الحد الأقصى عند الانتفاخ في مذيب قطبي HMC يحتوي على كمية كبيرة من المجموعات القطبية والحد الأدنى عند الانتفاخ في مذيب غير قطبي لبوليمر هيدروكربوني.
حموضة البيئة التي يتم فيها تأسيس تساوي الشحنات الموجبة والسالبة ويصبح البروتين فيها محايد كهربائيًا ، يسمى النقطة الكهروضوئية (IEP). تسمى البروتينات التي يوجد فيها IET في بيئة حمضية بالحمضية. تسمى البروتينات التي تكون قيمة IEP لها في بيئة قلوية أساسية. تحتوي معظم البروتينات النباتية على IEP في بيئة حمضية قليلاً.
. يعتمد تورم اللولب وانحلاله على:
1. طبيعة المذيب والبوليمر ،
2. هياكل جزيئات البوليمر الكبيرة ،
3. درجة الحرارة ،
4. وجود المنحلات بالكهرباء ،
5.
على الرقم الهيدروجيني للوسط (للكهرباء المتعددة).
دور 2،3-diphosphoglycerate
يتكون 2،3-ثنائي فسفوغليسيرات في كريات الدم الحمراء من 1،3-ديفوسفوجليسيرات ، مستقلب وسيط لتحلل السكر ، في تفاعلات تسمى تحويلة رابابورت.

تفاعلات تحويلة رابابورت
يقع 2،3-Diphosphoglycerate في التجويف المركزي لرباعي deoxyhemoglobin tetramer ويرتبط بسلاسل β ، مما يشكل جسر ملح عرضيًا بين ذرات الأكسجين لـ2،3-diphosphoglycerate والمجموعات الأمينية من الفالين الطرفي لكل من السلاسل ، وكذلك المجموعات الأمينية من الراديكاليين ليسين وهستيدين.

موقع 2،3-diphosphoglycerate في الهيموجلوبين
وظيفة 2،3-diphosphoglycerate هي في تقليل التقاربالهيموغلوبين إلى الأكسجين. هذا له أهمية خاصة عند التسلق إلى ارتفاع ، مع نقص الأكسجين في الهواء المستنشق. في ظل هذه الظروف ، لا ينزعج ارتباط الأكسجين بالهيموجلوبين في الرئتين ، لأن تركيزه مرتفع نسبيًا. ومع ذلك ، في الأنسجة الناتجة عن 2،3-diphosphoglycerate ، يزداد إطلاق الأكسجين 2 مرات.
الكربوهيدرات. تصنيف. المهام
الكربوهيدرات- استدعاء المركبات العضوية المكونة من الكربون (C) والهيدروجين (H) والأكسجين (O2). الصيغة العامة لهذه الكربوهيدرات هي Cn (H2O) m. مثال على ذلك الجلوكوز (C6H12O6)
من وجهة نظر كيميائية ، الكربوهيدرات عبارة عن مواد عضوية تحتوي على سلسلة مستقيمة من عدة ذرات كربون ومجموعة كربونيل (C = O) وعدة مجموعات هيدروكسيل (OH).
في جسم الإنسان ، يتم إنتاج الكربوهيدرات بكميات صغيرة ، لذلك يدخل معظمها الجسم مع الطعام.
أنواع الكربوهيدرات.
الكربوهيدرات هي:
1) السكريات الأحادية(أبسط أشكال الكربوهيدرات)
الجلوكوز C6H12O6 (الوقود الرئيسي في أجسامنا)
الفركتوز C6H12O6 (أحلى كربوهيدرات)
ريبوز C5H10O5 (جزء من الأحماض النووية)
احمرار الحمام C4H8O4 (شكل وسيط في تكسير الكربوهيدرات)
2) قلة السكريات(تحتوي على 2 إلى 10 بقايا أحادية السكاريد)
السكروز С12Н22О11 (الجلوكوز + الفركتوز ، أو ببساطة - قصب السكر)
اللاكتوز C12H22O11 (سكر الحليب)
المالتوز C12H24O12 (سكر الشعير ، يتكون من بقايا جلوكوز مرتبطة)
110516_1305537009_Sugar-Cubes.jpg
3) الكربوهيدرات المعقدة(تتكون من العديد من وحدات الجلوكوز)
النشا (C6H10O5) n (أهم مكون كربوهيدرات في النظام الغذائي ، يستهلك الشخص حوالي 80٪ من النشا من الكربوهيدرات).
الجليكوجين (احتياطيات الطاقة في الجسم ، الجلوكوز الزائد ، عندما يدخل الدم ، يتم تخزينه في احتياطي الجسم على شكل جليكوجين)
starch12.jpg
4) الكربوهيدرات الليفية أو غير القابلة للهضم والتي تعرف بالألياف الغذائية.
السليلوز (المادة العضوية الأكثر شيوعًا على وجه الأرض ونوع من الألياف)
وفقًا لتصنيف بسيط ، يمكن تقسيم الكربوهيدرات إلى بسيطة ومعقدة. تشمل الأنواع البسيطة السكريات الأحادية والسكريات قليلة السكاريد والسكريات المعقدة والألياف.
وظائف رئيسيه.
طاقة.
الكربوهيدرات هي مادة الطاقة الرئيسية. عندما تتحلل الكربوهيدرات ، تتبدد الطاقة المنبعثة على شكل حرارة أو تخزن في جزيئات ATP. توفر الكربوهيدرات حوالي 50-60٪ من استهلاك الجسم اليومي للطاقة ، وأثناء نشاط التحمل العضلي - ما يصل إلى 70٪. عند أكسدة 1 جرام من الكربوهيدرات ، يتم تحرير 17 كيلو جول من الطاقة (4.1 كيلو كالوري). كمصدر رئيسي للطاقة في الجسم ، يتم استخدام الجلوكوز الحر أو الكربوهيدرات المخزنة على شكل جليكوجين. إنها الركيزة الأساسية للطاقة في الدماغ.
بلاستيك.
تستخدم الكربوهيدرات (الريبوز ، الديوكسيريبوز) لبناء ATP و ADP والنيوكليوتيدات الأخرى ، وكذلك الأحماض النووية. هم جزء من بعض الإنزيمات. الكربوهيدرات الفردية هي مكونات هيكلية لأغشية الخلايا. تعتبر منتجات تحويل الجلوكوز (حمض الجلوكورونيك والجلوكوزامين وما إلى ذلك) جزءًا من السكريات والبروتينات المعقدة للغضاريف والأنسجة الأخرى.
توريد المغذيات.
يتم تخزين الكربوهيدرات (تخزينها) في العضلات والهيكل العظمي والكبد والأنسجة الأخرى على شكل جليكوجين. يؤدي النشاط العضلي المنتظم إلى زيادة مخزون الجليكوجين ، مما يزيد من قدرة الجسم على الطاقة.
محدد.
تشارك الكربوهيدرات الفردية في ضمان خصوصية مجموعات الدم ، وتلعب دور مضادات التخثر (التي تسبب التخثر) ، كونها مستقبلات لسلسلة من الهرمونات أو المواد الدوائية ، تمارس تأثيرًا مضادًا للأورام.
محمي.
الكربوهيدرات المعقدة هي جزء من مكونات الجهاز المناعي. توجد عديدات السكاريد المخاطية في المواد المخاطية التي تغطي سطح أوعية الأنف والشعب الهوائية والجهاز الهضمي والمسالك البولية وتحمي من تغلغل البكتيريا والفيروسات وكذلك من التلف الميكانيكي.
تنظيمية.
لا تصلح الألياف الغذائية نفسها لعملية الانقسام في الأمعاء ، لكنها تنشط التمعج في الأمعاء ، وهي الإنزيمات المستخدمة في الجهاز الهضمي ، مما يحسن عملية الهضم وامتصاص العناصر الغذائية.
تعريف
الكربوهيدراتهي مركبات طبيعية لها التركيبة C $ _n $ (H $ _2 $ O) $ _ m $. الاستثناء هو deoxyribose C $ _5 $ H $ _ (10) $ O $ _4 $.
وتجدر الإشارة إلى أن الصيغة الجزيئية C $ _n $ (H $ _2 $ O) $ _ m $ يمكن أن تصف أيضًا فئات أخرى من المركبات.
تعتبر الكربوهيدرات جزءًا من جميع الكائنات الحية ، وتشكل حوالي 80 ٪ من الكتلة الجافة للنباتات ، كما أن السليلوز متعدد السكريات هو المادة العضوية الأكثر شيوعًا على الأرض.
تؤدي الكربوهيدرات في النباتات والحيوانات مجموعة متنوعة من الوظائف: فهي تعمل كمصدر للطاقة ، وهي "مادة بناء" جدران الخلايا النباتية ، وتحدد الخصائص الوقائية للثدييات (جنبًا إلى جنب مع البروتينات). تعمل الكربوهيدرات كمواد أولية لإنتاج الورق والألياف الصناعية والمتفجرات وما إلى ذلك. تستخدم الكربوهيدرات في الطب.
من بين الكربوهيدرات الأكثر شهرة ، يمكن تمييز ما يلي (توضح الأشكال الصيغ الهيكلية للكربوهيدرات ومصادرها (لـ "أ" ، "ب" ، "ج") أو استخدامها ("د")):
أ) الجلوكوز - أحادي السكاريد وسكر العنب.

ب) السكروز- ديساكهاريد ، قصب السكر.


في) نشاء - عديد السكاريد يتم تصنيعه بواسطة نباتات مختلفة في البلاستيدات الخضراء تحت تأثير الضوء أثناء عملية التمثيل الضوئي ، وهي المغذيات الرئيسية في الخلايا النباتية.


ز) السليلوز - عديد السكاريد ، المكون الرئيسي لأغشية الخلايا في جميع النباتات العليا.


تصنيف الكربوهيدرات.
تاريخيًا ، تشتمل الكربوهيدرات على مواد ذات بنية متنوعة للغاية - بدءًا من الوزن الجزيئي المنخفض ، والمبني من عدد قليل من ذرات الكربون (غالبًا خمس أو ست ذرات) ، إلى البوليمرات التي يبلغ وزنها الجزيئي عدة ملايين.
هذا الأخير ، ودعا السكريات، نتيجة للتحلل المائي الكامل ، فإنها تشكل مركبات أبسط - السكريات الأحادية. المجموعة الوسيطة هي قليل السكريات، بما في ذلك عدد صغير نسبيًا من وحدات المونومر.
التعريف 1
السكريات الأحادية - المونومرات ، بقاياها عبارة عن كربوهيدرات ذات بنية أكثر تعقيدًا. السكريات الأحادية لا تخضع للتحلل المائي.
التعريف 2
قلة السكريات - أوليغومرات تحتوي من 2 إلى 10 بقايا أحادية السكاريد.
التعريف 3
السكريات - البوليمرات التي تحتوي على ما يصل إلى عدة آلاف من وحدات السكاريد الأحادي
تنتمي السكريات الأحادية (على سبيل المثال ، الجلوكوز ، الفركتوز ، الجالاكتوز ، وما إلى ذلك) إلى مجموعة المواد التي تعتبر مسألة التركيب فيها أكثر أهمية من أي فئة أخرى من المركبات. لذلك ، يمكن تصنيف السكريات الأحادية وفقًا لما يلي:
I. بعدد ذرات الكربون في السلسلة
ثلاثي - ثلاثة ذرات كربون
تتروز - أربع ذرات كربون في سلسلة
البنتوز - خمس ذرات كربون في سلسلة
سداسي - ستة ذرات كربون في سلسلة
ثانيًا. حسب نوع مجموعة الكاربونيل
ألدوز - يحتوي على مجموعة ألدهيد ($ -C (O) H $)
الكيتوز - يحتوي على مجموعة كيتو ($ -C (O) - $)
ثالثا. وفقًا لتكوين آخر ذرة كربون حلزونية
الكربوهيدرات من السلسلة D
الكربوهيدرات سلسلة L
تنوع السكريات الأحادية يرجع أساسًا إلى الاختلافات الكيميائية الفراغية. على سبيل المثال ، تحتوي جزيئات البنتوز أو السداسيوز على 2 إلى 4 ذرات كربون مراوان (غير متماثلة) ، لذلك تتوافق العديد من الأيزومرات مع نفس الصيغة البنائية.
تعريف
غير متناظر (أو غير متماثل ) ذرة الكربون - ذرة الكربون في $ sp ^ 3 $ - التهجين ، والذي يحتوي على أربعة نواب مختلفين. المركبات التي تحتوي على ذرة كربون حلزونية (مركز مراوان) لها نشاط بصري ، أي قدرة المادة في المحلول على تدوير مستوى الضوء المستقطب.
لتعيين التركيب المكاني للسكريات الأحادية ، تم استخدام نظام D ، L تاريخيًا.
يشير موضع مجموعة الهيدروكسيل في المركز الأخير من chirality على اليمين إلى أن السكاريد الأحادي ينتمي إلى سلسلة D ، على اليسار - إلى السلسلة L ، على سبيل المثال.
موضوع الدرس: "الكربوهيدرات" للصف الحادي عشر من التوجيه الإنسانيالأهداف:
التعليمية:
لتكوين معرفة الطلاب حول الكربوهيدرات وتكوينها وتصنيفها. ضع في اعتبارك اعتماد الخصائص الكيميائية للكربوهيدرات على بنية الجزيئات. التفاعلات النوعية للجلوكوز والنشا. لإعطاء فكرة عن الدور البيولوجي للكربوهيدرات وأهميتها في حياة الإنسان.
تطوير:
الاستمرار في تطوير العمليات العقلية لدى الطلاب: القدرة على ربط المعرفة الحالية بالمعرفة المكتسبة حديثًا ، والقدرة على إبراز الشيء الرئيسي في المادة المدروسة ، وتعميم المادة المدروسة واستخلاص النتائج.
التعليمية:
تعليم موقف مسؤول تجاه التعلم ، والرغبة في النشاط الإبداعي والمعرفي.
نوع من: تعلم مواد جديدة
رأي: محاضرة
طريقة : توضيحي وتوضيحي مع دعم الكمبيوتر
خطة الدرس
1. لحظة تنظيمية
2. الدافع للدرس
تعتبر الكربوهيدرات مصدرًا مهمًا للتغذية: فنحن نستهلك الحبوب أو نطعمها للحيوانات التي يتحول النشا في أجسامها إلى بروتينات ودهون. تصنع الملابس الأكثر صحية من السليلوز أو المنتجات التي تعتمد عليها: القطن والكتان وألياف الفسكوز أو حرير الأسيتات. يتم بناء المنازل والأثاث الخشبي من نفس اللب الذي يتكون منه الخشب. في قلب إنتاج التصوير الفوتوغرافي والأفلام لا يزال السليلوز نفسه. الكتب والصحف والأوراق النقدية كلها من منتجات صناعة اللب والورق. لذا فإن الكربوهيدرات تزودنا بكل ما نحتاجه.
بالإضافة إلى ذلك ، تشارك الكربوهيدرات في بناء البروتينات المعقدة والإنزيمات والهرمونات. الكربوهيدرات هي أيضًا مواد حيوية مثل الهيبارين (يلعب دورًا مهمًا - يمنع تخثر الدم) ، أجار أجار (يتم الحصول عليه من الأعشاب البحرية ويستخدم في الصناعات الميكروبيولوجية والحلويات).
المصدر الوحيد للطاقة على الأرض (إلى جانب الطاقة النووية) هو طاقة الشمس ، والطريقة الوحيدة لتجميعها لضمان النشاط الحيوي لجميع الكائنات الحية هي عملية التمثيل الضوئي التي تحدث في الخلايا النباتية وتؤدي إلى تخليق الكربوهيدرات من الماء وثاني أكسيد الكربون. بالمناسبة ، خلال هذا التحول يتكون الأكسجين ، والذي بدونه ستكون الحياة على كوكبنا مستحيلة.
خطة المحاضرة
1. مفهوم الكربوهيدرات. تصنيف الكربوهيدرات.
2. السكريات الأحادية
3. السكريات
4. السكريات
1. مفهوم الكربوهيدرات. تصنيف الكربوهيدرات.
الكربوهيدرات- فئة واسعة من المركبات الطبيعية التي تلعب دورًا مهمًا في حياة الإنسان والحيوان والنبات .
سميت هذه المركبات بـ "الكربوهيدرات" لأن تركيب العديد منها يعبر عنه بالصيغة العامة Cn (H 2 O) m ، أي رسميا ، هم مركبات الكربون والماء. مع تطور كيمياء الكربوهيدرات ، تم اكتشاف مركبات لا يتوافق تركيبها مع الصيغة المذكورة أعلاه ، ولكن لها خصائص مواد من فئتها (على سبيل المثال ، deoxyribose C 5 H 10 O 4). في الوقت نفسه ، هناك مواد تتوافق مع الصيغة العامة للكربوهيدرات ، ولكنها لا تظهر خصائصها (على سبيل المثال ، inositol C 6 H 12 O 6 alcohol).
تصنيف الكربوهيدرات
يمكن تقسيم جميع الكربوهيدرات إلى مجموعتين: الكربوهيدرات البسيطة (السكريات الأحادية) والكربوهيدرات المعقدة.
الكربوهيدرات البسيطة (السكريات الأحادية)هي أبسط الكربوهيدرات التي لم يتم تحللها لتشكيل كربوهيدرات أبسط.
الكربوهيدرات المعقدة- هذه هي الكربوهيدرات ، والتي تتكون جزيئاتها من اثنين أو أكثر من بقايا السكاريد الأحادي وتتحلل إلى هذه السكريات الأحادية أثناء التحلل المائي.
2. السكريات الأحادية
السكريات الأحادية هي مركبات ذات وظائف مختلطة. تحتوي على مجموعة ألدهيد أو كيتو والعديد من مجموعات الهيدروكسيل ، أي نكون كحول الألدهيد أو كحول كيتو.
تسمى السكريات الأحادية مع مجموعة الألدهيد ألدوز ،ومع مجموعة الكيتو - الكيتوزيه.
وفقًا لعدد ذرات الكربون في الجزيء ، يتم تقسيم السكريات الأحادية إلى تتروس ، خماسيات ، سداسيإلخ.
السداسي والبنتوز هي أهم السكريات الأحادية.
هيكل السكريات الأحادية
تستخدم إسقاطات الإسقاط لتصوير بنية السكريات الأحادية. صيغ فيشر.في معادلات فيشر ، تقع سلسلة ذرات الكربون في سلسلة واحدة. يبدأ ترقيم السلسلة من ذرة مجموعة الألدهيد (في حالة الألدوز) أو من ذرة الكربون القصوى ، التي تقع مجموعة الكيتو على مقربة منها (في حالة الكيتوز).
اعتمادًا على الترتيب المكاني لذرات H ومجموعات OH عند ذرة الكربون الرابعة في البنتوز وذرة الكربون الخامسة في السداسي ، يتم تخصيص السكريات الأحادية للسلسلة D - أو L.
يتم تصنيف السكريات الأحادية على أنها سلسلة D إذا كانت مجموعة OH من هذه الذرات تقع على يمين السلسلة.
تنتمي جميع السكريات الأحادية التي تحدث بشكل طبيعي إلى السلسلة D.
ومع ذلك ، يمكن أن توجد السكريات الأحادية أيضًا في أشكال دورية. تسمى الأشكال الدورية من hexoses و pentoses pyranose و furanose ، على التوالي.
في محاليل السكريات الأحادية ، يتم إنشاء توازن متنقل بين الأشكال الحلقية وغير الحلقية - الحشو.
عادة ما يتم تصوير الأشكال الدورية واعدة صيغ هاوورث.
في الأشكال الدورية للسكريات الأحادية ، تظهر ذرة كربون غير متماثلة (C-1 للألدوز ، C-2 للكيتوز). تسمى ذرة الكربون هذه شاذ.إذا كانت مجموعة OH في ذرة شاذة تقع أسفل المستوى ، ثم يتم تشكيل α-anomer ، يؤدي الترتيب المعاكس إلى تكوين β-anomer.
الخصائص الفيزيائية
مواد بلورية عديمة اللون ، حلوة المذاق ، عالية الذوبان في الماء ، ضعيفة الذوبان في الكحول. تختلف حلاوة السكريات الأحادية. على سبيل المثال ، الفركتوز أحلى بثلاث مرات من الجلوكوز.
(الشريحة 8 - 12.)
الخواص الكيميائية
تعود الخواص الكيميائية للسكريات الأحادية إلى خصائص هيكلها.
ضع في اعتبارك الخصائص الكيميائية للجلوكوز كمثال.
1. التفاعلات التي تنطوي على مجموعة ألدهيد الجلوكوز
أ) الانتعاش (الهدرجة)مع تشكيل السوربيتول الكحول متعدد الهيدروكسيل
CH = O CH 2 OH
│ كات ، تي 0 │
(CHOH) 4 + H 2 → (CHOH) 4
CH 2 OH CH 2 OH
ب) الأكسدة
تفاعل "مرآة الفضة" (بمحلول أمونيا من أكسيد الفضة ،ر 0 ),
تفاعل مع هيدروكسيد النحاس (ثانيًا ) النحاس (أوه ) 2 في بيئة قلويةر 0 )
CH = OCOOH
│ NH 4 OH ، ر 0 │
(CHOH) 4 + Ag 2 O → (CHOH) 4
CH 2 OH CH 2 OH
منتج الأكسدة هو حمض الغلوكونيك (ملح هذا الحمض هو غلوكونات الكالسيوم ، وهو عقار معروف).
CH = OCOOH
│ t0 │
(CHOH) 4 + 2Cu (OH) 2 → (CHOH) 4 + Cu 2 O ↓ + 2H 2 O
│ أزرق │ قرميدي أحمر
CH 2 OH CH 2 OH
هذه التفاعلات نوعية للجلوكوز كألدهيد.
تحت تأثير العوامل المؤكسدة القوية (على سبيل المثال ، حمض النيتريك) ، يتكون حمض الجلوكاريك ثنائي القاعدة.
CH = OCOOH
│ t0 │
(CH أوه) 4 + HNO 3 → (CHOH) 4
CH2OHCOOH
2. تفاعل الجلوكوز بمشاركة مجموعات الهيدروكسيل (أي خصائص الجلوكوز ككحول متعدد الهيدروكسيل)
أ) التفاعل النحاس (أوه ) 2 في البردمع تكوين جلوكونات النحاس (II) - تفاعل نوعي للجلوكوز ككحول متعدد الهيدروكسيل.
3. تخمير (تخمير) السكريات الأحادية
أ) التخمير الكحولي
ج 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2
ب) التخمير الزبداني
C 6 H 12 O 6 → CH 3 ─CH 2 CH 2 ─ COOH + 2H 2 + 2CO 2
في) التخمير اللبني
C 6 H 12 O 6 → 2CH 3 CH ─ COOH
هو
الدور البيولوجي للجلوكوز
D- الجلوكوز (سكر العنب) منتشر على نطاق واسع في الطبيعة: يوجد في العنب والفواكه الأخرى ، في العسل. إنه عنصر أساسي في دم وأنسجة الحيوانات ومصدر مباشر للطاقة للتفاعلات الخلوية. مستوى الجلوكوز في دم الإنسان ثابت ويتراوح بين 0.08-0.11٪. يحتوي حجم دم الشخص البالغ على 5-6 جم من الجلوكوز. هذا المقدار كافٍ لتغطية تكاليف طاقة الجسم لمدة 15 دقيقة. نشاط حياته. في بعض الأمراض ، على سبيل المثال ، مع مرض السكري ، يرتفع مستوى السكر في الدم ، ويتم إفراز فائضه في البول. في الوقت نفسه ، يمكن أن تزيد كمية الجلوكوز في البول بنسبة تصل إلى 12٪ مقابل 0.1٪ المعتادة.
3. السكريات
(الشريحة 13.)
السكريات -نواتج تكثيف اثنين من السكريات الأحادية.
أهم الممثلين الطبيعيين: السكروز (قصب السكر أو البنجر) ، المالتوز (سكر الشعير) ، اللاكتوز (سكر الحليب) ، السيلوبيوز. كل منهم له نفس الصيغة التجريبية C 12 H 22 O 11 ، أي هي ايزومرات.
السكريات الثنائية هي كربوهيدرات نموذجية تشبه السكر. هذه مواد بلورية صلبة لها طعم حلو.
(الشريحة 14-15.)
بنية
1. قد تحتوي جزيئات السكاريد على اثنين من بقايا أحادي السكاريد أو اثنين من بقايا السكريات الأحادية المختلفة ؛
2. يمكن أن تكون الروابط المتكونة بين بقايا السكاريد الأحادي من نوعين:
أ) هيدروكسيل نصفي لكلا جزيئات السكريات الأحادية تشارك في تكوين الرابطة. على سبيل المثال ، تكوين جزيء السكروز ؛
ب) يشارك هيدروكسيل نصفي أحادي السكاريد وهيدروكسيل الكحول لسكاريد آخر في تكوين الرابطة. على سبيل المثال ، تكوين جزيئات المالتوز واللاكتوز والسيلوبيوز.
(الشريحة 16-17.)
الخواص الكيميائية للسكريات
1. السكريات ، في الجزيئات التي يتم حفظ هيدروكسيل نصفي (المالتوز ، اللاكتوز ، السيلوبيوز) ، في المحاليل يتم تحويلها جزئيًا إلى أشكال ألدهيد مفتوحة وتدخل في تفاعلات مميزة للألدهيدات ، على وجه الخصوص ، في تفاعل "المرآة الفضية" ومع هيدروكسيد النحاس (II). تسمى هذه السكاريد استعادة.
لا يمكن للسكريات ، في الجزيئات التي لا يوجد فيها هيدروكسيل نصفي (سكروز) ، أن تنتقل إلى مجموعات كربونيل مفتوحة. تسمى هذه السكاريد غير الحد(لا تستعيد Cu (OH) 2 و Ag 2 O).
2. جميع السكريات الثنائية عبارة عن كحول متعدد الهيدروكسيل ، وتتميز بخصائص الكحولات متعددة الهيدروكسيل ، فهي تعطي تفاعلًا نوعيًا للكحولات متعددة الهيدروكسيل - تفاعل مع النحاس (OH) 2 في البرد.
3. يتم تحلل جميع السكريات الثنائية لتشكيل السكريات الأحادية:
H + ، t0
ج 12 س 22 س 11 + س 2 س → ج 6 س 12 س 6 + ج 6 س 12 س 6
السكروز الجلوكوز الفركتوز
يحدث التحلل المائي في الكائنات الحية تحت تأثير الإنزيمات.
4. السكريات
(الشريحة 18 - 20.)
السكريات- الكربوهيدرات عالية الجزيئات غير الشبيهة بالسكر التي تحتوي على ما بين عشرة إلى مئات الآلاف من بقايا السكريات الأحادية (عادة السداسيات) المرتبطة بروابط جليكوسيدية.
أهم الممثلين الطبيعيين: النشا ، الجليكوجين ، السليلوز. هذه عبارة عن بوليمرات طبيعية (VMC) ، ومونومرها هو الجلوكوز. صيغتهم التجريبية العامة هي (C 6 H 10 O 5) n.
نشاء- مسحوق غير متبلور أبيض اللون ، عديم الطعم والرائحة ، ضعيف الذوبان في الماء ، يشكل محلول غرواني في الماء الساخن. يتم بناء جزيئات النشا من عدد كبير من بقايا α-glucose المرتبطة بروابط α-1،4-glycosidic.
يتكون النشا من جزئين: أميلوز (20-30٪) وأميلوبكتين (70-80٪).
جزيئات الأميلوز عبارة عن سلاسل طويلة جدًا غير متفرعة تتكون من بقايا الجلوكوز ألفا. جزيئات الأميلوبكتين ، على عكس الأميلوز ، شديدة التشعب.
الخواص الكيميائية للنشا:
(الشريحة 21.)
1. التحلل المائي
H 2 O ، إنزيمات
(ج 6 س 10 س 5) ن ← (ج 6 س 10 س 5) م → ج 12 س 22 س 11 ← ن ج 6 س 12 س 6
النشا ديكسترين الجلوكوز المالتوز
تم اكتشاف تفاعل تحويل النشا إلى جلوكوز تحت التأثير التحفيزي لحمض الكبريتيك في عام 1811 من قبل العالم الروسي ك. كيرشوف.
2. رد فعل نوعي للنشا
(ج 6 س 10 س 5) n + I 2 → مركب مركب أزرق بنفسجي.
عند تسخينه ، يختفي التلوين (يتم تدمير المجمع) ، ويظهر مرة أخرى عند تبريده.
النشا هو أحد منتجات التمثيل الضوئي ، وهو العنصر الغذائي الاحتياطي الرئيسي للنباتات. ترتبط بقايا الجلوكوز في جزيئات النشا بإحكام تام وفي نفس الوقت يمكن فصلها بسهولة تحت تأثير الإنزيمات. بمجرد وجود حاجة لمصدر للطاقة.
الجليكوجينهو ما يعادل النشا المركب في جسم الحيوان ، أي وهو أيضًا عديد السكاريد الاحتياطي ، حيث تُبنى جزيئاته من عدد كبير من بقايا الجلوكوز ألفا. يوجد الجليكوجين بشكل رئيسي في الكبد والعضلات.
السليلوز أو الألياف
يتم تصنيع المكون الرئيسي للخلية النباتية في النباتات (حتى 60٪ من السليلوز في الخشب). السليلوز النقي مادة ليفية بيضاء ، عديم الطعم والرائحة ، غير قابل للذوبان في الماء.
جزيئات السليلوز عبارة عن سلاسل طويلة تتكون من بقايا بيتا-جلوكوز مرتبطة بتكوين روابط β-1،4-glycosidic.
على عكس جزيئات النشا ، يتكون السليلوز فقط من جزيئات غير متفرعة في شكل خيوط ، منذ ذلك الحين شكل بقايا β-الجلوكوز يمنع اللف.
السليلوز ليس منتجًا غذائيًا للإنسان ومعظم الحيوانات ، لأنه. في الكائنات الحية لا توجد إنزيمات تعمل على تكسير روابط β-1،4-glycosidic الأقوى.
(الشريحة 22-23.)
الخصائص الكيميائية للسليلوز:
1. التحلل المائي
مع التسخين المطول بالأحماض المعدنية أو تحت تأثير الإنزيمات (في المجترات والأرانب) ، يحدث التحلل المائي التدريجي:
H 2 O
(ج 6 س 10 س 5) n → y (C 6 H 10 O 5) x → n / 2 C 12 H 22 O 11 → n C 6 H 12 O 6
السليلوز السليلوز β- الجلوكوز
2. تكوين استر
أ) التفاعل مع الأحماض غير العضوية
ب) التفاعل مع الأحماض العضوية
3. حرق
(ج 6 س 10 س 5) n + 6nO 2 → 6nCO 2 + 5nH 2 O
4. التحلل الحراري للسليلوز بدون دخول الهواء:
t0
(ج 6 س 10 س 5) ن ← فحم + H 2 O + مواد عضوية متطايرة
لكونه جزءًا لا يتجزأ من الخشب ، يستخدم السليلوز في البناء والنجارة ؛ كوقود يتم الحصول على الورق والكرتون والكحول الإيثيلي من الخشب. في شكل مواد ليفية (قطن ، كتان) ، يستخدم السليلوز في صناعة الأقمشة والخيوط. تُستخدم إيثرات السليلوز في صناعة ورنيش النيترو والبلاستيك والكولوديون الطبي والألياف الاصطناعية.
تفاعلات الجلوكوز بواسطة مجموعات الكحول
يتفاعل الجلوكوز مع الأحماض الكربوكسيلية أو أنهيدريدها لتكوين الإسترات. على سبيل المثال ، مع أنهيدريد الخل:
يتفاعل الجلوكوز ، باعتباره كحول متعدد الهيدروكسيل ، مع هيدروكسيد النحاس (II) لتكوين محلول أزرق لامع من جليكوسيد النحاس (II):
تفاعلات الجلوكوز على مجموعة الألدهيد
تفاعل المرآة الفضية:
أكسدة الجلوكوز مع هيدروكسيد النحاس (II) عند تسخينه في وسط قلوي:
عند تعرضه لمياه البروم ، يتأكسد الجلوكوز أيضًا إلى حمض الجلوكونيك.
أكسدة الجلوكوز بحمض النيتريك يؤدي إلى حمض السكر ثنائي القاعدة:

الحد من الجلوكوز إلى السوربيتول الكحول سداسي الهيدرات:
تم العثور على السوربيتول في العديد من التوت والفواكه.
ثلاثة أنواع من تخمير الجلوكوز
بواسطة إنزيمات مختلفة
التخمير الكحولي:

التخمير اللاكتيكي:

التخمير الزبدي:

تفاعلات السكاريد
التحلل المائي للسكروز في وجود الأحماض المعدنية (H 2 SO 4، Hcl، H 2 CO 3):
أكسدة المالتوز (تقليل ثنائي السكاريد) ، مثل تفاعل "المرآة الفضية":
تفاعلات السكريات
يمكن أن يستمر التحلل المائي للنشا في وجود الأحماض أو الإنزيمات في خطوات. في ظل ظروف مختلفة ، يمكن تمييز المنتجات المختلفة - الدكسترين أو المالتوز أو الجلوكوز:
النشا يعطي اللون الأزرق بمحلول مائي من اليود. عند تسخينه ، يختفي اللون ، وعندما يبرد ، يظهر مرة أخرى. تفاعل اليود النشا هو تفاعل نوعي للنشا. يُعتقد أن يوديد النشا هو مركب لإدراج اليود في الأنابيب الداخلية لجزيئات النشا.
التحلل المائي للسليلوز في وجود الأحماض:

نترات السليلوز مع حمض النيتريك المركز في وجود حامض الكبريتيك المركز. من بين ثلاثة نيتروستر محتملة (أحادية وثنائية وثلاثي نيتروستر) من السليلوز ، اعتمادًا على كمية حمض النيتريك ودرجة حرارة التفاعل ، يتشكل أحدها في الغالب. على سبيل المثال ، تكوين ثلاثي نتروسليلوز:
Trinitrocellulose ، ودعا البروكسيلينتستخدم في إنتاج مسحوق لا يدخن.
أستلة السليلوز عن طريق التفاعل مع أنهيدريد الخل في وجود أحماض الأسيتيك والكبريتيك:
من ثلاثي أسيتيل السليلوز احصل على ألياف صناعية - خلات.
يذوب السليلوز في كاشف من النحاس والأمونيا - محلول (OH) 2 في الأمونيا المركزة. عندما يتم تحمض مثل هذا المحلول في ظل ظروف خاصة ، يتم الحصول على السليلوز في شكل خيوط.
هو - هي - ألياف النحاس.
تحت تأثير القلويات ثم ثاني كبريتيد الكربون على السليلوز ، يتم تشكيل زانثات السليلوز:
من محلول قلوي من هذا الزانثات ، يتم الحصول على ألياف السليلوز - فسكوزي.
 |