|
免疫系、内分泌系、神経系の調節(後者-いわゆる「 脳腸軸» -
体にとってのミクロフローラの重要性を過大評価することは困難です。 現代科学の成果のおかげで、正常な腸内細菌叢はタンパク質、脂肪、炭水化物の分解に関与し、腸での消化と吸収の最適なコースの条件を作り出し、細胞の成熟に関与することが知られています体の保護特性を高める免疫システムなど..。正常な微生物叢の2つの主な機能は次のとおりです。病原体に対するバリアと免疫応答の刺激:
バリアアクション。
腸内細菌叢は病原菌の繁殖を抑制し、病原菌感染を防ぎます。
 プロセス添付ファイル iyaには複雑なメカニズムが含まれています。腸内細菌は、競合相手の排除を通じて病原体の付着を抑制または低減します。 プロセス添付ファイル iyaには複雑なメカニズムが含まれています。腸内細菌は、競合相手の排除を通じて病原体の付着を抑制または低減します。
たとえば、頭頂(粘液)微生物叢の細菌は、上皮細胞の表面にある特定の受容体を占めています。 病原菌同じ受容体に結合する可能性のあるものは、腸から排除されます。 したがって、腸内細菌は、病原性および日和見性微生物の粘膜への侵入を防ぎます。(特に、プロピオン酸菌 P. freudenreichiiかなり良好な接着特性を持ち、腸細胞に非常に確実に接着し、前述の保護バリアを作成します。また、永久微生物叢の細菌は、腸の運動性と腸粘膜の完全性を維持するのに役立ちます。 だから、bアクテリア-小腸(いわゆる食物繊維)形態の非消化性炭水化物の異化作用中の大腸の片利共生 短鎖脂肪酸 (SCFA、短鎖脂肪酸)、バリアをサポートする酢酸塩、プロピオン酸塩、酪酸塩など ムチン層の機能粘液(ムチンの産生と上皮の保護機能を高めます)。
腸の免疫システム。
免疫細胞の70%以上が人間の腸に集中しています。 腸の免疫システムの主な機能は、細菌が血流に入るのを防ぐことです。 2つ目の機能は、病原菌(病気の原因となるバクテリア)を排除することです。 これは、先天性(母親から子供に受け継がれ、生まれたときから血液中に抗体を持っている)と獲得免疫(たとえば、感染症にかかった後、外来タンパク質が血流に入った後に現れる)の2つのメカニズムによって提供されます。
病原体と接触すると、体の免疫防御が刺激されます。 Toll様受容体と相互作用すると、さまざまな種類のサイトカインの合成が引き起こされます。 腸内細菌叢は、リンパ組織の特定の蓄積に影響を与えます。 これは、細胞性および体液性免疫応答を刺激します。 腸の免疫系の細胞は、局所免疫の提供に関与し、免疫応答の重要なマーカーであるタンパク質である分泌免疫グロブリンA(LgA)を活発に産生します。
抗生物質のような物質。
また、腸内細菌叢は、病原菌の繁殖と増殖を阻害する多くの抗菌物質を生成します。 腸内の異生物性疾患では、病原性微生物の過剰な増殖が観察されるだけでなく、体の免疫防御の一般的な低下も観察されます。正常な腸内細菌叢は、新生児や子供の体の生活において特に重要な役割を果たします。
リゾチーム、過酸化水素、乳酸、酢酸、プロピオン酸、酪酸、および培地の酸性度(pH)を低下させる他の多くの有機酸および代謝物の生成により、正常な微生物叢の細菌は病原体と効果的に戦います。 生存のための微生物のこの競争の激しい闘争では、バクテリオシンやマイクロシンなどの抗生物質のような物質が主要な場所を占めています。 下の写真 左:アシドフィルスバチルスのコロニー(x 1100)、 右側:フレキシネル赤痢菌のバクテリオシン産生細胞(x 60,000)の作用下でのフレキシネル赤痢菌の破壊(a)(フレキシネル赤痢菌は赤痢の原因菌である細菌の一種です)
,_%D0%A1%D0%BF%D1%80%D0%B0%D0%B2%D0%B0_%D0%A0%D0%B0%D0%B7%D1%80%D1%83%D1%88%D0%B5%D0%BD%D0%B8%D0%B5_Shigella_flexneri_(%D0%B0)_(%D0%A8%D0%B8%D0%B3%D0%B5%D0%BB%D0%BB%D0%B0_%D0%A4%D0%BB%D0%B5%D0%BA%D1%81%D0%BD%D0%B5%D1%80%D0%B0__%E2%80%94_%D0%B2%D0%B8%D0%B4_%D0%B1%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%B8%D0%B9,_%D0%B2%D0%BE%D0%B7.jpg)
腸内では、ほとんどすべての微生物が特に注意する必要がありますバイオフィルムと呼ばれる特別な形の共存があります。 バイオフィルムはコミュニティ(コロニー)あらゆる表面に存在する微生物で、その細胞は互いに付着しています。 通常、細胞はそれらによって分泌される細胞外高分子物質である粘液に浸されます。 病原体が上皮細胞に侵入する可能性を排除することにより、病原体の血液への侵入に対する主要なバリア機能を実行するのはバイオフィルムです。
バイオフィルムの詳細については、以下を参照してください。
GITマイクロフローラ組成物の研究の歴史
消化管(GIT)の微生物叢の組成を研究した歴史は、オランダの研究者であるアンソニー・ヴァン・レーウェンフックが人間の糞便に含まれる細菌やその他の微生物の観察について最初に報告し、共存についての仮説を立てた1681年に始まりました。消化管内のさまざまな種類の細菌の分析-腸管。
1850年、ルイパスツールは 機能的発酵プロセスにおける細菌の役割、そしてドイツの医師ロバート・コッホはこの方向で研究を続け、病原体と有益な微生物を区別するために必要な特定の細菌株を特定することを可能にする純粋な培養物を分離する方法を作成しました。
 1886年に、の教義の創設者の一人 腸感染症F.エシェリッヒが最初に記述した 腸大腸菌(Bacterium coli communae)。 1888年のイリヤ・イリヤ・メチニコフは、ルイ・パスツール研究所で働いていたときに、 腸胃腸管への「健康な」バクテリアの導入が効果を変えることができると信じて、体に「自己中毒効果」を持っている微生物の複合体 腸ミクロフローラと中毒を打ち消します。 メチニコフのアイデアの実際的な実装は、治療目的での好酸性乳酸桿菌の使用でした。これは、1920年から1922年に米国で始まりました。 国内の研究者は、20世紀の50年代にのみこの問題を研究し始めました。 1886年に、の教義の創設者の一人 腸感染症F.エシェリッヒが最初に記述した 腸大腸菌(Bacterium coli communae)。 1888年のイリヤ・イリヤ・メチニコフは、ルイ・パスツール研究所で働いていたときに、 腸胃腸管への「健康な」バクテリアの導入が効果を変えることができると信じて、体に「自己中毒効果」を持っている微生物の複合体 腸ミクロフローラと中毒を打ち消します。 メチニコフのアイデアの実際的な実装は、治療目的での好酸性乳酸桿菌の使用でした。これは、1920年から1922年に米国で始まりました。 国内の研究者は、20世紀の50年代にのみこの問題を研究し始めました。
1955年にPeretzL.G。 そのことを示した 腸健康な人の大腸菌は、正常な微生物叢の主要な代表の1つであり、病原性微生物との関係でその強力な拮抗特性のために積極的な役割を果たしています。 腸の組成に関する研究は300年以上前に始まりました ミクロバイオセノーシス、その正常で病理学的な生理学と腸内細菌叢にプラスの影響を与える方法の開発は現在も続いています。
バクテリアの生息地としての人間
主なビオトープは次のとおりです。胃腸トラクト(口腔、胃、小腸、大腸)、皮膚、気道、泌尿生殖器系。 しかし、ここでの私たちの主な関心は、消化器系の器官です。 さまざまな微生物の大部分がそこに住んでいます。

消化管の微生物叢が最も代表的であり、成人の腸内細菌叢の質量は2.5 kgを超え、最大10 14 CFU / gです。 以前は、消化管の微生物セノーシスの構成には、17科、45属、500種以上の微生物が含まれると考えられていました(最近のデータ-約1500種) 常に修正.
分子遺伝学的手法と気液クロマトグラフィー-質量分析法を用いた消化管のさまざまなバイオトープのミクロフローラの研究で得られた新しいデータを考慮すると、消化管内の細菌の全ゲノムには40万の遺伝子があります。これは人間のゲノムの12倍のサイズです。
露出 分析シーケンスされた16SrRNA遺伝子の相同性について、ボランティアの腸のさまざまな部分の内視鏡検査によって得られた、胃腸管の400のさまざまな部分の壁側(粘膜)ミクロフローラ。
研究の結果、頭頂および管腔の微生物叢には、系統発生的に分離した395の微生物群が含まれ、そのうち244は完全に新しいことが示されました。 同時に、分子遺伝学的研究中に特定された新しい分類群の80%は、未培養の微生物に属しています。 微生物の推定上の新しい系統型のほとんどは、ファーミキューテス属とバクテリオイデス属の代表です。 種の総数は1500に近づいており、さらに明確にする必要があります。
括約筋システムを介した胃腸管は、私たちの周りの世界の外部環境と通信し、同時に腸壁を介して、体の内部環境と通信します。 この機能のおかげで、独自の環境が消化管に作成されました。消化管は、粥状液と粘膜の2つのニッチに分けることができます。 人間の消化器系は、「人間の腸のビオトープの内栄養性微生物叢」と呼ばれるさまざまな細菌と相互作用します。 人間の内栄養微生物叢は3つの主要なグループに分けられます。 最初のグループには、ヒトに有用なユービオティック固有またはユービオティックな一過性微生物叢が含まれます。 第二に-腸から絶えずまたは定期的に播種されるが、人間の生活に影響を与えない中性微生物。 3番目に-病原性または潜在的に病原性の細菌(「攻撃的な集団」)。
キャビティとパラレルGITマイクロバイオトープ
微生物学的には、胃腸のビオトープは層(口腔、胃、腸)と微生物叢(空洞、頭頂、上皮)に分けることができます。

壁側マイクロバイオトープに適用する能力、すなわち 粘着性(組織を固定してコロニーを形成する能力)は、一過性または固有の細菌の本質を決定します。 これらの兆候は、真正生物または攻撃的なグループに属するだけでなく、胃腸管と相互作用する微生物を特徴付ける主な基準です。 真正細菌は、抗感染性バリアシステムのユニークなメカニズムである、生物のコロニー形成抵抗性の作成に関与しています。
虫歯マイクロバイオトープ
消化管全体が不均一であり、その特性は特定の層の内容物の組成と品質によって決定されます。 層には独自の解剖学的および機能的特徴があるため、それらの内容は、物質の組成、一貫性、pH、移動速度、およびその他の特性が異なります。 これらの特性は、それらに適応した虫歯微生物集団の定性的および定量的組成を決定します。
壁側マイクロバイオトープ
体の内部環境を外部から制限する最も重要な構造です。 それは、粘液オーバーレイ(粘液ゲル、ムチンゲル)、腸細胞の頂端膜の上に位置する糖衣、および頂端膜自体の表面によって表されます。
頭頂部のマイクロバイオトープは、細菌学の観点から最も興味深い(!)のです。なぜなら、人間にとって有益または有害な細菌との相互作用が発生するからです。これを共生と呼びます。
言い換えれば、腸内細菌叢には 2種類:
- 粘液
(M) フローラ-粘膜ミクロフローラは胃腸管の粘膜と相互作用し、微生物-組織複合体を形成します-細菌とその代謝物の微小コロニー、上皮細胞、杯細胞ムチン、線維芽細胞、パイエル板の免疫細胞、食細胞、白血球、リンパ球、神経内分泌細胞;
- 半透明
(P) フローラ-管腔ミクロフローラは胃腸管の内腔に位置し、粘膜と相互作用しません。 その寿命の基盤は、それが固定されている難消化性食物繊維です。
今日、腸粘膜のミクロフローラは、腸の内腔および糞便のミクロフローラとは著しく異なることが知られています。 すべての成人の腸には優勢な細菌種の特定の組み合わせが生息していますが、ミクロフローラの組成はライフスタイル、食事、年齢によって異なります。 ある程度遺伝的に関連している成人の微生物叢の比較研究は、遺伝的要因が栄養よりも腸内細菌叢の構成に影響を与えることを明らかにしました。

写真への注意: ALF-胃底、AOZ-胃の洞、十二指腸-十二指腸(:Chernin V.V.、Bondarenko V.M.、Parfenov A.I. 共生消化におけるヒト腸の管腔および粘液微生物叢の関与。 ロシア科学アカデミーのウラル支部のオレンブルク科学センターの会報(電子ジャーナル)、2013年、第4号)
粘膜微生物叢の位置は、その嫌気性菌の程度に対応します。偏性嫌気性菌(ビフィズス菌、バクテリア、プロピオン酸菌など)は、上皮と直接接触するニッチを占め、次に好気性嫌気性菌(乳酸桿菌など)があります。その後、嫌気性菌はさらに高く、通性...管腔ミクロフローラは最も変化しやすく、さまざまな外因性の影響に敏感です。 食事療法、環境への影響、薬物療法の変化は、主に管腔微生物叢の質に影響を及ぼします。
参照:
粘膜および管腔微生物叢の微生物の数
粘膜ミクロフローラは、管腔ミクロフローラよりも外部の影響に対してより耐性があります。 粘膜と管腔ミクロフローラの関係は動的であり、以下の要因によって決定されます。
- 内因性因子
-消化管の粘膜、その分泌物、運動性および微生物自体の影響;
- 外因性要因
-内因性の要因を介して直接的および間接的に影響を及ぼします。たとえば、特定の食品を摂取すると、消化管の分泌および運動活動が変化し、その微生物叢が変化します。
口腔、食道および胃のミクロフローラ
消化管のさまざまな部分の正常な微生物叢の組成を考えてみましょう。
 口腔と咽頭は、食品の予備的な機械的および化学的処理を実行し、人体に侵入する細菌に関する細菌学的危険性の評価を行います。 口腔と咽頭は、食品の予備的な機械的および化学的処理を実行し、人体に侵入する細菌に関する細菌学的危険性の評価を行います。
唾液は、栄養素を処理し、浸透する微生物叢に影響を与える最初の消化液です。 唾液中の細菌の総含有量は変動し、平均10 8 MC / mlです。
口腔の正常な微生物叢の組成には、連鎖球菌、ブドウ球菌、乳酸桿菌、コリネバクテリア、多数の嫌気性菌が含まれます。 合計で、口の微生物叢には200種類以上の微生物が含まれています。
粘膜の表面には、個人が使用する衛生製品にもよりますが、約10 3 -10 5 MK / mm2が見られます。 口のコロニー形成抵抗性は、主に連鎖球菌(S. salivarus、S。mitis、S。mutans、S。sangius、S。viridans)、および皮膚と腸のビオトープの代表によって実行されます。 同時に、S。salivarus、S。sangius、S。viridansは粘膜と歯垢によく付着します。 高度の組織接着性を有するこれらのアルファ溶血性連鎖球菌は、サンディダ属の真菌およびブドウ球菌による口のコロニー形成を阻害します。
 食道を一時的に通過するミクロフローラは不安定で、壁への付着性を示さず、口腔および咽頭から入る一時的に存在する種が豊富にあることを特徴としています。 バクテリアにとって比較的不利な条件は、酸性度の増加、タンパク質分解酵素の効果、胃の急速な運動排出機能、およびそれらの成長と繁殖を制限する他の要因のために、胃の中で作られます。 ここで、微生物は、1mlの内容物中に102〜104を超えない量で含まれている。胃の中のユービオトープは主に虫歯のビオトープを吸収し、頭頂部のビオトープはそれらにアクセスしにくくなります。 食道を一時的に通過するミクロフローラは不安定で、壁への付着性を示さず、口腔および咽頭から入る一時的に存在する種が豊富にあることを特徴としています。 バクテリアにとって比較的不利な条件は、酸性度の増加、タンパク質分解酵素の効果、胃の急速な運動排出機能、およびそれらの成長と繁殖を制限する他の要因のために、胃の中で作られます。 ここで、微生物は、1mlの内容物中に102〜104を超えない量で含まれている。胃の中のユービオトープは主に虫歯のビオトープを吸収し、頭頂部のビオトープはそれらにアクセスしにくくなります。
胃の環境で活動する主な微生物は 抗酸菌ムチン、いくつかのタイプの土壌細菌およびビフィズス菌との組織接着関係の有無にかかわらず、ラクトバチルス属の代表。 乳酸桿菌は、胃での滞留時間が短いにもかかわらず、腹腔内での抗生物質効果に加えて、頭頂部の微生物トープに一時的にコロニーを形成することができます。 保護成分の共同作用の結果として、胃に入る微生物の大部分は死にます。 ただし、粘液や免疫生物学的要素が破壊された場合、一部の細菌は胃の中にビオトープを見つけます。 したがって、病原性の要因により、ヘリコバクターピロリの集団は胃腔に固定されます。
胃の酸性度について少し: 胃の中で理論的に可能な最大の酸性度は0.86pHです。 胃の中で理論的に可能な最小の酸性度は8.3pHです。 空腹時の胃の体の内腔の通常の酸性度は1.5〜2.0pHです。 胃の内腔に面する上皮層の表面の酸性度は1.5-2.0pHです。 胃の上皮層の深部の酸性度は約7.0pHです。
小腸の基本機能
小腸
長さ約6mのチューブです。 それは下腹部のほぼ全体を占め、胃と大腸をつなぐ消化器系の最も長い部分です。 食物のほとんどは、特殊な物質である酵素(酵素)の助けを借りて、すでに小腸で消化されています。

小腸の主な機能へ食物の虫歯および頭頂部の加水分解、吸収、分泌、およびバリア保護が含まれます。 後者では、化学的、酵素的、機械的要因に加えて、小腸の固有の微生物叢が重要な役割を果たします。 彼女は虫歯や頭頂部の加水分解、そして栄養素の吸収過程に積極的に参加しています。 小腸は、真正性の壁側微生物叢の長期保存を確実にする最も重要なリンクの1つです。
虫歯および壁側マイクロバイオトープと真正微生物叢のコロニー形成、および腸の長さに沿った層のコロニー形成には違いがあります。 空洞のマイクロバイオトープは、微生物集団の組成と濃度の変動の影響を受けます。頭頂部のマイクロバイオトープは、比較的安定した恒常性を持っています。 粘液オーバーレイの厚さでは、ムチンに対する組織接着性を持つ集団が保存されます。
近位小腸には通常、主に乳酸桿菌、連鎖球菌、真菌からなる比較的少量のグラム陽性菌が含まれています。 微生物の濃度は、腸内容物1mlあたり102 -104です。 小腸の遠位部に近づくと、細菌の総数は内容物1mlあたり108に増加しますが、腸内細菌、バクテロイデス、ビフィズス菌などの追加の種が出現します。
大腸の基本機能
コロンの主な機能は次のとおりです粥状液の確保と排出、食物の残留消化、水分の排出と吸収、一部の代謝物の吸収、残留栄養素基質、電解質とガス、糞便の形成と無害化、排泄の調節、バリア保護メカニズムの維持。

これらの機能はすべて、腸内の真正微生物が関与して実行されます。 結腸微生物の数は、内容物1mlあたり1010 -10 12CFUです。 バクテリアは糞便の最大60%を占めます。 生涯を通じて、健康な人は嫌気性細菌種(総組成の90-95%)によって支配されます:ビフィズス菌、バクテリア、乳酸桿菌、フソバクテリウム、真正細菌、ベイロネラ、ペプトストレプトコッカス、クロストリジウム。 大腸の微生物叢の5〜10%は好気性微生物です:エシェリキア属、腸内細菌、ブドウ球菌、さまざまな種類の日和見性腸内細菌(プロテウス、エンテロバクター、シトロバクター、セラータなど)、非発酵性細菌(シュードモナス、アシネトバクター)菌類博士
結腸微生物叢の種組成を分析すると、示された嫌気性および好気性微生物に加えて、非病原性原生動物および約10の腸内ウイルスの代表が含まれることを強調する必要があります。したがって、腸内の健康な個人には、約500種のさまざまな微生物があり、そのほとんどは、いわゆる偏性微生物叢の代表です-ビフィズス菌、乳酸桿菌、非病原性大腸菌など。腸の92〜95%微生物叢は偏性嫌気性菌で構成されています。
1.優勢なバクテリア。健康な人の嫌気性条件のために、嫌気性細菌は大腸の正常な微生物叢の組成に優勢です(約97%):バクテリア(特にバクテロイデスフラジリス)、嫌気性乳酸菌(例、Bifidumbacterium)、ウェルシュ菌、嫌気性連鎖球菌、フソバクテリウム、真正細菌、ベイロネラ。
2.小さな部分 ミクロフローラ好気性を構成し、通性嫌気性微生物:
グラム陰性大腸菌群(主に大腸菌)、腸球菌。
3.
非常に少量で:
ブドウ球菌、プロテア、シュードモナド、カンジダ属の真菌、特定の種類のスピロヘータ、マイコバクテリア、マイコプラズマ、原生動物およびウイルス
定性的および定量的 化合物 健康な人の大腸の主な微生物叢(CFU /糞便のg)は、年齢層によって異なります。

画像上大腸の近位および遠位部分における細菌の増殖および酵素活性の特徴は、短鎖脂肪酸(SCFA)のモル濃度、mM(モル濃度)およびpH値、pH(酸性度)のさまざまな条件下で示されています。 )媒体の.
« 階数第三国定住 バクテリア»
トピックをよりよく理解するために、簡単な定義を示します好気性菌と嫌気性菌とは何かの概念
嫌気性菌-基質リン酸化によって酸素の非存在下でエネルギーを受け取る生物(微生物を含む)、基質の不完全な酸化の最終生成物を酸化して、最終的なプロトン受容体の存在下でATPの形でより多くのエネルギーを得ることができます酸化的リン酸化を実行する生物。
オプションの(条件付き)嫌気性菌-エネルギーサイクルが嫌気性経路をたどるが、酸素が破壊的である偏性嫌気性菌とは対照的に、酸素が利用可能である場合でも存在することができる(すなわち、嫌気性および好気性条件の両方で成長する)生物。
偏性嫌気性菌-環境中に分子状酸素がない状態でのみ生きて成長する生物は、それらにとって破壊的です。
 好気性菌 (から ギリシャ語. aer-空気と生物-生命)-好気性タイプの呼吸、つまり、遊離酸素の存在下でのみ生きて発達し、原則として栄養培地の表面で成長する能力を持つ生物。 好気性菌 (から ギリシャ語. aer-空気と生物-生命)-好気性タイプの呼吸、つまり、遊離酸素の存在下でのみ生きて発達し、原則として栄養培地の表面で成長する能力を持つ生物。
嫌気性菌には、ほとんどすべての動植物と、遊離酸素の吸収によって起こる酸化反応中に放出されるエネルギーのために存在する微生物の大規模なグループが含まれます。
好気性菌と酸素の比率に関連して、それらはに分けられます 義務付ける(重度)、または遊離酸素がないと発達できない好気性物質、および オプション(条件付き)、環境中の酸素含有量を減らして開発することができます。
注意すべきことビフィズス菌
、最も重度の嫌気性菌が上皮に最も近いゾーンにコロニーを形成するため、負の酸化還元電位が常に維持されます(大腸だけでなく、体の他のより好気性のビオトープ:中咽頭、膣、皮膚)。 プロピオン酸菌それほど厳密ではない嫌気性菌、つまり通性嫌気性菌に属し、低酸素分圧にしか耐えられません。

解剖学的、生理学的、生態学的特性が異なる2つのビオトープ-小腸と大腸は、効率的に機能するバリアによって分離されています。弓のフラップは開閉し、腸の内容物を一方向にのみ通過させ、コロニー形成を維持します。健康な体に必要な量の腸管の。
内容物が腸管内を移動すると、酸素分圧が低下し、培地のpH値が上昇します。これに関連して、垂直方向に沿ったさまざまな種類の細菌の定着の「床」が現れます。 好気性菌が最も高い, 以下は通性嫌気性菌ですそしてさらに低い- 厳格な嫌気性菌.
したがって、口の中の細菌の含有量は非常に高くなる可能性があります-最大10 6 CFU / ml、胃では0-10 2-4 CFU / mlに減少し、空腸では10 5 CFU / mlに上昇します。回腸遠位部で最大107〜8 CFU / ml、続いて結腸内の微生物の量が急激に増加し、遠位部で10 11〜12 CFU / mlのレベルに達します。
結論

人間と動物の進化は微生物の世界と絶えず接触して起こり、その結果、マクロと微生物の間に密接な関係が形成されました。 胃腸管の微生物叢が人間の健康の維持に及ぼす影響、その生化学的、代謝と免疫のバランスは間違いなく、多数の実験的研究と臨床的観察によって証明されています。 多くの疾患(アテローム性動脈硬化症、肥満、過敏性腸症候群、非特異的炎症性腸疾患、セリアック病、結腸直腸癌など)の発生におけるその役割は引き続き活発に研究されています。 したがって、ミクロフローラ障害の矯正の問題は、実際には、健康的なライフスタイルの形成である人間の健康を維持することの問題です。 プロバイオティクスの準備そしてプロバイオティクス製品は、正常な腸内細菌叢の回復を確実にし、体の非特異的耐性を高めます。
人間にとっての通常のGITマイクロフローラの重要性に関する一般的な情報を体系化します
GIT MICROFLORA:
- 毒素、変異原性物質、発癌物質、フリーラジカルから体を保護します。
- これは、フェノール、金属、毒物、生体異物など、多くの有毒な製品を蓄積する生物吸着剤です。
- 腸内感染の原因菌である腐敗性、病原性および条件付き病原性細菌を抑制します。
- 腫瘍の形成に関与する酵素の活性を阻害(抑制)します。
- 体の免疫システムを強化します。
- 抗生物質のような物質を合成します。
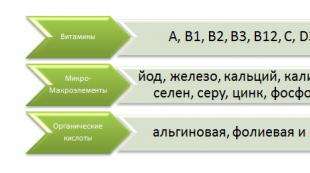
- ビタミンと必須アミノ酸を合成します。
- 消化プロセスだけでなく、代謝プロセスでも大きな役割を果たし、ビタミンD、鉄、カルシウムの吸収を促進します。
- 主要なフードプロセッサーです。
- 胃腸管の運動機能と消化機能を回復し、鼓腸を防ぎ、蠕動を正常化します。
- 精神状態を正常化し、睡眠、概日リズム、食欲を調節します。
- 体の細胞にエネルギーを提供します。
詳細を見る:
- 微生物叢の局所的および全身的機能。 (Babin V.N.、Minushkin O.N.、Dubinin A.V. et al。、1998)
腸内毒素症の極端な程度は外観です
血中(!)
胃腸管からの病原菌(細菌血症)または敗血症の発症さえ:
ビデオは、免疫防御の違反が危険なバクテリアの血液への侵入につながる可能性がある瞬間のいくつかを示しています。
結論:
微生物とその人間への影響を研究している現代の科学は静止していないという事実のために、それは基本的に変化する そして、今日一般的に腸内細菌叢または腸内細菌叢と呼ばれている腸内細菌叢の役割についての多くのアイデア。 ヒトマイクロバイオーム腸内細菌叢よりも広い概念。 しかし、腸内微生物叢は人体で最も代表的であり、そこで発生するすべての代謝および免疫学的プロセスに最も重要な影響を及ぼします。 現代の研究の結果は、腸内細菌叢が多くの病気を予防および治療するための治療的介入の優れた標的になり得ることを明確に示しています。 腸内細菌叢と宿主の間の相互作用のさまざまなメカニズムを最初に理解するために、補足資料に精通することをお勧めします。 1型糖尿病の状態を改善するためのプロバイオティクスとプレバイオティクス
Catad_tema腸内毒素症-記事
腸内細菌、プロバイオティクスおよび胃腸管の疾患の治療のためのそれらの使用の見通し
Yu.O. Shulpekova
モスクワ医科大学医学部内科 彼ら。 セチェノフ、モスクワ健康を維持する上での組成の特徴と腸内共生細菌の役割が考慮されています。 臨床診療における「腸内毒素症」という用語の使用の正しさについて説明します。 腸内毒素症と誤って解釈されることが多い疾患および状態を示した。 いくつかのプロバイオティクスの有効性が比較研究の結果によって確認された病気の簡単な概要が与えられます。 現代の複合プロバイオティクス薬Linexの使用の適応症、その利点と投与計画が提示されます。 人間の健康を維持する上での腸内細菌叢の役割を研究した歴史は、腸の「自己中毒」の結果としての病気の概念が開発された19世紀の終わりにまでさかのぼります。 しかし、今日でも、私たちの体とそれに生息する細菌との相互作用についてはほとんど知られていないことを認めなければなりません。また、消化管(GIT)に生息する微生物叢の組成を「標準」の観点から評価することは非常に困難です。 」と「病理学」。 腸内細菌叢の組成と生理学的重要性 400種以上の微生物が人間の胃腸管に生息しています。 1 mlの管腔内内容物中のコロニー形成単位(CFU)の内容物は、胃から大腸に移動するにつれて10 2–3から10 11–12に増加します。 同時に、嫌気性微生物の割合が増加し、それらの酸化電位が低下します。 腸内細菌は、主要な(優勢、または常在)、付随する、および残存する集団によって表されます。 優勢な集団は、主に乳酸桿菌、ビフィズス菌、およびバクテロイデス属の細菌で構成されています。 付随する集団は、大腸菌、真正細菌、フソバクテリウム、腸球菌およびペプトコッカスによって表されます。 残りの集団には、酵母のような真菌、桿菌、クロストリジウム、プロテウスなどが含まれます。これらの微生物のいくつかは、多かれ少なかれ顕著な病原性を持っています。 健康な人では、腸内微生物の15%以下が病原性または条件付き病原性の特徴を持っていると一般に認められています。 上部消化管では、ミクロフローラの組成は中咽頭の組成と似ています。 その顕著なシェアは連鎖球菌によって表されます。 遠位方向では、乳酸桿菌の含有量が徐々に増加し、結腸ではビフィズス菌が優勢になります。 現代の概念によれば、胃腸内細菌叢の正常な生理学的状態を維持する上での主な役割は、病原性を持たないグラム陽性の非胞子形成嫌気性菌であるラクトバチルス菌およびビフィズス菌科の細菌によって果たされます。 これらの微生物の重要な特徴は、糖分解型の代謝です。 乳酸桿菌とビフィズス菌の酵素の作用下での炭水化物の発酵の過程で、短鎖脂肪酸が形成されます-乳酸、酢酸、酪酸、プロピオン酸。 これらの酸の存在下では、大部分がタンパク質分解型の代謝を有する日和見菌株の発生が阻害されます。 タンパク質分解菌株の抑制は、腐敗プロセスの抑制と、アンモニア、芳香族アミン、硫化物、内因性発癌物質の形成の抑制を伴います。 脂肪酸の生成により、腸内容物のpHが調節されます。 短鎖脂肪酸は代謝の調節に重要な役割を果たしています。 体循環に入ると、それらは体の毎日のエネルギー必要量の最大20%を提供し、腸壁の上皮のためのエネルギーの主要な供給者としても機能します。 酪酸とプロピオン酸は有糸分裂活性を高め、上皮の分化を調節します。 乳酸とプロピオン酸はカルシウム吸収を調節します。 非常に興味深いのは、肝臓でのコレステロール代謝とグルコース代謝の調節におけるそれらの役割です。 乳酸桿菌とビフィズス菌は、アミノ酸、タンパク質、ビタミンB1、B2、B6、B12、K、ニコチン酸、葉酸、抗酸化作用のある物質を合成します。 一般の人々のバクテリアは、ミルク成分の消化に重要な役割を果たします。 乳酸桿菌と腸球菌は、乳糖と乳タンパク質を分解することができます。 ビフィズス菌が分泌するリンタンパク質ホスファターゼは、カゼインの代謝に関与しています。 これらのプロセスはすべて小腸で行われます。 腸内乳酸菌種には、L。アシドフィルス、L。カゼイ、L。ブルガリクス、L。プランタルム、L。サリバリウス、L。ラムノサス、L。ロイテリが含まれます。 B. bifidum、B。longum、B.infantisはビフィズス菌の間で区別されます。 付随する集団に属する好気性微生物のうち、腸の微生物バイオセノシスにおける重大な役割は、ビタミン(B1、B2、B6、B12、K、ニコチン、葉)を産生する非溶血性大腸菌-大腸菌に属します、パントテン酸)、コレステロール、ビリルビン、コリン、胆汁、脂肪酸の代謝に関与し、間接的に鉄とカルシウムの吸収に影響を与えます。 腸内細菌叢の生命活動の特徴に関する知識の拡大に伴い、局所および全身免疫の緊張を維持する上でのその重要な役割の考えがますます明確になっています。 腸には、過剰な繁殖や微生物叢の導入を防ぐ保護メカニズムがあります。 これらには、上皮と刷子縁の完全性(微絨毛間の距離が細菌のサイズよりも小さい)、免疫グロブリンAの産生、胆汁の存在、パイエル板の存在などが含まれます。 抗菌活性を持つ物質(バクテリオシン、短鎖脂肪酸、ラクトフェリン、リゾチーム)の生産により、通常の微生物叢は、日和見病原体の過剰な繁殖と病原性微生物の導入に対する局所的な保護を提供します。 パイエル板の領域に一定の微生物刺激が存在し、マクロファージやリンパ球と接触すると、十分な強度の局所免疫、免疫グロブリンAの産生、および高い食作用活性が得られます。 同時に、免疫細胞との絶え間ない接触は免疫寛容の根底にあります。 腸内細菌の成分は体循環に浸透し、全身免疫の必要な程度の緊張を維持し、環境の微生物叢との「知り合い」を確保します。 しかし、非病原性と見なされ、毒素の付着、侵入、産生に対する明確な能力を欠き、局所的な防御機構が機能しない腸内細菌でさえ、理論的には腸壁に損傷を与え、場合によっては全身感染を引き起こす可能性があります。 したがって、腸内細菌(プロバイオティクス)に基づく薬の処方は常に正当化されるべきです。 腸内細菌叢の組成違反の原因 腸内微生物集団の構成は、健康な人でも変動しやすく、明らかに、食生活や生活習慣、気候要因に適応する身体の能力を反映しています。 最近まで腸内細菌叢の組成の違反を示すために広く使用されていた「腸内毒素症」の一般的な概念は、そのような変化の本質を完全に反映しておらず、診断を明確に定式化して決定することを可能にしないことを認識すべきです。治療戦術。 したがって、腸内毒素症と誤って解釈されることが多い個々の疾患や症候群を区別することが可能です。 - 細菌異常増殖症候群;
- 抗生物質関連下痢;
- クロストリジウム・ディフィシル感染症(偽膜性腸炎);
- 過敏性腸症候群;
- 旅行者下痢;
- ジサッカリダーゼ欠乏症;
- 免疫不全状態を背景とした腸カンジダ症;
- 黄色ブドウ球菌性腸炎など
これらの疾患にはそれぞれ、独自の原因、特定の危険因子、臨床症状、診断基準、および治療戦術があります。 もちろん、これらの病気を背景に、腸内微生物組成の二次障害が発生する可能性があります。 おそらく、臨床診療で最も一般的なのは、嫌気性菌(特にビフィズス菌)の数の減少、機能的に欠陥のある大腸菌(「ラクトース」、「マンニトール」)の総数の増加を特徴とする細菌の異常増殖の症候群です。 、「インドロネガティブ」)、溶血性大腸菌の含有量およびカンジダ属菌の増殖のための条件の作成。 細菌異常増殖の症候群は、管腔または壁側消化の障害(先天性酵素欠損症、膵炎、腹腔腸症、腸炎)、腸内容物の通過(腸間瘻、腸の「ブラインドループ」、憩室、蠕動障害、腸閉塞); 粘膜の保護特性の低下(制酸状態、免疫不全); 腸内細菌叢に対する医原性の影響(特に衰弱した高齢の患者におけるコルチコステロイド、細胞増殖抑制剤の使用)。 最も好ましい栄養培地がここで作られるので、細菌の過剰な増殖は主に小腸で観察されます。 鼓腸、ゴロゴロ、腹部の輸血、軟便、ビタミン欠乏症、体重減少などの細菌異常増殖症候群の症状は、上記の主な疾患の臨床像でしばしば前面に出てきます。 ミクロフローラの組成における病理学的障害の存在を確認する試験 他の病気の診断と同様に、腸内細菌叢の変化を評価するために適切な方法を使用する必要があります。 ロシアで一般的な腸内毒素症の糞便の播種は、特に微生物叢の病理学的変化が主に小腸に影響を与えるため、有益な検査とは見なされません。 この方法は、腸の感染症やクロストリジウム・ディフィシル感染症を除外するのに役立ちます。 小腸の内容物の吸引物の接種の微生物学的研究は非常に高い精度を持っています。 14C-キシロースを用いた呼吸試験、ラクツロースとブドウ糖を用いた水素試験は、腸内の細菌異常増殖の存在を明らかにすることができますが、微生物叢の組成についてはわかりません。 気液クロマトグラフィー分析による糞便中の脂肪酸のスペクトルの決定は、さまざまな種類の腸内細菌の定量的比率を概算することを可能にします。 プロバイオティクスの使用 20世紀初頭、ロシアの偉大な科学者メチニコフI.I. 腸内生物群集に含まれる乳酸菌の含有量が高いことが、人間の健康と長寿に必要な条件であるという仮説を立てます。 I.I.メチニコフ ビフィズス菌の生きた培養物を薬用に使用する実験を行った。 その後、有益な特性を持つ微生物、いわゆるプロバイオティクスに基づく薬剤の開発が続けられました。 潜在的な治療薬として、乳酸桿菌は当初、最もよく研究された有益な特性を持つ細菌として最も注目されました。 1920年代から。 L.アシドフィルス培養物は、便秘を伴う胃腸疾患の治療のために好酸性乳の形で使用され始めました。 1950年代から。 抗生物質関連下痢を予防するためのL.アシドフィルスおよび他の作物の使用において経験が蓄積されています。 微生物学の発展に伴い、ビフィズス菌、大腸菌、非毒素産生乳酸連鎖球菌-連鎖球菌(または腸球菌)菌の陽性特性に関する新しい情報が得られました。 これらの微生物の特定の菌株およびそれらの組み合わせは、プロバイオティクス調製物の組成に含まれ始めた。 小腸の上皮細胞に付着する微生物の能力を研究するとき、微生物を組み合わせて使用すると、刷子縁の領域に固定する能力が高まることが示されました。 プロバイオティクスの治療作用のメカニズムには、病原性微生物の増殖の抑制、上皮の完全性の回復、免疫グロブリンAの分泌の刺激、炎症性サイトカインの産生の抑制、および代謝プロセスの正常化が含まれます。 そのような薬の開発への現代的なアプローチは、第一に、微生物を組み合わせて使用すること、そして第二に、常温での長期保存を可能にするカプセル化された形でそれらを放出することを意味します。 臨床実験研究は、胃液と胆汁の影響下で、プロバイオティクスが腸に入る前にそれらの活性の最大90%を失うことを示しました。 バクテリアの生存率を高める方法が開発されています-多孔性マイクロキャリアに固定化されているため、調製物に栄養培地成分が含まれています。 「理論的に」有能なプロバイオティクス製剤の開発にもかかわらず、それらのすべてが実際に効果的であるわけではありません。 これまで、多くのオープンおよびブラインド制御研究からのデータが蓄積されており、その結果に基づいて、さまざまな腸疾患における特定の種類の微生物の使用の見通しについていくつかの結論が導き出されています。 L.ラムノサス菌株GGは、小児の感染性胃腸炎、および成人のE.フェシウムSF68の治療に最大の効果があることが示されています。 いくつかの報告によると、ウイルス性胃腸炎後の回復期間中に、乳酸菌を含む薬、またはビフィズス菌や腸球菌との組み合わせを処方することをお勧めします。 細菌性腸感染後の最速の解決は、ビフィズス菌の亜種によって促進されます。 抗生物質関連下痢の発生率を減らす能力は、プロバイオティクスの次の細菌で確立されています。 - L.ラムノサス株GG;
- L.アシドフィルスとL.ブルガリクスの組み合わせ;
- E.フェシウムSF68;
- B.ロンガム;
- ラクトバチルスとB.ロンガムの組み合わせ;
- 薬用酵母Saccharomycesboulardii。
ヘリコバクターピロリ療法の副作用の発生率を減らすために、L。ラムノサスとS.ブーラルディ、またはL.アシドフィルスとビフィズス菌ラクティスの組み合わせを含むプロバイオティクスの併用投与が推奨されます。 L.アシドフィルス、L。ブルガリクス、ストレプトコッカスサーモフィラスの組み合わせは、旅行者下痢の発症を予防するのに効果的であることが示されています。 メタアナリシスによると、S。boulardiiを含むプロバイオティクスは、再発性C.ディフィシル感染症(偽膜性腸炎)の治療に最も効果的です。 過敏性腸症候群では、膨満感、痛みなどの症状の重症度、および症状の総量に対するプロバイオティクスの影響が調査されました。 微生物E.faecium、L。plantarum、およびVSL#3の混合物(Bifidobacterium breve、B。longum、B。infantis、L。acidophilus、L。plantarum、L。casei、L .bulgaricus、S。thermophilus)、L。acidophilus、L。plantarum、B。breveの混合物、およびL.SalivariusとB.infantisの混合物。 ただし、これらのデータは比較的少数の患者グループで取得されたものであるため、過敏性腸症候群の患者の治療に関する国際的な推奨事項にはまだ反映されていません。 慢性炎症性腸疾患(潰瘍性大腸炎やクローン病)の悪化の治療と予防にプロバイオティクスを使用する可能性については、深刻な問題があります。 上皮の完全性の維持と炎症の制御における内因性微生物叢の疑いのない役割、および今日使用されている免疫抑制剤の潜在的な毒性を考えると、プロバイオティクスは炎症性腸疾患の治療における「未来の薬」として大きな期待が寄せられています。 統計資料が不十分なため、実施された研究の結果は、標準的な治療レジメンにプロバイオティクスを含めるための一般的に受け入れられている推奨事項の開発をまだ許可していません。 しかし、クローン病の再発率を低下させる複合プロバイオティクスVSL#3の能力に関して、非常に有望なデータが得られています。 潰瘍性大腸炎では、寛解を維持する効果がE. coli Nissle1917とLactobacillusGGによって実証されました。 寛解の誘導に関して-非常に高用量のVSL#3プロバイオティクス。 プロバイオティクスの任命は、基礎疾患の病因的および病因的治療がない場合にはめったに効果的ではないことを理解する必要があります。 特定の状況に応じて、外科的治療(たとえば、内転筋ループ症候群、腸間瘻)、抗炎症薬および抗菌薬の指定、胃腸運動の調節因子(たとえば、過敏性腸症候群)が必要になる場合があります。 多くのプロバイオティクス製剤がロシアで登録されています。 しかし、それらの圧倒的多数は十分に近代的ではなく、比較研究からの証拠が得られた微生物の種と菌株を含んでいません。 より多くの経験が得られるにつれて、組み合わせたプロバイオティクスの使用に向かう傾向がありました。 Linexの特徴と応用 近年、ロシアの消化器病専門医であるLinexの診療では、細菌を含む混合製剤-自然の腸内細菌叢の代表的なもの:Bifidobacterium infantisv。 liberorum、Lactobacillus acidophilus、および非毒素産生乳酸グループD連鎖球菌-連鎖球菌(Enterococcus)フェシウム。 上記のように、これらのタイプの細菌は、多くの腸疾患の治療において臨床効果を示しており、将来の慢性炎症性腸疾患の治療に含めるために特別な「希望」が固定されている微生物の1つです。 Linexの一部である微生物の培養物は、抗生物質を添加した培地で増殖させることによって得られたため、ほとんどの抗菌剤に耐性があり、抗菌療法の条件下でも増殖することができます。 得られた菌株の抗生物質に対する耐性は非常に高いため、30世代の繰り返し接種後もinvivoでも維持されます。 同時に、他の種類の微生物に対する抗菌耐性の遺伝子の移入はありませんでした。 これは、Linexを使用した結果の観点から非常に重要です。薬剤の服用と中止の両方の背景に対して、病原菌とそれ自体の微生物叢から抗生物質耐性を発症する危険はありません。 Linexの治療効果は、特に抗生物質の使用を背景に、抑制状態で患者自身の腸内細菌叢の機能を一時的に置き換えることです。 Linexに乳酸菌、S。フェシウム、ビフィズス菌を含めることで、腸のさまざまな部分への「治癒的」微生物叢の流れを定量的および定性的にバランスの取れた比率で確保します。 抗生物質関連下痢または原因不明の下痢に苦しむ60人の成人患者を対象としたプラセボ対照試験では、Linexを3〜5日間服用すると、便の正常化が伴いました。 小児では、Linexはすでに発症している抗生物質関連下痢の予防と治療に非常に効果的であることが示されています。 抗ヘリコバクター根絶療法の背景に対してLinexを使用すると、抗生物質の耐性が向上します。鼓腸や下痢の発生率が低下します。 腸内では、Linexの微生物成分はユービオティック効果があるだけでなく、正常な腸内細菌叢のすべての機能を実行します:それらはビタミンB1、B2、B3、B6、B12、H(ビオチン)、PP、Kの合成に関与します、E、葉酸およびアスコルビン酸。 腸内容物のpHを下げることにより、鉄、カルシウム、ビタミンDの吸収に適した条件を作り出します。 乳酸桿菌と乳酸連鎖球菌は、タンパク質、脂肪、複雑な炭水化物の酵素分解を行います。これには、ほとんどの場合、腸疾患に伴うラクターゼ欠乏症の補充効果があります。 Linexは、少なくとも1.2×107個の凍結乾燥細菌を含むカプセルで入手できます。 異なる分子量の成分からなる、ヒトの複雑な生物学的物質を研究するための薬物動態モデルが現在ないという事実のために、薬物の薬物動態はほとんど研究されていません。 乳幼児および2歳未満の子供には、Linexは1カプセルを1日3回、2〜12歳の子供は1〜2カプセルを1日3回、12歳以上の子供および大人は2カプセルを1日3回処方されます。 。 薬は食後に少量の液体で服用します。 生きている微生物叢の死を避けるために、温かい飲み物を飲まないでください。 Linexは、妊娠中および授乳中に処方することができます。 Linexの過剰摂取の報告はありません。 結論 したがって、プロバイオティクス、特にそれらを組み合わせた製剤は、胃腸病学においてますます確固たる地位を占めています。 エビデンスベースが蓄積するにつれて、それらは医師に患者を治療する方法を提供し、細菌の世界との共生に巧みに影響を与え、人体へのリスクを最小限に抑える可能性があります。
文学 - ベルマーS.V. 抗生物質関連腸内毒素症//紀元前。 2004. T. 12. No. 3. P. 148–151。
- Zhikhareva N.S.、Khavkin A.I. 抗生物質関連下痢の治療//紀元前。 2006.Vol。14.No.19.P.1384–1385。
- E.A. Ushkalova 胃腸病学におけるプロバイオティクスの役割// Farmateka。 2007. No. 6. P. 16–23。
- Shenwald S.、Tsar V.Linexの単一のプラセボ対照臨床試験の結果。 INDOC、Lek、1984年。
- Arunachalam K、Gill HS、ChandraRK。 ビフィズス菌(HN019)の食事摂取による自然免疫機能の強化。 Eur J Clin Nutr 2000; 54(3):263-67。
- Bassetti S、Frei R、Zimmerli W. Saccharomycesboulardiiによる治療後のSaccharomycescerevisiaeによる真菌血症。 Am J Med 1998; 105:71-72。
- Bengmark S.結腸洗浄:プレバイオティクスとプロバイオティクス。 Am J Gastroenterol 2000; 95(Suppl。1):S5-7。
- Cremonini F、Di Caro S、Covino M、他 抗ヘリコバクターピロリ療法に関連する副作用に対するさまざまなプロバイオティクス製剤の効果:並行群、トリプルブラインド、プラセボ対照試験。 Am J Gastroenterol 2002; 97:2744-49。
- Elmer GW、Surawicz CM、McFarland LV 生物療法剤。 JAMA 1996; 275:870-76。
- ヒルトンE、アイゼンバーグHD、アルパースタインP、他 カンジダ性膣炎の予防としてのラクトバチルスアシドフィルスを含むヨーグルトの摂取。 Ann Intern Med 1992; 116:353-57。
- Loizeau E.抗生物質関連下痢を予防できますか? Ann Gastroenterol Hepatol 1993; 29:15-18。
- Perapoch J、Planes AM、Querol A、etal。 2人の新生児におけるSaccharomycescerevisiaeによる真菌血症。そのうちの1人だけがUltra-Levuraで治療されていました。 Eur J Clin Microbiol Infect Dis 2000; 19:468-70。
- Perdigon G、Alvarez S、Rachid M、他。 プロバイオティクスによる免疫系の刺激。 J Dairy Sci 1995; 78:1597-606。
- Scarpignato C、Rampal P.旅行者下痢の予防と治療:臨床薬理学的アプローチ。Chemotherapy1995; 41:48–81。
胃の正常な機能の間、胃液の酸性反応と加水分解酵素の高い活性のために、胃の中の微生物叢はほとんど存在しません。 したがって、胃の中では、少量の抗酸菌種(乳酸桿菌、酵母、サルシナベントリキュリなど)に見られます(内容物1mlあたり106 -10 7細胞)。 胃の酸性環境がアルカリ性環境に置き換わっているにもかかわらず、十二指腸や小腸上部には微生物がほとんどいません。 これは、ここに存在する酵素の微生物への悪影響によるものです。 腸球菌、乳酸菌、真菌、ジフテロイドがここにあります(内容物1mlあたり106個の細胞)。 小腸の下部では、徐々に濃縮され、ミクロフローラは大腸のミクロフローラに近づきます。 結腸の微生物叢は、種の数(200種以上)と検出された微生物の数(1mlの内容物あたり109 -10 11細胞)の点で最も多様です。 微生物は糞便の乾燥重量の1/3を占めています。 義務的な微生物叢は、嫌気性(バクテロイデス、ビフィダンバクテリア、ベイロネラ)細菌(96-99%)および通性嫌気性菌(大腸菌、腸球菌、乳酸桿菌-1-4%)によって表されます。 一過性微生物叢は、次の属および種によって表されます:プロテウス、クレブシエラ、クロストリディア、緑膿菌、カンピロバクター、カンジダ属の酵母様真菌など。カンピロバクター属の微生物(C. fennelliae、C。cinaedi、C。hyointestinalis )ヒト免疫不全の大腸に見られる..。 腸内細菌叢の構成は、人の生涯の間に変化します。 新生児では、出生後の最初の数時間で、胎便は無菌状態になります-無菌段階。 第二段階は汚染を増加させる段階です(子供の人生の最初の3日間)。 この期間中、腸はエシェリキア属、ブドウ球菌、腸球菌、酵母様真菌によって支配されます。 第三段階は、腸内細菌叢の形質転換の段階です(生後4日目から始まります)。 乳酸菌、乳酸桿菌、好酸性菌が定着しています。 母乳育児が終わった後、消化管で永続的な生物群集が徐々に形成され始めます。 消化管のミクロフローラでは、粘膜(M)と管腔(P)のミクロフローラが区別され、その組成は異なります。 M-floraは粘膜と密接に関連しており、より安定しており、ビフィダンバクテリアと乳酸桿菌によって表されます。 M-floraは、病原性および日和見性微生物による粘膜への侵入を防ぎます。 P-フローラは、ビフィダムおよび乳酸桿菌とともに、腸の他の恒久的な住民を含みます。 大腸の微生物叢を研究するために、糞便を検査します。糞便は、無菌の木製またはガラス棒で採取され、防腐剤とともに試験管に入れられます。 長期保管は種間の関係を著しく混乱させるため、材料は1時間以内に実験室に届けられます。 グラムに従って染色された塗抹標本および糞便の顕微鏡検査、ならびに栄養培地(遠藤、血液寒天培地、乳塩寒天培地、サブロー寒天培地)への糞便の播種が行われる。 播種は、異なる特性を持つコロニーの数を数え、特定のサンプル中の異なるタイプの微生物の微生物細胞の数を決定できるように実行されます。 必要に応じて、種の生化学的同定と血清学的タイピングが行われます。
正常な人間の微生物叢は、特定の関係と生息地を特徴とする多くの微生物セノーズのセットです。 人体では、生活条件に応じて、特定のマイクロビオトープを含むビオトープが形成されます。 あらゆる微生物症は、食物連鎖と微生物学によって接続された、全体として存在する微生物のコミュニティです。 通常の微生物叢の種類: 1)居住者-永続的で、特定の種の特徴。 2)一時的-一時的に取り残され、特定のビオトープには特徴がありません。 積極的に繁殖しません。 通常のミクロフローラは出生から形成されます。 その形成は、母親の微生物叢と院内環境、摂食の性質に影響されます。 正常な微生物叢の状態に影響を与える要因。 1.内因性: 1)体の分泌機能; 2)ホルモンの背景; 3)酸塩基状態。 2.外因性の生活条件(気候、家庭、生態)。 微生物汚染は、環境と接触しているすべてのシステムの特徴です。 人体では、血液、脳脊髄液、関節液、胸水、胸管のリンパ液、内臓:心臓、脳、肝臓の実質、腎臓、脾臓、子宮、膀胱、肺の肺胞は無菌です。 通常のミクロフローラは、バイオフィルムの形で粘膜を裏打ちします。 この多糖類フレームワークは、微生物細胞の多糖類とムチンで構成されています。 それは正常な微生物叢の細胞の微小コロニーを含んでいます。 バイオフィルムの厚さ-0.1〜0.5mm。 数百から数千のマイクロコロニーが含まれています。 バクテリアのバイオフィルム形成は、追加の保護を提供します。 バイオフィルム内のバクテリアは、化学的および物理的要因に対してより耐性があります。 消化管(GIT)の正常な微生物叢の形成段階: 1)粘膜の偶発的な播種。 乳酸桿菌、クロストリジウム、ビフィズス菌、マイクロコッカス、ブドウ球菌、腸球菌、大腸菌などが消化管に入ります。 2)絨毛の表面にテープバクテリアのネットワークが形成される。 主に棒状のバクテリアが固定されており、バイオフィルム形成の過程が絶えず進んでいます。 正常な微生物叢は、特定の解剖学的構造と機能を備えた独立した体外器官と見なされます。 通常のミクロフローラの機能: 1)あらゆる種類の交換への参加。 2)エキソ製品とエンド製品に関連する解毒、薬用物質の変換と排泄。 3)ビタミンの合成への参加(グループB、E、H、K); 4)保護: a)拮抗的(バクテリオシンの産生に関連する); b)粘膜のコロニー形成抵抗性; 5)免疫原性機能。 最高の汚染率は次の特徴があります。 1)大腸; 2)口腔; 3)泌尿器系; 4)上気道; 2.腸内毒素症 腸内毒素症(腸内毒素症)は、さまざまな好ましくない要因のマクロまたは微生物への曝露の結果として生じる、特定のビオトープに典型的な正常なヒト微生物叢の量的または質的変化です。 腸内毒素症の微生物学的指標は次のとおりです。 1)1つまたは複数の永続的な種の数の減少。 2)バクテリアによる特定の兆候の喪失または新しい兆候の獲得。 3)一過性の種の数の増加。 4)このビオトープでは珍しい新種の出現。 5)正常な微生物叢の拮抗作用の弱体化。 腸内毒素症の発症の理由は次のとおりです。 1)抗生物質と化学療法; 2)重度の感染症; 3)重度の身体疾患; 4)ホルモン療法; 5)放射線の影響; 6)毒性因子; 7)ビタミン欠乏症。 異なるビオトープの腸内毒素症は、異なる臨床症状を示します。 腸内毒素症は、下痢、非特異的大腸炎、十二指腸炎、胃腸炎、および慢性便秘の形で現れる可能性があります。 呼吸器系の腸内毒素症は、気管支炎、細気管支炎、慢性肺疾患の形で発生します。 口腔腸内毒素症の主な症状は、歯肉炎、口内炎、虫歯です。 女性の生殖器系の腸内毒素症は、膣炎として進行します。 これらの症状の重症度に応じて、腸内毒素症のいくつかの段階が区別されます。 1)腸内毒素症が臨床症状を伴わない場合、補償される。 2)正常な微生物叢の不均衡の結果として局所的な炎症性変化が発生した場合、準補償。 3)代償不全。転移性炎症性病巣の出現を伴うプロセスの一般化があります。 腸内毒素症の検査室診断 主な方法は細菌学的検査です。 同時に、その結果を評価する際には、定量的な指標が優先されます。 種の識別は行われず、属に対してのみ行われます。 追加の方法は、試験物質中の脂肪酸のスペクトルのクロマトグラフィーです。 各属には、独自の脂肪酸のスペクトルがあります。 腸内毒素症の矯正: 1)正常な微生物叢の不均衡を引き起こした原因の排除。 2)ユービオティクスとプロバイオティクスの使用。 ユービオティクスは、正常な微生物叢の生きたバクテリシン生成菌株(コリバクテリン、ビフィダンバクテリン、ビフィコールなど)を含む製剤です。 プロバイオティクスは、非微生物性物質であり、独自の通常の微生物叢を刺激する添加物を含む食品です。 刺激物質-オリゴ糖、カゼイン加水分解物、ムチン、ホエイ、ラクトフェリン、食物繊維。
正常な腸内微生物下部消化管の内腔と粘膜の表面に生息する細菌のコロニーです。 それらは、粥状液(食物塊)の高品質な消化、感染性病原体、および有毒な製品に対する局所防御の代謝と活性化に必要です。 正常な腸内細菌叢-これは、消化器系の下部のさまざまな微生物のバランス、つまり、体の生化学的、代謝的、免疫学的バランスを維持し、人間の健康を維持するために必要なそれらの量的および質的比率です。 - 保護機能。正常な微生物叢は、病原性および日和見性微生物に対して顕著な耐性があります。 有益なバクテリアは、腸の特徴ではない他の感染性病原体による腸のコロニー形成を防ぎます。 正常な微生物叢の量が減少した場合、潜在的に危険な微生物が増殖し始めます。 化膿性炎症プロセスが進行し、細菌性血液感染(敗血症)が発生します。 したがって、正常な微生物叢の量を減少させないことが重要です。
- 消化機能。腸内細菌叢は、タンパク質、脂肪、高分子量炭水化物の発酵に関与しています。 有益なバクテリアは、水の作用下で繊維と粥状液の残留物の大部分を破壊し、腸内で必要な酸性度(pH)を維持します。 ミクロフローラは不活性化し(アルカリホスファターゼ、エンテロキナーゼ)、タンパク質分解産物(フェノール、インドール、スカトール)の形成に関与し、蠕動を刺激します。 また、消化管の微生物は胆汁酸の代謝を調節します。 ビリルビン(胆汁色素)のステルコビリンとウロビリンへの変換を促進します。 善玉菌はコレステロール変換の最終段階で重要な役割を果たします。 コプロスタノールはそれから形成され、大腸では吸収されず、糞便中に排泄されます。 Normofloraは、肝臓による胆汁酸の生成を減らし、体内の正常なコレステロール値を制御することができます。
- 合成(代謝)機能。消化管の有益なバクテリアは、ビタミン(C、K、H、PP、E、グループB)と必須アミノ酸を生成します。 腸内細菌叢は鉄とカルシウムのより良い吸収を促進し、したがって貧血やくる病などの病気の発症を防ぎます。 有益なバクテリアの作用により、造血系を調節するビタミン(D 3、B 12および葉酸)の活発な吸収があります。 腸内細菌叢の代謝機能は、抗生物質様物質(アシドフィルス、ラクトシジン、コリシンなど)および生物学的に活性な化合物(ヒスタミン、ジメチルアミン、チラミンなど)を合成する能力にも現れます。病原性微生物。
- 解毒機能。この機能は、腸内細菌叢が量を減らし、糞便を含む有害な有毒物質(重金属塩、亜硝酸塩、変異原物質、生体異物など)を除去する能力に関連しています。 有害な化合物は体の組織に保持されません。 有益なバクテリアはそれらの毒性効果を防ぎます。
- 免疫機能。腸内細菌叢は、免疫グロブリンの合成を刺激します。免疫グロブリンは、危険な感染症に対する体の防御力を高める特殊なタンパク質です。 また、有益なバクテリアは、病原性微生物を吸収して破壊することができる食細胞のシステムの成熟(非特異的免疫)に貢献します(を参照)。

腸内細菌叢の代表者腸内細菌叢全体は次のように分けられます。 - 通常(基本);
- 日和見主義;
- 病原性。
すべての代表者の中には、嫌気性菌と好気性菌があります。 それらの違いは、存在と生命の特性にあります。 好気性菌は、一定の酸素供給の条件下でのみ生きて増殖することができる微生物です。 別のグループの代表者は、義務的(厳格)嫌気性菌と通性(条件付き)嫌気性菌の2つのタイプに分けられます。 それらと他の両方は、酸素の不在下でそれらの存在のためにエネルギーを受け取ります。 偏性嫌気性菌にとっては致命的ですが、通性嫌気性菌にとっては致命的ではありません。つまり、微生物はその存在下に存在する可能性があります。 正常な微生物これらには、グラム陽性菌(ビフィズス菌、乳酸菌、真正細菌、ペプトストレプトコッカス)およびグラム陰性菌(バクテリア、フソバクテリウム、ベイロネラ)嫌気性菌が含まれます。 この名前は、デンマークの細菌学者であるグラムの名前に関連付けられています。 彼は、アニリン染料、ヨウ素、アルコールを使用して塗抹標本を染色するための特別な方法を開発しました。 顕微鏡で見ると、一部の細菌は青紫色でグラム陽性菌です。 他の微生物は変色しています。 これらのバクテリアをよりよく視覚化するために、ピンクに染まる造影剤(フクシン)が使用されます。 これらはグラム陰性菌です。 このグループのすべてのメンバーは、厳格な嫌気性菌です。 それらは腸内細菌叢全体の基礎を形成します(92-95%)。 有益なバクテリアは、生息地から危険な感染性病原体を追い出すのを助ける抗生物質のような物質を生成します。 また、通常の微生物は腸内に「酸性化」(pH = 4.0-5.0)のゾーンを作り、その粘膜の表面に保護膜を形成します。 このようにして、外部からの外来細菌のコロニー形成を防ぐバリアが形成されます。 有益な微生物は、日和見植物相のバランスを調節し、その異常増殖を防ぎます。 ビタミンの合成に参加してください。 これらには、グラム陽性菌(クロストリディア、ブドウ球菌、連鎖球菌、細菌)およびグラム陰性菌(大腸菌および腸内細菌科の他の代表者:プロテウス、クレブシエラ、エンテロバクター、シトロバクターなど)の任意の嫌気性菌が含まれます。
 これらの微生物は日和見です。 つまり、体の健康状態では、通常の微生物叢の効果と同様に、それらの効果はプラスになります。 不利な要因の影響は、それらの過剰な繁殖と病原体への変換につながります。 それは下痢、便の性質の変化(粘液、血液または膿の混合物を伴う液体)および一般的な健康の悪化とともに発症します。 日和見微生物叢の量的成長は、免疫力の低下、消化器系の炎症性疾患、栄養失調、および薬物(抗生物質、ホルモン、細胞増殖抑制剤、鎮痛薬、その他の薬物)の使用に関連している可能性があります。 腸内細菌の主な代表は、典型的な生物学的特性を持っています。 彼女は免疫グロブリンの合成を活性化することができます。 特定のタンパク質は、腸内細菌科の病原性微生物と相互作用し、粘膜への侵入を防ぎます。 さらに、大腸菌は物質、つまり抗菌活性を持つコリシンを生成します。 つまり、正常なエシェリキア菌は、腸内細菌のファミリー(生物学的特性が変化した大腸菌(溶血菌株)、クレブシエラ、プロテウスなど)からの腐敗性および病原性微生物の増殖と繁殖を阻害することができます。 エシェリキア属はビタミンKの合成に参加しています。 日和見微生物叢には、カンジダ属の酵母様真菌も含まれます。 健康な子供や大人にはめったに見られません。 糞便中のそれらの検出は、たとえ少量であっても、除外するために患者の臨床検査を伴う必要があります(酵母様真菌の過剰な成長と繁殖)。 これは特に幼児や免疫力が低下している患者に当てはまります。 病原性微生物これらは、外部から消化管に入り、急性腸感染症を引き起こす細菌です。 汚染された食品(野菜、果物など)や水を食べると、個人の衛生規則や患者との接触に違反して、病原性微生物に感染する可能性があります。 通常、それらは腸には見られません。 これらには、危険な感染症の病原体、仮性結核菌やその他の病気が含まれます。 このグループの最も頻繁な代表者は、赤痢菌、サルモネラ菌、エルシニア菌などです。いくつかの病原体(黄色ブドウ球菌、緑膿菌、非定型大腸菌)は、医療関係者(病原菌株の保菌者)や病院で見つかります。 それらは深刻な院内感染を引き起こします。 すべての病原菌は、タイプ別または便障害(下痢、糞便中の粘液、血液、膿)による腸の炎症の発症および体の中毒の発症を引き起こします。 有益な微生物叢は抑制されます。 腸内のバクテリアの含有量の基準善玉菌| 正常な微生物 | | | 1歳以上の子供 | 大人 |
|---|
| ビフィズス菌 | 10 9 –10 10
| 10 8 –10 10
| 10 10 –10 11
| 10 9 –10 10
|
| 乳酸桿菌 | 10 6 –10 7
| 10 7 –10 8
| 10 7 –10 8
| >10 9
|
| 真正細菌 | 10 6 –10 7
| >10 10
| 10 9 –10 10
| 10 9 –10 10
|
| ペプト連鎖球菌 | <10 5
| >10 9
| 10 9 –10 10
| 10 9 –10 10
|
| バクテロイデス | 10 7 –10 8
| 10 8 –10 9
| 10 9 –10 10
| 10 9 –10 10
|
| フソバクテリウム | <10 6
| <10 6
| 10 8 –10 9
| 10 8 –10 9
|
| Waylonella | <10 5
| >10 8
| 10 5 –10 6
| 10 5 –10 6
|
CFU / gは、1グラムの糞便中の微生物のコロニー形成単位の数です。 条件付き病原菌| 条件付きで病原性の微生物 | 1歳未満の母乳で育てられた赤ちゃん | 人工給餌中の1歳未満の子供 | 1歳以上の子供 | 大人 |
|---|
| 典型的な特性を持つ大腸菌 | 10 7 –10 8
| 10 7 –10 8
| 10 7 –10 8
| 10 7 –10 8
|
| クロストリジウム | 10 5 –10 6
| 10 7 –10 8
| <
=10 5
| 10 6 –10 7
|
| ブドウ球菌 | 10 4 –10 5
| 10 4 –10 5
| <=10 4
| 10 3 –10 4
|
| 連鎖球菌 | 10 6 –10 7
| 10 8 –10 9
| 10 7 –10 8
| 10 7 –10 8
|
| バシラス | 10 2 –10 3
| 10 8 –10 9
| <10 4
| <10 4
|
| カンジダ属のきのこ | 不在 | 不在 | <10 4
| <10 4
|
有益な腸内細菌グラム陽性の重度の嫌気性菌:  グラム陰性の重度の嫌気性菌: - バクテロイデス-多形(サイズと形状が異なる)スティック。 ビフィズス菌と一緒に、彼らは生後6-7日までに新生児の腸にコロニーを形成します。 母乳育児をしていると、50%の子供にバクテロイデスが検出されます。 人工給餌では、ほとんどの場合、それらは播種されます。 バクテロイデスは、胆汁酸の消化と分解に関与しています。
- フソバクテリウム-多形性の棒状微生物。 成人の腸内細菌叢に典型的です。 多くの場合、それらはさまざまな局在化の化膿性合併症を伴う病理学的材料から播種されます。 それらは、白血球毒素(白血球に毒性作用を有する生物学的物質)および重度の敗血症における血栓塞栓症の原因となる血小板凝集因子を分泌することができる。
- Waylonella-球菌微生物。 母乳で育てられている子供では、50%未満のケースで検出されます。 人工栄養を摂取している乳児では、混合物が高濃度で播種されます。 Veilonellaは素晴らしいガス生産が可能です。 それらの過度の生殖により、この独特の特徴は消化不良障害(鼓腸、げっぷおよび下痢)につながる可能性があります。
正常な微生物叢を確認する方法は? 糞便の細菌学的研究は、特別な栄養培地に接種することによって実施されるべきです。 材料は、滅菌スパチュラで糞便の最後の部分から採取されます。 必要な糞便量は20グラムです。 研究用の材料は、防腐剤を含まない滅菌容器に入れられます。 微生物-嫌気性菌は、糞便のサンプリングから播種までの酸素の作用から確実に保護されなければならないという事実を考慮する必要があります。 特殊なガス混合物(二酸化炭素(5%)+水素(10%)+窒素(85%))としっかりと粉砕されたキャップで満たされた試験管を使用することをお勧めします。 材料をサンプリングしてから細菌学的研究を開始するまで、2時間以内に経過する必要があります。 糞便の細菌学的研究は、特別な栄養培地に接種することによって実施されるべきです。 材料は、滅菌スパチュラで糞便の最後の部分から採取されます。 必要な糞便量は20グラムです。 研究用の材料は、防腐剤を含まない滅菌容器に入れられます。 微生物-嫌気性菌は、糞便のサンプリングから播種までの酸素の作用から確実に保護されなければならないという事実を考慮する必要があります。 特殊なガス混合物(二酸化炭素(5%)+水素(10%)+窒素(85%))としっかりと粉砕されたキャップで満たされた試験管を使用することをお勧めします。 材料をサンプリングしてから細菌学的研究を開始するまで、2時間以内に経過する必要があります。
この糞便の分析により、広範囲の微生物を検出し、それらの比率を計算し、目に見える障害(腸内毒素症)を診断することができます。 腸内細菌叢の組成の乱れは、有益な細菌の割合の減少、その通常の生物学的特性の変化に伴う日和見細菌叢の量の増加、および病原体の出現によって特徴付けられます。 通常の微生物叢の含有量が少ない-何をすべきか?微生物の不均衡は、特別な準備の助けを借りて修正されます: - 細菌の1つまたは複数のグループの成長と代謝活動を選択的に刺激することにより、主な微生物叢による腸のコロニー形成を促進します。 これらの薬は薬ではありません。 これらには、有益なバクテリアの基質として機能し、消化酵素の影響を受けない未消化の食品成分が含まれます。 準備:「ヒラックフォルテ」、「デュファラック」(「ノルマーゼ」)、「パントテン酸カルシウム」、「リゾチーム」など。
- –
これらは、腸内細菌のバランスを正常化し、日和見細菌叢と競合する生きた微生物です。 それらは人間の健康に有益な効果をもたらします。 それらは有用なビフィズス菌、乳酸桿菌、乳酸連鎖球菌などを含んでいます。
- 免疫刺激剤。それらは、正常な腸の微生物発生を維持し、体の防御を強化するために使用されます。 準備:「KIP」、「Immunal」、「Echinacea」など。
- 腸内容物の通過を調節する薬。食物の消化と排出を改善するために使用されます。 準備:ビタミンなど。
したがって、その特定の機能(保護、代謝、免疫刺激)を備えた正常な微生物叢は、消化管の微生物生態学を決定し、体の内部環境の恒常性の維持に関与します(恒常性)。
| ![]()
 胃にはミクロフローラがほとんど含まれていません。小腸に多く、特に大腸に多く含まれています。 注意すべきこと 吸引脂溶性必須物質 ビタミンと微量元素は主に空腸で発生します。 したがって、食事療法およびプロバイオティクス製品および栄養補助食品への体系的な包含腸内細菌叢(微生物叢)を調節します。これは腸内吸収のプロセスを調節します。栄養疾患の予防と治療に非常に効果的なツールになります。
胃にはミクロフローラがほとんど含まれていません。小腸に多く、特に大腸に多く含まれています。 注意すべきこと 吸引脂溶性必須物質 ビタミンと微量元素は主に空腸で発生します。 したがって、食事療法およびプロバイオティクス製品および栄養補助食品への体系的な包含腸内細菌叢(微生物叢)を調節します。これは腸内吸収のプロセスを調節します。栄養疾患の予防と治療に非常に効果的なツールになります。 腸管吸収-これは、細胞の層を通って血液やリンパ液にさまざまな化合物が入るプロセスであり、その結果、体は必要なすべての物質を受け取ります。
腸管吸収-これは、細胞の層を通って血液やリンパ液にさまざまな化合物が入るプロセスであり、その結果、体は必要なすべての物質を受け取ります。 左の写真(小腸の絨毛の構造の図):1-円筒形の上皮、2-中央リンパ管、3-毛細血管網、4-粘膜、5-粘膜下組織、6-粘膜の筋板、7-腸陰窩、8-リンパ管..。
左の写真(小腸の絨毛の構造の図):1-円筒形の上皮、2-中央リンパ管、3-毛細血管網、4-粘膜、5-粘膜下組織、6-粘膜の筋板、7-腸陰窩、8-リンパ管..。


 糞便の細菌学的研究は、特別な栄養培地に接種することによって実施されるべきです。 材料は、滅菌スパチュラで糞便の最後の部分から採取されます。 必要な糞便量は20グラムです。 研究用の材料は、防腐剤を含まない滅菌容器に入れられます。 微生物-嫌気性菌は、糞便のサンプリングから播種までの酸素の作用から確実に保護されなければならないという事実を考慮する必要があります。 特殊なガス混合物(二酸化炭素(5%)+水素(10%)+窒素(85%))としっかりと粉砕されたキャップで満たされた試験管を使用することをお勧めします。 材料をサンプリングしてから細菌学的研究を開始するまで、2時間以内に経過する必要があります。
糞便の細菌学的研究は、特別な栄養培地に接種することによって実施されるべきです。 材料は、滅菌スパチュラで糞便の最後の部分から採取されます。 必要な糞便量は20グラムです。 研究用の材料は、防腐剤を含まない滅菌容器に入れられます。 微生物-嫌気性菌は、糞便のサンプリングから播種までの酸素の作用から確実に保護されなければならないという事実を考慮する必要があります。 特殊なガス混合物(二酸化炭素(5%)+水素(10%)+窒素(85%))としっかりと粉砕されたキャップで満たされた試験管を使用することをお勧めします。 材料をサンプリングしてから細菌学的研究を開始するまで、2時間以内に経過する必要があります。 プロセス
プロセス,_%D0%A1%D0%BF%D1%80%D0%B0%D0%B2%D0%B0_%D0%A0%D0%B0%D0%B7%D1%80%D1%83%D1%88%D0%B5%D0%BD%D0%B8%D0%B5_Shigella_flexneri_(%D0%B0)_(%D0%A8%D0%B8%D0%B3%D0%B5%D0%BB%D0%BB%D0%B0_%D0%A4%D0%BB%D0%B5%D0%BA%D1%81%D0%BD%D0%B5%D1%80%D0%B0__%E2%80%94_%D0%B2%D0%B8%D0%B4_%D0%B1%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%B8%D0%B9,_%D0%B2%D0%BE%D0%B7.jpg)
 1886年に、の教義の創設者の一人 腸感染症F.エシェリッヒが最初に記述した 腸大腸菌(Bacterium coli communae)。 1888年のイリヤ・イリヤ・メチニコフは、ルイ・パスツール研究所で働いていたときに、 腸胃腸管への「健康な」バクテリアの導入が効果を変えることができると信じて、体に「自己中毒効果」を持っている微生物の複合体 腸ミクロフローラと中毒を打ち消します。 メチニコフのアイデアの実際的な実装は、治療目的での好酸性乳酸桿菌の使用でした。これは、1920年から1922年に米国で始まりました。 国内の研究者は、20世紀の50年代にのみこの問題を研究し始めました。
1886年に、の教義の創設者の一人 腸感染症F.エシェリッヒが最初に記述した 腸大腸菌(Bacterium coli communae)。 1888年のイリヤ・イリヤ・メチニコフは、ルイ・パスツール研究所で働いていたときに、 腸胃腸管への「健康な」バクテリアの導入が効果を変えることができると信じて、体に「自己中毒効果」を持っている微生物の複合体 腸ミクロフローラと中毒を打ち消します。 メチニコフのアイデアの実際的な実装は、治療目的での好酸性乳酸桿菌の使用でした。これは、1920年から1922年に米国で始まりました。 国内の研究者は、20世紀の50年代にのみこの問題を研究し始めました。







 好気性菌
好気性菌