رشد اطراف عروقی. رشد و گسترش سرطان اولیه پستان. فیبروز پستان: اشکال و علائم
Nabebina T.I.، Dubrovsky A.Ch.، Rolevich A.I.، Polyakov S.L.
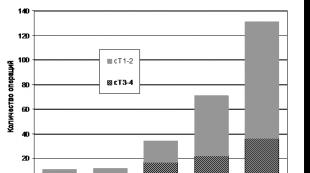
در سال های اخیر، افزایش قابل توجهی در تشخیص سرطان پروستات (PCa) در جمهوری بلاروس وجود داشته است. ظاهراً، این افزایش نشاندهنده روند در حال ظهور در کشورهای CIS به سمت تشخیص زودهنگام سرطان پروستات به دلیل افزایش فراوانی تعیین سطح آنتی ژن اختصاصی پروستات (PSA) در خون بیماران بدون علامت است. افزایش تعداد دفعات تشخیص سرطان پروستات موضعی و پیشرفته منجر به افزایش فراوانی پروستاتکتومی رادیکال (RP) در 3-5 سال گذشته در موسسه تحقیقات دولتی OMR شده است (شکل 1).
یکی از مهم ترین مسائلی که پاتومورفولوژیست ها و اورولوژیست ها با آن مواجه هستند، تعیین صحیح پیش آگهی پس از جراحی برای هر بیمار جداگانه است. نتایج بررسی پاتولوژیک دارو پس از RP با ارزش ترین اطلاعات برای پاسخ به این سوال است. بنابراین، با توجه به Stamey و همکاران. عود سرطان پروستات بعد از RP را می توان با دقت بالایی بر اساس نتایج معاینه پاتولوژیک پیش بینی کرد. این کار که بر اساس آخرین توصیههای گروه کاری انجمن اروپایی اوروپاتی است، مروری بر روش بررسی مورفولوژیکی دارو پس از RP ارائه میکند.
ساختار و عملکرد غده پروستات
نقش و عملکرد غده پروستات (PG) در بدن مرد ظاهراً به طور کامل شناخته نشده است. ترشح غده حدود 20 درصد از حجم مایع منی را تشکیل می دهد؛ این غده حاوی موادی است که حرکت اسپرم را تقویت می کند، اما برای لقاح حیاتی نیست. لوزالمعده قسمت پروگزیمال مجرای ادرار را می پوشاند و به شکل مخروط بریده ای است که قسمت پهن آن رو به مثانه است. سطوح جلو، پشت و جانبی متمایز می شوند، از پایین - راس و از بالا - پایه. یک شیار در امتداد سطح خلفی پانکراس را به دو لوب تقسیم می کند.
لوزالمعده از غدد توبولو آلوئولی تشکیل شده است که به لوبول ها و استرومای اطراف غدد گروه بندی شده اند. مجاری دفعی غدد به مجرای بزرگتر متصل می شوند که به مجرای ادرار پروستات باز می شوند. پانکراس توسط یک کپسول متراکم متشکل از کلاژن، الاستین و مقدار زیادی عضله صاف احاطه شده است. لوزالمعده در خلف با راست روده، مثانه در بالا و استخوان شرمگاهی در جلو، عضلات کف لگن از طرف جانبی و اسفنکتر مخطط ارادی در پایین هم مرز است. خلفی و جانبی به پانکراس به اصطلاح هستند بسته های عصبی عروقی آنها حاوی شاخه های نازک شریان ایلیاک داخلی هستند که خون را به وزیکول های منی و پروستات می رسانند. این رگها با رشتههای عصبی خودمختار (به اصطلاح اعصاب غاری) که از شبکه لگنی میآیند و پانکراس و بدنهای غاردار آلت تناسلی را عصب میکنند، همراهی میکنند. پانکراس توسط شبکه وریدی سانتورینی احاطه شده است.
آناتومی ناحیه ای پانکراس.پانکراس از پنج ناحیه تشکیل شده است: استرومای فیبروماسکولار مرکزی، محیطی، انتقالی، اطراف مجرای ادرار و قدامی (شکل 2). PCa با سرعت متفاوتی در هر ناحیه ایجاد می شود و این فرکانس متناسب با جرم بافت غده در آن نیست. نواحی مرکزی و محیطی - بزرگترین نواحی پروستات - روی هم حدود 95 درصد از بافت غده ای غده پروستات را تشکیل می دهند. ناحیه مرکزی مجرای دفران را در مسیر خود از قاعده پانکراس به سل منی احاطه می کند. ناحیه مرکزی 15 تا 20 درصد از حجم غده را اشغال می کند، اما تنها 5 تا 10 درصد از کل سرطان های پروستات در آن ایجاد می شود. ناحیه محیطی بخشی از غده است که از طریق راست روده لمس می شود. ناحیه مرکزی را احاطه کرده و 70 درصد بافت غده را شامل می شود و حدود 70 درصد آدنوکارسینوم های پانکراس در آن ایجاد می شود. منطقه انتقال بخش های جفت پانکراس است که در طرفین مجرای ادرار پروستات در سطح سل منی قرار دارد و 5٪ باقیمانده غده را اشغال می کند. شایع ترین آسیب شناسی این ناحیه، هیپرپلازی خوش خیم پروستات (BPH) است که می تواند منجر به افزایش قابل توجهی در این نواحی شود که گاهی اوقات از حجم سایر نواحی پروستات بیشتر می شود. در این منطقه، PC کمتر از BPH ایجاد می شود، فرکانس آن حدود 20٪ است. غدد اطراف مجرای ادرار بین مجرای ادرار پروستات و اسفنکتر عضله صاف پروگزیمال مثانه قرار دارند. استرومای فیبروماسکولار سطح قدامی پانکراس را اشغال می کند و عمدتاً از بافت ماهیچه ای تشکیل شده است. آدنوکارسینوما در دو ناحیه آخر ایجاد نمی شوند.
روش پردازش MACROPREPARE بعد از RP
توصیه می شود که فرآورده های تازه (غیرثابت) پس از RP توزین و در سه بعد (طول، عرض و ضخامت) اندازه گیری شوند. ارزیابی وزن نمونه ناخالص پس از RP بسیار مهم است، به ویژه در ترکیب با نظرات پاتولوژیست مربوط به ارزیابی کامل بودن برداشتن غده پروستات. با توجه به اینکه لوزالمعده شکل نامنظمی دارد و فقط نسبت به صفحه ساژیتال متقارن است، ابعاد خطی فرآورده از دقت، تکرارپذیری و ارزش کمتری نسبت به وزن فرآورده برخوردار است. حجم آماده سازی را می توان تقریباً با فرمول مورد استفاده برای تشکیلات گرد تعیین کرد:
از آنجایی که سطح لوزالمعده توسط بافت فیبرو عضلانی پوشیده شده است که مرز بافت شناسی جداگانه و جداگانه ای بین غده و بافت همبند خارج پروستات ایجاد نمی کند، ارزیابی رادیکال بودن عمل می تواند هم برای جراح و هم برای پاتولوژیست بسیار دشوار باشد. توسعه یک تکنیک ویژه برای ارزیابی حاشیه های برداشتن پانکراس. برای تعیین وضعیت لبه های برداشتن اندام، باید تمام سطح پانکراس برداشته شده و ثابت نشده رنگ شود. اگر این کار انجام نشود، مورفولوژیست قادر نخواهد بود در میکرواسلاید تشخیص دهد که آیا تشخیص رشد تومور در امتداد لبه یک حاشیه مثبت جراحی است یا یک اثر برش است. همچنین قضاوت قابل اعتماد در مورد وجود تومور در حاشیه برداشتن بر اساس بررسی سطح نمونه ماکروسکوپی غیرممکن است. برای این منظور میتوان از جوهر سیاه استفاده کرد، زیرا حاشیههای رزکسیون سیاه در معاینه میکروسکوپی راحتتر تشخیص داده میشوند. گزینه دیگر برای رنگ آمیزی سطح غده استفاده از دو رنگ مختلف برای هر طرف آماده سازی است تا جهت گیری بعدی و تشخیص سمت راست و چپ را تسهیل کند. رنگ هایی که معمولا استفاده می شود سبز و قرمز (یا آبی) هستند. پس از رنگ آمیزی سطح، آماده سازی در محلول ثابت کننده مانند محلول بوون یا اسید استیک غوطه ور می شود و پس از آن جوهر روی سطح پانکراس ثابت می شود و در حین سیم کشی شسته نمی شود.
قبل از بریدن لوزالمعده به قطعات، توصیه می شود آن را در فرمالین ثابت کنید، که باعث نازک شدن بخش ها می شود. برای کاهش زمان تثبیت و نفوذ یکنواخت فرمالین به غده، محلول فرمالین 10 درصد خنثی با استفاده از یک سوزن نازک داخل پوستی به دارو تزریق می شود. منطق این روش این است که با غوطه ور شدن معمول غده در محلول فرمالین، نفوذ آن به ضخامت اندام بسیار کند و ناهموار است؛ علاوه بر این، پروتئین هایی با فرمالدئید در بافت ناحیه محیطی پانکراس منعقد می شوند. نفوذ بیشتر محلول را دشوار می کند.
پس از وارد کردن سوزن به عمق بافت پانکراس، محلول فرمالین به آرامی به بافت تزریق می شود در حالی که سوزن به آرامی خارج می شود. چنین تزریق هایی به طور سیستماتیک هر 0.5 سانتی متر در تمام طرف های آماده سازی انجام می شود. در مجموع، حدود 100 میلی لیتر محلول به آماده سازی تزریق می شود، پس از آن پانکراس در 300 - 400 میلی لیتر محلول فرمالین غوطه ور شده و به مدت 24 ساعت ثابت می شود.
پس از تثبیت، آماده سازی به قسمت های جداگانه بریده می شود (شکل 3). ابتدا وزیکول های منی از ماکروپرپریشن حذف می شوند. وزیکول های منی پس از برش از محل ورود به پانکراس (پایه کیسه منی) بررسی می شوند. تقریباً تمام موارد تهاجم تومور به وزیکولهای منی در ابتدا پایه وزیکول منی را درگیر میکند. تومور مستقیماً از طریق مجرای انزال یا به طور ثانویه به دلیل گسترش تومور فراتر از پانکراس به بافت همبند پری پروستاتیک و سپس به لومن وزیکول منی به داخل وزیکولهای منی رشد میکند.
پس از برداشتن وزیکولهای منی با دو برش عرضی به فاصله 4 میلیمتر از لبههای دیستال و پروگزیمال پانکراس، قسمتهای آپیکال و پایه غده از نمونه جدا میشوند. سپس این بخشها در جهت پاراساژیتال عمود بر سطح رنگشده در فواصل 4 میلیمتر همانطور که در شکل نشان داده شده است، به قطعات بریده میشوند. 3.
ماکروآماده سازی باقی مانده پس از برداشتن قسمت های آپیکال و پایه لوزالمعده به طور متوالی در فواصل 4 میلی متری عمود بر محور بلند (آپیکو-پایه) پانکراس بریده می شود. توصیه میشود که این بخشهای لوزالمعده با حروف بزرگ و متوالی حروف الفبا مشخص شوند و همیشه با قسمت اپیکالترین قسمت شروع شده و به قسمت پایه ختم شوند. توصیه می شود پس از قرار دادن در پارافین برای بررسی میکروسکوپی، چنین بخش هایی را از طریق کل پانکراس برش دهید، به عنوان مثال. عمود بر محور بلند (آپیکو-پایه) در سراسر ضخامت پانکراس. یک جایگزین برای این تهیه ریز اسلایدها، تقسیم لایه های 4 میلی متری به ربع هایی است که با اعداد عربی شماره گذاری می شوند. با این روش کل غده پروستات برای بررسی بافت شناسی در دسترس است. اگر از جوهر برای رنگ آمیزی سطح لوزالمعده استفاده می شود، سپس برای علامت گذاری سمت راست، یک برش با چاقوی جراحی در هر بخش در امتداد سطح قدامی جانبی آماده سازی در سمت راست استفاده می شود. پس از چنین برش آماده سازی، قطعات را می توان به مدت 24 ساعت در فرمالدئید ثابت کرد.
دلیل نیاز به جاسازی کامل پروستات در پارافین این است که شناسایی محل و گسترش تومور با بررسی ماکروسکوپی پروستات بریده شده همیشه امکان پذیر نیست، به ویژه در مواردی که سرطان پروستات به طور تصادفی یا در طول غربالگری تشخیص داده شود. مطالعه ای که اخیرا توسط Desai و همکاران منتشر شده است. نشان می دهد که در مقایسه با روش مرسوم تهیه یک میکرواسلاید، پر کردن کامل و برش مکرر یک ماکرو نمونه پس از RP، سرعت تشخیص گسترش تومور به خارج از پانکراس را افزایش می دهد و منجر به افزایش بقای بدون عود در هر مرحله از سرطان پروستات می شود. .
قطعات به دست آمده از لوزالمعده به تدریج در الکل های رقیق شده آبگیری می شوند، در زایلن شفاف می شوند، در پارافین جاسازی می شوند، به لایه هایی به ضخامت 5 میکرون بریده می شوند، با هماتوکسیلین-ائوزین رنگ آمیزی می شوند، پس از آن می توان آنها را از نظر بافت شناسی بررسی کرد (شکل 4). در این حالت باید از کاست های قالب گیری و اسلایدهایی با اندازه های خاص استفاده شود. اسلایدها و روکش ها باید حداقل 76 میلی متر طول و 50 میلی متر عرض داشته باشند.
انتخاب بین به دست آوردن بخش های کل نمونه یا بررسی ربع های آن بستگی به ترجیح پاتولوژیست دارد که تحت تأثیر راحتی و سهولت بررسی مقاطع بزرگ و مشکلات فنی بدست آوردن و نگهداری نمونه هایی با اندازه غیر استاندارد است. تنها تفاوت قابل توجه در روش به دست آوردن دارو با استفاده از این دو رویکرد این است که برش ضخیم تر کل پانکراس مورد نیاز است. علاوه بر این، انجام IHC معمولاً به معرف بیشتری نیاز دارد و فقط به صورت دستی قابل انجام است.
تکنیک برای مطالعه یک آماده سازی کلان پس از RP در مورد pT0
اگر هنگام بررسی میکرواسلایدها، آسیب شناس سرطان پروستات را پیدا نکرد، موارد زیر توصیه می شود: اگر پروستات به طور کامل در پارافین جاسازی نشده باشد، توصیه می شود این کار را انجام دهید. اگر لوزالمعده به طور کامل در پارافین جاسازی شده باشد، میکرواسلایدها پس از بیوپسی باید برای ارزیابی محل تومور بررسی شوند. لازم است پس از برگرداندن بلوک، بخش هایی از دارو پس از RP در این ناحیه بریده شود.
برای تشخیص به اصطلاح "سرطان باقیمانده حداقل"، به ویژه در بیمارانی که قبل از جراحی تحت درمان هورمونی نئوادجوانت قرار گرفته اند، می توان آزمایش ایمونوهیستوشیمی با آنتی بادی ضد CAM را انجام داد.
نتیجه گیری در مورد آماده سازی پروستات
نتیجه گیری کامل و واضح از یک پاتولوژیست در مورد نمونه پانکراس برداشته شده در طی RP برای ایجاد تاکتیک های درمانی بهینه برای بیمار بسیار مهم است. نتیجه گیری باید حاوی اطلاعات مهم بالینی باشد که بر اساس مطالعات ماکرو و میکروسکوپی دارو پس از RP به دست آمده است. تمرکز اولیه باید بر ارزیابی عوامل پیش آگهی موجود در کالج آسیب شناسان آمریکایی دسته های 1 و 2 باشد (جدول 1). این عوامل با اهمیت پیش آگهی اثبات شده و مورد استفاده در درمان بیمار شامل نوع بافتی تومور، درجه تمایز، حجم سرطان، درجه گسترش موضعی و مرحله سرطان پروستات و همچنین وضعیت حاشیه های رزکسیون می باشد. سایر عوامل بیولوژیکی و بالینی مورد مطالعه که اهمیت پیش آگهی آنها هنوز در مطالعات بزرگ تأیید نشده است نیز ممکن است مورد استفاده قرار گیرند.
نوع بافت شناسی سرطان پروستات.طبقه بندی بافت شناسی سرطان پروستات در جدول ارائه شده است. 2. بیش از 95 درصد سرطان های پروستات دارای ساختار معمولی آدنوکارسینوم آسینار هستند. در سال های اخیر، چندین نوع بافت شناسی جدید و غیرمعمول PCa توصیف شده است. این گونهها طیفی از تغییرات را نشان میدهند که میتوانند در آدنوکارسینوما رخ دهند و در صورت شناسایی در نمونه باید در گزارش مورفولوژیکی نشان داده شوند. علاوه بر این، تعدادی از تومورهای لوزالمعده مانند سلول های انتقالی، سلول های سنگفرشی، بازالوئید و آدنوئید کیستیک کارسینوما وجود دارد که رفتار بیولوژیکی و روش های درمان آنها به طور قابل توجهی با سرطان پروستات معمولی متفاوت است که باعث تشخیص دقیق نوع تومور می شود. برای تعیین تاکتیک های درمان بیمار بسیار مهم است.
درجه تمایز (درجه بدخیمی).مهم ترین پیش بینی کننده پیشرفت PCa پس از RP، امتیاز گلیسون تعیین شده در آماده سازی پس از RP است (جدول 3). سیستم گلیسون روش انتخابی برای تعیین درجه بدخیمی تومور است؛ استفاده از اصطلاحات "خوب تمایز یافته"، "تمایز متوسط" و "تمایز ضعیف" برای تعیین درجه بدخیمی PCa توصیه نمی شود. نمره گلیسون از دو جزء تشکیل شده است: درجه اولیه (متداول ترین) و درجه دوم (دومین رایج ترین) درجه گلیسون. اگر نمونه نمره گلیسون ثانویه را نشان ندهد، نمره اولیه گلیسون دو برابر می شود تا نمره گلیسون به دست آید. نمرات اولیه و ثانویه گلیسون باید بعد از نمره گلیسون در پرانتز نشان داده شود (به عنوان مثال: نمره گلیسون 7 (3 + 4)). برای گروه بندی مجموع گلیسون به دسته ها به منظور خلاصه کردن نتایج درمان و غیره، گروه بندی زیر توصیه می شود (جدول 4): 2-5، 6، 7، 8-10، یا 2-6، 7، 8-10 .
اگر دو یا چند تومور متمایز در نمونه RP شناسایی شود، ممکن است مجموع گلیسون هر تومور گزارش شود، یا نمره گلیسون مهمترین تومور باید گزارش شود. به عنوان مثال، اگر یک تومور بزرگ در ناحیه انتقال پانکراس با نمره گلیسون 5 و یک تومور کوچکتر جداگانه در ناحیه محیطی با نمره گلیسون 7 وجود داشته باشد، هر دو گلیسون یا حداقل نمره گلیسون از تومور اخیر باید گزارش شود، نه میانگین نمره گلیسون.
با توجه به مقدار بیشتر تومور در نمونه پس از RP که برای تحقیق در دسترس است (بر خلاف مواد بیوپسی)، اغلب ممکن است بیش از دو درجه گلیسون در تومور شناسایی شود، به عنوان مثال. نمره ثالث گلیسون وجود دارد. از آنجایی که سیستم اصلی گلیسون فقط نمرات گلیسون اولیه و ثانویه را در نظر می گیرد، در رویکرد درجه بندی تومورها با نمرات گلیسون ثالث اختلاف نظر وجود دارد، اگرچه وجود نمره گلیسون سوم بر پیش آگهی تأثیر می گذارد. بنابراین، سرعت پیشرفت PCa با نمره گلیسون 5-6 و نمره سوم 4 تقریباً مشابه تومورهای با نمره گلیسون 7 است. به نوبه خود، تومورهایی با نمره گلیسون 7 و نمره سوم. از 5، مانند تومورهایی با نمره گلیسون 8 رفتار می کنند. از طرف دیگر، چنین تفاوت هایی در PCa با نمره گلیسون 8 و نمره سوم 5 مشاهده نمی شود، ظاهراً به دلیل تعداد کم بیماران با این آسیب شناسی است. و همچنین چنین پیش آگهی نامطلوبی برای PCa با نمره گلیسون 8 که وجود نمره ثالث 5 نمی تواند به طور قابل توجهی آن را بدتر کند.
موضوع بحث برانگیز دیگر در تعیین درجه بدخیمی، مسئله تعیین مجموع گلیسون در تومورهای متشکل از 95٪ از همان نوع گلیسون است که در آن فقط مقدار کمی تومور درجه پایین وجود دارد. به عنوان مثال، یک تومور پانکراس حاوی بیش از 95 درصد بافت تومور با نمره گلیسون 3 و< 5% с показателем 4, некоторые эксперты оценили бы как имеющую сумму Глисона 3 + 3 = 6, поскольку эти специалисты считают, что для учета показателя Глисона в сумме, участок опухоли с этим показателем должен занимать более 5% от всего объема опухоли. Другие морфологи при такой опухоли установили бы сумму Глисона 3 + 4 = 7, поскольку известно, что присутствие более низкодифференцированного компонента, даже если он занимает менее 5% от объема опухоли, имеет существенное негативное влияние на течение опухолевого процесса.
علاوه بر نمره گلیسون، سیستم های درجه بندی دیگری مانند سیستم WHO یا MD Anderson ممکن است استفاده شود، اما نمره گلیسون باید مشخص شود تا امکان مقایسه داده های بالینی یا نتایج درمان را فراهم کند. اگر بیماران قبل از جراحی تحت درمان هورمونی قرار گرفتند، سیستم گلیسون و همچنین سیستمهای WHO و MD Anderson قابل استفاده نیستند. در این شرایط، پاتولوژیست باید میزان پسرفت تومور را نشان دهد.
درجه شیوع محلیاین دسته شامل گسترش تومور فراتر از کپسول (شکل 2) و درگیری وزیکول های منی است. مشکلات در تعیین رشد تومور فراتر از اندام به این دلیل است که کپسول پانکراس به عنوان یک ساختار آناتومیک همیشه به وضوح تعریف نشده است. در برخی نواحی در امتداد لبه لوزالمعده، ممکن است لایهای از بافت فیبری یا فیبرو عضلانی تشخیص داده شود، اگرچه در مناطق دیگر در امتداد لبه اندام، غدد پانکراس معمولی بدون حضور واضح کپسول تشخیص داده میشوند. به همین دلیل، اصطلاح "نفوذ کپسولی" با "اکستنشن خارج پروستاتیک" (EPE) جایگزین شده است. در صورت تشخیص تماس تومور با بافت چربی، گسترش خارج پروستاتیک تومور ایجاد می شود. همچنین، گسترش سرطان پروستات به خارج از اندام را می توان در صورت درگیری فضاهای اطراف عصبی بسته عصبی عروقی، حتی در غیاب تهاجم تومور به بافت چربی اطراف پروستات، ایجاد کرد.
مشکلاتی در ارزیابی گسترش تومور خارج پروستاتیک در حضور واکنش دسموپلاستیک متراکم بافت همبند پری پروستاتیک در پاسخ به تهاجم PCa به آن وجود دارد. این واکنش اغلب در طول درمان با هورمون نئوادجوانت قبل از جراحی مشاهده می شود. به همین دلیل، تشخیص گسترش تومور در خارج از پانکراس از رشد تومور در بافت فیبری پانکراس دشوار است. برای حل مشکلات، توصیه می شود از یک میکروسکوپ با بزرگنمایی کم برای یافتن لبه پانکراس در ناحیه مجاور که تومور وجود ندارد، استفاده کنید و لبه غده را تا محل رشد فرضی کپسول ردیابی کنید. گسترش سرطان پروستات فراتر از کانتور گرد پانکراس نشان دهنده گسترش خارج پروستات است.
در برخی از نواحی، مانند گردن مثانه یا ناحیه قدامی پانکراس، بافت چربی پری پروستاتیک کمی وجود دارد یا اصلا وجود ندارد. در این نواحی، در صورت گسترش سرطان پروستات به خارج از مرزهای غده طبیعی پانکراس، توصیه میشود که وجود گسترش تومور خارج پروستات مشخص شود. در ناحیه راس پانکراس، تشخیص تومور در بین عضلات مخطط به عنوان پایه ای برای ایجاد گسترش خارج پروستات سرطان پروستات عمل نمی کند.
وسعت گسترش تومور به خارج از پانکراس می تواند از وجود چندین غده در خارج از اندام تا مواردی با گسترش گسترده در خارج از کپسول متفاوت باشد. میزان انتشار خارج پروستاتیک دارای اهمیت پیش آگهی است. روش های مختلفی برای تعیین کمیت گسترش تومور خارج پروستات وجود دارد. اگر مساوی یا کمتر از دو میدان دید در بزرگنمایی میکروسکوپ بالا (40×) باشد، گسترش خارج پروستات "کانونی" در نظر گرفته می شود. گسترش فراتر از کپسول در بیش از دو میدان دید با بزرگنمایی میکروسکوپ بالا (40×) "گسترده" در نظر گرفته می شود.
مرحله سرطان پروستات.در حال حاضر، برای تعیین مرحله سرطان پروستات، توصیه می شود از طبقه بندی TNM اتحادیه بین المللی علیه سرطان (UICC) و کمیته مشترک آمریکایی سرطان (AJCC) که در سال 2002 اصلاح شده است استفاده شود. طبقه بندی بالینی (cTNM) در معاینه اولیه بیمار قبل از درمان یا در صورت عدم امکان استفاده از طبقه بندی پاتولوژیک. طبقه بندی پاتولوژیک TNM (pTNM) بر اساس نتایج بررسی ماکرو و میکروسکوپی است. هنگام استفاده، پیشوند "p" است. بنابراین، برای استفاده از دسته pT، برداشتن تومور اولیه یا بیوپسی برای ایجاد بالاترین دسته pT مورد نیاز است. برای استفاده از نماد pN، برداشتن غدد لنفاوی منطقه ضروری است و pM به معنای تأیید متاستازهای دوردست است.
اگر قبل از مرحله بندی از درمان قبل از عمل (نئوادجوانت) استفاده شده باشد، صرف نظر از نوع (پرتودرمانی، شیمی درمانی، هورمون درمانی به صورت جداگانه یا ترکیبی)، هنگام ارزیابی وسعت تومور با استفاده از سیستم TNM از پیشوند "y" استفاده می شود.
حاشیه جراحی مثبتبیماران RP با حاشیه های جراحی مثبت در مقایسه با بیماران با حاشیه منفی به طور قابل توجهی در معرض خطر پیشرفت سرطان هستند. دو دلیل اصلی حاشیه های مثبت شرح داده شده است (شکل 5):
— علت غیر ایتروژنیک:حاشیه مثبت به دلیل عدم امکان برداشت گسترده جزء خارج پروستاتیک تومور پانکراس در طول عمل مشاهده می شود.
— برش کپسولی (علت ایتروژنیک):دلیل حاشیه مثبت، تشریح تومور واقع در غده پروستات (یعنی یک برش کپسولی) است. چنین مواردی به عنوان مرحله پاتولوژیک T2X نامیده می شود. این بدان معنی است که اگرچه تومور فقط در داخل اندام تشخیص داده می شود، اما نمی توان تعیین کرد که آیا سرطان پروستات به خارج از کپسول در ناحیه برش کپسول گسترش یافته است، زیرا لبه سرطان پروستات در بدن بیمار باقی مانده است.
اگر توموری در امتداد لبه رنگآمیزی نمونه تشخیص داده نشود، حاشیه جراحی بهعنوان "منفی" و اگر تومور با لبه رنگآمیزی پانکراس در تماس باشد، "مثبت" تعیین میشود. وجود حاشیه مثبت جراحی نباید به عنوان گسترش تومور خارج پروستات تفسیر شود. همچنین لازم است احتمال وجود حاشیه های برداشتن مثبت کاذب به دلیل نفوذ دارو از طریق ترک ها یا برش های سطح پانکراس را به خاطر بسپارید. در نتیجه، لازم است محلی سازی لبه مثبت و همچنین شیوع آن (به عنوان مثال، تعداد بلوک های مثبت، اندازه خطی لبه بر حسب میلی متر) مشخص شود. به دلیل تشخیص مکرر حاشیه مثبت در راس پانکراس، این قسمت باید با توجه ویژه مورد بررسی قرار گیرد.
اختلافات اصلی بین آسیب شناسان در تعیین حاشیه های مثبت می تواند در دو موقعیت رخ دهد. اولین وضعیت زمانی رخ می دهد که تومور بسیار نزدیک به لبه پیدا می شود، اما به طور کامل لبه رنگی پانکراس را لمس نمی کند. در حالت دوم، اگر رنگ لبه بسیار کم رنگ باشد، ممکن است خطا رخ دهد.
در شرایطی که تومور قاعده لوزالمعده یا گردن مثانه را درگیر می کند و حاشیه های مثبتی در این ناحیه وجود دارد، در تعریف دسته T اختلاف نظر وجود دارد. این مشکل به این دلیل به وجود می آید که مرز مشخصی بین استرومای قاعده لوزالمعده و عضلات گردن مثانه وجود ندارد، اغلب غدد بیرون زده و با عضلات صاف مثانه مخلوط می شوند، بنابراین بسیار دشوار است. محل انتقال پایه پانکراس به گردن مثانه را تعیین کنید. تعدادی از متخصصان درگیری میکروسکوپی عضلات گردن مثانه در آماده سازی پس از RP را pT4 تعریف می کنند. سایر آسیب شناسان معتقدند که ضایعات میکروسکوپی عضله صاف گردن مثانه نباید pT4 در نظر گرفته شود، زیرا دومی فقط باید به ضایعات ماکروسکوپیک گردن مثانه اشاره کند.
برای طبقه بندی تومور باقیمانده در بدن بیمار، از سیستم R استفاده می شود (جدول 5). این طبقه بندی می تواند هم توسط جراح برای نشان دادن درجه رادیکال بودن عمل و هم توسط پاتولوژیست بر اساس مطالعه حاشیه های رزکسیون مورد استفاده قرار گیرد. در بیماران مبتلا به تومور قابل تشخیص در حاشیه رزکسیون در طول معاینه ماکرو یا میکروسکوپی، می توان از نمادهای R1 یا R2 استفاده کرد.
نتیجه گیری پاتولوژیست باید منعکس کننده وجود بافت طبیعی پانکراس در لبه برداشتن اندام باشد. این ممکن است به توضیح دلیل وجود سطح قابل تشخیص PSA بعد از RP کمک کند. در این مورد، سطح قابل تشخیص PSA پس از جراحی با سرطان پروستات عود کننده یا وجود تومور باقیمانده مرتبط نیست، بلکه به دلیل برداشتن ناقص بافت پانکراس ایجاد می شود.
حجم سرطان پروستات.یکی از بحث برانگیزترین مسائل اندازه گیری حجم تومور در یک نمونه پس از RP است. این به دلیل قابل بحث بودن اهمیت پیش آگهی مستقل این شاخص است. با این حال، تنها یک موقعیت وجود دارد که ارزیابی حجم تومور برای تعیین پیش آگهی بیمار مهم است. از آنجایی که با استفاده از غربالگری فشرده می توان به اصطلاح را شناسایی کرد. PCa "غیر قابل توجه"، که با حجم تومور کمتر از 0.5 سانتی متر مکعب تعریف می شود، پیش آگهی چنین PCa صرف نظر از روش درمانی بسیار مطلوب در نظر گرفته می شود. بنابراین، اگر پاتولوژیست نشان دهد که حجم تومور در نمونه پس از RP کمتر از 0.5 سانتی متر مکعب است، احتمال درمان در این مورد تقریبا 100٪ است.
در حال حاضر هیچ روش استانداردی برای ارزیابی حجم تومور وجود ندارد. دقیق ترین حجم با استفاده از پلان سنجی یا با استفاده از روکش شبکه ای روی یک میکرونمونه تعیین می شود. با این حال، این روش ها نیاز به زمان و تلاش زیادی دارند که استفاده از آنها را در این مورد غیر قابل توجیه می کند. در حال حاضر توصیه می شود که حداقل نسبت (درصد) بافت پانکراس تحت تأثیر تومور تخمین زده شود.
تهاجم عروقی.طبق سیستم مرحلهبندی AJCC/UICC، تهاجم عروقی (لنفاوی یا وریدی) به تعریف دسته T کمکی نمیکند. بنابراین، وقتی تهاجم عروقی تشخیص داده میشود، باید به طور جداگانه علامتگذاری شود. از آنجایی که وجود تهاجم عروقی معمولاً در تومورهای پیشرفته رخ می دهد، ارزش پیش آگهی مستقل این شاخص هنوز دقیقاً تأیید نشده است.
تهاجم پری عصبیتهاجم پری عصبی یکی از مکانیسم های اصلی گسترش تومور به خارج از پانکراس است. تهاجم پری عصبی در آماده سازی پس از RP بسیار رایج است، بنابراین بسیاری از متخصصان این را یک پارامتر پیش آگهی در نظر نمی گیرند و آن را در نتیجه گیری نشان نمی دهند.
نتیجه
در سالهای اخیر، تلاشهای زیادی برای بهبود و استاندارد کردن ارزیابی پاتولوژیک نمونهها پس از RP صورت گرفته است که توانایی میکروسکوپ نوری استاندارد برای تعیین فاکتورهای پیش آگهی در بیماران مبتلا به RP را افزایش داده است. امروزه بر اساس این تکنیک استاندارد، با احتمال بالایی می توان روند روند تومور را در یک بیمار خاص پیش بینی کرد. وظیفه پاتومورفولوژیست های بلاروس در مرحله کنونی تسلط بر تجربه چندین ساله جهانی است که هدف نهایی آن بهبود نتایج درمان بیماران مبتلا به سرطان پروستات است.
ادبیات
- نئوپلاسم های بدخیم در بلاروس 1996-2005 / S.M. پولیاکوف، ال.ف. لوین، N.G. شبکو; ویرایش شده توسط A.A. گراکوویچ، I.V. Zalutsky.- Mn.: BelTsMT، 2006.- 194 p.
- Stamey T.A.، Yemoto C.M.، McNeal J.E.، Sigal B.M.، Johnstone I.M. سرطان پروستات بسیار قابل پیش بینی است: یک معادله پیش آگهی بر اساس تمام متغیرهای مورفولوژیکی در نمونه های رادیکال پروستاتکتومی // J. Urol.- 2000.- Vol. 163.- ص 1155-1160.
- Montironi R., van der Kwast T, Boccon-Gibod L., Bono A.V., Boccon-Gibod L. Handling and Patology Reporting of Radical Prostatectomy Eximens // Eur. Urol.- 2003.- جلد. 44.- ص 626-636.
- مک نیل جی.ای. منشا و توسعه کارسینوم در پروستات // سرطان.- 1969.- جلد. 23.- ص 24-34.
- Bostwick D. G.، Foster C. S.، Algaba F.، Hutter R. V. P.، Montironi R.، Mostofi F. K.، و همکاران. فاکتورهای بافت پروستات در: مورفی جی، دنیس ال، خوری اس، پارتین الف، دنیس ال، ویراستاران. سرطان پروستات. دومین مشاوره بین المللی در مورد سرطان پروستات، با حمایت WHO و UICC. لندن: Plymbridge Distributors Ltd. 2000
- Bostwick D. G.، Grignon D. J.، Hammond E. H.، Amin M. B.، Cohen M.، Crawford D.، و همکاران. عوامل پیش آگهی در سرطان پروستات بیانیه اجماع کالج آسیب شناسان آمریکایی 1999 // Arch. پاتول. آزمایشگاه. Med.- 2000.- Vol. 124.- ص 995-1000.
- Littrup P.J.، ویلیام C.R.، Egglin T.K.، Kane R.A. تعیین حجم پروستات با US transrectal برای غربالگری سرطان. II. دقت تکنیک های in vitro و in vivo // Radiology.- 1991.- Vol. 179.- ص 49-53.
- Mazzucchelli R.، Santinelli A.، Lopez-Beltran A.، Scarpelli M.، Montironi R. ارزیابی عوامل پیش آگهی در نمونه های رادیکال پروستاتکتومی با سرطان // Urol. Int.- 2002.- Vol. 68.- ص 209-215.
- Hoedemaeker R.F.، Ruijter E.T.G.، Ruizeveld-de Winter J.A.، van der Kaa C.A.، گروه مطالعاتی BIOMED II MPC، van der Kwast T.H. پردازش نمونه های رادیکال پروستاتکتومی یک پروتکل جامع و استاندارد // J. Urol. Pathol.- 1998.- Vol. 9.- ص 211-222.
- Ohori M.، Scardino P.T.، Lapin S.L.، Seale-Hawkins C.، Link J.، Wheeler T.M. مکانیسم ها و اهمیت پیش آگهی درگیری وزیکول منی توسط سرطان پروستات // Am. جی. سرگ. Pathol.- 1993.- Vol. 17.- ص 1252-1261.
- Stamey T.A., McNeal J.E., Freiha F.S., Redwine E. مطالعات مورفومتریک و بالینی روی 68 پروستاتکتومی رادیکال متوالی // J. Urol.- 1988.- Vol. 139.- ص 1235-1241.
- Desai A.، Wu H.، Dun L.، Sesterhenn I.A.، Mostofi F.K.، McLeod D.، و همکاران. جاسازی کامل و گام برش نزدیک نمونههای پروستاتکتومی رادیکال، هم تشخیص اکستنشن خارج از پروستات را افزایش میدهد و هم با افزایش بقای عاری از بیماری در مرحله بیماران سرطان پروستات مرتبط است // سرطان پروستات بیماریهای پروستات.- 2002.- جلد. 5.- ص 212-218.
- Bostwick D.G., Montironi R. ارزیابی نمونه های رادیکال پروستاتکتومی: اهمیت درمانی و پیش آگهی // Virchows Arch.- 1997.- Vol. 430.- ص 1-16.
- مونتیرونی آر.، شولمن سی.سی. تغییرات پاتولوژیک در ضایعات پروستات پس از دستکاری آندروژن // J. Clin. Pathol.- 1998.- Vol. 51.- ص 5-12.
- Srigley J.R.، Amin M.B., Humphrey P.A. غده پروستات: خلاصه مورد سرطان آسیب شناسی جراحی، اسناد پس زمینه و یادداشت های توضیحی. کالج آسیب شناسان آمریکایی تایید شد. ftp://ftp.cap.org/cancerprotocols/prostate05p.doc.
- Gleason D.R.، Mellinger G.T.، گروه تحقیقات اورولوژی تعاونی اداره جانبازان. پیش بینی پیش آگهی آدنوکارسینوم پروستات با درجه بندی ترکیبی بافت شناسی و مرحله بندی بالینی // J. Urol.- 1974.- Vol. 111.- ص 58-64.
- گلیسون دی.اف. درجه بندی بافت شناسی سرطان پروستات: دیدگاه // هوم. Pathol.- 1992.- Vol. 23.- ص 273-279.
- Bostwick D.G. درجه بندی گلیسون بیوپسی سوزنی پروستات: ارتباط با درجه در 316 پروستاتکتومی همسان // Am. جی. سرگ. Pathol.- 1994.- Vol. 18.- ص 796-803.
- Partin A.W.، Kattan M.W.، Subong E.N.P.، و همکاران. ترکیبی از آنتی ژن اختصاصی پروستات، مرحله بالینی و امتیاز گلیسون برای پیش بینی مرحله پاتولوژیک سرطان موضعی پروستات: یک به روز رسانی چند نهادی // JAMA.- 1997.- جلد. 277.- ص 1445-1451.
- Vis A.N.، Hoedemaeker R.F.، van der Kwast T.H.، Schroder F.H. تعریف پنجره فرصت تومور در غربالگری سرطان پروستات: اعتبار سنجی یک مدل طبقه بندی پیش بینی کننده // Prostate.- 2001.- Vol. 46.- ص 154-162.
- Montironi R.، Bartels P.H.، Thompson D.، و همکاران. آدنوکارسینوم پروستات فاقد آندروژن: ارزیابی تغییرات مرتبط با درمان در مقابل عدم اثر درمانی متمایز با شبکه اعتقادی بیزی // Eur. Urol.- 1996.- Vol. 30.- ص 307-315.
- Grignon D.J., Sakr W.A. مرحله پاتولوژیک کارسینوم پروستات مسائل چیست // سرطان.- 1996.- جلد. 78.- ص 337-340.
- Sobin L.H.، Wittekind C.، ویراستاران. طبقه بندی TNM تومورهای بدخیم: اتحادیه بین المللی علیه سرطان. ویرایش 6 نیویورک: ویلی-لیس; 2002.
- Sakr W.A., Wheeler T.M., Blute M., et al. مرحله بندی و گزارش سرطان پروستات؛ نمونه برداری از نمونه پروستاتکتومی رادیکال // Cancer.- 1996.- Vol. 78.- ص 366-369.
- اپستین جی.آی. ارزیابی نمونه های پروستاتکتومی رادیکال: پیامدهای درمانی و پیش آگهی // پاتول. Annu.- 1991.- Vol. 26.- ص 159-210.
- Hoedemaeker R.F., Vis A.N., van der Kwast T.H. مرحله بندی سرطان پروستات // Microsc. Res. تکنیک.- 2000.- جلد. 51.- ص 423-429.
- L.D واقعی بررسی آسیب شناسی جراحی غده پروستات. نظرسنجی عملی توسط انجمن آسیب شناسان بالینی آمریکا // Am. جی. کلین. Pathol.- 1994.- Vol. 102.- ص 572-579.
جدول 1. توزیع عوامل پیش آگهی بسته به اهمیت آنها (بر اساس اجماع کالج آسیب شناسان آمریکایی 1999).
| دسته 1. عوامل با اهمیت پیش آگهی اثبات شده، در نظر گرفته شده در درمان بیماران: |
|
|
|
|
| دسته 2. عواملی که از نظر بیولوژیکی و بالینی مورد مطالعه قرار گرفته اند اما اهمیت آنها در مطالعات به خوبی طراحی شده نشان داده نشده است: |
|
|
|
|
| دسته 3. عوامل دیگری که به اندازه کافی برای نشان دادن ارزش پیش آگهی آنها مطالعه نشده اند: |
|
|
|
|
|
|
|
جدول 2. طبقه بندی بافت شناسی تومورهای پانکراس
| 1. آدنوکارسینوم (معمولی، مشخص نشده است) |
| 2. انواع خاصی از آدنوکارسینوم و سایر سرطان ها: |
|
|
|
|
|
|
|
|
|
|
|
جدول 3. درجه گلیسون.
جدول 4. گروه بندی مجموع گلیسون به دسته های پیش آگهی.
جدول 5. طبقه بندی تومور باقیمانده (باقی مانده).

برنج. 1. دینامیک فراوانی اجرای RP در موسسه دولتی "موسسه تحقیقاتی OMR به نام. N.N. الکساندروا


برنج. 3. روش فرآوری و برش دارو پس از RP
I. ملاک مطلق- تأثیر تومور بر عملکرد ارگانیسم به عنوان یک کل (این ویژگی در تعریف تومورهای خوش خیم و بدخیم منعکس شده است).
II. معیارهای نسبی:
1. الگوی رشد تومور(تومورهای خوش خیم معمولاً به طور گسترده رشد می کنند؛ تومورهای بدخیم معمولاً به صورت تهاجمی رشد می کنند). برخی از تومورهای خوش خیم به صورت تهاجمی رشد می کنند (به عنوان مثال، فیبروماتوز)، و برخی از تومورهای بدخیم به طور گسترده رشد می کنند (به عنوان مثال، برخی از تومورهای بالغ داخل جمجمه). اگر رشد آهسته تهاجمی یک تومور خوش خیم بالغ باعث تخریب بافت طبیعی مجاور شود، به چنین توموری گفته می شود. تومور خوش خیم با رشد محلی مخرب(مثلا آملوبلاستوم).
2. متاستاز(تومورهای خوش خیم معمولاً متاستاز نمی دهند؛ تومورهای بدخیم معمولاً متاستاز می دهند). برخی از تومورهای خوش خیم می توانند متاستاز بدهند (لیومیوم رحم گاهی اوقات به ریه ها، خال های رنگدانه به غدد لنفاوی منطقه متاستاز می دهد)، در حالی که برخی از تومورهای بدخیم متاستاز نمی دهند (این تومورها نامیده می شوند. تومورهای بدخیم با رشد محلی مخرببه عنوان مثال کارسینوم سلول بازال پوست).
3. بلوغ تومور(تومورهای خوش خیم معمولا بالغ هستند، تومورهای بدخیم معمولا نابالغ هستند). با این حال، برخی از تومورهای خوش خیم نابالغ هستند، به عنوان مثال، خال جوانی (که قبلا ملانوم جوان نامیده می شد) توسط سلول های رنگدانه نابالغ با علائم آتیپی سلولی برجسته تشکیل می شود. برعکس، تعدادی از تومورهای بدخیم دارای ساختار بالغ هستند (بنابراین، تمام تومورهای بالغ در حفره جمجمه که به اندازه خاصی می رسند، بدخیم می شوند).
اتیولوژی تومورهای بدخیم
علت شایع رشد بدخیم است نارسایی سیستم مقاومت آنتی بلاستوما(سیستم دفاع ضد توموری) که عناصر اصلی آن آنزیم های ترمیم کننده DNA، آنتی انکوژن ها (مثلا p53) و سلول های NK (سلول های کشنده طبیعی) هستند. نارسایی سیستم مقاومت ضد بلاستوما به دلیل قرار گرفتن در معرض شدید سرطان زا، حالت های نقص ایمنی، کمبود آنزیم های ترمیم DNA و عملکرد آنتی انکوژن ها و همچنین تراکم بافت اسکار ("سرطان در اسکار") ایجاد می شود.
اثرات سرطان زای شدید انواع تروماتیک، حرارتی، تشعشعی، شیمیایی و ویروسی سرطان زایی وجود دارد.
1. سرطان زایی ضربه ای- ایجاد تومور بدخیم در محل آسیب (به عنوان مثال، آسیب مزمن به مرز قرمز لب می تواند منجر به ایجاد سرطان شود).
2. سرطان زایی حرارتی- ایجاد تومور بدخیم در مکان هایی که قرار گرفتن در معرض دوز طولانی مدت در دمای بالا (در محل های سوختگی، به عنوان مثال، سرطان مخاط دهان و مری در دوستداران غذای گرم).
3. سرطان زایی تشعشع- ایجاد تومور بدخیم نابالغ هنگام قرار گرفتن در معرض پرتوهای یونیزه یا غیریونیزان در دوز سرطان زا. عامل اصلی سرطانزای طبیعی برای مردم نژادهای قفقازی و مغولوئیدی، تابش فرابنفش خورشیدی است، بنابراین عادت آفتاب گرفتن در زیر نور خورشید به ایجاد تومورهای بدخیم پوست کمک میکند.
4. سرطان زایی شیمیایی- ایجاد تومورهای بدخیم نابالغ تحت تأثیر مواد شیمیایی سرطان زا (مواد سرطان زا). از جانب برون زاسرطان زاهای شیمیایی، نقش اصلی را مواد سرطان زا از دود تنباکو ایفا می کنند که عامل اصلی ایجاد سرطان ریه و سرطان حنجره هستند. در میان درون زامواد سرطانزای شیمیایی، هورمونهای استروژنی (که سطح بالایی از آنها منجر به ایجاد سرطان سینه، تخمدان و آندومتر میشود) و متابولیتهای سرطانزای کلسترول که تحت تأثیر میکروارگانیسمها در روده بزرگ تشکیل میشوند و در ایجاد سرطان روده بزرگ نقش دارند، مهم هستند.
5. سرطان زایی ویروسی- القای تومورهای بدخیم توسط ویروس ها (ویروس های انکوژن). تنها ویروس هایی که مستقیماً با وارد کردن انکوژن های سلولی (انکوژن های ویروسی) به ژنوم آن باعث بدخیمی سلولی می شوند، انکوژن نامیده می شوند. برخی از ویروس ها به طور غیرمستقیم در ایجاد تومورهای بدخیم نقش دارند و باعث ایجاد فرآیند پاتولوژیک پس زمینه می شوند (به عنوان مثال، ویروس های هپاتیت B، C، D، در حالی که انکوژن نیستند، به توسعه سرطان کبد کمک می کنند و باعث سیروز می شوند). مهمترین ویروس های تومور انسانی هستند ویروس سیمپلکس(ویروس هرپس سیمپلکس) نوع IIاز خانواده Herpesviridae (باعث سرطان دهانه رحم، سرطان آلت تناسلی و احتمالا تعدادی از تومورهای دیگر) می شود. ویروس هرپس نوع VIII (به ایجاد سارکوم کاپوزی منجر می شود). ویروس پاپیلوم انسانیاز خانواده Papovaviridae (باعث سرطان دهانه رحم و سرطان پوست می شود). ویروس Epstein-Barr از خانواده Herpesviridae (عمدتاً در کشورهای دارای آب و هوای گرم باعث ایجاد تومورهای بدخیم می شود - لنفوم/سرطان خون بورکیت، شایع ترین در آفریقا، سرطان نازوفارنکس در آسیای جنوب شرقی و احتمالاً سایر تومورها).
ویروس های RNA انکوژنیک نامیده می شوند oncornaviruses. دو ویروس از خانواده Retroviridae برای انسان انکوژن هستند: HTLV-I و HTLV-II. مخفف HTLV مخفف ویروس T-لنفوتروپیک (TL) انسانی (H) است. HTLV-I باعث لوسمی سلول T و لنفوم سلول T بالغ می شود (لوسمی/لنفوم سلول T بزرگسال). HTLV-II - لوسمی سلول مویی.
"سرطان در شکمبه."در انسان، شایعترین شکل «سرطان در شکمبه» سرطانی است که در زخمهای پوستی تغذیهای، سرطان ریه محیطی، سرطان ناشی از زخمهای مزمن معده و اثنی عشر، سرطان اولیه کبد در پس زمینه سیروز ایجاد میشود.
پاتوژنز، مورفوژنز و مسیرها
تکامل تومورهای بدخیم
چهار مرحله اصلی توسعه تومورهای بدخیم نابالغ وجود دارد: مراحل بدخیمی، تومور پیش تهاجمی، تهاجم و متاستاز.
1. مرحله بدخیمی- تبدیل یک سلول طبیعی به یک سلول بدخیم (در مرحله اول، مرحله شروع، یک جهش جسمی رخ می دهد، در نتیجه انکوژن ها در ژنوم سلول های بدخیم ظاهر می شوند؛ در مرحله دوم، مرحله ارتقا، تکثیر. سلول های آغاز شده شروع می شود). Oncogenes (onc) هر ژنی است که مستقیماً باعث تبدیل یک سلول طبیعی به یک سلول بدخیم می شود یا در این تبدیل نقش دارد. انکوژن ها بسته به منشاءشان به دو گروه انکوژن های سلولی (c-onc) و انکوژن های ویروسی (v-onc) تقسیم می شوند. انکوژن های سلولی از ژن های سلولی طبیعی به نام پروتوآنکوژن تشکیل می شوند. یک نمونه معمولی از یک انکوژن سلولی، ژن پروتئین p53 است - ژن p53 طبیعی ("وحشی") نقش یکی از آنتی انکوژن های فعال را بازی می کند. جهش آن منجر به تشکیل یک انکوژن (ژن p53 "جهش یافته") می شود. محصولات بیان انکوژن را انکوپروتئین (انکوپروتئین) می نامند.
2. مرحله تومور پیش تهاجمی- وضعیت یک تومور بدخیم نابالغ قبل از شروع تهاجم (در مورد سرطان از اصطلاح کارسینوم درجا برای این مرحله استفاده می شود).
3. مرحله آلودگی- رشد تهاجمی تومور بدخیم
4. مرحله متاستاز.
مورفوژنز تومورهای بدخیم. 1. توسعه تومور de novo (تکامل "جهش مانند")، بدون تغییرات پیش از تومور قابل مشاهده قبلی. 2. سرطان زایی مرحله ای - ایجاد تومور در محل تغییرات پیش از تومور (در مورد سرطان، این اصطلاح برای تعیین تغییرات پیش از تومور استفاده می شود. پیش سرطانی).
دو شکل پیش سرطانی وجود دارد: 1. پیش سرطانی اجباری– پیش سرطانی که دیر یا زود لزوماً به سرطان تبدیل می شود (مثلاً تغییرات پوستی در خشکی پیگمنتوزوم)، 2. پیش سرطان اختیاری- پیش سرطانی که لزوماً به سرطان تبدیل نمی شود (مثلاً لکوپلاکیا).
مسیرهای تکامل تومورهای بدخیم 1. پیشرفت تومور- تقویت پتانسیل بدخیم آن در طول زمان. 2. پسرفت تومور(پدیده نادر) - ناپدید شدن خود به خود (بدون درمان) تومور.
تومورهای اپیتلیال
در میان تومورهای اپیتلیال، بین بالغ (معمولاً خوش خیم) و نابالغ (بدخیم) تمایز قائل می شود. تومورهای اپیتلیال بالغ در درجه اول شامل آدنومو پاپیلومبه تومورهای اپیتلیال نابالغ با اصطلاح کلی گفته می شود سرطان (سرطان). اصطلاح روسی "سرطان" موفقیت آمیز نیست، زیرا از آن برای اشاره به همه تومورهای بدخیم استفاده می شود (در نامگذاری بین المللی این اصطلاح برای این منظور استفاده می شود. سرطانو نئوپلاسم های بدخیم اپیتلیال (کارسینوم).
آدنوم- تومور بالغی که از اپیتلیوم غدد یا اپیتلیوم ستونی تک لایه غشاهای مخاطی (حفره بینی، نای، برونش، معده، روده، آندومتر) ایجاد می شود. سه نوع خاص بالینی و مورفولوژیکی آدنوم وجود دارد: پولیپ آدنوماتوز، سیستادنوما (سیستادنوما) و فیبروآدنوم. پولیپ آدنوماتوزآدنوم نامیده می شود که از اپیتلیوم ستونی تک لایه غشاهای مخاطی ایجاد می شود. پولیپ آدنوماتوز را باید از پولیپ هایپرپلاستیک که تومور نیستند، اما می توانند به پولیپ آدنوماتوز تبدیل کنند، متمایز کرد. سیستادنوما- آدنوم با وجود کیست (حفره). در این مورد، کیست ممکن است قبل از ایجاد یک آدنوم (کیست اولیه) یا در بافت یک تومور از قبل تشکیل شده (کیست ثانویه) ایجاد شود. کیست ها با مایع، مخاط، خون لخته شده یا توده های لخته یا متراکم پر می شوند. سیستادنوما بیشتر در تخمدان ها دیده می شود. آدنوم با استروما برجسته نامیده می شود فیبروآدنوم. یک مکان معمولی برای فیبروآدنوم، غدد پستانی است.
پاپیلوم- تومور بالغی که از بافت های پوششی پوشیده شده با اپیتلیوم سنگفرشی طبقه بندی شده یا یوروتلیوم (اپیتلیوم انتقالی) و همچنین در مجاری دفعی غدد ایجاد می شود. پاپیلوم های سنگفرشیبر روی پوست و غشاهای مخاطی پوشیده از اپیتلیوم سنگفرشی طبقه بندی شده (حفره دهان، حلق، مری، چین های صوتی حنجره، واژن، بخش واژن دهانه رحم) تشکیل می شوند. پاپیلومای سلولی انتقالیدر مجاری ادراری، عمدتاً در مثانه، موضعی است.
کارسینوم (سرطان، کارسینوم)- تومور اپیتلیال بدخیم نابالغ دو شکل مورفولوژیکی اصلی سرطان وجود دارد: سرطان داخل اپیتلیال (غیر تهاجمی) و تهاجمی (نفوذی). سرطان داخل اپیتلیال، همچنین به نام سرطان درجا("درجا")، که با عدم رشد تهاجمی مشخص می شود. تمام سلول های بدخیم در ضخامت لایه اپیتلیال متمرکز شده اند. در حال حاضر، اصطلاح "کارسینوم در محل" به ندرت در انکوپاتولوژی عملی استفاده می شود، زیرا تشخیص این وضعیت از تغییرات پیش سرطانی (دیسپلاستیک) برجسته در اپیتلیوم دشوار یا غیرممکن است. بنابراین، دیسپلازی اپیتلیال و کارسینوم درجا تحت عنوان کلی ترکیب می شوند نئوپلازی داخل اپیتلیالنشان دهنده درجه شدت آن (I - خفیف، II - متوسط، III - شدید).
از نقطه نظر هیستوژنز، انواع مختلفی از کارسینوم وجود دارد که شایع ترین آنها عبارتند از سلول بازال، سلول سنگفرشی (اپیدرموئید)، کارسینوم سلول انتقالی (اوروتلیال)، آدنوکارسینوما و کارسینوم تمایز نیافته (آناپلاستیک).
1. کارسینوم سلول بازال- کارسینوما که سلول های آن شبیه سلول های پایه اپیتلیوم سنگفرشی طبقه ای است. اغلب، کارسینوم سلول بازال در نواحی باز پوست رخ می دهد و یک تومور بدخیم با رشد محلی مخرب است.
2. سرطان سلول سنگفرشی– سرطانی که سلول های آن در جهت اپیتلیوم سنگفرشی چندلایه متمایز می شوند. تومور اغلب در ریه، حنجره، مری، بافت های حفره دهان، پوست و دهانه رحم قرار دارد. کارسینوم سلول سنگفرشی ریه معمولاً از کانونهای متاپلازی اپیتلیال سنگفرشی ایجاد میشود که تشکیل آن نمونهای از برونشیت مزمن افراد سیگاری است. دو نوع اصلی کارسینوم سلول سنگفرشی وجود دارد: کارسینوم سلول سنگفرشی با تمایز خوب و ضعیف. مشخصترین علامت بافتشناسی کارسینوم سلول سنگفرشی به خوبی تمایز یافته، تشکیل کانونهای کراتینهسازی ("مرواریدهای سرطانی") در لایههای سلولهای تومور است.
3. کارسینوم سلول انتقالی- کارسینوما که سلول های آن به سمت اپیتلیوم انتقالی (یوروتلیوم) تمایز می یابند. در حال حاضر، این تومور نامیده می شود کارسینوم ادراری. در اکثریت قریب به اتفاق موارد، کارسینوم سلولی انتقالی در غشای مخاطی دستگاه ادراری، در درجه اول مثانه ایجاد می شود.
4. آدنوکارسینوم- نوعی سرطان با علائم تمایز غده ای سلول های تشکیل دهنده آن (به معنای واقعی کلمه، اصطلاح "آدنوکارسینوم" به عنوان "سرطان غده" ترجمه می شود). تومور اغلب در معده، روده، آندومتر و غدد مختلف درونریز و برونریز ایجاد میشود. نمونه آدنوکارسینوم ساختارهای غده ای، لوله ای (کارسینوم لوله ای) و پاپیلاری (کارسینوم پاپیلاری) است. آدنوکارسینوم های با تمایز زیاد، متوسط و ضعیف وجود دارد. انواع خاصی از آدنوکارسینوم شامل آدنوکارسینوم مخاطی و کارسینوم سلول حلقه مهره است. آدنوکارسینوم مخاطی(کارسینوم مخاطی) با تشکیل مقادیر زیادی موکوس خارج سلولی در بافت تومور مشخص می شود. کارسینوم سلول حلقه علامتتوسط سلولهای گرد تشکیل میشود که سیتوپلاسم آن حاوی مخاط است، که تغییر شکل داده و هسته را به سمت محیط هل میدهد، که به سلول شباهت به یک حلقه میدهد.
5. سرطان تمایز نیافتهبا عدم وجود علائم تمایز بافتی در طول معاینه بافت شناسی معمول تومور مشخص می شود. استفاده از روش های خاص (ایمونوهیستوشیمی و میکروسکوپی الکترونی) تشخیص این علائم را ممکن می سازد. سرطان تمایز نیافته تقریباً در هر عضوی می تواند ایجاد شود و یک نئوپلاسم بسیار بدخیم است. سلول های تومور را می توان به شکل ترابکول (کارسینوم ترابکولار) یا ورقه (کارسینوم جامد) قرار داد. اندازه سلول های سرطانی تمایز نیافته به طور قابل توجهی متفاوت است (کارسینوم سلول بزرگ، کارسینوم سلول غول پیکر). یک نوع خاص از سرطان تمایز نیافته است کارسینوم سلول کوچک، به ویژه مشخصه ریه است.
از انواع سرطان های خاص اندام، شایع ترین آنها هستند سلول کلیهو کبدیسرطان ها
بسته به شدت استروما، دو نوع سرطان متمایز می شود: مدولاریو فیبری (اسکور). کارسینوم مدولاری سرطانی با استرومای کم است، کارسینوم فیبری سرطانی با استرومای مشخص است. بافت کارسینوم مدولاری معمولاً خاکستری مایل به صورتی، نرم یا الاستیک است و شبیه ماده مغز (لاتین مدولا - مغز) است. سرطان فیبری با تراکم بافت تومور به دلیل فراوانی فیبرهای کلاژن در استروما مشخص می شود. سرطان مدولاری در تیروئید و غدد پستان شایع تر است. فیبری - در غده پستانی و معده. اگر از اصطلاح "کارسینوم مدولاری" برای تعیین اشکال انکولوژیک مستقل استفاده شود، اصطلاح "سرطان فیبری" برای این منظور در انکوپاتولوژی مدرن استفاده نمی شود.
تومورهای بافت نرم و استخوان
(تومورهای مزانشیمی)
تومورهای بافت نرم شامل تومورهای فیبری (فیبری)، چربی، بافت عضلانی، عروق خونی، غشاهای سروزی و سینوویال و همچنین ساختارهای سیستم عصبی محیطی هستند. تومورهای سیستم عصبی محیطی در مبحث بعدی مورد بحث قرار خواهند گرفت. تومورهای بافت نرم (به استثنای نئوپلاسم های نوروژنیک) و تومورهای استخوانی خاص در انکومورفولوژی اغلب با مفهوم ترکیب می شوند. تومورهای مزانشیمی. تومورهای مزانشیمی متعدد می توانند تظاهراتی از سندرم های تومور ارثی باشند - توبروس اسکلروزیس(بیماری پرینگل بورنویل) سندرم گاردنرو دیگران.
I. تومورهای بافت فیبری
تومورهای بافت فیبری (همبند فیبری) شامل انواع ضایعات است که احتمالاً بسیاری از آنها نئوپلاسم واقعی نیستند، بلکه تومور مانند رشد بافت هستند. تومورها و ضایعات تومور مانند به بالغ و نابالغ تقسیم می شوند. ضایعات فیبری بالغ عمدتاً با یک دوره خوش خیم مشخص می شوند، در حالی که ضایعات نابالغ نئوپلاسم های بدخیم هستند.
به بالغتومورهای بافت فیبری شامل فیبروم هاو فیبروماتوزها, نابالغتومورهای فیبری نامیده می شوند فیبروسارکوم ها. فیبروم معمولاً به طور گسترده رشد می کند و دارای مرزهای واضح است؛ فیبروماتوز با عدم وجود مرزهای واضح ضایعه به دلیل رشد تهاجمی (نفوذی) مشخص می شود. برجسته سطحیو عمیقفیبروماتوز فیبروماتوز سطحی شامل فیبروماتوز کف دست ( انقباض دوپویترن، کف پا ( بیماری لدرهوز، گردن (معمولاً به صورت ظاهر می شود تورتیکولی مادرزادیآلت تناسلی ( بیماری پیرونیر، لثه ها، کمتر در سایر مکان ها. فیبروماتوز عمیق سیر تهاجمی تر و در برخی موارد بدخیم دارد. فیبروماتوز عمیق شامل تومورهای دسموئید (دسموئید) و فیبروماتوز مادرزادی (فیبروماتوز کودکان خردسال) است.
فیبروم ها و ضایعات مرتبط فیبروم- توموری که توسط بافت همبند فیبری بالغ تشکیل شده است. بیش از ده نوع مورفولوژیکی فیبروم ها (الاستوفیبروم، میوفیبروم، فیبروم متراکم، فیبروم نرم، فیبروم آپونورتیک کلسیفیه و غیره) وجود دارد، اما، به عنوان یک قاعده، سیر بالینی آنها تفاوت قابل توجهی ندارد. استثنا است آنژیوفیبروم نازوفارنکسمعمولاً در پسران در دهه دوم زندگی رخ می دهد. این تومور با پرخاشگری موضعی (رشد مخرب موضعی) مشخص می شود و اغلب پس از برداشتن عود می کند. علاوه بر بافت های نرم، فیبروم ها نیز می توانند ایجاد شوند استخوان ها(فیبروم استخوان دسموپلاستیک، فیبروم ادنتوژنیک).
علاوه بر فیبروم ها، ضایعات پرولیفراتیو فیبری خوش خیم شامل اسکار هیپرتروفیک، کلوئید، فاسییت ندولر، فاسییت پرولیفراتیو، میوزیت پرولیفراتیو و تومور میوفیبروبلاستیک التهابی است. اسکار بیش از حد بزرگ شده نامیده می شود اسکار هیپرتروفیک. اسکار با تراکم غضروفی ناشی از هیالینوز بافت فیبری تشکیل دهنده آن نامیده می شود. کلوئید . فاسییت ندولارندولی است که به سرعت افزایش می یابد (حدود 1 سانتی متر در هفته) که در بافت زیر جلدی، ماهیچه های اسکلتی قرار دارد یا با فاسیای آنها مرتبط است. قطر ضایعه به ندرت از 3 سانتی متر بیشتر می شود و معمولاً دارای مرزهای واضح است. پس از حذف به ندرت عود می کند. فاسییت پرولیفراتیوضایعه مشابهی نامیده می شود که در بافت آن فیبروبلاست های بزرگی شبیه به نورون ها تشخیص داده می شود. همین فرآیند در عضلات اسکلتی نامیده می شود میوزیت پرولیفراتیو . تومور میوفیبروبلاستیک التهابی- تکثیر شدید فیبروبلاست ها و میوفیبروبلاست ها با حضور انفیلتراسیون التهابی ضایعه. این فرآیند معمولاً در بافتهای نرم و اندامهای داخلی در کودکان و جوانان محلی است. تومور معمولاً خوش خیم است، اما می تواند پس از برداشتن عود کند و گاهی به سارکوم تبدیل می شود.
فیبروماتوز عمیق تومورهای دسموئید (دسموئید می کند) - فیبروماتوزهای عمیق که با تکثیر شدید فیبروبلاست های فعال مشخص می شود. تمیز دادن شکمی(در ضخامت دیواره قدامی شکم) داخل شکمی(در اندام های شکمی، در درجه اول در مزانتر روده کوچک) و خارج شکمی(زمانی که این فرآیند در خارج از دیواره شکم و اندام های شکمی محلی است) انواع تومورهای دسموئید. ضایعات متعدد اندام های داخلی با فیبروماتوز کودکان خردسالاغلب به مرگ کودک ختم می شود.
فیبروسارکوم- یکی از نادرترین تومورهای بدخیم انسانی. دو نوع بالینی و مورفولوژیکی فیبروسارکوم وجود دارد: فیبروسارکوم کودکان خردسال (مادرزادی و تا 5 سال) و فیبروسارکوم بزرگسالان. فیبروسارکوم در کودکان خردسال سیر نسبتاً مطلوبی دارد و میزان بقای 5 ساله آن به 85٪ می رسد.
II. تومورهای فیبروهیستیوسیتیک
تومورهای فیبروهیستیوسیتی تومورهای بافت فیبری با تعداد زیادی ماکروفاژ (هیستوسیت) هستند. سه گروه از نئوپلاسم های فیبروهیستیوسیتی وجود دارد: خوش خیم، مرزی و بدخیم. تومورهای مرزی شامل ضایعات مکرر عود کننده با رشد محلی مخرب هستند، اما به ندرت متاستاز می کنند، به عنوان مثال. نداشتن تمام علائم نئوپلاسم های بدخیم. نئوپلاسم های فیبروهیستیوسیتی بدخیم با اصطلاح عمومی نامیده می شوند هیستیوسیتوم فیبری بدخیم.
به تومورهای فیبروهیستیوسیتی خوش خیمشامل هیستیوسیتوم فیبری خوش خیم، گزانتوما، زانتوگرانولومای جوان و رتیکولوهیستوسیتوما می باشد. هیستیوسیتوم فیبری خوش خیمیک گره کوچک بدون مرزهای مشخص است. هیستیوسیتوم فیبروز خوش خیم پوست نامیده می شود درماتوفیبروم. پس از برداشتن، این ضایعات به ندرت عود می کنند. تومورها و نئوپلاسم های عمیق واقع شده با سلولی بالا تا حدودی بیشتر عود می کنند. زانتومایک گره یا گره است، کمتر یک نقطه، به رنگ زرد (از لاتین xanthos - زرد). گزانتوم ها اغلب با سطوح بالا از لیپیدها در پلاسمای خون (هیپرلیپوپروتئینمی) ترکیب می شوند. گاهی اوقات هیپرلیپیدمی با ظهور گزانتوم های کوچک متعدد روی پوست (گزانتوما به عنوان عناصر بثورات پوستی) همراه است. چنین گزانتومایی نامیده می شوند فوران کننده. زانتوما در پوست و بافت اندام های مختلف تشکیل می شود. زانتوم روی پلک ها نامیده می شود گزانتلاسما .
توموری شبیه به گزانتوما، اما با حضور سلول های فوم با اندازه ها و اشکال مختلف، نامیده می شود. زانتوگرانولوما. گزانتوگرانولوما در بزرگسالان نادر است و عمدتا در دوران کودکی دیده می شود. زانتوگرانولومای جوان) حتی در نوزادان تازه متولد شده. یک نوع خاص بالینی و مورفولوژیکی گزانتوگرانولوما، زانتوگرانولوما اوبرلینگ خلفی صفاقی (رتروپریتونئال) است. زانتوگرانولوم اوبرلینگبیشتر در بزرگسالان، نشان دهنده شکل عجیبی از فیبروز خلفی صفاقی است. رتیکولوهیستوسیتوما- یک تومور فیبروهیستیوسیتی خوش خیم، که اغلب با اشکال مختلف آرتریت همراه است، با بیماری های خود ایمنی ترکیب می شود و گاهی اوقات یک فرآیند پارانئوپلاستیک است که منعکس کننده وجود یک تومور بدخیم اندام های داخلی بدن است.
نئوپلاسم های فیبروهیستیوسیتی مرزیضایعات فیبروهیستیوسیتی مرزی شامل درماتوفیبروسارکوم پروتوبرانس، فیبروکسانتوما آتیپیک، فیبروبلاستوما سلول غول پیکر و تومور فیبروهیستیوسیتیک پلکسی فرم است.
درماتوفیبروسارکوم پروتوبرانساین یک گره نسبتا بزرگ (به قطر چند سانتی متر) است که از سطح پوست بالا می رود. رشد تومور کند است. گره مرزهای مشخصی ندارد؛ اغلب تومور به چربی زیر جلدی رشد می کند. در موارد نادر، بافت تومور به دلیل وجود سلول های حاوی ملانین، قهوه ای تیره یا سیاه است. Bednar pigmented dermatofibrosarcoma protuberans). تومور Bednar از نظر ظاهری شبیه ملانوم بدخیم است. تقریباً در نیمی از موارد، درماتوفیبروسارکوم پروتوبرانس پس از برداشتن عود می کند، بنابراین درمان باید با برداشت گسترده تومور انجام شود. متاستاز به ندرت ایجاد می شود.
فیبروکسانتوما آتیپیکمعمولا در افراد مسن رخ می دهد و در پوست نواحی در معرض بدن قرار دارد. تومور، به عنوان یک قاعده، یک گره کوچک با زخم سطحی و مرزهای واضح است. به طور معمول، سیر تومور خوش خیم است، اما گاهی اوقات عود می کند، متاستاز ایجاد می شود و تبدیل به هیستیوسیتوم فیبری بدخیم مشاهده می شود. فیبروبلاستوم سلول غول پیکرعمدتاً در کودکان دهه اول زندگی در پوست و چربی زیر جلدی پشت و اندام تحتانی رخ می دهد. تومور متاستاز نمی دهد و با رشد محلی مخرب مشخص نمی شود، اما اغلب پس از برداشتن عود می کند. تومور فیبروهیستیوسیتیک پلکسی فرمدر کودکان و جوانان در پوست و بافت زیر جلدی اندام ها یافت می شود. پس از برداشتن، تومور اغلب عود می کند؛ در موارد نادر، متاستاز در غدد لنفاوی منطقه ایجاد می شود.
هیستیوسیتوم فیبری بدخیم- شایع ترین سارکوم. تومور در اندام های مختلف به ویژه در بافت های عمقی اندام ها و در فضای خلفی صفاقی موضعی است. از نظر خارجی، به صورت یک گره/گره بدون مرزهای مشخص همراه با نکروز و خونریزی ظاهر می شود. پنج نوع تومور وجود دارد: انواع پلئومورفیک و سلول غول پیکر تومورهای با درجه بالا، میکسوئید و التهابی متوسط هستند و نوع آنژیوماتوئید درجه پایین است. گاهی اوقات هیستیوسیتوم فیبری بدخیم آنژیوماتوئید در گروه تومورهای فیبروهیستیوسیتی مرزی به نام هیستیوسیتوم فیبری آنژیوماتوئید. تصویر بالینی با ایجاد کم خونی، تب طولانی مدت و کاهش وزن مشخص می شود. این تومور اغلب در کودکان و جوانان رخ می دهد؛ به ندرت متاستاز می دهد، اما اغلب پس از برداشتن عود می کند.
III. تومورهای چربی و بافت عضلانی
تومورهای بافت چربی.تومورهای بافت چربی سفید و قهوه ای وجود دارد. تومور بالغ بافت چربی سفید با این اصطلاح مشخص می شود لیپوم، رنگ قهوه ای - خواب زمستانی. تومورهای بدخیم نابالغ بافت چربی نامیده می شوند لیپوسارکوم .
لیپوم هامعمولاً به صورت ندول های نرم و زرد رنگی که توسط لوبول های بافت چربی تشکیل شده اند ظاهر می شوند. علاوه بر لیپوم های منفرد (تک)، تومورهای متعددی نیز وجود دارد. انواع مورفولوژیکی لیپوم ها (منظم، سلول دوکی، پلئومورفیک و آتیپیک) وجود دارد، اما از نظر بالینی همه آنها سیر خوش خیم یکسانی دارند. اغلب، یک تومور خوشخیم، همراه با بافت چربی، شامل سایر بافتها میشود: عروق خونی متعدد (آنژیولیپوم)، عروق و دستههای سلولهای عضلانی صاف (آنژیومیولیپوما)، مغز استخوان قرمز (میلولیپوم). آنژیومیولیپوم اغلب در کلیه ها، میلولیپوم - در غدد فوق کلیوی و بافت خلف صفاقی رخ می دهد. علاوه بر این، لیپوم داخل عضلانی، لیپوبلاستوم و لیپوماتوز متمایز می شوند. لیپوم داخل عضلانیموضعی در ضخامت عضلات اسکلتی، با رشد آهسته تهاجمی و در نتیجه عدم وجود مرزهای واضح مشخص می شود. تومور بزرگ باعث آتروفی عضلانی می شود. پس از برداشتن، لیپوم داخل عضلانی اغلب عود می کند. لیپوبلاستومکه از بلوغ سلول های چربی تشکیل می شود، عمدتا در کودکان، معمولا در سال های اول زندگی رخ می دهد. لیپوماتوز منتشرکانون های تکثیر بافت چربی نامیده می شوند که مرزهای مشخصی ندارند (به استثنای محلی سازی داخل عضلانی فرآیند). در برخی موارد علت لیپوماتوز منتشر افزایش غلظت گلوکوکورتیکوئیدها در بدن است (لیپوماتوز استروئیدی). هنگامی که ضایعه در بافت پاراکتال یا پاراوزیکال موضعی شود، انسداد کولون یا احتباس ادرار ممکن است رخ دهد. لیپوم های متعدد نیز به عنوان لیپوماتیک. شناخته شده ترین لیپوماتوزها هستند لیپوماتوز درکومو لیپوماتوز مادلونگ. لیپوماتوز درکوم با وجود لیپوم های دردناک عمدتا در اندام ها مشخص می شود. با لیپوماتوز Madelung، لیپوم ها در گردن موضعی می شوند، گاهی اوقات آن را در یک حلقه می پوشانند و باعث فشرده شدن رگ های خونی، اعصاب، دستگاه تنفسی و حلق می شوند. هیبرنومااغلب در نواحی کتف و بین کتف قرار دارند. لیپوسارکومبا تنوع قابل توجهی مشخص می شود. لیپوسارکوم خوب تمایز یافته و میکسوئید تومورهای با درجه پایین هستند. یک استثنا لیپوسارکوم محلی سازی خلف صفاقی است که پیش آگهی آن همیشه کمتر مطلوب است. لیپوسارکوم سلول گرد، پلئومورفیک و تمایز زدایی شده با یک دوره بسیار بدخیم مشخص می شود.
تومورهای بافت عضلانیبه تومورهای بافت ماهیچه ای صاف و مخطط تقسیم می شوند. تومورهای بالغ ماهیچه های صاف - لیومیوم، بافت ماهیچه ای مخطط - رابدومیوم. تومورهای بدخیم نابالغ عضله صاف لیومیوسارکوم نامیده می شوند، بافت ماهیچه ای مخطط - رابدومیوسارکوم.
اغلب اوقات لیومیوم هاتحت تأثیر هورمون های استروژنی که فعالیت تکثیری سلول های عضله صاف میومتر را افزایش می دهد، در رحم ایجاد می شود. علاوه بر این، لیومیوم ها از لیومیوسیت های عروقی، ماهیچه های پیلیار پوست، و همچنین دیواره های اندام های توخالی، در درجه اول دستگاه گوارش ایجاد می شوند. گاهی اوقات لیومیوم رحم به ریه ها متاستاز می دهد ( لیومیوم متاستاتیک، با این حال آنها یک فرآیند خوش خیم باقی می مانند. گاهی اوقات، بافت تومور در لومن وریدهای رحم، لگن و حتی به داخل ورید اجوف تحتانی رشد می کند. لیومیوماتوز داخل وریدی). پیش آگهی لیومیوماتوز داخل وریدی، علیرغم برداشتن ناقص جراحی تومور، مطلوب باقی می ماند. اوفورکتومی دو طرفه عملاً احتمال عود را از بین می برد. در زنان در سنین باروری، به اصطلاح لیومیوماتوز پریتونئال منتشرکه در آن لیومیوم های کوچک متعدد (متاستازهای لانه گزینی) روی صفاق تشکیل می شوند که از نظر خارجی شبیه متاستازهای یک تومور بدخیم هستند. این وضعیت معمولاً با بارداری، وجود تومور سلولی گرانولوزای تولید کننده استروژن در تخمدان یا استفاده از داروهای ضد بارداری خوراکی همراه است. به طور معمول، لیومیوماتوز پریتوئن منتشر شده یک یافته غیرمنتظره در طی سزارین است. در بیشتر موارد، ضایعات خود به خود پسرفت می کنند.
برخی از تومورهای عضله صاف دارای بافت های دیگری نیز هستند: آنژیومیولیپوما (معمولاً کلیه ها)، آنژیومیوم، لنفانژیومیوماتوز. لیومیوسارکوماغلب در رحم با بدخیمی لیومیوم های طولانی مدت، معمولاً در اندازه بزرگ، ایجاد می شود. در این مورد، مناطق با قوام نرم تر، کانون های نکروز و خونریزی در گره تومور ظاهر می شود. رابدومیوسارکومتنوع قابل توجهی دارند. آنها عمدتا در دوران کودکی رشد می کنند. رابدومیوسارکوم های سلول دوکی و جنینی تومورهای با درجه پایین هستند. رابدومیوسارکوم های آلوئولی و پلئومورفیک نئوپلاسم های بسیار بدخیم هستند. یک نوع خاص از رابدومیوسارکوم جنینی است بوتریوئید(از یونانی بوتریوس - خوشه انگور) رابدومیوسارکومدر کودکان سال های اول زندگی در غشاهای مخاطی اندام های مختلف، اغلب واژن، و بیرون زده بالای سطح آنها ("پولیپ بوتروئید") ایجاد می شود. رابدومیوسارکوم های آلوئولی و پلئومورفیک معمولاً در عضله اسکلتی تشکیل می شوند.
IV. تومورهای خونی و عروق لنفاوی
تومورهای عروقی به تومورهای اندوتلیال (که از سلولهای اندوتلیال خون و عروق لنفاوی ایجاد میشوند) و دور عروقی (برخاسته از انواع دیگر عناصر سلولی دیواره عروق و بافت اطراف عروقی که مستقیماً در مجاورت رگ هستند) تقسیم میشوند.
تومورهای اندوتلیال عروق خونی.تومورهای بالغ رگهای خونی همانژیوم نامیده می شوند، تومورهای بدخیم نابالغ با اصطلاح آنژیوسارکوم (همانژیوسارکوم، همانژیواندوتلیومای بدخیم) مشخص می شوند. نوع خاصی از تومورهای عروق خونی سارکوم کاپوزی است. گروه خاصی از تومورهای اندوتلیال مرزی از همانژیواندوتلیوم ها تشکیل شده است که نمی توان آنها را به طور واضح به عنوان نئوپلاسم های خوش خیم یا بدخیم طبقه بندی کرد.
مویرگی، غاری، عضلانی، وریدی، شریانی وریدی و اپیتلیوئیدی (هیستوسیتوئید) وجود دارد. همانژیوم. یک نوع خاص از همانژیوم گرانولوم پیوژنیک (همانژیوم از نوع گرانولاسیون بافتی) است. همانژیوم مویرگی توسط عروق مویرگی تشکیل می شود، آنها به دو نوع تقسیم می شوند: نوجوانان (کودکان) و بزرگسالان. همانژیوم مویرگی از نوع جوانی(نوس عروقی) ندول یا لکه ای است که عمدتاً به رنگ قرمز است، در 0.5 درصد نوزادان ایجاد می شود، معمولاً پس از چند هفته یا ماه ایجاد می شود و معمولاً روی پوست صورت یا گردن موضعی می شود. اغلب این همانژیوم ها متعدد هستند. پس از مدتی آنها به طور خود به خود پسرفت می کنند. همانژیوم مویرگی بزرگسالانقبلاً در نوجوانان رخ می دهد، اما فراوانی رشد آنها با افزایش سن افزایش می یابد. آنها عمدتاً روی پوست تنه و اندام ها و همچنین در اندام های داخلی موضعی هستند. همانژیوم کاورنوستوسط عروق با لومن به شدت منبسط شده تشکیل شده است. آنها هم روی پوست و هم در اندام های داخلی (عمدتاً در کبد و طحال) قرار دارند. همانژیوم غاری معمولاً به طور خود به خود پسرفت نمی کند، با رشد سریع، تخریب بافت اطراف تومور ممکن است رخ دهد. همانژیوم داخل عضلانیهمانژیوم مویرگی یا غاری که در عمق عضله اسکلتی قرار دارد. همانژیوم وریدیتشکیل شده توسط تجمع کانونی عروق نوع وریدی، همانژیوم شریانی وریدیشامل عروق وریدی، مویرگی و شریانی است. همانژیوم اپیتلیوئیدی(هیپرپلازی آنژیولنفوئید همراه با ائوزینوفیلی) با تکثیر مویرگ ها در پوست با سلول های اندوتلیال بزرگ شبیه هیستوسیت ها مشخص می شود. مویرگ ها توسط تجمع لنفوسیت ها، ماکروفاژها و گرانولوسیت های ائوزینوفیلیک احاطه شده اند و فولیکول های لنفوئیدی اغلب یافت می شوند. اغلب تومور روی پوست سر قرار دارد. گرانولوم پیوژنیکرشد بافت گرانولاسیون در محل آسیب به شکل ندول روی پوست یا غشاهای مخاطی است. بیشتر اوقات روی غشای مخاطی حفره دهان و عمدتاً روی لثه ها موضعی می شود. تشکیل گرانولوم های پیوژنیک در دوران بارداری مشخص است ( گرانولومای حاملگیچنین تومورهایی پس از زایمان یا خاتمه بارداری پسرفت می کنند.
بسته به تعداد همانژیوم ها، همانژیوم های منفرد و متعدد تشخیص داده می شوند. همانژیوم های متعدد نیز به عنوان نامیده می شود همانژیوماتوز. همانژیوماتوزها عبارتند از همانژیوماتوز پوستی پیشرونده داریر، سندرم کاساباخ-مریت، سندرم مافوچی و سندرم هافرکمپ. همانژیوماتوز پیشرونده پوست داریابا افزایش اندازه و تعداد همانژیوم های پوستی مشخص می شود که می تواند با مصرف ترومبوسیتوپنی و سندرم انعقاد داخل عروقی منتشر پیچیده شود. سندرم کاساباخ – مریت- همانژیوم غول پیکر پوست با ایجاد ترومبوسیتوپنی مصرفی و سندرم انعقاد داخل عروقی منتشر. سندرم مافوچی- گزینه بیماری Ollier(انکندروماتوز استخوان ها، عمدتاً انگشتان دست و پا) در ترکیب با همانژیوم های مویرگی و غاری متعدد بافت نرم انگشتان دست. سندرم هافرکمپ- همانژیوماتوز عمومی استخوان. این بیماری به سرعت پیشرفت می کند و به مرگ ختم می شود. رشد تهاجمی همانژیوم داخل استخوانی منجر به تغییر شکل استخوان، تخریب آنها (شکستگی های پاتولوژیک) و جابجایی بافت میلوئید از ماده اسفنجی با ایجاد کم خونی هیپوپلاستیک می شود.
همانژیوماتوزهای سیستمیکبیماری هایی که در آن همانژیوم در اندام های مختلف (پوست، اندام های داخلی، مغز، چشم ها، استخوان ها) موضعی دارند، نامیده می شوند. همانژیوماتوز سیستمیک. اینها شامل سندرم های هیپل-لیندو و استورج-وبر-کرابه است. سندرم هیپل-لیندو(آنژیوماتوز رتینوسروویسرال) با وجود همانژیوم در شبکیه، در اندام های داخلی (کبد، طحال) و در سیستم عصبی مرکزی (معمولاً در مخچه با علائم عصبی مربوطه) مشخص می شود. سندرم استرج-وبر-کرابه- معمولاً ترکیبی از همانژیوم های یک طرفه پوست صورت در ناحیه عصب دهی شاخه های I یا II عصب سه قلو، همانژیوم مشیمیه (که منجر به ایجاد گلوکوم یا جدا شدن شبکیه می شود) و همانژیوم. از مغز، که با ایجاد سندرم تشنج و همی پارزی/همی پلژی در تومورهای طرف مقابل در طرف بدن ظاهر می شود.
دو گزینه اصلی وجود دارد همانژیواندوتلیوما- اپیتلیوئید (هیستوسیتوئید) و سلول دوکی. همانژیواندوتلیومای اپیتلیوئیدیزمانی که در ریه ها موضعی شود، معمولاً منجر به عوارض شدید و مرگ می شود. هنگامی که تومور در سایر اندام های داخلی و بافت های نرم قرار دارد، به ندرت عوارض کشنده ایجاد می شود. همانژیواندوتلیومای سلول دوکیاغلب پس از برداشتن عود می کند، اما متاستاز نمی دهد. آنژیوسارکومبه تومورهایی با بدخیمی بالا اشاره دارد. نقش اتیولوژیکی ترکیبات آرسنیک، وینیل کلرید و عایق بندی در ایجاد آنژیوسارکوما مشخص شده است. بیشتر بزرگسالان و افراد مسن مبتلا می شوند. از نظر ماکروسکوپی، آنژیوسارکوم، به عنوان یک قاعده، یک گره قرمز رنگ بدون مرزهای واضح است. سارکوم کاپوزی- تومور سلول های عروقی با تمایز ضعیف (آنژیوبلاست ها) که در پس زمینه نقص ایمنی شدید تحت تأثیر ویروس هرپس نوع 8 (HHV-8) ایجاد می شود. سه نوع بالینی و اپیدمیولوژیک اصلی سارکوم کاپوزی وجود دارد: پیری، اپیدمی و ایاتروژنیک. سارکوم سنیل کاپوزی، همانطور که از نامش پیداست، در سنین بالا ایجاد می شود و یک تومور با درجه پایین است (متوسط طول مدت بیماری 10-15 سال است). انواع اپیدمی (با عفونت HIV) و ایتروژنیک (به دلیل سرکوب سیستم ایمنی دارو) با درجه بالایی از بدخیمی مشخص می شوند. به طور معمول، سارکوم کاپوزی به صورت پلاک قهوه ای مایل به قرمز و نرم روی پوست پاها یا پاها ظاهر می شود.
تومورهای اندوتلیال عروق لنفاوی.تومورهای بالغ رگ های خونی لنفانژیوم و تومورهای بدخیم نابالغ لنفانژیوسارکوم نامیده می شوند. لنفانژیوماغلب توسط عروق لنفاوی مویرگی معمولی (لنفانژیوم مویرگی) یا به شدت گشاد شده (لنفانژیوم غاری) تشکیل می شود. لنفانژیوسارکومعمدتا در زنان رخ می دهد. عمدتاً در پس زمینه لنفوستاز طولانی مدت ایجاد می شود. لنفانژیوسارکوم در زنانی که تحت ماستکتومی رادیکال برای سرطان سینه قرار گرفته اند. سندرم استوارت-تروز) معمولاً 10 سال پس از جراحی ایجاد می شود.
تومورهای اطراف عروقیتومورهای اطراف عروقی شامل تومور گلوموس (و انواع آن گلومانژیوم و گلومانژیوما) و همانژیوپری سیتوما هستند. تومورهای خوش خیم و بدخیم گلوموس و همچنین همانژیوپری سیتوماهای خوش خیم و بدخیم وجود دارد. انواع خوش خیم نئوپلاسم های اطراف عروقی شایع تر است. تومور خوش خیم گلوموسبه عنوان یک قاعده، در بافت نرم انگشتان زیر صفحه ناخن موضعی است و یک گره قرمز مایل به آبی با قطر معمولاً کمتر از 1 سانتی متر است. تومور دردناک است، به ویژه با هیپوترمی. پس از حذف اغلب عود می کند. همانژیوپری سیتوما خوش خیماغلب در فضای خلفی صفاقی، اندام های لگنی و بافت های ران موضعی می شود و دارای مرزهای واضح است. در برخی موارد، تومور منجر به ایجاد هیپوگلیسمی می شود.
V. تومورهای غشاهای سروز و سینوویال
تومورهای پوشش سروزی.تومورهای خوش خیم و بدخیم مختلف از غشاهای سروزی به وجود می آیند. نئوپلاسم های خوش خیم عبارتند از تومور فیبری منفرد پلور و صفاق(مزوتلیوم فیبری موضعی)، مزوتلیومای پاپیلاری خوب تمایز یافته, مزوتلیومای مولتی کیستیکو تومور آدنوماتوئید. نئوپلاسم های بدخیم پوشش سروزی هستند تومور فیبری منفرد بدخیم پلور و صفاق، باصطلاح مزوتلیومای منتشر، و اپیتلیال, سلول دوکی(سارکوماتوئید) و مزوتلیومای بدخیم دوفازی. مشخص شده است که آزبست ممکن است علت ایجاد مزوتلیومای بدخیم پلور باشد.
تومورهای غشای سینوویال مفاصل.در حال حاضر، تومورهای غشای سینوویال فقط شامل دو نئوپلاسم هستند: خوش خیمو تومور سلول غول پیکر تنوسینوویال بدخیم. قبلا این گروه شامل سارکوم "سینوویال".[سارکوم "سینوویال"]، با این حال، از نظر هیستوژنتیکی به تومورهای سینوویال تعلق ندارد، علیرغم این واقعیت که اغلب در نزدیکی مفاصل قرار دارد. سارکوم "سینوویال" در بیماران زیر 15 سال کمتر بدخیم است، در صورت موضعی شدن در اندام های انتهایی و با اندازه گره تا قطر 5 سانتی متر.
VI. تومورهای استخوانی
چهار گروه اصلی تومورهای استخوانی وجود دارد: تومورهای استخوانی، تومورهای غضروفی، تومورهای سلول غول پیکر و تومورهای مغز استخوان. علاوه بر این، گاهی اوقات تومورهای استخوان و غضروف عمدتاً در بافتهای نرم و اندامهای داخلی ایجاد میشوند.
تومورهای استخوان سازنئوپلاسمهای خوشخیم استخوانساز بالغ شامل استئوما، استئوئید استئوما و استئوبلاستوم خوشخیم هستند. تومورهای بدخیم استخوان ساز نابالغ عبارتند از استئوبلاستوم تهاجمی (استئوبلاستوم بدخیم) و استئوسارکوم (سارکوم استئووژنیک).
استئوما- یک تومور با رشد آهسته که عمدتاً در استخوان های جمجمه ایجاد می شود. استئومای استوئیدی(استئومای استوئیدی) در بافت استخوانی فشرده لایه سطحی (قشری) استخوان قرار دارد. نزدیکی تومور به پریوستوم باعث ایجاد درد شدید می شود. تومور عمدتاً در نوجوانان و جوانان در دیافیز استخوانهای لولهای بلند ایجاد میشود؛ این تومور با اندازه کوچک (معمولاً کمتر از 1 سانتیمتر قطر)، رشد بسیار آهسته، مرزهای واضح و معمولاً یک منطقه مشخص مشخص میشود. تشکیل استخوان واکنشی استئوبلاستوم خوش خیماز نظر ساختار میکروسکوپی شبیه به استئوما استئویید است، اما در قسمت های عمیق استخوان، در بافت استخوان اسفنجی موضعی است. اندازه تومور معمولاً بیش از 1 سانتی متر قطر دارد و تشکیل استخوان واکنشی ناچیز است. به عنوان یک قاعده، درد شدید مشخصه استئومای استئوییدی وجود ندارد. استئوبلاستوم تهاجمیبا عودهای مکرر پس از درمان جراحی مشخص می شود، اما متاستاز نمی دهد.
استئوسارکوم- شایع ترین تومور بدخیم اولیه استخوان. عمدتاً در دهه دوم زندگی در مردان ایجاد می شود. در سنین بالا، استئوسارکوم معمولاً در پس زمینه ایجاد می شود بیماری پاژه استخوان. اغلب، استئوسارکوم در متافیز استخوانهای لولهای بلند قرار دارد. استئوسارکوم به دو نوع کلینیکی و مورفولوژیکی اصلی تقسیم می شود: مرکزی(مدولاری) و سطح(پیرامونی). به عنوان یک قاعده، استئوسارکوم مرکزی یک تومور با درجه بالا است، در حالی که استئوسارکوم محیطی درجه پایین است. استئوسارکوم سطحی به طور محکم به سطح استخوان می چسبد یا آن را به شکل آستین احاطه می کند، بدون اینکه باعث تخریب قابل توجهی در لایه قشر مغز شود. تومورها معمولاً در دیافیز استخوان های بلند ایجاد می شوند. از نظر رادیولوژیک، در بیشتر موارد، تومور کدورت های خطی شعاعی و همچنین استئوفیت های دیستال و پروگزیمال ("مثلث های Codman") را نشان می دهد که به دلیل تشکیل استخوان واکنشی در حین جدا شدن پریوست در امتداد حاشیه تومور ایجاد شده اند. دو نوع اصلی استئوسارکوم سطحی وجود دارد: پاروستئال (ژاکستوکورتیکال) و پریوستال. استئوسارکوم پاروستئالعمدتاً توسط بافت استخوانی تومور تشکیل شده است، استئوسارکوم پریوستالعمدتا از غضروف تومور تشکیل شده است.
تومورهای غضروفیتومورهای خوش خیم استخوان غضروفی بالغ عبارتند از کندروما، استئوکندروما، کندروبلاستوم خوش خیم و کندرومیکسوئید فیبروم. تومور بدخیم نابالغ بافت غضروفی با این اصطلاح مشخص می شود کندروسارکوم .
کندروماتوسط غضروف هیالین بالغ نشان داده می شود. بسته به محل استخوان، دو نوع کندروما وجود دارد: آنکندروم ها، واقع در مرکز، و کندروم پریوستالدر قسمت های محیطی استخوان قرار دارد. شایعتر آنکوندرومها هستند که میتوانند منفرد (تک) یا چندگانه باشند. آنکندروم های متعدد به عنوان نامیده می شوند انکندروماتوزاستخوان ها. در میان انکندروماتوزها، اصلی ترین آنها بیماری اولیر و نوع سندرم مافوچی است. بیماری Ollierبا تشکیل انکوندروما در استخوان های دست و پا آشکار می شود. انکندروماها باعث انحنای استخوانها میشوند که تا زمانی که رشد استخوان اتفاق میافتد ادامه مییابد، که میتواند منجر به تبدیل دستها و پاها به کنگلومراهای گرهدار شود. وجود همانژیوم بافت نرم در بیماری Ollier نامیده می شود سندرم مافوچی. انکوندروم های منفرد، بر خلاف چندین آن، به ندرت به کندروسارکوم تبدیل می شوند.
استئوکندرم(اگزوستوز استخوانی غضروفی) رشد استخوانی در سطح خارجی استخوان پوشیده شده با لایه ای از غضروف ("کلاه غضروفی") است. استئوکندروم ها می توانند منفرد یا چندگانه باشند، معمولاً در ناحیه متافیز استخوان های لوله ای بلند قرار دارند و عمدتاً در کودکان یافت می شوند (رشد استئوکندروم معمولاً تا زمان بلوغ اسکلت متوقف می شود). همانند کندروماها، استئوکندروم های منفرد، بر خلاف چندین آن، به ندرت دچار بدخیمی می شوند. کندروبلاستوم خوش خیمتقریباً همیشه در اپی فیز استخوان های لوله ای بلند قرار دارد، معمولاً در افراد زیر 20 سال، دردناک است، اغلب قابل توجه است، گاهی اوقات پس از برداشتن عود می کند و به ندرت به کندروسارکوم تبدیل می شود. فیبروم کندرومیکسوئیدویژگی های بالینی آن شبیه کندروبلاستوم است، با این حال، تصویر بافتی تومور می تواند کندروسارکوم متمایز را شبیه سازی کند. در معاینه اشعه ایکس، تومور به صورت یک گره داخل استخوانی با مرزهای واضح و لبه نازکی از بافت استخوانی هایپرمینرالیزه ظاهر می شود.
کندروسارکوم.بر خلاف کندروماها که بیشتر آنها در قسمت های محیطی اندام ها یافت می شوند، کندروسارکوم عمدتاً در استخوان های لگن، دنده ها، بازو و استخوان ران رخ می دهد. کندروسارکوم عمدتاً یا به طور کامل توسط بافت غضروفی نابالغ بدون تشکیل استخوان تومور ایجاد می شود. چهار نوع اصلی کندروسارکوم وجود دارد: معمولی، ژاکستوکورتیکال (پریوستئال)، مزانشیمی و تمایز زدایی شده. گزینه های با تمایز زیاد و کم وجود دارد کندروسارکوم معمولی. تومور در قسمت های مرکزی استخوان قرار دارد (کندروسارکوم مرکزی)، بافت استخوانی اطراف را تخریب می کند و مرز مشخصی ندارد که با معاینه اشعه ایکس قابل تشخیص است. کندروسارکوم Juxtacortical(تومور درجه پایین) آنالوگ استئوسارکوم پریوستال است، اما بدون علائم استخوان زایی تومور. کندروسارکوم های مزانشیمی و تمایز زدایی شده نئوپلاسم های بسیار بدخیم هستند. کندروسارکوم تمایز نیافته- یکی از بدخیم ترین تومورهای انسانی، تهاجمی تر از استئوسارکوم، معمولاً در افراد مسن ایجاد می شود. میزان بقای 5 ساله برای این تومور 10-15٪ است.
تومور سلول غول پیکر استخوان (استئوکلاستوما)یک تومور تهاجمی اما به ندرت متاستاتیک است. علاوه بر سلولهای تومور تک هستهای، حاوی سلولهای چند هستهای مشابه استئوکلاستها است (از این رو تومور نامیده میشود). به عنوان یک قاعده، تومور عمدتاً در سنین 20-40 سالگی در اپی فیز استخوان های لوله ای بلند ایجاد می شود. تومور سلول غول پیکر یک نئوپلاسم استئولیتیک است. با ظهور در اپی فیز، در نزدیکی غضروف مفصلی، متعاقباً گسترش می یابد و کل اپی فیز و قسمت های مجاور متافیز را می پوشاند. پس از برداشتن، تومورهای سلول غول پیکر اغلب عود می کنند و گاهی اوقات به ریه ها متاستاز می دهند.
تومورهای "مغز استخوان".به اصطلاح تومورهای مغز استخوان شامل تومورهایی از سلولهای مزانشیمی با تمایز ضعیف هستند. این نئوپلاسمها تومورهایی با درجه بدخیمی بالا هستند. سارکوم یوئینگمعمولاً در سنین 5 تا 15 سالگی، معمولاً در دیافیز و متافیز استخوانهای بلند رخ میدهد. در معاینه اشعه ایکس، تومور به طور کلی استئولیتیک به نظر می رسد، اما تخریب استخوان اغلب با کانون های استخوان سازی همراه است. تشکیل استخوان پریوست با تصویر مشخصه اشعه ایکس از "فلس های پیاز" اغلب دیده می شود. سارکوم یوینگ در مراحل اولیه به سایر استخوان ها، ریه ها و کبد متاستاز می دهد. علاوه بر این، اغلب در ابتدا در چندین استخوان ایجاد می شود (رشد تومور چند مرکزی). به ندرت، سارکوم یوینگ در بافت های نرم و اندام های داخلی ایجاد می شود. سارکوم یووینگ خارج استخوانی).
تومورهای سیستم عصبی، غشاهای مغزی،
تاریخ اضافه شدن: 1394/08/26 | بازدید: 4959 | نقض قوانین حق تکثیر
| | | | | | | | | | | | | | | | | | 19 | | | | | | | | | | | | | |
در صورت مشکوک شدن به آسیب شناسی مغز، برای بیماران تصویربرداری تشدید مغناطیسی تجویز می شود. اغلب نتایج مطالعه نشان می دهد که بیمار دارای فضاهای اطراف عروقی گشاد شده است. این چقدر خطرناک است؟ و چنین نشانه ای می تواند نشان دهنده چه بیماری هایی باشد؟ ما این سوالات را در مقاله بررسی خواهیم کرد.
آنچه هست
فضاهای دور عروقی بین دیواره رگ های خونی و ماده سفید مغز قرار دارند. به این سازندها، فضاهای ویرچو-رابین نیز می گویند. آنها با مایع مغزی نخاعی پر شده و خروج مایع مغزی نخاعی را تنظیم می کنند.
به طور معمول، کریبلورها آنقدر کوچک هستند که قابل رویت نیستند، اما مواردی وجود دارد که در حین معاینه، فضاهای اطراف عروقی منبسط شده مشخص می شود. این نتیجه تشخیصی به چه معناست؟ این نشان می دهد که کریبلورها در طول معاینه MRI قابل مشاهده هستند. آنها مانند لکه های سفید در عکس به نظر می رسند.
علل
علائم Robin-Virchow همیشه نشانه آسیب شناسی نیستند. این نتیجه تشخیصی در افراد کاملا سالم نیز مشاهده می شود. بیشتر اوقات، گسترش کریبلورها در بیماران مسن مشاهده می شود و با تغییرات مرتبط با سن در مغز همراه است.
با این حال، در برخی موارد، گشاد شدن فضاهای اطراف عروقی ممکن است نشانه ای از بیماری ها و شرایط زیر باشد:
- آتروفی مغز؛
- لکوآرایوز؛
- ایسکمی مغزی (از جمله انفارکتوس مغزی)؛
- آنسفالومیلیت منتشر
در افراد مسن، گسترش کریبلورها اغلب با فشار خون بالا، آترواسکلروز و زوال عقل مشاهده می شود. این آسیب شناسی ها معمولاً با اختلال حافظه و سایر اختلالات شناختی همراه هستند.
روش های تشخیصی اضافی
اگر نتایج MRI نشان داد که فضاهای Virchow-Robin اطراف عروقی گشاد شده دارید، چه باید کرد؟ لازم است رونوشت مطالعه به متخصص مغز و اعصاب نشان داده شود. فقط یک متخصص می تواند تعیین کند که آیا این یک نوع هنجار، یک ویژگی مرتبط با سن یا نشانه ای از آسیب شناسی است.
مواردی وجود دارد که MRI هیچ تغییری در مغز نشان نمی دهد، اما تصویر فضاهای گشاد شده دور عروقی Virchow-Robin را نشان می دهد. این یعنی چی؟ به عنوان یک قاعده، چنین علامتی نشان دهنده آسیب شناسی نیست. پزشکان افزایش کریبلور را تنها در ترکیب با سایر تغییرات شناسایی شده در طول معاینه MRI در نظر می گیرند.
در صورت لزوم، پزشک ممکن است آزمایشات اضافی را تجویز کند:
- توموگرافی کامپیوتری چند برش؛
- آنژیوگرافی عروقی؛
- داپلروگرافی؛
- معاینه مایع مغزی نخاعی

بیایید نگاهی دقیقتر به شایعترین بیماریها و شرایطی که میتوانند به گسترش کریبلورها منجر شوند، بیاندازیم.
آتروفی مغز
اگر فضاهای اطراف عروقی بیمار گسترش یافته و حجم مغز کاهش یابد، پزشکان در مورد آتروفی اندام صحبت می کنند. اغلب این نشانه بیماری های زیر است:
- زوال عقل پیری؛
- آترواسکلروز؛
- بیماری آلزایمر.
در این بیماری ها نورون ها می میرند. این با اختلال حافظه، اختلال روانی و اختلالات روانی همراه است. به طور معمول، چنین بیماری هایی در بیماران مسن رخ می دهد.

در برخی موارد، فضاهای گشاد شده دور عروقی Virchow-Robin در نوزادان تشخیص داده می شود. این ممکن است نشانه ای از بیماری های ژنتیکی جدی همراه با مرگ نورون ها باشد.
چگونه چنین آسیب شناسی هایی را درمان کنیم؟ به هر حال، دیگر امکان بازیابی نورون های از دست رفته وجود ندارد. شما فقط می توانید روند مرگ سلول های عصبی را کاهش دهید. برای درمان علامتی، بیماران داروهای زیر را تجویز می کنند:
- نوتروپیک ها: "پیراستام"، "کاوینتون"، "نوتروپیل"؛
- داروهای آرام بخش: "فنازپام"، "فنیبوت"؛
- داروهای ضد افسردگی: والدوکسان، آمی تریپتیلین.

پیش آگهی چنین آسیب شناسی معمولا نامطلوب است، زیرا آتروفی مغز و مرگ نورون ها پیشرفت می کند.
لوکوآرایوز
پزشکان لکوآرایوز را نادر شدن مغز می نامند. به دلیل تغییرات ساختاری در بافت عصبی، بیماران فضاهای اطراف عروقی بزرگ شده اند. این نیز نشانه ای از بیماری های مشخصه افراد مسن است:
- فشار خون؛
- آترواسکلروز؛
- زوال عقل پیری
تغییرات در ماده سفید مغز باعث اختلال شناختی می شود. بیماران به صورت علامتی با داروهای نوتروپیک درمان می شوند. این داروها تغذیه نورون ها را بهبود می بخشد و مرگ آنها را متوقف می کند. برای آترواسکلروز، استاتین ها نشان داده شده اند. برای فشار خون بالا، داروهای ضد فشار خون تجویز می شود.
شرایط ایسکمیک
با ایسکمی، خون رسانی به مغز بدتر می شود. این معمولاً نتیجه تغییرات آترواسکلروتیک در عروق است. بیمار به صورت دوره ای دچار سرگیجه، دوبینی، اختلالات هماهنگی حرکتی، اختلالات گفتار و حافظه می شود. به دلیل تغییر در رگ ها، فضاهای اطراف دیواره های آنها نیز گسترش می یابد.

بیماران داروهای نوتروپیک (Piracetam، Cerebrolysin، Actovegin) و همچنین داروهایی که متابولیسم را در سلول های مغز عادی می کنند (Cortexin، Ceraxon) تجویز می کنند. در این مورد، درمان آترواسکلروز با استاتین ها بسیار مهم است. داروهای لوواستاتین، آتورواستاتین و سیمواستاتین تجویز می شوند. این درمان علت ایسکمی را از بین می برد.
انفارکتوس مغزی
اغلب در بیمارانی که دچار انفارکتوس مغزی شده اند، فضاهای اطراف عروقی گشاد می شود. این بیماری نتیجه ایسکمی طولانی مدت است. در برخی موارد، انفارکتوس مغزی بدون علامت است و بیمار متوجه آن نمی شود. عواقب آن فقط در اسکن MRI قابل مشاهده است.
لازم به یادآوری است که اگر بیمار دارای عوامل خطر (فشار خون بالا، آترواسکلروز، دیابت) باشد، ممکن است حمله قلبی به شکل شدید عود کند. برای جلوگیری از حمله مکرر ایسکمی حاد، بیماران داروهای ضد فشار خون، عوامل کاهش دهنده قند خون و رقیق کننده های خون تجویز می شوند.

آنسفالومیلیت منتشر
آنسفالومیلیت منتشر (DEM) یک آسیب شناسی حاد سیستم عصبی مرکزی است. با این بیماری رشته های عصبی از بین می روند. فضاهای دور عروقی Virchow-Robin به دلیل آسیب به ماده سفید و خاکستری متسع می شوند. تصویر MRI کانون های دمیلیناسیون را نشان می دهد.
این آسیب شناسی منشا خود ایمنی دارد. تصویر بالینی بیماری شبیه علائم مولتیپل اسکلروزیس است. بیماران دچار اختلال در راه رفتن و حرکت، اختلالات گفتاری، سرگیجه و التهاب عصب بینایی می شوند.
برخلاف بسیاری از بیماری های دمیلینه کننده دیگر، REM قابل درمان است. برای سرکوب واکنش خود ایمنی به بیماران کورتیکواستروئیدها تجویز می شود:
- "پردنیزولون"؛
- "دگزامتازون"؛
- "متیپرد."
پس از یک دوره درمانی، 70 درصد بیماران بهبودی کامل را تجربه می کنند. در موارد پیشرفته، بیماران ممکن است همچنان عواقب بیماری را تجربه کنند: اختلال در حساسیت اندام ها، اختلال در راه رفتن، و اختلالات بینایی.
جلوگیری
چگونه از آسیب شناسی های فوق پیشگیری کنیم؟ می توان نتیجه گرفت که بیماران مسن بیشتر مستعد ابتلا به چنین بیماری هایی هستند. بنابراین، همه افراد بالای 60 سال باید به طور منظم به متخصص مغز و اعصاب مراجعه کنند و تحت آزمایش MRI مغز قرار گیرند.
همچنین کنترل مداوم سطح کلسترول خون و فشار خون بسیار مهم است. از این گذشته ، بیماری هایی که با تغییرات پاتولوژیک در ماده سفید همراه هستند اغلب در پس زمینه آترواسکلروز و فشار خون بالا ایجاد می شوند.
فصل 2. طبقه بندی بالینی و مورفولوژیکی سرطان پروستات
در 70٪ موارد، سرطان پروستات در ناحیه محیطی ایجاد می شود، فقط در 10-15٪ موارد تومور در ناحیه مرکزی ظاهر می شود، در بقیه - در منطقه انتقال. همانطور که در بالا ذکر شد، بیماری، به استثنای نادر، پس از 50 سال شروع می شود. با این حال، بررسی های بافت شناسی کالبد شکافی پروستات در مردان جوان 30 تا 40 ساله کانون های میکروسکوپی سرطان نهفته را در 20 درصد موارد نشان داد. از آنجایی که چنین تومورهای میکروسکوپی بسیار آهسته رشد می کنند، بیماری خود را از نظر بالینی نشان نمی دهد. با گذشت زمان، کانون های سرطان نهفته به تدریج در اندازه افزایش می یابد و شروع به از دست دادن ویژگی های مشخصه تمایز خود می کند. به طور کلی پذیرفته شده است که وقتی یک تومور به حجم 0.5 سانتی متر مکعب می رسد، از نظر بالینی مهم می شود و نیاز به درمان مناسب دارد. از نظر مورفولوژیکی، تومورهای بدخیم پروستات به دو دسته اپیتلیال و غیر اپیتلیال تقسیم می شوند. به نوبه خود، تومورهای اپیتلیال به آدنوکارسینوم، کارسینوم سلول انتقالی و کارسینوم سلول سنگفرشی تقسیم می شوند. دو شکل آخر تومور بسیار نادر هستند. شایع ترین تومور اپیتلیال آدنوکارسینوم است. لازم به ذکر است که از نظر میکروسکوپی آدنوکارسینوم در ساختار خود ناهمگن است. انواع زیر از آدنوکارسینوم متمایز می شود:
1) آسینار کوچک،
5) سرطان ترابکولار جامد،
2) آسینار بزرگ،
6) اندومتریوئید،
3) سرطان کریبریفورم،
7) غده-کیستیک،
4) آدنوکارسیوم پاپیلاری،
8) سرطان مخاط ساز.
معیارهای اصلی تشخیصی برای سرطان پروستات، آتیپی ساختاری است: آرایش فشرده تومورهای تومور، رشد آشفته آنها با نفوذ به استرومای اندام. در استرومای تومور، مرگ الیاف الاستیک رخ می دهد، نفوذ بافت مجاور توسط تومور و تهاجم به فضاهای لنفاوی پری عصبی و اطراف عروقی مشاهده می شود.
در حال حاضر، طبقه بندی بافت شناسی گلیسون به طور گسترده مورد استفاده قرار می گیرد، زیرا تا حد زیادی نیازهای بالینی را هنگام انتخاب تاکتیک های درمانی و پیش آگهی بیماری برآورده می کند (شکل 1).
برنج. 1.طبقه بندی بافت شناسی گلیسون سرطان پروستات
طبقه بندی گلیسون بر اساس درجه تمایز ساختارهای غده ای تومور است. تومور با نمره گلیسون 1 غدد تقریباً طبیعی را تشکیل می دهد که ساختار آنها با افزایش نمره گلیسون از بین می رود و با نمره 5 تومور با سلول های تمایز نیافته مشخص می شود. هر چه تمایز بافتی بیشتر از بین برود، پیش آگهی برای یک بیمار بدتر است.
طبق طبقه بندی گلیسون، درجه تمایز تومور به پنج درجه تقسیم می شود:
- درجه بندی 1: تومور از غدد کوچک همگن با حداقل تغییرات هسته ای تشکیل شده است.
- درجه 2: تومور شامل خوشه هایی از غدد است که هنوز توسط استروما از هم جدا شده اند، اما نزدیک به یکدیگر قرار دارند.
- درجه بندی 3: تومور از غدد با اندازه ها و ساختارهای مختلف تشکیل شده است و به طور معمول به استروما و بافت های اطراف نفوذ می کند.
- درجه 4: تومور متشکل از سلول های غیر معمول است و به بافت های اطراف نفوذ می کند.
- درجه بندی 5: تومور از لایه هایی از سلول های آتیپیک تمایز نیافته تشکیل شده است.
تجزیه و تحلیل نتایج مدیریت انتظاری در درمان سرطان پروستات نشان داد که در بیماران با نمره گلیسون کمتر از 4، تومور در 2.1٪ موارد در سال متاستاز می دهد، در بیماران با نمره گلیسون 5 تا 7 - در 5.4 درصد موارد و در بیماران با نمره گلیسون بیش از 7 - در 13.5 درصد موارد.
جدول 9.درجه بندی گلیسون
متأسفانه، در حال حاضر نمی توان پیش بینی کرد که کدام تومور در طول زندگی بعدی بیمار بدون علامت باشد و کدام یک به مرحله ای با تظاهرات بالینی پیشرفت کند. برای ارزیابی شایستگی طبقه بندی پیشنهادی گلیسون، اجازه دهید آن را با سیستم سازمان بهداشت جهانی، که عمدتاً در اروپا استفاده می شود، مقایسه کنیم. تقسیم 3 درجه بندی سلول ها (G1 - G2 - G3) به تمایز زیاد، متوسط و ضعیف را فراهم می کند و نتیجه گیری با توجه به کمترین تمایز سلول ها ارائه می شود. سیستم گلیسون بر اساس تجزیه و تحلیل تمایز غدد در بزرگنمایی میکروسکوپی نسبتا کم است. و بررسی سیتولوژیک سلولها در اینجا نقشی ندارد. هنگام مقایسه این دو طبقه بندی، سازگاری ناقص آنها ظاهر می شود. به عنوان مثال، نمره گلیسون 2 تا 4 ممکن است تومور با درجه بالا در نظر گرفته شود و نمره گلیسون از 8 تا 10 ممکن است تومور با درجه پایین در نظر گرفته شود، اما نمره گلیسون از 5 تا 7 با یک تومور متوسط قابل مقایسه نیست. تومور درجه مشخص شده است که تومورهای با نمره گلیسون 7 به طور قابل توجهی تهاجمی تر از سرطان هایی با نمره گلیسون 5 تا 6 هستند. برخی از تومورها با نمره گلیسون 5 و 6 ممکن است تحت نظر باقی بمانند، در حالی که نمره گلیسون 7 اغلب اورولوژیست ها را مورد بررسی قرار می دهند. قطعاً بیمار را درمان کنید. البته، در هر مورد ممکن است تفاوت هایی بین گریدهای فردی وجود داشته باشد، اما تفاوت بین 6 و 5 یا تا 4 مهم نیست، زیرا پیش آگهی و درمان این تومورها یکسان است. خطا در درجه بندی تومور در مواردی رخ می دهد که تعداد قطعات تومور محدود است.
مقایسه نمره گلیسون بیوپسی ارائه شده و نتایج به دست آمده پس از پروستاتکتومی رادیکال برای دانستن اینکه تشخیص قبل از عمل چقدر دقیق است ضروری است. طبق گفته اپستین I (1997)، بر اساس 499 نمونه برداری، توافق در همان نمره گلیسون در 74 تا 94 درصد موارد رخ می دهد (جدول 10 را ببینید).
جدول 10.همبستگی نمره گلیسون بین بیوپسی و رادیکال پروستاتکتومی.
نویسنده معتقد است که خطاهای ایجاد شده در درجه بندی تومور بر اساس بیوپسی و پروستاتکتومی رادیکال با نمونه گیری ضعیف، موارد مرزی تمایز تومور و ذهنی بودن ارزیابی آن مرتبط است. بنابراین، در 55 درصد از نمونهبرداریهایی که در موسسات دیگر درجهبندی شدند و نمره گلیسون 2-4 داده شد، تومور یا به کپسول و وزیکولهای سمینال تهاجم داشت یا به غدد لنفاوی متاستاز داشت. برای افزایش دقت معاینه مورفولوژیکی، نویسنده توصیه می کند یک پارامتر اضافی - میزان سرطان در طول بیوپسی سوزنی، و همچنین در نظر گرفتن شاخص PSA به طور همزمان با داده های بررسی بافت شناسی معرفی شود.
ارزش اصلی هر طبقه بندی اهمیت آن برای درمان و پیش آگهی بیماری پروستات است. هنگامی که مورد مطالعه قرار گرفت، داده های گلیسون برای 2911 بیمار همبستگی نسبتا بالایی را بین نمره گلیسون و پیش آگهی بیماری نشان داد. Epstein I. (1997) خاطرنشان می کند: «در داده های ما، افزایش نمره گلیسون در مورد پروستاتکتومی رادیکال با بدتر شدن تمام پارامترهای پیش آگهی همراه است».
همانطور که نویسنده اشاره می کند، نمره گلیسون نیز قوی ترین پیش بینی کننده پیشرفت پس از پروستاتکتومی رادیکال است. تومورهایی با نمره گلیسون 8 تا 10 پیش آگهی بدی دارند. اگر متاستازهای منطقه ای تشخیص داده شوند، پروستاتکتومی هیچ فایده ای ندارد، اگرچه از نظر فنی امکان پذیر است. همه موارد فوق در جدول 11 نشان داده شده است. همانطور که از جدول مشاهده می شود، با نمره گلیسون 8-10، همه عوامل پیش آگهی چندین بار بدتر می شوند.
جدول 11.ارتباط نمره گلیسون با آسیب شناسی شناسایی شده پس از پروستاتکتومی رادیکال.
طبقه بندی بین المللی سرطان پروستات بر اساس سیستم TNM (1997).
مرحله T1، همانطور که در طبقه بندی ذکر شد، به معنای بیماری است که به طور اتفاقی پس از برداشتن پروستات از طریق مجرای ادرار یا تعیین سطح PSA تشخیص داده می شود، که با لمس و سونوگرافی تشخیص داده نمی شود. با وجود موارد فوق، این مرحله به 3 گزینه تقسیم می شود. نکته این است که پیش آگهی برای هر یک به طور قابل توجهی متفاوت است. به عنوان مثال، برای مرحله T1b میانگین دوره زمانی قبل از پیشرفت 4.75 سال و برای مرحله T1a 13.5 سال است، یعنی. در افراد مسن مبتلا به مرحله بیماری T1a، انتظار مراقبه اغلب ضروری است، در حالی که افراد مبتلا به مرحله بیماری T1b به درمان تهاجمی با هدف درمان بیماری نیاز دارند.
طبقه بندی بین المللی سرطان پروستات با استفاده از سیستم TNM
تومور
T1 - به طور تصادفی تشخیص داده می شود (قابل لمس نیست و با سونوگرافی تشخیص داده نمی شود)
T1a - سرطان خوب تمایز یافته پس از برداشتن غده پروستات از طریق مجرای ادرار که کمتر از 5 درصد از بافت برداشته شده را اشغال می کند، شناسایی می شود.
T1b - هر توموری که پس از برداشتن پروستات از طریق مجرای ادراری، با درجه پایین تر یا بیش از 5 درصد از بافت برداشته شده را اشغال کند، شناسایی شود.
T1c - سرطان غیر قابل لمس پروستات که با بیوپسی با هدایت اولتراسوند ترانس رکتال شناسایی می شود. اندیکاسیون های بیوپسی - سطح PSA بالا
برنج. 2.سرطان پروستات که تصادفاً تشخیص داده می شود، توموری است که پس از برداشتن غده پروستات از طریق مجرای ادراری کشف می شود. سرطان مرحله T1a یک تومور کوچک و با تمایز خوب است که کمتر از 5 درصد از بافت برداشته شده را اشغال می کند. سرطان پروستات مرحله T1b تومور بزرگتری است که بیش از 5 درصد از بافت برداشته را اشغال می کند و تمایز کمتری دارد.

T2 - تومور محدود به غده پروستات
T2a - تومور یک لوب را تحت تاثیر قرار می دهد
T2b - تومور 2 لوب را تحت تاثیر قرار می دهد
T3 - تومور فراتر از کپسول پروستات رشد می کند
T3a - گسترش تومور خارج کپسولی
T3b - تومور به وزیکول های منی گسترش می یابد
T4 - تومور به اندام های مجاور رشد می کند
شکل 3.با توجه به سیستم TNM، چهار مرحله از گسترش تومور موضعی متمایز می شود - از T1 (یافته تصادفی) تا T4 (گسترش به اندام های مجاور).

N - غدد لنفاوی منطقه ای
NX - متاستاز به غدد لنفاوی منطقه ای شناسایی نشده است
NO - بدون متاستاز به غدد لنفاوی منطقه ای
N1 - متاستاز به غدد لنفاوی منطقه ای
م - متاستازهای دوردست
MX - متاستازهای دور شناسایی نشده است
M0 - بدون متاستاز دور
M1 - متاستازهای دور
M1a - متاستاز به غدد لنفاوی غیر از غدد منطقه ای
M1b - متاستازهای استخوانی
M1c - متاستاز به سایر اندام ها (رکتوم، وزیکول منی)
رشد تومور خودمختار با عدم کنترل تکثیر و تمایز سلول های ارگانیسم حامل تومور مشخص می شود. تهاجم تومور در سه مرحله رخ می دهد و با بازآرایی ژنتیکی خاصی تضمین می شود.
مرحله اول تهاجم تومور با تضعیف تماس بین سلول ها مشخص می شود. در مرحله دوم، سلول تومور آنزیمهای پروتئولیتیک و فعالکنندههای آنها را ترشح میکند که تخریب ماتریکس خارج سلولی را تضمین میکند و در نتیجه راه را برای تهاجم باز میکند.
مرحله متاستاز مرحله نهایی مورفوژنز تومور است که با گسترش سلول های تومور از تومور اولیه به سایر اندام ها از طریق لنفاوی، عروق خونی، پری عصبی و لانه گزینی همراه است که مبنایی برای شناسایی انواع متاستاز بود.
رشد تومور خودمختار
رشد تومور خودمختار با عدم کنترل تکثیر سلولی و تمایز توسط ارگانیسم حامل تومور مشخص می شود. این بدان معنا نیست که سلول های تومور در نوعی هرج و مرج تکثیر هستند. در واقع سلول های تومور به اتوکرینیا مکانیسم پاراکرین برای تنظیم رشد آن
در طی تحریک اتوکرین رشد، سلول تومور خود فاکتورهای رشد یا انکوپروتئینهای آنالوگ فاکتورهای رشد و همچنین گیرندهها یا انکوپروتئینهای آنالوگ گیرندههای فاکتور رشد را تولید میکند. این اتفاق می افتد، برای مثال، در سرطان ریه سلول کوچک، سلول های آن هورمون رشد بمبسین و در عین حال گیرنده های آن را تولید می کنند. تحریک پاراکرین نیز رخ می دهد، زیرا بمبسین می تواند با سلول های همسایه نیز تعامل داشته باشد.
نمونه بارز تحریک تومور پاراکرین تولید فاکتور رشد شبه انسولین 2 توسط فیبروبلاست ها در استرومای سرطان ریه است. فاکتور رشد با گیرندههای سلولهای سرطانی تعامل دارد و تکثیر آنها را تحریک میکند. رشد تومور خودمختار در از دست دادن مهار تماس و جاودانگی (کسب جاودانگی) سلول های تومور بیان می شود، که می تواند با انتقال سلول ها به روش های اتوکرین و پاراکرین برای تنظیم رشد آنها توضیح داده شود.
استقلال تومور ماهیت نسبی دارد، زیرا بافت تومور به طور مداوم مواد مغذی، اکسیژن، هورمونها و سیتوکینهای مختلف را از بدن دریافت میکند. علاوه بر این، تحت تأثیر سیستم ایمنی و بافت غیر توموری اطراف آن است.
بنابراین، استقلال تومور را باید نه به عنوان استقلال کامل سلول های تومور از بدن، بلکه به عنوان کسب توانایی خودگردانی توسط سلول های تومور درک کرد.
در تومورهای بدخیم، رشد خودمختار به طور قابل توجهی بیان می شود، و آنها به سرعت رشد می کنند و به بافت های طبیعی مجاور حمله می کنند. در تومورهای خوش خیم بسیار ضعیف بیان می شود. برخی از آنها در معرض تأثیرات تنظیمی هستند و به آرامی رشد می کنند، بدون اینکه در بافت های همسایه رشد کنند.
پیشرفت تومور
تئوری پیشرفت تومورتوسط L. Foulds در سال 1969 بر اساس داده های انکولوژی تجربی توسعه یافته است. با توجه به تئوری پیشرفت تومور، رشد تدریجی و تدریجی تومور با عبور از تعدادی از مراحل کیفی متفاوت وجود دارد. همانطور که خود نویسنده این نظریه معتقد بود، استقلال نه تنها در رشد، بلکه در سایر علائم تومور نیز آشکار می شود.
موافقت با دیدگاه دوم دشوار است، زیرا بدخیمی تومور همیشه پایه مادی به شکل سنتز فعال برخی از انکوپروتئین ها، فاکتورهای رشد و گیرنده های آنها دارد. این شرایط اثری بر تظاهرات آتیپی مورفولوژیکی تومور می گذارد و در پیش بینی زندگی بیماران سرطانی استفاده می شود.
تومور دائماً در حال تغییر است: پیشرفت معمولاً به سمت افزایش بدخیمی رخ می دهد که با رشد تهاجمی و ایجاد متاستاز آشکار می شود.
صحنه تومور مهاجمبا وقوع رشد نفوذی مشخص می شود. یک شبکه عروقی توسعه یافته و استروما در تومور ظاهر می شود که به درجات مختلف بیان می شود. هیچ مرزی با بافت غیر توموری مجاور به دلیل رشد سلول های تومور در آن وجود ندارد. تهاجم تومور در سه مرحله رخ می دهد و با بازآرایی ژنتیکی خاصی تضمین می شود.
مرحله اول تهاجم توموربا تضعیف تماسهای بین سلولها مشخص میشود، همانطور که با کاهش تعداد تماسهای بین سلولی، کاهش غلظت برخی از مولکولهای چسبنده از خانواده CD44 و سایرین مشهود است، و برعکس، افزایش بیان سایرین که تضمین میکنند. تحرک سلول های تومور و تماس آنها با ماتریکس خارج سلولی.
غلظت یون های کلسیم در سطح سلول کاهش می یابد که منجر به افزایش بار منفی سلول های تومور می شود. بیان گیرنده های اینتگرین افزایش می یابد و از اتصال سلولی به اجزای ماتریکس خارج سلولی - لامینین، فیبرونکتین، کلاژن ها اطمینان می یابد.
در فاز دومسلول تومور آنزیم های پروتئولیتیک و فعال کننده های آنها را ترشح می کند که از تخریب ماتریکس خارج سلولی اطمینان حاصل می کند و در نتیجه راه را برای تهاجم باز می کند.
در عین حال، محصولات تخریب فیبرونکتین و لامینین مواد شیمیایی جذب کننده سلول های توموری هستند که در طول مدت به منطقه تخریب مهاجرت می کنند. فاز سومتهاجم، و سپس روند دوباره تکرار می شود.
مرحله متاستاز- مرحله نهایی مورفوژنز تومور، همراه با بازآرایی ژنتیکی و فنوتیپی خاص تومور. فرآیند متاستاز با گسترش سلول های تومور از تومور اولیه به سایر اندام ها از طریق رگ های لنفاوی و خونی، از راه عصبی و لانه گزینی همراه است که مبنایی برای تشخیص انواع متاستاز شد.
فرآیند متاستاز با تئوری آبشار متاستاتیک توضیح داده می شود، که بر اساس آن یک سلول تومور تحت یک زنجیره (آبشار) از بازآرایی قرار می گیرد که پخش شدن به اندام های دور را تضمین می کند.
در طول فرآیند متاستاز، یک سلول تومور باید ویژگی های خاصی داشته باشد:
- نفوذ به بافت های مجاور و لومن رگ های خونی (وریدهای کوچک و عروق لنفاوی)؛
- جدا از لایه تومور به جریان خون (لنف) به شکل سلول های فردی یا گروه های کوچکی از آنها.
- حفظ زنده ماندن پس از تماس در جریان خون (لنف) با عوامل دفاعی ایمنی خاص و غیر اختصاصی.
- به ونول ها (رگ های لنفاوی) مهاجرت می کنند و در اندام های خاصی به اندوتلیوم آنها متصل می شوند.
- به رگ های کوچک حمله کرده و در مکانی جدید در یک محیط جدید رشد می کنند.
آبشار متاستاتیک تقریباً به چهار مرحله تقسیم می شود:
- تشکیل یک ساب کلون تومور متاستاتیک؛ تهاجم به لومن رگ؛
- گردش آمبولی تومور در جریان خون (جریان لنفاوی)؛
- مستقر شدن در یک مکان جدید با تشکیل یک تومور ثانویه.
فرآیند متاستاز با ظهور یک زیر کلون متاستاتیک از سلول های تومور با پلاسمالمای تغییر یافته آغاز می شود که در نتیجه تماس های بین سلولی از بین می رود و توانایی حرکت ظاهر می شود.
سپس سلول های تومور از طریق ماتریکس خارج سلولی مهاجرت می کنند و با گیرنده های اینتگرین به لامینین، فیبرونکتین، مولکول های کلاژن غشای پایه رگ متصل می شوند و پروتئولیز آن را به دلیل آزاد شدن کلاژنازها، کاتپسین، الاستاز، گلیکوزآمینوهیدرولاز، پلاسمین و غیره انجام می دهند. .
این به سلول های تومور اجازه می دهد تا به غشای پایه رگ حمله کنند، به اندوتلیوم آن بچسبند و سپس با تغییر خواص چسبندگی خود (سرکوب مولکول های چسبنده مولکول های چسب سلولی - خانواده CAM)، از لایه تومور و اندوتلیوم عروق جدا شوند. .
در مرحله بعد آمبولی های توموری تشکیل می شود که می تواند فقط از سلول های تومور یا در ترکیب با پلاکت ها و لنفوسیت ها تشکیل شود. پوشش فیبرین چنین آمبولی می تواند سلول های تومور را از حذف توسط سلول های سیستم ایمنی و عملکرد عوامل محافظتی غیر اختصاصی محافظت کند.
در مرحله نهایی، برهمکنش سلول های تومور با اندوتلیوم ونول ها به دلیل گیرنده های β و مولکول های CD44، اتصال و پروتئولیز غشای پایه، تهاجم به بافت اطراف عروقی و رشد تومور ثانویه رخ می دهد.
با پیشرفت تومور، ممکن است تکامل کلونال(Nowell P., 1988)، یعنی ممکن است کلون های جدیدی از سلول های تومور ظاهر شوند که در نتیجه جهش های ثانویه ایجاد می شوند که منجر به پلی کلونالیته تومور و تسلط تهاجمی ترین کلون ها در نتیجه انتخاب کلونال می شود.
تومورهای خوش خیم با غلبه سلول های تومور یک کلون در سراسر وجودشان مشخص می شوند، در حالی که در تومورهای بدخیم پلی کلونالیته به طور مداوم پیشرفت می کند، به ویژه در انواع با تمایز کم و بسیار بدخیم.
نظریه تکامل کلونال نه تنها می تواند به توضیح پیشرفت تومور بدخیم و متاستاز کمک کند، بلکه به سوالات زیر نیز پاسخ دهد:
- چرا پدیده متاپلازی (تغییر در تمایز سلولی در مناطق خاص) می تواند در تومورها رخ دهد.
- چگونه بدخیمی تومور ممکن است در طول زمان یا به ویژه پس از درمان ضد تومور افزایش یابد.
- چرا تومورهای مقاوم به اثرات ضد تومور خود به خود و پس از اثرات درمانی ایجاد می شوند (پدیده مقاومت چند دارویی تومور).
نقش استرومای تومور و فرآیندهای رگزایی در رشد و پیشرفت مستقل آن
یک جزء ساختاری مهم تومور استرومای آن است. استروما در تومور، مانند استروما در بافت طبیعی، عمدتاً عملکردهای تغذیه ای، تعدیل کننده و حمایتی را انجام می دهد.
عناصر استرومایی تومور توسط سلول ها و ماتریکس خارج سلولی بافت همبند، عروق و انتهای عصبی نشان داده می شوند. ماتریکس خارج سلولی تومورها با دو جزء ساختاری نشان داده می شود: غشاهای پایه و ماتریکس بافت همبند بینابینی.
ترکیب غشاهای پایه شامل انواع کلاژن های IV، VI و VII، گلیکوپروتئین ها (لامینین، فیبرونکتین، ویترونکتین)، پروتئوگلیکان ها (هپاران سولفات و غیره) است. ماتریکس بافت همبند بینابینی حاوی کلاژن نوع I و III، فیبرونکتین، پروتئوگلیکان و گلیکوزآمینوگلیکان است.
منشا استرومای تومور. داده های تجربی قانع کننده ای در مورد ظهور عناصر سلولی استرومای تومور از پیش سازهای بافت همبند طبیعی بافت اطراف تومور از قبل موجود به دست آمده است. در سال 1971
جی فولکمن نشان داد که سلول های تومور بدخیم عامل خاصی تولید می کنند که تکثیر عناصر دیواره عروقی و رشد رگ های خونی را تحریک می کند. این ماده پروتئینی پیچیده فاکتور Volkmann نامیده می شود.
همانطور که بعداً مشخص شد، فاکتور Volkmann گروهی از فاکتورهای رشد فیبروبلاست است که بیش از 11 مورد از آنها قبلاً شناخته شده است. Volkmann اولین کسی بود که به طور قانع کننده ای نشان داد که تشکیل استروما در تومور نتیجه تعاملات پیچیده بین سلول تومور و بافت همبند است. سلول ها.
نقش مهمی در تشکیل استروما در نئوپلاسم توسط سلول های بافت همبند با منشاء موضعی، بافت زایی و هماتوژن ایفا می شود. سلولهای استرومایی فاکتورهای رشد مختلفی تولید میکنند که تکثیر سلولهای با منشا مزانشیمی (فاکتورهای رشد فیبروبلاست، فاکتور رشد پلاکتی، فاکتور نکروز تومور a، فیبرونکتین، فاکتورهای رشد شبه انسولین و غیره)، برخی انکوپروتئینها (c-sis، c-myc).
در عین حال، آنها گیرنده هایی را بیان می کنند که فاکتورهای رشد و انکوپروتئین ها را به هم متصل می کنند، که باعث می شود تکثیر آنها در هر دو مسیر اتوکرین و پاراکرین تحریک شود.
علاوه بر این، سلول های استرومایی خود قادر به ترشح انواع آنزیم های پروتئولیتیک هستند که منجر به تخریب ماتریکس خارج سلولی می شود.
سلول های تومور به طور فعال در تشکیل استروما شرکت می کنند.
اولاسلول های تبدیل شده از طریق مکانیسم تنظیمی پاراکرین تکثیر سلول های بافت همبند را تحریک می کنند و فاکتورهای رشد و انکوپروتئین ها را تولید می کنند.
دوماآنها قادر به تحریک سنتز و ترشح اجزای ماتریکس خارج سلولی توسط سلول های بافت همبند هستند.
سومسلول های تومور خود قادر به ترشح اجزای خاصی از ماتریکس خارج سلولی هستند. علاوه بر این، نوع چنین اجزایی در برخی از تومورها دارای ترکیب مشخصی است که می توان از آن در تشخیص افتراقی آنها استفاده کرد.
چهارمسلولهای تومور آنزیمهایی (کلاژنازها و غیره)، مهارکنندهها و فعالکنندههای آنها را تولید میکنند که باعث تقویت یا برعکس، فیلتر شدن و رشد تهاجمی تومورهای بدخیم میشوند. تعادل پویا بین فعالکنندههای کلاژناز و مهارکنندههای آن، وضعیت تومور پایدار را تضمین میکند و از رشد در بافتهای مجاور جلوگیری میکند. در طول رشد، سلول های تومور به طور فعال کلاژنازها، الاستازها و مهارکننده های آنها را سنتز می کنند.
تومورهای بدخیم اغلب استروما را تشکیل می دهند که در آن نوع کلاژن استرومای اندام مربوطه در مرحله رشد جنینی غالب است. به عنوان مثال، در استرومای سرطان ریه، نوع غالب کلاژن، کلاژن III، مشخصه ریه جنینی است.
تومورهای مختلف ممکن است در ترکیب کلاژن های استرومایی متفاوت باشند. در کارسینوم ها، به طور معمول، کلاژن های نوع III (سرطان ریه)، نوع IV (کارسینوم سلول کلیوی و نفروبلاستوما) غالب هستند؛ در سارکوم ها، کلاژن های بینابینی غالب هستند، اما در کندروسارکوم ها، کلاژن II غالب است. سارکوم سینوویال حاوی مقدار زیادی کلاژن IV است.
تفاوت های توصیف شده در ترکیب استروما به ویژه در تشخیص افتراقی سارکوم مهم است.
آنژیوژنز در تومور. رشد تومورها به درجه توسعه شبکه عروقی در آنها بستگی دارد. در نئوپلاسم های با قطر کمتر از 1-2 میلی متر، مواد مغذی و اکسیژن از مایع بافتی بافت های اطراف به وسیله انتشار می آیند. برای تغذیه نئوپلاسم های بزرگتر، عروقی شدن بافت آنها ضروری است.
رگ زایی در تومور توسط گروهی از فاکتورهای رشد رگ زا تضمین می شود که برخی از آنها می توانند توسط سلول های اپیتلیال فعال در مناطق التهاب مزمن و بازسازی نیز ایجاد شوند. گروه فاکتورهای رگ زایی تومور شامل فاکتورهای رشد فیبروبلاست ها، اندوتلیوم، عروق گلیوما، کراتینوسیت ها، فاکتور رشد اپیدرموئید، آنژیوژنین، برخی از عوامل محرک کلنی مغز استخوان و غیره می باشد.
در کنار فاکتورهای رشد، ترکیب ماتریکس خارج سلولی استرومای تومور از اهمیت زیادی در رگزایی برخوردار است. محتوای اجزای غشای پایه - لامینین، فیبرونکتین و کلاژن نوع IV مطلوب است.
تشکیل رگ های خونی در تومورها در برابر پس زمینه تحریک میتوژنتیک منحرف و یک ماتریکس خارج سلولی تغییر یافته رخ می دهد. این منجر به ایجاد عروق معیوب، عمدتاً از نوع مویرگی، اغلب دارای غشای پایه ناپیوسته و پوشش اندوتلیال آسیب دیده است. اندوتلیوم را می توان با سلول های تومور جایگزین کرد و گاهی اوقات کاملاً وجود ندارد.
نقش استروما برای تومور به عملکردهای تغذیه ای و حمایتی محدود نمی شود. استروما بر رفتار سلول های تومور اثر اصلاحی دارد، یعنی اثر تنظیمی بر تکثیر، تمایز سلول های تومور، امکان رشد تهاجمی و متاستاز دارد.
اثر اصلاحی استروما بر روی تومور به دلیل وجود گیرنده های اینتگرین و مولکول های چسبنده روی غشای سلولی سلول های تومور است که قادر به انتقال سیگنال به عناصر اسکلت سلولی و بیشتر به هسته سلول تومور هستند.
گیرنده های اینتگرین- دسته ای از گلیکوپروتئین ها که در غشاء قرار دارند، انتهای داخلی آن با عناصر اسکلت سلولی مرتبط است، و قسمت بیرونی، خارج سلولی، قادر به تعامل با سوبسترا تری پپتید Arg-Gly-Asp است.
هر گیرنده از دو زیر واحد a و b تشکیل شده است که انواع مختلفی دارند. ترکیبات مختلف زیر واحدها تنوع و ویژگی گیرنده های اینتگرین را فراهم می کند.
در تومورها، گیرنده های اینتگرین به گیرنده های بین سلولی و اینتگرین بین سلول های تومور و اجزای ماتریکس خارج سلولی - لامینین، فیبرونکتین، ویترونکتین، به انواع مختلف کلاژن ها، به مولکول های چسبنده از خانواده CD44 تقسیم می شوند.
گیرنده های اینتگرین واسطه تعاملات بین سلولی بین سلول های تومور و همچنین با سلول ها و ماتریکس خارج سلولی استروما هستند. در نهایت، آنها توانایی تومور برای رشد تهاجمی و متاستاز را تعیین می کنند.
مولکول های چسب CAM یکی دیگر از اجزای مهم غشای سلولی سلول های تومور هستند که از تعامل آنها با یکدیگر و با اجزای استرومایی اطمینان می دهند. آنها توسط خانواده های NCAM، LCAM، N-cadherin و CD44 نشان داده می شوند.
در طول تبدیل تومور، ساختار و بیان مولکول های چسبنده که غشای سلولی را تشکیل می دهند تغییر می کند، در نتیجه روابط بین سلول های تومور مختل می شود و در نتیجه رشد تهاجمی و متاستاز آغاز می شود.
بسته به رشد استروما، تومورها به ارگانوئید و هیستیوئید تقسیم می شوند.
که در تومورهای ارگانوئیدیپارانشیم و استرومای توسعه یافته وجود دارد. نمونه ای از تومورهای ارگانوئید تومورهای مختلف اپیتلیال هستند. درجه توسعه استروما همچنین می تواند از لایه های فیبری نازک باریک و عروق نوع مویرگی در سرطان مدولاری تا زمینه های قدرتمند بافت فیبری که در آن زنجیره های تومور اپیتلیال به سختی قابل تشخیص هستند، در سرطان فیبری یا سیرا متفاوت باشد.
که در تومورهای هیستوئیدیپارانشیم غالب است ، استروما عملاً وجود ندارد ، زیرا فقط توسط عروق مویرگی دیواره نازک که برای تغذیه ضروری است نشان داده می شود. تومورهای نوع هیستیوئید از بافت همبند خود و برخی نئوپلاسم های دیگر ساخته می شوند.
بنابراین، می توان نتیجه گرفت که تشکیل استروما در تومور یک فرآیند پیچیده چند مرحله ای است که مراحل اصلی آن را می توان در نظر گرفت:
- ترشح سیتوکین های میتوژنیک توسط سلول های تومور - فاکتورهای رشد مختلف و انکوپروتئین هایی که تکثیر سلول های بافت همبند، عمدتاً اندوتلیوم، فیبروبلاست ها، میوفیبروبلاست ها و سلول های ماهیچه صاف را تحریک می کنند.
- سنتز برخی از اجزای ماتریکس خارج سلولی توسط سلول های تومور - کلاژن ها، لامینین، فیبرونکتین و غیره.
- تکثیر و تمایز سلول های پیش ساز با منشاء بافت همبند، ترشح آنها از اجزای ماتریکس خارج سلولی و تشکیل عروق نوع مویرگی دیواره نازک، که با هم استرومای تومور است.
- مهاجرت سلول های با منشاء هماتوژن به استرومای تومور - مونوسیت ها، سلول های پلاسما، عناصر لنفاوی، ماست سل ها و غیره.