النمو حول الأوعية الدموية. نمو وانتشار سرطان الثدي الأولي. تليف الثدي: الأشكال والأعراض
نبيبينا تي آي، دوبروفسكي إيه سي، روليفيتش آي آي، بولياكوف إس إل.
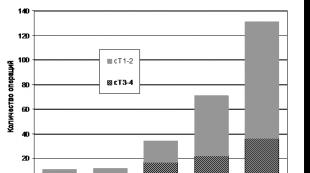
في السنوات الأخيرة، حدثت زيادة كبيرة في اكتشاف سرطان البروستاتا (PCa) في جمهورية بيلاروسيا. ومن الواضح أن هذه الزيادة تعكس الاتجاه الناشئ في بلدان رابطة الدول المستقلة نحو الكشف المبكر عن سرطان البروستاتا بسبب التكرار المتزايد لتحديد مستوى المستضد الخاص بالبروستاتا (PSA) في دم المرضى الذين لا يعانون من أعراض. أدت الزيادة في وتيرة الكشف عن سرطان البروستاتا الموضعي والمتقدم محليًا إلى زيادة في وتيرة استئصال البروستاتا الجذري (RP) في السنوات 3-5 الماضية في معهد أبحاث الدولة OMR (الشكل 1).
واحدة من أهم القضايا التي تواجه علماء الأمراض وأطباء المسالك البولية هي التحديد الصحيح للتشخيص بعد الجراحة لكل مريض على حدة. تعتبر نتائج الفحص المرضي للدواء بعد الإصابة بالـ RP هي المعلومات الأكثر قيمة للإجابة على هذا السؤال. وهكذا، وفقا لستامي وآخرون. يمكن التنبؤ بتكرار الإصابة بسرطان البروستاتا بعد الإصابة بالمرض بدرجة عالية من الدقة بناءً على نتائج الفحص المرضي. يقدم هذا العمل، الذي يستند إلى أحدث توصيات الفريق العامل التابع للجمعية الأوروبية لاعتلال المسالك البولية، لمحة عامة عن منهجية الفحص المورفولوجي للدواء بعد التهاب المفاصل الروماتويدي.
هيكل ووظيفة غدة البروستاتا
يبدو أن دور ووظيفة غدة البروستاتا (PG) في جسم الذكر ليس مفهومًا تمامًا. يشكل إفراز الغدة حوالي 20% من حجم السائل المنوي، ويحتوي على مواد تعزز حركة الحيوانات المنوية، ولكنها ليست حيوية للتخصيب. يغطي البنكرياس الجزء القريب من مجرى البول وله شكل مخروطي مقطوع، وجزءه العريض يواجه المثانة. تتميز الأسطح الأمامية والخلفية والجانبية، من الأسفل - القمة ومن الأعلى - القاعدة. يقسم الأخدود الذي يمتد على طول السطح الخلفي البنكرياس إلى فصين.
يتكون البنكرياس من غدد أنبوبية سنخية، متجمعة في فصيصات وسدى تحيط بالغدد. تتحد قنوات الإخراج في الغدد لتشكل قنوات أكبر، والتي تنفتح في مجرى البول البروستاتا. يحيط بالبنكرياس كبسولة كثيفة تتكون من الكولاجين والإيلاستين وكمية كبيرة من العضلات الملساء. يحد البنكرياس المستقيم من الخلف، والمثانة من الأعلى، وعظمة العانة من الأمام، وعضلات قاع الحوض من الجانب الجانبي، والعضلة العاصرة المخططة الإرادية من الأسفل. ما يسمى الخلفي والجانبي للبنكرياس حزم الأوعية الدموية العصبية. أنها تحتوي على فروع رقيقة من الشريان الحرقفي الداخلي الذي يزود الدم إلى الحويصلات المنوية والبروستاتا. ترافق هذه الأوعية الألياف العصبية اللاإرادية (ما يسمى بالأعصاب الكهفية)، والتي تأتي من الضفيرة الحوضية وتعصب البنكرياس والأجسام الكهفية للقضيب. البنكرياس محاط بالضفيرة الوريدية سانتوريني.
التشريح المنطقي للبنكرياس.يتكون البنكرياس من خمس مناطق: المركزية، الطرفية، الانتقالية، المحيطة بالإحليل، والسدى العضلي الليفي الأمامي (الشكل 2). يتطور PCa بمعدل مختلف في كل منطقة، وهذا التردد لا يتناسب مع كتلة الأنسجة الغدية فيها. تشكل المناطق المركزية والمحيطية - أكبر مناطق البروستاتا - معًا حوالي 95٪ من الأنسجة الغدية لغدة البروستاتا. تحيط المنطقة المركزية بالأسهر في طريقها من قاعدة البنكرياس إلى الحديبة المنوية. تشغل المنطقة المركزية 15-20% من حجم الغدة، لكن 5-10% فقط من جميع حالات سرطان البروستاتا تنشأ فيها. المنطقة المحيطية هي جزء الغدة الذي يتم ملامسته من خلال المستقيم. وهي تحيط بالمنطقة المركزية، وتضم 70% من الأنسجة الغدية، وينشأ فيها حوالي 70% من الأورام السرطانية الغدية البنكرياسية. المنطقة الانتقالية هي أقسام البنكرياس المقترنة، والتي تقع على جانبي مجرى البول البروستاتا على مستوى الحديبة المنوية، وتحتل الـ 5٪ المتبقية من الغدة. علم الأمراض الأكثر شيوعا في هذه المنطقة هو تضخم البروستاتا الحميد (BPH)، والذي يمكن أن يؤدي إلى زيادة كبيرة في هذه المناطق، وأحيانا يتجاوز حجم مناطق أخرى من البروستاتا. في هذه المنطقة، يتطور جهاز الكمبيوتر بشكل أقل تكرارًا من تضخم البروستاتا الحميد، ويبلغ تردده حوالي 20٪. تقع الغدد المحيطة بالإحليل بين مجرى البول البروستاتا والعضلة العاصرة الملساء القريبة للمثانة. تحتل السدى العضلي الليفي السطح الأمامي للبنكرياس وتتكون في الغالب من الأنسجة العضلية. لا تتطور الأورام السرطانية الغدية في المنطقتين الأخيرتين.
طريقة لمعالجة MACROPREPARE بعد RP
يوصى بوزن المستحضرات الطازجة (غير المثبتة) بعد RP وقياسها بثلاثة أبعاد (الطول والعرض والسمك). من المهم جدًا تقييم وزن العينة الإجمالية بعد التهاب البروستاتا، خاصةً مع تعليقات أخصائي علم الأمراض المتعلقة بتقييم مدى اكتمال استئصال غدة البروستاتا. نظرًا لأن البنكرياس له شكل غير منتظم ومتناظر فقط بالنسبة للمستوى السهمي، فإن الأبعاد الخطية للمستحضر تكون أقل دقة وقابلية للتكرار وقيمة من وزن المستحضر. يمكن تحديد حجم المستحضر تقريبًا من خلال الصيغة المستخدمة للتكوينات الدائرية:
نظرًا لأن سطح البنكرياس مغطى بنسيج ليفي عضلي، والذي لا يشكل حدودًا نسيجية منفصلة منفصلة بين الغدة والنسيج الضام خارج البروستاتا، فإن تقييم مدى خطورة العملية قد يكون أمرًا صعبًا للغاية لكل من الجراح وأخصائي علم الأمراض، مما أدى إلى لتطوير تقنية خاصة لتقييم هوامش استئصال البنكرياس. لتحديد حالة حواف استئصال العضو لاحقًا، يجب طلاء كامل سطح البنكرياس المزال وغير المثبت. إذا لم يتم ذلك، فلن يتمكن اختصاصي علم التشكل من التحديد في الشريحة الدقيقة ما إذا كان اكتشاف نمو الورم على طول الحافة يمثل هامشًا جراحيًا إيجابيًا أم أنه قطعة أثرية للقطع. ومن المستحيل أيضًا الحكم بشكل موثوق على وجود ورم عند هامش الاستئصال بناءً على فحص سطح العينة العيانية. يمكن استخدام الحبر الأسود لهذا الغرض، حيث يسهل التعرف على هوامش الاستئصال السوداء تحت الفحص المجهري. خيار آخر لتلوين سطح الغدة هو استخدام لونين مختلفين لكل جانب من المستحضر لتسهيل التوجيه اللاحق والتعرف على الجانبين الأيمن والأيسر. الألوان المستخدمة عادة هي الأخضر والأحمر (أو الأزرق). بعد طلاء السطح، يتم غمر المستحضر في محلول تثبيت، مثل محلول بوين أو حمض الأسيتيك، وبعد ذلك يتم تثبيت الحبر على سطح البنكرياس ولا يتم غسله أثناء الأسلاك.
قبل تقطيع البنكرياس إلى أجزاء، يوصى بتثبيته بالفورمالين، مما يضمن وجود أقسام أرق. لتقليل وقت التثبيت والاختراق الموحد للفورمالين في الغدة، يتم حقن محلول الفورمالين المحايد بنسبة 10٪ في المستحضر باستخدام إبرة رفيعة داخل الأدمة. الأساس المنطقي لهذه التقنية هو أنه مع الغمر المعتاد للغدة في محلول الفورمالين، فإن تغلغلها في سمك العضو يكون بطيئًا للغاية وغير متساوٍ؛ بالإضافة إلى ذلك، تتخثر البروتينات بالفورمالدهيد في أنسجة المنطقة المحيطية للبنكرياس. جعل مزيد من اختراق الحل صعبا.
بعد إدخال الإبرة في عمق أنسجة البنكرياس، يتم حقن محلول الفورمالين ببطء في الأنسجة بينما يتم سحب الإبرة ببطء. يتم إجراء هذه الحقن بشكل منتظم كل 0.5 سم على جميع جوانب المستحضر. في المجموع، يتم حقن حوالي 100 مل من المحلول في المستحضر، وبعد ذلك يتم غمر البنكرياس في 300 - 400 مل من محلول الفورمالين وتثبيته لمدة 24 ساعة.
بعد التثبيت، يتم تقطيع المستحضر إلى أجزاء منفصلة (الشكل 3). أولاً، تتم إزالة الحويصلات المنوية من التحضير الكلي. يتم فحص الحويصلات المنوية بعد تقطيعها من خلال مكان الدخول إلى البنكرياس (قاعدة الحويصلة المنوية). تقريبًا جميع حالات غزو الورم للحويصلات المنوية تصيب في البداية قاعدة الحويصلة المنوية. ينمو الورم إلى الحويصلات المنوية إما مباشرة من خلال قناة القذف أو بشكل ثانوي بسبب انتشار الورم خارج البنكرياس إلى النسيج الضام المحيط بالبروستات ثم إلى تجويف الحويصلة المنوية.
بعد إزالة الحويصلات المنوية بشقين عرضيين على مسافة 4 مم من الحواف البعيدة والدانية للبنكرياس، يتم قطع الأجزاء القمية والقاعدية من الغدة من العينة. يتم بعد ذلك تقطيع هذه المقاطع إلى قطع في اتجاه مجاور للسهمي بشكل عمودي على السطح المطلي على مسافة 4 مم كما هو موضح في الشكل. 3.
يتم قطع التحضير الكلي المتبقي بعد إزالة الأجزاء القمية والقاعدية من البنكرياس بالتتابع على فترات 4 مم عموديًا على المحور الطويل (القعدي) للبنكرياس. من المستحسن أن يتم تحديد هذه الأقسام من البنكرياس بأحرف أبجدية كبيرة متسلسلة، تبدأ دائمًا بالقسم الأكثر قميًا وتنتهي بالقسم القاعدي. يوصى بقطع هذه المقاطع عبر البنكرياس بأكمله بعد تضمينها في البارافين للفحص المجهري بنفس الطريقة، أي. عمودي على المحور الطويل (apico-basal) في جميع أنحاء سمك البنكرياس بأكمله. البديل لهذا التحضير للشرائح الدقيقة هو تقسيم الطبقات ذات الـ 4 مم إلى أرباع، والتي يتم ترقيمها بالأرقام العربية. بهذه الطريقة، تصبح غدة البروستاتا بأكملها متاحة للفحص النسيجي. إذا تم استخدام الحبر لتلطيخ سطح البنكرياس، فسيتم استخدام شق بمشرط في كل قسم على طول السطح الأمامي الوحشي للدواء على اليمين، وذلك لوضع علامة على الجانب الأيمن. بعد قطع المستحضر، يمكن أيضًا تثبيت الأجزاء في الفورمالديهايد لمدة 24 ساعة.
الأساس المنطقي للحاجة إلى تضمين البروستاتا بالكامل في البارافين هو أن تحديد موقع وانتشار الورم عن طريق الفحص المجهري للبروستاتا المقطوعة ليس ممكنًا دائمًا، خاصة في حالات سرطان البروستاتا التي يتم اكتشافها بالصدفة أو أثناء الفحص. دراسة نشرت مؤخرا من قبل ديساي وآخرون. يوضح أنه، بالمقارنة مع الطريقة التقليدية لإعداد شريحة مجهرية، فإن الحشو الكامل والقطع المتكرر لعينة كبيرة بعد RP يزيد من معدل اكتشاف الورم المنتشر خارج البنكرياس، ويؤدي إلى زيادة البقاء على قيد الحياة بدون انتكاسة في كل مرحلة من مراحل سرطان البروستاتا. .
يتم تجفيف الأجزاء الناتجة من البنكرياس تدريجيًا في كحولات مخففة، وتنقيتها في الزيلين، ومضمنة في البارافين، وتقطيعها إلى طبقات بسمك 5 ميكرون، وملطخة بالهيماتوكسيلين يوزين، وبعد ذلك يمكن فحصها تشريحيًا (الشكل 4). في هذه الحالة، يجب استخدام أشرطة صب وشرائح ذات أحجام خاصة. يجب ألا يقل طول الشرائح والأغطية عن 76 مم وعرضها 50 مم.
يعتمد الاختيار بين الحصول على أجزاء من العينة بأكملها أو فحص أرباعها على تفضيل الطبيب الشرعي، والذي يتأثر بسهولة وسهولة فحص المقاطع الكبيرة والمشاكل الفنية للحصول على عينات ذات حجم غير قياسي وتخزينها. والفرق الوحيد المهم في طريقة الحصول على الأدوية باستخدام هذين النهجين هو الحاجة إلى قطع أكثر سمكًا للبنكرياس بأكمله. بالإضافة إلى ذلك، عادةً ما يتطلب إجراء IHC المزيد من الكاشف ولا يمكن إجراؤه إلا يدويًا.
تقنية لدراسة التحضير الكلي بعد RP في حالة pT0
إذا لم يجد أخصائي علم الأمراض، عند فحص الشرائح المجهرية، سرطان البروستاتا، فمن المستحسن القيام بما يلي: إذا لم تكن البروستاتا مغروسة بالكامل في البارافين، فمن المستحسن القيام بذلك؛ إذا كان البنكرياس مضمنًا بالكامل في البارافين، فيجب مراجعة الشرائح الدقيقة بعد الخزعة لتقييم موقع الورم. من الضروري قطع أجزاء من الدواء بعد RP في هذه المنطقة بعد قلب الكتلة.
للكشف عن ما يسمى "الحد الأدنى من السرطان المتبقي"، خاصة في المرضى الذين تلقوا علاجًا هرمونيًا مساعدًا جديدًا قبل الجراحة، يمكن إجراء اختبار كيميائي مناعي باستخدام الأجسام المضادة لـ CAM 5،2.
استنتاج بشأن إعداد البروستاتا
يعد الاستنتاج الكامل والواضح من أخصائي علم الأمراض بشأن عينة البنكرياس التي تمت إزالتها أثناء RP أمرًا مهمًا للغاية لتطوير أساليب العلاج المثلى للمريض. يجب أن يحتوي الاستنتاج على معلومات مهمة سريريًا تم الحصول عليها على أساس الدراسات الكلية والمجهرية للدواء بعد RP. يجب أن يكون التركيز الأساسي على تقييم العوامل النذير المدرجة في الفئتين 1 و 2 من كلية علماء الأمراض الأمريكيين (الجدول 1). تشمل هذه العوامل ذات الأهمية النذير المثبتة والمستخدمة في علاج المريض نوع الورم النسيجي، ودرجة التمايز، وحجم السرطان، ودرجة الانتشار المحلي ومرحلة سرطان البروستاتا، بالإضافة إلى حالة هوامش الاستئصال. يمكن أيضًا استخدام العوامل البيولوجية والسريرية الأخرى المدروسة، والتي لم يتم تأكيد أهميتها النذير في دراسات كبيرة.
النوع النسيجي لسرطان البروستاتا.ويرد في الجدول التصنيف النسيجي لسرطان البروستاتا. 2. أكثر من 95% من جميع حالات سرطان البروستاتا لها البنية النموذجية للسرطان الغدي العنيبي. في السنوات الأخيرة، تم وصف العديد من المتغيرات النسيجية الجديدة وغير العادية للـ PCa. تمثل هذه المتغيرات مجموعة من التغييرات التي يمكن أن تحدث في السرطان الغدي ويجب الإشارة إليها في التقرير المورفولوجي إذا تم اكتشافها في العينة. بالإضافة إلى ذلك، هناك عدد من أورام البنكرياس، على سبيل المثال، الخلايا الانتقالية، الخلايا الحرشفية، القاعدية والسرطان الغداني، والتي يختلف سلوكها البيولوجي وطرق علاجها بشكل كبير عن سرطان البروستاتا النموذجي، مما يجعل التشخيص دقيقًا لنوع الورم. مهم للغاية لتحديد أساليب علاج المريض.
درجة التمايز (درجة الورم الخبيث).إن أهم مؤشر لتقدم PCa بعد RP هو درجة Gleason المحددة في التحضير بعد RP (الجدول 3). نظام غليسون هو الطريقة المفضلة لتحديد درجة الورم الخبيث للورم؛ لا يوصى باستخدام المصطلحات "جيد التمايز" و"متباين بشكل معتدل" و"ضعيف التمايز" لتحديد درجة الورم الخبيث للـ PCa. تتكون درجة غليسون من عنصرين: درجة غليسون الأولية (الأكثر شيوعًا) والثانوية (الثانية الأكثر شيوعًا). إذا لم تكشف العينة عن درجة غليسون الثانوية، فسيتم مضاعفة درجة غليسون الأولية للحصول على درجة غليسون. يجب الإشارة إلى درجات غليسون الابتدائية والثانوية بين قوسين بعد درجة غليسون (على سبيل المثال: درجة غليسون 7 (3 + 4)). لتجميع مجموع غليسون في فئات لغرض تلخيص نتائج العلاج، وما إلى ذلك، يوصى بالتجميع التالي (الجدول 4): 2-5، 6، 7، 8-10، أو 2-6، 7، 8-10 .
إذا تم تحديد اثنين أو أكثر من الأورام المميزة في عينة RP، فقد يتم الإبلاغ عن مجموع غليسون لكل ورم، أو يجب الإبلاغ عن درجة غليسون للورم الأكثر أهمية. على سبيل المثال، إذا كان هناك ورم كبير في المنطقة الانتقالية للبنكرياس بدرجة غليسون 5 وورم منفصل أصغر في المنطقة المحيطية بدرجة غليسون 7، فإن كلا من درجات غليسون أو على الأقل درجة غليسون من ينبغي الإبلاغ عن الورم الأخير، بدلا من متوسط درجة غليسون.
نظرًا للكمية الأكبر من الورم في العينة بعد RP المتاح للبحث (على عكس مادة الخزعة)، فمن الممكن غالبًا اكتشاف أكثر من درجتين من غليسون في الورم، أي. هناك درجة جليسون من الدرجة الثالثة. نظرًا لأن نظام غليسون الأصلي يأخذ في الاعتبار فقط درجات غليسون الأولية والثانوية، فهناك جدل في النهج المتبع في تصنيف الأورام باستخدام درجات غليسون من الدرجة الثالثة، على الرغم من أن وجود درجة غليسون من الدرجة الثالثة يؤثر على التشخيص. وبالتالي، فإن معدل تطور PCA مع درجة غليسون من 5 إلى 6 والدرجة الثالثة 4 هو تقريبًا نفس معدل تطور الأورام ذات درجة غليسون 7. وفي المقابل، الأورام ذات درجة غليسون 7 والدرجة الثالثة من 5 تتصرف مثل الأورام بدرجة غليسون 8. C من ناحية أخرى، لم يتم ملاحظة مثل هذه الاختلافات في PCa بدرجة غليسون 8 ودرجة التعليم العالي 5، ويرجع ذلك على ما يبدو إلى قلة عدد المرضى الذين يعانون من هذه الحالة المرضية، بالإضافة إلى مثل هذا التشخيص غير المواتي لـ PCa بدرجة غليسون 8 بحيث لا يمكن أن يؤدي وجود درجة التعليم العالي 5 إلى تفاقمها بشكل كبير.
مسألة أخرى مثيرة للجدل في تحديد درجة الورم الخبيث هي مسألة تحديد مجموع غليسون في الأورام التي تتكون من 95% من نفس نوع غليسون، والتي لا يوجد فيها سوى كمية صغيرة من الورم من الدرجة الأدنى. على سبيل المثال، ورم البنكرياس الذي يحتوي على > 95% من أنسجة الورم مع درجة غليسون 3 و< 5% с показателем 4, некоторые эксперты оценили бы как имеющую сумму Глисона 3 + 3 = 6, поскольку эти специалисты считают, что для учета показателя Глисона в сумме, участок опухоли с этим показателем должен занимать более 5% от всего объема опухоли. Другие морфологи при такой опухоли установили бы сумму Глисона 3 + 4 = 7, поскольку известно, что присутствие более низкодифференцированного компонента, даже если он занимает менее 5% от объема опухоли, имеет существенное негативное влияние на течение опухолевого процесса.
بالإضافة إلى درجة غليسون، يمكن استخدام أنظمة تصنيف أخرى، مثل نظام منظمة الصحة العالمية أو نظام إم دي أندرسون، ولكن يجب تحديد درجة غليسون للسماح بمقارنة البيانات السريرية أو نتائج العلاج. إذا تلقى المرضى علاجًا هرمونيًا قبل الجراحة، فلا يمكن استخدام نظام جليسون، وكذلك نظامي منظمة الصحة العالمية وإم دي أندرسون. في هذه الحالات، يجب على علماء الأمراض الإشارة إلى درجة تراجع الورم.
درجة الانتشار المحلي.تشمل هذه الفئة امتداد الورم إلى ما بعد المحفظة (الشكل 2) وتورط الحويصلات المنوية. ترجع المشاكل في تحديد نمو الورم خارج العضو إلى حقيقة أن كبسولة البنكرياس كبنية تشريحية لا يتم تعريفها بشكل واضح دائمًا. في بعض المناطق على طول حافة البنكرياس، قد يتم اكتشاف طبقة من الأنسجة الليفية أو العضلية الليفية، على الرغم من أنه في مناطق أخرى على طول حافة العضو، يتم اكتشاف غدد بنكرياسية عادية دون وجود واضح للمحفظة. ولهذا السبب، تم استبدال مصطلح "اختراق المحفظة" بمصطلح "الامتداد خارج البروستاتا" (EPE). يتم تحديد انتشار الورم خارج البروستاتا إذا تم اكتشاف اتصال الورم بالأنسجة الدهنية. أيضًا، يمكن تحديد انتشار سرطان البروستاتا خارج العضو في حالة إصابة المساحات المحيطة بالعصبية للحزمة الوعائية العصبية، حتى في حالة عدم غزو الورم للأنسجة الدهنية المحيطة بالبروستات.
هناك صعوبات في تقييم انتشار الورم خارج البروستاتا في وجود تفاعل كثيف لإزالة النسيج الضام من النسيج الضام المحيط بالبروستاتا استجابةً لغزو PCa فيه. غالبًا ما يتم ملاحظة هذا التفاعل أثناء العلاج الهرموني المساعد الجديد قبل الجراحة. ولهذا السبب، قد يكون من الصعب التمييز بين انتشار الورم خارج البنكرياس ونمو الورم داخل الأنسجة الليفية للبنكرياس. لحل هذه المشكلة، يوصى باستخدام مجهر منخفض التكبير للعثور على حافة البنكرياس في منطقة مجاورة حيث لا يوجد ورم، وتتبع حافة الغدة إلى موقع النمو المفترض للمحفظة. إن امتداد سرطان البروستاتا إلى ما هو أبعد من المحيط المستدير للبنكرياس سيشير إلى انتشار خارج البروستاتا.
في بعض المناطق، مثل عنق المثانة أو المنطقة الأمامية من البنكرياس، يوجد القليل من الأنسجة الدهنية المحيطة بالبروستات أو لا يوجد أي منها على الإطلاق. في هذه المناطق، يوصى بإثبات وجود ورم منتشر خارج البروستاتا في حالة انتشار سرطان البروستاتا خارج حدود البنكرياس الغدي الطبيعي. في منطقة قمة البنكرياس، لا يكون اكتشاف الورم بين العضلات المخططة بمثابة أساس لانتشار سرطان البروستاتا خارج البروستاتا.
يمكن أن يختلف مدى انتشار الورم خارج البنكرياس من وجود عدة غدد خارج البنكرياس، إلى الحالات التي ينتشر فيها بشكل كبير خارج الكبسولة. كمية الانتشار خارج البروستاتا لها أهمية إنذارية. هناك طرق مختلفة لقياس انتشار الورم خارج البروستاتا. إذا كان يساوي أو أقل من مجالي رؤية عند تكبير المجهر العالي (40×)، فإن الانتشار خارج البروستاتا يعتبر "بؤريًا". يعتبر الامتداد خارج الكبسولة على أكثر من مجالي رؤية بتكبير مجهر عالي (40×) "واسع النطاق".
مرحلة سرطان البروستاتا.حاليًا، لتحديد مرحلة سرطان البروستاتا، يوصى باستخدام تصنيف TNM الخاص بالاتحاد الدولي لمكافحة السرطان (UICC) واللجنة الأمريكية المشتركة لمكافحة السرطان (AJCC) بصيغته المعدلة في عام 2002. ويستخدم التصنيف السريري (cTNM) في الفحص الأولي للمريض قبل العلاج أو إذا كان استخدام التصنيف المرضي غير ممكن. يعتمد التصنيف المرضي لـ TNM (pTNM) على نتائج الفحص الكلي والمجهري. عند استخدامها، تكون مسبوقة بـ "p". وبالتالي، لاستخدام فئة pT، يلزم إزالة الورم الرئيسي أو إجراء خزعة لتحديد أعلى فئة pT. لاستخدام رمز pN، من الضروري إزالة العقد الليمفاوية الإقليمية، ويعني pM التحقق من النقائل البعيدة.
إذا تم استخدام العلاج قبل الجراحة (العلاج المساعد الجديد) قبل تحديد المرحلة، بغض النظر عن النوع (الإشعاع، العلاج الكيميائي، العلاج الهرموني بشكل فردي أو مجتمع)، يتم استخدام البادئة "y" عند تقييم مدى الورم باستخدام نظام TNM.
هامش جراحي إيجابي.مرضى RP ذوي الهوامش الجراحية الإيجابية لديهم خطر أعلى بكثير لتطور السرطان مقارنة بالمرضى ذوي الهوامش الجراحية السلبية. تم وصف سببين رئيسيين للهوامش الإيجابية (الشكل 5):
— أسباب غير علاجية:ويلاحظ وجود هامش إيجابي بسبب استحالة الاستئصال الواسع للمكون خارج البروستاتا من ورم البنكرياس أثناء العملية.
— شق المحفظة (سبب علاجي المنشأ):سبب الهامش الإيجابي هو تشريح الورم الموجود داخل غدة البروستاتا (أي شق المحفظة). يشار إلى مثل هذه الحالات بالمرحلة المرضية T2X. وهذا يعني أنه على الرغم من اكتشاف الورم داخل العضو فقط، فإنه من المستحيل تحديد ما إذا كان سرطان البروستاتا قد انتشر خارج الكبسولة في منطقة شق الكبسولة، حيث أن حافة سرطان البروستاتا تبقى في جسم المريض.
يتم تعيين الهامش الجراحي على أنه "سلبي" إذا لم يتم اكتشاف أي ورم على طول الحافة الملونة للعينة، و"إيجابي" إذا كان الورم على اتصال بالحافة الملونة للبنكرياس. لا ينبغي تفسير وجود هامش جراحي إيجابي على أنه امتداد للورم خارج البروستاتا. من الضروري أيضًا أن نتذكر إمكانية وجود هوامش استئصال إيجابية كاذبة بسبب اختراق الدواء من خلال الشقوق أو الشقوق الموجودة على سطح البنكرياس. في الختام، من الضروري الإشارة إلى توطين الحافة الإيجابية، فضلا عن انتشارها (أي عدد الكتل الإيجابية، الحجم الخطي للحافة بالملليمتر). بسبب الكشف المتكرر عن هامش إيجابي في قمة البنكرياس، يجب فحص هذا الجزء باهتمام خاص.
يمكن أن تحدث التناقضات الرئيسية بين علماء الأمراض في تحديد الهوامش الإيجابية في حالتين. تحدث الحالة الأولى عندما يكون الورم قريبًا جدًا من الحافة، لكنه لا يمس الحافة الملونة للبنكرياس تمامًا. في الحالة الثانية، قد تحدث أخطاء إذا كان لون الحافة شاحبًا جدًا.
هناك خلاف في تعريف الفئة T في الحالات التي يكون فيها الورم يشمل قاعدة البنكرياس أو عنق المثانة وتوجد هوامش موجبة في هذه المنطقة. وتنشأ هذه المشكلة بسبب عدم وجود حدود واضحة بين سدى قاعدة البنكرياس وعضلات عنق المثانة، ففي كثير من الأحيان تبرز الغدد وتختلط مع العضلات الملساء للمثانة، لذلك يصعب للغاية تحديد موقع انتقال قاعدة البنكرياس إلى عنق المثانة. يحدد عدد من المتخصصين المشاركة المجهرية لعضلات عنق المثانة في التحضير بعد RP على أنها pT4. يعتقد علماء الأمراض الآخرون أن الآفات المجهرية للعضلات الملساء في عنق المثانة لا ينبغي اعتبارها pT4، لأن الأخير يجب أن يشير فقط إلى الآفات العيانية في عنق المثانة.
لتصنيف الورم المتبقي في جسم المريض، يتم استخدام نظام R (الجدول 5). يمكن استخدام هذا التصنيف من قبل الجراح للإشارة إلى درجة خطورة العملية ومن قبل أخصائي علم الأمراض بناءً على دراسة هوامش الاستئصال. في المرضى الذين يعانون من ورم يمكن اكتشافه على هامش الاستئصال أثناء الفحص الكلي أو المجهري، يمكن استخدام الرموز R1 أو R2.
يجب أن يعكس استنتاج الطبيب الشرعي وجود أنسجة البنكرياس الطبيعية على حافة استئصال العضو. قد يساعد هذا في تفسير سبب وجود مستوى PSA يمكن اكتشافه بعد RP. في هذه الحالة، لا يرتبط مستوى PSA القابل للاكتشاف بعد الجراحة بسرطان البروستاتا المتكرر أو وجود ورم متبقي، ولكنه يحدث بسبب الاستئصال غير الكامل لأنسجة البنكرياس.
حجم سرطان البروستاتا.واحدة من القضايا الأكثر إثارة للجدل هي قياس حجم الورم في عينة بعد RP. ويرجع ذلك إلى إمكانية مناقشة الأهمية النذير المستقلة لهذا المؤشر. ومع ذلك، هناك حالة واحدة فقط حيث يكون تقييم حجم الورم مهمًا لتحديد تشخيص المريض. لأنه مع استخدام الفحص المكثف من الممكن التعرف على ما يسمى ب. PCa "ضئيل" ، والذي يتم تعريفه بحجم الورم أقل من 0.5 سم 3 ، يعتبر تشخيص مثل هذا PCa مناسبًا للغاية ، بغض النظر عن طريقة العلاج. وبالتالي، إذا أشار الطبيب الشرعي إلى أن حجم الورم في العينة بعد RP أقل من 0.5 سم 3، فإن احتمال الشفاء في هذه الحالة يكون 100٪ تقريبًا.
لا توجد حاليًا طريقة قياسية لتقييم حجم الورم. يتم تحديد الحجم الأكثر دقة باستخدام قياس التخطيط أو استخدام تراكب الشبكة على عينة مجهرية. إلا أن هذه الأساليب تتطلب الكثير من الوقت والجهد، مما يجعل استخدامها في هذه الحالة غير مبرر. يوصى حاليًا بأنه من الضروري على الأقل تقدير نسبة (نسبة) أنسجة البنكرياس المتضررة من الورم.
غزو الأوعية الدموية.وفقًا لنظام التدريج AJCC/UICC، لا يساهم غزو الأوعية الدموية (اللمفاوي أو الوريدي) في تعريف فئة T. وبالتالي، عند اكتشاف غزو الأوعية الدموية، يجب وضع علامة عليه بشكل منفصل. وبما أن وجود غزو الأوعية الدموية يحدث عادة في الأورام المتقدمة، فإن القيمة النذير المستقلة لهذا المؤشر لم يتم تأكيدها بدقة بعد.
الغزو العجاني.يعد الغزو حول العصب أحد الآليات الرئيسية لانتشار الورم خارج البنكرياس. يعد الغزو حول العصب شائعًا جدًا في الاستعدادات بعد الإصابة بالـ RP، لذلك لا يعتبر العديد من المتخصصين هذا مؤشرًا إنذاريًا ولا يشيرون إليه في الاستنتاج.
خاتمة
في السنوات الأخيرة، تم بذل الكثير من الجهود لتحسين وتوحيد التقييم المرضي للعينات بعد RP، مما أدى إلى توسيع قدرة الفحص المجهري الضوئي القياسي لتحديد العوامل النذير في المرضى الذين يعانون من RP. اليوم، واستنادا إلى هذه التقنية القياسية، من الممكن بدرجة عالية من الاحتمال التنبؤ بمسار عملية الورم لدى مريض معين. تتمثل مهمة علماء الأمراض البيلاروسية في المرحلة الحالية في إتقان سنوات عديدة من الخبرة العالمية، والهدف النهائي منها هو تحسين نتائج علاج مرضى سرطان البروستاتا.
الأدب
- الأورام الخبيثة في بيلاروسيا 1996-2005 / س.م. بولياكوف، ل.ف. ليفين، ن.ج. شيبيكو؛ حررت بواسطة أ.أ. جراكوفيتش ، آي.في. زالوتسكي.- مينيسوتا: BelTsMT، 2006.- 194 ص.
- ستامي تي إيه، يموتو سي إم، ماكنيل جي إي، سيجال بي إم، جونستون آي إم سرطان البروستاتا يمكن التنبؤ به إلى حد كبير: معادلة تشخيصية تعتمد على جميع المتغيرات المورفولوجية في عينات استئصال البروستاتا الجذري // J. Urol.- 2000.- المجلد. 163.- ص1155-1160.
- Montironi R.، van der Kwast T، Boccon-Gibod L.، Bono A.V.، Boccon-Gibod L. التعامل مع تقارير علم الأمراض لعينات استئصال البروستاتا الجذري // يورو. أورول.- 2003.- المجلد. 44.- ص626-636.
- ماكنيل ج.إي. أصل وتطور سرطان البروستاتا // السرطان.- 1969.- المجلد. 23.- ص24-34.
- بوستويك دي جي، فوستر سي إس، ألجابا إف، هوتر آر في بي، مونتيروني آر، موستوفي إف كيه، وآخرون. عوامل أنسجة البروستاتا. في: ميرفي جي، دينيس إل، خوري إس، بارتين أ، دينيس إل، المحررون. سرطان البروستات. المشاورة الدولية الثانية بشأن سرطان البروستاتا، برعاية مشتركة من منظمة الصحة العالمية والاتحاد الدولي لمكافحة السرطان. لندن: شركة بليمبريدج للتوزيع المحدودة؛ 2000
- بوستويك دي جي، جرينيون دي جي، هاموند إي إتش، أمين إم بي، كوهين إم، كروفورد دي، وآخرون. العوامل النذير في سرطان البروستاتا. بيان إجماع كلية علماء الأمراض الأمريكيين 1999 // آرتش. باثول. مختبر. الطب- 2000.- المجلد. 124.- ص 995-1000.
- ليتروب بي.جي.، ويليام سي.آر.، إيجلين تي.ك.، كين آر.إيه. تحديد حجم البروستاتا عبر المستقيم لفحص السرطان. ثانيا. دقة التقنيات المختبرية والحيوية // الأشعة.- 1991.- المجلد. 179.- ص49-53.
- Mazzucchelli R.، Santinelli A.، Lopez-Beltran A.، Scarpelli M.، Montironi R. تقييم العوامل النذير في عينات استئصال البروستاتا الجذري مع السرطان // Urol. إنت.- 2002.- المجلد. 68.- ص209-215.
- Hoedemaeker R.F.، Ruijter E.T.G.، Ruizeveld-de Winter J.A.، van der Kaa C.A.، مجموعة دراسة BIOMED II MPC، van der Kwast T.H. تجهيز عينات استئصال البروستاتا الجذري. بروتوكول شامل وموحد // J. Urol. باثول.- 1998.- المجلد. 9.- ص211-222.
- أوهوري إم، سكاردينو بي تي، لابين إس إل، سيل هوكينز سي، لينك جيه، ويلر تي إم. الآليات والأهمية النذير لتورط الحويصلة المنوية بسرطان البروستاتا // صباحا. جيه سورج. باثول.- 1993.- المجلد. 17.- ص1252-1261.
- Stamey T.A., McNeal J.E., Freiha F.S., Redwine E. الدراسات المورفومترية والسريرية على 68 عملية استئصال البروستاتا الجذرية على التوالي // J. Urol.- 1988.- المجلد. 139.- ص1235-1241.
- ديساي أ.، وو إتش.، دون إل.، سيسترهين آي.إي.، موستوفي إف كيه، ماكليود دي، وآخرون. يؤدي التضمين الكامل والتقسيم التدريجي لعينات استئصال البروستاتا الجذري إلى زيادة اكتشاف الامتداد خارج البروستاتا، ويرتبط بزيادة البقاء على قيد الحياة بدون مرض حسب مرحلة مرضى سرطان البروستاتا // سرطان البروستاتا أمراض البروستاتا.- 2002.- المجلد. 5.- ص212-218.
- Bostwick D.G.، Montironi R. تقييم عينات استئصال البروستاتا الجذري: أهمية علاجية ونذير // Virchows Arch.- 1997.- Vol. 430.- ص1-16.
- مونتيروني آر، شولمان سي.سي. التغيرات المرضية في آفات البروستاتا بعد التلاعب بالأندروجين // J. كلين. باثول.- 1998.- المجلد. 51.- ص5-12.
- سريجلي جي آر، أمين إم بي، همفري بي إيه غدة البروستاتا: ملخص حالة السرطان الباثولوجي الجراحي، والوثائق الأساسية والملاحظات التوضيحية. تمت الموافقة عليه من كلية علماء الأمراض الأمريكية. ftp://ftp.cap.org/cancerprotocols/prostate05p.doc.
- جليسون دي آر، ميلينجر جي تي، مجموعة أبحاث المسالك البولية التعاونية التابعة لإدارة المحاربين القدامى. التنبؤ بتشخيص سرطان البروستاتا الغدي عن طريق الجمع بين الدرجات النسيجية والتدريج السريري // J. Urol.- 1974.- المجلد. 111.- ص58-64.
- جليسون دي إف. الدرجات النسيجية لسرطان البروستاتا: منظور // همهمة. باثول.- 1992.- المجلد. 23.- ص273-279.
- بوستويك دي جي. تصنيف جليسون لخزعات إبرة البروستاتا: الارتباط مع الدرجة في 316 عملية استئصال البروستاتا المتطابقة // صباحا. جيه سورج. باثول.- 1994.- المجلد. 18.- ص796-803.
- بارتين إيه دبليو، قطان إم دبليو، سوبونج إي إن بي، وآخرون. مزيج من مستضد البروستاتا النوعي، والمرحلة السريرية، ودرجة جليسون للتنبؤ بالمرحلة المرضية لسرطان البروستاتا الموضعي: تحديث متعدد المؤسسات // JAMA.- 1997.- المجلد. 277.- ص1445-1451.
- فيس إيه إن، هويديماكر آر إف، فان دير كواست تي إتش، شرودر إف إتش. تحديد نافذة فرصة الورم في فحص سرطان البروستاتا: التحقق من صحة نموذج التصنيف التنبؤي // البروستاتا.- 2001.- المجلد. 46.- ص154-162.
- مونتيروني ر.، بارتلز بي إتش، طومسون د.، وآخرون. سرطان غدي البروستاتا المحروم من الأندروجين: تقييم التغيرات المرتبطة بالعلاج مقابل عدم وجود تأثير علاجي مميز مع شبكة المعتقدات البايزية // يورو. أورول.- 1996.- المجلد. 30.- ص307-315.
- جرينيون دي جي، صقر و.أ. التدريج المرضي لسرطان البروستاتا. ما هي القضايا // السرطان.- 1996.- المجلد. 78.- ص337-340.
- سوبين إل إتش، ويتكايند سي، محرران. تصنيف TNM للأورام الخبيثة: الاتحاد الدولي لمكافحة السرطان. الطبعة السادسة. نيويورك: وايلي ليس؛ 2002.
- صقر دبليو إيه، ويلر تي إم، بلوت إم، وآخرون. التدريج والإبلاغ عن سرطان البروستاتا . أخذ عينة من عينة استئصال البروستاتا الجذري // السرطان.- 1996.- المجلد. 78.- ص366-369.
- إبستين جي. تقييم عينات استئصال البروستاتا الجذري: الآثار العلاجية والنذير // Pathol. أنو.- 1991.- المجلد. 26.- ص159-210.
- Hoedemaeker R.F.، Vis A.N.، van der Kwast T.H. تنظيم سرطان البروستاتا // Microsc. الدقة. تقنية.- 2000.- المجلد. 51.- ص423-429.
- صحيح إل دي. الفحص الباثولوجي الجراحي لغدة البروستاتا. مسح الممارسة من قبل الجمعية الأمريكية لعلماء الأمراض السريرية // صباحا. جيه كلين. باثول.- 1994.- المجلد. 102.- ص572-579.
طاولة 1. توزيع العوامل النذير حسب أهميتها (وفقا لإجماع كلية علماء الأمراض الأمريكية 1999).
| الفئة 1. العوامل ذات الأهمية النذير المؤكدة، والتي تؤخذ في الاعتبار عند علاج المرضى: |
|
|
|
|
| الفئة 2. العوامل التي تمت دراستها بيولوجيًا وسريريًا ولكن لم يتم إثبات أهميتها في الدراسات المصممة جيدًا: |
|
|
|
|
| الفئة 3. عوامل أخرى لم تتم دراستها بشكل كافٍ لإثبات قيمتها النذير: |
|
|
|
|
|
|
|
طاولة 2. التصنيف النسيجي لأورام البنكرياس
| 1. سرطان غدي (نموذجي، غير محدد خلاف ذلك) |
| 2. أنواع معينة من السرطان الغدي وأنواع السرطان الأخرى: |
|
|
|
|
|
|
|
|
|
|
|
طاولة 3. درجة جليسون.
طاولة 4. تجميع مبالغ غليسون في فئات النذير.
طاولة 5. تصنيف الورم المتبقي (المتبقي).

أرز. 1. ديناميكيات تكرار تنفيذ RP في مؤسسة الدولة "معهد أبحاث OMR الذي يحمل اسم. ن.ن. الكسندروفا


أرز. 3. طريقة تجهيز وتقطيع الدواء بعد الإصابة بمرض RP
I. المعيار المطلق– تأثير الورم على عمل الكائن الحي ككل (تتجلى هذه الخاصية في تعريف الأورام الحميدة والخبيثة).
ثانيا. المعايير النسبية:
1. نمط نمو الورم(الأورام الحميدة عادة ما تنمو على نطاق واسع، والأورام الخبيثة، كقاعدة عامة، تنمو بشكل غازي). تنمو بعض الأورام الحميدة بشكل غزوي (مثل الورم الليفي)، وتنمو بعض الأورام الخبيثة بشكل توسعي (مثل بعض الأورام الناضجة داخل الجمجمة). إذا تسبب النمو الغزوي البطيء للورم الحميد الناضج في تدمير الأنسجة الطبيعية المجاورة، فسيتم تسمية هذا الورم ورم حميد مع نمو مدمر محليا(على سبيل المثال، الورم الأرومي النخاعي).
2. ورم خبيث(الأورام الحميدة، كقاعدة عامة، لا تنتشر؛ الأورام الخبيثة، كقاعدة عامة، تنتشر). يمكن لبعض الأورام الحميدة أن تنتشر (ورم عضلي أملس الرحم ينتقل أحيانًا إلى الرئتين، الشامات المصطبغة - إلى العقد الليمفاوية الإقليمية)، في حين أن بعض الأورام الخبيثة لا تنتشر (تسمى هذه الأورام الأورام الخبيثة مع النمو المدمر محلياعلى سبيل المثال، سرطان الخلايا القاعدية في الجلد).
3. نضج الورم(الأورام الحميدة عادة ما تكون ناضجة، والأورام الخبيثة عادة ما تكون غير ناضجة). ومع ذلك، فإن بعض الأورام الحميدة تكون غير ناضجة، على سبيل المثال، تتشكل الوحمة اليافعة (التي كانت تسمى سابقًا الورم الميلانيني اليافعي) بواسطة خلايا صبغية غير ناضجة مع علامات عدم النمطية الخلوية الواضحة. على العكس من ذلك، فإن عددًا من الأورام الخبيثة لها بنية ناضجة (وبالتالي، فإن جميع الأورام الناضجة في تجويف الجمجمة، التي تصل إلى حجم معين، تصبح خبيثة).
مسببات الأورام الخبيثة
السبب الشائع للنمو الخبيث هو قصور نظام مقاومة الورم الأرومي(نظام الدفاع المضاد للأورام)، وعناصره الرئيسية هي إنزيمات إصلاح الحمض النووي، والجينات المضادة (على سبيل المثال، p53) والخلايا القاتلة الطبيعية (الخلايا القاتلة الطبيعية). يحدث قصور نظام المقاومة المضاد للورم الأرومي بسبب التعرض الشديد للمواد المسرطنة، وحالات نقص المناعة، ونقص إنزيمات إصلاح الحمض النووي ووظيفة الجينات المضادة، بالإضافة إلى ضغط الأنسجة الندبية ("السرطان في الندبة").
آثار مسرطنة شديدة. هناك متغيرات مؤلمة، حرارية، إشعاعية، كيميائية وفيروسية للتسرطن.
1. التسرطن المؤلم– تطور ورم خبيث في مكان الإصابة (على سبيل المثال، إصابة مزمنة في الحدود الحمراء للشفاه يمكن أن تؤدي إلى تطور السرطان).
2. التسرطن الحراري– تطور ورم خبيث في أماكن التعرض لجرعات طويلة لدرجات حرارة عالية (في أماكن الحروق، على سبيل المثال، سرطان الغشاء المخاطي للفم والمريء لدى محبي الطعام الساخن).
3. التسرطن الإشعاعي– تطور ورم خبيث غير ناضج عند التعرض للإشعاع المؤين أو غير المؤين بجرعة مسرطنة. المادة المسرطنة الطبيعية الرئيسية للأشخاص من السباقات القوقازية والمنغولية هي الأشعة فوق البنفسجية الشمسية، وبالتالي فإن عادة حمامات الشمس في الشمس تساهم في تطوير أورام الجلد الخبيثة.
4. التسرطن الكيميائي– تطور الأورام الخبيثة غير الناضجة تحت تأثير المواد الكيميائية المسرطنة (المواد المسرطنة). من خارجيالمواد الكيميائية المسرطنة، تلعب المواد المسرطنة الناتجة عن دخان التبغ الدور الرئيسي، وهي السبب الرئيسي لتطور سرطان الرئة وسرطان الحنجرة. ضمن ذاتية النموتعتبر المواد الكيميائية المسرطنة وهرمونات الاستروجين (التي تؤدي مستوياتها العالية إلى الإصابة بسرطان الثدي والمبيض وبطانة الرحم) ومستقلبات الكوليسترول المسببة للسرطان، والتي تتشكل في القولون تحت تأثير الكائنات الحية الدقيقة وتساهم في تطور سرطان القولون، من العوامل المهمة.
5. التسرطن الفيروسي– تحريض الأورام الخبيثة عن طريق الفيروسات (الفيروسات المسرطنة). فقط تلك الفيروسات التي تسبب الأورام الخبيثة للخلية بشكل مباشر عن طريق إدخال الجينات المسرطنة (الجينات المسرطنة الفيروسية) في جينومها تسمى جينية. تساهم بعض الفيروسات في تطور الأورام الخبيثة بشكل غير مباشر، مما يسبب العملية المرضية الخلفية (على سبيل المثال، فيروسات التهاب الكبد B، C، D، على الرغم من أنها ليست مسرطنة، تساهم في تطور سرطان الكبد، مما يسبب تليف الكبد). أهم فيروسات الأورام البشرية هي فيروس بسيط(فيروس الهربس البسيط) النوع الثانيمن عائلة Herpesviridae (يسبب سرطان عنق الرحم، وسرطان القضيب، وربما عددًا من الأورام الأخرى)؛ فيروس الهربس من النوع الثامن (يؤدي إلى تطور ساركوما كابوزي)؛ فيروس الورم الحليمي البشريمن عائلة الفيروسات البابوية (يسبب سرطان عنق الرحم وسرطان الجلد)؛ فيروس إبشتاين-بار من عائلة الفيروسات الهربسية (يسبب أورامًا خبيثة بشكل رئيسي في البلدان ذات المناخ الحار - سرطان الغدد الليمفاوية/سرطان الدم في بوركيت، الأكثر شيوعًا في أفريقيا، وسرطان البلعوم الأنفي في جنوب شرق آسيا وربما أورام أخرى).
تسمى فيروسات RNA المسرطنة فيروسات الورم السرطاني. هناك فيروسان من عائلة الفيروسات القهقرية يعتبران مسببين للسرطان بالنسبة للبشر: HTLV-I وHTLV-II. يشير الاختصار HTLV إلى الفيروس البشري (H) T-lymphotropic (TL) (V). يسبب HTLV-I سرطان الدم في الخلايا التائية وسرطان الغدد الليمفاوية في الخلايا التائية البالغة (سرطان الدم في الخلايا التائية / سرطان الغدد الليمفاوية عند البالغين)؛ HTLV-II – سرطان الدم مشعر الخلايا.
"السرطان في الكرش."في البشر، الأشكال الأكثر شيوعا من "سرطان الكرش" هي السرطان الذي يتطور في تقرحات الجلد الغذائية، وسرطان الرئة المحيطي، والسرطان الناجم عن قرحة المعدة والاثني عشر المزمنة، وسرطان الكبد الأولي على خلفية تليف الكبد.
التسبب في المرض والتشكل والمسارات
تطور الأورام الخبيثة
هناك أربع مراحل رئيسية لتطور الأورام الخبيثة غير الناضجة: مراحل الورم الخبيث، والورم ما قبل الغزو، والغزو والانتشار.
1. مرحلة الورم الخبيث– تحول الخلية الطبيعية إلى خلية خبيثة (في المرحلة الأولى، مرحلة البدء، تحدث طفرة جسدية، ونتيجة لذلك تظهر الجينات المسرطنة في جينوم الخلايا الخبيثة؛ في المرحلة الثانية، مرحلة الترويج، والانتشار تبدأ الخلايا التي بدأت). الجينات المسرطنة (onc) هي أي جينات تسبب بشكل مباشر تحول الخلية الطبيعية إلى خلية خبيثة أو تساهم في هذا التحول. تنقسم الجينات المسرطنة، اعتمادًا على أصلها، إلى مجموعتين: الجينات المسرطنة الخلوية (c-onc) والجينات المسرطنة الفيروسية (v-onc). تتشكل الجينات المسرطنة الخلوية من جينات الخلايا الطبيعية، والتي تسمى الجينات الورمية الأولية. أحد الأمثلة النموذجية للجين الورمي الخلوي هو جين البروتين p53 - يلعب جين p53 الطبيعي ("البري") دور أحد الجينات المضادة النشطة؛ تؤدي طفرته إلى تكوين الجين الورمي (الجين p53 "المتحول"). تسمى منتجات التعبير الجيني الورمي بالبروتينات الورمية (البروتينات الورمية).
2. مرحلة ما قبل الورم– حالة الورم الخبيث غير الناضج قبل بداية الغزو (في حالة السرطان، تم استخدام مصطلح سرطان في الموقع لهذه المرحلة).
3. مرحلة الإصابة– النمو الغازية للورم الخبيث.
4. مرحلة ورم خبيث.
تشكل الأورام الخبيثة. 1. تطور الورم من جديد (تطور "يشبه القفزة")، دون تغيرات سابقة واضحة في الورم. 2. التسرطن المرحلي - تطور الورم في موقع التغيرات السابقة للورم (في حالة السرطان، يستخدم المصطلح للإشارة إلى التغيرات السابقة للورم مسرطن).
هناك نوعان من حالات ما قبل التسرطن: 1. إلزام ما قبل التسرطن– مرحلة ما قبل السرطان، والتي تتحول عاجلاً أم آجلاً بالضرورة إلى سرطان (على سبيل المثال، تغيرات الجلد في جفاف الجلد المصطبغ)، 2. مُسرطن اختياري- مرحلة ما قبل التسرطن، والتي لا تتحول بالضرورة إلى سرطان (على سبيل المثال، الطلاوة).
مسارات تطور الأورام الخبيثة. 1. تطور الورم– تعزيز إمكاناتها الخبيثة مع مرور الوقت. 2. تراجع الورم(ظاهرة نادرة) – اختفاء الورم بشكل عفوي (بدون علاج).
الأورام الظهارية
من بين الأورام الظهارية، يتم التمييز بين الأورام الناضجة (الحميدة عادة) وغير الناضجة (الخبيثة). تشمل الأورام الظهارية الناضجة في المقام الأول الورم الحميدو الورم الحليمييشار إلى الأورام الظهارية غير الناضجة بالمصطلح العام سرطان (سرطان). المصطلح الروسي "السرطان" ليس ناجحا، لأنه يتم استخدامه للإشارة إلى كل من الأورام الخبيثة (في التسمية الدولية يستخدم المصطلح لهذا الغرض) سرطان) ، والأورام الظهارية الخبيثة (السرطان).
الورم الحميد- ورم ناضج يتطور من ظهارة غدية أو من ظهارة عمودية أحادية الطبقة للأغشية المخاطية (تجويف الأنف، القصبة الهوائية، القصبات الهوائية، المعدة، الأمعاء، بطانة الرحم). هناك ثلاثة أنواع سريرية ومورفولوجية خاصة للأورام الغدية: الورم الغدي، والورم الغدي الكيسي (الورم الغدي الكيسي) والورم الغدي الليفي. ورم غدييسمى الورم الحميد الذي يتطور من ظهارة عمودية أحادية الطبقة من الأغشية المخاطية. ينبغي تمييز السلائل الورمية الغدية عن السلائل المفرطة التنسج، وهي ليست أورامًا، ولكنها يمكن أن تتحول إلى سلائل غدية. ورم غدي كيسي– الورم الحميد مع وجود الخراجات (تجاويف). في هذه الحالة، قد يسبق الكيس تطور الورم الحميد (الكيس الأولي) أو ينشأ في أنسجة الورم المتشكل بالفعل (الكيس الثانوي). تمتلئ الأكياس بالسوائل أو المخاط أو الدم المتجلط أو كتل طرية أو كثيفة. الأورام الغدية الكيسية هي الأكثر شيوعًا في المبيضين. يسمى الورم الحميد ذو السدى الواضح ورم غدي ليفي. الموقع النموذجي للأورام الليفية هو الغدد الثديية.
الورم الحليمي- ورم ناضج يتطور من أنسجة غلافية مبطنة بظهارة حرشفية طبقية أو ظهارة بولية (ظهارة انتقالية)، وكذلك في قنوات إفراز الغدد. الأورام الحليمية الحرشفيةتتشكل على الجلد والأغشية المخاطية المغطاة بظهارة حرشفية طبقية (تجويف الفم والبلعوم والمريء والطيات الصوتية في الحنجرة والمهبل والجزء المهبلي من عنق الرحم). الأورام الحليمية للخلايا الانتقاليةموضعي في المسالك البولية، وخاصة في المثانة.
سرطان (سرطان، سرطان)- ورم ظهاري خبيث غير ناضج. هناك نوعان من الأشكال المورفولوجية الرئيسية للسرطان: السرطان داخل الظهارة (غير الغازية) والسرطان الغازي (المتسلل). سرطان داخل الظهارة، أيضا يسمى سرطان في الموقع("في الموقع")، وتتميز بغياب النمو الغازية؛ تتركز جميع الخلايا الخبيثة في سمك الطبقة الظهارية. حاليًا، نادرًا ما يستخدم مصطلح "السرطان اللابد" في علم الأورام العملي، لأنه يصعب أو يستحيل تمييز هذه الحالة عن التغيرات السابقة للتسرطن (خلل التنسج) الواضحة في الظهارة. ولذلك، يتم الجمع بين خلل التنسج الظهاري والسرطان في الموقع تحت المصطلح العام الأورام داخل الظهارةمع الإشارة إلى درجة خطورته (I – خفيف، II – معتدل، III – شديد).
من وجهة نظر تكوين الأنسجة، هناك العديد من أنواع السرطان، وأكثرها شيوعًا هي سرطان الخلايا القاعدية، وسرطان الخلايا الحرشفية (البشرة)، وسرطان الخلايا الانتقالية (الظهارة البولية)، والسرطان الغدي، والسرطان غير المتمايز (الكشمي).
1. سرطان الخلايا القاعدية– السرطان الذي تشبه خلاياه الخلايا القاعدية للظهارة الحرشفية الطبقية. في أغلب الأحيان، يحدث سرطان الخلايا القاعدية في المناطق المفتوحة من الجلد وهو ورم خبيث ذو نمو مدمر محليًا.
2. سرطانة حرشفية الخلايا– السرطان، حيث تتمايز خلاياه في اتجاه الظهارة الحرشفية متعددة الطبقات. غالبًا ما يتم تحديد الورم في الرئة والحنجرة والمريء وأنسجة تجويف الفم والجلد وعنق الرحم. عادة ما يتطور سرطان الخلايا الحرشفية في الرئة من بؤر الحؤول الظهاري الحرشفية، والتي تكون نموذجية لالتهاب الشعب الهوائية المزمن لدى المدخنين. هناك نوعان رئيسيان من سرطان الخلايا الحرشفية: سرطان الخلايا الحرشفية جيد التمايز وسيئ التمايز. العلامة النسيجية الأكثر تميزًا لسرطان الخلايا الحرشفية المتمايزة بشكل جيد هي تكوين بؤر التقرن ("لآلئ السرطان") في طبقات الخلايا السرطانية.
3. سرطان الخلايا الانتقالية– السرطان، حيث تتمايز خلاياه نحو الظهارة الانتقالية (الظهارة البولية). حاليا، يسمى هذا الورم سرطان الظهارة البولية. في الغالبية العظمى من الحالات، يتطور سرطان الخلايا الانتقالية في الغشاء المخاطي للمسالك البولية، وخاصة المثانة.
4. سرطان غدي- شكل من أشكال السرطان مع علامات التمايز الغدي للخلايا التي تشكله (حرفيًا، يُترجم مصطلح "السرطان الغدي" إلى "السرطان الغدي"). غالبًا ما يتطور الورم في المعدة والأمعاء وبطانة الرحم ومختلف الغدد الصماء والغدد الخارجية. النموذجي للسرطان الغدي هو الهياكل الغدية والأنبوبية (السرطان الأنبوبي) والسرطان الحليمي (السرطان الحليمي). هناك أورام سرطانية عالية ومتوسطة وضعيفة التمايز. تشمل الأنواع الخاصة من السرطان الغدي السرطان الغدي المخاطي وسرطان الخلايا الحلقية الخاتم. سرطان غدي مخاطي(سرطان الغشاء المخاطي) يتميز بتكوين كميات كبيرة من المخاط خارج الخلية في أنسجة الورم. سرطان الخلايا الحلقية الخاتمتتكون من خلايا مستديرة، يحتوي السيتوبلازم فيها على مخاط، يشوه النواة ويدفعها إلى الأطراف، مما يعطي الخلية شبهاً بالحلقة.
5. سرطان غير متمايزيتميز بغياب علامات التمايز النوعي للأنسجة أثناء الفحص النسيجي الروتيني للورم. إن استخدام الطرق الخاصة (الكيميائية المناعية والمجهرية الإلكترونية) يجعل من الممكن اكتشاف هذه العلامات. يمكن أن يتطور السرطان غير المتمايز في أي عضو تقريبًا وهو ورم خبيث للغاية. يمكن أن توجد الخلايا السرطانية على شكل ترابيق (سرطان تربيقي) أو صفائح (سرطان صلب). يختلف حجم الخلايا السرطانية غير المتمايزة بشكل كبير (سرطان الخلايا الكبيرة، وسرطان الخلايا العملاقة). هناك نوع غريب من السرطان غير المتمايز سرطان الخلايا الصغيرة، وخاصة سمة الرئة.
من بين أشكال السرطان الخاصة بالأعضاء، الأكثر شيوعًا هي خلية الكلىو الخلية الكبديةسرطانات.
اعتمادًا على شدة السدى، يتم التمييز بين نوعين من السرطان: النخاعو ليفي (Skirr). سرطان النخاع هو سرطان ذو سدى ضئيل، والسرطان الليفي هو سرطان ذو سدى واضح. عادة ما يكون نسيج سرطان النخاع رماديًا ورديًا، ناعمًا أو مرنًا، ويشبه مادة الدماغ (النخاع اللاتيني - الدماغ). يتميز السرطان الليفي بكثافة أنسجة الورم بسبب وفرة ألياف الكولاجين في السدى. سرطان النخاع أكثر شيوعا في الغدة الدرقية والغدد الثديية. ليفي - في الغدة الثديية والمعدة. إذا تم استخدام مصطلح "سرطان النخاع" لتعيين أشكال الأورام المستقلة، فإن مصطلح "السرطان الليفي" لا يستخدم لهذا الغرض في علم الأورام الحديث.
أورام الأنسجة الرخوة والعظام
(الأورام الوسيطة)
تشمل أورام الأنسجة الرخوة الأورام الليفية (الليفية)، والدهنية، والأنسجة العضلية، والأوعية الدموية، والأغشية المصلية والزليلية، بالإضافة إلى هياكل الجهاز العصبي المحيطي. سيتم مناقشة أورام الجهاز العصبي المحيطي في الموضوع التالي. غالبًا ما يتم دمج أورام الأنسجة الرخوة (باستثناء الأورام العصبية) وأورام العظام المحددة في علم الأورام مع هذا المفهوم الأورام الوسيطة. يمكن أن تكون الأورام الوسيطة المتعددة مظهرًا لمتلازمات الورم الوراثي - التصلب الحدبي(مرض برينجل بورنفيل) متلازمة جاردنرو اخرين.
I. أورام الأنسجة الليفية
تشتمل أورام النسيج الليفي (الضام الليفي) على مجموعة متنوعة من الآفات، والتي ربما لا يكون الكثير منها أورامًا حقيقية، ولكن نموًا تفاعليًا للأنسجة يشبه الورم. تنقسم الأورام والآفات الشبيهة بالورم إلى ناضجة وغير ناضجة. تتميز الآفات الليفية الناضجة بشكل رئيسي بمسار حميد، في حين أن الآفات غير الناضجة هي أورام خبيثة.
ل ناضجةوتشمل أورام الأنسجة الليفية الأورام الليفيةو الأورام الليفية, غير ناضجتسمى الأورام الليفية الأورام الليفية. عادة ما ينمو الورم الليفي بشكل واسع وله حدود واضحة؛ ويتميز الورم الليفي بغياب الحدود الواضحة للآفة بسبب النمو الغازي (المتسلل). تسليط الضوء سطحيو عميقورم ليفي. يشمل الورم الليفي السطحي الورم الليفي في راحة اليد ( انكماش دوبوترين)، نعل ( مرض ليدرهوز) ، الرقبة (تتجلى عادة على شكل الصعر الخلقي) ، القضيب ( مرض بيرونييه)، اللثة، أقل في كثير من الأحيان في التعريبات الأخرى. يتميز الورم الليفي العميق بمسار أكثر عدوانية، وفي بعض الحالات، خبيث. يشمل الورم الليفي العميق الأورام الرباطية (الورم الليفي) والورم الليفي الخلقي (الورم الليفي عند الأطفال الصغار).
الأورام الليفية والآفات ذات الصلة. الورم الليفي– ورم يتكون من نسيج ضام ليفي ناضج. هناك أكثر من عشرة أنواع مورفولوجية من الأورام الليفية (الورم الليفي المرنة، والورم الليفي العضلي، والورم الليفي الكثيف، والورم الليفي الناعم، والورم الليفي السفاقي المتكلس، وما إلى ذلك)، ولكن، كقاعدة عامة، لا يختلف مسارها السريري بشكل كبير. الاستثناء هو ورم ليفي وعائي من البلعوم الأنفي، وعادة ما يحدث عند الأولاد في العقد الثاني من العمر. يتميز هذا الورم بالعدوانية الموضعية (النمو المدمر محليًا) وغالبًا ما يتكرر بعد الإزالة. بالإضافة إلى الأنسجة الرخوة، يمكن أن تتشكل الأورام الليفية فيها العظام(الورم الليفي العظمي، الورم الليفي السني).
بالإضافة إلى الأورام الليفية، تشمل الآفات التكاثرية الليفية الحميدة الندبة الضخامية، والجُدرة، والتهاب اللفافة العقدي، والتهاب اللفافة التكاثري، والتهاب العضل التكاثري، والورم الليفي العضلي الالتهابي. تسمى الندبة المتضخمة بشكل مفرط ندبة تضخمية. تسمى ندبة ذات كثافة غضروفية بسبب تصبغ الأنسجة الليفية التي تشكلها جُدَرَة . التهاب اللفافة العقديهي عقيدة تزداد حجمها بسرعة (حوالي 1 سم في الأسبوع)، وتقع في الأنسجة تحت الجلد أو العضلات الهيكلية أو المرتبطة باللفافة. ونادرا ما يتجاوز قطر الآفة 3 سم وعادة ما يكون لها حدود واضحة. بعد الإزالة نادرا ما تتكرر. التهاب اللفافة التكاثريتسمى آفة مماثلة، حيث يتم اكتشاف خلايا ليفية كبيرة تشبه الخلايا العصبية في الأنسجة. وتسمى نفس العملية في العضلات الهيكلية التهاب العضلات التكاثري . ورم ليفي عضلي التهابي– انتشار واضح للخلايا الليفية والخلايا الليفية العضلية مع وجود تسلل التهابي للآفة. عادة ما تكون العملية موضعية في الأنسجة الرخوة والأعضاء الداخلية عند الأطفال والشباب. عادة ما يكون الورم حميدًا، ولكن يمكن أن يتكرر بعد إزالته، ويتحول أحيانًا إلى ساركوما.
الورم الليفي العميق. الأورام الرباطية (com.desmoids) – ورم ليفي عميق، يتميز بانتشار واضح للخلايا الليفية النشطة. يميز البطني(في سمك جدار البطن الأمامي)، داخل البطن(في أعضاء البطن، في المقام الأول في مساريق الأمعاء الدقيقة) و خارج البطن(عندما تكون العملية موضعية خارج جدار البطن وأعضاء البطن) متغيرات الأورام الرباطية. آفات متعددة للأعضاء الداخلية الورم الليفي للأطفال الصغارغالبا ما تنتهي بوفاة الطفل.
الساركوما الليفية– أحد أندر الأورام الخبيثة التي تصيب الإنسان. هناك نوعان من المتغيرات السريرية والمورفولوجية للورم الليفي: الساركوما الليفية لدى الأطفال الصغار (الخلقية وحتى سن 5 سنوات) والساركوما الليفية لدى البالغين. تتميز الساركوما الليفية لدى الأطفال الصغار بمسار إيجابي نسبيًا، حيث يصل معدل البقاء على قيد الحياة لمدة 5 سنوات إلى 85٪.
ثانيا. أورام الخلايا الليفية
الأورام الليفية هي أورام الأنسجة الليفية التي تحتوي على عدد كبير من الخلايا البلعمية (الخلايا المنسجات). هناك ثلاث مجموعات من الأورام الليفية: الحميدة، والحدية والخبيثة. تشمل الأورام الحدية آفات متكررة بشكل متكرر مع نمو مدمر محليًا، ولكن نادرًا ما تكون منتشرة، أي. عدم وجود كافة علامات الأورام الخبيثة. يشار إلى الأورام الليفية الخبيثة بالمصطلح العام ورم المنسجات الليفي الخبيث.
ل الأورام الليفية الحميدةتشمل ورم المنسجات الليفي الحميد، والورم الأصفر، والورم الأصفر الحبيبي للأحداث، والورم الشبكي المنسج. ورم المنسجات الليفي الحميدهي عقدة صغيرة بدون حدود واضحة. يسمى ورم المنسجات الليفي الحميد في الجلد ورم ليفي جلدي. بمجرد إزالتها، نادرا ما تتكرر هذه الآفات. تتكرر الأورام والأورام العميقة ذات الخلايا العالية إلى حد ما في كثير من الأحيان. الورم الأصفرهي عقيدات أو عقدة، في كثير من الأحيان بقعة، صفراء اللون (من اللاتينية زانثوس - أصفر). غالبًا ما يتم دمج الأورام الصفراء مع مستويات مرتفعة من الدهون في بلازما الدم (فرط بروتينات الدم الدهنية). في بعض الأحيان يكون فرط شحميات الدم مصحوبًا بظهور أورام صفراء صغيرة متعددة على الجلد (أورام صفراء كعناصر من الطفح الجلدي) ؛ تسمى هذه الأورام الصفراء ثائر. تتشكل الأورام السرطانية في الجلد وفي أنسجة الأعضاء المختلفة. تسمى الأورام الزانثومية على الجفون زانثيلزما .
يسمى الورم المشابه للورم الأصفر، ولكن مع وجود خلايا رغوية مختلفة الأحجام والأشكال ورم حبيبي أصفر. الورم الحبيبي الأصفر نادر عند البالغين، ويوجد بشكل رئيسي في مرحلة الطفولة ( ورم زانثوغرانولوما الشبابي)، حتى عند الأطفال حديثي الولادة. البديل السريري والمورفولوجي الخاص للورم الحبيبي الأصفر هو الورم الحبيبي خلف الصفاق (خلف الصفاق) Oberling. ورم حبيبي أصفر في أوبرلنجوهو أكثر شيوعًا عند البالغين، ويمثل شكلًا غريبًا من التليف خلف الصفاق. ورم شبكي منسج– ورم ليفي عظمي حميد، والذي غالباً ما يصاحب أشكال مختلفة من التهاب المفاصل، يقترن بأمراض المناعة الذاتية، وفي بعض الأحيان يكون عملية ورمية، مما يعكس وجود ورم خبيث في الأعضاء الداخلية في الجسم.
الأورام الليفية الحدية.تشمل آفات الخلايا الليفية الليفية الحدبية الورم الليفي الجلدي الحدبي، والورم الليفي الليفي غير النمطي، والورم الأرومي الليفي للخلايا العملاقة، والورم الليفي الليفي الضفيري.
الساركومة الليفية الجلدية الحدبيةإنها عقدة كبيرة إلى حد ما (قطرها عدة سنتيمترات) ترتفع فوق سطح الجلد. نمو الورم بطيء. العقدة ليس لها حدود واضحة، وغالبا ما ينمو الورم إلى الدهون تحت الجلد. وفي حالات نادرة، يكون لون أنسجة الورم بني غامق أو أسود بسبب وجود خلايا تحتوي على الميلانين ( الساركومة الليفية الجلدية المصطبغة بيدنار). يشبه ورم بيدنار الورم الميلانيني الخبيث في المظهر. في ما يقرب من نصف الحالات، تتكرر الساركومة الليفية الجلدية الحدبية بعد إزالتها، لذلك يجب أن يتم العلاج عن طريق الاستئصال الواسع للورم. نادرا ما تتشكل النقائل.
ورم ليفي غير نمطييحدث عادةً عند كبار السن ويكون موضعيًا في جلد المناطق المكشوفة من الجسم. الورم، كقاعدة عامة، عبارة عن عقيدات صغيرة مع تقرح في السطح وحدود واضحة. عادةً ما يكون مسار الورم حميدًا، ولكن في بعض الأحيان ينتكس، وتتشكل النقائل، ويلاحظ التحول إلى ورم المنسجات الليفي الخبيث. ورم ليفي الخلايا العملاقةيحدث بشكل رئيسي عند الأطفال في العقد الأول من العمر في الجلد والدهون تحت الجلد في الظهر والأطراف السفلية. لا ينتشر الورم ولا يتميز بنمو مدمر محليًا، ولكنه غالبًا ما يتكرر بعد الإزالة. ورم ليفي ضفيري الشكلتوجد عند الأطفال والشباب في الجلد والأنسجة تحت الجلد في الأطراف. بعد الإزالة، غالبا ما يتكرر الورم، وفي حالات نادرة، تتشكل النقائل في العقد الليمفاوية الإقليمية.
ورم المنسجات الليفي الخبيث- الساركوما الأكثر شيوعا. يتم تحديد الورم في أعضاء مختلفة، وخاصة في الأنسجة العميقة للأطراف وفي الفضاء خلف الصفاق. خارجياً، تظهر على شكل عقدة/عقد بدون حدود واضحة مع نخر ونزيف. هناك خمسة أنواع مختلفة من الأورام: متغيرات الخلايا متعددة الأشكال والعملاقة هي أورام عالية الجودة، والميكسويد والالتهابات متوسطة، والمتغير الوعائي منخفض الدرجة. يُنظر أحيانًا إلى ورم المنسجات الليفي الوعائي الخبيث ضمن مجموعة أورام المنسجات الليفية الحدية التي تسمى ورم المنسجات الليفي الوعائي. تتميز الصورة السريرية بتطور فقر الدم والحمى الطويلة الأمد وفقدان وزن الجسم. يحدث هذا الورم غالبًا عند الأطفال والشباب، ونادرًا ما ينتشر، ولكنه غالبًا ما يتكرر بعد إزالته.
ثالثا. أورام الدهون والأنسجة العضلية
أورام الأنسجة الدهنية.هناك أورام في الأنسجة الدهنية البيضاء والبنية. يُطلق على الورم الناضج من الأنسجة الدهنية البيضاء هذا المصطلح ورم شحمي، بني - السبات. تسمى الأورام الخبيثة غير الناضجة في الأنسجة الدهنية ساركومة شحمية .
الأورام الشحميةتظهر عادة على شكل عقيدات صفراء ناعمة تتكون من فصيصات الأنسجة الدهنية. بالإضافة إلى الأورام الشحمية الانفرادية (المفردة)، هناك أورام متعددة. هناك العديد من المتغيرات المورفولوجية للأورام الشحمية (العادية، المغزلية، متعددة الأشكال، وغير النمطية)، ولكن سريريًا لديهم جميعًا نفس المسار الحميد. في كثير من الأحيان، يشمل الورم الحميد، إلى جانب الأنسجة الدهنية، أنسجة أخرى: العديد من الأوعية الدموية (الورم الشحمي الوعائي)، والأوعية وحزم خلايا العضلات الملساء (الورم الشحمي العضلي الوعائي)، ونخاع العظم الأحمر (الورم الشحمي النقوي). غالبًا ما يحدث الورم الشحمي العضلي الوعائي في الكلى، والورم الشحمي النقوي - في الغدد الكظرية والأنسجة خلف الصفاق. وبالإضافة إلى ذلك، هناك ورم شحمي عضلي، ورم أرومي شحمي، وورم شحمي. الورم الشحمي العضليموضعية في سمك العضلات الهيكلية، وتتميز بنمو بطيء، ونتيجة لذلك، عدم وجود حدود واضحة. ورم كبير يسبب ضمور العضلات. بعد الإزالة، غالبًا ما يتكرر الورم الشحمي العضلي. ورم أرومي شحمي، والتي تتكون من الخلايا الدهنية الناضجة، وتحدث بشكل رئيسي عند الأطفال، وعادة في السنوات الأولى من الحياة. داء شحمي منتشرتسمى بؤر تكاثر الأنسجة الدهنية التي ليس لها حدود واضحة (باستثناء التوطين العضلي للعملية). في بعض الحالات، يكون سبب الورم الشحمي المنتشر هو زيادة في تركيز الجلايكورتيكويدات في الجسم (الورم الدهني الستيرويدي). عندما تكون الآفة موضعية في الأنسجة المجاورة للمستقيم أو شبه المستقيمي، قد يحدث انسداد القولون أو احتباس البول. ويشار إلى الأورام الشحمية المتعددة أيضًا باسم داء دهني. أشهر أنواع الأورام الشحمية هي ورم دهني ديركومو داء ماديلونج الشحمي. يتميز ورم ديركوم الدهني بوجود أورام شحمية مؤلمة بشكل رئيسي على الأطراف. في حالة الورم الشحمي Madelung، تتوضع الأورام الشحمية في الرقبة، وتغلفها أحيانًا بحلقة، مما يسبب ضغطًا على الأوعية الدموية والأعصاب والجهاز التنفسي والبلعوم. السباتغالبًا ما تقع في المناطق الكتفية والبينية. ساركومة شحميةتتميز بالتنوع الكبير. الساركوما الدهنية الدهنية المتمايزة جيدًا هي أورام منخفضة الدرجة. الاستثناء هو الساركوما الشحمية ذات التوطين خلف الصفاق، والتي يكون تشخيصها دائمًا أقل ملاءمة. تتميز الخلايا المستديرة والساركوما الشحمية متعددة الأشكال وغير المتمايزة بمسار خبيث للغاية.
أورام الأنسجة العضليةوتنقسم إلى أورام الأنسجة العضلية الملساء والمخططة. أورام العضلات الملساء الناضجة - الأورام العضلية الملساء، الأنسجة العضلية المخططة - الأورام العضلية المخططة. تسمى الأورام الخبيثة غير الناضجة في العضلات الملساء بالساركوما العضلية الأملس، والأنسجة العضلية المخططة - الساركوما العضلية المخططة.
في أغلب الأحيان الورم العضلي الأملستتطور في الرحم تحت تأثير هرمونات الاستروجين التي تعزز النشاط التكاثري لخلايا العضلات الملساء العضلية الرحمية. بالإضافة إلى ذلك، تتطور الأورام العضلية الأملس من الخلايا العضلية الأملس الوعائية، والعضلات الصفراوية للجلد، وكذلك جدران الأعضاء المجوفة، وخاصة الجهاز الهضمي. في بعض الأحيان ينتشر الورم العضلي الأملس الرحمي إلى الرئتين ( الورم العضلي الأملس النقيلي)، إلا أنها تظل عملية حميدة. في بعض الأحيان، ينمو نسيج الورم في تجويف أوردة الرحم، والحوض، وحتى في الوريد الأجوف السفلي ( ورم عضلي أملس عن طريق الوريد). يظل تشخيص الورم العضلي الأملس الوريدي مواتيًا، على الرغم من عدم اكتمال الاستئصال الجراحي للورم؛ استئصال المبيض الثنائي يلغي عمليا إمكانية الانتكاس. في النساء في سن الإنجاب، ما يسمى الورم العضلي الأملس البريتوني المنتشر، حيث تتشكل عدة أورام عضلية ملساء صغيرة (نقائل زرع) على الصفاق، تشبه ظاهريًا نقائل الورم الخبيث. عادة ما ترتبط هذه الحالة بالحمل، أو وجود ورم في الخلايا الحبيبية المنتجة لهرمون الاستروجين في المبيض، أو استخدام وسائل منع الحمل عن طريق الفم. عادةً ما يكون الورم العضلي الأملس البريتوني المنتشر نتيجة غير متوقعة أثناء العملية القيصرية. في معظم الحالات، تتراجع الآفات تلقائيًا.
تحتوي بعض أورام العضلات الملساء أيضًا على أنسجة أخرى: ورم شحمي عضلي وعائي (نموذجي في الكلى)، ورم عضلي وعائي، ورم عضلي لمفي. ورم خبيثغالبا ما يتطور في الرحم مع ورم خبيث من الأورام العضلية الملساء الموجودة منذ فترة طويلة، وعادة ما تكون كبيرة الحجم. في هذه الحالة، تظهر مناطق ذات اتساق أكثر ليونة وبؤر النخر والنزيف في عقدة الورم. الساركوما العضلية المخططةلديها تنوع كبير. أنها تتطور بشكل رئيسي في مرحلة الطفولة. الخلايا المغزلية والساركوما العضلية المخططة الجنينية هي أورام منخفضة الدرجة. الساركوما العضلية المخططة السنخية والمتعددة الأشكال هي أورام خبيثة للغاية. هناك نوع غريب من الساركوما العضلية المخططة الجنينية botryoid(من اليونانية بوثريوس – عنقود عنب) ساركومة عضلية مخططة، يتطور عند الأطفال في السنوات الأولى من العمر في الأغشية المخاطية للأعضاء المختلفة، غالبًا المهبل، ويبرز فوق سطحها ("السليلة البوثريويدية"). عادة ما تتشكل الساركوما العضلية المخططة السنخية والمتعددة الأشكال في العضلات الهيكلية.
رابعا. أورام الدم والأوعية الليمفاوية
تنقسم أورام الأوعية الدموية إلى أورام بطانية (تتطور من الخلايا البطانية للدم والأوعية الليمفاوية) وأورام محيطة بالأوعية (ناشئة عن أنواع أخرى من العناصر الخلوية لجدار الوعاء الدموي والأنسجة المحيطة بالأوعية المجاورة مباشرة للأوعية الدموية).
الأورام البطانية للأوعية الدموية.تسمى أورام الأوعية الدموية الناضجة بالأورام الوعائية، أما الأورام الخبيثة غير الناضجة فتسمى الساركوما الوعائية (ساركوما وعائية، ورم بطاني وعائي خبيث). هناك نوع خاص من أورام الأوعية الدموية وهو ساركوما كابوزي. تتكون مجموعة خاصة من الأورام البطانية الحدية من أورام بطانية وعائية، والتي لا يمكن تصنيفها بشكل لا لبس فيه على أنها أورام حميدة أو خبيثة.
هناك الشعيرات الدموية، الكهفية، العضلية، الوريدية، الشريانية الوريدية والظهارية (المنسجات) الأورام الوعائية. النوع الغريب من الأورام الوعائية هو الورم الحبيبي القيحي (ورم وعائي من نوع الأنسجة الحبيبية). تتشكل الأورام الوعائية الشعرية بواسطة الأوعية الشعرية، وهي مقسمة إلى نوعين: الأحداث (الأطفال) والبالغين. ورم وعائي شعري للأحداث(الحمة الوعائية) هي عقيدة أو بقعة، معظمها حمراء اللون، تظهر عند 0.5٪ من الأطفال حديثي الولادة، وعادة ما تتشكل بعد عدة أسابيع أو أشهر وعادة ما تكون موضعية على جلد الوجه أو الرقبة. في كثير من الأحيان تكون هذه الأورام الوعائية متعددة. وبعد مرور بعض الوقت يتراجعون بشكل عفوي. ورم وعائي شعري بالغيحدث بالفعل عند المراهقين، ولكن تواتر تطورهم يزيد مع تقدم العمر. وهي موضعية في المقام الأول على جلد الجذع والأطراف، وكذلك في الأعضاء الداخلية. الأورام الوعائية الكهفيةتتشكل بواسطة السفن ذات التجويف الموسع بشكل حاد. وهي تقع على الجلد وفي الأعضاء الداخلية (في المقام الأول في الكبد والطحال). عادة لا تتراجع الأورام الوعائية الكهفية تلقائيًا، ومع النمو السريع قد يحدث تدمير للأنسجة المحيطة بالورم. ورم وعائي عضلي- ورم وعائي شعري أو كهفي، يقع في عمق العضلات الهيكلية. الأورام الوعائية الوريديةيتكون من تراكم بؤري للأوعية الوريدية، الأورام الوعائية الشريانية الوريديةتتكون من الأوعية الوريدية والشعرية والشريانية. ورم وعائي ظهاري(تضخم الأوعية اللمفاوية مع كثرة اليوزينيات) يتميز بتكاثر الشعيرات الدموية في الجلد مع خلايا بطانية كبيرة تشبه الخلايا المنسجات. الشعيرات الدموية محاطة بتراكمات من الخلايا الليمفاوية والبلاعم والخلايا المحببة اليوزينية، وغالبًا ما توجد الجريبات اللمفاوية. في معظم الأحيان يقع الورم على فروة الرأس. الورم الحبيبي القيحيهو نمو نسيج حبيبي في مكان الإصابة على شكل عقدة على الجلد أو الأغشية المخاطية. في كثير من الأحيان يتم توطينه على الغشاء المخاطي للتجويف الفموي، في المقام الأول على اللثة. من المميزات تكوين الأورام الحبيبية القيحية أثناء الحمل ( الورم الحبيبي الحملي) ، تتراجع هذه الأورام بعد الولادة أو إنهاء الحمل.
اعتمادا على عدد الأورام الوعائية، يتم التمييز بين الأورام الوعائية الانفرادية والمتعددة. ويشار أيضًا إلى الأورام الوعائية المتعددة باسم ورم وعائي. تشمل الأورام الوعائية ورم دارييه الدموي الجلدي التقدمي، ومتلازمة كاساباخ-ميريت، ومتلازمة مافوتشي، ومتلازمة هافركامب. ورم وعائي تقدمي في الجلد داريايتميز بوجود أورام وعائية جلدية متزايدة في الحجم والعدد، والتي يمكن أن تكون معقدة بسبب نقص الصفيحات الاستهلاكية ومتلازمة التخثر المنتشر داخل الأوعية. متلازمة كاساباخ-ميريت– الأورام الوعائية الجلدية العملاقة مع تطور نقص الصفيحات الاستهلاكية ومتلازمة التخثر المنتشر داخل الأوعية الدموية. متلازمة مافوتشي- خيار مرض أولييه(الورم الغضروفي في العظام، وخاصة أصابع اليدين والقدمين) بالاشتراك مع الأورام الوعائية الشعرية والكهفية المتعددة في الأنسجة الرخوة للأصابع. متلازمة هافركامب– ورم وعائي معمم في العظام. يتطور المرض بسرعة وينتهي بالوفاة. يؤدي النمو الغازي للأورام الوعائية داخل العظم إلى تشوه العظام، وتدميرها (الكسور المرضية)، ونزوح الأنسجة النخاعية من المادة الإسفنجية مع تطور فقر الدم الناقص التنسج.
الأورام الوعائية الجهازية.تسمى الأمراض التي تتمركز فيها الأورام الوعائية في الأعضاء المختلفة (الجلد والأعضاء الداخلية والدماغ والعينين والعظام) ورم وعائي جهازي. وتشمل هذه متلازمات هيبل-لينداو وستورج-ويبر-كرابي. متلازمة هيبل لينداو(الورم الوعائي الشبكي الدماغي الحشوي) يتميز بوجود أورام وعائية في شبكية العين وفي الأعضاء الداخلية (الكبد والطحال) وفي الجهاز العصبي المركزي (عادة في المخيخ مع الأعراض العصبية المقابلة). متلازمة ستورج-ويبر-كرابه- مزيج، كقاعدة عامة، من الأورام الوعائية الأحادية الجانب لجلد الوجه في منطقة تعصيب الفروع الأولى أو الثانية للعصب ثلاثي التوائم، والأورام الوعائية المشيمية (مما يؤدي إلى تطور الجلوكوما أو انفصال الشبكية) والأورام الوعائية الدماغ، والذي يتجلى في تطور متلازمة متشنجة وشلل نصفي / شلل نصفي على أورام الجانب الآخر على جانب الجسم.
هناك خياران رئيسيان ورم بطاني وعائي– الظهارية (المنسجات) والخلية المغزلية. ورم بطاني وعائي ظهاريعندما يكون موضعيًا في الرئتين، يؤدي عادةً إلى مضاعفات خطيرة والوفاة. عندما يقع الورم في الأعضاء الداخلية الأخرى والأنسجة الرخوة، نادرا ما تتطور مضاعفات قاتلة. ورم بطاني وعائي للخلايا المغزليةفي كثير من الأحيان يتكرر بعد الإزالة، ولكن لا ينتشر. ساركوما وعائيةيشير إلى أورام خبيثة عالية. تم تحديد الدور المسبب للمرض لمركبات الزرنيخ وكلوريد الفينيل والتشمس في تطور الساركوما الوعائية. ويتأثر في الغالب البالغين وكبار السن. من الناحية المجهرية، تكون الساركوما الوعائية، كقاعدة عامة، عبارة عن عقيدات حمراء بدون حدود واضحة. ساركوما كابوزي– ورم من الخلايا الوعائية ضعيفة التمايز (الأرومات الوعائية)، يتطور على خلفية نقص المناعة الشديد تحت تأثير فيروس الهربس من النوع 8 (HHV-8). هناك ثلاثة متغيرات سريرية ووبائية رئيسية لساركوما كابوزي: الشيخوخة والوبائية وعلاجي المنشأ. تتطور ساركوما خرف كابوزي، كما يوحي اسمها، في سن الشيخوخة وهي عبارة عن ورم منخفض الدرجة (متوسط مدة المرض هو 10-15 سنة). تتميز المتغيرات الوبائية (مع الإصابة بفيروس نقص المناعة البشرية) والعلاجية المنشأ (بسبب تثبيط المناعة الدوائي) بدرجة عالية من الأورام الخبيثة. عادة، تظهر ساركوما كابوزي على شكل لوحة ناعمة حمراء بنية على جلد الساقين أو القدمين.
الأورام البطانية للأوعية الليمفاوية.تسمى الأورام الناضجة في الأوعية الدموية بالأورام الوعائية اللمفية، وتسمى الأورام الخبيثة غير الناضجة بالساركوما الوعائية اللمفية. الأورام اللمفاويةغالبًا ما تتشكل من الأوعية اللمفاوية الشعرية العادية (الورم الوعائي اللمفي الشعري) أو الأوعية اللمفاوية المتوسعة بشكل حاد (الورم اللمفي الكهفي). ساركوما لمفيةيحدث في الغالب عند النساء. يتم تشكيله بشكل رئيسي على خلفية تضخم الغدد الليمفاوية لفترات طويلة. الساركوما اللمفية لدى النساء اللاتي خضعن لاستئصال الثدي الجذري لسرطان الثدي ( متلازمة ستيوارت-تريفيس) عادة ما يتطور بعد 10 سنوات من الجراحة.
الأورام المحيطة بالأوعية الدموية.تشمل الأورام المحيطة بالأوعية الدموية الورم الكبي (ومتغيراته الورم الكبيبي والورم العضلي الكبيبي) والورم الوعائي الدموي. هناك أورام كبية حميدة وخبيثة، بالإضافة إلى أورام وعائية خبيثة حميدة وخبيثة. تعد المتغيرات الحميدة للأورام المحيطة بالأوعية الدموية أكثر شيوعًا. ورم كبي حميدكقاعدة عامة، يتم وضعها في الأنسجة الرخوة للأصابع تحت صفيحة الظفر وهي عبارة عن عقيدات حمراء مزرقة يبلغ قطرها عادة أقل من 1 سم، والورم مؤلم، خاصة مع انخفاض حرارة الجسم. بعد الإزالة غالبا ما يتكرر. ورم وعائي حميدغالبًا ما تكون موضعية في الفضاء خلف الصفاق وأعضاء الحوض وأنسجة الفخذ ولها حدود واضحة. في بعض الحالات، يؤدي الورم إلى تطور نقص السكر في الدم.
V. أورام الأغشية المصلية والزلالية
أورام الجلد المصلي.تنشأ من الأغشية المصلية العديد من الأورام الحميدة والخبيثة. وتشمل الأورام الحميدة ورم ليفي منفرد في غشاء الجنب والصفاق(ورم الظهارة المتوسطة الليفي الموضعي) ، ورم الظهارة المتوسطة الحليمي المتمايز بشكل جيد, ورم الظهارة المتوسطة المتعدد الكيساتو ورم غدي. الأورام الخبيثة في الجلد المصلي هي ورم ليفي انفرادي خبيث في غشاء الجنب والصفاق، ما يسمى ورم الظهارة المتوسطة منتشر، و طلائية, خلية مغزلية(ساركوماتويد) و ورم الظهارة المتوسطة الخبيث ثنائي الطور. لقد ثبت أن الأسبستوس قد يكون سبب تطور ورم الظهارة المتوسطة الجنبي الخبيث.
أورام الأغشية الزليلية للمفاصل.حاليًا، تشتمل أورام الأغشية الزليلية على ورمين فقط: حميدةو ورم الخلايا العملاقة الوترية الزليلية الخبيث. في السابق كانت هذه المجموعة متضمنة الساركوما "الزلالية".[الساركوما الزليلية]، من الناحية النسيجية، لا تنتمي إلى أورام زليلية، على الرغم من أنها غالبًا ما تقع بالقرب من المفاصل. تعتبر الساركوما "الزلالية" أقل خبثًا لدى المرضى الذين تقل أعمارهم عن 15 عامًا، في حالة توطينها في الأطراف البعيدة وبحجم عقدة يصل قطرها إلى 5 سم.
السادس. أورام العظام
هناك أربع مجموعات رئيسية من أورام العظام: أورام العظام، وأورام الغضاريف، وأورام الخلايا العملاقة، وأورام نخاع العظم. بالإضافة إلى ذلك، يمكن أن تتطور أورام العظام والغضاريف في بعض الأحيان بشكل أساسي في الأنسجة الرخوة والأعضاء الداخلية.
الأورام المكونة للعظام.الأورام العظمية الحميدة الناضجة المكونة للعظام تشمل ورم العظم، ورم العظم العظمي، والورم الأرومي العظمي الحميد. الأورام الخبيثة المكونة للعظام غير الناضجة هي ورم أرومي عظمي عدواني (ورم أرومي عظمي خبيث) وساركوما عظمية (ساركوما عظمية المنشأ).
ورم عظمي– ورم بطيء النمو، ينشأ بشكل رئيسي في عظام الجمجمة. ورم عظمي عظمي(الورم العظمي العظمي) يقع في النسيج العظمي المضغوط للطبقة السطحية (القشرية) للعظم. قرب الورم من السمحاق يسبب ألما شديدا. يتطور الورم بشكل رئيسي عند المراهقين والشباب في شلل العظام الأنبوبية الطويلة؛ ويتميز بحجمه الصغير (قطره عادة أقل من 1 سم)، ونموه البطيء للغاية، وحدوده الواضحة، وكقاعدة عامة، منطقة واضحة من تكوين العظام التفاعلي. ورم أرومي عظمي حميد، يشبه في التركيب المجهري الورم العظمي العظمي، ولكنه موضعي في الأجزاء العميقة من العظم، في الأنسجة العظمية الإسفنجية. يتجاوز حجم الورم عادة 1 سم، ويكون تكوين العظام التفاعلي غير مهم. كقاعدة عامة، لا يوجد ألم شديد مميز للورم العظمي العظمي. ورم أرومي عظمي عدوانييتميز بانتكاسات متكررة بعد العلاج الجراحي، لكنه لا ينتشر.
ساركوما عظمية- ورم العظام الخبيث الأساسي الأكثر شيوعًا. يتطور بشكل رئيسي في العقد الثاني من الحياة عند الذكور. في سن الشيخوخة، عادة ما تتشكل الساركوما العظمية على الخلفية مرض باجيت في العظام. في أغلب الأحيان، يتم تحديد الساركوما العظمية في الكردوس للعظام الأنبوبية الطويلة. تنقسم الساركوما العظمية إلى نوعين سريريين ومورفولوجيين رئيسيين: وسط(النخاع) و سطح(المحيطية). كقاعدة عامة، الساركوما العظمية المركزية هي ورم عالي الجودة، في حين أن الساركوما العظمية المحيطية منخفضة الدرجة. تلتصق الساركوما العظمية السطحية بإحكام بسطح العظم أو تحيط به على شكل كم، دون التسبب في تدمير كبير للطبقة القشرية. الأورام تتطور عادة في diaphysis من العظام الطويلة. من الناحية الإشعاعية، في معظم الحالات، يكشف الورم عن عتامة خطية شعاعية، بالإضافة إلى النابتات العظمية البعيدة والقريبة ("مثلثات كودمان")، التي تشكلت بسبب تكوين العظام التفاعلي أثناء انفصال السمحاق على طول محيط الورم. هناك نوعان رئيسيان من الساركوما العظمية السطحية: العظمية (المجاورة للقشرة) والسمحاقية. ساركوما عظمية باروستيةتتشكل في الغالب من أنسجة العظام الورمية ، ساركوما عظمية سمحاقيةيتكون بشكل رئيسي من غضروف الورم.
الأورام الغضروفية.أورام العظام الغضروفية الحميدة الناضجة هي الورم الغضروفي، والورم العظمي الغضروفي، والورم الأرومي الغضروفي الحميد، والورم الليفي الغضروفي. يُشار إلى الورم الخبيث غير الناضج في أنسجة الغضروف بالمصطلح ساركومة غضروفية .
ورم غضروفيويمثلها غضروف زجاجي ناضج. اعتمادًا على الموقع في العظم، هناك نوعان من الأورام الغضروفية: الأورام الغضروفية، ذو موقع مركزي، و الأورام الغضروفية السمحاقيةتقع في الأجزاء الطرفية من العظام. الأكثر شيوعًا هي الأورام الغضروفية، والتي يمكن أن تكون مفردة (مفردة) أو متعددة. يشار إلى الأورام الغضروفية المتعددة باسم ورم غضروفيالعظام. من بين الأورام الغضروفية، أهمها مرض أولييه ومتغيره متلازمة مافوتشي. مرض أولييهيتجلى في تكوين الأورام الغضروفية في عظام اليدين والقدمين. تسبب الأورام الغضروفية انحناء العظام الذي يستمر طوال فترة نمو العظام، مما قد يؤدي إلى تحول اليدين والقدمين إلى تكتلات معقدة. ويسمى وجود أورام وعائية الأنسجة الرخوة في مرض أولييه متلازمة مافوتشي. نادرًا ما تتحول الأورام الغضروفية الانفرادية، على عكس الأورام المتعددة، إلى ساركومة غضروفية.
ورم عظمي غضروفي(التعظم الغضروفي العظمي) هو نمو عظمي على السطح الخارجي للعظم مغطى بطبقة من الغضروف ("الغطاء الغضروفي"). يمكن أن تكون الأورام العظمية الغضروفية منفردة أو متعددة، وتقع عادة في منطقة الكردوس للعظام الأنبوبية الطويلة وتوجد بشكل رئيسي عند الأطفال (يتوقف نمو الأورام العظمية الغضروفية عادة بحلول الوقت الذي ينضج فيه الهيكل العظمي). كما هو الحال مع الأورام الغضروفية، نادرًا ما تخضع الأورام العظمية الغضروفية الانفرادية، على عكس الأورام المتعددة، للأورام الخبيثة. ورم أرومي غضروفي حميديقع دائمًا تقريبًا في المشاش للعظام الأنبوبية الطويلة، عادةً عند الأشخاص الذين تقل أعمارهم عن 20 عامًا، وهو مؤلم، وغالبًا ما يكون مهمًا، ويتكرر أحيانًا بعد الإزالة ونادرًا ما يتحول إلى ساركومة غضروفية. الورم الليفي الغضروفيسماته السريرية تشبه الورم الأرومي الغضروفي، ومع ذلك، فإن الصورة النسيجية للورم يمكن أن تحاكي الساركومة الغضروفية المتمايزة. في فحص الأشعة السينية، يظهر الورم كعقدة داخل العظم ذات حدود واضحة وحافة رقيقة من أنسجة العظام شديدة التمعدن.
ساركومة غضروفية.على عكس الأورام الغضروفية، التي يوجد معظمها في الأجزاء الطرفية من الأطراف، تحدث الساركوما الغضروفية بشكل رئيسي في عظام الحوض والأضلاع وعظم العضد وعظم الفخذ. تتشكل الساركوما الغضروفية في الغالب أو بشكل كامل عن طريق الأنسجة الغضروفية غير الناضجة دون تكوين ورم عظمي. هناك أربعة أنواع رئيسية من الساركومة الغضروفية: التقليدية، والقشرية المجاورة (السمحاقية)، واللحمة المتوسطة، وغير المتمايزة. هناك خيارات متباينة للغاية ومنخفضة ساركومة غضروفية عادية. يقع الورم في الأجزاء الوسطى من العظم (الساركوما الغضروفية المركزية)، ويدمر الأنسجة العظمية المحيطة به، وليس له حدود واضحة، يمكن اكتشافها عن طريق فحص الأشعة السينية. ساركومة غضروفية قشرية مجاورة(ورم منخفض الدرجة) هو نظير للساركوما العظمية السمحاقية، ولكن بدون علامات تكوين العظم الورمي. الساركوما الغضروفية الوسيطة وغير المتمايزة هي أورام خبيثة للغاية. ساركومة غضروفية غير متمايزة- أحد أكثر الأورام البشرية الخبيثة، وهو أكثر عدوانية من الساركوما العظمية، وعادة ما يتطور عند كبار السن. معدل البقاء على قيد الحياة لمدة 5 سنوات لهذا الورم هو 10-15٪.
ورم الخلايا العملاقة في العظام (ورم عظمي)هو ورم عدواني ولكن نادرا ما يكون منتشرا. بالإضافة إلى الخلايا السرطانية وحيدة النواة، فإنه يحتوي على خلايا متعددة النوى تشبه الخلايا العظمية (ومن هنا جاء اسم الورم). كقاعدة عامة، يتطور الورم بشكل رئيسي في سن 20-40 سنة في المشاشات للعظام الأنبوبية الطويلة. ورم الخلايا العملاقة هو ورم عظمي. بعد أن نشأت في المشاش، بالقرب من الغضروف المفصلي، ينتشر بعد ذلك ويغطي المشاش بالكامل والأجزاء المجاورة من الكردوس. بعد الإزالة، غالبًا ما تعود أورام الخلايا العملاقة وتنتشر أحيانًا إلى الرئتين.
أورام "نخاع العظام".ما يسمى بأورام النخاع العظمي يشمل أورام من الخلايا الوسيطة سيئة التمايز. هذه الأورام هي أورام ذات درجة عالية من الخباثة. والنوع الرئيسي هو ساركومةً يُوِينغ، وعادة ما يحدث بين سن 5 و 15 سنة، وعادة في جدل وكردوس العظام الطويلة. عند فحص الأشعة السينية، يظهر الورم عمومًا كحالة للعظم، ولكن غالبًا ما يرتبط تدمير العظام ببؤر تكون العظم. غالبًا ما يتم العثور على تكوين العظم السمحاقي مع صورة الأشعة السينية المميزة لـ "قشور البصل". تنتشر ساركوما إيوينج مبكرًا إلى العظام الأخرى والرئتين والكبد. بالإضافة إلى ذلك، غالبًا ما يتطور في المقام الأول في العديد من العظام (نمو الورم متعدد المراكز). في حالات نادرة، تتطور ساركوما إيوينج في الأنسجة الرخوة والأعضاء الداخلية ( ساركوما يوينغ خارج العظم).
أورام الجهاز العصبي، وأغشية الدماغ،
تاريخ الإضافة: 2015-08-26 | المشاهدات: 4959 | انتهاك حقوق الملكية
| | | | | | | | | | | | | | | | | | 19 | | | | | | | | | | | | | |
في حالة الاشتباه في أمراض الدماغ، يتم وصف التصوير بالرنين المغناطيسي للمرضى. في كثير من الأحيان تشير نتائج الدراسة إلى أن المريض لديه مساحات محيطة بالأوعية متوسعة. ما مدى خطورة هذا؟ وما هي الأمراض التي يمكن أن تشير إليها هذه العلامة؟ سننظر في هذه الأسئلة في المقال.
ما هو عليه
تقع المساحات المحيطة بالأوعية الدموية بين جدران الأوعية الدموية والمادة البيضاء في الدماغ. وتسمى هذه التكوينات أيضًا بمساحات criblures أو مساحات Virchow-Robin. وهي مليئة بالسائل النخاعي وتنظم تدفق السائل النخاعي.
عادةً ما تكون الكريبلورات صغيرة جدًا لدرجة أنها غير مرئية، ومع ذلك، هناك حالات يتم فيها تحديد المساحات المحيطة بالأوعية الدموية الممتدة أثناء الفحص. ماذا تعني هذه النتيجة التشخيصية؟ يشير هذا إلى أنه يتم رؤية كريبلور أثناء فحص التصوير بالرنين المغناطيسي. تبدو وكأنها بقع بيضاء في الصورة.
الأسباب
علامات روبن فيرشو ليست دائمًا علامة على علم الأمراض. يتم ملاحظة هذه النتيجة التشخيصية أيضًا في الأشخاص الأصحاء تمامًا. في أغلب الأحيان، يتم ملاحظة توسع كريبلور في المرضى المسنين ويرتبط بالتغيرات المرتبطة بالعمر في الدماغ.
ومع ذلك، في بعض الحالات، قد تكون المساحات المحيطة بالأوعية الدموية المتوسعة علامة على الأمراض والحالات التالية:
- ضمور الدماغ؛
- داء الكريات البيضاء.
- نقص تروية الدماغ (بما في ذلك احتشاء الدماغ) ؛
- التهاب الدماغ والنخاع المنتشر.
عند كبار السن، غالبًا ما يُلاحظ توسع الكريبلور مع ارتفاع ضغط الدم وتصلب الشرايين والخرف. عادة ما تكون هذه الأمراض مصحوبة بضعف الذاكرة وضعف إدراكي آخر.
طرق تشخيصية إضافية
ماذا تفعل إذا أشارت نتائج التصوير بالرنين المغناطيسي إلى أن لديك مساحات فيرشو-روبن متوسعة حول الأوعية الدموية؟ من الضروري إظهار نسخة الدراسة لطبيب أعصاب. يمكن للأخصائي فقط تحديد ما إذا كان هذا هو البديل للقاعدة، أو ميزة مرتبطة بالعمر، أو علامة على علم الأمراض.
هناك حالات لا يكشف فيها التصوير بالرنين المغناطيسي عن أي تغيرات في الدماغ، لكن الصورة تظهر مساحات فيرشو-روبن المتوسعة حول الأوعية الدموية. ماذا يعني هذا؟ وكقاعدة عامة، مثل هذه العلامة لا تشير إلى علم الأمراض. ينظر الأطباء إلى زيادة الكريبلر فقط مع التغيرات الأخرى التي تم تحديدها أثناء فحص التصوير بالرنين المغناطيسي.
إذا لزم الأمر، قد يصف الطبيب اختبارات إضافية:
- التصوير المقطعي المحوسب متعدد الشرائح؛
- تصوير الأوعية الدموية.
- تصوير دوبلر.
- فحص السائل النخاعي.

دعونا نلقي نظرة فاحصة على الأمراض والظروف الأكثر شيوعا التي يمكن أن تؤدي إلى توسع criblures.
ضمور الدماغ
إذا تم توسيع المساحات المحيطة بالأوعية الدموية للمريض وتقلص حجم الدماغ، فإن الأطباء يتحدثون عن ضمور الأعضاء. غالبًا ما تكون هذه علامة على الأمراض التالية:
- خرف الشيخوخة.
- تصلب الشرايين؛
- مرض الزهايمر.
في هذه الأمراض، تموت الخلايا العصبية. ويصاحب ذلك ضعف في الذاكرة، وضعف عقلي، واضطرابات عقلية. عادة، تحدث مثل هذه الأمراض في المرضى المسنين.

في بعض الحالات، يتم اكتشاف مساحات فيرشو-روبن المتوسعة حول الأوعية الدموية عند الأطفال حديثي الولادة. وقد يكون ذلك علامة على أمراض وراثية خطيرة يصاحبها موت الخلايا العصبية.
كيفية علاج مثل هذه الأمراض؟ بعد كل شيء، لم يعد من الممكن استعادة الخلايا العصبية المفقودة. يمكنك فقط إبطاء عملية موت الخلايا العصبية. يتم وصف الأدوية التالية للمرضى لعلاج الأعراض:
- منشط الذهن: "بيراسيتام"، "كافينتون"، "نوتروبيل"؛
- المهدئات: "فينازيبام"، "فينيبوت"؛
- مضادات الاكتئاب: فالدوكسان، أميتريبتيلين.

عادة ما يكون تشخيص مثل هذه الأمراض غير مواتٍ، مع تقدم ضمور الدماغ وموت الخلايا العصبية.
داء الكريات البيض
يصف الأطباء داء الكريات البيض بأنه خلخلة في الدماغ. بسبب التغيرات الهيكلية في الأنسجة العصبية، يعاني المرضى من اتساع المساحات المحيطة بالأوعية الدموية. وهذه أيضًا علامة على الأمراض المميزة لكبار السن:
- ارتفاع ضغط الدم.
- تصلب الشرايين؛
- خرف الشيخوخة.
التغيرات في المادة البيضاء في الدماغ تسبب ضعفًا إدراكيًا. يتم علاج المرضى الذين يعانون من أعراض بأدوية منشط الذهن. تعمل هذه الأدوية على تحسين تغذية الخلايا العصبية ووقف موتها. في حالة تصلب الشرايين، يشار إلى الستاتينات. لارتفاع ضغط الدم، توصف الأدوية الخافضة للضغط.
الحالات الإقفارية
مع نقص التروية، يتدهور تدفق الدم إلى الدماغ. عادة ما يكون هذا نتيجة لتغيرات تصلب الشرايين في الأوعية. يعاني المريض بشكل دوري من الدوخة والرؤية المزدوجة واضطرابات التنسيق الحركي واضطرابات الكلام والذاكرة. بسبب التغيرات في السفن، تتوسع المساحات حول جدرانها أيضا.

يتم وصف أدوية منشط الذهن للمرضى (Piracetam، Cerebrolysin، Actovegin)، وكذلك الأدوية التي تعمل على تطبيع عملية التمثيل الغذائي في خلايا الدماغ (Cortexin، Ceraxon). في هذه الحالة، من المهم جدًا علاج تصلب الشرايين باستخدام الستاتينات. توصف الأدوية لوفاستاتين، وأتورفاستاتين، وسيمفاستاتين. هذا العلاج يزيل سبب نقص التروية.
احتشاء الدماغ
في كثير من الأحيان يتم توسيع المساحات المحيطة بالأوعية الدموية في المرضى الذين عانوا من احتشاء دماغي. هذا المرض هو نتيجة لنقص التروية لفترة طويلة. في بعض الحالات، يكون الاحتشاء الدماغي بدون أعراض ويمر دون أن يلاحظه المريض. لا يمكن رؤية عواقبه إلا من خلال فحص التصوير بالرنين المغناطيسي.
من المهم أن نتذكر أنه إذا كان لدى المريض عوامل خطر (ارتفاع ضغط الدم، وتصلب الشرايين، والسكري)، فإن النوبة القلبية قد تتكرر بشكل حاد. لمنع حدوث نوبة متكررة من نقص التروية الحاد، توصف للمرضى الأدوية الخافضة للضغط، وعوامل سكر الدم، ومخففات الدم.

التهاب الدماغ والنخاع المنتشر
التهاب الدماغ والنخاع المنتشر (DEM) هو مرض حاد يصيب الجهاز العصبي المركزي. مع هذا المرض، يتم تدمير الألياف العصبية. تتوسع مساحات فيرشو-روبن المحيطة بالأوعية بسبب تلف المادة البيضاء والرمادية. تظهر صورة التصوير بالرنين المغناطيسي بؤر إزالة الميالين.
هذا المرض هو من أصل المناعة الذاتية. الصورة السريرية للمرض تشبه علامات التصلب المتعدد. يعاني المرضى من اضطرابات في المشي والحركة، واضطرابات في النطق، والدوخة، والتهاب العصب البصري.
على عكس العديد من أمراض إزالة الميالين الأخرى، يمكن علاج حركة العين السريعة. يوصف للمرضى الكورتيكوستيرويدات لقمع رد فعل المناعة الذاتية:
- "بريدنيزولون"
- "ديكساميثازون"؛
- "ميتيبريد."
بعد دورة العلاج، 70٪ من المرضى يشعرون بالشفاء التام. في الحالات المتقدمة، قد لا يزال المرضى يعانون من عواقب المرض: ضعف حساسية الأطراف، واضطرابات المشي، واضطرابات الرؤية.
وقاية
كيفية الوقاية من الأمراض المذكورة أعلاه؟ ويمكن الاستنتاج أن المرضى الأكبر سنا هم أكثر عرضة لمثل هذه الأمراض. لذلك، يحتاج جميع الأشخاص الذين تزيد أعمارهم عن 60 عامًا إلى زيارة طبيب الأعصاب بانتظام والخضوع لفحص الدماغ بالرنين المغناطيسي.
ومن المهم أيضًا مراقبة مستويات الكوليسترول في الدم وقراءات ضغط الدم باستمرار. بعد كل شيء، الأمراض المصحوبة بالتغيرات المرضية في المادة البيضاء غالبا ما تتطور على خلفية تصلب الشرايين وارتفاع ضغط الدم.
الفصل 2. التصنيف السريري والمورفولوجي لسرطان البروستاتا
في 70٪ من الحالات، يتطور سرطان البروستاتا في المنطقة المحيطية، فقط في 10-15٪ من الحالات يظهر الورم في المنطقة المركزية، في الباقي - في المنطقة الانتقالية. كما ذكر أعلاه، فإن المرض، مع استثناءات نادرة، يبدأ بعد 50 عاما. ومع ذلك، كشفت الفحوصات النسيجية لتشريح البروستاتا لدى الشباب الذين تتراوح أعمارهم بين 30 إلى 40 عامًا عن بؤر مجهرية للسرطان الكامن في 20٪ من الحالات. وبما أن هذه الأورام المجهرية تنمو ببطء شديد، فإن المرض لا يظهر سريريا. بمرور الوقت، يزداد حجم بؤر السرطان الكامن تدريجيًا وتبدأ في فقدان سماتها المميزة للتمايز. من المقبول عمومًا أنه عندما يصل حجم الورم إلى 0.5 سم 3، فإنه يصبح ذا أهمية سريرية ويتطلب العلاج المناسب. من الناحية الشكلية، تنقسم أورام البروستاتا الخبيثة إلى ظهارية وغير ظهارية. بدورها، تنقسم الأورام الظهارية إلى سرطان غدي، وسرطان الخلايا الانتقالية، وسرطان الخلايا الحرشفية. النوعان الأخيران من الورم نادران جدًا. الورم الظهاري الأكثر شيوعا هو الورم الغدي. تجدر الإشارة إلى أن السرطان الغدي المجهري غير متجانس في بنيته. تتميز الأنواع التالية من السرطان الغدي:
1) عنيبية صغيرة،
5) سرطان التربيق الصلب،
2) عنيبية كبيرة،
6) بطانة الرحم،
3) السرطان المصفوي الشكل،
7) الكيس الغدي،
4) الورم الغدي الحليمي،
8) سرطان المخاط.
المعايير التشخيصية الرئيسية لسرطان البروستاتا هي عدم النمطية الهيكلية: الترتيب المدمج للورم عنيبات الورم، ونموها الفوضوي مع تسلل سدى العضو. في سدى الورم، يحدث موت الألياف المرنة، ويلاحظ تسلل الورم إلى الأنسجة المجاورة، ويغزو المساحات اللمفاوية المحيطة بالأعصاب وحول الأوعية الدموية.
حاليًا، يتم استخدام تصنيف غليسون النسيجي على نطاق واسع، لأنه يلبي إلى حد كبير المتطلبات السريرية عند اختيار أساليب العلاج والتشخيص للمرض (الشكل 1).
أرز. 1.تصنيف غليسون النسيجي لسرطان البروستاتا
يعتمد تصنيف غليسون على درجة تمايز الهياكل الغدية للورم. يشكل الورم ذو درجة غليسون 1 غددًا طبيعية تقريبًا، والتي يتم فقدان بنيتها مع زيادة درجة غليسون، ومع درجة 5 يتميز الورم بخلايا غير متمايزة. كلما زاد فقدان تمايز الأنسجة، كلما كان التشخيص أسوأ بالنسبة لمريض معين.
وفقًا لتصنيف غليسون، تنقسم درجة تمايز الورم إلى خمس تدرجات:
- التدرج 1: يتكون الورم من غدد صغيرة متجانسة مع الحد الأدنى من التغيرات النووية.
- الدرجة الثانية: يتكون الورم من مجموعات من الغدد، لا تزال مفصولة بسدى، ولكنها تقع بالقرب من بعضها البعض.
- التدرج 3: يتكون الورم من غدد بأحجام وهياكل مختلفة، وعادة ما يتسلل إلى السدى والأنسجة المحيطة بها.
- الدرجة الرابعة: يتكون الورم من خلايا غير نمطية بشكل واضح ويتسلل إلى الأنسجة المحيطة؛
- التدرج 5: يتكون الورم من طبقات من الخلايا غير النمطية غير المتمايزة.
أظهر تحليل نتائج التدبير التوقعي في علاج سرطان البروستاتا أنه في المرضى الذين لديهم درجة جليسون أقل من 4، ينتشر الورم في 2.1% من الحالات سنويًا، وفي المرضى الذين لديهم درجة جليسون من 5 إلى 7 - في 2.1% من الحالات سنويًا. 5.4% من الحالات، وفي المرضى الذين لديهم درجة غليسون أكثر من 7 - في 13.5% من الحالات.
الجدول 9.تصنيف جليسون.
لسوء الحظ، من المستحيل حاليًا التنبؤ بالورم الذي سيكون بدون أعراض طوال حياة المريض اللاحقة وأي الورم سيتطور إلى مرحلة ذات مظاهر سريرية. ولتقييم مزايا التصنيف الذي اقترحه جليسون، دعونا نقارنه بنظام منظمة الصحة العالمية، المستخدم بشكل رئيسي في أوروبا. وهو ينص على تقسيم الخلايا إلى 3 درجات (G1 - G2 - G3) إلى درجة عالية ومتوسطة وضعيفة التمايز، ويتم إعطاء الاستنتاج وفقًا لأدنى تمايز للخلايا. يعتمد نظام جليسون على تحليل تمايز الغدة عند تكبير مجهري منخفض نسبيًا. والفحص الخلوي للخلايا لا يلعب دورا هنا. وعند مقارنة هذين التصنيفين يظهر توافقهما غير الكامل. على سبيل المثال، يمكن اعتبار درجة غليسون من 2 إلى 4 ورمًا عالي الجودة، ويمكن اعتبار درجة غليسون من 8 إلى 10 ورمًا منخفض الدرجة، ولكن لا يمكن مقارنة درجة غليسون من 5 إلى 7 بدرجة متوسطة. - ورم من الدرجة. تم العثور على الأورام ذات درجة غليسون 7 لتكون أكثر عدوانية بشكل ملحوظ من السرطانات ذات درجة غليسون من 5 إلى 6. قد تظل بعض الأورام ذات درجة غليسون 5 و 6 تحت الملاحظة، في حين أن درجة غليسون 7 سيظل معظم أطباء المسالك البولية بالتأكيد علاج المرضى. بالطبع، في كل حالة على حدة قد تكون هناك اختلافات بين الدرجات الفردية، ولكن الاختلافات بين 6 و 5 أو حتى 4 ليست حرجة، لأن تشخيص وعلاج هذه الأورام هو نفسه. تحدث أخطاء في تصنيف الورم في الحالات التي يكون فيها عدد قطع الورم محدودًا.
من الضروري إجراء مقارنة بين درجة جليسون للخزعة المقدمة والنتائج التي تم الحصول عليها بعد استئصال البروستاتا الجذري لمعرفة مدى دقة تشخيصنا قبل الجراحة. وفقًا لـ Epstein I (1997)، استنادًا إلى 499 خزعة، يحدث الاتفاق ضمن نفس درجة Gleason في 74% إلى 94% من الحالات (انظر الجدول 10).
الجدول 10.علاقة درجة جليسون بين الخزعة واستئصال البروستاتا الجذري.
يعتقد المؤلف أن الأخطاء التي تحدث في تصنيف الورم وفقًا للخزعة واستئصال البروستاتا الجذري ترتبط بضعف أخذ العينات، وحالات تمايز الورم الحدية، وعدم موضوعية تقييمه. لذا، في 55% من الخزعات التي تم تصنيفها في مؤسسات أخرى وحصلت على درجة غليسون من 2 إلى 4، كان الورم إما قد غزو الكبسولة والحويصلات المنوية، أو انتقل إلى الغدد الليمفاوية. لزيادة دقة الفحص المورفولوجي، يوصي المؤلف بإدخال معلمة إضافية - مدى السرطان أثناء خزعة الإبرة، وكذلك مراعاة مؤشر PSA في وقت واحد مع بيانات الفحص النسيجي.
القيمة الرئيسية لأي تصنيف هي أهميته لعلاج مرض البروستاتا والتشخيص له. عند دراستها، أظهرت بيانات جليسون لـ 2911 مريضًا وجود علاقة عالية إلى حد ما بين درجة جليسون ومآل المرض. "في بياناتنا، ترتبط الزيادة في درجة جليسون في حالة استئصال البروستاتا الجذري بتدهور في جميع المعلمات النذير،" يشير إبستين آي. (1997).
وكما يشير المؤلف، فإن درجة جليسون هي أيضًا أقوى مؤشر للتقدم بعد استئصال البروستاتا الجذري. الأورام ذات درجة غليسون من 8 إلى 10 لها تشخيص كئيب. إذا تم الكشف عن النقائل الإقليمية، فلا فائدة من استئصال البروستاتا، على الرغم من أن ذلك ممكن من الناحية الفنية. كل ما سبق موضح في الجدول 11. وكما يتبين من الجدول، مع درجة غليسون من 8 إلى 10، فإن جميع العوامل النذير تتفاقم عدة مرات.
الجدول 11.ارتباط درجة غليسون مع علم الأمراض المكتشف بعد استئصال البروستاتا الجذري.
التصنيف الدولي لسرطان البروستاتا حسب نظام TNM (1997).
المرحلة T1، كما هو مذكور في التصنيف، تعني مرض تم اكتشافه بالصدفة بعد استئصال البروستاتا عبر الإحليل أو تحديد مستويات PSA، والذي لم يتم اكتشافه عن طريق الجس والموجات فوق الصوتية. وعلى الرغم مما سبق، تنقسم هذه المرحلة إلى 3 خيارات. النقطة المهمة هي أن التشخيص لكل منها يختلف بشكل كبير. على سبيل المثال، بالنسبة للمرحلة T1b، يبلغ متوسط الفترة الزمنية قبل التقدم 4.75 سنة، وبالنسبة للمرحلة T1a يكون 13.5 سنة، أي. عند البالغين الأكبر سنًا المصابين بالمرحلة T1a، غالبًا ما يكون الانتظار اليقظ مبررًا، بينما يحتاج المصابون بالمرحلة T1b إلى علاج عدواني يهدف إلى علاج المرض.
التصنيف الدولي لسرطان البروستاتا باستخدام نظام TNM
ورم
T1 - تم اكتشافه بالصدفة (غير واضح ولم يتم اكتشافه بواسطة الموجات فوق الصوتية)
T1a - سرطان جيد التمايز تم اكتشافه بعد استئصال غدة البروستاتا عبر الإحليل، ويحتل أقل من 5% من الأنسجة التي تم استئصالها
T1b - أي ورم يتم اكتشافه بعد استئصال البروستاتا عبر الإحليل، من الدرجة الأدنى أو يشغل أكثر من 5٪ من الأنسجة التي تم استئصالها
T1c - سرطان البروستاتا غير الملموس الذي تم اكتشافه بواسطة خزعة موجهة بالموجات فوق الصوتية عبر المستقيم؛ مؤشرات للخزعة - ارتفاع مستوى PSA
أرز. 2.سرطان البروستاتا الذي تم تشخيصه بالصدفة هو ورم تم اكتشافه بعد استئصال غدة البروستاتا عبر الإحليل. سرطان المرحلة T1a عبارة عن ورم صغير جيد التمايز يشغل أقل من 5٪ من الأنسجة المستأصلة. يعتبر سرطان البروستاتا في المرحلة T1b ورمًا أكبر، حيث يشغل أكثر من 5% من أنسجة الاستئصال، وهو أقل تمايزًا.

T2 - ورم يقتصر على غدة البروستاتا
T2a - يؤثر الورم على فص واحد
T2b - سيؤثر الورم على فصين
T3 - ينمو الورم خارج كبسولة البروستاتا
T3a - انتشار الورم خارج المحفظة
T3b - يمتد الورم إلى الحويصلات المنوية
T4 - ينمو الورم إلى الأعضاء المجاورة
تين. 3.وفقًا لنظام TNM، يتم التمييز بين أربع مراحل لانتشار الورم المحلي - من T1 (اكتشاف عرضي) إلى T4 (الانتشار إلى الأعضاء المجاورة).

ن - العقد الليمفاوية الإقليمية
NX - لم يتم تحديد النقائل إلى الغدد الليمفاوية الإقليمية
لا - لا يوجد نقائل إلى العقد الليمفاوية الإقليمية
N1 - الانبثاث إلى الغدد الليمفاوية الإقليمية
م - النقائل البعيدة
MX - لم يتم تحديد النقائل البعيدة
M0 - لا يوجد نقائل بعيدة
M1 - النقائل البعيدة
M1a - الانبثاث إلى العقد الليمفاوية غير العقد الإقليمية
M1b - النقائل العظمية
M1c - النقائل إلى الأعضاء الأخرى (المستقيم، الحويصلات المنوية)
يتميز نمو الورم المستقل بنقص السيطرة على تكاثر وتمايز خلايا الكائن الحامل للورم. يحدث غزو الورم على ثلاث مراحل ويتم ضمانه من خلال عمليات إعادة ترتيب وراثية معينة.
تتميز المرحلة الأولى من غزو الورم بضعف الاتصالات بين الخلايا. في المرحلة الثانية، تفرز الخلية السرطانية الإنزيمات المحللة للبروتين ومنشطاتها، والتي تضمن تدهور المصفوفة خارج الخلية، وبالتالي تمهد الطريق للغزو.
مرحلة النقيلة هي المرحلة الأخيرة من تشكل الورم، والتي ترتبط بانتشار الخلايا السرطانية من الورم الأساسي إلى الأعضاء الأخرى عبر الأوعية اللمفاوية والأوعية الدموية والعجان والانغراس، والتي كانت الأساس لتحديد أنواع النقيلات.
نمو الورم المستقل
يتميز نمو الورم المستقل بنقص السيطرة على تكاثر الخلايا وتمايزها من قبل الكائن الحامل للورم. وهذا لا يعني أن الخلايا السرطانية تعاني من نوع من الفوضى التكاثرية. في الواقع، تتحول الخلايا السرطانية إلى مستبدأو آلية paracrine لتنظيم نموها.
أثناء التحفيز الاستبدادي للنمو، تنتج الخلية السرطانية نفسها عوامل النمو أو البروتينات الورمية - نظائرها لعوامل النمو، وكذلك المستقبلات أو نظائرها من البروتينات الورمية لمستقبلات عامل النمو. يحدث هذا، على سبيل المثال، في سرطان الرئة ذو الخلايا الصغيرة، حيث تنتج الخلايا هرمون النمو Bombesin وفي نفس الوقت مستقبلات له. ويحدث أيضًا تحفيز نظير الصماوي، نظرًا لأن البومبيسين يمكن أن يتفاعل أيضًا مع الخلايا المجاورة.
من الأمثلة الصارخة على تحفيز ورم نظير الصماوي هو إنتاج عامل النمو الشبيه بالأنسولين 2 بواسطة الخلايا الليفية في سدى سرطان الرئة. يتفاعل عامل النمو مع المستقبلات الموجودة على الخلايا السرطانية ويحفز تكاثرها. يتم التعبير عن نمو الورم المستقل في فقدان تثبيط التلامس وتخليد (اكتساب الخلود) للخلايا السرطانية، وهو ما يمكن تفسيره بانتقال الخلايا إلى طرق استبدادية ونظيرة صماوية لتنظيم نموها.
إن استقلالية الورم نسبية بطبيعتها، حيث أن أنسجة الورم تتلقى باستمرار من الجسم العديد من العناصر الغذائية والأكسجين والهرمونات والسيتوكينات التي يتم جلبها عبر مجرى الدم. بالإضافة إلى ذلك، فإنه يتأثر بجهاز المناعة والأنسجة غير الورمية المحيطة به.
وبالتالي، لا ينبغي فهم استقلالية الورم على أنها استقلال كامل للخلايا السرطانية عن الجسم، ولكن على أنها اكتساب الخلايا السرطانية للقدرة على الحكم الذاتي.
في الأورام الخبيثة، يتم التعبير عن النمو الذاتي بشكل ملحوظ، وتنمو بسرعة، وتغزو الأنسجة الطبيعية المجاورة. في الأورام الحميدة يتم التعبير عنها بشكل ضعيف للغاية. بعضها قابل للتأثيرات التنظيمية وينمو ببطء، دون أن ينمو إلى الأنسجة المجاورة.
تطور الورم
نظرية تطور الورمتم تطويره بواسطة L. Foulds في عام 1969 بناءً على بيانات الأورام التجريبية. وفقا لنظرية تطور الورم، هناك نمو تدريجي مستمر للورم مع مروره عبر عدد من المراحل المختلفة نوعيا. يتجلى الحكم الذاتي ليس فقط في النمو، ولكن أيضا في جميع العلامات الأخرى للورم، كما يعتقد مؤلف النظرية نفسه.
من الصعب الاتفاق مع وجهة النظر الأخيرة، لأن الورم الخبيث للورم له دائمًا أساس مادي في شكل تخليق نشط لبعض البروتينات الورمية وعوامل النمو ومستقبلاتها. يترك هذا الظرف بصمة على مظاهر عدم النمطية المورفولوجية للورم ويستخدم في التنبؤ بحياة مرضى السرطان.
يتغير الورم باستمرار: يحدث تقدم، عادةً نحو زيادة الورم الخبيث، والذي يتجلى في النمو الغازي وتطور النقائل.
منصة ورم غازيتتميز بحدوث نمو تسلل. تظهر شبكة الأوعية الدموية المتطورة والسدى في الورم، ويتم التعبير عنها بدرجات متفاوتة. لا توجد حدود مع الأنسجة غير الورمية المجاورة بسبب نمو الخلايا السرطانية فيها. يحدث غزو الورم على ثلاث مراحل ويتم ضمانه من خلال عمليات إعادة ترتيب وراثية معينة.
المرحلة الأولى من غزو الورميتميز بضعف الاتصالات بين الخلايا، كما يتضح من انخفاض عدد الاتصالات بين الخلايا، وانخفاض تركيز بعض جزيئات الالتصاق من عائلة CD44 وغيرها، وعلى العكس من ذلك، زيادة في التعبير عن الآخرين التي تضمن حركة الخلايا السرطانية واتصالها بالمصفوفة خارج الخلية.
يتناقص تركيز أيونات الكالسيوم على سطح الخلية، مما يؤدي إلى زيادة الشحنة السالبة للخلايا السرطانية. يزداد التعبير عن مستقبلات الإنتغرين، مما يضمن ارتباط الخلية بمكونات المصفوفة خارج الخلية - اللامينين، الفبرونكتين، الكولاجين.
في المرحلة الثانيةتفرز الخلية السرطانية الإنزيمات المحللة للبروتين ومنشطاتها، والتي تضمن تدهور المصفوفة خارج الخلية، وبالتالي تمهد الطريق للغزو.
وفي الوقت نفسه، تعتبر نواتج تحلل الفبرونكتين واللامينين بمثابة جاذبات كيميائية للخلايا السرطانية التي تهاجر إلى منطقة التحلل أثناء عملية التحلل. المرحلة الثالثةالغزو، ومن ثم تتكرر العملية مرة أخرى.
مرحلة ورم خبيث- المرحلة النهائية من تشكل الورم، مصحوبة بإعادة ترتيب جينية وظاهرية معينة للورم. ترتبط عملية الانبثاث بانتشار الخلايا السرطانية من الورم الأساسي إلى الأعضاء الأخرى من خلال الأوعية اللمفاوية والدموية، حول العصب، والزرع، والتي أصبحت الأساس لتمييز أنواع الانبثاث.
يتم تفسير عملية الانتشار من خلال نظرية الشلال النقيلي، والتي بموجبها تخضع الخلية السرطانية لسلسلة (سلسلة) من عمليات إعادة الترتيب التي تضمن الانتشار إلى الأعضاء البعيدة.
أثناء عملية الانتشار، يجب أن تتمتع الخلية السرطانية بصفات معينة:
- تخترق الأنسجة المجاورة وتجويف الأوعية الدموية (الأوردة الصغيرة والأوعية اللمفاوية) ؛
- تنفصل عن طبقة الورم إلى مجرى الدم (الليمفاوي) على شكل خلايا فردية أو مجموعات صغيرة منها؛
- الحفاظ على الحيوية بعد ملامسة تدفق الدم (الليمفاوي) لعوامل دفاع مناعية محددة وغير محددة؛
- تهاجر إلى الأوردة (الأوعية اللمفاوية) وتلتصق ببطانة الأوعية الدموية في بعض الأعضاء؛
- تغزو الأوعية الدقيقة وتنمو في مكان جديد في بيئة جديدة.
يمكن تقسيم الشلال النقيلي تقريبًا إلى أربع مراحل:
- تشكيل ورم فرعي منتشر. الغزو في تجويف السفينة.
- تداول الصمة الورمية في مجرى الدم (تدفق الليمفاوية) ؛
- الاستقرار في مكان جديد مع تكوين ورم ثانوي.
تبدأ عملية ورم خبيث بظهور طبقة فرعية منتشرة من الخلايا السرطانية مع بلازما متغيرة، ونتيجة لذلك يتم فقدان الاتصالات بين الخلايا وتظهر القدرة على الحركة.
ثم تهاجر الخلايا السرطانية عبر المصفوفة خارج الخلية، وترتبط مع مستقبلات الإنتغرين باللامينين والفبرونكتين وجزيئات الكولاجين في الغشاء القاعدي للسفينة، وتقوم بتحلل البروتينات عن طريق إطلاق كولاجيناز، وكاثيبسين، وإيلاستاز، وجليكوزامينو هيدرولاز، والبلازمين، وما إلى ذلك. .
يسمح هذا للخلايا السرطانية بغزو الغشاء القاعدي للسفينة، والالتصاق ببطانة الأوعية الدموية، ثم تغيير خصائصها اللاصقة (قمع الجزيئات اللاصقة للجزيئات اللاصقة للخلية - عائلة CAM)، منفصلة عن كل من طبقة الورم وبطانة الأوعية الدموية .
في المرحلة التالية، يتم تشكيل الصمات الورمية، والتي يمكن أن تتكون فقط من الخلايا السرطانية أو بالاشتراك مع الصفائح الدموية والخلايا الليمفاوية. يمكن لطبقة الفيبرين الخاصة بهذه الصمات أن تحمي الخلايا السرطانية من القضاء عليها بواسطة خلايا الجهاز المناعي وعمل عوامل الحماية غير المحددة.
في المرحلة النهائية، يحدث تفاعل الخلايا السرطانية مع بطانة الأوعية الدموية بسبب مستقبلات بيتا وجزيئات CD44، والارتباط والتحلل البروتيني للغشاء القاعدي، وغزو الأنسجة المحيطة بالأوعية الدموية ونمو ورم ثانوي.
ومع تقدم الورم، قد يحدث ذلك تطور نسيلي(نويل ب.، 1988)، أي أنه قد تظهر مستنسخات جديدة من الخلايا السرطانية، تنشأ نتيجة طفرات ثانوية، مما يؤدي إلى تعدد استنساخ الورم وهيمنة المستنسخات الأكثر عدوانية نتيجة الانتقاء النسيلي.
تتميز الأورام الحميدة بهيمنة الخلايا السرطانية لاستنساخ واحد طوال فترة وجودها، بينما في الأورام الخبيثة تتقدم تعدد النسيلة باستمرار، خاصة في المتغيرات منخفضة التمايز والخبيثة للغاية.
يمكن لنظرية التطور النسيلي أن تساعد ليس فقط في تفسير تطور الورم الخبيث والانتشار، ولكنها أيضًا تقدم إجابات على الأسئلة التالية:
- لماذا يمكن أن تحدث ظاهرة الحؤول (التغيرات في تمايز الخلايا في مناطق معينة) في الأورام؟
- كيف يمكن أن يزداد الورم الخبيث بمرور الوقت أو خاصة بعد العلاج المضاد للورم؛
- لماذا تنشأ الأورام المقاومة للتأثيرات المضادة للأورام بشكل عفوي وبعد التأثيرات العلاجية (ظاهرة مقاومة الورم للأدوية المتعددة).
دور سدى الورم وعمليات تكوين الأوعية الدموية في نموها وتطورها المستقل
أحد المكونات الهيكلية المهمة للورم هو السدى. السدى في الورم، مثل السدى في الأنسجة الطبيعية، يؤدي بشكل أساسي وظائف غذائية وتعديلية وداعمة.
يتم تمثيل العناصر اللحمية للورم بواسطة الخلايا والمصفوفة خارج الخلية من الأنسجة الضامة والأوعية والنهايات العصبية. يتم تمثيل المصفوفة خارج الخلية للأورام بمكونين هيكليين: الأغشية القاعدية ومصفوفة النسيج الضام الخلالي.
يتضمن تكوين الأغشية القاعدية أنواع الكولاجين الرابع والسادس والسابع والبروتينات السكرية (لامينين وفيبرونكتين وفيترونيكتين) والبروتيوغليكان (كبريتات الهيبارين وما إلى ذلك). تحتوي مصفوفة النسيج الضام الخلالي على أنواع الكولاجين الأول والثالث، وفيبرونكتين، والبروتيوغليكان، والجليكوزامينوجليكان.
أصل سدى الورم. تم الحصول على بيانات تجريبية مقنعة حول ظهور العناصر الخلوية لسدى الورم من سلائف النسيج الضام الطبيعي الموجود مسبقًا للأنسجة المحيطة بالورم. في عام 1971
أظهر J. Folkman أن الخلايا السرطانية الخبيثة تنتج عاملاً معينًا يحفز تكاثر عناصر جدار الأوعية الدموية ونمو الأوعية الدموية. تسمى هذه المادة البروتينية المعقدة بعامل فولكمان.
وكما تم تحديده لاحقًا، فإن عامل فولكمان عبارة عن مجموعة من عوامل نمو الخلايا الليفية، والتي يُعرف منها أكثر من 11 عاملًا بالفعل. وكان فولكمان أول من أظهر بشكل مقنع أن تكوين السدى في الورم هو نتيجة لتفاعلات معقدة بين خلية الورم والنسيج الضام. الخلايا.
تلعب خلايا النسيج الضام ذات الأصل الموضعي والنسيجي والدموي دورًا مهمًا في تكوين السدى في الورم. تنتج الخلايا اللحمية مجموعة متنوعة من عوامل النمو التي تحفز تكاثر الخلايا ذات الأصل الوسيط (عوامل نمو الخلايا الليفية، عامل نمو الصفائح الدموية، عامل نخر الورم أ، الفبرونكتين، عوامل النمو الشبيهة بالأنسولين، وما إلى ذلك)، وبعض البروتينات الورمية (c-sis، ج-myc).
وفي الوقت نفسه، فإنها تعبر عن المستقبلات التي تربط عوامل النمو والبروتينات الورمية، مما يجعل من الممكن تحفيز انتشارها على طول كل من المسارات الاستبدادية ونظيرة الصماوية.
بالإضافة إلى ذلك، فإن الخلايا اللحمية نفسها قادرة على إفراز مجموعة متنوعة من الإنزيمات المحللة للبروتين، مما يؤدي إلى تدهور المصفوفة خارج الخلية.
تشارك الخلايا السرطانية بنشاط في تكوين السدى.
أولاً، تحفز الخلايا المحولة تكاثر خلايا النسيج الضام من خلال آلية تنظيمية نظير الصماوي، مما ينتج عوامل النمو والبروتينات الورمية.
ثانيًافهي قادرة على تحفيز تخليق وإفراز مكونات المصفوفة خارج الخلية بواسطة خلايا النسيج الضام.
ثالثالخلايا السرطانية نفسها قادرة على إفراز مكونات معينة من المصفوفة خارج الخلية. علاوة على ذلك، فإن نوع هذه المكونات له تركيبة مميزة في بعض الأورام، والتي يمكن استخدامها في تشخيصها التفريقي.
الرابع، تنتج الخلايا السرطانية إنزيمات (الكولاجينات، وما إلى ذلك)، ومثبطاتها ومنشطاتها، التي تعزز أو، على العكس من ذلك، تمنع الترشيح والنمو الغازي للأورام الخبيثة. يضمن التوازن الديناميكي بين منشطات الكولاجيناز ومثبطاتها استقرار حالة الورم ويمنع نموه في الأنسجة المجاورة. أثناء النمو، تقوم الخلايا السرطانية بتصنيع الكولاجيناز والإيلاستاسيس ومثبطاتها بشكل فعال.
غالبًا ما تشكل الأورام الخبيثة سدى يسود فيه نوع الكولاجين من سدى العضو المقابل في مرحلة التطور الجنيني. على سبيل المثال، في سدى سرطان الرئة، النوع السائد من الكولاجين هو الكولاجين الثالث، وهو سمة الرئة الجنينية.
قد تختلف الأورام المختلفة في تكوين الكولاجين اللحمي. في الأورام السرطانية، كقاعدة عامة، يسود الكولاجين من النوع الثالث (سرطان الرئة)، والنوع الرابع (سرطان الخلايا الكلوية والأورام الأرومية الكلوية)، وفي الأورام اللحمية، يسود الكولاجين الخلالي، ولكن في الساركوما الغضروفية، يسود الكولاجين الثاني. تحتوي الساركوما الزليلية على الكثير من الكولاجين الرابع.
تعتبر الاختلافات الموصوفة في التركيب اللحمي مهمة بشكل خاص في التشخيص التفريقي للأورام اللحمية.
الأوعية الدموية في الورم. يعتمد نمو الأورام على درجة تطور شبكة الأوعية الدموية فيها. في الأورام التي يقل قطرها عن 1-2 ملم، تأتي العناصر الغذائية والأكسجين من سائل الأنسجة في الأنسجة المحيطة عن طريق الانتشار. لتغذية الأورام الأكبر حجما، من الضروري الأوعية الدموية في أنسجتها.
يتم ضمان تكوين الأوعية الدموية في الورم من خلال مجموعة من عوامل النمو الوعائي، والتي يمكن أيضًا توليد بعضها بواسطة الخلايا الظهارية المنشطة في مناطق الالتهاب المزمن والتجدد. تشمل مجموعة العوامل الوعائية السرطانية عوامل نمو الخلايا الليفية، والبطانة، والأوعية الدبقية، والخلايا الكيراتينية، وعامل نمو البشرة، والأنجيوجينين، وبعض عوامل تحفيز مستعمرة نخاع العظم، وما إلى ذلك.
إلى جانب عوامل النمو، فإن تكوين المصفوفة خارج الخلية لسدى الورم له أهمية كبيرة في تكوين الأوعية الدموية. المواتية هي محتوى مكونات الغشاء القاعدي - اللامينين والفبرونكتين والكولاجين من النوع الرابع.
يحدث تكوين الأوعية الدموية في الأورام على خلفية التحفيز الميتوجيني المنحرف والمصفوفة خارج الخلية المتغيرة. وهذا يؤدي إلى تطور الأوعية المعيبة، في الغالب من النوع الشعري، وغالبًا ما يكون لها غشاء قاعدي متقطع وبطانة بطانية تالفة. يمكن استبدال البطانة بالخلايا السرطانية، وفي بعض الأحيان تكون غائبة تمامًا.
لا يقتصر دور السدى للورم على الوظائف الغذائية والدعم. للسدى تأثير تعديل على سلوك الخلايا السرطانية، أي أن لها تأثيرًا تنظيميًا على تكاثر الخلايا السرطانية وتمايزها وإمكانية النمو الغازي والانتشار.
يرجع التأثير المعدل للسدى على الورم إلى وجود مستقبلات الإنتغرين والجزيئات اللاصقة على أغشية الخلايا والجزيئات اللاصقة القادرة على نقل الإشارات إلى عناصر الهيكل الخلوي وإلى نواة الخلية السرطانية.
مستقبلات الإنتغرين- فئة من البروتينات السكرية الموجودة عبر الغشاء، والتي ترتبط نهاياتها الداخلية بعناصر الهيكل الخلوي، والخارجية، خارج الخلية، قادرة على التفاعل مع الركيزة ثلاثية الببتيد Arg-Gly-Asp.
يتكون كل مستقبل من وحدتين فرعيتين a وb، والتي تأتي في العديد من الأصناف. مجموعات مختلفة من الوحدات الفرعية توفر تنوع وخصوصية مستقبلات الإنتغرين.
في الأورام، تنقسم مستقبلات الإنتغرين إلى مستقبلات بين الخلايا ومستقبلات الإنتغرين بين الخلايا السرطانية ومكونات المصفوفة خارج الخلية - اللامينين، فيبرونكتين، فيترونيكتين، إلى أنواع مختلفة من الكولاجين، إلى جزيئات الالتصاق من عائلة CD44.
تتوسط مستقبلات الإنتغرين التفاعلات بين الخلايا بين الخلايا السرطانية، وكذلك مع الخلايا والمصفوفة خارج الخلية للسدى. في النهاية، يحددون قدرة الورم على النمو بشكل غزوي وانتشاره.
تعد الجزيئات اللاصقة CAM مكونًا مهمًا آخر في أغشية الخلايا السرطانية، مما يضمن تفاعلها مع بعضها البعض ومع المكونات اللحمية. يتم تمثيلهم بواسطة عائلات NCAM، وLCAM، وN-cadherin، وCD44.
أثناء تحول الورم، يتغير هيكل وتعبير الجزيئات اللاصقة التي تشكل أغشية الخلايا، ونتيجة لذلك تتعطل العلاقات بين الخلايا السرطانية، وبالتالي يبدأ النمو الغازي والانتشار.
اعتمادًا على تطور السدى، تنقسم الأورام إلى عضوي ونسيجي.
في الأورام العضويةهناك حمة وسدى متطور. مثال على الأورام العضوية هي الأورام الظهارية المختلفة. يمكن أن تختلف درجة تطور السدى أيضًا من طبقات ليفية متفرقة ضيقة وأوعية شعرية في سرطان النخاع إلى مجالات قوية من الأنسجة الليفية، حيث يصعب تمييز سلاسل الورم الظهارية، في السرطان الليفي أو السرطان الليفي.
في الأورام النسيجيةتهيمن الحمة ، والسدى غائب عمليًا ، حيث يتم تمثيله فقط بواسطة أوعية شعرية رقيقة الجدران ضرورية للتغذية. يتم إنشاء الأورام من النوع النسيجي من النسيج الضام الخاص بها وبعض الأورام الأخرى.
لذلك، يمكننا أن نستنتج أن تكوين السدى في الورم هو عملية معقدة متعددة المراحل، ويمكن النظر في الخطوات الرئيسية لها:
- إفراز السيتوكينات الميتوجينية بواسطة الخلايا السرطانية - عوامل النمو المختلفة والبروتينات الورمية التي تحفز تكاثر خلايا النسيج الضام، وخاصة البطانة والخلايا الليفية والخلايا الليفية العضلية وخلايا العضلات الملساء.
- تخليق الخلايا السرطانية لبعض مكونات المصفوفة خارج الخلية - الكولاجين، اللامينين، فيبرونكتين، وما إلى ذلك؛
- تكاثر وتمايز الخلايا السليفة من أصل النسيج الضام، وإفرازها لمكونات المصفوفة خارج الخلية وتشكيل أوعية شعرية رقيقة الجدران، والتي تشكل معًا سدى الورم؛
- هجرة الخلايا ذات الأصل الدموي إلى سدى الورم - الخلايا الوحيدة وخلايا البلازما والعناصر اللمفاوية والخلايا البدينة وما إلى ذلك.